Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 2, стр. 250-258
Микроструктура нейронных связей между зрительными полями коры разных уровней иерархии
С. В. Алексеенко 1, *, П. Ю. Шкорбатова 1
1 Лаборатория физиологии зрения и лаборатория нейроморфологии, Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: binocularity@yandex.ru
Поступила в редакцию 28.09.2021
После доработки 20.12.2021
Принята к публикации 20.12.2021
- EDN: AANZIB
- DOI: 10.31857/S0044467722020034
Аннотация
С целью изучения прямых нейронных связей зрительных полей коры нижнего уровня иерархии с полями последующих уровней, микроионофоретически вводили пероксидазу хрена в отдельные вертикальные колонки полей 19, 21а и анализировали распределение ретроградно меченых нейронов в полях 17, 18 у кошки. Колонки полей 19, 21а по сравнению с глазодоминантными колонками поля 18 получают дополнительные корковые входы из ипсилатеральной переходной зоны 17/18, что указывает на усложнение структуры нейронных связей. В локализации входных нейронов из переходных зон 17/18 разных полушарий выявлена зеркальная симметрия, которая может обеспечить нейронам колонок полей 19, 21а настройку на локусы, расположенные в центральной сагиттальной плоскости трехмерного пространства. Выявленные также входы из полей 17, 18 ипсилатерального полушария, расположенные вне переходной зоны 17/18, в совокупности со входами из обеих переходных зон 17/18 могут обусловливать нейронам колонок полей 19, 21а кодирование более сложных стерео-признаков объектов.
ВВЕДЕНИЕ
Начиная с 50-х годов ХХ века, в микроэлектродных исследованиях были описаны функциональные свойства отдельных нейронов многих зрительных полей коры (Hubel, Wiesel, 2005). Формирование избирательных свойств нейронов в значительной мере обусловлено структурой их связей. Прямые, не опосредованные интернейронами, связи внутри и между полями коры образуют базовый каркас нейронных сетей мозга. На основе различий в послойной организации таких связей между разными полями коры создано представление об их иерархической организации у приматов и у кошки (Felleman, Van Essen,1991; Scanel et al., 1995; Hubel, Wiesel, 2005). К нижнему уровню иерархии относятся зрительные поля, получающие прямую афферентацию из дорзального ядра наружного коленчатого тела (НКТд), у приматов это поле V1, у кошки – поля 17 и 18. В них выделяются простые признаки зрительного окружения. Нейроны вертикальных колонок этих полей имеют сходство в положении центров их рецептивных полей на сетчатке, входах из глаз, предпочтении ориентации, направления движения стимулов. К настоящему времени у кошки в полях 17, 18 изучены прямые внутренние и межполушарные связи нейронов глазодоминантных колонок. Показано, что такие структурно-функциональные единицы коры получают афферентацию от нейронов удлиненных участков этих полей, которые ориентированы в поле (П) 17 вдоль проекции горизонтального меридиана поля зрения, а в П18 – вдоль проекции вертикального меридиана (Alekseenko et al., 2005), что согласуется с анизотропией фактора магнификации в этих полях (Tusa et al., 1981). Также выявлено, что прямые межполушарные связи в этих полях глазоспецифичны, они объединяют нейроны, иннервируемые из одного и того глаза, из зоны назо-темпорального перекрытия, представленной в коре обоих полушарияй (Olavarria, 2001; Алексеенко и др., 2002).
Поля 19 и 21а коры кошки относятся к следующим иерархическим уровням, они не имеют входов из НКТд и афферентируются из полей 17, 18, а также комплекса подкорковых ядер (Dreher, 1986). Целью данной работы было исследование структуры прямых внутри- и межполушарных нейронных связей колонок полей 19, 21а с полями 17, 18. Данные были частично опубликованы (Алексеенко, Шкорбатова, 2021).
МЕТОДИКА
В работе было использовано семь взрослых кошек массой 2.5–3.5 кг, каждой из которых вводили ретроградно транспортируемый маркер нейронных связей – пероксидазу хрена (ПХ) в одну вертикальную колонку П19 или П21а коры. Для возможности сравнения данных с ранее полученными результатами трассирования нейронных связей пероксидазой хрена у колонок полей 17, 18, протокол опытов и способ введения маркера в П19 и П21а были аналогичными (Алексеенко и др., 2002). Все эксперименты выполнены в соответствии с требованиями директивы Совета европейского парламента по защите животных, используемых для экспериментальных и других научных целей (2010/63EU) об использовании животных для экспериментальных исследований и были одобрены Комиссией по контролю за содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова Российской академии наук (заключение № 01/18 от 18.01.2021).
Животных анестезировали смесью Золетила 100 (золозепам+тилетамин, Virbac, Франция) в дозе 5 мг/кг и 2% ксилазина (Interchemie werken “De Adelaar” BV, Нидерланды) в дозе 2 мг/кг. Трепанацию черепа, рассечение твердой мозговой оболочки и введение маркера связей проводили животным в стереотаксическом аппарате. ПХ (8% раствор на фосфатном буфере, рН 6.2; Boehringer, Германия) вводили в колонки полей 19, 21а микроионофоретически под постоянным током +0.5 мкА. Стеклянный микроэлектрод (внутренний диаметр кончика 10–20 мкм), заполненный маркером, ориентировали перпендикулярно поверхности коры и погружали шаговым двигателем на глубину 1500–1800 мкм, затем поднимали на 200–400 мкм и проводили ионофорез в течение 20 мин; референтный электрод крепили над другим полушарием мозга. После выключения тока микроэлектрод поднимали до глубины 600–800 мкм и оставляли на 10 мин. Через 36–48 ч кошке под глубоким нембуталовым наркозом (100 мг/кг) проводили транскардиальную перфузионную фиксацию головного мозга (физиологический раствор 0.9% NaCl, затем фиксатор, содержащий 1% параформальдегид и 1.25% глютаральдегид на 0.1 М на фосфатном буфере (pH 7.4), и далее 10% раствор сахарозы на фосфатном буфере). Извлеченный головной мозг погружали в 30% раствор сахарозы на фосфатном буфере. На следующий день на замораживающем микротоме изготавливали непрерывную серию фронтальных срезов мозга толщиной 50 мкм. ПХ выявляли по методике Мезулама, срезы докрашивали сафранином. Зона введения ПХ представляла на срезах мозга интенсивно прокрашенный участок в виде полосы диаметром 200–300 мкм, проходящей через все шесть слоев коры. В этой зоне происходит захват маркера через синаптические бутоны аксонов с последующим ретроградным транспортом к телам инициальных нейронов.
Меченые клетки (МК) выявляли на срезах мозга в полях 17, 18 обоих полушарий при помощи светового микроскопа NU-2E (Jenaval, Netherlands). Затем срезы, содержащие МК, оцифровывали при помощи бинокулярной лупы WILD TYP 308700 HEERBRUGG, соединенной через видеокамеру (Baumer Optronic, Germany) с компьютером. В программе Adobe Photoshop отмечали контуры фронтальных срезов и местоположение МК. Итоговые изображения срезов сохраняли в формате JPEG. Основная цель анализа полученного материала состояла в реконструкции положения зон МК на выпрямленной поверхности коры. Для этого в программе ImageJ местоположение каждой МК при 20-кратном увеличении размеров среза проецировали на поверхность коры (или на границу слоя VI с белым веществом в случае, когда МК находилась в глубине борозды) и затем измеряли расстояние от МК до инъецированной колонки или до ее проекции на срез. По данным серии последовательных срезов мозга строили точечные двумерные диаграммы распределения МК на тангенциальной поверхности коры, используя программу Microsoft Excel. Местоположение каллозальных МК определяли при зеркальном наложении соответствующих срезов обоих полушарий.
Стереотаксические координаты исследованных колонок полей 19 и 21а вдоль каудо-ростральной оси мозга (уровни Хорсли-Кларка) были в диапазоне от Р3 до Р6.5. Зрительные координаты колонок (азимут и элевация), а также афферентных МК в полях 17, 18 определяли по их положению на срезах мозга, используя известные детальные проекционные карты корковых полей (Tusa et al., 1981). Дополнительным индикатором различий в степени удаленности колонок от проекции центрального (нулевого) вертикального меридиана (ЦВМ) была оценка расстояний между зонами афферентных МК в полях 17, 18. Учитывая ретинотопическую упорядоченность этих полей и их зеркально симметричное расположение относительно проекции ЦВМ, а также известную пространственную согласованность нейронных связей между этими полями (Salin et al., 1992), зоны МК в полях 17 и 18 расположены ближе друг к другу у более близких к проекции ЦВМ колонок П19, П21а, чем у более удаленных колонок.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Пероксидаза хрена была введена в пять корковых колонок П19 и две колонки П21а, три из которых были расположены в левом полушарии и четыре – в правом. Эти колонки находились на супрасильвиевой извилине мозга в области проекции поля зрения от –3 до +15 угл. град вдоль вертикального меридиана и от 2 до 15 угл. град вдоль горизонтального.
Подавляющее большинство МК, афферентирующих эти колонки, было расположено в поверхностных (супрагранулярных) слоях полей 17, 18 и только единичные МК (от одной до трех) локализовались в инфрагранулярных слоях.
Примеры расположения в полях 17, 18 МК, которые были спроецированы на выпрямленную поверхность коры, приведены для трех инъецированных колонок на рис. 1. Две из них были в левом полушарии и одна в правом (рис. 1 (а)), поэтому ее данные показаны на графике в зеркальном отображении. Кроме того, местоположение межполушарных (каллозальных) МК было отмечено в зеркальном отображении на графике распределения МК полушария, в котором была локализована инъецированная колонка.
Рис. 1.
Распределение на выпрямленной поверхности коры меченых клеток в полях 17, 18 мозга кошки после введения ПХ в колонку нейронов поля 19 (б), поля 21а (а), (в). Координаты колонки в поле зрения (азимут/высота) на (а) = 2/–1 угл/град, на (б) = 3/+5 угл/град, на (в) = 7/+5 угл/град. ПЗ – переходная зона 17/18. Вверху приведены фонтальные срезы мозга с мечеными клетками полей 17, 18, инъецированной колонкой и указаны ее координаты по Хорсли–Кларку (Р). Местоположение каллозальных входов колонок наложено на распределение внутриполушарных входов в зеркально симметричном отображении.
Fig. 1. Distribution on unfolded cortical surface of labeled cells in cat’s areas 17, 18 after HRP injection into a column of neurons in area 19 (б), area 21a (а), (в). Visual coordinates (azimuth/elevation) of the column in (а) = 2/–1 deg, in (б) = 3/+5 deg, in (в) = 7/+ 5 deg. ПЗ – transition zone 17/18. The upper inserts show the frontal brain sections with labeled cells, injected column and indicated its Horsley–Clark coordinate (P). The location of the callosal inputs of the column is mirror-symmetrically superimposed on the distribution of the intrahemispheric inputs.
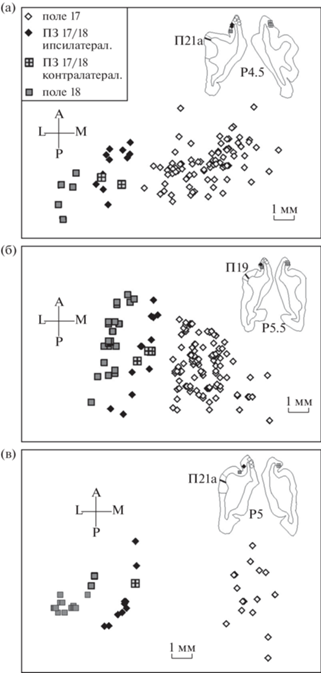
Выявлено группирование МК в полях 17, 18. Наличие участков полей, в которых отсутствуют МК, облегчало задачу отнесения групп МК к П17 и П18. При этом также учитывалось постепенное смещение в медиальном направлении границы между этими полями при переходе от каудальных к ростральным фронтальным срезам мозга (Р-А), т.е. в сторону проекции нижней части поля зрения (Tusa et al., 1981).
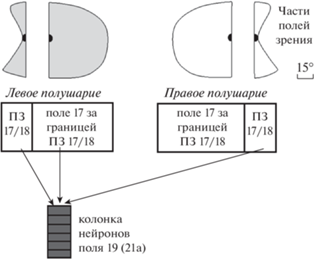
У колонок, имеющих каллозальные входы, МК были обнаружены в переходных зонах между полями 17 и 18 (ПЗ 17/18) в обоих полушариях, а также в участках (субзонах) полей 17, 18, расположенных по обеим сторонам от ПЗ 17/18 в полушарии, ипсилатеральном инъецированной колонке. На рис. 2 в схематическом виде показаны афферентные входы из П17 у колонки П19 или П21а.
Рис. 2.
Схематическое представление выявленных входов из поля 17 в колонку поля 19 (21а). Вверху показаны части полей зрения, которые представлены в переходной зоне между полями 17 и 18 (ПЗ 17/18) и за ее границей.
Fig. 2. Schematic representation of identified inputs from area 17 to the neuronal column of area 19 (21a). At the top are shown the parts of visual field, which are presented in the transition zone 17/18 and beyond.
Внутриполушарные входы колонок П19, 21а
Все семь инъецированных колонок получали афферентацию из участков П17 (белые ромбы на рис. 1) и П18 (серые квадраты), которые расположены по обе стороны от ПЗ 17/18. Эти субзоны входных нейронов находятся в проекции контралатерального полуполя зрения в обоих корковых полях (рис. 2). Расстояние между субзонами зависело от удаленности (азимута) колонки от проекции ЦВМ. Так, расстояние между субзонами МК в П17 и П18 у колонок, удаленных на 2–3 угл. град от проекции ЦВМ (рис. 1 (а), (б)), меньше, чем у колонки, удаленной на 7 угл. град (рис. 1 (в)). При использовании карт проекций (Tusa et al., 1981) отмечено примерное совпадение значений азимута колонки с азимутом центра зоны МК в П17. В П18 субзона МК была удлинена и ориентирована параллельно границе между П17 и П18, которая проходит внутри ПЗ 17/18, ее ориентация соответствует ориентации зоны внутренних связей колонок этого поля (Toporova et al., 2001). Однако субзона МК в П17 по сравнению с зонами внутренних связей этого поля, а также зонами связей колонок П18 с П17, удлиненными вдоль проекции горизонтального меридиана поля зрения (Алексеенко и др., 2002), расширена в основном вдоль проекции вертикального меридиана (А-Р), что указывает на суммацию входов.
Другой участок внутриполушарных входов в колонки полей 19, 21а расположен в ПЗ 17/18 (рис. 1, черные ромбы). Как было показано ранее для П17 (Payne, 1990), в ПЗ 17/18 представлена часть ипсилатерального полуполя зрения, которая расширяется кверху и книзу до 20–25 угл. град от 3.6 угл. град на уровне проекции нулевого горизонтального меридиана поля зрения (рис. 2, верхняя часть). В дальнейшем при исследовании межполушарных связей в полях 17, 18 методом локального введения маркеров (Olavarría 2001; Алексеенко и др., 2002; Alekseenko et al., 2005) обнаружено наличие в ПЗ 17/18 двух субзон, относящихся к П17 и к П18. Кроме того, были выявлены пространственно-временные различия этих субзон методом оптической визуализации активности (Rochefort et al., 2007). Следовательно, на обоих краях ПЗ 17/18 представлен ЦВМ, за которым в зеркально симметрично расположенных полях 17 и 18 полушария расположены проекции контралатерального полуполя зрения.
В ПЗ 17/18 полушария, ипсилатерального колонке П19 и П21а, обнаружен один или два ряда МК, ориентация которых параллельна субзоне МК П18 вне ПЗ 17/18 (рис. 1). Положение МК в рядах постепенно смещается в медиальную (М) сторону на извилине мозга по мере удаления от проекции area centralis в нижнюю часть поля зрения, к А (рис. 1, а также рис. 3, черные ромбы), что обусловлено отклонением проекции вертикального меридиана поля зрения от средней (сагиттальной ) плоскости мозга (Р-А).
Рис. 3.
Локализация меченых клеток в переходных зонах полей 17/18 обоих полушарий кошки после введения ПХ в колонки нейронов полей 19, 21а. Координаты колонок (азимут/высота) на (а) = 2/–1 угл/град, на (б) = 3/+5 угл/град, на (в) = 3/–1 угл/град, на (г) = 7/+5 угл/град, на (д) = 10/–3 угл/град. Черные ромбы – клетки в полушарии, ипсилатеральном колонке, квадраты с крестиками – каллозальные клетки, отложенные на графике в зеркальном отображении.
Fig. 3. Location of labeled cells in the transition zones 17/18 of both hemispheres after HRP injection into the columns of areas 19, 21a. Visual coordinates (azimuth/elevation) of the column in (а) = 2/–1 deg, in (б) = 3/+5 deg, in (в) = 3/–1 deg, in (г) = 7/+5 deg, in (д) = 10/–3 deg. Black diamonds – cells in the ipsilateral hemisphere, squares with crosses – callosal cells, represented in mirror symmetric mannier.

Полученные данные указывают, что МК отдельного ряда имеют одинаковые значения азимута их положения в проекции поля зрения при разных значениях элевации (высоты). Расположение МК в один или два ряда в ПЗ 17/18 зависело от координат колонки полей 19, 21а относительно ЦВМ. Два ряда МК (рис 3 (а), (б), (в)) наблюдались у колонок полей 19, 21а, расположенных вблизи проекции ЦВМ (азимут от 2 до 3 угл. град в проекции контралатерального полуполя зрения). Ряды входных МК у этих колонок были расположены на расстоянии менее 1 мм, т.е. локализованы в ПЗ 17/18 вблизи ее границ, в проекциях части ипсилатерального полуполя зрения, относящихся к П17 и П18. У более удаленных колонок полей 19, 21а (азимут 7–10 угл. град.) МК расположены в один ряд (рис. 3 (г), (д)), что указывает на их положение в центре ПЗ 17/18, т.е. там, где представлены крайние участки части ипсилатерального полуполя зрения в полях 17, 18 и проходит граница между этими полями. Таким образом, данные о расположении МК в ПЗ 17/18, которые иннервируют колонки полей 19, 21а, подтверждают представление о разделении этой зоны на две субзоны, относящиеся к разным полям (17 и 18).
Межполушарные входы колонок П19, 21а
В полушарии, противоположном инъецированной колонке полей 19, 21а, МК были обнаружены в ПЗ 17/18 и не выявлены в участках полей 17, 18, расположенных за пределами этой зоны. Положение этих каллозальных клеток отмечено квадратами с крестиками на рис. 1, а также на рис. 3, на котором для трех колонок П19 (3 (б), (в), (д)) и двух колонок П21а (3 (а), (г)) показаны МК только переходных зон 17/18 обоих полушарий.
При зеркальном совмещении фронтальных срезов разных полушарий было обнаружено, что местоположение каллозальных МК в ПЗ 17/18 совпадает с положением МК из одного или двух рядов ПЗ 17/18 на соответствующих срезах противоположного полушария. Это указывает, что пространственные координаты положения таких входов из ПЗ 17/18 разных полушарий у колонок полей 19, 21а одинаковы как по азимуту, так и по элевации. Такие симметрично расположенные входы из противоположных полуполей зрения локализованы в проекции одного и того же горизонтального меридиана.
Несмотря на значительные различия в количестве входов из переходных зон 17/18 разных полушарий, паттерны локализации МК сходным образом зависели от удаленности инъецированной колонки от проекции ЦВМ. У более близких к проекции ЦВМ колонок выявлены входы от двух рядов МК в ПЗ 17/18 ипсилатерального полушария, которые локализованы вблизи обеих ее границ, а также входы от каллозальных МК двух участков, которые также расположены вблизи границ ПЗ 17/18 (рис. 3 (а), (б), (в)). У более удаленных от проекции ЦВМ колонок обнаружены входы от одного ряда МК ПЗ 17/18 ипсилатерального полушария, а также от МК одного участка в ПЗ 17/18 противоположного полушария (рис. 3 (г), (д)).
Отметим, что каллозальные входы из ПЗ 17/18 не были обнаружены у одной из наиболее удаленных инъецированных колонок П19, которая была расположена в проекции поля зрения на расстоянии более 15 угл. град. от ЦВМ; у нее также отсутствовали и внутриполушарные входы из ПЗ 17/18. По техническим причинам не были получены данные о межполушарных связях еще одной колонки П19 с координатами 7/+10 угл. град, у которой в ПЗ 17/18 полушария, ипсилатерального колонке, был один ряд МК.
Таким образом, в проведенном исследовании было выяснено, что колонки нейронов П19 и П21а, расположенные в области проекции поля зрения от 2 до 10 угл. град вдоль горизонтального меридиана и от –3 до +5 угл. град вдоль вертикального, получают афферентацию от нейронов трех отдельных субзон в П17, а также в П18. Входные нейроны расположены в переходных зонах 17/18 обоих полушарий, а также в участках полей 17, 18, локализованных вне переходной зоны 17/18, полушария, ипсилатерального колонке.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
П19 и П21а у кошки занимают промежуточное положение в иерархии корковых полей между проекционными П17, 18 и полями более высоких уровней, которые разделяются на каналы передачи информации “что?” и “где?”. По данным электрофизиологических и поведенческих исследований считается, что П19 и П21 относятся к каналу анализа формы и текстуры изображений, т.е. к каналу “что? ” (Dreher, 1986; Khayat et al., 2000; Harutiunian-Kozak et al., 2008; Villeneuve et al., 2009; Kim et al., 2019). В работе, проведенной нами на относительно небольшом экспериментальном материале, принципиальной разницы между П19 и П21а в структуре их афферентных входов из полей 17, 18 не было обнаружено. Это, вероятно, связано с общими закономерностями в иннервации разных корковых полей из двух сетчаток, при этом известные различия свойств нейронов этих полей обусловлены локальными связями между нейронами, получающими входы из сетчатки одного и того же глаза.
В проведенном исследовании выявлено, что колонки полей 19, 21а, расположенные в проекции поля зрения до 10 угл. град от ЦВМ, получают прямые входы из трех субзон поля 17 и трех субзон поля 18. Две субзоны локализованы в ипсилатеральном относительно колонки полушарии (в ПЗ 17/18 и участке за ее границей) и одна – в ПЗ 17/18 противоположного полушария (рис. 1). Эти данные свидетельствуют об усложнении структуры нейронных связей при переходе от полей нижнего иерархического уровня (17, 18) к полям последующих уровней (19, 21а). Выявленная локализация входных нейронов в верхних слоях полей 17, 18 у колонок полей 19, 21а подтверждает, что эти поля относятся к разным уровням в иерархии корковых полей (Felleman, Van Essen, 1991; Scanel et al., 1995). При этом у кошки поля 17 и 18 относятся к одному иерархическому уровню в отличие от полей V1 и V2 у приматов (Felleman, Van Essen, 1991), поскольку они получают входы из НКТд и, кроме того, связи между полями 17 и 18, а также внутренние связи этих полей, обеспечиваются нейронами не только верхних слоев (Houzel et al., 1994; Toporova et al., 2001; Alekseenko et al. 2005; Innocenti, 2017).
Из сравнения результатов, полученных в нашей работе, с данными исследования входов из П17 в колонки П18 и входов из П18 в колонки П17, которые также были расположены в области межполушарных связей (Alekseenko et al., 2005), очевидно, что колонки полей 19, 21а получают дополнительные входы из ПЗ 17/18 ипсилатерального полушария. Эти входы исходят от нейронов, расположенных в проекции противоположного полуполя зрения, по сравнению со входами от нейронов других двух субзон (рис. 2). В связи с тем, что входы из дополнительной субзоны в ПЗ 17/18 упорядочены в один или два ряда, расположенных вдоль проекции вертикали поля зрения, они могут обеспечить нейронам колонок полей 19, 21а чувствительность к ориентационному компоненту изображений (Dreher, 1986; Wimborne, Henry, 1992; Harutiunian-Kozak et al., 2008).
Колонки полей 19, 21а, как и глазодоминантные колонки полей 17, 18, имеют немногочисленные каллозальные входы из полей 17, 18 (Alekseenko et al., 2005). Таких каллозальных входов из ПЗ 17/18 у колонок полей 19, 21а было значительно меньше, чем входов из ПЗ 17/18 ипсилатерального полушария, однако их удаленность от проекции ЦВМ в разных полушариях и соответственно в разных полуполях зрения, была одинаковой. При этом положение этих входных нейронов внутри переходных зон 17/18 коррелировало с удаленностью колонки полей 19, 21а от проекции ЦВМ. Такие равноудаленные от проекции ЦВМ нейроны ПЗ 17/18 обоих полушарий активируются при появлении симметрично расположенных изображений или их фрагментов в назальных полуполях зрения разных глаз. Это обусловлено тем, что источником входов в ПЗ 17/18 является зона назо-темпорального перекрытия на сетчатке, которая у кошек расположена в ее темпоральной половине. Поскольку в ПЗ 17/18 каждого полушария доминируют монокулярные нейроны, управляемые из контралатерального глаза (Berman et al., 1982), то нейроны колонок полей 19, 21а, получающие входы от нейронов обеих ПЗ 17/18, приобретают бинокулярные свойства и настройку на локусы трехмерного пространства. При этом конвергенция тех равноудаленных от проекции ЦВМ входных нейронов, которые локализованы в проекции одного и того же горизонтального меридиана поля зрения, обеспечивает нейронам колонок настройку на локусы пространства, расположенные в его центральной сагиттальной плоскости ближе точки фиксации (Barlow et al., 1967). Информация от таких бинокулярных нейронов может передаваться в центры вергентных движений глаз и использоваться при реализации психофизического процесса фузии двух изображений объектов.
Важными сведениями, касающимися организации межполушарных связей, является обнаруженное в работе отсутствие у колонок полей 19, 21а каллозальных входов из участков полей 17, 18, расположенных за пределом ПЗ 17/ 18. В полях 17, 18 нейроны этих участков имеют прямые межполушарные связи с нейронами ПЗ 17/ 18 противоположного полушария (Olavarria, 2001; Алексеенко и др., 2002). Однако колонки полей 19, 21а получают входы из двух других межполушарно связанных участков в полях 17, 18: это нейроны ПЗ 17/18 полушария, противоположного колонке, и нейроны, расположенные в ипсилатеральном полушарии за границей ПЗ 17/18 (рис. 1). Следовательно нейроны не всех участков области межполушарных связей в полях 17, 18 имеют выходы в колонки полей 19, 21а. На основании имеющихся морфологических данных по прослеживанию траекторий аксонов и их коллатералей в коре (Houzel et al., 1994; Innocenti, 2017; Rockland, 2018) , а также полученных в данной работе сведений можно полагать, что коллатерали аксонов нейронов трех выявленных субзон в полях 17, 18, которые имеют межполушарные связи в этих полях, обеспечивают входы в колонки полей 19, 21а.
Бинокулярные нейроны составляют 34–42% в П19 и 70% в П 21а (Duysens et al., 1982; Guillemot et al., 1993). Большинство нейронов, обеспечивающих входы в эти поля из полей 17, 18, также бинокулярны (Barlow et al., 1967; Hubel, Wiesel, 2005); они кодируют абсолютную диспаратность, т.е. настроены на положение локусов в трехмерном пространстве относительно точки фиксации взора (Cumming, Parker, 1999), причем их ответы модулируются каллозальными входами (Wunderle et al., 2015; Ramachandra et al., 2020). В недавних исследованиях поля V1 у макак (Parker et al., 2016) были выявлены функциональные модули кодирования диапазона диспаратностей, предпочитаемых бинокулярными нейронами. Размер модуля (3–4 мм) превышает диаметр глазодоминантной колонки и примерно соответствует протяженности внутренних нейронных связей в этом поле. Подобная изотропная модульная структура может существовать и у кошки в полях 17, 18, аналогичная организации ориентационных модулей (Иванов и др., 2006). Мы предполагаем, что модулем, состоящим из диспаратно селективных нейронов, может быть субзона нейронов, локализованных в поле 17 вне ПЗ 17/18, которые иннервируют отдельную колонку в полях 19, 21а. Конвергенция входов от бинокулярных нейронов такого модуля и нейронов обеих ПЗ 17/18 может обеспечить нейронам колонок полей 19, 21а настройку на относительную диспаратность между разными зрительными признаками (Thomas et al., 2002), а также кодирование более сложных стерео-признаков объектов, которые описаны у приматов: положение и наклон стерео-плоскостей, границ между ними, конфигурация поверхностей (Bakin et al., 2000; Li et al., 2017; Lu et al., 2018; Li, Shigemasu, 2019; Pettine et al., 2019; Parker, 2020; Pasupathy et al., 2020).
ЗАКЛЮЧЕНИЕ
Обнаруженная у кошки структура афферентных входов из полей 17 и 18 в колонки нейронов полей 19, 21а по сравнению со входами глазодоминантных колонок поля 18 (17) из поля 17 (18) может обеспечивать выделение более сложных стерео-признаков объектов.
Работа выполнена при поддержке Госпрограммы 47 ГП “Научно-технологическое развитие Российской Федерации” (2019–2030), тема 0134-2019-0005.
Список литературы
Алексеенко С.В., Шкорбатова П.Ю. Микроструктура внутриполушарных восходящих путей в экстрастриарные поля коры кошки. Интегративная физиология. 2021. 2 (2): 205–214.
Алексеенко С.В., Топорова С.Н., Макаров Ф.Н. Нейрональные связи, обеспечивающие объединение полуполей зрения. Сенсорные системы. 2002. 16 (2): 83–88.
Иванов Р.С., Бондарь И.В., Салтыков К.А., Шевелев И.А. Площадь зон оптической активации поля 17 коры мозга кошки при предъявлении решеток разной ориентации. Журн. высш. нерв. деят. им. И.П. Павлова. 2006. 56 (4): 516–522.
Alekseenko S.V., Toporova S.N., Makarov F.N. Neuronal connections of the cortex and reconstruction of the visual space. Neurosci. Behav. Physiol. 2005. 35 (4): 435–442.
Bakin J.S., Nakayama K., Gilbert C.D. Visual responses in monkey areas V1 and V2 to three-dimensional surface configurations. J. Neurosci. 2000. 20 (21): 8188–8198.
Barlow H.B., Blakemore C., Pettigrew J.D. The neural mechanisms of binocular depth discrimination. J. Physiol. 1967. 193 (2): 327–342.
Berman N., Payne B.R., Labar D.R., Murhy E.H. Functional organization of neurons in cat striate cortex: variations in ocular dominance and receptive-field type with cortical laminae and location in visual field. J. Neurophysiol. 1982. 48: 1362–1377.
Cumming B.G., Parker A.J. Binocular neurons in V1 of awake monkeys are selective for absolute, not relative, disparity. J. Neurosci. 1999. 19: 5602–5618.
Dreher B. Thalamocortical and corticocortical interconnections in the cat visual system: relation to the mechanisms of information processing. In: Pettigrew J.D., Sanderson K.J., Levick W.R., eds.Visual Neuroscience. 1986. London, England: Cambridge University Press. pp. 290–314.
Duysens J., Orban G.A., van der Glas H.W., de Zegher F.E. Functional properties of area 19 as compared to area 17 of the cat. Brain Res.1982. 231: 279–291.
Felleman D.J., Van Essen D.C. Distributed hierarchical processing in the primate cerebral cortex. Cerebral Cortex 1991. 1: 1–47.
Guillemot J-P., Paradis M.-C., Samson A., Ptito M., Richer L., Lepore F. Binocular interaction and disparity coding in area 19 of visual cortex in normal and split-chiasm cats. Exp. Brain Res. 1993. 94: 405–417.
Harutiunian-Kozak B.A., Grigorian G.G., Kozak J.A., Sharanbekian A.B., Sarkisyan G.S., Khachvankian D.K. Orientation sensitive properties of visually driven neurons in extrastriate area 21a of cat cortex. Arch. Ital. Biol. 2008. 146 (2): 119–130.
Houzel J.C., Milleret C., Innocenti G. Morphology of callosal axons interconnecting areas 17 and 18 of the cat. Eur. J. Neurosci. 1994. 6 (6): 898–917.
Hubel D.H., Wiesel T.N. Brain and visual perception. 2005. Oxford University Press. N. Y. Oxford. 744 p.
Innocenti G.M. Network causality, axonal computations, and Poffenberger. Exp. Brain Res. 2017. 235: 2349–2357.
Khayat P. S., Saint-Amour D., Molotchnikoff S., Lepore F., Guillemot J.-P. Cellular response to texture and form defined by motion in area 19 of the cat. Eur. J. Neurosci. 2000. 5: 1727–1738.
Kim T., Bair W., Pasupathy A. Neural Coding for Shape and Texture in Macaque Area V4. J. Neurosci. 2019. 39 (24): 4760–4774.
Li Z., Shigemasu H. Generalized representation of stereoscopic surface shape and orientation in the human visual cortex. Front. Hum. Neurosci. 2019. Aug 20;13:283. eCollection 2019.https://doi.org/10.3389/fnhum.2019.00283
Li Y., Zhang C., Hou C., Yao L., Zhang J., Long Z. Stereoscopic processing of crossed and uncrossed disparities in the human visual cortex. BMC Neurosci. 2017. 18 (1): 80. https://doi.org/10.1186/s12868-017-0395-7
Lu Y., Yin J., Chen Z., Gong H., Liu Y., Qian L., Li X., Liu R., Andolina I., Wang W. Revealing detail along the visual hierarchy: neural clustering preserves acuity from V1 to V4. Neuron. 2018. 98 (2): 417–428.
Olavarría J.F. Callosal connections correlate preferentially with ipsilateral cortical domains in cat areas 17 and 18, and with contralateral domains in the 17/18 transition zone. J. Comp. Neurol. 2001. 433: 441–457.
Parker A.J. Intermediate level cortical areas and the multiple roles of area V4. Current Opin.Physiol. 2020. 16: 61–66.
Parker A.J., Smith J.E.T., Krug K. Neural architectures for stereo vision. Phil.Trans. R. Soc. B. 2016. 371: 20150261.
Pasupathy A., Popovkina D.V., Kim T.: Visual functions of primate area V4. Annu. Rev. Vis. Sci. 2020. https://doi.org/10.1146/ annurev-vision-030320-041306
Payne B.R. Representation of the ipsilateral visual field in the transition zone between areas 17 and 18 of the cat’s cerebral cortex. Visual Neurosci. 1990. 4 (5): 445–474.
Pettine W.W., Steinmetz N.A., Moore T. Laminar segregation of sensory coding and behavioral readout in macaque V4. Proc. Natl. Acad. Sci. USA. 2019. 116: 14749–14754.
Ramachandra V., Pawlak V., Wallace D.J., Kerr J.N.D. Impact of visual callosal pathway is dependent upon ipsilateral thalamus Nat. Commun. 2020. 11 (1): 1889. https://doi.org/10.1038/s41467-020-15672-4
Rochefort N.L., Buzas P., Kisvarday Z.F., Eysel U.T., Milleret C. Layout of transcallosal activity in cat visual cortex revealed by optical imaging. Neuroimage. 2007. 36: 804–821.
Rockland K.S. Axon Collaterals and Brain States. Front. Syst. Neurosci. 2018. Jul 17;12: 32. eCollection 2018.https://doi.org/10.3389/fnsys.2018.00032
Salin P.A., Girard P., Kennedy H., Bullier J. Visuotopic organization of corticocortical connections in the visual system of the cat. J. Comp. Neurol. 1992. 320 (4): 415–434.
Scannell J.W., Blakemore C., Young M.P. Analysis of connectivity in the cat cerebral cortex. J. Neurosci. 1995. 15 (2): 1463–1483.
Thomas O.M., Cumming B.G., Parker A.J. A specialization for relative disparity in V2. Nature Neurosci. 2002. 5: 472–478.
Toporova S.N., Alekseenko S.V., Makarov F.N. The spatial distribution of horizontal connections in area 18 of the cortex in cats. Neurosci. Behav. Physiol. 2001. 31 (4): 345–348.
Tusa R.J., Palmer L.A., Rosenquist A.C. Multiple cortical visual areas: Visual field topography in the cat. Cortical sensory organization. New York. Humana Press. 1981. 2: 1–31.
Villeneuve M.Y., Vanni M.P., Casanova C. Modular organization in area 21a of the cat revealed by optical imaging: comparison with the primary visual cortex. Neuroscience. 2009. 164 (3): 1320–33.
Wimborne B.M., Henry G.H. Response characteristics of the cells in the cortical area 21a of the cat with special reference to orientation specificity. J. Physiol. 1992. 449: 457–478.
Wunderle T., Eriksson D., Peiker C., Schmid K.E. Input and Output Gain Modulation by the Lateral Interhemispheric Network in Early Visual Cortex. J. Neurosci. 2015. 35 (20): 7682–7694.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


