Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 2, стр. 259-273
Что может рассказать двунаправленная ходьба о центральных генераторах паттерна?
А. А. Вещицкий 1, В. А. Ляховецкий 2, О. В. Горский 3, 4, П. Е. Мусиенко 3, 4, Н. С. Меркульева 1, *
1 Институт физиологии им. И.П. Павлова РАН, лаб. нейроморфологии
Санкт-Петербург, Россия
2 Институт физиологии им. И.П. Павлова РАН, лаб. физиологии движения
Санкт-Петербург, Россия
3 Институт физиологии им. И.П. Павлова РАН, лаб. нейромодуляции двигательных и висцеральных функций
Санкт-Петербург, Россия
4 Институт трансляционной биомедицины СПбГУ, лаб. нейропротезов
Санкт-Петербург, Россия
* E-mail: mer-natalia@yandex.ru
Поступила в редакцию 08.09.2021
После доработки 12.11.2021
Принята к публикации 20.12.2021
- EDN: FAMNKD
- DOI: 10.31857/S0044467722020113
Аннотация
В экспериментально-теоретическом исследовании изучены особенности ЭМГ-активности мышц m. iliopsoas (IP), m. tibialis anterior (ТА) и m. gastrocnemius medialis (GM) задних конечностей децеребрированной кошки при ходьбе, вызванной эпидуральной стимуляцией спинного мозга, в различных локомоторных режимах, определяемых направлением движения лент тредбана: при однонаправленной ходьбе вперед (ХВ) и назад (ХН) и при двунаправленной ходьбе (ДХ), и предпринята попытка объяснения полученных данных с точки зрения различных моделей центрального генератора паттернов (ЦГП). При сохранении реципрокности работы мышц-антагонистов во время ДХ, активность TA и GM при ДХ у разнонаправленных конечностей отличается между собой: активность TA и GM для конечности, идущей назад при ДХ, подобна активности этих мышц при однонаправленной ХН, а активность TA и GM для конечности, идущей вперед при ДХ, подобна активности этих мышц при однонаправленной ХВ. Паттерны активности IP обеих конечностей при ДХ сходны, но активность IP ниже, чем для однонаправленной ХВ, и выше, чем для однонаправленной ХН. Стабильность мышечной активности IP более вариабельна, чем у TA и GM. Полученные данные могут быть объяснены с позиции работы двухуровневых моделей ЦГП, а также схемы согласования ЦГП разных конечностей, включающей реципрокные взаимоотношения между сгибательными полуцентрами и влияние возбуждающих и тормозных афферентных сигналов на каждое из звеньев системы в разные фазы локомоторного цикла.
ВВЕДЕНИЕ
Все четвероногие животные способны к локомоции; при этом конечности могут иметь различный паттерн взаимных движений (галоп, ходьба, рысь) в зависимости от целей двигательной активности. Такая согласованная активность конечностей основана на интеграции центральных генераторов паттерна (ЦГП) (особых интернейронных сетей, контролирующих локомоцию отдельной конечности) посредством спинальных комиссуральных связей (для интеграции конечностей одного и того же пояса, расположенных на разных сторонах тела) и длинных проприо-спинальных связей (для интеграции конечностей, принадлежащих различным поясам) (Frigon et al., 2017a). Одним из способов изучения функционирования комиссуральных взаимодействий является парадигма экспериментального расщепления конечностей (латеральное рассечение спинного мозга) (например, Kato, 1988, 1989), другим – парадигма “расщепленного” тредбана, когда каждая конечность двигается по отдельной ленте, скорость которой можно менять независимо от скорости другой ленты (Кулагин, Шик, 1970). Как правило, в рамках последней парадигмы изучается наиболее простой вид локомоции – ходьба вперед (ХВ). Такая ХВ возможна как в режиме 1:1, когда на 1 шаг одной конечности приходится 1 шаг другой конечности, так и в режимах иной кратности (1:2, …, 1:5), в которых на 1 шаг одной конечности приходится несколько шагов другой (Forssberg et al., 1980; Frigon et al., 2017b). Во время ходьбы по расщепленному тредбану активность двух конечностей несколько различается по частоте следования и амплитуде пачек электрической активности мышц, что, тем не менее, не мешает их согласованной работе.
Yang et al. (2005) и Choi, Bastian (2007) показали, что человек способен к двунаправленной ходьбе (ДХ), при которой одна конечность идет вперед, а другая – назад. Согласованная работа конечностей в этом режиме выглядит более сложной, чем при однонаправленной ходьбе, поскольку на примере кошки показано, что паттерны активности мышц при ХВ и ходьбе назад (ХН) различны в большей степени, чем при однонаправленной ходьбе с разными скоростями (Buford et al., 1990; Merkulyeva et al., 2021). Недавно нами было установлено, что электрическая эпидуральная стимуляция (ЭС) способна вызвать координированную ДХ у децеребрированных кошек, что позволило предположить, что для выполнения такой необычной локомоторной задачи достаточно контроля со стороны структур спинного мозга, ствола головного мозга и мозжечка (Lyakhovetskii et al., 2021). Сам факт существования ДХ у децеребрированного животного предъявляет определенные требования к функциональным схемам ЦГП и их сопряжениям, которые мы рассмотрим далее; и далеко не каждая схема ЦГП, известная по литературным данным, отвечает этим требованиям. Таким образом, целью данной работы являются изучение взаимной активности мышц двух задних конечностей децеребрированной кошки при ДХ и ее интерпретация с точки зрения основных функциональных схем ЦГП.
МЕТОДИКА
Объектом исследования являлись девять взрослых самцов кошек (весом 2.5–3.5 кг). Экспериментальные процедуры были одобрены Комиссией по этике Института физиологии им. Павлова (#10/17/2020). Эксперименты проводились в строгом соответствии с требованиями Директивы Совета Европы 2010/63EU Европейского парламента о защите животных, используемых в экспериментальных и других научных целях.
Хирургические процедуры и электростимуляция. Кошек глубоко анестезировали смесью изофлурана (2–4%) и газообразного кислорода. Трахея была интубирована, а сонные артерии перевязаны. Биполярные электромиографические электроды (провода из нержавеющей стали, диаметр 0.2 мм, тефлоновая изоляция) имплантировали в m. iliopsoas (IP, сгибатель бедра), m. tibialis anterior (ТА, сгибатель голеностопного сустава) и m. gastrocnemius medialis (GM, разгибатель голеностопного сустава) обеих задних конечностей. После животных децеребрировали на преколликулярно-постмаммилярном уровне (Ge-rasimenko et al., 2009). После децеребрации подача анестезии прекращалась. Голова, позвоночный столб и таз животного закреплялись в стереотаксической раме. В области поясничного отдела позвоночника выполнялась ламинэктомия. Эксперименты начинались через несколько часов после децеребрации.
Локомоцию вызывали с помощью ЭС посредством шарикового электрода (диаметр 0.5 мм), позиционируемого на твердой мозговой оболочке дорзальной поверхности спинного мозга в сегментах L5–L7; для каждого животного вызов всех рассматриваемых в работе режимов локомоции осуществляли из одной и той же точки поверхности спинного мозга. Точное расположение точки стимуляции определялось посмертно на основе бескорешково-корешкового метода сегментарного деления спинного мозга (Shkorbatova et al., 2019). Аналогично (Merkulyeva et al., 2018) были использованы следующие параметры стимуляции: частота 5 Гц, длительность импульса 0.2–0.5 мс, ток 80–300 мкА. Задние конечности были расположены на отдельных лентах тредбана, движущихся или назад (для однонаправленной ХВ), или вперед (для однонаправленной ХН) (Buford et al., 1990; Musienko et al., 2012), или одновременно в противоположных направлениях (для ДХ) со скоростью 0.45 м/с. Расстояние между тредбаном и фиксированным тазом составляло 21–25 см.
Анализ и статистика. Чтобы охарактеризовать кинематику локомоторных движений, на гребне подвздошной кости, головке бедра, латеральном мыщелке бедра, латеральной стороне лодыжки и пятом плюсневом суставе были установлены светоотражающие маркеры, а вид сбоку шагающей кошки был записан на видео (50 кадров/с) и проанализирован покадрово. В дополнение к видео ростро-каудальное перемещение конечностей оценивалось и по сигналам двух потенциометрических датчиков, прикрепленных к лодыжкам; с помощью тензометрических датчиков, расположенных под лентами тредбана, регистрировались силы реакции опоры. На основе анализа этих сигналов определялись фазы шага каждой конечности (опора и перенос). Сигналы ЭМГ усиливались и оцифровывались с частотой дискретизации 20 кГц, а сигналы от тензометрических и потенциометрических датчиков – с частотами дискретизации 5 кГц. ЭМГ-сигналы фильтровались в диапазоне 100–2000 Гц.
Согласно подходу, использованному для анализа ХВ и ХН в (Merkulyeva et al., 2018), определяли среднюю интегральную ЭМГ-активность каждой мышцы каждого животного в рамках 10–20 циклов ХН или ДХ, которую затем нормировали на соответствующую величину, полученную при ХВ. Аналогично нормировали паттерны ЭМГ-активности мышц при ДХ. Стабильность работы отдельных мышц при ходьбе оценивалась на основе коэффициента самоподобия (амплитуда второго пика автокорреляционной функции временного ряда (Kim et al., 2007)) по ЭМГ, сглаженной скользящим средним с окном 50 мс.
Данные представлены как среднее значение ± стандартное отклонение для индивидуальных величин и среднее значение ± стандартная ошибка для распределений ЭМГ в рамках шагательного цикла. Значимость на уровне 0.05 оценивалась с использованием парного критерия Уилкоксона – для оценки отличий индивидуальных величин – и с помощью критерия χ2 – для парных выборок (Press et al., 1992) при оценке отличий форм распределений ЭМГ в рамках шагательного цикла.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Перед вызовом ДХ проводили предварительное картирование области интереса, оценивая возможность вызова координированной ХВ и ХН. На рис. 1 (а) представлены примеры ЭМГ и траекторий движений конечностей для ДХ. При ДХ, как и во время однонаправленной ходьбы, периоды шагов конечностей одинаковы; наблюдаются правильный порядок чередования фаз локомоторного цикла для двух конечностей и их согласование: фазе переноса одной конечности соответствует фаза опоры другой. Однако при ДХ траектории движения конечностей сонаправлены: когда одна конечность движется вперед в фазе опоры, другая движется вперед в фазе переноса; когда одна конечность движется назад в фазе переноса, другая движется назад в фазе опоры. Высокий уровень стабильности движений задних конечностей в течение ДХ сопровождается стабильной реципрокной пачечной активностью ипсилатеральных мышц-антагонистов (TA и GM), а также чередованием пачечной активности мышц (IP, TA и GM) левой и правой конечности.
Рис. 1.
Характеристики двунаправленной ходьбы (ДХ). (а) – ЭМГ и траектории движения конечностей. GM, IP, TA – m. gastrocnemius medialis, m. tibialis anterior и m. illiopsoas левой (Л) и правой (П) конечностей, идущих вперед (ХВ) и назад (ХН) соответственно, ЭС – канал эпидуральной стимуляции, Шаг – траектории движения конечностей, черные прямоугольники – опора (ОП), белые – перенос (ПР). (б) – ЭМГ GM, IP и TA для конечности, движущейся вперед и назад при ДХ. Абсцисса – цикл шага конечности, движущейся вперед или назад, ордината – % от значений, полученных для однонаправленной ХВ. (в) – Интегральные характеристики ЭМГ GM, IP и TA по отношению к однонаправленной ХВ. Пунктирная линия – значение 100%. #, ##, ### – Достоверные отличия от однонаправленной ХВ, *, **, *** – достоверные отличия между иными режимами ходьбы на уровне p < 0.001, p < 0.01 и p < 0.05 соответственно. (г) – ЭМГ-стабильность GM, IP, TA во время однонаправленной ХВ, однонаправленной ХН и ДХ. * – Достоверные отличия между разными режимами ходьбы на уровне p <0.05. #, ## – Достоверные отличия между IP и GM/TA в условии ходьбы вперед. @ – Достоверные отличия между IP и GM в условии ДХ.
Fig. 1. The features of bidirectional locomotion. (а) – EMG and hind limb trajectories. GM, IP, TA – m. gastrocnemius medialis, m. tibialis anterior and m. illiopsoas of the left (Л) and right (П) hind limb going forward (ХВ) or backward (ХН) respectively, ЭС – channel of epidural stimulation, Шаг – the trajectory of hind limb movements, black rectangles – stance (ОП), white rectangles – swing (ПР). (б) – EMG of GM, IP and TA for hind limb moving forward or backward during bidirectional locomotion. Abscissa – the step cycle for hind limb moving forward or backward, ordinate – percentage ratio relative to bilateral forward stepping. (в) – Integral EMG characteristics of GM, IP and AT relative to bilateral forward stepping. Dotted line means 100%. #, ##, ### – significant difference relative to bilateral forward stepping, *, **, *** – significant difference between other locomotor modes at p < 0.001, p < 0.01 and p < 0.05 level respectively. (г) – EMG stability of GM, IP and TA during bilateral forward, bilateral backward stepping and bidirectional stepping. * – significant difference between different locomotor modes at p < 0.05 level. #, ## – significant difference between IP and TA/GM during forward walking. @ – significant difference between IP and GM during bidirectional walking.
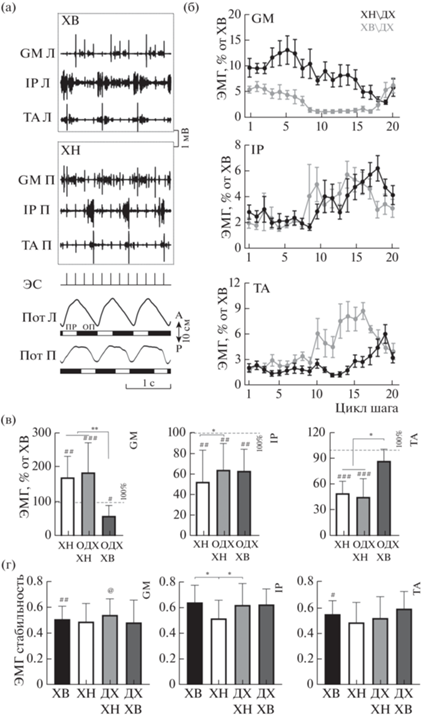
Временной паттерн мышечной активности в рамках шага при ДХ для конечности, идущей вперед, и конечности, идущей назад, вычисленный на основе средних данных ЭМГ и нормированный по отношению к однонаправленной ХВ, показан на рис. 1 (б). Как и при однонаправленной ХВ (Halbertsma, 1983; Smith, Carlson-Kuhta, 1995), разгибатель голени GM у обеих конечностей был в большей степени активен в фазе опоры, сгибатель голени (TA) и сгибатель бедра (IP) – в фазе переноса. Аналогично (Pratt et al., 1996) мы оценивали два параметра мышечной активности: интегральную амплитуду и паттерн активности мышцы в рамках шагательного цикла.
Разные мышцы иллюстрируют различные эффекты при переходе от однонаправленной ХВ к ДХ. Наибольшие изменения показаны для GM: выявлено как различное распределение мышечной активности в пределах шагательного цикла – для конечностей, идущих во время ДХ вперед или назад (p < 0.05), так и изменение в интегральной мышечной активности по отношению к однонаправленной ХВ (рис. 1 (в)). Активность GM для конечности, идущей назад при ДХ, как и при однонаправленной ХН, выше, чем для однонаправленной ХВ (183 ± 84%, p < 0.001 и 176 ± 74%, p < 0.01 соответственно), а активность GM для конечности, идущей вперед при ДХ, ниже, чем для однонаправленной ХВ (66 ± 32%, p < 0.05). Причем эти изменения не сонаправлены с изменением длительности фаз цикла ходьбы – длительность фазы опоры у конечности, идущей назад при ДХ, ниже, чем у конечности, идущей вперед при ДХ (Lyakhovetskii et al., 2021).
Меньшие изменения показаны для ТА: активность TA конечности, идущей назад во время ДХ, как и при однонаправленной ХН, снижена по отношению к однонаправленной ХВ (48 ± 24%, p < 0.001 и 52 ± 15%, p < 0.001 соответственно), а также – по отношению к конечности, идущей вперед при ДХ (91 ± 15% против 48 ± 24% и 52 ± 15%, p < 0.05), что предположительно обусловлено большим объемом движения в голеностопе при однонаправленной ХВ (Lyakhovetskii et al., 2021). При этом паттерны активности TA двух конечностей при ДХ не отличаются.
Выявленные изменения активности GM и TA могут быть обусловлены взаимными возбуждающими связями между ипсилатеральными сгибателями и контралатеральными разгибателями (Lundberg, 1981). В целом активность TA и GM для конечности, идущей назад при ДХ, подобна активности этих мышц при однонаправленной ХН, а активность TA и GM для конечности, идущей вперед при ДХ, подобна активности этих мышц при однонаправленной ХВ.
Напротив, паттерны активности IP обеих конечностей при ДХ сходны, равно как и уровни их активности, которые ниже, чем для однонаправленной ХВ (69 ± 31%, p < 0.01 и 67 ± 24%, p < 0.01, для конечностей, идущих назад и вперед соответственно). При этом уровень активности IP для конечности, идущей назад во время ДХ, несколько выше, чем во время однонаправленной ХН (69 ± 31% против 52 ± 30%, p < 0.05). Пониженная активность IP при однонаправленной ХН по отношению к однонаправленной ХВ (52 ± 30%, p < 0.01) хорошо согласуется с результатами, полученными нами ранее (Merkulyeva et al., 2021).
Различные режимы ходьбы характеризуются неодинаковыми уровнями стабильности мышечной активности (рис. 1 (г)). Среди трех анализируемых мышц стабильность ЭМГ IP наиболее вариабельна. При однонаправленной ХН ЭМГ IP менее стабильна, чем ЭМГ IP при однонаправленной ХВ и при ХН при ДХ (0.52 ± 0.14 против 0.65 ± 0.13, p < 0.05 и 0.63 ± 0.17, p < 0.05 соответственно), достоверных отличий между стабильностью ЭМГ IP при однонаправленной ХВ и при ДХ не выявлено. При однонаправленной ХВ ЭМГ IP стабильнее, чем ЭМГ GM и TA (0.65 ± 0.13 против 0.52 ± 0.10, p < 0.01 и 0.55 ± 0.10, p < < 0.05 соответственно). При ДХ ЭМГ IP для конечности, идущей назад, стабильнее, чем ЭМГ мышцы-разгибателя GM (0.63 ± 0.17 против 0.55 ± 0.12, p < 0.05), но не мышцы-сгибателя TA. При однонаправленной ХН и ХВ при ДХ достоверных отличий между стабильностью ЭМГ IP, TA и GM не выявлено.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Одной из задач настоящей работы была оценка работоспособности имеющихся моделей ЦГП в условиях необычных локомоторных задач (в данном случае ДХ). Большинство из этих моделей рассматривают ХВ, что или напрямую отражено в соответствующих работах, или следует из отсутствия описания иных видов локомоции.
Сделаем краткий экскурс в историю разработки некоторых из этих моделей. Предпосылки для формирования представлений об устройстве локомоторного ЦГП были сформулированы в работах C.S. Sherrington, в которых он показал способность спинальных кошек и собак к ходьбе задними конечностями, сходной с ходьбой интактных животных, объяснив это достаточно простыми рефлекторными механизмами, запускаемыми проприорецепторами (Sherrington, 1910) (рис. 2 (а)).
Рис. 2.
Модели локомоторного центрального генератора паттернов. (а) – Рефлекторная модель C.S. Sherington; (б) – Модель “полуцентров” T.G. Brown; (в) – Пример “трехнейронной” кольцевой модели G. Székely; (г) – Модель многорядного многослойного кольца В.С. Гурфинкеля и М.Л. Шика; (д) – Модульная модель S. Grillner для ходьбы вперед, РБ – разгибатель бедра, РК – разгибатель колена, РЛ – разгибатель лодыжки, РС – разгибатель стопы, РП – короткий сгибатель большого пальца стопы, короткий разгибатель пальцев, СБ – сгибатель бедра, СК – сгибатель колена, СЛ – сгибатель лодыжки, СС – сгибатель стопы, МРБ – мышцы-разгибатели бедра, МРК – мышцы-разгибатели колена, МРЛ – мышцы-разгибатели лодыжки, МРС – мышцы-разгибатели стопы, МРП – мышцы-разгибатели пальцев, МСБ – мышцы-сгибатели бедра, МСК – мышцы-сгибатели колена, МСЛ – мышцы-сгибатели лодыжки, МСС – мышцы-сгибатели стопы; (е) – Асимметричная модель K.G. Pearson и J. Duysens; (ж) – Двухуровневая модель R.M. Brownstone и J.M. Willson. Рисунок создан по данным, опубликованным в Sherrington, 1910; Brown, 1911, 1913; Kling, Székely, 1968; Grillner, 1981; Pearson, Duysens, 1976; Brownstone, Wilson, 2008.
Fig. 2. Models of locomotor central pattern generators. (а) – Reflex model of C.S. Sherington; (б) – “Half-center” model of T.G. Brown; (в) – The example of the “three-neuron” ring model of G. Székely; (г) – Model of a multilayer ring of V.S. Gurfinkel and M.L. Shik; (д) – “Unit burst” model of S. Grillner, РБ – hip extensor, РК – knee extensor, РЛ – ankle extensor, РС – foot extensor, РП – short toe flexor, extensor digitorum brevis, СБ – hip flexor, СК – knee flexor, СЛ – ankle flexor, СС – foot flexor, МРБ – hip extensor muscles, МРК – knee extensor muscles, МРЛ – ankle extensor muscles, МРС – foot extensor muscles, МРП – short toe flexor muscles, extensor digitorum brevis muscles, МСБ – hip flexor muscles, МСК – knee flexor muscles, МСЛ – ankle flexor muscles, МСС – foot flexor muscles; (е) – Asymmetric “Flexor-burst” model of K.G. Pearson and J. Duysens; (ж) – “Two-level” model of R.M. Brownstone and J.M. Willson. The figure is created from data published in Sherrington, 1910; Brown, 1911, 1913; Kling, Székely, 1968; Grillner, 1981; Pearson, Duysens, 1976; Brownstone, Wilson, 2008.
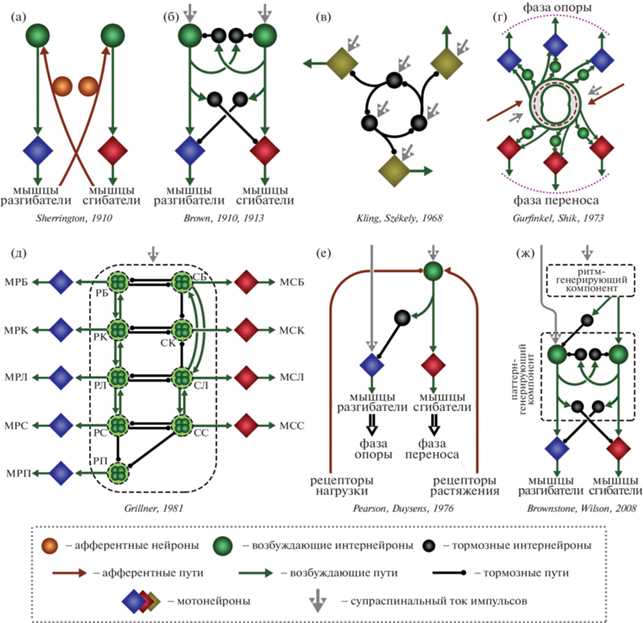
Позже эксперименты C.S. Sherrington были модифицированы T.G. Brown (Brown, 1911, 1913); в них были показаны неизменные паттерны моторной активности задних конечностей спинальных животных при перерезке дорзальных корешков или химической блокировке входов от проприо- и экстерорецепторов. На основе этих данных T.G. Brown предположил, что локомоторная активность обеспечивается внутренними структурами спинного мозга, и для объяснения механизма работы данных структур предложил модель “полуцентров” (“half-center”) (Brown, 1914). Согласно данной модели (рис. 2 (б)), движение любой конечности находится под контролем отдельного центра, который образован двумя группами возбуждающих интернейронов (полуцентров), имеющих прямые связи с мотонейронами, управляющими мышцами-сгибателями и мышцами-разгибателями соответственно. При этом взаимные тормозные (реципрокные) связи между полуцентрами обеспечивают возможность активности в каждый момент времени только одного из них. Постепенно активный полуцентр “утомляется”, что приводит к снижению его возбудимости до критического уровня, вследствие чего противоположный полуцентр освобождается от тормозного влияния и мгновенно активируется. Таким образом, модель “полуцентров” подразумевает в своем составе только один “уровень” интернейронов, обеспечивающих процесс генерации паттерна активности мышц в ходе локомоторного цикла (McCrea, Rybak, 2008).
Иным видом гипотетических схем ЦГП, объясняющих процесс формирования паттерна активности мышц для конечностей, стали кольцевые модели. Одна из таких моделей была предложена G. Székely в 1965 г. и развита им в соавторстве с U. Kling в 1968 г. (Kling, Székely, 1968; Gurfinkel, Shik, 1973). Она представляет собой зацикленную цепь из тормозных интернейронов, получающих тонический возбуждающий приток импульсов (рис. 2 (в)). При поступлении возбуждения на кольцевой интернейрон, он через терминали аксонов обеспечивает торможение связанных с ним мотонейрона и соседнего интернейрона. Заторможенный интернейрон, в свою очередь, высвобождает от своего влияния тонически возбуждаемый мотонейрон и следующий кольцевой интернейрон. Последовательность передачи возбуждения в такой системе определяет нормальный порядок активации мышц конечности в ходе локомоторного цикла (Шик, 1976).
В.С. Гурфинкель и М.Л. Шик (Gurfinkel, Shik, 1973) предложили иную кольцевую модель, называемую “многорядным многослойным кольцом” (Шик, 1976) (рис. 2 (г)). В основе данной модели лежат не тормозные, а возбуждающие интернейроны. Схематично данную модель изображают в виде тора, состоящего из множества взаимосвязанных интернейронов (“интернейронная среда”) (Shik, Orlovsky, 1976). Как и в классической кольцевой модели, вдоль данной закольцованной трехмерной сети интернейронов располагаются мотонейроны разных мышц конечности. Выход на эти мотонейроны из кольца реализуется либо напрямую, либо через дополнительные интернейроны. Все возможные особенности локомоции объясняются двумя составляющими: (1) величиной сечения тора (т.е. “интернейронной среды”) в разных его участках – чем она больше, тем быстрее скорость распространения активности за счет пространственной суммации (таким образом, наиболее широкими частями кольца являются области, представляющие в ходе локомоторного цикла наиболее быстрые переходы с фазы опоры на перенос, и наоборот); (2) нисходящим супраспинальным и афферентным притоками, обеспечивающими увеличение возбудимости нейронов кольца до надпороговых значений, за счет чего возможна циркуляция импульсов по кольцу. Кроме того, афферентный приток от рецепторов конечности, постоянно меняющийся в ходе локомоторного цикла, оказывает влияние на скорость распространения активности по кольцу, повышая и понижая возбудимость разных его участков.
Позже была представлена одна из наиболее гибких моделей, позволяющая объяснить все разнообразие возможных локомоторных паттернов – модульный ЦГП (“unit burst generator”), предложенный S. Grillner в 1981 г. (Grillner, 1981). Согласно данной концепции, в ЦГП каждой конечности отдельные модули интернейронов (единицы, генерирующие импульсы) обеспечивают активность конкретной группы мотонейронов, иннервирующих близкие мышцы-синергисты (например, все сгибатели бедра) (рис. 2 (д)). Общий моторный паттерн всей конечности реализуется за счет сочетания процессов торможения/возбуждения между данными модулями, при этом изменение режимов взаимодействия между ними, контролируемое супра-спинально, опосредует специфику локомоции (Grillner, 2006).
В 80-е годы K. Pearson с коллегами представили асимметричную модель устройства локомоторного ЦГП под названием “сгибательный генератор” (“flexor burst generator” или “swing generator”) (Pearson et al., 1973; Pearson, Duysens, 1976). Данная модель не является автономной от афферентного потока импульсов и была предложена на основе данных по исследованию механизмов инициации перехода от фазы опоры (обеспечиваемой в основном мышцами разгибателями) к фазе переноса (обеспечиваемой в основном мышцами-сгибателями) в ходе локомоторного цикла (рис. 2 (е)). Авторы выделяют две составляющие данного механизма: (1) сигнал от рецепторов о положении конечности в точке перехода вызывает переключение фазы опоры на перенос; (2) по мере разгибания конечности груз, переносимый ею, уменьшается, тем самым снижается активность в рецепторах, детектирующих нагрузку, вызывая инициацию фазы переноса. Асимметричность данной модели заключается в генерации ритма только для мотонейронов мышц-сгибателей, в то время как мотонейроны мышц-разгибателей тонически возбуждаются потоком супраспинальных импульсов без какого-либо ритма. Торможение данных “разгибательных” мотонейронов обеспечивается тормозными интернейронами, на которых заканчиваются проекции сгибательного генератора, тем самым обеспечивая реципрокное взаимодействие между антагонистичными мотонейронами.
Позже K. Pearson пересмотрел свои взгляды по поводу такой радикальной асимметрии в устройстве ЦГП (Pearson, 1995), приближаясь к классической модели полуцентров. Это связано с развитием представлений о механизмах взаимодействия локомоторных сетей с проприоцептивной системой и ее влияния на “разгибательные” элементы ЦГП. Однако свое развитие идеи асимметричной структуры ЦГП нашли в некоторых моделях двухуровневой организации локомоторного генератора (Brownstone, Wilson, 2008) (рис. 2 (ж)).
Согласно полученным в настоящем исследовании результатам, при ДХ левая и правая конечности двигаются в противоположные стороны с сохранением одного и того же ритма, а мышцы активируются в соответствующие для них фазы локомоторного цикла: сгибатели – во время фазы переноса, а разгибатели – во время фазы опоры. При ДХ IP каждой конечности имеет схожую амплитуду активности в рамках локомоторного цикла (рис. 1 (в)), паттерны их ЭМГ активности также одинаковы (рис. 1 (б)), что в совокупности свидетельствует о координированной работе ЦГП для левой и правой конечностей. Данное явление возможно в рамках работы каждой из вышеописанных моделей ЦГП, у которых ритм и паттерн активации мышц реализуются за счет работы одних и тех же нейронных сетей. Однако ЭМГ-активность остальных мышц (GM и TA) у левой и правой конечностей при ДХ существенно отличается (рис. 1 (б, в)). Данный факт может быть объяснен с точки зрения более сложных многоуровневых моделей организации ЦГП и их взаимодействия.
Принцип функционального разделения внутри ЦГП был, по-видимому, впервые предложен на основе теоретических соображений для построения математической модели связанных нелинейных осцилляторов, способной к синхронизации в режиме 2:1 (Collins, Stewart, 1992). Далее он был поддержан D. Kriellaars и соавт. (1994) для объяснения того, каким образом сенсорная стимуляция может менять длительность локомоторного цикла, не влияя на амплитуду некоторых электронейрограмм. Позже свое развитие данная концепция получила в виде многоуровневых моделей организации ЦГП (Burke et al., 2001; Lafreniere-Roula, McCrea, 2005). Наиболее признанной среди них является двухуровневая модель, согласно которой в каждом полуцентре нейроны первого уровня обеспечивают генерацию ритмической̆ активности и формируют прямые связи с интернейронами второго уровня, которые в соответствии с заданным на первом уровне ритмом обеспечивают правильный порядок активации мышц (McCrea, Rybak, 2008). При этом некоторые авторы на основе данных, которые легли в основу одноуровневой модели сгибательного генератора, полагают наличие схожей асимметрии у ритм-генерирующего компонента двухуровневой модели: формирование и передача ритма происходит только на сгибательную половину ЦГП, в то время как разгибательная часть, тонически возбуждаемая со стороны супраспинальных структур, с тем же ритмом тормозится через интернейроны (Brownstone, Wilson, 2008) (рис. 2 (ж)).
Возможность реализации сложных локомоторных паттернов требует системы комплексной координации между ЦПГ разных конечностей, зависимой от супраспинальных сигналов, периферической афферентации и уровня возбудимости локомоторных сетей (Rossignol et al., 2006). Ранее (Lyakhovetskii et al., 2021) была показана возможность вызова ДХ при ЭС спинного мозга у децеребрированного животного при обратимом отключении связей от супраспинальных локомоторных центров (мозжечка и ствола мозга) к спинному мозгу. Это свидетельствует о том, что для реализации такого необычного режима ходьбы достаточно работы нейронных сетей исключительно спинного мозга при наличии неспецифического тонического источника возбуждения спинальных нейронных сетей в виде ЭС. В качестве триггера и модулятора локомоторного поведения в таком случае выступают двигающиеся ленты тредбана, обеспечивающие афферентный поток импульсов от каждой из конечностей.
Многие модели межконечностной координации представляют собой достаточно простые схемы из взаимно возбуждающих и тормозящих связей между ЦГП разных конечностей, работающих под контролем супраспинальных локомоторных центров (Stafford, Barnwell, 1985; Grillner, 2006; Rybak, 2015; Molkov et al., 2015). Данные модели хорошо описывают некоторые локомоторные паттерны (ходьбу, галоп, рысь в направлении вперед) у интактных животных, но не у спинальных или децеребрированных экспериментальных моделей, супраспинальный вход у которых или отсутствует, или значительно редуцирован. Координация таких сложных моторных режимов требует заведения в схему межконечностной координации корректирующих афферентных импульсов от мышц конечностей, позволяющих модулировать ритм и паттерн мышечной активации в соответствии с требуемым видом локомоции.
В качестве источника афферентных сигналов выступают проприорецепторы мышц конечностей: мышечные веретена, сигнализирующие о растяжении мышцы, и сухожильные рецепторы, активирующиеся при сокращении мышцы (Pearson, 1995). Известно, что на смену фаз локомоторного цикла особое влияние оказывает состояние проприорецепторов мышц бедра (Lam, Pearson, 2001). Так, при ХВ экстремальное разгибание бедра является сигналом для инициации перехода из фазы опоры в фазу переноса посредством запуска сгибателей бедра и, наоборот, экстремальное сгибание бедра запускает смену фазы переноса на фазу опоры, активируя мышцы-разгибатели (Pearson, 2008). Другим важным корректирующим фактором является “нагрузка” конечности, определяемая передающимся на мышцы конечности весом тела во время фазы опоры (Pearson, Duysens, 1976). Наличие или отсутствие “нагрузки” указывает локомоторной системе на фазу локомоторного цикла в моменты, когда конечность не находится в экстремальных позициях (полное сгибание или полное разгибание бедра) (Frigon et al., 2016). Еще один фактор, который необходимо учитывать при построении модели межконечностной координации во время ходьбы, – это наличие реципрокных взаимоотношений между сгибательными компонентами ЦГП двух конечностей. При ХВ (Musienko et al., 2011), ХН (Buford et al., 1990; Merkulyeva et al., 2018; Harnie et al., 2020) и ДХ (Yang et al., 2005; Choi, Bastian, 2007; Lyakhovetskii et al., 2021) может наблюдаться двух-опорная фаза, во время которой одновременно активны мышцы-разгибатели двух конечностей, но не двухпереносная фаза, когда за счет одновременной работы мышц-сгибателей двух конечностей обе лапы находились бы в воздухе. Эти данные согласуются с принципами координации внутри ЦГП, описанными R.M. Brownstone и J.M. Willis (2008) в их асимметричной двухуровневой модели, рассмотренной ранее (рис. 2 (ж)): согласно ей, именно ритм-формирующие уровни каждого ЦГП (левой и правой конечности), генерирующие ритм для сгибателей (но никогда – для разгибателей), находятся в жестких реципрокных отношениях.
На особую роль сгибателя бедра (IP) при формировании локомоторного ритма указывают и данные, представленные на рис. 1 (г): стабильность (ритмичность) пачек IP при однонаправленной ХВ выше, чем у GM и TA, тогда как при однонаправленной ХН, когда обе конечности уже согнуты в момент начала фазы переноса, стабильность пачек IP уменьшается. При этом сопоставимый с однонаправленной ХВ уровень стабильности пачек IP конечности, идущей назад, во время ДХ, вероятно, связан с влиянием полноценно разгибающегося бедра противоположной конечности.
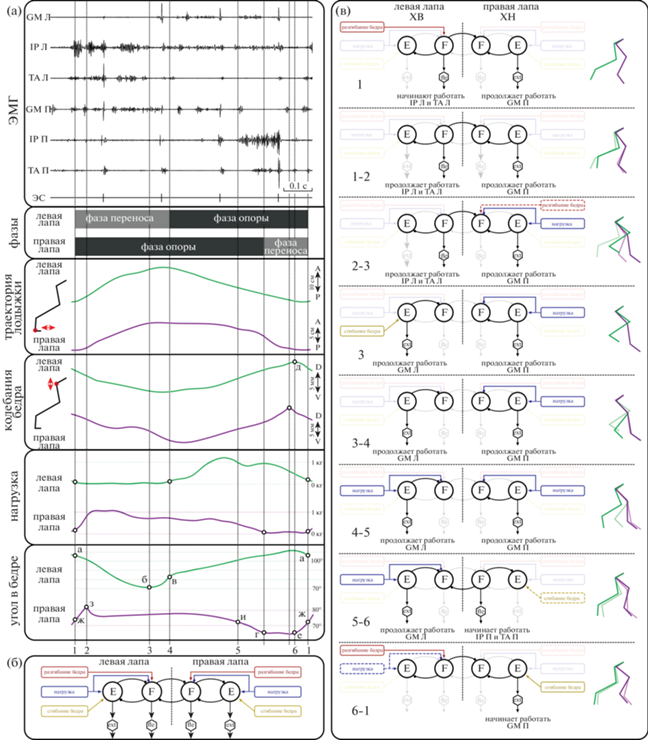
Среди моделей межконечностной координации вышеуказанные факторы были учтены в концепте, предложенном Frigon и соавт. (2016), для объяснения возможности ХВ у спинальных кошек на расщепленном тредбане, ленты которого движутся с разными скоростями. В этом случае возможна ходьба с разным соотношением количества шагов для левой и правой конечности за один локомоторный цикл (кратности 1: 2, 1: 3, 1: 4). Данная модель позволяет объяснить возможность ДХ в каждой из фаз локомоторного цикла (табл. 1, рис. 3).
Таблица 1.
Состояние задних конечностей в ключевых временных точках локомоторного цикла Table 1. Condition of the hind limbs at key time points of the locomotor cycle
| Этап цикла | Левая конечность (шагает вперед) | Правая конечность (шагает назад) |
|---|---|---|
| Момент времени 1 | Находится в конце фазы опоры предыдущего локомоторного цикла, афферентация от мышечных веретен разогнутого бедра запускает ипсилатеральный сгибательный полуцентр, который в свою очередь активирует работу мышц-сгибателей (IP Л и TA Л), а также тормозит ипсилатеральный разгибательный полуцентр и контралатеральный сгибательный полуцентр | За счет работы ипсилатерального разгибательного полуцентра (запущенного на этапе 6-1) и соответственно работы мышц-разгибателей (GM П) происходит касание конечности поверхности тредбана (рис. 3 (а), точка ж) |
| Этап 1–2 | За счет работы ипсилатерального сгибательного полуцентра (запущенного в момент времени 1) начинается фаза переноса: происходит процесс сгибания всех суставов конечности, ее отрыв от поверхности тредбана (рис. 3 (а), точка а) и перенос в ростральном направлении | За счет работы ипсилатерального разгибательного полуцентра (запущенного на этапе 6-1) наступает фаза опоры: в ходе разгибания суставов конечности происходит постепенное нарастание нагрузки |
| Этап 2–3 | Аналогично ХН интактных кошек (Buford et al., 1990), бедро достигает максимального разгибания (рис. 3 (а), точка з). Однако, по всей видимости, афферентация от его мышечных веретен, стимулирующая ипсилатеральный сгибательный полуцентр, недостаточна (84° (ХН) vs 110° (ХВ)), чтобы перекрыть высокую нагрузку, тормозящую ипсилатеральный сгибательный полуцентр, а также тормозящее воздействие от контралатерального сгибательного полуцентра. Вследствие чего продолжается активность мышц-разгибателей (GM П), активируемых ипсилатеральным разгибательным полуцентром | |
| Момент времени 3 | Находится ближе к концу фазы переноса (рис. 3 (а), точка б), афферентация от мышечных веретен согнутого бедра активирует ипсилатеральный разгибательный полуцентр, который в свою очередь активирует работу мышц-разгибателей (GM Л) и тормозит ипсилатеральный сгибательный полуцентр | |
| Этап 3–4 | За счет работы ипсилатерального разгибательного полуцентра (запущенного в момент времени 3) и, соответственно, активации мышц-разгибателей (GM Л) происходит разгибание суставов конечности и ее касание поверхности тредбана (рис. 3 (а), точка в) | |
| Этап 4–5 | Начинается фаза опоры, в ходе разгибания суставов конечности появляется нагрузка, поддерживающая дальнейшую работу ипсилатерального разгибательного полуцентра. За счет работы мышц-разгибателей несколько поднимается таз животного | |
| Этап 5–6 | Вероятно, за счет некоторого подъема таза животного левой конечностью (рис. 3 (а), точка д) нагрузка на конечность постепенно уменьшается, достигая порогового значения, после которого активность ипсилатерального разгибательного полуцентра перестает стимулироваться, а сгибательный полуцентр освобождается от всех тормозящих его воздействий, вследствие чего происходит активация работы мышц-сгибателей (IP П и TA П) (рис. 3 (а), точка и), наступает фаза переноса: происходит процесс сгибания всех суставов конечности, ее отрыв от поверхности тредбана (рис. 3 (а), точка г) и начинается фаза переноса в каудальном направлении | |
| Этап 6–1 | С одной стороны, афферентация от разогнутого бедра стимулирует ипсилатеральный сгибательный полуцентр, с другой – еще имеющаяся нагрузка на конечность тормозит его, вследствие чего мышечной активности не наблюдается | Находится в конце фазы переноса, афферентация от мышечных веретен согнутого бедра (рис. 3 (а), точка е) продолжает активировать работу ипсилатерального разгибательного полуцентра, который освобождается от тормозного влияния ипсилатерального сгибательного полуцентра, вследствие его реципрокного торможения контралатеральным сгибательным полуцентром. Таким образом происходит активация мышц-разгибателей (GM П) |
Рис. 3.
Схемы согласованной работы центральных генераторов паттерна (ЦГП) задних конечностей. (а) – Характеристики работы задних конечностей за один локомоторный цикл. GM – m. gastrocnemius medialis, TA – m. tibialis anterior, IP – m. iliopsoas, ЭС – эпидуральная электрическая стимуляция, Л – левая лапа, П – правая лапа, A – anterior, P – posterior, а-ж – ключевые моменты локомоторного цикла, 1–6 – этапы локомоторного цикла. (б) – Общая схема согласования ЦГП левой и правой задних конечностей модели по (Frigon et al., 2016). F – сгибательный полуцентр ЦГП, E – разгибательный полуцентр ЦГП, ext – мотонейроны мышц разгибателей, fle – мотонейроны мышц сгибателей, линия со стрелкой на конце – возбуждающий путь, линия с кругом на конце – тормозная связь, штриховая линия – подпороговая афферентация. (в) – Согласование ЦГП левой и правой задних конечностей при ДХ на разных этапах локомоторного цикла. Подробности в табл. 1. ХВ – ходьба вперед, ХН – ходьба назад, F – сгибательный полуцентр ЦГП, E – разгибательный полуцентр ЦГП, ext – мотонейроны мышц разгибателей, fle – мотонейроны мышц сгибателей, GM – m. gastrocnemius medialis, TA – m. tibialis anterior, IP – m. iliopsoas, линия со стрелкой на конце – возбуждающий путь, линия с кругом на конце – тормозная связь, штриховая линия – подпороговая афферентация, зеленая и фиолетовая изломанные линии – положение суставов в разные фазы локомоторного цикла, соответственно для левой и правой конечности.
Fig. 3. Coordination schemes of hind limbs central pattern generators (CPG). (а) – Hind limbs characteristics in one locomotor cycle. GM – m. gastrocnemius medialis, TA – m. tibialis anterior, IP – m. iliopsoas, ЭС – epidural electrical stimulation, Л – left limb, П – right limb, A – anterior, P – posterior, а–ж – key moments of the locomotor cycle, 1–6 – stages of the locomotor cycle. (б) – General scheme of coordination of hind limbs CPGs according to (Frigon et al., 2016). F – flexor half-center of CPG, E – extensor half-center of CPG, ext – extensor muscle motoneurons, fle – flexor muscle motoneurons, line ending with arrowhead – excitatory connection, line ending with circle – inhibitory connection, dashed line – subthreshold afferentation. (в) – Coordination of hind limb CPGs for BIDIW in different stages of the locomotor cycle. Details in table 1. ХВ – forward walking, ХН – backward walking, F – flexor half-center of CPG, E – extensor half-center of CPG, ext – extensor muscle motoneurons, fle – flexor muscle motoneurons, GM – m. gastrocnemius medialis, TA – m. tibialis anterior, IP – m. iliopsoas, Л – left hind limb, line ending with arrowhead – excitatory connection, line ending with circle – inhibitory connection, dashed line – subthreshold afferentation, green and violet stick diagrams – the position of the joints in different stages of the locomotor cycle for the left and right hind limb, respectively.
ЗАКЛЮЧЕНИЕ
В работе на модели децеребрированной кошки рассмотрены различные характеристики ДХ – необычного и сложного для координации режима локомоции. Проведен анализ характеристик активности мышц-сгибателей (IP, ТА) и разгибателей (GM) при ДХ в сравнении с однонаправленной ХВ и ХН. Показано, что во время ДХ паттерны ЭМГ-активности всех трех мышц конечности, идущей вперед, и конечности, идущей назад, подобны паттернам активности соответствующих мышц при однонаправленной ХВ и ХН соответственно. При этом наиболее подобны друг другу паттерны активности IP, а наименее подобны – паттерны активности GM. Во время однонаправленной ХВ ЭМГ-сигнал IP более стабилен, чем у TA и GM, при этом во время однонаправленной ХН он менее стабилен, чем при однонаправленной ХВ и при ХН во время ДХ. Полученные данные свидетельствуют в пользу многоуровневых асимметричных моделей организации ЦГП, в которых доминируют мышцы-сгибатели; при этом ЭМГ-сигналы при ДХ указывают на тесное согласование между сгибательными полуцентрами.
Работа поддержана грантами РНФ № 21-15-00235 (теоретическое исследование, оплата труда АВ и НМ), РФФИ № 19-015-00409 (экспериментальный дизайн), а также проектом Санкт-Петербургского государственного университета № 73025408 (оплата труда ПМ и ОГ).
Список литературы
Кулагин Л.С., Шик М.Л. Взаимодействие симметричных конечностей при управляемой локомоции. Биофизика. 1970. 15 (1): 164–170.
Шик М.Л. Физиология движения. Л.: Наука, 1976. 375 с.
Brown T.G. The intrinsic factors in the act of progression in the mammal. Proc. Roy. Soc. Lond. B. 1911. 84 (572): 308–319.
Brown T.G. The phenomenon of “Narcosis progression” in mammals. Proc. Roy. Soc. Lond. B. 1913. 86 (586): 140–164.
Brown T.G. On the nature of the fundamental activity of the nervous centres; together with an analysis of the conditioning of rhythmic activity in progression, and a theory of the evolution of function in the nervous system. J. Physiol. 1914. 48 (1): 18–46.
Brownstone R.M., Wilson J.M. Strategies for delineating spinal locomotor rhythm-generating networks and the possible role of Hb9 interneurones in rhythmogenesis. Brain Res. Rev. 2008. 57 (1): 64–76.
Buford J.A., Zernicke R.F., Smith J.L. Adaptive control for backward quadrupedal walking. I. Posture and hindlimb kinematics. J. Neurophysiol. 1990. 64 (3): 745–755.
Burke R.E., Degtyarenko A.M., Simon E.S. Patterns of locomotor drive to motoneurons and last-order interneurons: Clues to the structure of the CPG. J. Neurophysiol. 2001. 86 (1): 447–462.
Choi J.T., Bastian A.J. Adaptation reveals independent control networks for human walking. Nat. Neurosci. 2007. 10 (8): 1055–1062.
Collins J.J., Stewart I.N. Symmetry-breaking bifurcation: a possible mechanism for 2:1 frequency-locking in animal locomotion. J Math Biol. 1992. 30 (8): 827–838.
Forssberg H., Grillner S., Halbertsma J., Rossignol S. The locomotion of the low spinal cat. II. Interlimb coordination. Acta Physiol. Scand. 1980. 108 (3): 283–295.
Frigon A., Desrochers É., Thibaudier Y., Hurteau M-F., Dambreville C. Left–right coordination from simple to extreme conditions during split-belt locomotion in the chronic spinal adult cat. J. Physiol. 2017. 595 (1): 341–361.
Frigon A. The neural control of interlimb coordination during mammalian locomotion. J. Neurophysiol. 2017. 117 (6): 2224–2241.
Gerasimenko Y., Musienko P., Bogacheva I., Moshonkina T., Savochin A., Lavrov I., Roy R.R., Edgerton V.R. Propriospinal bypass of the serotonergic system that can facilitate stepping. J. Neurosci. 2009. 29 (17): 5681–5689.
Grillner S. Control of locomotion in bipeds, tetrapods, and fish. Handbook of Physiology. The Nervous System II. Ed. Brookhart M. American Physiology Society Bethesda: Rockville, MD, USA, 1981. 1179–1236 pp.
Grillner S. Biological pattern generation: The cellular and computational logic of networks in motion. Neuron. 2006. 52 (5): 751–766.
Gurfinkel V.S., Shik M.L. The control of posture and locomotion. Motor Control. Eds. Gydikov A.A., Tankov N.T., Kosarov D.S. Springer US, 1974. 217–234 pp.
Halbertsma J. The stride cycle of the cat: the modelling of locomotion by computerized analysis of automatic recordings. Acta Physiol. Scand. Suppl. 1983. 521: 1–76.
Harnie J., Audet J., Klishko A.N., Doelman A., Prilutsky B.I., Frigon A. The spinal control of backward locomotion. J. Neurosci. 2021. 41 (4): 630–647.
Kato M. Longitudinal myelotomy of lumbar spinal cord has little effect on coordinated locomotor activities of bilateral hindlimbs of the chronic cats. Neurosci Lett. 1988. 93: 259–263.
Kato M. Chronically isolated lumbar half spinal cord, produced by hemisection and longitudinal myelotomy, generates locomotor activities of the ipsilateral hindlimb of the cat. Neurosci Lett. 1989. 98: 149–153.
Kim S.A., Heinze K.G., Schwille P. Fluorescence correlation spectroscopy in living cells. Nat. Methods. 2007. 4 (11): 963–973.
Kling U., Székely G. Simulation of rhythmic nervous activities. Kybernetik. 1968. 5 (3): 89–103.
Kriellaars D.J., Brownstone R.M., Noga B.R., Jordan L.M. Mechanical entrainment of fictive locomotion in the decerebrate cat. J. Neurophysiol. 1994. 71 (6): 2074–2086.
Lafreniere-Roula M., McCrea D.A. Deletions of rhythmic motoneuron activity during fictive locomotion and scratch provide clues to the organization of the mammalian central pattern generator. J. Neurophysiol. 2005. 94 (2): 1120–1132.
Lam T., Pearson K.G. Proprioceptive modulation of hip flexor activity during the swing phase of locomotion in decerebrate cats. J. Neurophysiol. 2001. 86 (3): 1321–1332.
Lundberg A. Half-centres revisited. Regulatory Functions of the CNS. Principles of motion and Organization. Advances in physiological sciences. Eds. Szentagothai J., Palkovits M., Hamori J. Budapest: Pergamon 1981. 155–167 pp.
Lyakhovetskii V., Merkulyeva N., Gorskii O., Musienko P. Simultaneous bidirectional hindlimb locomotion in decerebrate cats. Sci. Rep. 2021. 11(1): 3252.
McCrea D.A., Rybak I.A. Organization of mammalian locomotor rhythm and pattern generation. Brain Res. Rev. 2008. 57 (1): 134–146.
Merkulyeva N., Lyakhovetskii V., Veshchitskii A., Gorskii O., Musienko P. Rostrocaudal distribution of the C-Fos-immunopositive spinal network defined by muscle activity during locomotion. Brain Sci. 2021. 11 (1): 69.
Merkulyeva N., Veshchitskii A., Gorsky O., Pavlova N., Zelenin P.V., Gerasimenko Y., Deliagina T.G., Musienko P. Distribution of spinal neuronal networks controlling forward and backward locomotion. J. Neurosci. 2018. 38 (20): 4695–4707.
Molkov Y.I., Bacak B.J., Talpalar A.E., Rybak I.A. Mechanisms of left-right coordination in mammalian locomotor pattern generation circuits: A mathematical modeling view. PLOS Comput. Biol. 2015. 11 (5): e1004270.
Musienko P., Brand R.V.D., Märzendorfer O., Roy R.R., Gerasimenko Y., Edgerton V.R., Courtine G. Controlling specific locomotor behaviors through multidimensional monoaminergic modulation of spinal circuitries. J. Neurosci. 2011. 31(25): 9264–9278.
Musienko P., Courtine G., Tibbs J.E., Kilimnik V., Savochin A., Garfinkel A., Roy R.R., Edgerton V.R., Gerasimenko Y. Somatosensory control of balance during locomotion in decerebrated cat. J. Neurophysiol. 2012. 107 (8): 2072–2082.
Pearson K.G., Fourtner C.R., Wong R.K. Nervous control of walking in the cockroach. Control of posture and locomotion. Advances in behavioral biology. Eds. Stein R.B., Pearson K.G., Smith R.S., Redford J.B. Springer US, 1973: 495–514.
Pearson K.G. Proprioceptive regulation of locomotion. Curr. Opin. Neurobiol. 1995. 5 (6): 786–791.
Pearson K.G. Role of sensory feedback in the control of stance duration in walking cats. Brain Res. Rev. 2008. 57 (1): 222–227.
Pearson K.G., Duysens J. Function of segmental reflexes in the control of stepping in cockroaches and cats. Neural control of locomotion. Advances in behavioral biology. Eds. Herman R.M., Grillner S., Stein P.S.G., Stuart D.G. Springer US, 1976. 519–537 pp.
Pratt C.A., Buford J.A., Smith J.L. Adaptive control for backward quadrupedal walking V. Mutable activation of bifunctional thigh muscles. J. Neurophysiol. 1996. 75 (2): 832–842.
Press W.H., Teukolsky S.A., Vetterling W.T., Flannery B.P. Statistical Description of Data. Numerical recipes in C++. The art of scientific computing. Third Edition. Eds. Press W.H., Teukolsky S.A., Vetterling W.T., Flannery B.P. Cambridge University Press. 2007. 1237 pp.
Rossignol S., Dubuc R., Gossard J-P. Dynamic sensorimotor interactions in locomotion. Physiol. Rev. 2006. 86 (1): 89–154.
Rybak I.A., Dougherty K.J., Shevtsova N.A. Organization of the mammalian locomotor CPG: Review of computational model and circuit architectures based on genetically identified spinal interneurons. eNeuro. 2015. 2 (5): 1–20.
Sherrington C.S. Flexion-reflex of the limb, crossed extension-reflex, and reflex stepping and standing. J. Physiol. 1910. 40 (1–2): 28–121.
Shik M.L., Orlovsky G.N. Neurophysiology of locomotor automatism. Physiol. Rev. 1976. 56 (3): 465–501.
Shkorbatova P.Y., Lyakhovetskii V.A., Merkulyeva N.S., Veshchitskii A.A., Bazhenova E.Y., Laurens J., Pavlova N.V., Musienko P.E. Prediction algorithm of the cat spinal segments lengths and positions in relation to the vertebrae. Anat. Rec. 2019. 302 (9): 1628–1637.
Smith J.L., Carlson-Kuhta P. Unexpected motor patterns for hindlimb muscles during slope walking in the cat. J. Neurophysiol. 1995. 74 (5): 2211–2215.
Stafford F.S., Barnwell G.M. Mathematical models of central pattern generators in locomotion. J. Mot. Behav. 1985. 17 (1): 3–26.
Yang Y-R., Yen J-G., Wang R-Y., Yen L-L., Lieu F-K. Gait outcomes after additional backward walking training in patients with stroke: a randomized controlled trial. Clin. Rehabil. 2005. 19 (3): 264–273.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


