Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 2, стр. 274-290
Влияние овариоэктомии на тревожно-депрессивное поведение самок крыс в норме и после раннего провоспалительного стресса
И. В. Павлова 1, *, Н. Д. Брошевицкая 1, М. И. Зайченко 1, Г. А. Григорьян 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: pavlovfml@mail.ru
Поступила в редакцию 10.11.2021
После доработки 30.11.2021
Принята к публикации 20.12.2021
- EDN: WEEYAL
- DOI: 10.31857/S0044467722020101
Аннотация
Исследовали роль женских половых гормонов, вырабатываемых яичниками, в возникновении половых особенностей в тревожно-депрессивном поведении крыс. У половины крысят в возрасте 3 и 5 дней создавали провоспалительный стресс путем введения бактериального липополисахарида в дозе 50 мкг/кг (группа ЛПС), другой половине крысят вводили физиологический раствор (группа ФИЗ, контроль). У половины самок в возрасте 35 дней проводили операцию двухсторонней овариоэктомии (ОЭ), у другой половины самок – операцию ложной овариоэктомии (ЛОЭ), не удаляя яичники. Поведение двух групп самок сопоставляли с поведением самцов в возрасте 75–100 дней. ОЭ способствовала увеличению веса самок, но не вызывала изменений в поведении в тестах на тревожность по сравнению с ЛОЭ самками. Овариоэктомия несколько сглаживала различия в уровне тревожности по сравнению с самцами. ОЭ приводила к депрессивно-подобному поведению, которое проявлялось только у животных ЛПС группы. ОЭ уменьшала различия по уровню кортикостерона между самцами и самками у животных ЛПС группы. ОЭ оказала наибольшее влияние на животных после раннего провоспалительного стресса.
Известно, что женщины чаще, чем мужчины, страдают депрессивными расстройствами (Albert, 2015). В основе этих расстройств лежат, в частности, нарушения работы гипоталамо-гипофизарно-надпочечникой системы и развитие нейровоспалительного процесса с микроглиальными, нейрохимическими, трофическими, синаптическими и другими изменениями (Jia et al., 2021; Troubat et al., 2021; Pitsillou et al., 2020; Григорьян, Гуляева, 2015; Stepanichev et al., 2014; Григорьян и др., 2014). Хотя женщины чаще страдают депрессией, чем мужчины, они более устойчивы к ней, т.е. имеют определенные защитные механизмы, противодействующие развитию депрессии. Это выявляется не только в эмпирических наблюдениях на людях, но и в большом числе модельных экспериментов на животных (Брошевицкая и др., 2020; Павлова и соавт., 2020; Fonken et al., 2018; Dalla et al., 2008).
Установлено, что у самцов и самок крыс иммунные/нейровоспалительные процессы в ответ на первую встречу организма со стрессом развиваются по-разному (Fonken et al., 2018). После первичного стресса, создаваемого путем нанесения неизбегаемых ударов током по хвосту, происходило увеличение чувствительности (primes) нейровоспалительного ответа, последующая иммунная активация (challenge) с помощью введения ЛПС вызывала больший нейровоспалительный ответ. При этом у самцов повышение чувствительности нейровоспаления происходило за счет активности микроглии, которая увеличивала выделение цитокинов ИЛ-1β и ИЛ-6, чего не наблюдали у самок.
Кроме того, у самок проявление тревожно-депрессивных расстройств находится под контролем стероидных половых гормонов, и прежде всего, эстрогенов, которые смягчают течение нейровоспалительного процесса (El-Khatib et al., 2020). В опытах на грызунах было показано, что двухстороннее удаление яичников (овариоэктомия, ОЭ) вызывает депрессивно-подобное поведение через развитие нейровоспалительного процесса и активацию иммунной системы (Eid et al., 2020; Khayum et al., 2020; Wu et al., 2020; Wang et al., 2016; Azizi-Malekabadi et al., 2015) подобно действию бактериального провоспалительного токсина, липополисахарида (ЛПС) (Azizi-Malekabadi et al., 2015; Iwasa et al., 2014a,b).
Многие авторы сообщали о проявлениях в результате операции ОЭ тревожного и/или депрессивно-подобного поведения. Однако все зависело от того, в каком возрасте проводили ОЭ, через какое время после нее выполняли поведенческие тесты, какие конкретно тесты проводили, на каких животных (мышах или крысах), как оценивали действие ОЭ, изолированно или в комбинации с хроническим непредсказуемым/вариабельным стрессом и т.д. (см. подробно в обзоре (Григорьян, 2022)). В большинстве работ операцию ОЭ проводили в молодом возрасте (2–3 мес) (Eid et al., 2020; Puga-Alguin et al., 2019; Schoenrock et al., 2016). Реже ее проводили в “пожилом” (18–20 мес) (Renczes et al. 2020; de Chaves et al., 2009) и в раннем препубертатном возрасте (4 нед) (Delevich et al., 2020; Boivin et al., 2017). ОЭ у крыс в зрелом (6 мес) и “пожилом” возрасте (18 мес) усиливала тревожное поведение в тесте приподнятого крестообразного лабиринта (ПКЛ) и вызывала депрессивно-подобное поведение в тесте вынужденного плавания (ТВП) по сравнению с контрольными самками того же возраста (de Chaves et al., 2009). Интересно, что ОЭ в 3 мес у крыс линии Вистар вызывала тревожное поведение в тесте ПКЛ, но не вызывала его в тесте ОП. Необходимо отметить, что практически во всех работах по исследованию влияния ОЭ на проявления тревожного и депрессивно-подобного поведения сопоставляли реакции ОЭ и ложнооперированных (контрольных) самок, не сравнивая их с интактными самцами. Между тем половые различия в проявлениях тревожного и депрессивно-подобного поведения у самцов и самок крыс зависят от важного вклада половых гормонов, и, прежде всего, эстрогенов, вырабатываемых в яичниках самок. Можно поэтому предположить, что “выключение” выработки и действия эстрогенов в результате операции ОЭ существенно изменит поведение оперированных самок и приблизит его к поведению интактных самцов.
Наконец, в ряде работ (Eid et al., 2020; Ge et al., 2020; Iqbal, Ma, 2020; Khayum et al., 2020; Iwasa et al., 2014a,b) наряду с исследованиями влияния на поведение только ОЭ, изучали также комбинированное действие ОЭ и разных типов хронического стресса. В последние годы широко используется модель раннего провоспалительного стресса, создаваемого путем введения бактериального липополисахарида крысятам в раннем онтогенезе. Совместное действие раннего провоспалительного стресса и ОЭ не изучено, однако можно предположить, что эффекты от этих двух воздействий будут суммироваться.
Целью настоящей работы было исследование влияния овариоэктомии на проявления тревожного и депрессивно-подобного поведения у самок крыс линии Вистар в норме и после раннего провоспалительного стресса. В связи со сказанным выше, были определены четыре основные задачи исследования. Во-первых, стояла задача удаления яичников в пубертатном возрасте (35 дней). Во-вторых, в задачи работы входило сопоставление поведения ОЭ и ложноовариоэктомированных (ЛОЭ) самок, а также сопоставление этих групп с поведением самцов с целью выявления половых различий в поведении в тестах на тревожность и депрессивно-подобное поведение. В-третьих, стояла задача сопоставить последствия овариоэктомии у животных в норме и после раннего провоспалительного стресса (введение ЛПС на 3-й и 5-й дни жизни). В-четвертых, проанализировать уровень кортикостерона и интерлейкина-1β в сыворотке крови у крыс разных групп.
МЕТОДИКА
Объект исследования. Опыты проводили на 130 самцах и самках крыс Вистар в возрасте от 2.5 до 3.5 мес. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU) и положения Института высшей нервной деятельности и нейрофизиологии РАН о работе с экспериментальными животными. Крысята были выведены в виварии ИВНД и НФ от родителей, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА, Россия. На рис. 1 представлена схема экспериментов. На 3-й и 5-й дни жизни у одной половины крысят из помета вызывали провоспалительный стресс путем введения бактериального липополисахарида (ЛПС) от Echerichia coli, серотип О26:В6 (Sigma) в дозе 50 мкг/кг в объеме 10 мкл/г (группа ЛПС, всего 63 крысенка). Во время этой процедуры крысят разлучали с матерью на 15–20 мин, взвешивали на электронных весах с точностью до 0.01 г и им подкожно в холку вводили ЛПС с помощью инсулинового шприца. Этих крысят дополнительно метили с помощью подкожного введения у основания хвоста 10 мкл черной краски, которая используется для татуировок. Другой половине крысят из помета в этом же возрасте подкожно вводили физиологический раствор в объеме 10 мкл/г (группа ФИЗ, контроль, всего 67 крысят). При разделении пометов старались уравнять в группах ЛПС и ФИЗ число самцов и самок. Разделение пометов делали с целью ослабить влияние генетического фактора и особенностей матери на результаты экспериментов. В возрасте 25 дней крысят отлучали от матери.
Рис. 1.
Схема экспериментов. ПНД – постнатальный день, ФИЗ/ЛПС – введение крысятам физиологического раствора или липополисахарида, кровь – забор крови для иммуноферментного анализа, ОП – тест открытого поля, ПКЛ – тест приподнятый крестообразный лабиринт, ТПС – тест предпочтения сахарозы, ТВП – тест вынужденного плавания.
Fig. 1. The scheme of experiments. ПНД – postnatal day, ФИЗ/ЛПС – injections of Saline or LPS, кровь – blood sampling for enzyme immunoassay analysis, ОП – the open field test, ПКЛ – the elevated plus maze, ТПС – the sucrose preference test, ТВП – the forced swimming test.
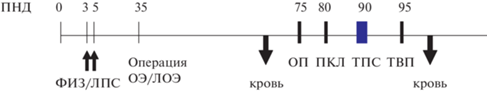
В возрасте 35 дней у 26 самок (13 из группы ЛПС, 13 из группы ФИЗ) проводили операцию двухсторонней овариоэктомии (ОЭ), у других 26 самок (13 из группы ЛПС, 13 из группы ФИЗ) операцию ложной овариоэктомии (ЛОЭ). Операции проводили под изофлурановым ингаляционным наркозом (Аэрран). При овариоэктомии делали разрез длиной 2 см по белой линии в нижней части живота, рассекая кожу, мышцы и брюшину, идентифицировали маточные трубы и яичники, перевязывали трубы на расстоянии 1 см от яичников, коагулировали сосуды, подходящие к яичникам, затем удаляли верхнюю часть труб и яичники. С помощью шовного материала последовательно зашивали брюшину, жировую клетчатку и кожу. Шов на коже дополнительно смазывали клеем БФ-6. При операции ложной овариоэктомии после идентификации маточных труб и яичников их соответственно не перевязывали и не удаляли. После операции крысам вводили антибиотик амоксициллин (0.3 мл) в/м и 2 мл глюкозы п/к в холку.
Были сформированы шесть экспериментальных групп животных: самцы группы ЛПС (n = 37), самцы группы ФИЗ (n = 41), самки группы ЛПС после овариоэктомии (ЛПС+ОЭ, n = 13), самки группы ЛПС после ложной овариоэктомии (ЛПС+ЛОЭ, n = 13), самки группы ФИЗ после овариоэктомии (ФИЗ+ОЭ, n = 13), самки группы ФИЗ после ложной овариоэктомии (ФИЗ+ЛОЭ, n = 13). Отдельно группу интактных самок не создавали, в настоящей статье проводится сопоставление с данными, полученными ранее на интактных самках (Павлова и соавт., 2020).
Тестирование уровня тревожности. Изучали поведение крыс в двух тестах на тревожность: в “открытом поле” (ОП) и в “приподнятом крестообразном лабиринте” (ПКЛ). Крыс тестировали в возрасте 75–90 дней (рис. 1). Перед первым тестированием на животных проводили 10–15-минутное приручение (хендлинг) в течение 3–4 дней. Использовали общепринятые размеры и конфигурации ПКЛ и ОП. Время наблюдения в каждом тесте 5 мин. Для фиксирования траектории движения крыс и элементов поведения использовали программу Etho Vision, а также видеорегистрацию. Анализировали показатели, отражающие тревожность/смелость крыс (время нахождения на периферии ОП, число и длительность выходов в центр ОП, число и длительность выходов в открытые рукава ПКЛ), двигательную активность крыс (пройденную дистанцию, скорость движения, время движения, число переходов между рукавами в ПКЛ), исследовательское поведение (стойки, выглядывания в открытые рукава в ПКЛ), поведение по оценке риска (свешивания в ПКЛ, вытягивания (stretch-attend postures)), элементы “смещенной активности” (число эпизодов и длительность груминга), а также ряд показателей, отражающих вегетативные реакции (число дефекаций и уринаций). При дальнейшей обработке для оценки тревожности в ПКЛ подсчитывали процент времени нахождения в открытых рукавах от общего времени нахождения в открытых и закрытых рукавах, а также процент заходов в открытые рукава от общего числа заходов в открытые и закрытые рукава. Всегда вначале тестировали крыс в ОП, а через 2–3 дня в ПКЛ. Перед помещением в камеру животного другого пола, кроме обычной влажной и сухой уборки, лабиринт протирали 10% раствором этилового спирта. Для переноски самцов и самок из вивария в экспериментальную комнату и для ожидания своей очереди использовали разные клетки. В виварии клетки с самками и самцами располагались на значительном расстоянии друг от друга.
Оценка депрессивно-подобного поведения. У крыс в возрасте 90–95 дней (рис. 1) проводили тест на ангедонию (предпочтение сахарозы) в течение одних суток. В клетку помещали 2 бутылки, одну с 1% раствором сахарозы, другую с водой. Через 12 ч от начала тестирования бутылки взвешивали и меняли местами. Определяли объем выпитого раствора сахарозы и воды за сутки каждой крысой, а также процент выпитой сахарозы от общего объема потребленной жидкости.
Тест вынужденного плавания проводили в возрасте 95–100 дней (рис. 1), для этих целей использовали цилиндры из оргстекла диаметром 20 см и высотой 50 см, которые заполняли водой температурой 25–26°С до уровня 30 см. Крыс помещали в воду на 5 мин. Фиксировали время пассивного плавания (зависания). При зависании в ходе плавания крысы осуществляли лишь слабые движения лапами и хвостом для коррекции положения тела около поверхности воды. Во время опыта проводили видеорегистрацию. При обработке данных подсчитывали время зависания крыс поминутно и суммарно за весь опыт.
Иммуноферментный анализ крови. Забор крови проводили у взрослых крыс за один день до начала тестирования и через 30–40 мин после теста вынужденного плавания (рис. 1). Для этого крыс наркотизировали с помощью изофлуранового ингаляционного наркоза (Аэрран), на кончике хвоста делали косые надрезы скальпелем и собирали периферическую кровь в объеме 0.7–1 мл в микропробирки, содержащие 10 мкл гепарина. Затем кровь центрифугировали 15 мин при 1500 g для получения сыворотки. Аликвоты сыворотки хранили при –80°С до проведения иммуноферментного анализа.
Для определения уровня кортикостерона в сыворотке крови использовали наборы для иммуноферментного анализа (DRG, Германия), с помощью которых детектировали как свободный, так и связанный с транспортными белками кортикостерон методом конкурентного иммуноферментного анализа. Содержание провоспалительного интерлейкина-1β (ИЛ-1β) в сыворотке крови определяли с помощью наборов производства R&D Systems (США) согласно инструкции производителя. При статистической обработке показателей уровня кортикостерона и ИЛ-1β из анализа исключали экстремумы.
Статистическая обработка результатов. Для статистической обработки результатов использовали стандартную программу STATISTICA 8.0. Распределение исследованных параметров было проверено на нормальность по критерию Колмогорова–Смирнова (Basic Statistics, раздел Descriptive Statistics). Если анализируемый параметр удовлетворял данному критерию, то при сравнении групп крыс использовали дисперсионный анализ ANOVA, раздел factorial ANOVA. При post-hoc анализе применяли критерий Newman–Keuls test. Различия считали статистически значимыми при р < 0.05, отмечали наличие тенденции при 0.05 ≤ р < 0.1. Во всех экспериментах анализировали влияние факторов ГРУППА (ЛПС или ФИЗ) и ПОЛ (условно выделяли три группы животных: самцы, ОЭ самки и ЛОЭ самки). В ТВП дополнительно анализировали фактор ВОЗДЕЙСТВИЕ (до и после теста). При отсутствии нормальности распределения поведенческих параметров использовали Kruskal–Wallis test, с последующим сравнением групп с помощью Multiple Comparisons (Nonparametric Statistics) и Mann–Whitney U test. Данные на рисунках представлены в виде средних значений ± ошибки средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
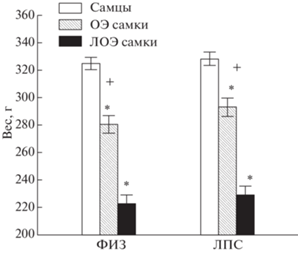
1. Влияние овариоэктомии на вес крыс. Вес тела у самок ОЭ группы в три месяца был больше (286.8 ± 4.6 г, р < 0.05), чем у самок ЛОЭ группы (226.0 ± 4.6 г), но меньше, чем вес самцов (326.6 ± 3.3 г) (Kruskal–Wallis test: H (2, n = 107) = 76.1, p = 0.000 (рис. 2). Различий в весе животных ФИЗ и ЛПС групп не было обнаружено. Таким образом, операция ОЭ приводила к увеличению веса тела и уменьшению половых различий по весу с самцами.
Рис. 2.
Влияние овариоэктомии на вес самок. ФИЗ – группа крыс с введением физиологического раствора в раннем онтогенезе, ЛПС – с введением липополисахарида. ОЭ – овариоэктомированные самки, ЛОЭ – ложноовариоэктомированные самки. * – различия (р < 0.05, Kruskal–Wallis test, Multiple comparison) между самцами и самками, + – различия между ОЭ и ЛОЭ самками.
Fig. 2. The influence of ovariectomy on the weight of females. ФИЗ – the Sal group, received the injections of saline at the early ontogenesis, ЛПС – the LPS group received the injections of lipopolysaccharide. ОЭ – OVX females, ЛОЭ – sham operated females. * – the difference (р < 0.05, Kruskal–Wallis test, Multiple comparison) between males and females, + – the differences between the OVX and Sham females groups.
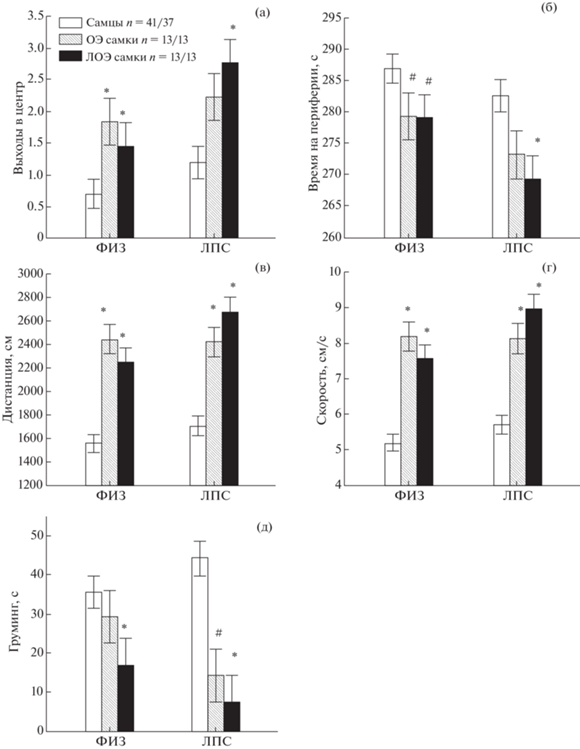
2. Влияние овариоэктомии на уровень тревожности крыс. Фактор ПОЛ оказывал существенное влияние на все показатели поведения в ОП, которые имели нормальное распределение (табл. 1), различия между группами крыс разного пола были так же обнаружены при анализе с помощью методов непараметрической статистики (табл. 2). Post-hoc анализ не выявил никаких статистически значимых отличий по всем показателям поведения между группами ОЭ и ЛОЭ самок, вместе с тем сопоставление самцов с самками ЛОЭ группы обнаружило больше различий, чем при сопоставлении с группой ОЭ. Так, самки ЛОЭ как в группе ФИЗ, так и ЛПС по сравнению с самцами больше (р < < 0.05) выходили в центр ОП (рис. 3 (а)), меньше времени проводили на периферии поля (рис. 3 (б)), для ФИЗ группы самок это проявлялось в виде тенденции), проходили большую дистанцию (рис. 3 (в)) и с большей скоростью (рис. 3 (г)), больше времени находились в движении, совершали больше поворотов, делали больше стоек, меньше времени занимались грумингом (рис. 3 (д)). ОЭ самки в отличие от ЛОЭ самок статистически значимо не различались с самцами в ЛПС группах по числу выходов в центр поля и по времени нахождения на периферии поля (рис. 3 (а), (б)). ОЭ самки также не различались с самцами в ФИЗ группе по длительности груминга (рис. 3 (д)).
Таблица 1.
Значения F и p при анализе с помощью Factorial ANOVA некоторых показателей поведения крыс в различных тестах Table 1. The values of F and p in the analysis using Factorial ANOVA of some indicators of rat behavior in various tests
| Тест | Показатели поведения | Факторы | ||
|---|---|---|---|---|
| ПОЛ | ГРУППА | ПОЛ × ГРУППА | ||
| ОП | Дистанция | F2, 124 = 44.8, p = 0.000 | – | – |
| Скорость | F2, 124 = 45.3, p = 0.000 | – | – | |
| Число поворотов | F2, 124 = 28.8, p = 0.000 | – | – | |
| ПКЛ | Дистанция | F2, 124 = 26.6, p = 0.000 | – | – |
| Скорость | F2, 124 = 26.6, p = 0.000 | – | – | |
| Время движения | F2, 124 = 12.6, p = 0.000 | – | – | |
| Стойки | F2, 124 = 26.7, p = 0.000 | – | – | |
| Длительность груминга | F2, 124 = 26.7, p = 0.000 | – | – | |
| Число поворотов | F2, 124 = 21.7, p = 0.000 | – | – | |
| % Т выходов в ОР | F2, 124 = 5.2, p = 0.007 | F1, 124 = 5.3, p = 0.022 | – | |
| ТПС | % сахарозы | F2, 69 = 3.5, p = 0.037 | – | F2, 69 = 5.6, p = 0.006 |
Таблица 2.
Сопоставление поведения крыс разного пола в тестах ОП, ПКЛ и ТВП с помощью Kruskal–Wallis ANOVA Table 2. Comparison of the behavior of rats of different sexes in open field, elevated plus maze and forced swimming test using Kruskal–Wallis ANOVA
| Тест | Показатели поведения | Группа ФИЗ | Группа ЛПС | |
|---|---|---|---|---|
| ОП | Выходы в центр | H(2, n = 67) = 11.57, p = 0.003 | H(2, n = 63) = 15.58, p = 0.000 | |
| Время на периферии | H(2, n = 67) = 8.00, p = 0.018 | H(2, n = 63) = 14.15, p = 0.001 | ||
| Груминг, с | – | H(2, n = 63) = 17.21, p = 0.000 | ||
| ПКЛ | Выглядывания | H(2, n = 67) = 15.23, p = 0.001 | H(2, n = 63) = 14.25, p = 0.001 | |
| Вытягивания | H(2, n = 67) = 31.94, p = 0.000 | H(2, n = 59) = 19.15, p = 0.000 | ||
| ТВП | Время зависания | 1 мин | – | – |
| 2 мин | H (2, n = 45) = 9.61, p = 0.008 | – | ||
| 3 мин | – | – | ||
| 4 мин | H(2, n = 45) = 5.64, p = 0.050 | H(2, n = 48)=11.06, p = 0.004 | ||
| 5 мин | – | H (2, n = 48) = 6.15 p = 0.046 | ||
Рис. 3.
Влияние овариоэктомии на некоторые показатели поведения крыс в открытом поле. n – число крыс в группе ФИЗ/ЛПС. * – различия между самцами и самками ((а), (б), (д) – р < 0.05, Kruskal–Wallis test, Multiple comparison, (в), (г) – р < 0.05, Factorial ANOVA, Post hoc анализ, Newman–Keuls test), # – тенденция (0.05 ≤ р < 0.1) к различиям между самцами и самками.
Fig. 3. The influence of ovariectomy on parameters of behavior in the open field. The designations are the same as in Fig. 1. n – a number of rats in groups Sal/LPS. * – the differences between males and females ((а), (б), (д) – р < < 0.05, Kruskal–Wallis test, Multiple comparison, (в), (г) – р < 0.05, Factorial ANOVA, Post hoc analysis, Newman–Keuls test), # – tendency (0.05 ≤ р < 0.1) in difference between males and females.
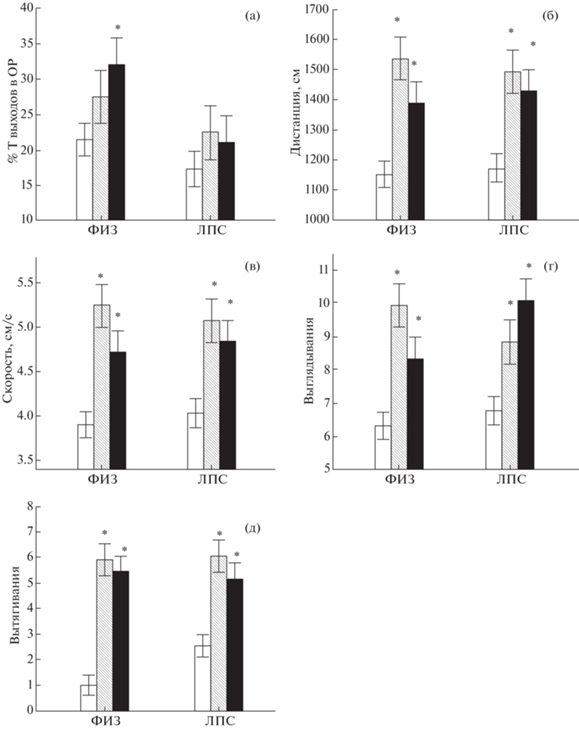
Фактор ПОЛ оказывал существенное влияние на поведение крыс в ПКЛ (табл. 1, 2), однако сопоставление различных параметров поведения с помощью post-hoc анализа не выявило различий между ОЭ и ЛОЭ самками. Сопоставление самцов с ЛОЭ самками выявило больше различий по параметрам, характеризующим уровень тревожности, чем у самцов с ОЭ самками. Так, например, в группе ФИЗ у самок ЛОЭ группы наблюдался больший (р < 0.05) процент времени нахождения в открытых рукавах, чем у самцов (рис. 4 (а)). Различий между самцами и ОЭ самками по этому параметру не наблюдалось. По другим показателям, характеризующим двигательную активность, исследовательское поведение, поведение по оценке риска, самки ОЭ группы отличались от самцов также, как и самки ЛОЭ группы (рис. 4 (б)–(д)). Например, у самок обеих групп по сравнению с самцами были больше пройденная дистанция (рис. 4 (б)), скорость движения (рис. 4 (в)), число переходов через центр, число поворотов, число стоек, выглядываний (рис. 4 (г)), вытягиваний (рис. 4 (д)), свешиваний.
Рис. 4.
Влияние овариоэктомии на некоторые показатели поведения крыс в приподнятом крестообразном лабиринте. * – различия между самцами и самками ((а), (б), (в) – р < 0.05, Factorial ANOVA, Post hoc анализ, Newman–Keuls test, (г), (д) – р < 0.05, Kruskal–Wallis test, Multiple comparison). Остальные обозначения как на рис. 2.
Fig. 4. The influence of ovariectomy on some parameters of behavior in the elevated plus maze. * – the differences between males and females ((а), (б), (в) – р < 0.05, Factorial ANOVA, Post hoc analysis, Newman–Keuls test, (г), (д) – р < 0.05, Kruskal–Wallis test, Multiple comparison). The rest designations are the same as in Fig. 2.
Фактор ГРУППА не оказывал значимого влияния на большинство показателей поведения в ОП и ПКЛ за исключением процента времени нахождения в открытых рукавах ПКЛ (табл. 1), у крыс ФИЗ группы значения данного показателя были больше, чем в ЛПС группе. Данные результаты подтверждают ранее полученные данные об уменьшении различий в поведении животных из ФИЗ и ЛПС групп во взрослом возрасте по сравнению с подростковым возрастом (Брошевицкая и соавт., 2020).
Таким образом, овариоэктомия не вызывала существенных изменений в уровне тревожности, двигательной активности и исследовательском поведении по сравнению с ЛОЭ самками. Вместе с тем овариоэктомия приводила к некоторому уменьшению половых различий в уровне тревожности между самками и самцами.
3. Влияние овариоэктомии на депрессивно-подобное поведение. В тесте на предпочтение сахарозы фактор ПОЛ оказывал влияние на процент выпитой сахарозы (табл. 1), также наблюдалось взаимодействие факторов ПОЛ × ГРУППА. Post-hoc анализ показал, что процент потребленного раствора сахарозы от общего объема выпитой жидкости был меньше (р < 0.05) у ОЭ самок в группе ЛПС, чем у самцов и ЛОЭ самок этой группы (рис. 5 (а)). В ФИЗ группе различий между самцами и самками не наблюдалось. Обнаруженные различия свидетельствуют о депрессивно-подобном поведении самок после овариоэктомии, переживших ранний провоспалительный стресс.
Рис. 5.
Влияние овариоэктомии на некоторые показатели поведения крыс в тестах на депрессивно-подобное поведение. (а) – тест на предпочтение сахарозы, (б) – тест вынужденного плавания. * – различия между самцами и самками ((а) – р < 0.05, Factorial ANOVA, Post hoc анализ, Newman–Keuls test, (б) – р < 0.05, Kruskal–Wallis test, Multiple comparison). Остальные обозначения как на рис. 2 и 3.
Fig. 5. The influence of ovariectomy on some parameters of depressive-like behavior. (а) – sucrose preference test, (б) – forced swimming test. * – the differences between males and females ((а) – р < 0.05, Factorial ANOVA, Post hoc analysis, Newman–Keuls test, (б) – р < 0.05, Kruskal–Wallis test, Multiple comparison). The rest designations are the same as in Fig. 2 and 3.
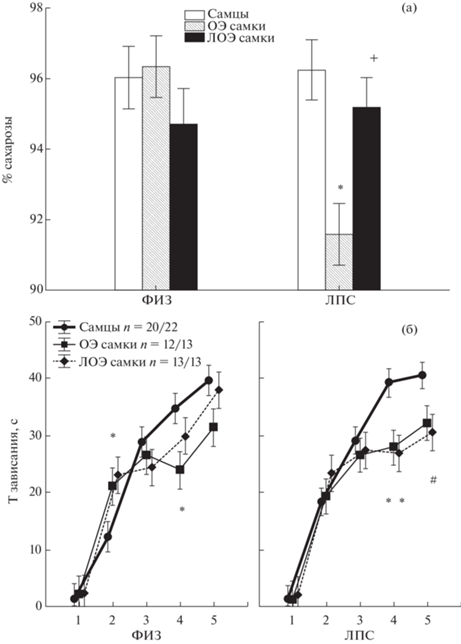
В тесте вынужденного плавания (рис. 5 (б)) как у ОЭ, так и ЛОЭ самок время зависания было меньше, чем у самцов на 4-й и 5-й минутах теста. Существенных различий по времени зависания между ОЭ и ЛОЭ самками обнаружено не было.
4. Влияние овариоэктомии на содержание кортикостерона и ИЛ-1 бета в сыворотке крови. При анализе уровня кортикостерона в плазме крови по всем значениям до и после ТВП было выявлено влияние фактора ПОЛ (F2, 102 = 13.6, p = 0.000), но не было обнаружено влияния фактора ГРУППА (F1, 102 = 3.07, p = 0.083) и ВОЗДЕЙСТВИЕ (F1, 102 = 0.86, p = = 0.355). Post hoc анализ показал, что во всех группах крыс как до, так и после теста вынужденного плавания у ЛОЭ самок уровень кортикостерона был выше, чем у самцов (рис. 6 (а)). У ОЭ самок уровень кортикостерона в ФИЗ группах также был выше, чем у самцов, однако в ЛПС группах уровень кортикостерона не отличался от наблюдаемого у самцов. Различия по уровню кортикостерона у самок ОЭ и ЛОЭ групп проявлялись только на уровне тенденции в ЛПС группе после теста вынужденного плавания.
Рис. 6.
Влияние овариоэктомии на уровень кортикостерона (а) и ИЛ-1β в сыворотке крови (б). * – различия между самцами и самками, # – тенденция. + – различие между ОЭ и ЛОЭ самками, ± – тенденция (Factorial ANOVA, Post hoc analysis, Newman–Keuls test).
Fig. 6. The influence of ovariectomy on the levels of corticosterone (а) and IL-1β in the blood serum (б). * – the differences between males and females, # – tendency. + – the differences between the OVX and Sham females groups, + – tendency. (Factorial ANOVA, Post hoc analysis, Newman–Keuls test).
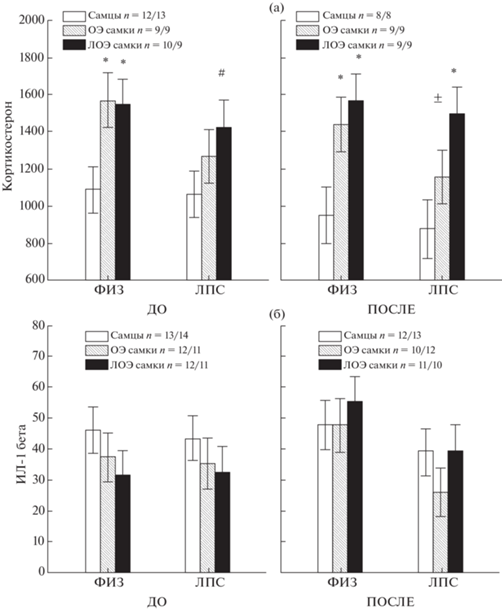
При анализе уровня ИЛ-1β по суммарным данным до и после ТВП не было обнаружено влияния фактора ПОЛ (F2, 129 = 0.88, p = 0.417), ГРУППА (F1, 129 = 3.29, p = 0.072) и ВОЗДЕЙСТВИЕ (F1, 129 = 1.10, p = 0.296). Отсутствие различий по уровню ИЛ-1β между всеми рассмотренными группами иллюстрирует рис. 6 (б). Таким образом, овариоэктомия уменьшала половые различия между самцами и самками по уровню кортикостерона.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
1. Влияние овариоэктомии на вес крыс. В наших опытах ОЭ в возрасте 35 дней вызывала существенное увеличение массы тела крыс по сравнению с ЛОЭ животными. В 3 мес вес ОЭ самок занимал промежуточное положение между весом самцов и ложнооперированных самок. Эти результаты полностью согласуются с данными литературы (Ge et al., 2020; Khayum et al., 2020; Iwasa et al., 2014 a,b; McElroy, Wade, 1987), которые свидетельствуют о тормозном влиянии эстрогенов на прирост массы тела самок. Дж. МкЭлрой и Г. Уэйд (McElroy, Wade, 1987) показали, что крысы с ОЭ в течение первых 5 нед после операции быстро набирают вес по сравнению с контрольными животными, но после этого потребление пищи у них нормализуется и вес стабилизируется, превышая на 12–16% вес контрольных животных. Авторы подробно проанализировали в разные интервалы времени (от 1 до 12 нед) структуру пищевого потребления у ОЭ крыс с участием жировой и не жировой диеты, воды и других компонентов питания, а также выявили роль бурой жировой ткани и метаболизма норадреналина в приросте массы тела (McElroy, Wade, 1987). Недавно К. Хайям и др. (Khayum et al., 2020) показали, что самки, получавшие эстрадиол с 1-го по 60-й день после ОЭ, в отличие от самок с ОЭ, но без введения эстрадиола, значительно отставали в прибавке массы тела, начиная с 10-го дня.
2. Влияние овариоэктомии на уровень тревожности крыс. В проведенных нами опытах самцы значительно превосходили ложнооперированных самок по уровню тревожности. Они меньше входили в центр ОП и в открытые рукава ПКЛ, и больше времени проводили на периферии ОП. У них была меньше двигательная и исследовательская активность, чем у ложнооперированных самок. Эти результаты по половым различиям в уровне тревожности совпадают с нашими ранее полученными данными (Павлова и соавт., 2020). Различия между ОЭ и ложнооперированными самками по всем исследованным показателям поведения не обнаружились. Но у ОЭ самок сглаживались различия с самцами по показателям выхода в центр ОП и по времени, проведенному на его периферии, а также по проценту выходов в открытые рукава ПКЛ. А. Пьюга-Олгвин и соавт. (Puga-Olguin et al., 2019), в отличие от наших данных, обнаружили тревожно-подобное поведение у ОЭ крыс спустя 3 нед после операции. Но, во-первых, операцию ОЭ они проводили в зрелом возрасте (3 мес), а мы в раннем пубертатном периоде (35 дней). Во-вторых, они сравнивали ОЭ группу не с ложнооперированными крысами, а с нормальными животными. В опытах на мышах линии C57Bl/6 было показано, что гонадоэктомия в препубертатном периоде существенно отличается по влиянию на тревожное поведение, чем гонадоэктомия в зрелом возрасте, причем эти влияния оказались прямо противоположными у самцов и самок (Delevich et al., 2020; Boivin et al., 2017). В частности, у самок ОЭ на 25-й день жизни приводила в возрасте 80–90 дней не к усилению (или отсутствию изменений, как в наших опытах), а к ослаблению тревожно-подобного поведения по сравнению с ложнооперированными животными. Это проявилось в увеличении у ОЭ самок времени пребывания в открытых рукавах ПКЛ и в центре ОП и в увеличении пройденного ими расстояния (Delevich et al., 2020). Авторы объясняли ослабление тревожного поведения не собственно анксиолитическим действием препубертатной овариоэктомии, а растормаживанием двигательной активности и исследовательского поведения в результате операции. В более ранней работе из той же лаборатории (Boivin et al., 2017) в опытах на мышах тестирование тревожно-подобного поведения в 40–47 дней в ПКЛ и ОП после овариоэктомии в препубертатном возрасте (24 дня) не обнаружило у ОЭ самок различий в уровне тревожности по сравнению с контрольными животными. В опытах на крысах линии Вистар-Киото, операция ОЭ в препубертатном периоде, как и в нашей работе, не влияла на уровень тревожно-подобного поведения, но это наблюдалось только у специально селектированных крыс с высоким уровнем двигательной активности (Raghavan et al., 2018). Рассогласование результатов по влиянию препубертатной и взрослой ОЭ может быть связано с возрастной разницей в действии половых гормонов (de Chaves et al., 2009). Имеются данные, согласно которым половые гормоны по-разному влияют на поведение в период полового созревания, в зрелом и “пожилом” возрасте (см. обзор Schulz et al., 2009).
Один из возможных механизмов влияния ОЭ на уровень тревожного поведения связывают с уменьшением плотности глутаматных рецепторов и снижением уровня ГАМК в гиппокампе (De Jesus-Burgos et al., 2012), а также c уменьшением мРНК экспрессии α2, α3, α4, β3, и γ1 субъединиц ГАМК А рецепторов в миндалине (Herbison, Fenelon, 1995). Предполагается, что в результате малой концентрации стероидных гормонов после удаления яичников происходит ослабление ГАМКэргической нейропередачи в гиппокампе и миндалине, что облегчает развитие тревожно-подобного поведения (Puga-Olguin et al., 2019). Определенный вклад в развитие тревожного поведения могут внести также особенности взаимодействия на мембранном уровне эстрогеновых рецепторов с mGlu1 в базолатеральной миндалине (De Jesus-Burgos et al., 2012).
Напомним, что при тестировании в открытом поле ранний провоспалительный стресс в комбинации с ОЭ в наших опытах сглаживал разницу по сравнению с самцами до несущественных различий. В литературе имеются неодназначные данные о совместном влиянии ОЭ и разных видов хронического стресса (Khalyghi et al., 2021; Ge et al., 2020; Khayum et al., 2020; Azizi-Malekabadi et al., 2015). В частности, М. Хайям и др. (Khayum et al., 2020) в опытах на крысах с ОЭ и хроническим умеренным стрессом (6 нед) не обнаружили различий в уровне тревожного поведения у 4-х групп животных, получавших эстрадиол, пласебо, хронический умеренный стресс + эстрадиол и хронический умеренный стресс + пласебо (Khayum et al., 2020). Наоборот, в работе (Azizi-Malekabadi et al., 2015) три группы крыс (ОЭ, с однократным введением ЛПС взрослым и ОЭ+ЛПС) значительно уступали контрольным животным по выходам в центр ОП, по времени пребывания в нем и пройденной дистанции, а также по выходам и времени пребывания в открытых рукавах ПКЛ. Совместное влияние ОЭ с хроническим непредсказуемым стрессом усиливало уровень тревожности по сравнению с контрольными животными, отдельно ОЭ не оказывала влияния (Ge et al., 2020).
3. Влияние овариоэктомии на депрессивно-подобное поведение. В тесте предпочтения сахарозы, оценивающего депрессивно-подобное поведение, ОЭ самки ЛПС группы, потребляли существенно меньше сладкого раствора, чем самцы и ЛОЭ самки, что свидетельствует о признаках депрессивно-подобного поведения при совместном влиянии ОЭ и раннего провоспалительного ЛПС стресса. В ТВП самцы достоверно больше времени находились в состоянии неподвижности, особенно на 4-й и 5-й минутах теста по сравнению с ОЭ и ЛОЭ самками, что совпадает с нашими ранее полученными данными (Павлова и соавт., 2020). ОЭ, сама по себе или в комбинации с ЛПС стрессом, не вызывала депрессивно-подобного поведения в ТВП, поскольку все группы животных зависали в неподвижности примерно одно и то же время. Таким образом, согласно нашим данным, депрессивно-подобный эффект ОЭ проявился в комбинации с ранним ЛПС стрессом только в тесте предпочтения сахарозы и не проявился в ТВП.
В большинстве работ было обнаружено влияние ОЭ у грызунов на депрессивно-подобное поведение (Ge et al., 2020; Eid et al., 2020; Khayum et al., 2020; Puga-Olguin et al., 2019; Schoerock et al., 2016; Wang et al., 2016; de Chaves et al., 2009). Но все зависело от уже рассмотренных выше факторов: возраста животного в момент проведения операции ОЭ, времени с момента ОЭ до начала тестирования, вида животного, типа используемого теста, изолированного или комбинированного с хроническим стрессом влияния ОЭ и т.д. В работе (Puga-Olguin et al., 2019) поведение крыс исследовали через 1, 3, 6, 9, 12 и 15 нед после ОЭ. Оказалось, что время “зависания” в неподвижности в ТВП было больше только у ОЭ групп, протестированных через 6, 12 и 15 нед после операции (Puga-Olguin et al., 2019). В других работах, напротив, как и в наших опытах, при интервалах в 3 и 12 нед после ОЭ (Estrada-Camarena et al., 2011) или в 4 мес (Fedotova et al., 2016) эффекты ОЭ на депрессивно-подобное поведение в ТВП не проявились. Добавление к ОЭ различных видов хронического стресса могло как усилить, так и не повлиять на последствия ОЭ. Так, например, в работе М. Хайяма и соавт. (Khayum et al., 2020) прибавление к ОЭ хронического умеренного стресса не усилило депрессивно-подобного поведения в ТВП, причем эффекты ОЭ проявились только спустя 2 мес после операции, но не через 2 нед после нее. В еще одной недавней работе (Eid et al., 2020) в ТВП и предпочтения сахарозы, ни одна из пяти групп (ОЭ, ЛОЭ, ОЭ + эстрадиол, ОЭ + агонист, ERβ, ОЭ + агонист ERα) в условиях хронического непредсказуемого стресса и без него, не показала различий в проявлениях депрессивно-подобного поведения. Наоборот, Ф. Ге и др. (Ge et al., 2020) показали, что в тесте предпочтения сахарозы меньше всего по сравнению с контрольными животными пили подслащенный раствор самки, перенесшие операцию ОЭ и хронический непредсказуемый стресс.
4. Влияние овариоэктомии на биохимические показатели сыворотки крови. В настоящих опытах наблюдались существенные различия по уровню кортикостерона в сыворотке крови между самцами и ЛОЭ самками, что совпадает с ранее полученными нами и другими авторами данными (Павлова и соавт., 2020; Aoki et al., 2010). У самок уровень кортикостерона был выше, чем у самцов, как до, так и после теста вынужденного плавания. Овариоэктомия приводила к уменьшению половых различий, но только в группе ЛПС. В случае с ранним провоспалительным стрессом уровень кортикостерона в сыворотке крови ОЭ самок до и после стресса вынужденного плавания не отличался от уровня у самцов. Согласно данным литературы, у самок грызунов овариоэктомия снижала секрецию кортикостерона и АКТГ в ответ на стресс, а введение эстрадиола возвращало секрецию этих гормонов к контрольному уровню (Weiser et al., 2009; Handa et al., 1994). Похожие результаты были получены в работе Ч. МкГормик (McGormick, 2011). В ее опытах самки с ОЭ на 1-й постнатальный день или в зрелом возрасте имели более низкую концентрацию кортикостерона после принудительного стресса, чем ложнооперированные самки. Г. Валлетт и др. (Vallette et al., 1982) показали, что овариоэктомия в раннем возрасте (5–15 дней) приводит к постепенному уменьшению концентрации кортикостерона в крови с максимумом эффекта через 6 дней или позже. Функция эстрогеновых α-рецепторов может заключаться в торможении обратной отрицательной глюкокортикоидной связи с помощью ГАМК-ергических нейронов, расположенных около паравентрикулярного ядра гипоталамуса, и таким образом поддержании высокого тонуса ГГНС (Григорьян, обзор 2022). По другим данным, однако, ОЭ приводила к увеличению уровня кортикостерона в сыворотке крови (Khaleghi et al., 2021; Iqbal, Ma, 2020).
Овариоэктомия в наших опытах не сказалась на уровне ИЛ-1β в сыворотке крови. Это могло быть связано с тем, что вынужденное плавание не явилось сильным стрессором для ОЭ крыс, поскольку мы использовали модифицированный вариант ТВП продолжительностью всего 5 мин и только в один день. Другой причиной могло быть то, что провоспалительный липополисахаридный стресс в наших опытах был применен в раннем постнатальном периоде (3–5-й дни). Ранее при определении концентрации цитокинов ИЛ-1β и ИЛ-10 в сыворотке крови у ОЭ крыс на 3, 6, 9 и 13-й дни после операции было обнаружено увеличение концентрации обоих цитокинов, но в разные промежутки времени после операции – ИЛ-1β – во все дни, а ИЛ-10 – только после 9-го дня (Percegoni et al., 2009). Эти данные не согласуются с нашими результатами возможно потому, что в наших опытах кровь на содержание ИЛ-1β исследовали спустя два месяца после ОЭ, а не через 1–13 дней, как в опытах (Percegoni et al., 2009). В ряде работ было обнаружено увеличение провоспалительных цитокинов после ОЭ в различных структурах мозга. Так, например, Р. Даниелс (Daniels et al., 2018) обнаружила у ОЭ крыс усиление мРНК экспрессии провоспалительных цитокинов ИЛ-1β, TNF-a и ИЛ-6 в гиппокампе и усиление экспрессии ИЛ-1β и TNF-a в изолированных клетках микроглии. Однако это происходило только в том случае, если после ОЭ создавали дополнительный провоспалительный стресс введением ЛПС взрослым животным. Если ЛПС не вводили, стресс от ОЭ был недостаточным для получения разницы в уровне цитокинов у ОЭ и контрольных животных. По другим данным ОЭ так же приводила к увеличению уровней цитокинов ИЛ-1β и ИЛ-18 в гиппокампе (Wang et al., 2016), и ИЛ-1β, TNF-α, ИЛ-6 в гипоталамусе (Iwasa et al., 2014 a,b), а также к росту числа активированных микроглиальных клеток в префронтальной коре (Ge et al., 2020). В последней работе прибавление к ОЭ хронического непредсказуемого стресса в течение 6 нед усиливало активность провоспалительных и проокислительных молекул (ИЛ-1β, ИЛ-6, TNF-α, iNOS, и CX3CR1) и уменьшало активность противовоспалительного фактора Arg1 и фактора CD200, отрицательно регулирующего микроглиальные клетки (Ge et al., 2020). Уровень цитокинов существенно зависел от дополнительного иммобилизационного стресса, добавленного к ОЭ (Park et al., 2020). Было обнаружено разнонаправленное изменение цитокинов ИЛ-1β и ИЛ-4 у крыс с ОЭ, получавших иммобилизационный стресс, по сравнению с ОЭ крысами, не получавшими стресс, и с крысами, получавшими стресс, но без операции ОЭ. Оказалось, что уровень цитокина ИЛ-1β при совместном стрессе (ОЭ + + иммобилизация) существенно возрастал в паравентрикулярном ядре гипоталамуса и в области моторного ядра тройничного нерва по сравнению с одиночным стрессом (ОЭ или иммобилизация), а интерлейкин ИЛ-4 претерпевал при отмеченных формах стресса прямо противоположные изменения (Park et al., 2020).
ВЫВОДЫ
1. Овариоэктомия в возрасте 35 дней приводила к увеличению массы тела крыс по сравнению с ложнооперированными животными. В 3 мес вес ОЭ самок занимал промежуточное положение между весом самцов и ложнооперированных самок.
2. В тестах на тревожность (в открытом поле и приподнятом крестообразном лабиринте) не было обнаружено различий между ОЭ и ложнооперированными самками по всем исследованным показателям, оценивающим уровень тревожности, двигательное и исследовательское поведение. Однако у ОЭ самок, в отличие от ЛОЭ самок, не было различий по сравнению с самцами по показателям, оценивающим тревожность (выходы в центр ОП, время, проведенное на его периферии, а также процент времени выходов в открытые рукава ПКЛ).
3. В тесте предпочтения сахарозы, оценивающем депрессивно-подобное поведение, ОЭ самки ЛПС группы потребляли существенно меньше раствора сахарозы, чем самцы и ложнооперированные животные, что свидетельствует о депрессивно-подобном характере влияния совместных эффектов ОЭ и раннего провоспалительного ЛПС стресса. В тесте вынужденного плавания ОЭ сама по себе или в комбинации с ЛПС стрессом не вызывала увеличения времени зависания по сравнению с ложнооперированными самками.
4. ОЭ в комбинации с ранним провоспалительным стрессом приводила к уменьшению различий по уровню кортикостерона в сыворотке крови по сравнению с самцами, в контрольных ФИЗ группах у ОЭ или ЛОЭ самок уровень кортикостерона был выше, чем у самцов. По уровню ИЛ-1β различий между группами крыс не наблюдалось.
5. Впервые показано, что, судя по поведению крыс и биохимическим показателям крови, животные после раннего провоспалительного стресса наиболее подвержены влиянию овариоэктомии.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 19-015-00129A).
Список литературы
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Груздева В.А., Григорьян Г.А. Влияние раннего провоспалительного стресса на тревожное и депрессивно-подобное поведение крыс разного возраста. Рос. физиол. журн. им. И.М. Сеченова. 2020.106 (6): 823–842.
Григорьян Г.А. Овариоэктомия как модель тревожно-депрессивных расстройств. Нейрохимия. 2022. Т. 39. № 1.
Григорьян Г.А., Гуляева Н.В. Моделирование депрессии на животных: поведение как основа методологии, критериев оценки и классификации Журнал высшей нервной деятельности им. И.П. Павлова. 2015. 65 (6): 643–660.
Григорьян Г.А., Дыгало Н.Н., Гехт А.Б., Степаничев М.Ю., Гуляева Н.В. Молекулярно-клеточные механизмы депрессии. Роль глюкокортикоидов, цитокинов и нейротрофических факторов в генезе депрессивных расстройств. Успехи физ. наук. 2014. 44 (2): 3–20.
Павлова И.В., Брошевицкая Н.Д., Онуфриев М.В., Моисеева Ю.В. Половые различия в тревожности и оборонительном поведении крыс Вистар. Журнал высшей нервной деятельности им. И.П. Павлова. 2020. 70 (2): 243–258.
Aoki M., Shimozuru M., Kikusui T., Takeuchi Y., Mori Y. Sex differences in behavioral and corticosterone responses to mild stressors in ICR mice are altered by ovariectomy in peripubertal period. Zoolog. Sci. 2010. 27 (10): 783–789.
Albert P.R. Why is depression more prevalent in women? J. Psychiatry Neurosci. 2015. 40 (4): 219–221.
Azizi-Malekabadi H., Hosseini M., Pourganji M., Zabihi H., Saeedjalali M., Anaeigoudari A. Deletion of ovarian hormones induces a sickness behavior in rats comparable to the effect of lipopolysaccharide. Neurol. Res. Int. 2015.627642.
Boivin J.R., Piekarski D.J., Wahlberg J.K., Wilbrecht L. Age, sex, and gonadal hormones differently influence anxiety- and depression-related behavior during puberty in mice. Psychoneuroendocrinology. 2017. 85: 78–87.
Daniels R. Ovariectomy in female rats increases pro-inflammatory cytokine expression in whole hippocampal tissue and isolated microglia. PhD thesis. Department of Psychology and Neuroscience, University of Colorado Boulder. April 9. 2018.
de Chaves G., Moretti M., Castro A.A., Dagostin W., da Silva G.G., Boeck C.R., Quevedo J., Gavioli E.C. Effects of long-term ovariectomy on anxiety and behavioral despair in rats. Physiol. Behav. 2009. 97 (3–4): 420–425.
Dalla C., Edgecomb C., Whetstone A.S., Shors T.J. Females do not express learned helplessness like males do. Neuropsychopharm.2008. 33(7): 1559–1569.
Delevich K., Hall C.D., Piekarski D., Zhang Y., Wilbrecht L. Prepubertal gonadectomy reveals sex differences in approach-avoidance behavior in adult mice. Horm. Behav. 2020. 118: 104641.
De Jesús-Burgos M., Torres-Llenza V., Pérez-Acevedo N.L. Activation of amygdalar metabotropic glutamate receptors modulates anxiety, and risk assessment behaviors in ovariectomized estradiol-treated female rats. Pharmacol. Biochem. Behav. 2012. 101(3): 369–378.
Eid R.S., Lieblich S.E., Duarte-Guterman P., Chaiton J.A., Mah A.G., Wong S.J., Wen Y., Galea L.A.M. Selective activation of estrogen receptors alpha and beta: Implications for depressive-like phenotypes in female mice exposed to chronic unpredictable stress. Horm. Behav. 2020. 119: 104651.
El-Khatib Y.A., Sayed R.H., Sallam N.A., Zaki H.F., Khattab M.M. 17β-Estradiol augments the neuroprotective effect of agomelatine in depressive- and anxiety-like behaviors in ovariectomized rats. Psychopharmacology (Berl). 2020. 237 (9): 2873–2886.
Estrada-Camarena E., López-Rubalcava C., Hernández-Aragón A., Mejía-Mauries S., Picazo O. Long-term ovariectomy modulates the antidepressant-like action of estrogens, but not of antidepressants. J Psychopharmacol. 2011. 25 (10): 1365–1377.
Fedotova J., Dudnichenko T., Kruzliak P., Puchavskaya Z. Different effects of vitamin D hormone treatment on depression-like behavior in the adult ovariectomized female rats. Biomed. Pharmacother. 2016. 84: 1865–1872.
Fonken L.K., Frank M.G., Gaudet A.D., D’Angelo H.M., Daut R.A., Hampson E.C., Ayala M.T., Watkins L.R., Maier S.F. Neuroinflammatory priming to stress is differentially regulated in male and female rats. Brain Behav. Immun. 2018. 70: 257–267.
Ge F., Yang H., Lu W., Shi H., Chen Q., Luo Y., Liu L., Yan J. Ovariectomy induces microglial cell activation and inflammatory response in rat prefrontal cortices to accelerate the chronic unpredictable stress-mediated anxiety and depression. Biomed. Res. Int. 2020. 2020: 3609758.
Handa R.J., Burgess L.H., Kerr J.E., O’Keefe J.A. Gonadal steroid hormone receptors and sex differences in the hypothalamo-pituitary-adrenal axis. Horm. Behav. 1994. 28. (4): 464–476.
Herbison A.E., Fénelon V.S. Estrogen regulation of GABAA receptor subunit mRNA expression in preoptic area and bed nucleus of the stria terminalis of female rat brain. J. Neurosci. 1995. 15 (3 Pt 2): 2328–2337.
Jia X., Gao Z., Hu H. Microglia in depression: current perspectives. Sci.China Life Sci. 2021. 64 (6): 911–925.
Iqbal J., Ma X.M. Impact of subchronic variable stress on ovariectomy and dendritic spine density in prefrontal cortex in mice. Neuroreport. 2020. 31 (3): 213–219.
Iwasa T., Matsuzaki T., Tungalagsuvd A., Munkhzaya M., Kawami T., Kato T., Kuwahara A., Yasui T., Irahara M. Effects of ovariectomy on the inflammatory responses of female rats to the central injection of lipopolysaccharide. J. Neuroimmunol. 2014a. 277 (1–2): 50–56.
Iwasa T., Matsuzaki T., Kinouchi R., Gereltsetseg G., Murakami M., Munkhzaya M., Altankhuu T., Kuwahara A., Yasui T., Irahara M. Changes in central and peripheral inflammatory responses to lipopolysaccharide in ovariectomized female rats. Cytokine. 2014b. 65 (1): 65–73.
Khaleghi M., Rajizadeh M.A., Bashiri H., Kohlmeier K.A., Mohammadi F., Khaksari M., Shabani M. Estrogen attenuates physical and psychological stress-induced cognitive impairments in ovariectomized rats. Brain Behav. 2021. 11 (5): e02139.
Khayum M.A., Moraga-Amaro R., Buwalda B., Koole M., den Boer J.A., Dierckx R.A.J.O., Doorduin J., de Vries E.F. Ovariectomy-induced depressive-like behavior and brain glucose metabolism changes in female rats are not affected by chronic mild stress. J. Psychoneuroendocrinology. 2020. 115: 104610.
McElroy J.F., Wade G.N. Short- and long-term effects of ovariectomy on food intake, body weight, carcass composition, and brown adipose tissue in rats. Physiol. Behav. 1987. 39 (3): 361–365.
McCormick C.M. Effect of neonatal ovariectomy and estradiol treatment on corticosterone release in response to stress in the adult female rat. Stress. 2011. 14 (1): 82–87.
Park H.J., Shim H.S., Shim I. The Differential role of cytokines on stress responses in a menopause rat model. Front. Psychiatry. 2020. 11: 577561.
Percegoni N., Ferreira A.C., Rodrigues C.F., Rosenthal D., Castelo Branco M.T., Rumjanek V.M., Carvalho D.P. Profile of serum IL-1beta and IL-10 shortly after ovariectomy and estradiol replacement in rats. Horm. Metab. Res. 2009. 41 (1): 50–54.
Pitsillou E., Bresnehan S.M., Kagarakis E.A., Wijoyo S.J., Liang J., Hung A., Karagiannis T.C. The cellular and molecular basis of major depressive disorder: towards a unified model for understanding clinical depression. Mol. Biol. Rep. 2020. 47 (1): 753–770.
Puga-Olguín A., Rodríguez-Landa J.F., Rovirosa-Hernández M.J., Germán-Ponciano L.J., Caba M., Meza E., Guillén-Ruiz G., Olmos-Vázquez O.J. Long-term ovariectomy increases anxiety- and despair-like behaviors associated with lower Fos immunoreactivity in the lateral septal nucleus in rats. Behav. Brain Res. 2019. 360: 185–195.
Raghavan N.S., Chen H., Schipma M., Luo W., Chung S., Wang L., Redei E.E. Prepubertal ovariectomy exaggerates adult affective behaviors and alters the hippocampal transcriptome in a genetic rat model of depression. Front. Endocrinol. (Lausanne). 2018. 8: 373.
Renczés E., Borbélyová V., Steinhardt M., Höpfner T., Stehle T., Ostatníková D., Celec P. The Role of Estrogen in Anxiety-Like Behavior and Memory of Middle-Aged Female Rats. Front. Endocrinol. (Lausanne). 2020. 11: 570560.
Schoenrock S.A., Oreper D., Young N., Ervin R.B., Bogue M.A., Valdar W., Tarantino L.M. Ovariectomy results in inbred strain-specific increases in anxiety-like behavior in mice. Physiol. Behav. 2016. 167: 404–412.
Schulz K.M., Molenda-Figueira H.A., Sisk C.L. Back to the future: The organizational-activational hypothesis adapted to puberty and adolescence. Horm. Behav. 2009. 55 (5): 597–604.
Stepanichev M.Yu., Dygalo N.N., Grigoryan G.A., Shishkina G., Gulyaeva N.V. Rodents model of depression: neurotrophic and neuroinflammatory biomarkers. BioMed. Research International. 2014. 1–20 (ID932757).
Troubat R., Barone P., Leman S., Desmidt T., Cressant A., Atanasova B., Brizard B., El Hage W., Surget A., Belzung C., Camus V. Neuroinflammation and depression: A review. Eur. J. Neurosci. 2021. 53 (1): 151–171.
Vallette G., Delorme J., Benassayag C., Savu L., Nunez E.A., Meijs-Roelofs H.M., Kramer P. Developmental patterns of levels of corticosterone and of corticosterone binding in the serum of female rats: effects of ovariectomy and adrenalectomy. Acta Endocrinol. (Copenh). 1982. 101 (3): 442–451.
Villa A., Vegeto E., Poletti A., Maggi A. Estrogens, neuroinflammation, and neurodegeneration. Endocrin.Rev. 2016. 37 (4): 372–402.
Wang Y., Xu Y., Sheng H., Ni X., Lu J. Exercise amelioration of depression-like behavior in OVX mice is associated with suppression of NLRP3 inflammasome activation in hippocampus. Behav. Brain Res. 2016. 307: 18–24.
Weiser M.J., Wu T.J., Handa R.J. Estrogen receptor-beta agonist diarylpropionitrile: biological activities of R- and S-enantiomers on behavior and hormonal response to stress. Endocrinology. 2009. V. 150. P. 1817–1825.
Wu B., Song Q., Zhang Y., Wang C., Yang M., Zhang J., Han W., Jiang P. Antidepressant activity of ω-3 polyunsaturated fatty acids in ovariectomized rats: role of neuroinflammation and microglial polarization. Lipids Health Dis. 2020. 19 (1): 4.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


