Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 2, стр. 217-226
Реактивность сенсомоторных ритмов ЭЭГ при наблюдении за про- и антисоциальными действиями у детей в раннем возрасте
А. А. Михайлова 1, Л. С. Орехова 1, С. А. Махин 1, В. Б. Павленко 1, *
1 Крымский федеральный университет им. В.И. Вернадского
Симферополь, Россия
* E-mail: vpav55@gmail.com
Поступила в редакцию 05.10.2021
После доработки 24.10.2021
Принята к публикации 20.12.2021
- EDN: BJEPWB
- DOI: 10.31857/S0044467722020095
Аннотация
Нравственное развитие необходимо для успешной социализации личности. В формировании просоциального морального поведения у детей важную роль играет система зеркальных нейронов, активность которой проявляется в изменениях паттерна сенсомоторных ритмов ЭЭГ. Цель работы: выявить особенности реактивности ЭЭГ при наблюдении за нейтральными, про- и антисоциальными действиями у детей раннего возраста с разным уровнем выраженности моральных оценок. В исследовании принял участие 51 ребенок в возрасте от 17 до 42 мес. Для определения выраженности моральных оценок использовали игровую методику с предъявлением нейтральных, просоциальных и антисоциальных ситуаций. При первом предъявлении действий нейтрального персонажа, которые не сопровождались каким-либо морально нагруженным контекстом, в группе детей с низким уровнем моральных оценок амплитуда мю- и бета-ритма оказалась значимо ниже, чем у детей с высокими значениями данного показателя. При наблюдении за положительным социальным действием у детей с высоким уровнем моральных оценок наблюдалась десинхронизация сенсомоторного бета-ритма, а у детей с низким уровнем моральных оценок – синхронизация. Данные различия достигали уровня статистической значимости в отведениях Fz и C4. Наблюдение за антисоциальным действием не вызывало значимых изменений сенсомоторных ритмов ЭЭГ у детей обеих групп. Выдвинуто предположение, что реактивность сенсомоторных ритмов ЭЭГ у ребенка в значительной степени связана с уровнем сформированности моральных оценок и возможностью отождествления себя с персонажем, совершающим социально значимые действия.
ВВЕДЕНИЕ
Моральное поведение лежит в основе оптимальных отношений индивида с окружающими, возможности занять достойное место в обществе. Без становления адекватных моральных качеств дети подвержены риску развития в дальнейшей жизни антисоциального поведения (вплоть до совершения преступлений с применением насилия), нарушений привязанности к близким, проявлений патологических особенностей в развитии психики (Termini et al., 2009). Моральность включает в себя когнитивную составляющую, эмоциональные переживания и систему ценностей человека. Ранний возраст является критическим для развития способностей ребенка к социальному взаимодействию и к эмпатии – способности на чувственном уровне понимать и сопереживать эмоциям и состояниям других людей (DiGirolamo et al., 2020; D’Errico et al., 2020). Моральное развитие можно описать как формирование понимания и эмоционального отношения к окружающим людям и к моральным принципам в течение всей жизни. Понимание моральных принципов может меняться в зависимости от возраста человека и пережитых им событий (Malti et al., 2015).
Становление морального поведения происходит с первых лет жизни, а степень его выраженности можно оценить на основе объективных проявлений моральных оценок ребенка по отношению к определенным действиям в экспериментальных ситуациях. Как правило, у детей раннего возраста способность к моральным оценкам определяют с использованием игровых методов, в которых между “добрым” и “злым” персонажами необходимо распределить ограниченное количество вознаграждения (например, сладости, игрушки и т.д.) (Sampaio et al., 2015). Считают, что такое моральное поведение обеспечивается интеграцией когнитивных и эмоциональных процессов (Reese et al., 2015). В процессе принятия морального решения важную роль играют нейронные сети целого ряда структур головного мозга: верхней височной борозды, нижней теменной дольки, верхней лобной извилины и дорсолатеральной префронтальной коры (Gillett et al., 2016).
Моральное поведение реализуется благодаря эмпатическим переживаниям (Hur, 2020). Предполагается, что биологической основой эмпатии является система зеркальных нейронов (СЗН), которая имеет реципрокные связи с целым рядом структур мозга, отвечающих как за когнитивную обработку информации, так и за переживание соответствующих наблюдаемой ситуации эмоций (Schunke et al., 2016). Система зеркальных нейронов отвечает за подражание и понимание намерений и чувств других людей (Лебедева и др., 2018; DiGirolamo et al., 2020). Одними из методов изучения активности СЗН у детей являются регистрация и анализ электроэнцефалограммы (ЭЭГ). Маркером активации СЗН считают десинхронизацию сенсомоторных мю- и бета-ритмов ЭЭГ (Muthukumaraswamy et al., 2008; Fox et al., 2016; Kaida et al., 2020). Исследования показали, что десинхронизация сенсомоторных ритмов (СМР) как при выполнении целенаправленных действий, так и при наблюдении за ними, проявляется у детей уже с девяти месяцев жизни (Debnath et al., 2019). Результаты некоторых исследований (Riecansky et al., 2015) позволяют заключить, что реактивность СМР ЭЭГ может быть связана не только с процессами подражания наблюдаемым действиям, но и с сопереживанием эмоциональным реакциям других людей. Можно предположить, что индивидуальные особенности реакций СМР, отражающих активность СЗН, уже на ранних этапах онтогенеза могут быть связаны с уровнем развития эмпатии и морального поведения.
Существуют лишь единичные исследования, рассматривающие взаимосвязь между характеристиками ЭЭГ и выраженностью моральных оценок у детей (Cowell et al., 2015), при этом специфика реакций СМР у детей с разной выраженностью морального поведения остается неизученной. В связи с этим целью настоящего исследования явилось изучение особенностей реактивности СМР ЭЭГ при наблюдении за морально значимыми ситуациями у детей раннего возраста с разным уровнем показателя моральных оценок.
МЕТОДИКА
В исследовании принял участие 51 ребенок (17 мальчиков и 34 девочки) в возрасте от 17 до 42 мес. Средний возраст детей составил 32.0 ± 0.93 мес. В выборку не включали детей с массой тела при рождении менее 2.5 кг, с наличием генетических заболеваний, с заболеваниями ЦНС, а также левшей (с очевидным преобладанием левой руки при манипуляциях с предметами и при рисовании). Родители детей давали письменное согласие на участие ребенка в эксперименте, с процедурой которого они были заранее ознакомлены. Исследование одобрено этическим комитетом Крымского федерального университета им. В.И. Вернадского (№ 12 от 14 июня 2016 г.). Получено информированное согласие от родителей на участие детей в эксперименте.
Определение уровня моральных оценок. Для измерения моральных оценок у детей раннего возраста использовалась методика B. Kenward и M. Dahl (Kenward et al., 2011) с изменениями (Orekhova et al., 2020). Поскольку существует предположение, что СЗН в большей степени активируется при “живом” социальном контакте (Лебедева и соавт., 2020), в настоящем исследовании демонстрация экспериментальных ситуаций проводилась не с использованием видеороликов, а лично экспериментатором. Перед детьми разыгрывались две сценки с участием трех кукол: “нейтральной”, “доброй” и “злой”. Куклы отличались по цвету: “нейтральная” – голубая, “добрая” и “злая” – оранжевая или зеленая (цвет доброй и злой кукол в разных опытах чередовали). Обе сценки начинались с того, что “нейтральная” кукла поднималась по лестнице, но в какой-то момент начинала испытывать затруднения (экспериментатор произносил фразу: “Ой, я так устала! Кто бы мне помог подняться?”). В первой сценке “добрая” кукла помогала подняться “нейтральной”. Вторая сценка характеризуется тем, что “злая” кукла причиняла боль “нейтральной” (сталкивала ее с лестницы, и “нейтральная” кукла “говорила”: “Ой, мне так больно стало!”). После этого ребенку демонстрировали “добрую” и “злую” кукол, поведение которых необходимо было оценить раздачей пяти “печений”, сделанных из картона. Оценивали уровень выраженности моральных оценок в зависимости от того, как много ресурсов (печений, сделанных из картона) ребенок отдавал “доброй” или “злой” кукле, или оставлял себе.
Производился расчет индекса моральных оценок (ИМО), значения которого варьировали от 1 до 20 баллов. Например, ребенку присваивался 1 балл, если он дал все пять печений “злой” кукле и ничего не дал “доброй”; 20 баллов, если он дал пять печений “доброй” кукле и ничего – “злой”. Подробности данной методики описаны раннее (Orekhova et al., 2020).
Регистрация и анализ ЭЭГ. Запись ЭЭГ проводили во время теста на определение уровня моральных оценок. Таким образом, ЭЭГ регистрировалась в следующих ситуациях:
1. “Нейтральный персонаж, сценка 1” – наблюдение нейтрального действия (“нейтральная” кукла поднимается по лестнице).
2. “Наблюдение за просоциальным действием” – ребенок наблюдает, как “добрая” кукла помогает подняться “нейтральной”.
3. “Нейтральный персонаж, сценка 2” – наблюдение нейтрального действия (“нейтральная” кукла поднимается по лестнице).
4. “Наблюдение за антисоциальным действием” – ребенок наблюдает, как “злая” кукла причиняет боль “нейтральной”, сталкивая ее с лестницы.
Продолжительность записи ЭЭГ в каждой ситуации составляла 20–30 с.
Регистрация ЭЭГ производилась с помощью электроэнцефалографа “Мицар” монополярно в лобных, центральных, височных, теменных и затылочных отведениях в соответствии с международной системой “10–20”. В качестве референтного использовался объединенный ушной электрод. Во время записи ЭЭГ велась аудио- и видеорегистрация. Участки записей ЭЭГ, сопровождающиеся движениями глаз и содержащие артефакты с амплитудой более 250 мкВ, исключались из обработки. Для коррекции незначительных артефактов применяли метод независимых компонент. Полученные безартефактные отрезки ЭЭГ разбивали на эпохи по 2.5 с. Фрагменты ЭЭГ подвергались быстрому преобразованию Фурье с взаимным перекрытием эпох 50%. Амплитуды СМР анализировали в 11 отведениях: лобных (F3, F4, F7, F8), центральных (С3, С4), теменных (Р3, Р4) и сагиттальных (Fz, Cz, Pz).
При проведении ЭЭГ-исследований у детей рекомендуется учитывать индивидуальные частотные границы ритмов (Bazanova, 2012). Для определения индивидуального частотного диапазона мю-ритма у каждого ребенка на спектре ЭЭГ в отведении С3 в условиях устойчивого зрительного внимания выявляли пик мощности в диапазоне 5–10 Гц, который исчезал во время совершения ребенком самостоятельного движения рукой. Данную компоненту альфа-ритма, демонстрирующую снижение мощности во фронтальных, центральных и теменных регионах в ситуации двигательной активности, рассматривают как сенсомоторный, или мю-ритм (Thorpe et al., 2016). Подробности методики определения индивидуального частотного диапазона мю-ритма описаны ранее (Михайлова и др., 2020). Нижняя граница бета-ритма определялась исходя из индивидуального частотного диапазона мю-ритма. За верхнюю границу диапазона бета-ритма, как и в других исследованиях детей раннего возраста (Marshall et al., 2002), принимали 18 Гц.
Для частотных полос мю- и бета-ритмов рассчитывали амплитуду, значения которой подвергали логарифмированию для нормализации распределения.
Статистическая обработка данных. Статистическую обработку данных проводили с использованием программы STATISTICA v. 10. Результаты измерений представлены как средние значения ± стандартная ошибка среднего. Различия в возрасте у детей с низким и высоким ИМО оценивали t-критерием Стьюдента. Логарифмированные значения амплитуд мю- и бета-ритмов подвергали дисперсионному анализу с учетом межсубъектного фактора ГРУППА (2 уровня: низкий и высокий ИМО), внутрисубъектного фактора ЛОКУС (уровни: 11 отведений) и при их взаимодействии. Изменения амплитуд СМР в экспериментальных ситуациях анализировали с помощью ANOVA с повторными измерениями (repeated measures) с факторами СИТУАЦИЯ (“Нейтральный персонаж, сценка 1” и “Наблюдение за просоциальным действием”; “Нейтральный персонаж, сценка 2” и “Наблюдение за антисоциальным действием”), ГРУППА, ЛОКУС, СИТУАЦИЯ × × ГРУППА и СИТУАЦИЯ × ГРУППА × ЛОКУС. Для оценки изменений амплитуд ритмов в каждом из 11 локусов ЭЭГ использовался метод линейных контрастов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Показатели моральных оценок. Результаты анализа показали, что средние значения ИМО у исследуемых детей составили 13.7 ± ± 0.54 баллов. Для анализа характеристик ЭЭГ в зависимости от выраженности моральных оценок дети были разделены на две группы исходя из того, как они распределили вознаграждение между игровыми персонажами. Группу с высоким ИМО составили 34 ребенка (12 мальчиков и 22 девочки), которые распределяли вознаграждение в пользу “доброго” персонажа, т.е. дети, набравшие от 13 до 20 баллов. В группу с низким ИМО вошли 17 детей (4 мальчика и 13 девочек), которые не проявили предпочтение к “доброму” персонажу (дали больше вознаграждения “злому” персонажу, распределили вознаграждение между персонажами поровну, оставив остальные “печенья” себе) и, соответственно, набрали от 1 до 12 баллов. В первой группе среднее значение ИМО составило 15.9 ± 0.37 балла, во второй – 9.29 ± 0.55 балла. Возраст детей в обеих группах значимо не отличался (t = 0.29, p = 0.76).
Особенности влияния фактора ГРУППА (дети с высоким и низким ИМО) на амплитуду мю- и бета-ритмов ЭЭГ в ситуациях “Нейтральный персонаж, сценка 1”, “Наблюдение за просоциальным действием”, “Нейтральный персонаж, сценка 2” и “Наблюдение за антисоциальным действием”. Для оценки особенностей различий в амплитудах мю- и бета-ритмов ЭЭГ у детей с разным уровнем ИМО проводился дисперсионный анализ данных показателей во всех исследуемых ситуациях. Влияние факторов ГРУППА и ЛОКУС, а также их взаимодействия представлено в табл. 1.
Таблица 1.
Результаты дисперсионного анализа амплитуд мю- и бета-ритмов ЭЭГ в ситуациях “Нейтральный персонаж, сценка 1”, “Наблюдение за просоциальным действием”, “Нейтральный персонаж, сценка 2”, “Наблюдение за антисоциальным действием” у детей с разным уровнем индекса моральных оценок (фактор ГРУППА) Table 1. ANOVA results for the amplitudes of the EEG mu and beta rhythms in conditions “Neutral character, scene 1”, “Observation of prosocial behavior”, “Neutral character, scene 2” and “Observation of antisocial behavior” in children with different levels of the moral evaluation index (factor ГРУППА)
| Ритм | ГРУППА | ЛОКУС | ГРУППА × × ЛОКУС |
|---|---|---|---|
| F1, 49;p | F10, 490;p | F10, 490;p | |
| “Нейтральный персонаж, сценка 1” | |||
| Мю- | 4.698; 0.035 | 6.116; <0.001 | 0.807; 0.622 |
| Бета- | 11.526; 0.001 | 3.578; <0.001 | 0.718; 0.707 |
| “Наблюдение за просоциальным действием” | |||
| Мю- | 2.114; 0.152 | 5.808; <0.001 | 0.85; 0.537 |
| Бета- | 2.987; 0.090 | 3.217; <0.001 | 0.472; 0.908 |
| “Нейтральный персонаж, сценка 2” | |||
| Мю- | 1.010; 0.319 | 4,449; <0.001 | 0.738; 0.688 |
| Бета- | 1.564; 0.217 | 2.846; 0.002 | 0.397; 0.941 |
| “Наблюдение за антисоциальным действием” | |||
| Мю- | 0.782; 0.381 | 4.456; <0.001 | 0.476; 0.905 |
| Бета- | 2.794; 0.100 | 2.985; <0.001 | 0.475; 0.906 |
Фактор ЛОКУС оказывал значимое влияние на амплитуды обоих СМР в каждом из рассматриваемых условий.
Фактор ГРУППА продемонстрировал значимое влияние на амплитуды СМР исключительно для ситуации “Нейтральный персонаж, сценка 1”. Амплитуда мю- и бета-ритмов оказалась значимо ниже в группе детей с низким ИМО. Отсутствие значимого взаимодействия между факторами ГРУППА и ЛОКУС указывает на то, что различия в амплитудах ритмов между двумя группами не являются специфическими для отдельных локусов. Тем не менее для конкретизации результатов укажем отведения, в которых данные различия достигали уровня статистической значимости при их оценке с помощью метода контрастов.
В данной ситуации у детей с низким ИМО по сравнению с детьми с высоким ИМО амплитуда мю-ритма значимо ниже во фронтальных (F4: F(1, 49) = 4.3, p = 0.04; F8: F(1, 49) = 4.8, p = 0.03), центральном (С4: F(1, 49) = = 5.62, p = 0.02) и париетальном (Р3: F(1, 49) = = 4.64, p = 0.03) отведениях (рис. 1 (а)). Также выявлено, что амплитуда бета-ритма у детей с низким ИМО значимо ниже, чем у детей с выским ИМО во фронтальных (F3: F(1, 49) = = 7.91, p = 0.007; F4: F(1, 49) = 10.4, p = 0.002; F7: F(1, 49) = 5.8, p = 0.02; F8: F(1, 49) = 5.3, p = 0.03; Fz: F(1, 49) = 8.5, p = 0.005) центральных (С3: F(1, 49) = 7.2, p = 0.01; С4: F(1, 49) = = 9.6, p = 0.003; Cz: F(1, 49) = 5.9, p = 0.02) и париетальных (Р3: F(1, 49) = 10.7, p = 0.002; Р4: F(1, 49) = 5.0, p = 0.03; Pz: F(1, 49) = 4.7, p = = 0.03) отведениях (рис. 1 (б)).
Рис. 1.
Амплитуда (А, lg) мю- (а) и бета- (б) ритмов ЭЭГ у детей с низким (темные столбцы) и высоким (светлые столбцы) индексами моральных оценок в ситуациях: “Нейтральный персонаж, сценка 1” (1), “Наблюдение за просоциальным действием” (2), “Нейтральный персонаж, сценка 2” (3) и “Наблюдение за антисоциальным действием” (4). Звездочками отмечены случаи достоверных различий в амплитуде ритмов между группами детей с низким и высоким индексом моральных оценок, выявленные методом контрастов (* – р < 0.05). Темными кружками отмечены случаи достоверных различий между ситуациями 1 и 2, выявленные методом контрастов (* – р < 0.05).
Fig. 1. Amplitude (A, lg) of the EEG mu (a) and beta (б) rhythms in children with low (dark columns) and high (light columns) moral evaluation indices in conditions “Neutral character, scene 1” (1), “Observation of prosocial behavior” (2), “Neutral character, scene 2” (3) and “Observation of antisocial behavior” (4). Asterix symbols mark the cases of significant differences in amplitudes of the EEG rhythms between the groups of children with low and high indices of moral evaluation, calculated as linear contrasts (* – р < 0.05). Dark circles mark the cases of significant differences between situations 1 and 2, calculated as linear contrasts (* – р < 0.05).
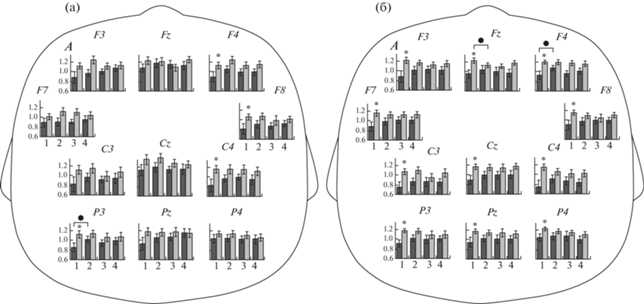
Особенности влияния факторов СИТУАЦИЯ, ГРУППА, ЛОКУС и их взаимодействия на амплитуду мю- и бета-ритмов ЭЭГ у детей с разным уровнем ИМО. Обнаружено значимое влияние факторов ГРУППА и ЛОКУС на изменение амплитуды мю-ритма ЭЭГ при наблюдении за просоциальным действием по сравнению с ситуацией “Нейтральный персонаж, сценка 1” (табл. 2). Фактор СИТУАЦИЯ не оказывал значимого влияния на амплитуду мю-ритма. Однако у детей с низким ИМО при наблюдении за просоциальным действием по сравнению с ситуацией “Нейтральный персонаж, сценка 1” амплитуда мю-ритма увеличивалась в большинстве локусов (см. рис. 1(а)). С использованием метода контрастов выявлено, что данные различия достигали значимого уровня в теменном отведении левого полушария (Р3: F(1, 49) = = 5.05, p = 0.039).
Таблица 2.
Результаты дисперсионного анализа амплитуд мю- и бета-ритмов ЭЭГ в ситуациях “Наблюдение за просоциальным действием” и “Наблюдение за антисоциальным действием” по сравнению с ситуацией наблюдения за нейтральным персонажем (фактор СИТУАЦИЯ) у детей с разным уровнем индекса моральных оценок (фактор ГРУППА) Table 2. ANOVA results for the amplitudes of the EEG mu and beta rhythms in conditions “Observation of prosocial behavior” and “Observation of antisocial behavior” relative to the condition of observing the neutral character (factor СИТУАЦИЯ (a, б) in children with different levels of the moral evaluation index (factor ГРУППА)
| Ритм | СИТУАЦИЯ | ГРУППА | ЛОКУС | СИТУАЦИЯ × × ГРУППА | СИТУАЦИЯ × × ГРУППА × ЛОКУС |
|---|---|---|---|---|---|
| F1, 49;p | F1, 49;p | F10, 490;p | F1, 49;p | F10, 490;p | |
| При наблюдении за просоциальным действием по сравнению с нейтральным (сценка 1) | |||||
| Мю- | 1.960; 0.167 | 3.970; 0.051 | 8.637; <0.001 | 0.774; 0.383 | 0.891; 0.540 |
| Бета- | 1.393; 0.243 | 7.965; 0.006 | 4.950; <0.001 | 3.773; 0.057 | 0.463; 0.913 |
| При наблюдении за антисоциальным действием по сравнению с нейтральным (сценка 2) | |||||
| Мю- | 0.208; 0.650 | 0.991; 0.324 | 6.845 <0.001 | 0.033; 0.856 | 0.793; 0.635 |
| Бета- | 0.024; 0.877 | 2.464; 0.122 | 4.314; <0.001 | 0.185; 0.677 | 0.394; 0.949 |
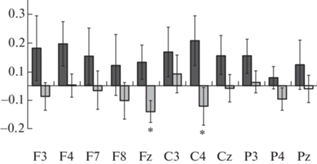
Анализ изменений амплитуды бета-ритма ЭЭГ при наблюдении за просоциальным действием по сравнению с ситуацией “Нейтральный персонаж, сценка 1” выявил значимое влияние факторов ГРУППА и ЛОКУС, а также близкое к значимому влияние взаимодействия факторов СИТУАЦИЯ × ГРУППА (см. табл. 2). Так, у детей с низким ИМО при наблюдении за просоциальным действием по сравнению с нейтральным во всех отведениях выявлено увеличение амплитуды бета-ритма ЭЭГ (см. рис. 1(б)). Метод контрастов показал, что данные различия достигали статистической значимости в отведении F4 (F(1, 49) = = 5.4; р = 0.02). У детей с высоким ИМО происходит снижение амплитуды бета-ритма ЭЭГ при наблюдении за просоциальным действием по сравнению с ситуацией “Нейтральный персонаж, сценка 1”, которое достигало значимого уровня в медианном фронтальном отведении (Fz: F(1, 49) = 5.3; р = = 0.02, метод контрастов) (см. рис. 1(б)). Для оценки изменений бета-ритма ЭЭГ в ситуации наблюдения за просоциальным действием относительно нейтрального проведен дополнительный анализ индексов реактивности (ИР), рассчитанных как отношение амплитуды бета-ритма в ситуациях “Наблюдение за просоциальным действием” и “Нейтральный персонаж, сценка 1” (lg А “Наблюдение за просоциальным действием”/А “Нейтральный персонаж, сценка 1”). У детей с низким ИМО величины ИР имели только положительные значения, а у испытуемых с высоким – в основном отрицательные (рис. 2). Иными словами, у детей с высоким ИМО наблюдалась преимущественно десинхронизация бета-ритма ЭЭГ в ситуации наблюдения за просоциальным действием относительно нейтрального, а у детей с низким ИМО – синхронизация. Метод контрастов показал, что данные различия достигали статистической значимости во фронтальном (Fz: F(1, 49) = = 6.6; р = 0.01) и центральном (С4: F(1, 49) = = 4.2; р = 0.04) отведениях.
Рис. 2.
Индексы реактивности ЭЭГ в диапазоне бета-ритма в группах детей с низким (темные столбцы) и высоким (светлые столбцы) уровнем индекса моральных оценок в условии наблюдения просоциального действия относительно нейтрального. Звездочками отмечены случаи достоверных различий между группами, выявленные методом контрастов (* – p < 0.05).
Fig. 2. EEG beta rhythm reactivity indices in the groups of children with low (dark columns) and high (light columns) levels of moral evaluation index in the condition of observing the prosocial behavior relative to the neutral one. Asterix symbols mark the cases of significant differences between the groups, calculated as linear contrasts (* – р < 0.05).
Для амплитуды мю- и бета-ритмов ЭЭГ в ситуации наблюдения за антисоциальным действием по сравнению с ситуацией “Нейтральный персонаж, сценка 2” выявлено значимое влияние лишь фактора ЛОКУС (см. табл. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты настоящего исследования показывают, что у детей раннего возраста при предъявлении нейтральных, про- и антисоциальных действий, совершаемых игровыми персонажами, наблюдаются изменения в паттернах ЭЭГ-активности СМР. Можно предположить, что не только экспериментатора, но и кукольных персонажей дети раннего возраста воспринимают как неких живых субъектов (на этом основаны представления кукольных театров), действия которых вызывают реакции СЗН.
Значительный интерес представляют выявленные различия в амплитуде СМР у детей в ходе наблюдения за нейтральным персонажем в сценке 1, а именно – в ситуации наблюдения за действиями куклы, которая поднималась по лестнице. В группе детей с низким ИМО амплитуда и мю-, и бета-ритма оказалась значимо ниже, чем у детей с высокими значениями данного показателя, причем для бета-ритма различия были заметно более выраженными. Поскольку амплитуда СМР ЭЭГ, как отмечалось выше, отрицательно коррелирует с активацией СЗН, можно предположить, что уже начальный этап наблюдения за действиями нейтрального персонажа, которые еще не сопровождались каким-либо морально нагруженным контекстом, вызывал более выраженное внимание и вовлеченность в процесс восприятия разыгрываемых действий у детей с низким ИМО. При наблюдении за последующими экспериментальными ситуациями, в том числе имеющими выраженную моральную окраску, их сосредоточенность на поведении персонажей падала, о чем могут свидетельствовать более высокие значения амплитуды СМР. То есть у детей данной группы моральность действий персонажей не находится в фокусе внимания. В случае детей с высоким ИМО наблюдалась противоположная тенденция, которую можно интерпретировать как повышение интереса к наблюдаемым действиям, сопровождающимся морально значимым контекстом.
Было установлено, что у детей с высоким ИМО при просмотре сценки с “добрым” персонажем наблюдалось снижение амплитуды сенсомоторного бета-ритма ЭЭГ. У детей с низкими значениями ИМО в ситуации наблюдения за просоциальными действиями персонажа наблюдался рост амплитуды СМР ЭЭГ. Результаты ряда исследований (см. обзор (Saltuklaroglu et al., 2018)) свидетельствуют о том, что десинхронизация СМР происходит в ситуациях наблюдения и/или подражания действию. В то же время десинхронизация в диапазоне бета-ритма отражает также и эмоциональные процессы. Так, в исследовании I. Riecansky и соавт. (Riecansky et al., 2015) показано, что наблюдение за ситуацией причинения вреда представителю той расы, к которой принадлежит испытуемый, сопровождается большей десинхронизацией в диапазоне бета-ритма. Было выдвинуто предположение, что подобная реактивность бета-ритма сопровождает проявление эмпатии по отношению к тем, кто в чем-то на нас похож. Исследования разных видов просоциального поведения показали, что эмпатия играет важную роль как при формировании моральных оценок (Decety, 2016), так и при оказании помощи (Leone et al., 2008).
Одним из объяснений полученных результатов может быть следующее. Как отмечалось выше, десинхронизация в диапазоне мю-ритма может свидетельствовать о внутренней репрезентации человеком наблюдаемых им двигательных актов и действий, тогда как десинхронизация в диапазоне бета-ритма может указывать и на протекание более сложных, в том числе эмоционально окрашенных процессов. Согласно модели V. Gallese (Gallese, 2009), когда мы наблюдаем намеренное поведение окружающих, проявляется особое качество отождествления себя с другими индивидами. У наблюдателя возникают внутренние представления о состояниях тела, эмоциях и ощущениях, связанных с этими действиями, как если бы он выполнял аналогичное действие или испытывал подобные эмоции или ощущения. Наиболее интенсивно такие процессы протекают, если у индивида уже имеется опыт подобных действий. В результате обеспечивается возможность социальной идентификации с другими. По нашему мнению, дети с высокими значениями ИМО, которые, предположительно, могли иметь определенный личный опыт помогающего поведения в семье, отождествляли себя с персонажем, совершившим положительный поступок. Это сопровождалось активацией СЗН, отражающейся в десинхронизации сенсомоторного бета-ритма. Как уже отмечалось, у детей с низкими значениями ИМО в ситуации наблюдения за добрым персонажем выявлен рост СМР ЭЭГ. Мы предполагаем, что детям этой группы сложнее поставить себя на место наблюдаемых персонажей (возможно, и за счет меньшего опыта помогающего поведения) и, следовательно, сложнее проявить моральное отношение к ним в наблюдаемой ситуации.
Возможна также интерпретация, согласно которой дети с более высокими значениями ИМО, идентифицирующие себя с “добрым” персонажем, при наблюдении за его помогающим поведением “зеркально” входили в режим повышенной моторной готовности к аналогичным действиям. Такое объяснение соответствует результатам экспериментальных исследований, в которых показана наиболее существенная десинхронизация амплитуды бета-ритма в режиме подготовки к выполнению самостоятельных движений (Tzagarakis et al., 2015). Наблюдение же за действиями “плохого” персонажа не вызывало реакции идентификации с ним и не сопровождалось значимыми изменениями СМР. Возможно, данная ситуация сопровождалась когнитивным и эмоциональным напряжением при наблюдении асоциального поведения персонажа, из-за чего моторные области коры испытывали тормозящие влияния “сверху-вниз” (top-down regulation), предположительно, со стороны кортикальных и субкортикальных отделов, активность которых лежит в основе т.н. управляющих функций (Курганский, 2021). Рост амплитуды СМР ЭЭГ в группе детей с низким ИМО при наблюдении за действиями “доброго” персонажа может быть следствием относительно низкой интенсивности когнитивных и аффективных процессов, связанных с восприятием именно морального аспекта наблюдаемой сцены, в результате чего моторные области коры были активированы в меньшей степени, чем у детей с высоким ИМО.
Выявленные в данном исследовании особенности изменений СМР при наблюдении за про- и антисоциальными действиями могут быть использованы в качестве маркеров при диагностике уровня развития просоциального поведения у детей в раннем возрасте. Кроме этого, понимание нейрофизиологических механизмов формирования моральных оценок может быть основой для разработки коррекционных программ для детей с риском проявления асоциального поведения, в том числе с применением метода биологической обратной связи по ЭЭГ.
ВЫВОДЫ
1. Выявлено, что при первом предъявлении действий нейтрального персонажа амплитуда мю- и бета-ритмов оказалась значимо ниже у детей, у которых отсутствовало предпочтение положительного персонажа (группа детей с низким ИМО), по сравнению с детьми с высокими значениями ИМО. При наблюдении за последующими экспериментальными ситуациями, в том числе имеющими выраженную моральную окраску, сосредоточенность детей с низким ИМО на поведении персонажей падала, о чем может свидетельствовать рост значений амплитуды СМР-ритмов. То есть у детей данной группы моральность действий персонажей не находится в фокусе внимания.
2. Анализ амплитуд и индексов реактивности СМР показал, что у детей, которые выше оценивали персонажа, совершающего положительное социальное действие – оказание помощи (группа детей с высоким ИМО), наблюдалась десинхронизация сенсомоторного бета-ритма в ситуации наблюдения за этим действием. Мы предполагаем, что такая направленность реактивности бета-ритма связана с отождествлением ребенком себя с игровым персонажем, совершающим просоциальное действие, следствием чего является активация “зеркальной” системы мозга. У детей с низким ИМО при наблюдении за действиями положительного персонажа наблюдалась синхронизация СМР ЭЭГ. Это позволяет предположить, что данная группа детей не отождествляла себя с действиями положительного персонажа, вероятно, вследствие недостатка опыта подобных социальных взаимодействий.
Исследование выполнено на базе ЦКП научным оборудованием “Экспериментальная физиология и биофизика” ФГАОУ ВО “КФУ имени В.И. Вернадского” в рамках темы: “Психофизиологические механизмы просоциального поведения у детей раннего возраста, воспитывающихся в разных социальных условиях” при финансовой поддержке гранта Президента Российской Федерации для государственной поддержки молодых российских ученых – кандидатов наук № МК-730.2020.6.
Список литературы
Курганский А.В. Оценка управляющих функций у детей 3–6 лет: состояние, проблемы и перспективы. Журнал высшей нервной деятельности им. И.П. Павлова. 2021. 71 (4): 468–484.
Лебедева Н.Н., Буркитбаев С.Е., Каримова Е.Д. Активация зеркальной системы мозга зависит от способа предъявления стимулов: непосредственно экспериментатором или как видеоролик. Журнал высшей нервной деятельности им. И.П. Павлова. 2020. 70 (4): 460–472.
Лебедева Н.Н., Каримова Е.Д., Карпычев В.В., Мальцев В.Ю. Зеркальная система мозга при наблюдении, выполнении и представлении моторных задач – нейрофизиологическое отражение восприятия чужого сознания. Журнал высшей нервной деятельности им. И.П. Павлова. 2018. 68 (2): 204–215.
Михайлова А.А., Орехова Л.С., Дягилева Ю.О., Мухтаримова Т.И., Павленко В.Б. Реактивность мю-ритма ЭЭГ при наблюдении и выполнении действий у детей раннего возраста, имеющих разный уровень развития рецептивной речи. Журнал высшей нервной деятельности им. И.П. Павлова. 2020. 70 (3): 423–433.
Bazanova O.M. Alpha EEG Activity Depends on the Individual Dominant Rhythm Frequency. Journal of Neurotherapy: Investigations in Neuromodulation, Neurofeedback and Applied Neuroscience. 2012. 16: 270–284.
Cowell J.M., Decety J. The neuroscience of implicit moral evaluation and its relation to generosity in early childhood. Current Biology. 2015. 25 (1): 93–97.
D’Errico F., Leone G., Schmid M., D’Anna C. Prosocial virtual reality, empathy, and EEG measures: a pilot study aimed at monitoring emotional processes in intergroup helping behaviors. Applied Sciences. 2020. 10: 1196.
Debnath R., Salo V., Buzzell G., Yoo K., Fox N. Mu rhythm desynchronization is specific to action execution and observation: evidence from time-frequency and connectivity analysis. NeuroImage. 2019. 184: 496–507.
Decety J. Is empathy necessary for morality? In: P.V. Sosa, M.L. Bringas, E. Martinez (eds.), IOP2016: Proceedings of the 18th World Congress of Psychophysiology of the International Organization of Psychophysiology (IOP). 2016. 108: 24.
DiGirolamo M.A., Simon J.C., Hubley K.M., Kopulsky A., Gutsell J.N. Clarifying the relationship between trait empathy and action-based resonance indexed by EEG mu-rhythm suppression. Neuropsychologia. 2020. 133: 107172.
Fox N.A., Bakermans-Kranenburg M.J., Yoo K.H., Bowman L.C., Cannon E.N., Vanderwert R.E. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychol Bull. 2016. 142 (3): 291–313.
Gallese V. Mirror neurons, embodied simulation, and the neural basis of social identification. Psychoanalytic Dialogues. 2009. 19 (5): 519–536.
Gillett G., Franz E. Evolutionary neurology, responsive equilibrium, and the moral brain. Consciousness and Cognition. 2016. 45: 245–250.
Hur Y.-M. Relationships between cognitive abilities and prosocial behavior are entirely explained by shared genetic influences: A Nigerian twin study. Intelligence. 2020. 82: 101483.
Kaida A.I., Mikhailova A.A., Eismont E.V., Dzhapparova L.L., Pavlenko V.B. EEG μ-rhythm reactivity in children during imitation of biological and non-biological motion. Bulletin of RSMU. 2020. (2): 61–8.
Kenward B., Dahl M. Preschoolers distribute scarce resources according to the moral valence of recipients' previous actions. Developmental Psychology. 2011. 47 (4): 1054–1064.
Leone G., D’Errico F., Serino C., Marzano M. Empatia e costi psicologici dell’aiuto’. In: I. Poggi (ed.), La Mente del Cuore. Le Emozioni nel Lavoro Nella Scuola Nella Vita. Rome: Armando Editore; 2008. p. 229–249.
Malti T., Dys S.P., Zuffianò A. The Moral Foundations of Prosocial Behaviour. In: R.E. Tremblay, M. Boivin, RDeV Peters, A. Knafo-Noam (eds.), Encyclopedia on Early Childhood Development [Internet]. 2015 [cited 2021 Sept 17]. Available from: https://www.child-encyclopedia.com/pdf/expert/ prosocial-behaviour/according-experts/moral-foundations-prosocial-behaviour
Marshall P.J., Bar-Haim Y., Fox N.A. Development of the EEG from 5 months to 4 years of age. Clinical Neurophysiology. 2002. 113: 1199–1208.
Muthukumaraswamy S.D., Singh K.D. Modulation of the human mirror neuron system during cognitive activity. Psychophysiology. 2008. 45 (6): 896–905.
Orekhova L.S., Makhin S.A., Mikhailova A.A., Pavlenko V.B. EEG Patterns in Early Childhood Differ Between Children Prone To Reward “Bad” or “Good” Actors. Psychology in Russia: State of the Art. 2020. 13 (2), 84–95.
Reese M., Bryant D., Ethridge L. Biomarkers for moral cognition: Current status and future prospects for neurotransmitters and neuropeptides. Neuroscience and Biobehavioral Reviews. 2020. 113: 88–97.
Riecansky I., Paul N., Kolble S., Stieger S., Lamm C. Beta oscillations reveal ethnicity ingroup bias in sensorimotor resonance to pain of others. SCAN. 2015. 10: 893–901.
Saltuklaroglu T., Bowers A., Harkrider A.W., Casenhiser D., Reilly K.J., Jenson D.E. EEG mu rhythms: Rich sources of sensorimotor information in speech Processing. Brain and Language. 2018. 187: 41–61.
Sampaio L.R., Cabral G. Differences in allocation patterns and in the use of distributive principles emerge from children of Brazilian parents in Brazil and in the United States. Suma Psicológica. 2015. 22: 19–27.
Schunke O., Schottle D., Vettorazzi E., Brandt V., Kahl U., Baumer T. Mirror me: Imitative responses in adults with autism. Autism. 2016. 20: 134–144.
Termini K., Golden J.A., Lyndon A.E., Sheaffer B.L. Reactive attachment disorder and cognitive, affective and behavioral dimensions of moral development. Behavioral Development Bulletin. 2009. 15 (1): 18–28.
Thorpe S.G., Cannon E.N., Fox N.A. Spectral and source structural development of mu and alpha rhythms from infancy through adulthood. Clinical Neurophysiology. 2016. 127 (1): 254–269.
Tzagarakis C., West S., Pellizzer G. Brain oscillatory activity during motor preparation: effect of directional uncertainty on beta, but not alpha, frequency band. Frontiers in neuroscience. 2015. (9): 246.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


