Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 2, стр. 187-200
Особенности функциональной коннективности головного мозга в состоянии покоя у пациентов с латерализованным поражением медиобазальных отделов височной доли (данные фМРТ и ЭЭГ)
А. Ю. Кулева 1, *, Е. В. Шарова 1, Г. Н. Болдырева 1, Ю. В. Струнина 2, М. Ю. Ярец 1, М. В. Галкин 2, А. С. Бычкова 3, А. С. Смирнов 2, О. А. Кроткова 2
1 ФГБУН “Институт высшей нервной деятельности и нейрофизиологии РАН”
Москва, Россия
2 ФГАУ “Национальный медицинский исследовательский центр нейрохирургии имени академика Н.Н. Бурденко” Минздрава России
Москва, Россия
3 Московский Государственный университет им. М.В. Ломоносова, факультет психологии
Москва, Россия
* E-mail: kylaria@mail.ru
Поступила в редакцию 24.05.2021
После доработки 02.08.2021
Принята к публикации 05.10.2021
- EDN: WMHRDI
- DOI: 10.31857/S0044467722020083
Аннотация
Структурно-функциональное обеспечение управляющих функций (executive functions), активно исследуемых в настоящее время, связывается по большей части с префронтальными и теменными отделами полушарий. Работа направлена на уточнение причастности к их формированию медиальных отделов височной доли. В исследовании участвовали пациенты (14 человек) с внемозговой опухолью (менингиома), оказывающей компримирующее влияние на медиобазальные отделы височной доли соответствующего полушария. В 7 случаях опухоль располагалась справа и в 7 случаях – слева. Контрольную группу составили 9 здоровых испытуемых. У каждого из пациентов и здоровых добровольцев проводили фМРТ в состоянии покоя с дальнейшим анализом функциональной коннективности между заданными областями интереса (ROI), соответствующими по топографии сети управляющих функций (УФ). Затем в тот же день регистрировали многоканальную ЭЭГ в состоянии покоя с закрытыми глазами с последующим спектрально-когерентным анализом всех возможных сочетаний пар отведений по основным физиологическим диапазонам ритмов. Дополнительно проводилось нейропсихологическое тестирование по методике зрительного запоминания АВП и опросника потока сознания при прохождении фМРТ покоя (ReSQ). Анализ фМРТ- и ЭЭГ-коннективности в состоянии покоя у пациентов в сравнении со здоровыми людьми выявил сходные для двух методов паттерны нарушений функциональных связей, соответствующие по топографии сети управляющих функций, подтверждая представления о причастности к этой системе нижней височной коры. Установлены специфические особенности изменений коннективности в группах пациентов с разной латерализацией поражения, согласующиеся с данными нейропсихологического тестирования и преобладающие при левостороннем расположении опухоли.
К числу актуальных направлений нейрофизиологии относится изучение церебральной структурно-функциональной организации управляющих функций (executive functions), под которыми понимают комплекс процессов, осуществляющих инициацию, планирование, регуляцию и контроль любой целенаправленной деятельности (Miyake et al., 2000; Diamond, 2013; Купцова и соавт., 2015). Структурно-функциональное обеспечение управляющих функций (УФ) традиционно связывают с активностью префронтальных отделов мозга (Лурия, 2002). В последующих работах были получены теоретические и практические подтверждения участия в реализации УФ теменных корковых областей, задействованных в переключении между задачами, инициации и корректировке выполнения задачи в режиме реального времени (Petersen, Posner, 2012; Мачинская, 2015; Ярец и соавт., 2018). Ряд исследований (Mishkin, 1983; Tonegawa et al., 2018; Kovner et al., 2019) обосновывает также возможную причастность к системе УФ нижней височной коры и гиппокампа в контексте функции рабочей памяти как одного из компонентов управляющих функций. Однако последнее требует дополнительного изучения и уточнения.
Общепринятыми в нейронауке сегодня являются представления о нейросетевой организации деятельности мозга (Dehaene et al., 2011; Анохин, 2021), а также структурной и функциональной коннективности как основе формирования нейронных сетей (Friston et al., 1993; Мартынова и соавт., 2016).
В качестве информативного исследовательского подхода к изучению этого аспекта работы мозга рассматривается анализ сетей фМРТ, зарегистрированных в состоянии покоя (Laureys, Schiff, 2012; Perri et al., 2014; Demertzi et al., 2019; Гаврон и соавт., 2019). При этом сеть управляющих функций, включающая лобные зоны коры, относится к числу наиболее характерных для здоровых людей (Rosazza, Minati, 2011). Было установлено, что особенности функционирования ряда нейросетей покоя напрямую коррелируют с успешностью реализации определенных когнитивных функций (Rocca et al., 2010). Кроме того, имеются данные о наличии топографического соответствия между нейросетевыми паттернами фМРТ и ЭЭГ по показателям их коннективности (Koenig et al., 2005; Meier et al., 2016; El-Baba, 2017; Li et al., 2019).
Учитывая все вышесказанное, фМРТ- и ЭЭГ-анализ функциональной коннективности головного мозга в состоянии покоя при латерализованном височном поражении в сопоставлении с нормой представляется адекватным методическим подходом для уточнения вклада правой и левой височных долей в структурно-функциональное обеспечение управляющих функций.
Задачи работы: 1) провести сравнительный анализ показателей функциональной коннективности фМРТ и ЭЭГ в состоянии покоя у здоровых людей и пациентов с внемозговым опухолевым поражением медиобазальных отделов правой и левой височной доли; 2) в областях, соответствующих по топографии сети УФ, проанализировать изменения функциональных связей, сопряженные с латерализацией поражения; 3) качественно сопоставить результаты оценки функциональной коннективности мозга с данными нейропсихологического тестирования.
МЕТОДИКА
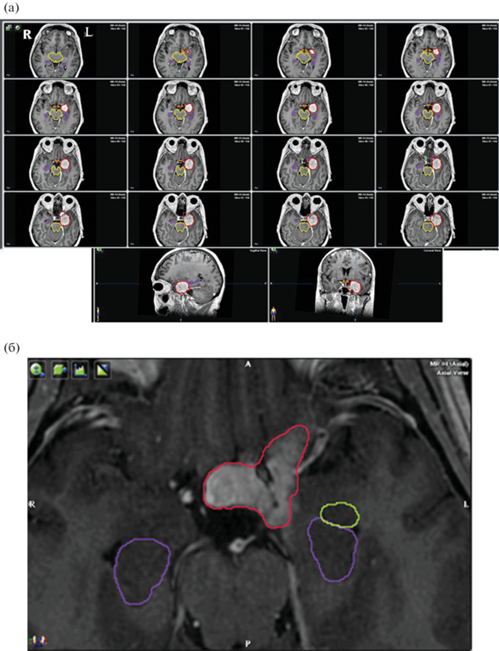
Основную выборку наблюдений составили пациенты с односторонней менингиомой области кавернозного синуса. Менингиома – это внемозговая опухоль, происходящая из паутинной оболочки. Опухоль этого типа не инфильтрирует мозговое вещество, но при данной локализации оказывает компримирующее влияние на медиобазальные отделы височной доли, включая структуры лимбической системы, в частности, гиппокамп. У 7 пациентов (возраст от 34 до 63 лет) опухоль располагалась слева, у 7 (возраст от 37 до 61 года) – справа. Для уточнения пространственной характеристики церебрального повреждения проводилось оконтуривание опухоли, гиппокампа, миндалины и ствола мозга в системе дозиметрического планирования iPlan (BrainLab) (рис. 1).
Рис. 1.
Примеры визуализации характерного расположения менингиомы в области кавернозного синуса на срезах МРТ в аксиальной проекции. (а) – последовательные срезы МРТ в аксиальной проекции у пациентки О-кой с левосторонним расположением опухоли (оконтурена красным цветом); (б) – пример расположения опухоли относительно гиппокампа (сиреневый контур) и миндалины (светло-зеленый контур) на большом увеличении (пац. К-ва.).
Fig. 1. Examples of visualization of the characteristic location of the tumor of the mediobasal parts of the temporal lobe in the volume of the brain. (а) – successive slices of MRI in the axial projection of patient O. with a left-sided tumor (contoured in red); (б) – an example of the location of the tumor relative to the hippocampus (contoured in purple) and amigdala (contoured in light green) at high magnification (patient K.).
По результатам опросника Аннет (Бизюк, 2005), у всех пациентов ведущей была правая рука.
Контрольную группу составили 9 здоровых праворуких испытуемых (4 женщины, 5 мужчин) в возрасте от 23 до 48 лет.
У каждого участника исследования в один и тот же день и в одинаковой последовательности проводились фМРТ- и ЭЭГ-исследования.
ФМРТ выполнялась в отделении рентгеновских и радиоизотопных методов диагностики ФГАУ “НМИЦ нейрохирургии имени академика Н.Н. Бурденко” Минздрава России, на магнитно-резонансном томографе General Electric Signa HDxt (США) с напряженностью магнитного поля 3.0 Тл. Длительность записи фМРТ в состоянии покоя с закрытыми глазами составляла 10 мин 12 сек. Для получения структурных данных (в объеме всего мозга) использовалась импульсная последовательность 3D FSPGR (BRAVO); TR 8.8 мс, TE 3.5 мс, толщина среза 1 мм, FOV 250 мм, матрица изображения 256 × 256, размер воксела 0.97 × 0.97 × 1.0 мм. Для получения функциональных данных использовалась эхопланарная последовательность “спиновое эхо” (BOLD T2); TR 2000 мс, TE 30 мс, толщина среза 3 мм, FOV 250 мм, матрица изображения 128 × 128, размер воксела 1.95 × × 1.95 × 3 мм. В каждой временной серии было получено 300 наборов функциональных объемов, каждый из которых содержал 24–40 аксиальных срезов, захватывающих весь головной мозг. Время сканирования одного функционального объема – 2 с. Общее число срезов в функциональной серии составляло 7000–12 000. Во время регистрации фМРТ проводились первичный контроль качества гемодинамических сигналов, автоматическая коррекция уровня шума, а также оценка качества блоковых записей по присутствию двигательных артефактов.
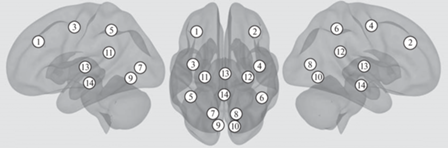
Обработку и статистическую оценку результатов данных фМРТ покоя проводили с помощью программного пакета CONN v.18b (Functional connectivity toolbox, https://web.conn-toolbox.org/), работающего на базе MATLAB®. Использовали стандартный шаблон обработки, включенный в пакет: коррекцию временного и пространственного сдвига функциональных изображений, корегистрацию со структурным изображением, нормализацию в стандартное MNI-пространство, сглаживание с Гауссовым ядром, применение фильтра для BOLD-сигнала (0.008–0.09 Hz). Зонами интереса выступили области, соответствующие по топографии сети УФ, с дополнениями, касающимися зрительной коры больших полушарий: Middle frontal gyrus, Inferior parietal gyrus, Precentral gyrus, Hippocampus, Lingual gyrus, Calcarine fissure правого и левого полушарий, а также Thalamus и Cingulum, согласно координатам атласа AAL (рис. 2). При выборе этих ROI мы руководствовались довольно вариативными данными литературы о наиболее стабильных компонентах сети УФ (лобные и теменные корковые зоны) (Krmpotich et al., 2013; Zhang et al., 2017; McIntosh et al., 2020), дополнив их структурами таламуса (Niendam et al., 2012, Мачинская, 2015) и гиппокампа (Zidda et al., 2019), а также рядом зрительных корковых зон, учитывая основную задачу нейропсихологического тестирования (см. далее).
Рис. 2.
“Маска” для оценки коннективности фМРТ состояния покоя. “Зоны интереса”, согласно координатам атласа AAL: 1 – Middle frontal gyrus_L; 2 – Middle frontal gyrus_R; 3 – Precentral gyrus_L; 4 – Precentral gyrus_R; 5 – Inferior parietal gyrus_L; 6 – Inferior parietal gyrus_R; 7 – Lingual gyrus_L; 8 – Lingual gyrus_R; 9 – Calcarine fissure_L; 10 – Calcarine fissure_R; 11 – Hippocampus_L; 12 – Hippocampus_R; 13 – Thalamus_LR; 14 – Cingulate gyrus_LR.
Fig. 2. “Mask” for assessing the connectivity of resting state fMRI. “Regions of interest” (ROI), according to the coordinates of the AAL atlas: 1 – Middle frontal gyrus_L; 2 – Middle frontal gyrus_R; 3 – Precentral gyrus_L; 4 – Precentral gyrus_R; 5 – Inferior parietal gyrus_L; 6 – Inferior parietal gyrus_R; 7 – Lingual gyrus_L; 8 – Lingual gyrus_R; 9 – Calcarine fissure_L; 10 – Calcarine fissure_R; 11 – Hippocampus_L; 12 – Hippocampus_R; 13 – Thalamus_LR; 14 – Cingulate gyrus_LR.
Функциональную связанность между областями интереса оценивали, используя ROI-to-ROI анализ (отношение выбранной области интереса к другой области интереса). Для определения уровня функционального взаимодействия между каждой парой ROI использовался корреляционный анализ Пирсона с последующим применением двумерного преобразования Фишера. Для межгруппового анализа применялся двухвыборочный критерий Стьюдента (two-sample t-test). Порогом статистической значимости было принято значение р < 0.05, с поправкой на множественность сравнений (FDR – false discovery rate).
ЭЭГ-исследование включало 18-канальную монополярную (относительно ушных референтных электродов) регистрацию биопотенциалов по международной схеме 10–20% от симметричных затылочных, теменных, центральных, лобных и височных корковых областей с частотой квантования 200 Гц и полосой пропускания 0.3–35 Гц на базе программно-вычислительного комплекса “Нейрокартограф” (МБН, Россия). Запись проводили в состоянии покоя с закрытыми глазами на протяжении 2–3 мин с последующим спектрально-когерентным анализом безартефактных реализаций длительностью не менее одной минуты, с “шагом” 0.4 Гц.
Когерентность ЭЭГ рассчитывалась для всех возможных сочетаний пар отведений по диапазонам основных физиологических ритмов: дельта (0.4–3.9 Гц), тета1 (4.3–5.5 Гц), тета2 (5.6–7.3 Гц), альфа1 (7.8–8.6 Гц), альфа2 (9–10.2), альфа3 (10.5–12.5) и бета1 (12.9–20.7 Гц). Сопоставлялись групповые показатели КогЭЭГ между нормой и каждой выборкой пациентов (с лево- и правосторонним расположением опухоли) на основе непараметрического критерия Манна–Уитни, с помощью пакета статистических программ (Воронов и соавт., 2003). При интерпретации этих данных учитывались наиболее достоверные результаты (p < 0.001), без коррекции на множественные сравнения.
Проводили качественное сопоставление топографии изменений КогЭЭГ и функциональной коннективности фМРТ корковых зон.
Нейропсихологическое тестирование. 1) В качестве модели для оценки состояния рабочей памяти и у здоровых испытуемых, и у пациентов исследовали зрительное запоминание по методике Айтрекер-Внимание-Память (АВП) (Кроткова и соавт., 2018): просмотр зрительных стимулов (триплеты цветных картинок) – свободное воспроизведение (вспомнить и назвать) через 10 мин после презентации – узнавание стимульного материала (среди показываемых на экране картинок, подаваемых в случайном порядке) через 15 мин после второго этапа – подсчет числа ошибок свободного воспроизведения и ошибок узнавания в %. 2) У пациентов анализировалось состояние сознания во время фМРТ-исследования. В течение 10 мин после завершения фМРТ-сессии проводилось исследование состояния покоя по опроснику ReSQ (Resting State Questionnaire; (Delamillieure et al., 2010)), включающему следующие категории мысленного потока, сопровождавшие исследование фМРТ: зрительные образы, внутренняя речь, соматические ощущения, слуховые образы и ритм, манипулирование цифрами, сонливость. Затем строился индивидуальный профиль по категориям свободного потока мыслей с общим баллом по 7 категориям, равным 100%.
Статистический анализ полученных нейропсихологических и морфометрических данных проводился на базе пакета программы IBM SPSS Statistics Ver.21, с использованием непараметрического критерия Вилкоксона–Манна–Уитни. Различия в распределениях значений категориальных переменных оценивали с помощью критерия Хи-квадрат и точного критерия Фишера. Они признавались статистически значимыми при p < 0.05.
Исследования выполнялись в соответствии с принципами Хельсинкской декларации, после получения информированного согласия и одобрения этическим комитетом ФГАУ “НМИЦ нейрохирургии” и ФГБУН “ИВНД и НФ РАН”.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Проведенный у пациентов анализ морфометрических параметров опухолевого повреждения медиобазальных отделов височной доли не выявил статистически значимых различий между группами с лево- и правосторонним его расположением (табл. 1).
Таблица 1.
Морфометрические показатели опухолевого повреждения медиобазальных отделов правой и левой височной доли Table 1. Morphometric parameters of tumor lesions in the mediobasal parts of the right and left temporal lobe
| Объем опухоли (см3) М ± σ | Объем левого гиппокампа (см3) М ± σ | Объем правого гиппокампа (см3) М ± σ | |
|---|---|---|---|
| Группа с левосторонним поражением (n = 7) | 20.44 ± 4.75 | 3.15 ± 0.23 | 3.27 ± 0.3 |
| Группа с правосторонним поражением (n = 7) | 22.43 ± 9.95 | 3.2 ± 0.43 | 3.27 ± 0.3 |
Эти данные обосновывают правомерность групповых фМРТ- и ЭЭГ-сопоставлений между выборками пациентов с латерализованным церебральным поражением, а также каждой из них – с нормой.
Анализ коннективности сети УФ фМРТ покоя у здоровых испытуемых (рис. 3 (а, I, II)) выявил наличие высоко достоверных функциональных связей практически между всеми заданными областями (см. рис. 2).
Рис. 3.
Функциональные связи сети УФ по данным фМРТ покоя в выборках наблюдений. На рисунке изображены функционально значимые связи (p-FDR corr < 0.05). Цветовая шкала соответствует величине эффекта (T-value). (a) – здоровые испытуемые (n = 9); (б) – пациенты с поражением левой височной доли (n = 7); (в) – пациенты с поражением правой височной доли (n = 7). Зоны интереса для расчета коннективностей представлены на рис. 2: I – связи в виде аксиальной проекции; II – связи в виде “зонтичной” диаграммы.
Fig. 3. Functional connections of the executive network according to resting state fMRI data in the observation samples. The figure shows functionally significant relationships (p-FDR corr < 0.05). The color scale corresponds to the size of the effect (T-value). (a) – healthy subjects (n = 9); (б) – patients with lesions of the left temporal lobe (n = 7); (в) – patients with lesions of the right temporal lobe (n = 7). Regions of interest for calculating connectivity are shown in Fig. 2. I – links in the form of an axial projection; II – links in the form of an “umbrella” diagram.
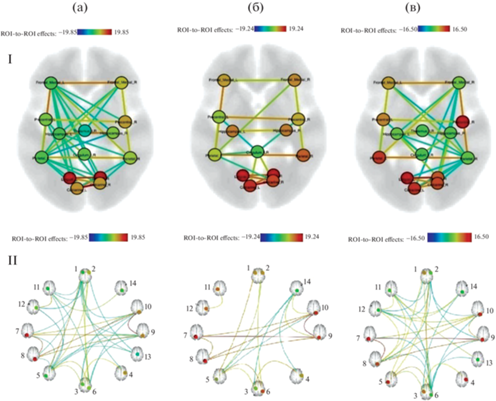
В передних отделах полушарий наиболее сильными (по коэффициенту корреляции) были связи между ROI в симметричных лобных регионах, лобной и центральной зонами левого полушария, а также межгиппокампальные. В каудальных отделах полушарий обращает на себя внимание высокая коннективность симметричных зрительных зон, при том, что, согласно инструкции, фМРТ-исследование проводилось при закрытых глазах. Анализ коннектома УФ показывает наличие большого числа диагональных межполушарных связей, образуемых чаще регионами левого полушария. Максимум их концентрации приходится на левую лобную зону.
Латерализованное опухолевое поражение медиобазальных отделов височной доли сопровождается качественными изменениями пространственной организации сети УФ. В обеих группах пациентов отмечена редукция значимых протяженных межструктурных связей (внутриполушарных и особенно диагональных межполушарных), касающаяся прежде всего лобной, а также прецентральной и теменной зон левой гемисферы, по сравнению с нормой.
Для левостороннего повреждения (рис. 3 (б, I)) нарушения сети УФ выражены в наибольшей степени. Уменьшается число значимых протяженных межструктурных связей, прежде всего – коннективностей лобных и затылочных областей обоих полушарий, между левой и правой лингвальной извилиной. Обращает внимание отсутствие достоверных сетевых связей таламуса (рис. 3 (б, II)), а также редукция внутрисетевых коннективностей правого и левого гиппокампа. Вместе с тем увеличивается число внутрисетевых функциональных связей поясной извилины, являющейся частью лимбической системы (рис. 3 (б, II)); повышается значимость коннективностей между симметричными теменными и моторными корковыми зонами (рис. 3 (б, I)).
При правостороннем повреждении (рис. 3 (в, I, II)) редукция протяженных функциональных связей не столь отчетлива и касается ряда коннективностей лобной, моторной и теменной областей левой гемисферы, а также некоторых таламокортикальных. Уменьшено по сравнению с нормой число внутриполушарных гемодинамических корреляций левой париетальной зоны. Для правосторонних компонентов сети, напротив, отмечается появление нехарактерных для нормы коннективностей: в первую очередь нарастание числа межструктурных функциональных связей правой теменной области, а также связи между правым гиппокампом и поясной извилиной. На уровне нормы сохраняется значимость симметричных связей лобной и моторной коры. В зрительных областях происходит перераспределение активности: повышается значимость симметричных связей лингвальной извилины, но снижается – для связей шпорной борозды.
Результат статистического сопоставления коннективностей в группах патологии по сравнению с нормой (табл. 2) подтвердил более характерные для левостороннего повреждения изменения диагональных межполушарных связей, а также коннективностей зрительных областей. Вместе с тем отличия от нормы односторонних внутриполушарных связей более значимы при правостороннем повреждении.
Таблица 2.
Коннективности сети УФ фМРТ покоя, значимо (p < 0.05) отличающиеся от нормы при латерализованном повреждении медиобазальных отделов височной доли Table 2. Connectivity of the EF resting state fMRI network, significantly (p < 0.05) different from the norm in case of lateralized damage to the mediobasal regions of the temporal lobe
| Левостороннее поражение (в сравнении с нормой) | Правостороннее поражение (в сравнении с нормой) | ||||
|---|---|---|---|---|---|
| Analysis Unit | Т-value | P-unc | Analysis Unit | Т-value | P-unc |
| CAL.L – THA.LR (9–13) | 2.17 | 0.048 | HIP.R – HIP.L (11–12) | –3.68 | 0.003* |
| CAL.R – PreCG.L (10–3) | 2.40 | 0.031 | HIP.R – CAL.R (12–10) | 3.16 | 0.007* |
| CG.LR – CAL.R (14–10) | 2.35 | 0.034 | CAL.L – PreCG.L (9–3) | 3.59 | 0.003* |
| HIP.R – IPL.L (12–5) | 2.80 | 0.014 | CAL.R – PreCG.L (10–9) | 3.15 | 0.007* |
| HIP.R – PreCG.R (12–4) | –2.23 | 0.043 | HIP.R – LING.R (12–8) | 2.62 | 0.020 |
| LING.L L – CAL.R (7–10) | 2.16 | 0.048 | CAL.L – IPL.L (9–5) | 2.82 | 0.014 |
| THA.LR – LING.L (13–7) | 2.26 | 0.040 | THA.LR – MFG.L (13–1) | 2.96 | 0.010 |
| THA.LR – MFG.R (13–2) | 2.56 | 0.023 | |||
| THA.LR – IPL.L(13–5) | 2.16 | 0.049 | |||
| CAL.R – IPL.L (10–5) | 2.83 | 0.013 | |||
| MFG.L – HIP.L(1–12) | 2.25 | 0.041 | |||
| LING.L – IPL.L (7–5) | 2.30 | 0.038 | |||
| HIP.R – MFG.R (12–2) | –2.29 | 0.038 | |||
Примечание: Названия структур обозначены в соответствии с атласом AAL и цифрами на рис. 2. T-value – критическая точка распределения Стьюдента, показатель достоверности статистической гипотезы, рекомендуемый к использованию при выборках менее 30 человек с неизвестным стандартным отклонением популяции; P-unc – значение р без учета коррекции на множественные сравнения; звездочкой (*) отмечены коннективности, для которых также оказалось возможным подсчитать р-значение с коррекцией на множественные сравнения (эффект множественных сравнений был оценен по частоте ошибки ложноположительных результатов – FDR, false discover rate). Notes: The names of the structures are designated in accordance with the AAL atlas and the numbers in Fig. 2. T-value – the critical point of the Student’s distribution, an indicator of the reliability of the statistical hypothesis, recommended for use with samples of less than 30 people with an unknown standard deviation of the population; P-unc – p-value excluding correction for multiple comparisons; an asterisk (*) denotes connectivity for which it was also possible to calculate the p-value corrected for multiple comparisons (the effect of multiple comparisons was assessed by the error rate of false-positive result – FDR, false discover rate).
Когерентный анализ ЭЭГ (рис. 4) выявил высоко достоверные (р < 0.001), диффузные и разнонаправленные отличия от нормы показателей межцентральных связей в группах пациентов. Общей для всех является тенденция к ослаблению межполушарных КогЭЭГ наряду с патологическим усилением внутриполушарных. При этом отмечаются и определенные качественные топографические особенности изменений КогЭЭГ, сопряженные с латерализацией опухоли, которые наиболее отчетливо проявляются в диапазонах частот от дельта до альфа2.
Рис. 4.
Изменения показателей когерентности ЭЭГ по диапазонам физиологических ритмов у пациентов с латерализованным височным повреждением в состоянии покоя с закрытыми глазами по сравнению со здоровыми испытуемыми (n = 9). (а) – группа с левосторонним поражением (n = 7); (б) – группа с правосторонним поражением (n = 7). Красные линии – значимое повышение когерентности, квадраты – средней мощности, зеленые – снижение с p < 0.001 по критерию Манна–Уитни. Черные квадраты – фокусы максимально измененной активности (по числу и степени отличных от нормы когерентных связей).
Fig. 4. Changes in EEG coherence indices by physiological rhythm ranges in patients with lateralized temporal lobe lesion at rest with closed eyes compared with healthy subjects (n = 9). (a) – group with left-sided lesion (n = 7); (б) – group with right-sided lesions (n = 7). Red lines – significant increase in coherence, squares – average power, green – decrease from p < 0.001 according to the Mann–Whitney test. Black squares are the foci of the most altered activity (in terms of the number and degree of coherent connections that are different from the norm).
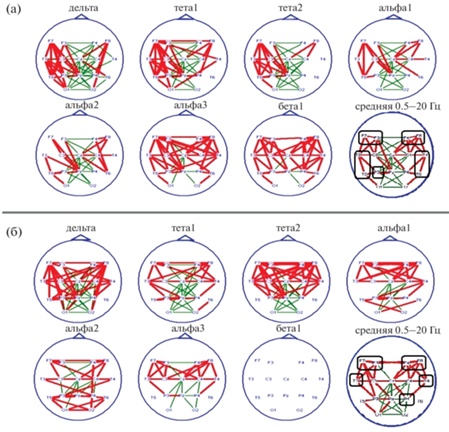
Межполушарные связи при левостороннем поражении ослаблены во всех регионах, а при правостороннем – преимущественно в задних отделах полушарий. Внутриполушарные связи при левосторонней локализации опухоли усилены более асимметрично: во всех областях “пораженного” полушария, при относительной их сохранности справа. При правосторонней локализации опухоли эти связи усилены в обоих полушариях: в передних отделах во всех частотных диапазонах, в теменных и задневисочных – в альфа1 и альфа2. Значимых изменений КогЭЭГ на более высоких частотах (диапазон бета1) не выявлено.
При сравнительной количественной оценке КогЭЭГ выявлено, что отклонения от нормы межполушарных связей (как симметричных, так и диагональных) варьируют от 11 до 150%. Для “левополушарной” группы они максимальны для КогЭЭГ симметричных передне-лобных областей (отведения F7-F8), а для “правополушарной” – симметричных височных (Т3-Т4). Для внутриполушарных КогЭЭГ разброс отклонений от нормы в большинстве частотных диапазонов варьировал от 12 до 166%. Вместе с тем в бета1-диапазоне он был существенно выше, достигая в отдельных случаях 400 и 600%. Следует подчеркнуть, что % отклонения от нормы в целом, а также одноименных показателей КогЭЭГ в частности (включая большинство затылочных) при левополушарном поражении был большим, чем при правополушарном.
Более детальный анализ региональных нарушений КогЭЭГ в группах пациентов позволил выявить локусы, коннективности которых изменяются относительно нормы в наибольшей степени.
При левополушарном повреждении к их числу можно отнести 5 таких локусов. Значительное число измененных по сравнению с нормой связей (n = 40), а также их высокую степень (до 166%) демонстрирует передне-лобная область левой гемисферы (отведения F7 и F3). КогЭЭГ этих регионов отличны от нормы практически во всех частотных диапазонах, чаще в пределах левого полушария, преимущественно в направлении патологического усиления, достигающего в отдельных случаях четырехкратного превышения.
В качестве другого локуса нарушенной функциональной коннективности можно рассматривать височную область левой гемисферы (отведения Т3, Т5, число измененных связей – 44). КогЭЭГ этих зон, в том числе области поясной коры, на которую приходится расположение электрода Pz, также патологически усилены на 100–200% от уровня нормы, преимущественно в тета- и бета-диапазонах. Поскольку указанная область может рассматриваться в качестве проекционной зоны опухолевого повреждения, выявленные изменения КогЭЭГ могут отражать дисфункцию лимбических образований пораженного полушария.
Выявляется также локус пониженной функциональной активности в левой теменной области (отведение Р3), 31 пара КогЭЭГ которой по большей части значимо снижена по сравнению с нормой.
Еще 2 зоны нарушенных связей обнаруживаются в правой гемисфере: передне-лобная (отведения F8, F4, число измененных связей – 48) и височная (отведения Т4 и Т6, число измененных связей – 29). Отличия от нормы КогЭЭГ этих областей, отчетливо выраженные в том числе и в бета-диапазоне, в направлении патологического усиления (до 7 раз), могут отражать выраженную ирритацию правого полушария.
Характерные для данной группы пациентов нарушения межполушарных, преимущественно диагональных, КогЭЭГ проявляются чаще ослаблением по сравнению с нормой на 25–40%. При этом в бета-диапазоне выявляется КогЭЭГ F3-F8, патологически усиленная более, чем в 4 раза. В литературе нарушения диагональных связей передних корковых областей относят к числу маркеров корково-таламической диссоциации (Костандов и соавт., 2010; Шарова и соавт., 2018).
При правополушарном повреждении к числу локусов нарушенной активности можно отнести следующие. Передне-лобный в правой гемисфере (57 значимо измененных КогЭЭГ: от ослабления на 14% до усиления в 125%). Височный правополушарный локус (отведение Т4) представлен 39 измененными КогЭЭГ, преимущественно в направлении усиления связей, достигающего 120% от уровня нормы. Наибольшие нарушения выявлены для КогЭЭГ Т3-Т4 в разных частотных диапазонах. Теменной правополушарный фокус (отведение Р4) – в виде 28 значимо измененных КогЭЭГ в пределах от –31% до +65% относительно нормы, чаще усиленных. Левополушарный передне-лобный локус (отведения F7 и F3) характеризуется 49 значимо измененными КогЭЭГ во всех частотных диапазонах, направленность которых варьирует от –25 до +101%. Левополушарный височный локус (отведение Т3) представлен 34 разночастотными измененными КогЭЭГ, достигающими +126% от нормы.
Таким образом, в обеих группах пациентов локусы нарушений КогЭЭГ выражены в обоих полушариях: по 3 в пораженном и по 2 – в условно здоровом. В схематическом виде они представлены черными прямоугольниками на рис. 4 (а), (б), демонстрирующими отличия от нормы среднего уровня когерентности при лево- и правостороннем височном повреждении. Если первые 3 локуса определяются по большей части функциональными перестройками в контексте очагового поражения, то последние 2 отражают скорее вторичные системные изменения реципрокного характера.
По результатам опросника состояния покоя ReSQ, который прошли 12 из 14 пациентов, у всех во время фМРТ-исследования на первый план выступали категории “Зрительные образы”, “Внутренняя речь”, а также “Соматические ощущения” (рис. 5).
Рис. 5.
Средние значения наиболее часто упоминаемых категорий “потока сознания” по результатам опросника состояния покоя ReSQ для двух групп пациентов (в %). Значимость различий: * – преобладание категории “Слуховые образы и ритм” у пациентов с левосторонним поражением с р < 0.06–0.1; ** – преобладание категории “Соматические ощущения” у пациентов с правосторонним поражением с р = 0.036.
Fig. 5. Average values of the most frequently mentioned categories of “stream of consciousness” according to the results of the ReSQ questionnaire for two groups of patients (in %). Significance of differences: * – prevalence of the category “Auditory images and rhythm” in patients with left-sided lesions; ** – significant (p = 0.036) prevalence of the category “Somatic sensations” in patients with right-sided lesions.
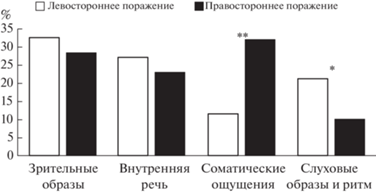
Анализ этих результатов относительно стороны латерализации поражения выявил значимое (р = 0.036) преобладание категории “Соматические ощущения” у пациентов с правосторонним поражением, а категории “Слуховые образы и ритм” – на уровне статистической тенденции (р < 0.06) при левостороннем.
Оценка зрительного запоминания по методике АВП установила недостоверно большее число ошибок при свободном вербальном воспроизведении зрительных стимулов по памяти, а также количество конфабуляторных ответов в группе пациентов с левосторонним поражением.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Оценка функциональных связей мозга в состоянии покоя у пациентов с латерализованным повреждением медиобазальных отделов височной доли по данным фМРТ и КогЭЭГ в сравнении со здоровыми людьми показала, что оба независимых метода демонстрируют сходные топографические паттерны нарушений коннективности при патологии. Общим для обеих групп пациентов является нарушение межполушарных связей: ослабление, более выраженное по КогЭЭГ, и уменьшение числа значимых межструктурных взаимодействий по данным фМРТ. На этом фоне подчеркиваются индивидуальные изменения (по отношению к норме) внутриполушарных коннективностей. Причем фокусы измененной активности (по числу и степени измененных связей) также сходны по топографии: лобные области, особенно левого полушария, и височно-теменные. Согласно литературе, лобные и теменные корковые зоны относятся к числу ключевых в структуре сети УФ (Лурия, 2002; Petersen, Posner, 2012; Мачинская, 2015; Лытаев, Сусин, 2016; Ярец и соавт., 2018). Выявленные в нашей работе нарушения коннективности этой сети при латерализованной височной патологии подтверждают имеющиеся данные (Mishkin, 1983; Мачинская, 2015; Tonegawa et al., 2018; Kovner et al., 2019) о вероятной причастности и нижней височной коры к системе УФ. В совокупности все они хорошо согласуются со сформулированными ранее представлениями П.В. Симонова о структуре церебральной функциональной системы организации поведенческого акта (Симонов, 1998).
Важным результатом настоящего исследования представляется выявленная специфика нарушения функциональных церебральных связей в зависимости от стороны височного повреждения. По данным обоих методов (фМРТ, ЭЭГ) наибольшие качественные и количественные изменения функциональной коннективности обнаруживаются в группе с левосторонней локализацией опухоли. Это касается ослабления коркового межполушарного взаимодействия (от лобных областей до затылочных) по показателям КогЭЭГ. Наряду с этим метод фМРТ выявил редукцию сетевых связей таламуса, а также правого и левого гиппокампов в сочетании с усилением внутрисетевой коннективности поясной (цингулярной) извилины. В то же время правостороннее височное повреждение сопровождается появлением нехарактерных для нормы коннективностей фМРТ: в первую очередь от правой теменной области, а также между правым гиппокампом и поясной извилиной.
По результатам нейропсихологического тестирования, данные о специфических особенностях изменений Ког ЭЭГ при поражении правого и левого полушария согласуются в первую очередь с оценкой состояния покоя во время фМРТ-исследования пациентов по опроснику ReSQ. Последний показал выраженные различия самоощущений в зависимости от стороны височного поражения: преобладание категории “Соматические ощущения” при правостороннем поражении, а категории “Слуховые образы и ритм” – при левостороннем. Этот результат согласуется с данными, полученными на основе анализа эффективных связей гиппокампа для фМРТ здоровых людей в состоянии покоя (Ushakov et al., 2016; Velichkovsky et al., 2018): правый гиппокамп преимущественно работает с информацией из внутренней среды организма, т.е. отвечает за формирование внутренней схемы тела и самоощущения, а левый получает информацию извне, т.е. участвует в коммуникациях с внешней средой.
Исходя из содержания задачи АВП, не выявлено основанной на данных литературы (Todd, Marois, 2004) ожидаемой связи между особенностями нарушения функциональных связей зрительных областей и результатами нейропсихологического тестирования зрительной памяти при височном повреждении. Однако, как следует из приведенной статьи, а также нашего предыдущего исследования (Yarets et al., 2019), асcоциированность зрительной памяти с функциональной (фМРТ, ЭЭГ) активностью задней теменной и затылочной коры проявляется главным образом во время выполнения заданий на зрительную память. То есть именно адресное тестирование является основным методическим подходом при исследовании функциональной нейроанатомии головного мозга (Болдырева и соавт., 2007). В настоящей работе отмеченное превалирование симптомов недостаточности зрительной памяти у пациентов с левополушарной опухолью может быть сопряжено с преимущественным нарушением в состоянии покоя лобных функциональных связей сети УФ, также преобладающим при левостороннем повреждении. Так, в работе (Noyce et al., 2017) показано, что латеральная лобная кора способна поддерживать широкий круг когнитивных задач, включая зрительные и слуховые, обеспечивая общую поддержку познавательных процессов.
Таким образом, при отсутствии статистически значимых различий морфометрических параметров опухоли в выборках пациентов, показаны специфические нарушения функциональных связей мозга в состоянии покоя в группах с право- и левосторонним поражением медиобазальных отделов височной доли относительно нормы.
Выявленные топографические особенности изменений коннективности согласуются с данными нейропсихологического тестирования (опросника ReSQ и методики АВП), преобладая при левосторонней локализации опухоли. В связи с этим перспективным направлением дальнейших исследований представляется анализ неидентичности участия правого и левого гиппокампа в системной организации УФ.
ВЫВОДЫ
1. Анализ фМРТ-ЭЭГ-коннективности в состоянии покоя у пациентов с опухолевым повреждением медиальных отделов височной доли в сравнении со здоровыми людьми выявил сходные для двух методов паттерны нарушений коннективности, соответствующие по топографии сети управляющих функций, подтверждая причастность к ней нижней височной коры.
2. При отсутствии статистически значимых различий морфометрических параметров опухоли в выборках с лево- и правосторонним повреждением показаны специфические особенности нарушения функциональных связей в группах пациентов, согласующиеся с данными их нейропсихологического тестирования и преобладающие при левостороннем расположении опухоли.
Работа поддержана Грантом РНФ 17-15-01426.
Список литературы
Анохин К.В. Когнитом: в поисках фундаментальной нейронаучной теории сознания. Журнал высшей нервной деятельности им. И.П. Павлова. 2021. 71 (1): 39–71.
Бизюк А.П. Компендиум методов нейропсихологического исследования. СПб.: Речь, 2005. 400 с.
Болдырева Г.Н., Корниенко В.Н., Шарова Е.В., Пронин И.Н., Фадеева Л.М., Котенев А.В., Меотишвили А.А. Оценка реакций мозга человека на сенсорные воздействия (пилотные исследования здоровых испытуемых) Доклады Академии Наук. 2007. Т. 416. № 3. с. 426–429.
Воронов В.Г., Щекутьев Г.А., Гриндель О.М. Пакет программ для статистического сравнения записей ЭЭГ. Материалы международной конференции “Клинические нейронауки: нейрофизиология неврология, нейрохирургия”. Украина, Крым, Гурзуф, июнь, 2003 г. С. 22–24.
Гаврон А.А., Yacila Isabela Deza Araujo, Шарова Е.В., Смирнов А.С., Князев Г.Г., Челяпина М.В., Фадеева Л.М., Абдулаев А.А., Куликов М.А., Жаворонкова Л.А., Болдырева Г.Н., Верхлютов В.М., Пронин И.Н. Групповой и индивидуальный фМРТ-анализ основных сетей покоя здоровых испытуемых. Журнал высшей нервной деятельности им. И.П. Павлова, 2019. 69 (2): 150–163. https://doi.org/10.1134/S0044467719020072
Кроткова О.А., Каверина М.Ю., Данилов Г.В. Движение глаз и межполушарное взаимодействие при распределении внимания в пространстве. Физиология человека. 2018. 44 (2): 66–74. https://doi.org/10.7868/S0131164618020108
Костандов Э.А., Фарбер Д.А., Мачинская Р.И., Черемушкин Е.А., Петренко Н.Е., Ашкинази М.Л. Пространственная синхронизация корковой электрической активности на отдельных стадиях зрительной установки у детей 8-летнего возраста с разным уровнем развития фронто-таламической системы избирательного внимания. Журнал высшей нервной деятельности им. И.П. Павлова. 2010. 60 (1): 3–11.
Купцова С.В., Иванова М.В., Петрушевский А.Г., Федина О.Н., Жаворонкова Л.А. Половые различия в способности к переключению зрительного внимания (фМРТ-исследование). Физиология человека. 2015 (6): 49–64.
Лурия А.Р. Основы нейропсихологии. М.: Изд-во МГУ, 2002. 174 с.
Лытаев С.А., Сусин Д.С. Психофизиологические механизмы синдрома нарушения исполнительных функций у больных болезнью Паркинсона. Вестник клинической нейрофизиологии. 2016 (2): 59–64.
Мартынова О.В., Сушинская-Тетерева А.О., Балаев В.В., Иваницкий А.М. Корреляция функциональной связанности областей мозга, активных в состоянии покоя, с поведенческими и психологическими показателями. Журнал высшей нервной деятельности им. И.П. Павлова. 2016. 66(5): 541–555.
Мачинская Р.И. Управляющие системы мозга. Журнал высшей нервной деятельности им. И.П. Павлова. 2015. 65 (1): 33–60.
Симонов П.В. Лекции о работе головного мозга. Москва. Институт психологии РАН. 1998. 98 с.
Шарова Е.В., Зайцев О.С., Коробкова Е.В., Захарова Н.Е., Погосбекян Э.Л., Челяпина М.В., Фадеева Л.М., Потапов А.А. Анализ поведенческих и электроэнцефалографических коррелятов внимания в динамике восстановления сознания после тяжелой черепно-мозговой травмы. Неврология, нейропсихиатрия, психосоматика. 2018. 8 (3): 17–25. https://doi.org/10.14412/2074-2711-2016-3-17-25
Ярец М.Ю., Шарова Е.В., Смирнов А.С., Погосбекян Э.Л., Болдырева Г.Н., Зайцев О.С., Ениколопова Е.В. Анализ структурно-функциональной организации задачи счета в контексте исследования управляющих функций. Журнал высшей нервной деятельности им. И.П. Павлова. 2018. 68 (2): 176–189. https://doi.org/10.7868/S0044467718020041
Dehaene S., Changeux J.P. Experimental and theoretical approaches to conscious processing. Neuron. 2011. 70 (2): 200–227.
Delamillieure P., Doucet G., Mazoyer B., Turbelin M.R., Delcroix N., Mellet E., Zago L., Crivello F., Petit L., Tzourio-Mazoyer N., Joliot M. The resting state questionnaire: An introspective questionnaire for evaluation of inner experience during the conscious resting state. Brain research bulletin. 2010. 81 (6): 565–573.
Demertzi A., Tagliazucchi E., Dehaene S., Deco G., Barttfeld P., Raimondo F., Martial C., Fernández-Espejo D., Rohaut B., Voss H.U., Schiff N.D., Owen A.M., Laureys S., Naccache L., Sitt J.D. Human consciousness is supported by dynamic complex patterns of brain signal coordination. Sci. Adv. 2019 (5): eaat7603.
Diamond A. Executive functions. Annual Review of Psychology. 2013 (64): 135–168. https://doi.org/10.1126/sciadv.aat7603
El-Baba M. Dynamic Functional Connectivity Reveals Temporal Differences in Wake and Stage-2 Sleep. Electronic Thesis and Dissertation Repository. 2017. 4603. https://ir.lib.uwo.ca/etd/4603
Friston K.J., Frith C.D., Liddle P.F., Frackowiak R.S. Functional connectivity: the principal- component analysis of large (PET) data sets. J.Cereb. Blood Flow Metab. 1993. 13 (1): 5–14.
Koenig T., Studer D., Hubl D., Melie L., Strik W.K. Brain connectivity at different time-scales measured with EEG. Phil. Trans. R. Soc. B. 2005 (360): 1015–1024. https://doi.org/10.1098/rstb.2005.1649
Kovner R., Oler J.A., Kalin N.H. Cortico-Limbic Interactions Mediate Adaptive and Maladaptive Responses Relevant to Psychopathology. Am J Psychiatry. 2019 (12): 987–999. https://doi.org/10.1176/appi.ajp.2019.19101064
Krmpotich T.D., Tregellas J.R., Thompson L.L., Banich M.T., Klenka A.M., Tanabe J.L. Resting-state activity in the left executive control network is associated with behavioral approach and is increased in substance dependence. Drug and Alcohol Dependence. 2013. V. 129. № 1–2. P. 1–7. https://doi.org/10.1016/j.drugalcdep.2013.01.021
Laureys S., Schiff N.D. Coma and consciousness: Paradigms (re)framed by neuroimaging. NeuroImage. 2012. https://doi.org/10.1016/j.neuroimage.2011.12.041
Li R., Nguyena T., Pottera T., Zhanga Y. Dynamic cortical connectivity alterations associated with Alzheimer’s disease: An EEG and fNIRS integration study. NeuroImage: Clinical. 2019. V. 21. 101622. https://doi.org/10.1016/j.nicl.2018.101622
McIntosh R.C., Hoshi R., Jason S. Nomi, Di Bello M., Goodman Z.T., Kornfel Z.T., Uddin L.Q., Ottaviani C. Neurovisceral integration in the executive control network: A resting state analysis. Biological Psychology. 2020. V. 157, 107986. https://doi.org/10.1016/j.biopsycho.2020.107986
Meier J., Tewarie P., Hillebrand A., Douw L., Dijk B.W., Stufflebeam S.M., Mieghem P.V. A Mapping Between Structural and Functional Brain Networks. Brain connectivity. V. 6. № 4. 2016. https://doi.org/10.1089/brain.2015.0408
Mishkin M., Ungerleider L.G., Macko K.A. Object vision and spatial vision: two cortical pathways. Trends in neurosciences. 1983 (6): 414–417.
Miyake A., Friedman N., Emerson M., Witzki A., Howerter A., Wager T. The unity and diversity of executive functions and their contributions to complex “frontal lobe” tasks: A latent variable analysis. Cognitive Psychology. 2000 (41): 49–100.
Niendam T.A., Laird A.R., Ray K.L., Dean Y.M., Glahn D.C., Carter C.S. Meta-analytic evidence for a superordinate cognitive control network subserving diverse executive functions. Cogn Affect Behav Neurosci. 2012. 12 (2): 241–268. https://doi.org/10.3758/s13415-011-0083-5
Noyce A.L., Cestero N., Michalka S.W., Shinn-Cunningham B.G., Somers D.C. Sensory-Biased and Multiple-Demand Processing in Human Lateral Frontal Cortex. The Journal of Neuroscience. 2017. 37 (36): 8755–8766.
Perri D.C., Stender J., Laureys S., Gosseries O. Functional neuroanatomy of disorders of consciousness. Epilepsy & Behavior. 2014 (30): 28–32. https://doi.org/10.1016/j.yebeh.2013.09.014
Petersen S.E., Posner M.I. The Attention System of the Human Brain: 20 Years After. Annu Rev Neurosci. 2012 (35): 73–89. https://doi.org/10.1146/annurev-neuro-062111-150525
Rocca M.A., Valsasina P., Absinta M., Riccitelli G., Rodegher M.E., Misci P., Rossi P., Falini A., Comi G., Filippi M. Default-mode network dysfunction and cognitive impairment in progressive MS. Neurol. 2010 (74): 1252–1259.
Rosazza C., Minati L. Resting-state brain networks: literature review and clinical applications. Neurol Sci. 2011. 32 (5): 773–785.
Todd J., Marois R. Capacity limit of visual short-term memory in human posterior parietal cortex. Nature. 2004. 428, 751–754. https://doi.org/10.1038/nature02466
Tonegawa S., Morrissey M.D., Kitamura T. The role of engram cells in the systems consolidation of memory. Nature Review. 2018. 19: 485–498.
Ushakov V.L., Sharaev M.G., Kartashov S.I., Zavyalova V.V., Verkhlyutov V.M., Velichkovsky B.M. Dynamic Causal Modeling of Hippocampal Links within the Human Default Mode Network: Lateralization and Computational Stability of Effective Connections. Front. Hum. Neurosci. 2016 (10). https://doi.org/10.3389/fnhum.2016.00528
Velichkovsky B.M., Krotkova O.A., Kotov A.A., Orlov V.A., Verkhlyutov V.M., Ushakov V.L., Sharaev M.G. Consciousness in a multilevel architecture: Evidence from the right side of the brain. Consciousness and Cognition. 2018. https://doi.org/10.1016/j.concog.2018.06.004
Yarets M.Yu., Kuleva A.Yu., Galkin M.V., Vigasina K.D., Strunina Yu.V., Sharova E.V., Krotkova O.A. EEG Connectivity Analysis in Patients with Left and Right Hemispheric Mediobasal Meningiomas before and after the Therapeutic Radiation Exposure. Arch Neurol & Neurosci. 5 (3): 2019. https://doi.org/10.33552/ANN.2019.05.000612
Zhang C., Yang H., Qin W., Liu C., Qi Z., Chen N., Li K. Characteristics of Resting-State Functional Connectivity in Intractable Unilateral Temporal Lobe Epilepsy Patients with Impaired Executive Control Function. 2017. Front. Hum. Neurosci. 11: 609. https://doi.org/10.3389/fnhum.2017.00609
Zidda F., Griebeb M., Ebert A., Ruttorf M., Roßmanith C., Gass A., Andoha J., Neesa F., Szabo K. Resting-state connectivity alterations during transient global amnesia. NeuroImage: Clinical. 2019. V. 23. 101869. https://doi.org/10.1016/j.nicl.2019.101869
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


