Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 1, стр. 36-54
Механизмы функционирования коннектома, включающего неокортекс, гиппокамп, базальные ганглии, мозжечок и таламус
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: isa-silkis@mail.ru
Поступила в редакцию 24.05.2021
После доработки 10.08.2021
Принята к публикации 05.10.2021
- EDN: JDAFOM
- DOI: 10.31857/S0044467722010105
Аннотация
Проведен анализ возможных механизмов взаимозависимого функционирования нейронов в коннектоме, включающем топографически связанные области неокортекса, гиппокампа, базальных ганглиев, мозжечка, таламуса и связанные с ними различные ядра ЦНС. Эти механизмы базируются на известных результатах морфологических и электрофизиологических исследований, сформулированных ранее унифицированных правилах модификации и модуляции эффективности синаптической передачи, а также результатах проведенного ранее анализа особенностей функционирования гиппокампальной формации, мозжечка и нейронных цепей кора – базальные ганглии – таламус – кора. Мозжечок влияет на неокортекс и базальные ганглии через топографически связанные с ними таламические ядра. На функционирование гиппокампа мозжечок может влиять через таламическое ядро реуниенс, ретросплениальную и префронтальную области коры, медиальную перегородку и супрамамиллярное ядро. Гиппокамп может влиять на функционирование мозжечка через неокортекс и ядра моста, а также через базальные ганглии, мишенями выходных ядер которых являются субталамическое ядро и педункулопонтийное ядро. Базальные ганглии, мозжечок и субталамическое ядро влияют на двигательную активность через красное ядро. С учетом топографической организации связей между структурами выдвинуто предположение, что мозг можно рассматривать как всеобъемлющий коннектом, состоящий из отдельных сходным образом организованных коннектомов, каждый из которых участвует в обработке определенного вида информации. Механизмы функционирования этих коннектомов однотипны. Проведенный анализ механизмов взаимозависимого функционирования нейронов в коннектоме представляет интерес для понимания механизмов функционирования всеобъемлющего коннектома, в котором происходит обработка разномодальной сенсорной информации, ее осознание и выбор необходимой реакции. Предположено, что нейронная сеть пассивного режима работы мозга, включающая высшие области новой коры, является частью всеобъемлющего коннектома, функционирующего в состоянии покоя. Сопоставление механизмов функционирования каждого из коннектомов в норме и патологии должно позволить оценить существующие методы лечения неврологических заболеваний и облегчить целенаправленный поиск новых методов лечения.
СПИСОК СОКРАЩЕНИЙ
| БГ | – базальные ганглии; |
| ГЯМ | – глубокие ядра мозжечка; |
| ДД и ДП | – длительная депрессия и потенциация эффективности синаптической передачи соответственно; |
| К-БГ-Т-К | – нейронная сеть кора – базальные ганглии – таламус – кора; |
| КП | – клетки Пуркинье; |
| ППЯ | – педункулопонтийное ядро; |
| ПфК | – префронтальная кора; |
| РЕ | – таламическое ядро реуниенс; |
| СПРРМ | – нейронная сеть пассивного режима работы мозга; |
| СТЯ | – субталамическое ядро; |
| ЯМ | – ядра моста. |
В настоящее время существенное внимание уделяется изучению функционирования коннектома – глобальной нейронной сети, включающей все структуры мозга. Для исследования структурных и функциональных свойств коннектома человека используются соответственно структурная и функциональная магнитно-резонансная томография. С помощью этих методов было обнаружено, что ряд неврологических расстройств соотносится со значительными нарушениями взаимодействий между разными областями коры, базальными ганглиями (БГ), таламусом и мозжечком (Hanekamp, Simonyan, 2020). В новой коре были обнаружены центры с множественными связями и центры с низким числом связей (van den Heuvel, Sporns, 2011). Центрами в коннектоме также являются мозжечок и БГ, которые связаны со многими структурами (Bostan, Strick, 2018). В обоих полушариях выявлены 12 центров с большим количеством связей. Этими центрами являются высшие фронтальные и височные области коры, гиппокамп, таламус и скорлупа стриатума (входное ядро дорзальной части БГ). Множество сведений об анатомической организации межнейронных связей в отдельных структурах, а также между разными структурами получено с помощью морфологических методов. Регистрация нейронной активности в поведенческих экспериментах позволила выявить особенности функционирования межнейронных связей. Было обнаружено, что мозжечок, который через таламус оказывает влияние на неокортекс, активируется при выполнении задач, ассоциировавшихся с участием БГ, и наоборот (Bostan, Strick, 2018). Кроме того, мозжечок участвует в задачах, ранее ассоциировавшихся с гиппокампом, а гиппокамп оказывает значительное влияние на выполнение задач, которые считали зависимыми только от мозжечка (Wikgren et al., 2010; Hoffmann et al., 2015). Так, показали, что мозжечок вовлечен в построение нейронных отображений пространственных карт в гиппокампе (при участии клеток места) (Rochefort et al., 2013). Эти эффекты объясняют непрямым влиянием мозжечка на функционирование гиппокампа за счет связей обеих структур с новой корой (Yu, Krook-Magnuson, 2015). При исследовании коннектома необходимо учитывать то обстоятельство, что взаимозависимое функционирование структур зависит от влияний различных нейромодуляторов на эффективность синаптических связей.
Известные экспериментальные данные об изменениях эффективности межнейронных связей позволили нам сформулировать унифицированные правила модификации и модуляции эффективности возбудительных и тормозных синаптических входов к разным типам нейронов в гиппокампе, новой коре, базальных ганглиях и мозжечке (Силькис, 2002, Силькис, 2021; Silkis, 1998; Silkis, 2000; Silkis, 2001). С учетом этих правил был проведен анализ возможных механизмов функционирования гиппокампальной формации (Силькис, 2010) и топографически организованных нейронных сетей кора – базальные ганглии – таламус – кора (К-БГ-Т-К), включающих сенсорные и моторные области указанных структур (Силькис, 2015; Silkis, 2001; Silkis, 2007). Кроме того, был предложен возможный механизм функционирования нейронной сети мозжечка (Silkis, 2000) и проведен анализ возможных механизмов функционирования нейронной сети, включающей БГ, мозжечок, таламус и новую кору (Силькис, 2021).
Существенное влияние на функционирование нейронных сетей, включающих разные структуры, оказывает дофамин, выделяющийся в ответ на условный сигнал и на подкрепление и способствующий длительной модуляции эффективности синаптической передачи. Нами предложен возможный механизм участия дофамина в функционировании мозжечка (Силькис, 2021), гиппокампальной формации (Силькис, 2016) и цепей К-БГ-Т-К, вовлеченных в обработку зрительной и слуховой информации и выбор движения (Силькис, 2015; Silkis, 2001; Silkis, 2007).
Задачей настоящей работы являлся анализ возможных механизмов взаимозависимого функционирования структур в коннектомах, включающих неокортекс, гиппокамп, БГ, мозжечок, таламус, а также определение вклада дофамин-зависимой модуляции эффективности синаптической передачи в функционирование коннектомов.
ОРГАНИЗАЦИЯ МЕЖНЕЙРОННЫХ ВЗАИМОДЕЙСТВИЙ В КОННЕКТОМЕ, ВКЛЮЧАЮЩЕМ НЕОКОРТЕКС, ГИППОКАМП, БАЗАЛЬНЫЕ ГАНГЛИИ, МОЗЖЕЧОК, ТАЛАМУС И СВЯЗАННЫЕ С НИМИ СТРУКТУРЫ ЦНС
Существующие морфологические и электрофизиологические данные указывают на то, что гиппокамп может влиять на функционирование мозжечка через БГ, таламус и новую кору (рис. 1). Через эти же структуры нейроны глубоких ядер мозжечка (ГЯМ), которые являются выходными ядрами этой структуры, могут воздействовать на гиппокамп. Кроме того, нейроны ГЯМ могут влиять на активность гиппокампа через переключение в медиальной перегородке и/или супрамамиллярном ядре (Lu et al., 2020; Watson et al., 2019) (рис. 1). Проведенный нами ранее анализ механизмов влияния супрамамиллярного ядра на функционирование гиппокампа показал, что вход из этого ядра способствует передаче сигналов из зубчатой извилины через поле СА2 в поле СА1 (Силькис, Маркевич, 2020). Нейроны ГЯМ через таламус могут влиять на активность в поле СА1 гиппокампа, субикулюме, ретросплениальной коре и ринальной коре (Bohne et al., 2019). Входная структура гиппокампальной формации – зубчатая извилина – связана с ретросплениальной корой, ринальной корой и субикулюмом, которые моносинаптически связаны с вентролатеральным и латеродорзальным ядрами таламуса (Bohne et al., 2019) (рис. 1). В этих же таламических ядрах имеются проекции из ГЯМ (фастигиального, интерпозитус и латерального). Нейроны фастигиального ядра проецируются в латеродорзальное таламическое ядро (Bohne et al., 2019), которое иннервирует ретросплениальную и цингулярную области коры (Bezdudnaya, Keller, 2008) и таламическое ядро реуниенс (РЕ). Ядро РЕ моносинаптически возбуждает нейроны поля СА1 гиппокампа и реципрокно связано с префронтальной корой (ПфК) (McKenna,Vertes, 2004). Обнаружен и моносинаптический вход из вентральной части поля СА1 в медиальную ПфК (Binder et al., 2019), причем этот вход модифицируется. В нем могут индуцироваться длительная потенциация (ДП), длительная депрессия (ДД) и депотенциация (Laroche et al., 2000). Об эффективности влияния мозжечка на гиппокамп свидетельствуют полученные на животных данные о том, что электрическая стимуляция ГЯМ вызывает ответы в гиппокампе (Heath, Harper, 1974; Heath et al., 1978). При стимуляции фастигиального ядра мозжечка ответы с ЛП 6–8 мс и 16–29 мс наблюдали не только в гиппокампе, но и в медиальной перегородке (Snider, Maiti, 1976). К активации нейронов гиппокампа приводила и оптогенетическая активация моторной области коры мозжечка (Choe et al., 2018).
Рис. 1.
Схема организации связей между нейронами разных структур в коннектоме. Нейронные сети мозжечка, базальных ганглиев и гиппокампальной формации ограничены прямоугольниками из пунктирных линий. мПфК – медиальная префронтальная кора; РСК – ретросплениальная кора; ЭК – энторинальная кора; Суб. – субикулюм; СА1 и СА3 – поля гиппокампа; ЗИ – зубчатая извилина; БГв – вентральная часть базальных ганглиев; Прил. ядро – прилежащее ядро; БШв – внутренняя часть бледного шара; ВП – вентральный паллидум; ЧВр – ретикулярная часть черного вещества; СТЯ – субталамическое ядро; ППЯ – педункулопонтийное ядро; ЛД – латеродорзальное таламическое ядро; РЕ – таламическое ядро реуниенс; КЗ – клетки-зерна; КП – клетки Пуркинье; ГЯМ – глубокие ядра мозжечка; МВ – мшистые волокна; ПВ – параллельные волокна; ЯМ – ядра моста; ВПП – вентральное поле покрышки; КЯ – красное ядро; МП – медиальная перегородка; СМЯ – супрамамиллярное ядро; ДА – дофамин. Линии, оканчивающиеся белыми и черными кружками – возбудительные и тормозные входы соответственно; линии с открытыми стрелками – холинергические входы. Интернейроны не представлены с целью упрощения.
Fig. 1. A scheme of the organization of connections between neurons of different structures in the connectome. The neural networks of the cerebellum, basal ganglia, and hippocampal formation are bounded by dashed rectangles. mPfC (мПфК), medial prefrontal cortex; RSC (РСК), retrosplenial cortex; EC (ЭК), entorhinal cortex; Sub. (Суб.), subiculum; СА1 and СА3, hippocampal fields; FD (ЗИ), fascia dentata; BGv (БГв), ventral part of the basal ganglia; NAcc (Прил. ядро), nucleus accumbens; GPi (БШв), internal part of the globus pallidus; VP (ВП), ventral pallidum; SNr (ЧВр), substantia nigra pars reticulata; STN (СТЯ), subthalamic nucleus; PPN (ППЯ), pedunculopontine nucleus; LD (ЛД), laterodorsal thalamic nucleus; RE (РЕ), thalamic nucleus reuniens; GCs (КЗ), granule cells; PCs (КП), Purkinje cells; DCN (ГЯМ) – deep cerebellar nuclei; MFs (МВ), mossy fibers; PFs (ПВ), parallel fibers. PN (ЯМ), pontine nuclei; VTA (ВПП), ventral tegmental area; RN (КЯ), red nucleus; MS (МП), medial septum; SMN (СМЯ), supramammillary nucleus; DA (ДА), dopamine. Lines ending in white and black circles, excitatory and inhibitory inputs, respectively; open arrows, cholinergic inputs. To motoneurons (к мотонейронам). Interneurons are not presented for simplicity of scheme.
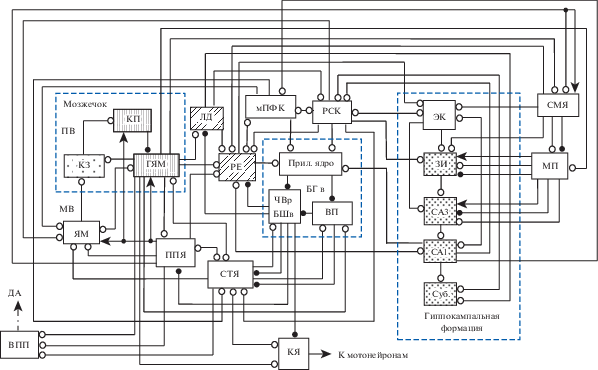
Одним из центров коннектома, по-видимому, является ретросплениальная кора, поскольку ее нейроны получают возбуждение из разных областей коры (цингулярной, дорзолатеральной, передней префронтальной, затылочной, парагиппокампальной, периринальной, энторинальной), субикулюма, пресубикулюма, парасубикулюма, а также из мозжечка через таламус (Kobayashi, Amaral, 2003) (рис. 1). В свою очередь, нейроны ретросплениальной коры, получающие разномодальную информацию (Li et al., 2018), иннервируют парагиппокампальную область коры, энторинальную кору, пре- и парасубикулюм, дорзомедиальный стриатум, ядро РЕ, ретикулярное таламическое ядро и мамиллярные тела (Kobayashi, Amaral, 2007; Van Groen, Wyss, 2003). Связи между ретросплениальной корой и гиппокампом организованы топографически (Miyashita, Rockland, 2007; Wyss, Van Groen, 1992). О тесных функциональных взаимодействиях между ретросплениальной корой и гиппокампом свидетельствуют данные о том, что повреждение ретросплениальной коры приводит к такому же дефициту обучения, как и удаление гиппокампа (Berger et al., 1986). Авторы указанной работы интерпретируют эти данные как поведенческое выражение связанных с обучением изменений в активности пирамидных клеток гиппокампа, в основе которых лежат мультисинаптические проекции из гиппокампа в ретросплениальную кору и, в конечном итоге, в мозжечок.
Сигналы из различных областей коры передаются в мозжечок через ядра моста (ЯМ), причем эти проекции организованы топографически (Chen et al,, 2014b; Kratochwil et al., 2017) (рис. 2). Кроме того, в ЯМ имеются входы из гипоталамуса (в частности, из супрамамиллярного ядра), вентральной части наружного коленчатого тела, верхнего двухолмия (Aas, 1989). Проекции из мамиллярных ядер образуют в ЯМ ограниченные области, где они частично конвергируют с проекциями из коры (Brodal, Bjaalie, 1992). Также в ЯМ поступает иннервация из педункулопонтийного ядра (ППЯ) (Mori, 2016) и субталамического ядра (СТЯ) (Jwair et al., 2017). Субталамическое ядро, реципрокно связанное с ППЯ (Hammond et al., 1983), через переключение в ППЯ может дисинаптически возбуждать клетки Пуркинье (КП) мозжечка (Jwair et al., 2017) (рис. 1). Кроме того, нейроны ППЯ могут моно- и полисинаптически возбуждать нейроны ГЯМ. Стимуляция ППЯ вызывала ответы с латентными периодами 1.5–2 мс и 13–15 мс в основном в зубчатом ядре, но также в ядрах фастигиальном и интерозитус (Vitale et al., 2016). В свою очередь, нейроны ГЯМ иннервируют клетки ППЯ. Этот вход образован аксонными коллатералями нейронов ГЯМ, которые поступают в таламус (Hazrati, Parent, 1992). Поскольку нейроны ППЯ иннервируют нейроны таламуса, в частности, ядро РЕ (McKenna, Vertes, 2004), ППЯ и СТЯ (опосредованно через ППЯ) могут влиять на функционирование гиппокампа и БГ (см. рис. 1). Полагают, что ППЯ является интерфейсом между БГ и мозжечком (Mori et al., 2016). Влияние ППЯ на таламические ядра является сильным. Так, показано, что в отсутствие тормозного влияния со стороны БГ ППЯ возбуждает нейроны парафасцикулярного ядра таламуса независимо от наличия возбуждения из мозжечка (Capozzo et al., 2003). Следует отметить, что в ППЯ имеется значительное число холинергических клеток, поэтому эффективность входов к клеткам-мишеням ППЯ модулируется ацетилхолином.
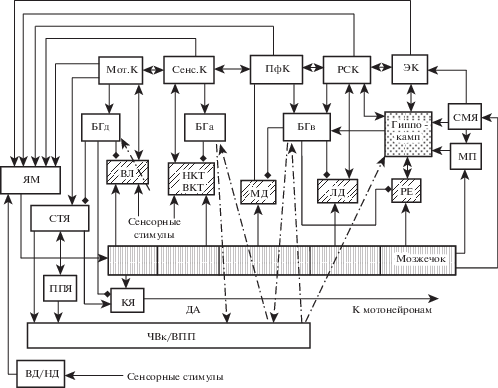
Рис. 2.
Топографическая организация нейронных цепей в глобальном коннектоме, состоящем из коннектомов, которые участвуют в обработке моторной, сенсорной и лимбической информации. Каждый коннектом включает область неокортекса, связанное с ней ядро таламуса и соответствующие участки мозжечка, базальных ганглиев, субталамического ядра, ядер моста, а также других структур. Во все коннектомы поступает дофамин. Мот.К и Сенс.К – моторная и сенсорные зоны коры соответственно; БГа и БГд – ассоциативная и дорзальная части базальных ганглиев соответственно; ВЛ и МД – вентролатеральное и медиодорзальное ядра таламуса соответственно; НКТ и ВКТ – наружное и внутреннее коленчатое тело соответственно; ВД и НД – верхнее и нижнее двухолмие соответственно. Линии, заканчивающиеся стрелками и ромбами – возбудительные и тормозные связи соответственно. Остальные обозначения как на рис. 1.
Fig. 2. Topographic organization of neural circuits in the global connectome, consisting of connectomes that are involved in the processing of motor, sensory and limbic information. Each connectome includes a neocortical area, connected with it thalamic nucleus, the corresponding regions of the cerebellum, basal ganglia, subthalamic nucleus, and pontine nucleus as well as other structures. Mot.C and Sens.C (Мот.К and Сенс.К), motor and sensory cortical areas, respectively; BGv and BGd (БГа and БГд), associative and dorsal parts of the basal ganglia, respectively;SNc (ЧВк), substantia nigra pars compacta; VL and MDN (ВЛ and МДЯ), ventrolateral and mediodorsal thalamic nuclei, respectively; LGB and MGB (НКТ and ВКТ), lateral and medial geniculate body, respectively; SC and IC (ВД and НД), superior and inferior colliculus, respectively. Lines ending with arrows and rhombuses, excitatory and inhibitory inputs, respectively. The other abbreviations are as in the Fig. 1.
Субталамическое ядро также является одним из важных центров в коннектоме, так как в нем имеются ипсилатеральные входы из разных областей коры (инфраламинарной, цингулярной, фронтальной, пириформной, первичной моторной, первичной сенсорной, инсулярной и ретросплениальной), из БГ (бледного шара, вентрального паллидума, хвостатого ядра стриатума, скорлупы стриатума, прилежащего ядра), из ГЯМ (латерального, переднего промежуточного). Кроме того, в СТЯ имеются билатеральные входы из миндалины, гипоталамуса (включая мамиллярные ядра), ретикулярного ядра таламуса, верхнего двухолмия, черного вещества (выходного ядра БГ) и красного ядра (Cavdar et al., 2018) (рис. 1). Связи СТЯ с мозжечком обнаружены и в мозге человека (Wang et al., 2020). Проекции из новой коры в СТЯ организованы топографически, хотя имеется и конвергенция между входами в СТЯ из разных областей коры (Accolla et al., 2016; Haynes, Haber, 2013). С височными структурами, включая гиппокамп и миндалину, преимущественно связана более вентральная часть СТЯ. Поскольку СТЯ возбуждает различные ядра БГ, выключая выходные, гиперпрямой путь из новой коры в СТЯ может усилить эффективность торможения клеток-мишеней БГ. Приведенные данные указывают на то, что СТЯ играет существенную роль в функционировании коннектома.
Влияние мозжечка на функционирование БГ реализуется, в частности, через таламо-стриатный вход, который усиливает действие кортико-стриатного входа (Johnson et al., 2017) и способствует индукции ДП на кортико-стриатном входе (Chen et al., 2014a). Из механизма функционирования БГ (Silkis, 2001) следует, что это должно облегчать синергичное растормаживание нейронов СТЯ и ППЯ со стороны БГ (рис. 1). Поскольку нейроны СТЯ и ППЯ возбуждают дофаминергические клетки вентрального поля покрышки и компактной части черного вещества (рис. 2), активность последних в таком случае должна возрасти. Кроме того, мозжечок может влиять на выделение дофамина непосредственно, поскольку имеются прямые возбуждающие проекции из ГЯМ в дофаминергические структуры (Carta et al., 2019) (рис. 1). Стимуляция входа из ГЯМ в вентральное поле покрышки приводила к усилению активности дофаминергических клеток (Carta et al., 2019) и увеличению выделения дофамина в медиальной ПфК (Rogers et al., 2011). Важно отметить, что активность нейронов ГЯМ зависит от торможения со стороны КП (рис. 1). О влиянии КП на выделение дофамина свидетельствуют данные о том, что у мутантных мышей с отсутствием КП выделение дофамина в медиальной ПфК уменьшалось (Rogers et al., 2013).
ВСЕОБЪЕМЛЮЩИЙ КОННЕКТОМ КАК ГЛОБАЛЬНАЯ НЕЙРОННАЯ СЕТЬ, СОСТОЯЩАЯ ИЗ ВЗАИМОСВЯЗАННЫХ ТОПОГРАФИЧЕСКИ ОРГАНИЗОВАННЫХ КОННЕКТОМОВ, ФУНКЦИОНИРУЮЩИХ СХОДНЫМ ОБРАЗОМ
С учетом данных о топографической организации связей между неокортексом, гиппокампом, БГ, мозжечком, таламусом и СТЯ, а также с другими связанными с ними ядрами и структурами ЦНС, мы полагаем, что всеобъемлющий коннектом, в который входят все структуры ЦНС, представляет собой глобальную нейронную сеть, состоящую из взаимосвязанных коннектомов, которые организованы сходным образом, и механизмы функционирования которых также сходны. Каждый из коннектомов включает одну из областей коры, связанное с ней таламическое ядро, соответствующие участки БГ, ЯМ, ГЯМ, СТЯ, а также других ядер и структур ЦНС (рис. 2). В настоящей работе, кроме указанных выше структур, в коннектоме представлены только ППЯ, супрамаммилярное ядро гипоталамуса, красное ядро, медиальная перегородка, верхнее и нижнее двухолмия, вентральное поле покрышки и компактная часть черного вещества.
Коннектомы, участвующие в обработке сенсорной информации, включают сенсорные области коры и связанные с ними части других структур. Сенсорная информация поступает в таламические ядра, от них в сенсорные области коры, а затем в мозжечок, поскольку нейроны коры иннервируют ЯМ. Кроме того, сенсорная информация поступает в ЯМ через верхнее и нижнее двухолмия (рис. 2). Показано, что сенсорные входы в мозжечок организованы топографически. Так, ретинотопические области в мозжечке связаны с соответствующими ретинотопическими областями в неокортексе (van Es et al., 2019). Возбуждение из нижнего двухолмия (являющегося частью слухового пути) поступает в латеральную часть ЯМ (Freeman et al., 2007). О существенном вкладе сенсорного входа в мозжечок в функционирование всеобъемлющего коннектома свидетельствуют данные о том, что повреждение входа в ЯМ из экстрастриатных зрительных областей коры приводило к зрительно-моторным нарушениям (Glickstein, 1997). При выработке глазодвигательной реакции на предъявление условного звукового стимула изменения в нейронной активности, коррелирующие с выработкой рефлекса, происходили в мозжечке раньше, чем во внутреннем коленчатом теле (проекционном ядре слухового пути) (Halverson et al., 2010). Затухание рефлекса приводило к ослаблению активности и в мозжечке, и в таламическом ядре (Halverson et al., 2010).
С учетом топографической организации сенсорных путей можно полагать, что в тех специализированных коннектомах, которые включают проекционные сенсорные области коры, происходит обработка отдельных характеристик сенсорного стимула (зрительного, слухового, сенсомоторного). В коннектомах, включающих высшие сенсорные области коры, обрабатывается информация о суммарных характеристиках сенсорных стимулов каждой модальности. Ранее нами было указано на то, что значительную роль в обработке зрительной и слуховой информации играют цепи К-БГ-Т-К (Silkis, 2007; Силькис, 2015). Эти цепи являются частями специализированных коннектомов (см. рис. 2). Согласно предложенному нами механизму функционирования цепи К-БГ-Т-К, дофамин, выделяющийся в БГ в ответ на стимул, способствует таким пластическим перестройкам синаптической передачи между разными элементами цепи, которые приводят к формированию в соответствующей области коры нейронных отображений сенсорного стимула (зрительного или слухового) (Silkis, 2007; Силькис, 2015).
От нейронных отображений сенсорных стимулов в различных областях коры сигналы через энторинальную кору поступают в гиппокамп. По мере их продвижения из зубчатой извилины в поле СА1 гиппокампа в разных его полях формируются последовательно усложняющиеся нейронные отображения ассоциаций “объект-место” (Силькис, 2010). Такой характер совместной обработки разномодальной информации в коннектоме, включающем гиппокампальную формацию, позволяет рассматривать его как коннектом более высокого порядка. Предположение, что гиппокамп является ключевым центром во всеобъемлющем коннектоме, было сделано ранее на основании исследований динамики взаимодействий гиппокампа с другими структурами (Mišić et al., 2014).
Ранее нами указано на то, что механизмы функционирования моторных и сенсорных цепей К-БГ-Т-К однотипны. Поэтому выделение дофамина в дорзальной части БГ способствует увеличению активности нейронного паттерна в моторной коре, который определяет выбор двигательной активности в ответ на сенсорный стимул (Silkis, 2001) (рис. 2). Не исключено, что с выполнением разных движений связаны коннектомы, включающие различные участки моторных областей коры. Важную роль в функционировании коннектомов, включающих моторные области коры, таламуса и БГ, играет мозжечок. Нейроны ГЯМ влияют на активность красного ядра, иннервирующего мотонейроны и премоторные нейроны в стволе мозга и спинном мозге (Cacciola et al., 2019) (рис. 1). Ядро интерпозитус топографически связано с магноцеллюлярной частью красного ядра, входящей в руброспинальную систему, а зубчатое ядро связано с парвоцеллюлярной частью, входящей в оливо-церебеллярную систему (Basile et al. 2021; Cacciola et al., 2019). На одних и тех же нейронах магноцеллюлярной части красного ядра входы из ядер зубчатого и интерпозитус конвергируют с входами из БГ (Pong et al., 2008). Также на активность магноцеллюлярной части красного ядра влияет вход из СТЯ (Ricardo, 1980) (рис. 2). Обе части красного ядра сильно взаимодействуют между собой и играют существенную роль не только в моторном, но и не моторном поведении (Basile et al., 2021). О взаимозависимом функционировании структур в коннектоме, включающем моторную кору, свидетельствуют данные о том, что во время концентрации внимания на подготовке к движению увеличивалась активность в цепи мозжечок – таламус – дополнительная моторная кора – хвостатое ядро стриатума – таламус – первичная моторная кора (Belkhiria et al., 2019).
Следует отметить, что для взаимодействия БГ с дофаминергическими структурами характерна спиральная организация. Поэтому изменения активности в лимбических цепях К-БГ-Т-К влияют на процессы в сенсорных цепях, а последние влияют на процессы в моторной цепи (Joel, Weiner, 2000). Исследования показали, что при выполнении поведенческих задач в активность последовательно вовлекаются разные части всеобъемлющего коннектома (Fermin et al., 2016). Вначале активируется цепь, включающая вентромедиальную ПфК, вентральный стриатум и заднюю часть мозжечка. По мере прогресса обучения активируется ассоциативная когнитивная цепь, включающая дорзолатеральную ПфК, дорзомедиальный стриатум и латеральную заднюю часть мозжечка. Затем активность смещается в моторную цепь, которая включает дополнительную моторную область коры, скорлупу стриатума и переднюю часть мозжечка (Bostan, Strick, 2018). Таким образом, обработка поступающей информации, выбор команды для целенаправленного поведения и его осуществления являются результатом функционирования всех частей коннектома.
Поскольку каждый из коннектомов является замкнутой цепью (см. рис. 2), сигналы, поступающие в какую-либо область коры, после процесса обработки в эту же область и возвращаются. Благодаря этому, в коннектоме функционируют циклы ауто-отождествления, которые, согласно выдвинутой в работе (Сергин, 2016) гипотезе, обеспечивают сенсорное осознание. При этом предполагается, что осознание какой-либо одной характеристики сенсорного стимула может происходить только в той области коры, которая отображает эту характеристику (Сергин, 2016). По аналогии можно полагать, что осознание обобщенных характеристик стимула одной модальности происходит вследствие процессов ауто-отождествления в коннектоме, включающем высшую область сенсорной коры данной модальности. Совместное осознание события, состоящего из разномодальных стимулов, происходит, по-видимому, одновременно во многих коннектомах, среди которых и коннектом, включающий гиппокамп. Коннектомы, участвующие в осознании стимулов, связаны с коннектомами, обеспечивающими выполнение движения (рис. 2), причем это могут быть реакции как на осознанные, так и не осознанные стимулы. Совокупность всех этих коннектомов образует всеобъемлющий коннектом, функционирование которого обеспечивает осознание события в целом и выбор адекватной реакции на это событие.
ВЛИЯНИЕ ДОФАМИНА НА ФУНКЦИОНИРОВАНИЕ РАЗНЫХ СТРУКТУР В КОННЕКТОМЕ
Дофамин играет важную роль в функционировании каждой структуры коннектома. При определении характера его влияния на синаптическую пластичность необходимо учитывать то обстоятельство, что воздействие дофамина на эффективность входа к клетке-мишени зависит от концентрации вещества, типов постсинаптических рецепторов на основной клетке и иннервирующем ее тормозном интернейроне, а также от соотношения “силы” возбуждения и торможения (Силькис, 2002). Поскольку рецепторы типов Д1/Д5 более чувствительны, чем Д2–Д4, для активации последних требуется большая концентрация дофамина. Так, показано, что при низких концентрациях дофамина преобладает его модулирующее действие на эффективность синаптической передачи через Д1/Д5-рецепторы, а при высоких концентрациях – через Д2-рецепторы (Xu et al., 2010).
Из проведенного ранее анализа механизмов влияния дофамина на функционирование гиппокампа и формирование в разных его полях нейронных отображений ассоциаций “объект-место” следует, что дофамин улучшает условия формирования этих отображений на пирамидных клетках поля СА1 и что это отображение меньше искажается не относящейся к нему информацией, поступающей из энторинальной коры и таламуса (Силькис, 2016). Анализ влияния дофамина на функционирование нейронной цепи К–БГ–Т–К показал, что активация Д1- и Д2-рецепторов на шипиковые клетки стриатума способствует растормаживанию со стороны выходных ядер БГ их клеток-мишеней в таламусе, СТЯ и ППЯ (Silkis, 2001). Дофамин может модулировать эффективность возбуждения таламических нейронов и непосредственно, поскольку дофаминергическая иннервация поступает в таламические ядра. Например, дофаминергические волокна из вентрального поля покрышки имеются в ядрах РЕ и медиодорзальном (Melchitzky, Lewis, 2001; McKenna, Vertes, 2004). Судя по известным экспериментальным данным, правила модификации и модуляции эффективности входов к нейронам таламуса и СТЯ такие же, какие были сформулированы для нейронов гиппокампа и новой коры (Силькис, 2002). Так, показано, что активация Д1/Д5-рецепторов приводит к увеличению деполяризации большинства нейронов наружного коленчатого тела и к усилению активности нейронов СТЯ (Baufreton et al., 2003; Govindaiah, Cox, 2005). К увеличению активности ядра РЕ и других таламических ядер средней линии приводило также использование антагонистов Д2-рецепторов (Cohen et al., 1998).
Ранее нами было указано на то, что модификация возбудительных и тормозных синаптических входов к разным типам нейронов мозжечка происходит одновременно и взаимозависимо (Silkis, 2000). Из предложенного в работе (Силькис, 2021) механизма влияния дофамина на функционирование нейронной сети мозжечка следует, что если вход от ЯМ к клеткам-зернам коры мозжечка первоначально не являлся сильным и если на нейроны ГЯМ поступало достаточно сильное торможение от КП, так что постсинаптическая концентрация Са2+ в нейронах ГЯМ относительно невелика, активация Д1-рецепторов может способствовать индукции ДП на входе от ЯМ к клеткам-зернам и к нейронам ГЯМ, что приведет к увеличению активности этих клеток. В результате увеличится возбуждающее влияние нейронов ГЯМ на таламус, а через него на новую кору, гиппокамп и БГ.
Следует отметить, что предложенные механизмы функционирования цепи К-БГ-Т-К и нейронной сети мозжечка отличаются от общепринятых, поскольку базируются на других правилах модификации и модуляции эффективности входов к нейронам стриатума, ГЯМ и к КП (Silkis, 2000; Silkis, 2001). В общепринятых моделях цепь К–БГ–Т–К функционирует таким образом, что выделение дофамина в стриатуме и активация Д1-рецепторов облегчают прохождение сигналов через прямой путь в БГ. В результате усиливается активность нейронного паттерна в моторной коре, что приводит к выполнению определенного движения. Активация Д2-рецепторов приводит к ингибированию движения через непрямой путь в БГ (Gurney et al., 2001). Из предложенного нами механизма следует, что обработка информации в цепи К-БГ-Т-К зависит от того, является ли кортико-стриатный вход сильным или слабым. В результате одновременной активации Д1- и Д2-рецепторов и прохождения сигналов по прямому и непрямому пути через БГ синергично увеличивается активность первоначально сильно активированных нейронных паттернов в новой коре и одновременно ослабляется активность остальных нейронов (Silkis, 2001). В настоящее время именно такой механизм получил подтверждение в экспериментах, показавших, что при выполнении движения активируются и стрионигральные нейроны, на которых располагаются Д1-рецепторы и которые дают начало прямому пути через БГ, и стриопаллидарные нейроны, на которых располагаются Д2-рецепторы и которые дают начало непрямому пути через БГ (Cui et al., 2013; Tecuapetla et al., 2016).
В общепринятых моделях до настоящего времени предполагается, что сигнал из ГЯМ максимален, когда на КП индуцируется ДД, причем необходимым условием этого является сильное возбуждение КП нейронами нижней оливы (Ito, Karachot, 1992). Из предложенного нами механизма функционирования мозжечка следует, что выходной сигнал из ГЯМ является максимальным, когда на входе от ЯМ к нейронам ГЯМ индуцируется ДП. Необходимым условием для этого является индукция ДП на входе от клеток-зерен к КП и возрастание вследствие этого активности КП (Silkis, 2000). В пользу предложенного нами механизма свидетельствуют данные о том, что при выработке рефлекса потенциируется простая спайковая активность КП (Romano et al., 2018). Такая активность характерна для КП в отсутствие сигналов из нижней оливы. Более того, после блокады ДП на КП двигательное обучение нарушалось (Schonewille et al., 2011).
ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ ВСЕОБЪЕМЛЮЩЕГО КОННЕКТОМА В ПАССИВНОМ РЕЖИМЕ РАБОТЫ МОЗГА (ГИПОТЕЗА)
Функциональные связи в нейронной сети пассивного режима работы мозга (СПРРМ), называемой в англоязычной литературе сетью оперативного покоя (default mode network, DMN) или сетью состояния покоя (resting state network), изучают в течение последних 20 лет (Raichle, 2015). Обычно в СПРРМ включают вентромедиальную и дорзолатеральную области ПфК, заднюю часть поясной извилины, предклинье, латеральную часть теменной коры и энторинальную кору (Raichle, 2015). Принято считать, что эта сеть активна в состоянии, когда человек не занят выполнением какой-либо задачи, связанной с внешним миром, а отдыхает, погружен в себя, грезит наяву, вспоминает прошедшие события или планирует будущие действия. Ранее полагали, что во время выполнения целенаправленных поведенческих задач эта сеть отключается, но ее активность возрастает при выполнении задач, связанных с личностными проблемами и воспоминаниями. Однако к настоящему времени получены доказательства того, что активность в этой сети необходима для рабочей памяти. Выявлена динамическая реконфигурация СПРРМ при ее взаимодействии с другими сетями (Vatansever et al., 2015). Например, при выполнении задач на рабочую память существенно меняются связи билатеральных угловых извилин (одной из основных структур СПРРМ) с другими структурами (Vatansever et al., 2017). Показано также, что в состоянии покоя при решении когнитивных задач, не связанных с внешними событиями, задняя поясная извилина сильнее связана с вентромедиальными частями стриатума и бледного шара, т.е. с входным и выходным ядрами БГ (Vatansever et al., 2016). Авторы указанной работы предположили, что эти связи способствуют когнитивной гибкости. В состоянии покоя выявлены сильные структурные и функциональные связи СПРРМ с предклиньем и таламусом, сильные связи таламуса с гиппокампом, а также сильные связи предклинья с таламусом и угловыми извилинами (Cunningham et al., 2017). Обычно в состоянии покоя СПРРМ и сеть, участвующая в решении поведенческих задач, связаны между собой негативно и вариабельно, но между ними имеются комплексные модуляторные взаимодействия. Показано, что на связи между этими сетями влияют такие критически важные структуры мозга, как БГ и таламус (Di, Biswal, 2014). Предшествующие исследования показали, что многие области СПРРМ вовлечены в процессы направленности внимания, причем субъекты со слабой функциональной связью между таламусом и задней поясной корой более внимательны к настоящему (Wang et al., 2014) (по-видимому, потому, что не отвлекаются на внутренние процессы). Авторы работы (Wang et al., 2014) предположили, что таламус можно рассматривать как переключатель между вниманием и невниманием. С учетом приведенных выше данных мы полагаем, что СПРРМ является частью всеобъемлющего коннектома, который функционирует в таких режимах, как пассивное бодрствование, медитация, сон, галлюцинации. В режиме покоя решаются задачи, связанные с воображением образов, обдумыванием и оценкой личностных прошедших и/или будущих событий, решением научных проблем или мысленным созданием каких-либо новых произведений в области искусства и литературы. При переходе из одного функционального состояния в другое в отдельных коннектомах происходит переключение режима обработки внешней информации на режим обработки внутренней информации. Это предположение базируется на следующих фактах. Во-первых, активность взаимосвязанных высших областей коры (которые, как полагают, образуют СПРРМ) зависит от возбуждения, поступающего к ним из высших сенсорных зон коры, причем последние должны быть активны, чтобы воспоминания были возможны. Показано, что рабочая память требует реактивации сенсорных областей коры (Hayden, Gallant, 2013). При формировании кратковременной памяти на запоминание определенной характеристики зрительного стимула активность нейронов в зрительном поле V4 синхронизируется с активностью ПфК (Liebe, et al., 2012). Во-вторых, энторинальная кора не может функционировать независимо от гиппокампа. В-третьих, все области коры не могут функционировать независимо от входов из топографически связанных с ними таламических ядер, от которых они получают возбуждение. В-четвертых, таламические ядра не могут функционировать независимо от БГ, поскольку их активность зависит от торможения со стороны выходных ядер БГ и поскольку нейроны таламуса возбуждают нейроны стриатума. Мы полагаем, что таламические ядра, которые реципрокно связаны с соответствующими областями новой коры, являются важными звеньями переключения работы мозга.
Согласно современным представлениям, активность СПРРМ лежит в основе сновидений и гипнотического сна (Fazekas, Nemeth, 2020). С нашей точки зрения, при сновидениях СПРРМ активируется совместно с гиппокампом, различными зрительными областями коры, таламическими ядрами, БГ и другими структурами. Ранее нами было указано на то, что во время сновидений в парадоксальной фазе сна, когда поток внешней зрительной информации не может проходить через наружное коленчатое тело в первичное зрительное поле V1, в сетях К-БГ-Т-К, включающих разные зрительные области коры, циркулируют сигналы, поступающие в наружное коленчатое тело и другие таламические ядра из внутренних источников (Силькис, 2006). Таким образом, переключение с восприятия внешних зрительных стимулов на сновидения происходит в коннектомах, участвующих в обработке разных свойств зрительных образов. При этом в коннектоме, включающем гиппокамп, также происходят изменения. В частности, депрессируется эффективность передачи в полисинаптическом пути через гиппокамп, но облегчается его связь с энторинальной корой. Вследствие этого сновидения и носят причудливый характер (Силькис, 2006). Согласно выдвинутой нами ранее гипотезе, в основе появления ночных кошмаров лежит вызванное стрессом изменение влияния базолатерального ядра миндалины на модификацию эффективности синаптических связей во всеобъемлющем коннектоме, включающем ПфК, зрительные области коры, гиппокамп, связанные с ними ядра таламуса, БГ и других структур (Силькис, 2019). Нами предположено также, что при галлюцинациях в состоянии бодрствования активность в зрительных коннектомах запускается благодаря измененному составу нейромодуляторов по сравнению с составом в норме (Силькис, 2005). Галлюцинации в виде осознанных зрительных образов являются результатом селекции сигналов, циркулирующих в нескольких замкнутых взаимосвязанных цепях К-БГ-Т-К, каждая из которых включает одну из зрительных областей коры, ПфК, одно из связанных с этой областью коры таламических ядер, а также соответствующую область в БГ, верхнем двухолмии и педункулопонтийном ядре.
Выдвинутые нами гипотезы опираются на данные о том, что в отсутствие входов из сетчатки, в возникновении различных зрительных образов, таких как сновидения, галлюцинации, воображаемые картины, участвуют не только высшие зрительные области коры, но и первичная зрительная кора V1 (Stoerig et al., 2001). При этом для активации поля V1 достаточно возвратных путей из экстрастриатных областей (Stoerig et al., 2001), а характер зрительных галлюцинаций зависит от того, какие зрительные области коры активируются (Santhouse et al., 2000). Отмечено, что активация нейронов области V1 необходима, но недостаточна для возникновения зрительного ощущения, для которого требуется взаимодействие зрительной коры, лобных областей коры и гиппокампа (Crick, Koch, 1995).
Согласно гипотезе, выдвинутой в работе (Onofrj et al., 2013), в основе появления зрительных галлюцинаций лежат нарушения функционального баланса между дорзальной и вентральной сетями внимания, а также продолжающаяся активность СПРРМ во время выполнения активных задач, хотя обычно активность этой сети ингибируется при наличии внимания. Показано, что субъекты со слабой функциональной связью между таламусом и задней поясной корой более внимательны к настоящему (Wang et al., 2014). Авторы указанной работы предположили, что таламус можно рассматривать как переключатель между вниманием и отсутствием внимания. Это согласуется с нашей гипотезой, поскольку при слабой функциональной связи между таламусом и СПРРМ в состоянии активного бодрствования создаются более благоприятные условия для обработки внешней информации, причем направленность произвольного и непроизвольного внимания к стимулу является частью обработки (Silkis, 2007).
ИЗМЕНЕНИЯ ФУНКЦИОНИРОВАНИЯ КОННЕКТОМА ПРИ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ
В силу взаимодействий между структурами в коннектоме, изменения активности в какой-либо одной структуре могут приводить к изменениям функционирования других. Из предлагаемого в настоящей работе механизма следует, что при выделении дофамина в стриатуме должно уменьшиться тормозное действие со стороны БГ на нейроны красного ядра (см. рис. 1), а при недостатке дофамина торможение красного ядра должно возрасти. Вызванные дефицитом дофамина изменения активности той части красного ядра, которая участвует в контроле движений головы и лица, приводили к таким симптомам, как шейная дистония и паркинсоническое лицо (Pong et al., 2008). При болезни Паркинсона меняется активность не только БГ, но и мозжечка (Mirdamadi, 2016). Перестройки в мозжечке могут быть вызваны снижением концентрации дофамина, использованием дофаминергических препаратов, изменением влияния со стороны БГ (Wu, Hallett, 2013; Wichmann, 2019). Показано, что изменения взаимодействий между БГ и мозжечком приводят к двигательным расстройствам (Quartarone et al., 2020). С изменениями функционирования мозжечка связывают такие симптомы болезни Паркинсона, как нарушение походки, акинезия, ригидность, тремор, дискинезия (Wu, Hallett, 2013).
Исследование коннектома человека показало, что стимуляция СТЯ (которую часто используют для лечения болезни Паркинсона) усиливает взаимодействие между моторными областями новой коры и таламуса, но уменьшает влияние БГ на активность мозжечка (Horn et al., 2019). Судя по проведенному в настоящей работе анализу, стимуляция ППЯ должна привести к изменению активности и в СТЯ, и в мозжечке (см. рис. 2). Примечательно, что мозжечок может способствовать не только усилению, но и ослаблению некоторых симптомов болезни Паркинсона, поскольку нейроны ГЯМ возбуждают СТЯ и ППЯ. Если стимуляция СТЯ уменьшает тормозное влияние на мозжечок со стороны БГ, как это показано в работе (Horn et al., 2019), то активность нейронов ГЯМ должна возрасти. Это должно усилить эффект от стимуляции СТЯ. Для облегчения замирания походки и снижения постуральной нестабильности у пациентов с запущенной формой болезни Паркинсона используют стимуляцию ППЯ (Mori et al., 2016).
Исследование нарушений функционирования коннектома человека с помощью повреждений разных структур, которые могли бы быть связаны с возникновением тремора Холмса, позволило показать, что этот синдром вызван изменениями в сети, включающей красное ядро, бледный шар, таламус и мозжечок (Joutsa et al., 2019). На этом основании авторы указанной работы заключили, что стимуляция СТЯ, обычно используемая для лечения тремора Холмса, вряд ли может быть полезной, так как СТЯ непосредственно не относится к этой сети, тогда как бледный шар относится.
Предполагают, что при болезни Паркинсона изменения активности в стриато-таламо-кортикальной цепи компенсируются интактной таламо-рубро-мозжечковой цепью и увеличением размера красного ядра (Philippens et al., 2019). Компенсаторная роль мозжечка при болезни Паркинсона проявлялась в ослаблении как некоторых моторных, так и не моторных симптомов, поэтому его рассматривают как потенциальную структуру для воздействия при лечении этого заболевания (Wu, Hallett, 2013; Meoni et al., 2020).
Дефицит дофамина приводит к изменениям и в гиппокампе. Так, при болезни Паркинсона меньше, чем в норме, толщина клеточного слоя в поле СА1 (La et al., 2019), уменьшен объем всего гиппокампа и нарушен нейрогенез (Lim et al., 2018). Кроме того, меняются связи гиппокампа с энторинальной корой, медиальной перегородкой и дофаминергическими структурами (Jeon et al., 2018). С аномальным функционированием гиппокампа при болезни Паркинсона связывают ухудшение памяти узнавания (Das et al., 2019) и депрессию (Lim et al., 2018). Однако системное использование дофаминергических препаратов для лечения болезни Паркинсона должно воздействовать и на гиппокамп. Из проведенного анализа следует, что дофамин может улучшить условия для формирования на нейронах гиппокампа отображений ассоциаций “объект-место”. В согласии с этим заключением на мутантных мышах, на которых моделировали болезнь Паркинсона, показали, что активация Д1/Д5-рецепторов, способствующая индукции ДП в гиппокампе, ослабляет когнитивный дефицит (Costa et al., 2012).
При различных неврологических заболеваниях меняется и эффективность связей в СПРРМ. Например, показано, что при БП снижается функциональная связь между задней поясной извилиной и медиальной височной долей (Lucas-Jiménez et al., 2016). Более низкая функциональная связь в СПРРМ коррелировала с более низкой вербальной и зрительной памятью при БП. Снижение связей между областями в СПРРМ коррелировало со снижением когнитивных способностей.
Различные изменения взаимодействий структур в коннектоме человека ассоциируют с разными неврологическими заболеваниями. Например, депрессию ассоциируют с чрезмерной функциональной связью мозжечка с вентромедиальной ПфК и передней цингулярной корой, тогда как когнитивные нарушения соотносят с отсутствием функциональной связи мозжечка с дорзолатеральной ПфК и задней цингулярной корой (Yin et al., 2015). При обсессивно-компульсивном расстройстве наблюдаются изменения связей между мозжечком, таламусом и неокортексом. В частности, увеличены по сравнению с контролем связи между мозжечком, моторными и соматомоторными областями, а также связи между левой частью хвостатого ядра стриатума и дорзолатеральной ПфК в обоих полушариях, причем чем сильнее связи, тем больше выражены симптомы (Sha et al., 2020a; Sha et al., 2020b).
Изменения в функционировании коннектома человека наблюдались и при нарушениях восприятия сенсорной информации. Так, при длительной унилатеральной потере слуха выявлены ослабление одних связей и усиление других в сенсорных областях коры, подкорковых цепях и мозжечке, причем эти изменения коррелировали с длительностью заболевания и степенью поражения слуха (Zhang et al, 2018). Так, было показано, что при билатеральной потере слуха не только снижается активность в слуховых областях коры, но и ослабляются связи мозжечка с рядом областей таламуса и коры, а также взаимодействия между разными участками мозжечка (Xu et al., 2019). Не исключено, что этот эффект связан с ослаблением слуховой иннервации мозжечка. Различные нарушения восприятия у пациентов с шизофренией и аутизмом также связывают с изменением функционирования мозжечка (Baumann et al., 2015).
ЗАКЛЮЧЕНИЕ
Проведенный анализ механизмов взаимодействий разных структур мозга в отдельных коннектомах представляет интерес для понимания его функционирования как всеобъемлющего коннектома, в котором происходит обработка поступающей разномодальной информации, ее осознание как целостного события и выбор необходимой поведенческой реакции. С нашей точки зрения, такой всеобъемлющий коннектом удовлетворяет некоторым требованиям, предъявляемым для когнитома – термина, предложенного в работе (Анохин, 2021) для обозначения совокупности познавательных способностей мозга. Предполагается, что когнитом представляет собой глобальную нейронную сеть, состоящую из нейронных групп со специфическими когнитивными свойствами (Анохин, 2021). В дальнейшем предполагается включить в анализируемый всеобъемлющий коннектом миндалину. Благодаря связям с различными структурами миндалина может влиять на функционирование коннектомов и поведенческие реакции. Например, показано, что инактивация центрального ядра миндалины, которое связано с мозжечком через ЯМ, ухудшает выработку мигательного рефлекса (Farley et al., 2018). Ослабление по сравнению с нормой связи миндалины с медиальной ПфК может привести к шизофрении (Mukherjee et al., 2016). Вследствие конвергенции входов из миндалины, ПфК и гиппокампа на нейронах прилежащего ядра миндалина влияет на функционирование лимбических нейронных сетей К–БГ–Т–К (Силькис, 2014). Проведенный в указанной работе анализ показал, что повреждение входов в прилежащее ядро из разных структур должно приводить к различным нарушениям поведения.
Также предполагается провести анализ влияний разных нейромодуляторов на функционирование всеобъемлющего коннектома. Например, известно, что выделяемые при стрессе глюкокортикоиды влияют на активность гиппокампа, инсулы и дорзального стриатума, от которых зависят разные формы памяти (Schwabe, 2017). Кроме того, острый стресс приводит к изменениям связей миндалины с гиппокампом, ПфК и дорзальным стриатумом, что создает условия для перехода от когнитивного контроля за обучением и памятью к более рефлексивным “привычным” процессам, позволяющим справиться с внешними угрозами (Schwabe, 2017). Нарушения функционирования холинергической и серотонинергической систем ассоциируют с различными симптомами болезни Альцгеймера. Исследование коннектома человека показало, что ингибитор ацетилхолинестеразы приводит к изменениям в сети мозжечка, а также влияет на связи мозжечка с таламусом (Klaassens et al., 2019).
Мы полагаем, что не только обнаружение межнейронных взаимодействий в коннектоме человека и выявление изменений их эффективности, но и понимание механизмов, лежащих в основе пластических перестроек эффективности связей между нейронами в коннектомах, необходимы для оценки используемых в настоящее время терапевтических методов лечения различных неврологических заболеваний и облегчения целенаправленного поиска новых методов лечения.
Список литературы
Анохин К.В. Когнитом: в поисках фундаментальной нейронаучной теории сознания. Журн. высш. нервн. деят. им. И.П. Павлова. 2021. 71 (1): 39–71. https://doi.org/10.31857/S0044467721010032
Сергин В.Я. Авто-отождествление паттернов нейронной активности как физиологический механизм осознания. Журн. высш. нерв. деят. им. И.П. Павлова. 2016. 66 (3): 259–278. https://doi.org/10.7868/S0044467716020076
Силькис И.Г. Возможный механизм влияния нейромодуляторов и модифицируемого торможения на длительную потенциацию и депрессию возбудительных входов к основным нейронам гиппокампа. Журн. высш. нервн. деят. 2002. им. И.П. Павлова. 52 (4): 392–405.
Силькис И.Г. Роль базальных ганглиев в появлении зрительных галлюцинаций (Гипотетический механизм). Журн. высш. нервн. деят. им. И.П. Павлова. 2005. 55 (5): 592–607.
Силькис И.Г. Роль базальных ганглиев в появлении сновидений при парадоксальном сне (Гипотетический механизм). Журн. высш. нервн. деят. им. И.П. Павлова. 2006. 56 (1): 5–21.
Силькис И.Г. Преимущества иерархического обобщения и хранения отображений ассоциаций “объект-место” в полях гиппокампа (Гипотеза). Журн. высш. нервн. деят. им. И.П. Павлова. 2010. 61 (6): 645–663.
Силькис И.Г. Механизмы взаимозависимого влияния префронтальной коры, гиппокампа и миндалины на функционирование базальных ганглиев и выбор поведения. Журн. высш. нервн. деят. им. И.П. Павлова. 2014. 64 (1): 82–100. https://doi.org/10.7868/S0044467714010110
Силькис И.Г. О роли базальных ганглиев в обработке сложных звуковых стимулов и слуховом внимании. Успехи физиол. 2015. 46 (3): 76–92.
Силькис И.Г. Вклад дофамина в функционирование гиппокампа при пространственном обучении (гипотетический механизм). Нейрохимия 2016. 33 (1): 1–14. https://doi.org/10.7868/S1027813316010131
Силькис И.Г. Возможный механизм появления ночных кошмаров при посттравматическом стрессовом расстройстве и подходы к их предотвращению. Нейрохимия 2019. 36 (4): 275–291. https://doi.org/10.1134/S1027813319030129
Силькис И.Г., Маркевич В.А. Возможные механизмы влияния супрамамиллярного ядра на функционирование зубчатой извилины и поля СА2 гиппокампа (роль растормаживания). Нейрохимия. 2020. 37 (4): 328–337. https://doi.org/10.31857/S1027813320040111
Силькис И.Г. Влияние дофамина на взаимозависимое функционирование мозжечка, базальных ганглиев и новой коры (гипотетический механизм). Успехи физиол. наук. 2021. 52 (1): 49–63. https://doi.org/10.31857/S0301179821010094
Aas J.E. Subcortical projections to the pontine nuclei in the cat. J. Comp. Neurol. 1989. 282 (3): 331–354. https://doi.org/10.1002/cne.902820303
Accolla E.A., Herrojo Ruiz M., Horn A., Schneider G.H., Schmitz-Hübsch T., Draganski B., Kühn A.A. Brain networks modulated by subthalamic nucleus deep brain stimulation. Brain. 2016. 139 (Pt. 9): 2503–2515. https://doi.org/10.1093/brain/aww182
Basile G.A., Quartu M., Bertino S., Serra M.P., Boi M., Bramanti A., Anastasi G.P., Milardi D., Cacciola A. Red nucleus structure and function: from anatomy to clinical neurosciences. Brain Struct. Funct. 2021. 226 (1): 69–91. https://doi.org/10.1007/s00429-020-02171-x
Baufreton J., Garret M., Rivera A., de la Calle A., Gonon F., Dufy B., Bioulac B., Taupignon A. D5 (not D1) dopamine receptors potentiate burst-firing in neurons of the subthalamic nucleus by modulating an L-type calcium conductance. J. Neurosci. 2003. 23 (3): 816–825. https://doi.org/10.1523/JNEUROSCI.23-03-00816.2003
Baumann O., Borra R.J., Bower J.M., Cullen K.E., Habas C., Ivry R.B., Leggio M., Mattingley J.B., Molinari M., Moulton E.A., Paulin M.G., Pavlova M.A., Schmahmann J.D., Sokolov A.A. Consensus paper: the role of the cerebellum in perceptual processes. Cerebellum. 2015. 14 (2): 197–220. https://doi.org/10.1007/s12311-014-0627-7
Belkhiria C., Mssedi E., Habas C., Driss T., de Marco G. Collaboration of cerebello-rubral and cerebello-striatal loops in a motor preparation task. Cerebellum. 2019. 18 (2): 203–211. https://doi.org/10.1007/s12311-018-0980-z
Berger T.W., Weikart C.L., Bassett J.L., Orr W.B. Lesions of the retrosplenial cortex produce deficits in reversal learning of the rabbit nictitating membrane response: implications for potential interactions between hippocampal and cerebellar brain systems. Behav. Neurosci. 1986. 100 (6): 802–809. https://doi.org/10.1037//0735-7044.100.6.802
Bezdudnaya T., Keller A. Laterodorsal nucleus of the thalamus: A processor of somatosensory inputs. J. Comp. Neurol. 2008. 507 (6): 1979–1989. https://doi.org/10.1002/cne.21664
Binder S., Mölle M., Lippert M., Bruder R., Aksamaz S., Ohl F., Wiegert J.S., Marshall L. Monosynaptic hippocampal-prefrontal projections contribute to spatial memory consolidation in mice. J. Neurosci. 2019. 39 (35): 6978–6991. https://doi.org/10.1523/JNEUROSCI.2158-18.2019
Bohne P., Schwarz M.K., Herlitze S., Mark M.D. A new projection from the deep cerebellar nuclei to the hippocampus via the ventrolateral and laterodorsal thalamus in mice. Front. Neural Circuits. 2019. 13, Article 51. https://doi.org/10.3389/fncir.2019.00051
Bostan A.C., Strick P.L. The basal ganglia and the cerebellum: nodes in an integrated network. Nat. Rev. Neurosci. 2018. 19 (6): 338–350. https://doi.org/10.1038/s41583-018-0002-7
Brodal P., Bjaalie J.G. Organization of the pontine nuclei. Neurosci. Res. 1992. 13 (2): 83–118. https://doi.org/10.1016/0168-0102(92)90092-q
Cacciola A., Milardi D., Basile G.A., Bertino S., Calamuneri A., Chillemi G., Paladina G., Impellizzeri F., Trimarchi F., Anastasi G., Bramanti A., Rizzo G. The cortico-rubral and cerebello-rubral pathways are topographically organized within the human red nucleus. Sci. Rep. 2019. 9 (1): 12117. https://doi.org/10.1038/s41598-019-48164-7
Capozzo A., Florio T., Cellini R., Moriconi U., Scarnati E. The pedunculopontine nucleus projection to the parafascicular nucleus of the thalamus: an electrophysiological investigation in the rat. J. Neural Transm. (Vienna). 2003. 110 (7): 733–747. https://doi.org/10.1007/s00702-003-0820-1
Carta I., Chen C.H., Schott A.L., Dorizan S., Khodakhah K. Cerebellar modulation of the reward circuitry and social behavior. Science 2019. 363 (6424): eaav0581. https://doi.org/10.1126/science.aav0581
Cavdar S., Özgür M., Çakmak Y.Ö., Kuvvet Y., Kunt S.K., Sağlam G. Afferent projections of the subthalamic nucleus in the rat: emphasis on bilateral and interhemispheric connections. Acta Neurobiol. Exp. (Wars.). 2018. 78 (3): 251–263.
Chen C.H., Fremont R., Arteaga-Bracho E.E. Khodakhah K. Short latency cerebellar modulation of the basal ganglia. Nature Neurosci. 2014a. 17 (12): 1767–1775. https://doi.org/10.1038/nn.3868
Chen H., Yang L., Xu Y., Wu G.Y., Yao J., Zhang J., Zhu Z.R., Hu Z.A., Sui J.F., Hu B. Prefrontal control of cerebellum-dependent associative motor learning. Cerebellum. 2014b. 13 (1): 64–78. https://doi.org/10.1007/s12311-013-0517-4
Choe K.Y., Sanchez C.F., Harris N.G., Otis T.S., Mathews P.J. Optogenetic fMRI and electrophysiological identification of region-specific connectivity between the cerebellar cortex and forebrain. NeuroImage 2018. 173: 370–383. https://doi.org/10.1016/j.neuroimage.2018.02.047
Cohen B.M., Wan W., Froimowitz M.P., Ennulat D.J., Cherkerzian S., Konieczna H. Activation of midline thalamic nuclei by antipsychotic drugs. Psychopharmacol. (Berl.). 1998. 135 (1): 37–43. https://doi.org/10.1007/s002130050483
Costa C., Sgobio C., Siliquini S., Tozzi A., Tantucci M., Ghiglieri V., Di Filippo M., Pendolino V., de Iure A., Marti M., Morari M., Spillantini M.G., Latagliata E.C., Pascucci T., Puglisi-Allegra S., Gardoni F., Di Luca M., Picconi B., Calabresi P. Mechanisms underlying the impairment of hippocampal long-term potentiation and memory in experimental Parkinson’s disease. Brain. 2012. 135 (Pt. 6): 1884–1899. https://doi.org/10.1093/brain/aws101
Crick F., Koch C. Are we aware of neuronal activity in primary visual cortex? Nature. 1995. 375 (6527); 121–123. https://doi.org/10.1038/375121a0
Cui G., Jun S.B., Jin X. Pham M., Vogel S.S., Lovinger D.M., Costa R.M. Concurrent activation of striatal direct and indirect pathways during action initiation. Nature. 2013. 494 (7436): 238–242. https://doi.org/10.1038/nature11846
Cunningham S.I., Tomasi D., Volkow N.D. Structural and functional connectivity of the precuneus and thalamus to the default mode network. Hum. Brain Mapp. 2017. 38 (2): 938–956. https://doi.org/10.1002/hbm.23429
Das T., Hwang J.J., Poston K.L. Episodic recognition memory and the hippocampus in Parkinson’s disease: A review. Cortex. 2019. 113: 191–209. https://doi.org/10.1016/j.cortex.2018.11.021
Di X., Biswal B.B. Modulatory interactions between the default mode network and task positive networks in resting-state. Peer J. 2014. 2: e367. https://doi.org/10.7717/peerj.367
Farley S.J., Albazboz H., De Corte B.J. Radley J.J., Freeman J.H. Amygdala central nucleus modulation of cerebellar learning with a visual conditioned stimulus. Neurobiol. Learn. Mem. 2018. 150: 84–92. https://doi.org/10.1016/j.nlm.2018.03.011
Fazekas P., Nemeth G. Dreaming, Mind-wandering, and hypnotic dreams. Front. Neurol. 2020. 11: 565673. https://doi.org/10.3389/fneur.2020.565673
Fermin A.S., Yoshida T., Yoshimoto J., Ito M., Tanaka S.C., Doya K. Model-based action planning involves cortico-cerebellar and basal ganglia networks. Sci. Rep. 2016. 6: 31378. https://doi.org/10.1038/srep31378
Freeman J.H., Halverson H.E., Hubbard E.M. Inferior colliculus lesions impair eyeblink conditioning in rats. Learn. Mem. 2007. 14 (12): 842–846. https://doi.org/10.1101/lm.716107
Glickstein M. Mossy-fibre sensory input to the cerebellum. Prog Brain Res. 1997. 114: 251–259. https://doi.org/10.1016/s0079-6123(08)63368-3
Govindaiah G., Cox C.L. Excitatory actions of dopamine via D1-like receptors in the rat lateral geniculate nucleus. J. Neurophysiol. 2005. 94 (6): 3708–3718. https://doi.org/10.1152/jn.00583.2005
Gurney K., Prescott T.J., Redgrave P. A computational model of action selection in the basal ganglia. II. Analysis and simulation of behaviour. Biol. Cybernetics. 2001. 84 (6): 411–423. https://doi.org/10.1007/PL00007985
Halverson H.E., Lee I., Freeman J.H. Associative plasticity in the medial auditory thalamus and cerebellar interpositus nucleus during eyeblink conditioning. J. Neurosci. 2010. 30 (26): 8787–8796. https://doi.org/10.1523/JNEUROSCI.0208-10.2010
Hammond C., Rouzaire-Dubois B., Féger J., Jackson A., Crossman A.R. Anatomical and electrophysiological studies on the reciprocal projections between the subthalamic nucleus and nucleus tegmenti pedunculopontinus in the rat. Neuroscience. 1983. 9 (1): 41–52. https://doi.org/10.1016/0306-4522(83)90045-3
Hanekamp S., Simonyan K. The large-scale structural connectome of task-specific focal dystonia. Hum. Brain Mapp. 2020. 41 (12): 3253–3265. https://doi.org/10.1002/hbm.25012
Hayden B.Y., Gallant J.L. Working memory and decision processes in visual area V4. Front. Neurosci. 2013. 7: 18. https://doi.org/10.3389/fnins.2013.00018
Haynes W.I., Haber S.N. The organization of prefrontal-subthalamic inputs in primates provides an anatomical substrate for both functional specificity and integration: implications for basal ganglia models and deep brain stimulation. J. Neurosci. 2013. 33 (11): 4804–4814. https://doi.org/10.1523/JNEUROSCI.4674-12.2013
Hazrati L.N., Parent A. Projection from the deep cerebellar nuclei to the pedunculopontine nucleus in the squirrel monkey. Brain Res. 1992. 585 (1–2): 267–271. https://doi.org/10.1016/0006-8993(92)91216-2
Heath R.G., Dempesy C.W., Fontana C.J., Myers W.A. Cerebellar stimulation: effects on septal region, hippocampus, and amygdala of cats and rats. Biol. Psychiatry. 1978. 13 (5): 501–529.
Heath R.G., Harper J.W. Ascending projections of the cerebellar fastigial nucleus to the hippocampus, amygdala, and other temporal lobe sites: evoked potential and histological studies in monkeys and cats. Exp. Neurol. 1974. 45 (2): 268–287. https://doi.org/10.1016/0014-4886(74)90118-6
Hoffmann L.C., Cicchese J.J., Berry S.D. Harnessing the power of theta: natural manipulations of cognitive performance during hippocampal theta-contingent eyeblink conditioning. Front. Syst. Neurosci. 2015. 9: Article 50. https://doi.org/10.3389/fnsys.2015.00050
Horn A., Wenzel G., Irmen F., Huebl J., Li N., Neumann W.J., Krause P., Bohner G., Scheel M., Kühn A.A. Deep brain stimulation induced normalization of the human functional connectome in Parkinson’s disease. Brain. 2019. 142 (10): 3129–3143. https://doi.org/10.1093/brain/awz239
Ito M., Karachot L. Protein kinases and phosphatase inhibitors mediating long-term desensitization of glutamate receptors in cerebellar Purkinje cells. Neurosci. Res. 1992. 14 (1): 27–38. https://doi.org/10.1016/s0168-0102(05)80004-5
Jeon S.G., Kim Y.J., Kim K.A., Mook-Jung I., Moon M. Visualization of altered hippocampal connectivity in an animal model of Alzheimer’s disease. Mol. Neurobiol. 2018. 55 (10): 7886–7899. https://doi.org/10.1007/s12035-018-0918-y
Joel D., Weiner I. The connections of the dopaminergic system with the striatum in rats and primates: an analysis with respect to the functional and compartmental organization of the striatum. Neuroscience. 2000. 96 (3): 451–474. https://doi.org/10.1016/s0306-4522(99)00575-8
Johnson K.A., Mateo Y., Lovinger D.M. Metabotropic glutamate receptor 2 inhibits thalamically-driven glutamate and dopamine release in the dorsal striatum. Neuropharmacology. 2017. 117: 114–123. https://doi.org/10.1016/j.neuropharm.2017.01.038
Joutsa J., Shih L.C., Fox M.D. Mapping holmes tremor circuit using the human brain connectome. Ann. Neurol. 2019. 86 (6): 812–820. https://doi.org/10.1002/ana.25618
Jwair S., Coulon P., Ruigrok T.J.H. Disynaptic subthalamic input to the posterior cerebellum in rat. Front. Neuroanat. 2017. 11: Article 13. https://doi.org/10.3389/fnana.2017.00013
Klaassens B.L., van Gerven J.M.A., Klaassen E.S., van der Grond J., Rombouts S.A.R.B. Cholinergic and serotonergic modulation of resting state functional brain connectivity in Alzheimer’s disease. Neuroimage. 2019. 199: 143–152. https://doi.org/10.1016/j.neuroimage.2019.05.044
Kobayashi Y., Amaral D.G. Macaque monkey retrosplenial cortex: II. Cortical afferents. J. Comp. Neurol. 2003. 466 (1): 48–79. https://doi.org/10.1002/cne.10883
Kobayashi Y., Amaral D.G. Macaque monkey retrosplenial cortex: III. Cortical efferents. J. Comp. Neurol. 2007. 502 (5): 810–833. https://doi.org/10.1002/cne.21346
Kratochwil C.F., Maheshwari U., Rijli F.M. The long journey of pontine nuclei neurons: from rhombic lip to cortico-ponto-cerebellar circuitry. Front. Neural. Circuits. 2017. 11: Article 33. https://doi.org/10.3389/fncir.2017.00033
La C., Linortner P., Bernstein J.D., Ua Cruadhlaoich M.A.I., Fenesy M., Deutsch G.K., Rutt B.K., Tian L., Wagner A.D., Zeineh M., Kerchner G.A., Poston K.L. Hippocampal CA1 subfield predicts episodic memory impairment in Parkinson’s disease. Neuroimage Clin. 2019. 23: 101824. https://doi.org/10.1016/j.nicl.2019.101824
Laroche S., Davis S., Jay T.M. Plasticity at hippocampal to prefrontal cortex synapses: dual roles in working memory and consolidation. Hippocampus. 2000. 10 (4): 438–446. https://doi.org/10.1002/1098-1063(2000)10:4<438::AID-HIPO10>3.0.CO;2-3
Li P., Shan H., Liang S., Nie B., Duan S., Huang Q., Zhang T., Sun X., Feng T., Ma L., Shan B., Li D., Liu H. Structural and functional brain network of human retrosplenial cortex. Neurosci. Lett. 2018. 674: 24–29. https://doi.org/10.1016/j.neulet.2018.03.016
Liebe S., Hoerzer G.M., Logothetis N.K., Rainer G. Theta coupling between V4 and prefrontal cortex predicts visual short-term memory performance. Nat. Neurosci. 2012. 15 (3): 456–462, S1–2. https://doi.org/10.1038/nn.3038
Lim J., Bang Y., Choi H.J. Abnormal hippocampal neurogenesis in Parkinson’s disease: relevance to a new therapeutic target for depression with Parkinson’s disease. Arch. Pharm. Res. 2018. 41 (10): 943–954. https://doi.org/10.1007/s12272-018-1063-x
Lu L., Ren Y., Yu T., Liu Z., Wang S., Tan L., Zeng J., Feng Q., Lin R., Liu Y., Guo Q., Luo M. Control of locomotor speed, arousal, and hippocampal theta rhythms by the nucleus incertus. Nat. Commun. 2020. 11 (1): 262. https://doi.org/10.1038/s41467-019-14116-y
Lucas-Jiménez O., Ojeda N., Peña J., Díez-Cirarda M., Cabrera-Zubizarreta A., Gómez-Esteban J.C., Gómez-Beldarrain M.Á., Ibarretxe-Bilbao N. Altered functional connectivity in the default mode network is associated with cognitive impairment and brain anatomical changes in Parkinson’s disease. Parkinsonism Relat. Disord. 2016. 33: 58–64. https://doi.org/10.1016/j.parkreldis.2016.09.012
McKenna J.T., Vertes R.P. Afferent projections to nucleus reuniens of the thalamus. J. Comp. Neurol. 2004. 480 (2): 115–142. https://doi.org/10.1002/cne.20342
Melchitzky D.S., Lewis D.A. Dopamine transporter-immunoreactive axons in the mediodorsal thalamic nucleus of the macaque monkey. Neuroscience. 2001. 103 (4): 1033–1042. https://doi.org/10.1016/s0306-4522(01)00021-5
Meoni S., Cury R.G., Moro E. New players in basal ganglia dysfunction in Parkinson’s disease. Prog. Brain Res. 2020. 252: 307–327. https://doi.org/10.1016/bs.pbr.2020.01.001
Mirdamadi J.L. Cerebellar role in Parkinson’s disease. J. Neurophysiol. 2016. 116 (3): 917–919. https://doi.org/10.1152/jn.01132.2015
Mišić B., Goñi J., Betzel R.F., Sporns O., McIntosh A.R. A network convergence zone in the hippocampus. PLoS Comput. Biol. 2014. 10 (12): e1003982. https://doi.org/10.1371/journal.pcbi.1003982
Miyashita T., Rockland K.S. GABAergic projections from the hippocampus to the retrosplenial cortex in the rat. Eur. J. Neurosci. 2007. 26: 1193–1204. https://doi.org/10.1111/j.1460-9568.2007.05745.x
Mori F., Okada K.I., Nomura T., Kobayashi Y. The pedunculopontine tegmental nucleus as a motor and cognitive interface between the cerebellum and basal ganglia. Front. Neuroanat. 2016. 10: Article 109. https://doi.org/10.3389/fnana.2016.00109
Mukherjee P., Sabharwal A., Kotov R., Szekely A., Parsey R., Barch D.M., Mohanty A. Disconnection between amygdala and medial prefrontal cortex in psychotic disorders. Schizophr. Bull. 2016. 42 (4): 1056–1067. https://doi.org/10.1093/schbul/sbw012
Onofrj M., Taylor J.P., Monaco D., Franciotti R., Anzellotti F., Bonanni L., Onofrj V., Thomas A. Visual hallucinations in PD and Lewy body dementias: old and new hypotheses. Behav. Neurol. 2013. 27(4): 479–493. https://doi.org/10.3233/BEN-129022
Philippens I.H.C.H.M., Wubben J.A., Franke S.K., Hofman S., Langermans J.A.M. Involvement of the red nucleus in the compensation of Parkinsonism may explain why primates can develop stable Parkinson’s Disease. Sci. Rep. 2019. 9 (1): 880. https://doi.org/10.1038/s41598-018-37381-1
Pong M., Horn K.M., Gibson A.R. Pathways for control of face and neck musculature by the basal ganglia and cerebellum. Brain Res. Rev. 2008. 58 (2): 249–264. https://doi.org/10.1016/j.brainresrev.2007.11.006
Quartarone A., Cacciola A., Milardi D., Ghilardi M.F., Calamuneri A., Chillemi G., Anastasi G., Rothwell J. New insights into cortico-basal-cerebellar connectome: clinical and physiological considerations. Brain. 2020. 143 (2): 396–406. https://doi.org/10.1093/brain/awz310
Raichle M.E. The Brain’s Default Mode Network. Annual Review of Neuroscience. 2015. 38: 433–447. https://doi.org/10.1146/annurev-neuro-071013-014030
Ricardo J.A. Efferent connections of the subthalamic region in the rat. I. The subthalamic nucleus of Luys. Brain Res. 1980. 202 (2): 257–271. https://doi.org/10.1016/0006-8993(80)90140-7
Rochefort C., Lefort J.M., Rondi-Reig L. The cerebellum: a new key structure in the navigation system. Front. Neural Circuits. 2013. 7: Article 35. https://doi.org/10.3389/fncir.2013.00035
Rogers T.D., Dickson P.E., Heck D.H., Goldowitz D., Mittleman G., Blaha C.D. Connecting the dots of the cerebro-cerebellar role in cognitive function: neuronal pathways for cerebellar modulation of dopamine release in the prefrontal cortex. Synapse. 2011. 65 (11): 1204–1212. https://doi.org/10.1002/syn.20960
Rogers T.D., Dickson P.E., McKimm E., Heck D.H., Goldowitz D., Blaha C.D., Mittleman G. Reorganization of circuits underlying cerebellar modulation of prefrontal cortical dopamine in mouse models of autism spectrum disorder. Cerebellum. 2013. 12 (4): 547–556. https://doi.org/10.1007/s12311-013-0462-2
Romano V., De Propris L., Bosman L.W., Warnaar P., Ten Brinke M.M., Lindeman S., Ju C., Velauthapillai A., Spanke J.K., Middendorp Guerra E., Hoogland T.M., Negrello M., D’Angelo E., De Zeeuw C. Potentiation of cerebellar Purkinje cells facilitates whisker reflex adaptation through increased simple spike activity. Elife. 2018. 7: e38852. https://doi.org/10.7554/eLife.38852
Santhouse A.M., Howard R.J., Ffytche D.H. Visual hallucinatory syndromes and the anatomy of the visual brain. Brain. 2000. 123 (Pt. 10):.2055–2064. https://doi.org/10.1093/brain/123.10.2055
Schonewille M., Gao Z., Boele H.J., Veloz M.F., Amerika W.E., Simek A.A., De Jeu M.T., Steinberg J.P., Takamiya K., Hoebeek F.E., Linden D.J., Huganir R.L., De Zeeuw C.I. Reevaluating the role of LTD in cerebellar motor learning. Neuron. 2011. 70 (1): 43–50. https://doi.org/10.1016/j.neuron.2011.02.044
Schwabe L. Memory under stress: from single systems to network changes. Eur. J. Neurosci. 2017. 45 (4): 478–489. https://doi.org/10.1111/ejn.13478
Sha Z., Edmiston E.K., Versace A., Fournier J.C., Graur S., Greenberg T., Lima Santos J.P., Chase H.W., Stiffler R.S., Bonar L., Hudak R., Yendiki A., Greenberg B.D., Rasmussen S., Liu H., Quirk G., Haber S., Phillips M.L. Functional disruption of cerebello-thalamo-cortical networks in obsessive-compulsive disorder. Biol. Psychiatry Cogn. Neurosci. Neuroimaging. 2020a. 5 (4): 438–447. https://doi.org/10.1016/j.bpsc.2019.12.002
Sha Z., Versace A., Edmiston E.K., Fournier J., Graur S., Greenberg T., Santos J.P.L., Chase H.W., Stiffler R.S., Bonar L., Hudak R., Yendiki A., Greenberg B.D., Rasmussen S., Liu H., Quirk G., Haber S., Phillips M.L. Functional disruption in prefrontal-striatal network in obsessive-compulsive disorder. Psychiatry. Res. Neuroimaging. 2020b. 300: 111081. https://doi.org/10.1016/j.pscychresns.2020.111081
Silkis I.G. The unitary modification rules for neural networks with excitatory and inhibitory synaptic plasticity. Biosystems. 1998. 48 (1–3): 205–213. https://doi.org/10.1016/s0303-2647(98)00067-7
Silkis I. Interrelated modification of excitatory and inhibitory synapses in three-layer olivary-cerebellar neural network. Biosystems. 2000. 54 (3): 141–149. https://doi.org/10.1016/s0303-2647(99)00075-1
Silkis I. The cortico-basal ganglia-thalamocortical circuit with synaptic plasticity. II. Mechanism of synergistic modulation of thalamic activity via the direct and indirect pathways through the basal ganglia. Biosystems. 2001. 59 (1): 7–14. https://doi.org/10.1016/s0303-2647(00)00135-0
Silkis I. A hypothetical role of cortico-basal ganglia-thalamocortical loops in visual processing. Biosystems, 2007. 89 (1–3): 227–235. https://doi.org/10.1016/j.biosystems.2006.04.020
Snider R.S., Maiti A. Cerebellar contributions to the Papez circuit. J. Neurosci. Res. 1976. 2 (2): 133–146. https://doi.org/10.1002/jnr.490020204
Stoerig P. The neuroanatomy of phenomenal vision: a psychological perspective. Ann. N. Y. Acad. Sci. 2001. 929: 176–194. https://doi.org/10.1111/j.1749-6632.2001.tb05716.x
Tecuapetla F., Jin X., Lima S.Q., Costa R.M. Complementary contributions of striatal projection pathways to action initiation and execution. Cell. 2016. 166 (3): 703–715. https://doi.org/10.1016/j.cell.2016.06.032
van den Heuvel M.P., Sporns O. Rich-club organization of the human connectome. J. Neurosci. 2011. 31 (44): 15775–15786. https://doi.org/10.1523/JNEUROSCI.3539-11.2011
van Es D.M., van der Zwaag W., Knapen T. Topographic maps of visual space in the human cerebellum. Curr. Biol. 2019. 29 (10): 1689–1694.e3. https://doi.org/10.1016/j.cub.2019.04.012
Van Groen T., Wyss J.M. Connections of the retrosplenial granular b cortex in the rat. J. Comp. Neurol. 2003. 463 (3): 249–263. https://doi.org/10.1002/cne.10757
Vatansever D., Menon D.K., Manktelow A.E., Sahakian B.J., Stamatakis E.A. Default mode dynamics for global functional integration. J. Neurosci. 2015. 35 (46): 15254–15262. https://doi.org/10.1523/JNEUROSCI.2135-15.2015
Vatansever D., Manktelow A.E., Sahakian B.J., Menon D.K., Stamatakis E.A. Cognitive flexibility: A default network and basal ganglia connectivity perspective. Brain Connect. 2016. 6 (3): 201–207. https://doi.org/10.1089/brain.2015.0388
Vatansever D., Manktelow A.E., Sahakian B.J., Menon D.K., Stamatakis E.A. Angular default mode network connectivity across working memory load. Hum. Brain Mapp. 2017. 38 (1): 41–52. https://doi.org/10.1002/hbm.23341
Vitale F., Mattei C., Capozzo A., Pietrantoni I., Mazzone P., Scarnati E. Cholinergic excitation from the pedunculopontine tegmental nucleus to the dentate nucleus in the rat. Neuroscience. 2016. 317: 12–22. https://doi.org/10.1016/j.neuroscience.2015.12.055
Wang Z-M., Wei P-H., Shan Y., Han M., Zhang M., Liu H., Gao J-H., Lu J. Identifying and characterizing projections from the subthalamic nucleus to the cerebellum in humans. Neuroimage. 2020. 210: 116573. https://doi.org/10.1016/j.neuroimage.2020.116573
Wang X., Xu M., Song Y., Li X., Zhen Z., Yang Z., Liu J. The network property of the thalamus in the default mode network is correlated with trait mindfulness. Neuroscience. 2014. 278: 291–301. https://doi.org/10.1016/j.neuroscience.2014.08.006
Watson T.C., Obiang P., Torres-Herraez A., Watilliaux A., Coulon P., Rochefort C., Rondi-Reig L. Anatomical and physiological foundations of cerebello-hippocampal interaction. Elife. 2019. 8: e41896. https://doi.org/10.7554/eLife.41896
Wichmann T. Changing views of the pathophysiology of Parkinsonism. Mov Disord. 2019. 34 (8): 1130–1143. https://doi.org/10.1002/mds.27741
Wikgren J., Nokia M.S., Penttonen M. Hippocampo-cerebellar theta band phase synchrony in rabbits. Neuroscience. 2010. 165 (4): 1538–1545. https://doi.org/10.1016/j.neuroscience.2009.11.044
Wu T., Hallett M. The cerebellum in Parkinson’s disease. Brain. 2013. 136 (Pt. 3): 696–709. https://doi.org/10.1093/brain/aws360
Wyss J.M., Van Groen T. Connections between the retrosplenial cortex and the hippocampal formation in the rat: a review. Hippocampus. 1992. 2 (1): 1–11. https://doi.org/10.1002/hipo.450020102
Xu X.M., Jiao Y., Tang T.Y., Zhang J., Lu C.Q., Luan Y., Salvi R., Teng G.J. Dissociation between cerebellar and cerebral neural activities in humans with long-term bilateral sensorineural hearing loss. Neural. Plast. 2019. 2019: 8354849. https://doi.org/10.1155/2019/8354849
Xu T.X., Ma Q., Spealman R.D., Yao W.D. Amphetamine modulation of long-term potentiation in the prefrontal cortex: dose dependency, monoaminergic contributions, and paradoxical rescue in hyperdopaminergic mutant. J. Neurochem. 2010. 115 (6): 1643–1654. https://doi.org/10.1111/j.1471-4159.2010.07073.x
Yin Y., Hou Z., Wang X., Sui Y., Yuan Y. Association between altered resting-state cortico-cerebellar functional connectivity networks and mood/cognition dysfunction in late-onset depression. J. Neural. Transm. (Vienna). 2015. 122 (6): 887–896. https://doi.org/10.1007/s00702-014-1347-3
Yu W., Krook-Magnuson E. Cognitive collaborations: bidirectional functional connectivity between the cerebellum and the hippocampus. Front. Syst. Neurosci. 2015. 9: 177. https://doi.org/10.3389/fnsys.2015.00177
Zhang Y., Mao Z., Feng S., Liu X., Lan L., Zhang J., Yu X. Altered functional networks in long-term unilateral hearing loss: A connectome analysis. Brain Behav. 2018. 8 (2): e00912. https://doi.org/10.1002/brb3.912
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


