Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 1, стр. 11-35
Мю-ритм в современных исследованиях: теоретические и методологические аспекты
Е. В. Ларионова 1, *, Ж. В. Гарах 1, Ю. С. Зайцева 2, 3
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Национальный центр психического здоровья
Клецаны, Чехия
3 3-й лечебный факультет, Карлов Университет в Праге
Прага, Чехия
* E-mail: larionova.ekaterin@gmail.com
Поступила в редакцию 07.05.2021
После доработки 01.06.2021
Принята к публикации 05.10.2021
- EDN: DKAQMQ
- DOI: 10.31857/S0044467722010051
Аннотация
Мю-ритм представляет интерес для изучения широкого спектра процессов от моторных функций до языковых процессов и эмоций. Этот ритм включает как минимум два негармонических компонента в частотных диапазонах альфа- (8–13 Гц) и бета-ритмов (15–25 Гц), имеющих различную функциональную роль, что обусловливает необходимость их самостоятельного изучения. Перекрытие с альфа-активностью требует контроля эффектов изменения внимания, учета электрической активности не только центральных отведений, а также применения математических методов для разделения мю- и альфа-ритмов. Подавление мю-ритма было предложено как индекс активации системы зеркальных нейронов, что породило большое число споров и исследований, в том числе связанных с проблемой потенциального смешения ее активности и активности системы внимания. В данном обзоре рассматриваются современные исследования в контексте этих трех аспектов, в том числе результаты собственных исследований авторов.
Мю-ритм, впервые описанный Гасто, был назван роландическим, поскольку наблюдался в роландовой области (Gastaut, 1952). Этот новый ритм был описан как “ритм в форме арки”, “гребенчатый ритм”, ритм с остроконечной формой. Мю-ритм называли “прецентральным альфа-ритмом”, “роландическим альфа-ритмом”, “центральным альфа-ритмом”, а также “соматосенсорным альфа-ритмом”. Мю-ритм характеризуется сенсомоторным источником (sensorimotor source), который находится проксимальнее мест интеграции петель двух базальных ганглиев, участвующих в моторном контроле (Dillon, Pizzagalli, 2007). Таким образом, на колебания мощности мю-ритма могут влиять как базальные ганглии, так и сенсомоторное функционирование (Jenson et al., 2020). Сенсомоторное происхождение модуляции мю-ритма было подтверждено в исследованиях с одновременным использованием методов ЭЭГ и фМРТ, показавших, что мощность мю-ритма отрицательно коррелирует с сигналами, зависящими от уровня кислорода в крови (blood-oxygen-level dependent signal, BOLD), в прецентральной области и дополнительной моторной коре (Ritter et al., 2009; Mizuhara, 2012).
Ещё в работах Гасто было показано, что собственные движения испытуемых приводили к подавлению или десинхронизации мю-ритма, а в дальнейших экспериментах было показано, что подавление мю-ритма происходит не только во время собственных движений, но и при представлении движения (Chatrian et al., 1959). Подавление мю-ритма также было продемонстрировано у людей с ампутациями конечностей во время умственных действий, касающихся движения фантомной конечности (Klass, Bickford, 1957). Выраженность десинхронизации зависит от задачи и ее сложности. Например, было обнаружено, что эффекты подавления мю-ритма различаются между движениями пальцев и стоп (Pfurtscheller et al., 2000), ходьбой вперед и назад (Lin et al., 2020). Подавление мю-ритма при активной двигательной задаче больше, чем при пассивной двигательной задаче (Park et al., 2015). Мю-ритм десинхронизируется также при наблюдении за движением (Angelini et al., 2018; Isoda et al., 2016; Sestito et al., 2018), при воображении движения (McFarland et al., 2000; Гарах и др., 2014; Лебедева и др., 2018), при тактильной стимуляции (Shibuya et al., 2019; Smyk et al., 2018). Во многих моторных задачах отмечается активация не только центральных корковых зон, но и других областей. При выполнении моторных задач десинхронизация мю-ритма может наблюдаться также во фронтальных и теменных областях (Cochin et al., 1999; Frenkel-Toledo et al., 2013), что подтверждается нейровизуализационными исследованиями, показывающими активацию теменной коры в парадигмах, включающих выполнение и планирование движения (Buneo et al., 2002; Pilacinski, Lindner, 2019), наблюдение за движением (Molenberghs et al., 2012; Aflalo et al., 2020), а также воображение движения (обзор Hanakawa, 2016). В целом десинхронизация мю-ритма во время произвольных движений указывает на активацию сенсомоторной коры, обусловленную асинхронным паттерном активации сенсомоторных нейронов (Angelini et al., 2018).
Анализ характеристик мю-ритма активно используется в области физиологии развития человека. Исследования показывают, что и в младенческом возрасте присутствует мю-ритм, хотя его пиковая активность приходится на более низкие частотные диапазоны по сравнению с детьми старшего возраста и взрослыми. Возрастная динамика мю-ритма подробно рассматривается в различных обзорах, в том числе на русском языке (Marshall, Meltzoff, 2014; Cuevas et al., 2014; Аликина и др., 2016). Изучение свойств младенческого мю-ритма в сопоставлении с поведенческими процессами подражания является важным, поскольку считается, что эти данные могут помочь в понимании природы межличностных взаимодействий и эмоций. Часто в таких работах полученные результаты связывают с функционированием системы зеркальных нейронов, поэтому мы рассмотрим несколько таких работ в этом контексте в соответствующей главе. Кроме того, в главе, посвященной мю-ритму в клинических исследованиях, мы затронем некоторые нарушения развития: детский церебральный паралич, синдром дефицита внимания и гиперактивности, расстройства аутистического спектра и другие.
Достаточно распространенными являются работы по изучению мю-ритма в рамках интерфейса “мозг-компьютер” (ИМК). Это активно развивающаяся технология, использующая в том числе спектральные, топографические и временные характеристики сенсомоторных ритмов. Более половины исследований ИМК применяют в качестве парадигмы задачи на моторное воображение (обзор Zhang et al., 2020). Распознавание паттернов биоэлектрической активности при выполнении таких задач используется как у здоровых испытуемых при изучении моторной организации, так и в клинических исследованиях реабилитации пациентов с двигательными нарушениями (обзор Фролов и др., 2017b). Имеется большое количество обзорных статей, посвященных тематике ИМК (например, Мокиенко и др., 2013; Rashid et al., 2020). Несколько работ, выполненных в рамках ИМК, мы упоминаем в главе, посвященной методическим аспектам, а также в главе, посвященной клиническим исследованиям, но в целом подробное рассмотрение работ по этой тематике не являлось целью настоящего обзора.
Целью данной статьи является обзор некоторых теоретических и методологических аспектов использования сенсомоторного ритма в электрофизиологических исследованиях. В обзоре рассматривается вопрос о двух частотных составляющих мю-ритма в альфа- (8–13 Гц) и бета- (15–25 Гц) диапазонах частот. Обсуждаются проблемы, возникающие при анализе мю-ритма, касающиеся в основном смешения мю-ритма с альфа-ритмом, и имеющиеся в настоящее время пути ее решения. В статье разбирается дискуссионный вопрос о возможной связи мю-ритма и системы зеркальных нейронов. В рамках этих теоретических и методических аспектов мы рассматриваем современные работы на здоровых испытуемых, а также в исследованиях мю-ритма при различных видах патологии ЦНС.
ЧАСТОТНЫЕ СОСТАВЛЯЮЩИЕ МЮ-РИТМА
Сенсомоторный мю-ритм, регистрируемый над центральными электродами, включает как минимум два негармонических компонента в альфа- (8–13 Гц) и бета- (15–25 Гц) диапазонах частот (Hari, Salmelin, 1997). Считается, что аркообразная форма волны мю-ритма обусловлена сосуществованием этих двух компонентов (Tiihonen et al., 1989; Avanzini et al., 2012). Некоторые авторы утверждают, что бета-составляющая является гармоникой альфа-диапазона, основываясь на данных о том, что активность этих двух диапазонов корреляционно связана (Carlqvist et al., 2005; Brismar, 2007). Однако показано, что две составляющие мю-ритма имеют отличающуюся локализацию источников и реактивность при выполнении двигательных задач, что может свидетельствовать об их различных функциональных свойствах (Angelini et al., 2018; Brinkman et al., 2014). Необходимо отметить, что границы частотных диапазонов сенсомоторных ритмов варьируют в различных исследованиях, также используется разделение этих составляющих на более узкие поддиапазоны (например, Heimann et al., 2019; Fitzpatrick et al., 2019; Cole et al., 2018). В настоящем обзоре, говоря о мю-ритме, как и большинство авторов, мы будем подразумевать альфа-составляющую, а для результатов, полученных в бета-диапазоне, это будет в явном виде указано.
Исследования локализации источников показывают, что мю-ритм в бета-диапазоне генерируется в прецентральной моторной коре, тогда как источник мю-ритма в альфа-диапазоне расположен в постцентральной соматосенсорной коре (Hari, Salmelin, 1997). Спектральная мощность этих двух частотных компонентов мю-ритма может быть полностью разделена в когнитивных исследованиях, что указывает на их функциональное различие (Brinkman et al., 2014; Jenson et al., 2014). Два компонента мю-ритма в полосах частот альфа и бета при выполнении моторных задач часто имеют различную реактивность: альфа-субкомпонент может отражать преобладающую сенсомоторную функцию, в то время как бета-компонент более тесно связан с моторным кортикальным контролем (Angelini et al., 2018).
В целом выполнение действий, наблюдение за действиями и воображение действия вызывают десинхронизацию сенсомоторных ритмов ЭЭГ в частотных диапазонах альфа и бета. Десинхронизация сенсомоторных ритмов традиционно интерпретируется как отражение активации сенсомоторной сети, тогда как их синхронизация после движения отражает процессы тормозного контроля сверху вниз (Klimesch et al., 2007). Однако функциональная роль у этих субкомпонентов может быть различной (Hari, Salmelin, 1997; Engel, Fries, 2010). Существует мнение о том, что низкочастотный компонент мю-волны отражает широко распространенный, неспецифический паттерн подавления, связанный с движением, тогда как верхний частотный компонент показывает более сфокусированный и специфический паттерн движения (Pineda, 2005). Например, показано, что во время планирования действия степень неопределенности будущего движения влияет на степень десинхронизации только бета-диапазона: чем больше степень неопределенности, тем больше показатель подавления мощности бета-ритма (Tzagarakis et al., 2015). С другой стороны, было показано, что повышение активности мю-ритма в альфа-диапазоне до начала выполнения задачи типа Go/NoGo связано с ошибочной моторной реакцией на стимул. Этот факт может свидетельствовать о сниженной возбудимости моторной коры еще до предъявления целевого стимула (Mazaheri et al., 2009). Исследование топографических особенностей электрической активности при выполнении движения левой или правой руки и воображении этого движения показало, что обе эти задачи вызывают десинхронизацию сенсомоторных ритмов в альфа- и бета-диапазонах (McFarland et al., 2000). При этом максимальная десинхронизация низкочастотной составляющей была выражена в контралатеральных левой (или правой) руке постцентральных корковых зонах в отведениях CP4 и CP3, тогда как десинхронизация бета-ритма имела более диффузную локализацию с максимумом в отведении Cz. Такое топографическое различие может служить еще одним доказательством независимости активности мю-ритма в бета- и в альфа-диапазонах.
Потенциальная роль сенсомоторного бета-ритма все еще активно исследуется. В настоящее время общепризнано, что мощность бета-диапазона снижается во время выполнения движения, кратковременно увеличивается после окончания движения (так называемый “бета-отскок”, post-movement beta rebound) и тонически увеличивается во время выполнения захвата объекта (обзор, Kilavik et al., 2013). Синхронизацию мощности в бета-полосе после окончания движения отмечают многие авторы (Pfurtscheller, Lopes da Silva, 1999; Tatti et al., 2020). Существует также множество факторов, которые влияют на модуляцию сенсомоторных бета-колебаний (Kilavik et al., 2013). Например, связанная с событием десинхронизация в бета-диапазоне зависит от планирования цели движения, а также моторных навыков (Pollok et al., 2014; Heinrichs-Graham, Wilson, 2015). Моторное обучение при этом по-разному модулирует десинхронизацию бета-колебаний у подростков и взрослых (Gehringer et al., 2019). Амплитуда бета-синхронизации после окончания выполнения действия также модулируется такими факторами, как моторное обучение (Boonstra et al., 2007; Tan et al., 2016) и практика (Moisello et al., 2015; Ricci et al., 2019).
Таким образом, поскольку сенсомоторные субкомпоненты в альфа- и бета-диапазонах частот имеют различную функциональную роль, для более полного понимания нейрофизиологических механизмов, связанных с движением, в экспериментальных задачах следует учитывать особенности модуляции этих составляющих. В разделах, посвященных экспериментальным работам, отметим частотные диапазоны, которые анализируют авторы.
МЕТОДОЛОГИЧЕСКИЕ ПРОБЛЕМЫ, ВОЗНИКАЮЩИЕ ПРИ АНАЛИЗЕ МЮ-РИТМА
Основные методические проблемы, возникающие при анализе мю-ритма, обусловлены тем, что он находится в том же частотном диапазоне, что и альфа-ритм – 8–13 Гц. Считается, что эти мозговые ритмы отличаются топографической и функциональной специфичностью: альфа-ритм наиболее заметен в затылочной коре и реагирует на изменения визуальной стимуляции и внимания, мю-ритм регистрируется в сенсомоторных областях и реагирует на движения (Hobson, Bishop, 2016; Hobson, Bishop, 2017).
Один из важных методических аспектов связан с выбором базового интервала или контрольного условия. Значение подавления или десинхронизация мю-ритма вычисляется относительно мощности в базовом интервале, поэтому зависит от значений мощности в этом интервале (Pfurtscheller, Lopes da Silva, 1999). Часто в исследованиях в качестве базового интервала выбираются продолжительные отрезки времени, не связанные по времени со стимулом (например, Oberman et al., 2005; Perry, Bentin, 2010). Адекватный выбор такого интервала необходим для контроля модуляций альфа-активности, сопряженной с процессами внимания, поэтому контрольное условие и экспериментальное задание, в котором исследуется подавление мю-ритма, должны иметь максимально схожие визуальные характеристики и быть одинаково привлекательными для испытуемого (Bowman et al., 2017). В качестве базового интервала используют, например, сопоставимые с тестовым заданием по яркости и контрастности ролики белого шума, видеозаписи движущихся теннисных мячей и прочее (Oberman et al., 2005; Perry et al., 2010). Для контроля эффектов внимания Хобсон и Бишоп просили испытуемых оценивать привлекательность различных контрольных условий (Hobson, Bishop, 2016). Другие исследователи для каждого блока стимулов исключали первые и последние отрезки записи ЭЭГ, чтобы уменьшить эффекты внимания, связанные с началом и окончанием стимула, а также с состоянием ожидания стимула (Sestito et al., 2018; Oberman et al., 2007; Perry, Bentin, 2010). Отмечают, что испытуемые могут демонстрировать разные величины подавления мю-ритма в зависимости от используемого базового интервала: только у 17% испытуемых величина подавления мю-ритма не зависела от выбранного базового интервала (Tangwiriyasakul et al., 2013). Считается, что в исследованиях с длительным базовым интервалом недостаточно контролируются эффекты внимания, которые связаны с его длительностью (Oberman et al., 2005; Moreno et al., 2013; Muthukumaraswamy et al., 2004; Александров и др., 2010), что в результате может приводить к завышенным показателям подавления мю-ритма. Влияние этих эффектов оказывается меньше в тех исследованиях, где в качестве базового интервала используется короткий интервал до начала стимула, который сравнивается с постстимульным интервалом (Cuellar, Del Toro, 2017; Jenson et al., 2019; Gutsell et al., 2020; Siqi-Liu et al., 2018), т.е. для исследования подавления мю-ритма анализируются связанные с событиями спектральные пертурбации (event-related spectral perturbation, ERSP) и десинхронизация/синхронизация (event-related desynchronization/event-related synchronization, ERD/ERS).
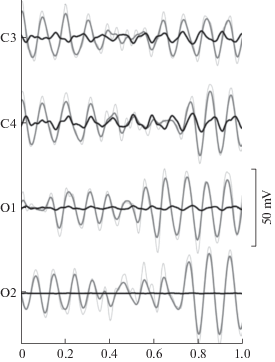
Еще одним методическим подходом для контроля смешения эффектов мю- и альфа-ритмов является включение в анализ не только центральных, но и затылочных отведений (Perry, Bentin, 2010). Объемная проводимость от затылочных альфа-волн зашумляет мю-ритм (рис. 1). На мощность альфа-ритма в задних корковых областях также влияет развертывание пространственного зрительного внимания (Sauseng et al., 2005). Действительно, в настоящее время многие авторы предоставляют данные о мощности альфа-ритма в затылочных отведениях в экспериментах, в которых проводится анализ мю-ритма (например, Aridan et al., 2018). Встречаются и работы, в которых для анализа мю-ритма используют результаты исключительно в центральных отведениях (например, Wen et al., 2017). Однако стоит отметить, что контроль альфа-ритма только в затылочных областях может быть в некоторых случаях недостаточен. С одной стороны, как показано в различных исследованиях, в процесс воображения движения вовлечены области теменной коры, где также регистрируется мю-ритм (Mulder, 2007; Hanakawa, 2016). Показано также, что наблюдение за целенаправленными и нецеленаправленными движениями вызывало десинхронизацию сенсомоторных ритмов в альфа- и бета-диапазонах не только в центральных, но и в теменных областях (Avanzini et al., 2012). С другой стороны, известно, что теменные отделы принимают участие в генерации альфа-колебаний (Jensen, Mazaheri, 2010), которые в этих корковых зонах изменяются при фокусировке пространственного внимания (Capotosto et al., 2009). Одним из решений для учета данных других отведений ЭЭГ при анализе мю-ритма может служить использование перестановочного или пермутационного анализа, который не основан на априорном выборе электродов (Kompatsiari et al., 2021; Bechtold et al., 2018).
Рис. 1.
Пример разделения альфа- и мю-ритмов ЭЭГ в центральных и затылочных отведениях для состояния спокойного бодрствования с закрытыми глазами. Тонкая серая линия – исходная запись ЭЭГ; толстая серая линия – альфа-ритм; толстая черная линия – мю-ритм.
Fig. 1. Alpha and mu waves extracted from an EEG signal of the central and occipital channel during the eyes-closed resting state. The thin gray line marks EEG before the analysis; the thick gray line – alpha rhythm; the thick black line – mu rhythm.
В настоящее время для идентификации сенсомоторной активности многие авторы применяют математические методы. Чаще используют различные варианты анализа независимых компонент (например, Cuellar, Del Toro, 2017; Керечанин и др., 2019). C помощью анализа независимых компонент (independent component analysis, ICA) выделяют как альфа-, так и бета-компоненты мю-ритма (например, Saltuklaroglu et al., 2017; Jenson et al., 2020). Показано, что с помощью метода независимых компонент можно идентифицировать источники в моторной коре, связанные с десинхронизацией или синхронизацией сенсомоторных ритмов. Преимущественно в этих подходах для выделения мю-ритма используют индивидуальные топографические карты распределения электрической активности в интересующем диапазоне частот, после чего выделенные независимые компоненты объединяют в кластеры на основе топографии, соответствующей активности сенсомоторных ритмов. Для дополнительной уверенности в том, что факторы, выделенные с помощью метода независимых компонент, относятся к мю-ритму, некоторые исследователи дополняют процедуру локализацией источников выделенных факторов (Jenson et al., 2019). В целом ряде работ были идентифицированы и локализованы кластеры компонентов мю-ритма в премоторной и первичной сенсомоторной коре во время наблюдения или воображения движения (например, Makeig et al., 2004).
Нами предложен возможный подход для выделения мю-ритма из смеси с альфа-ритмом (Garakh et al., 2020), основанный на знании о том, что этот ритм подавляется при выполнении, наблюдении или воображении движения и не реагирует на открывание глаз (Kuhlman, 1978). Особенностью метода является использование разности ковариационных матриц двух состояний: состояния покоя с открытыми глазами и при выполнении задачи на воображение движения с закрытыми глазами. С учетом топографии мы выбирали те факторы, реакция которых на воображаемое движение больше, чем на открытие глаз. Матрица соответствующих факторов определялась для каждого испытуемого отдельно, в данной работе использовали анализ главных компонент. Мы предполагаем, что после этого матрица индивидуального набора выбранных факторов может быть использована для определения мю-ритма в любой записи ЭЭГ с различными заданиями для данного субъекта (Garakh et al., 2020). Пример разделения альфа- и мю-ритмов для состояния спокойного бодрствования с закрытыми глазами, с помощью подхода, описанного нами, приведен на рис. 1: альфа-активность присутствует как в центральных, так и в затылочных отведениях, мю-ритм локализуется в основном в центральных.
Таким образом, в исследованиях, связанных с анализом мю-ритма, необходимо помнить о возможном влиянии самой парадигмы и базовой линии на вычисленное значение мю-ритма, контролировать параметры, сопряженные с процессами внимания, включать в анализ не только центральные отведения. В разделах, посвященных экспериментальным работам, отметим, каким образом авторы подходят к анализу мю-ритма.
ПОДАВЛЕНИЕ МЮ-РИТМА КАК ИНДЕКС АКТИВАЦИИ СИСТЕМЫ ЗЕРКАЛЬНЫХ НЕЙРОНОВ
Открытие у взрослых обезьян системы зеркальных нейронов (mirror neuron system, MNS, далее – СЗН), которая активировалась во время наблюдения и выполнения действий (di Pellegrino et al., 1992), и предположение о существовании аналогичной СЗН у людей породили большое число исследований. Считается, что СЗН играет решающую роль в обработке действий других и в ряде социальных когнитивных процессов, таких как ожидание действий, понимание намерения, имитация, сочувствие (Rizzolatti, Sinigaglia, 2010; Yin et al., 2017). Несмотря на то что метод ЭЭГ не позволяет точно определить активность конкретных нейронов, подавление мю-ритма было предложено в качестве показателя активности системы зеркальных нейронов человека, поскольку наблюдается при выполнении действия или наблюдении за ним (Muthukumaraswamy et al., 2004; Oberman et al., 2007; Fox et al., 2016; Bowman et al., 2017). Свидетельства так называемой “расширенной зеркальной нейронной сети” привели к более поздним представлениям о том, что активность зеркальных нейронов выходит за рамки моторного обучения. Мю-ритм использовался многими исследователями для исследования таких процессов, как эмпатия (Yang et al., 2009), восприятие речи (Moreno et al., 2013), социальная адаптация (Лебедева и др., 2018).
Стоит отметить, что в данной главе речь идет в основном об альфа-составляющей мю-ритма, а связь подавления мю-ритма с СЗН отмечают по большей части авторы, которые исследовали только альфа-составляющую мю-ритма (Лебедева и др., 2018; Wu et al., 2016; Krol et al., 2020; Isoda et al., 2016 и др.). Бета-составляющую также связывают с активностью СЗН, поскольку она подавляется при движении, наблюдении за движением и представлении движения (Muthukumaraswamy, Singh, 2008). Однако она в целом реже исследуется. Кроме того, некоторые авторы сообщают о том, что она недостаточно хороший показатель активности системы зеркальных нейронов, поскольку при наблюдении биологического движения подавление бета-составляющей не было более выраженным по сравнению с небиологическим, в отличие от альфа-составляющей (Hobson, Bishop, 2016).
В контексте обсуждения функционирования СЗН важно понимать, является ли десинхронизация мю-ритма специфичной для наблюдения объектно-направленного действия и биологического движения, поскольку была описана такая специфичность при активации системы зеркальных нейронов у обезьян (Rizzolatti, Craighero, 2004). В ряде работ на людях с использованием фМРТ среди областей, которые активируются во время наблюдения объектно-направленных действий, систематически отмечают области мозга, которые, как считается, отражают зеркальную систему человека: область Бродмана 44, латеральная и вентральная премоторная кора, нижняя и верхняя теменная доли (Caspers et al., 2010). Однако для наблюдения за биологическим движением были показаны противоречивые результаты (van Overwalle, Baetens, 2009). И хотя мета-анализ Фокса и соавторов, включающий 85 исследований, в которых мю-ритм использовался для определения активности зеркальной системы, показал, что мю-ритм является действенным средством измерения активности зеркальной системы, – общие эффекты десинхронизации мю-ритма обнаруживались как для выполнения, так и для наблюдения за действиями – авторы не нашли доказательств того, что десинхронизация мю-ритма была специфичной для объектно-направленного действия или биологического движения (Fox et al., 2016). В некоторых работах была продемонстрирована модуляция мю-ритма для объектно-направленного действия: десинхронизация мю-ритма была значительно больше при наблюдении точного захвата, чем при наблюдении за простым разгибанием руки без взаимодействия с предметом, и эти данные о подавлении мю-ритма во время объектно-связанных действий в отличие от действий, не связанных с объектом, были интерпретированы как активация целенаправленных моторных программ, связанных с системой зеркальных нейронов (Muthukumaraswamy, Johnson, 2004; Muthukumaraswamy et al., 2004). Однако простой просмотр стимулов-инструментов, без необходимости взаимодействия с ними, также приводил к подавлению мю-ритма, возможно, отражая автоматический доступ к действиям, связанным с объектом (Proverbio, 2012; Rüther et al., 2014). Кроме того, действия, не направленные на объекты, также приводили к десинхронизации мю-ритма (например, ходьба, Lin et al., 2020; глотание, Cuellar et al., 2016). Таким образом, объектно-направленные действия могут модулировать мю-ритм, но специфичности, подобной той, которая была обнаружена при описании системы зеркальных нейронов у обезьян, для показателя десинхронизации мю-ритма у человека не обнаруживается.
Схожие выводы можно сделать и относительно десинхронизации мю-ритма для биологического движения. С одной стороны, исследования, посвященные движению, показывают, что подавление мю-ритма может наблюдаться при просмотре биологического движения и не наблюдаться при просмотре небиологического: например, движения точечного света, созданные путем маркировки суставов конечностей людей (одетых в черное на полностью черном фоне), вызывали подавление мю-ритма относительно базовой линии, в то время как скремблированные версии этих анимаций – нет (Ulloa, Pineda, 2007). С другой стороны, видеоролики (процесса лепки из глины), из которых были исключены изображения рук, т.е. биологические объекты, также вызывали значительное подавление мю-ритма, что позволило авторам сделать выводы, что СЗН человека может активироваться даже при фактическом отсутствии биологических объектов (Isoda et al., 2016). У 14-месячных младенцев наблюдалось большее подавление мю-ритма в ситуации взаимодействия со взрослым, чем в условиях наблюдения за движениями взрослых людей и геометрических фигур, подавление мю-ритма в этих условиях не различалось между собой (Reid et al., 2011). Отсутствие различий между биологическим и небиологическим движением авторы объясняют тем, что мю-ритм модулируется в зависимости от способности производить наблюдаемое действие, а действия экспериментатора, которые они наблюдают, не могут быть воспроизведены младенцами из-за их ограниченного двигательного репертуара; а также делают вывод, что система зеркальных нейронов у младенцев активируется во время взаимодействия со взрослым (Reid et al., 2011); возможную зависимость активации СЗН от социального взаимодействия отмечают и в исследованиях на взрослых (Лебедева и др., 2020). Хобсон и Бишоп показали, что подавление мю-ритма как для биологических (руки), так и небиологических (калейдоскоп) движущихся стимулов в большей степени зависело от метода выделения мю-ритма, и в целом пришли к выводу, что эта мера не является надежной для изучения СЗН (Hobson, Bishop, 2016).
Действительно, далеко не все исследователи согласны с тем, что подавление мю-ритма является достоверным показателем активности системы зеркальных нейронов, а выводы, сделанные на основе изучения реактивности мю-ритма относительно активности СЗН, по их мнению, плохо охарактеризованы и зависят от предположений, которые выходят слишком далеко за пределы эмпирических данных (Dinstein et al., 2008; Turella et al., 2009; Hobson, Bishop, 2016; Hobson, Bishop, 2017). В частности, Хобсон и Бишоп (Hobson, Bishop, 2016) считают, что подавление мю-ритма может указывать на активность СЗН, но этот эффект является слабым и ненадежным и легко смешивается с подавлением альфа-ритма, что делает десинхронизацию мю-ритма недопустимым показателем для проверки активности зеркальной системы, так как она может просто фиксировать изменения визуального внимания во время наблюдения за действиями других.
Отмечают, что, чтобы мю-ритм считался допустимым показателем СЗН, он должен демонстрировать специфичность кросс-модального действия, т.е. реакция, связанная с одним действием, должна быть похожей независимо от того, наблюдается оно или выполняется (кроссмодальность), но также должна быть различимой для разных действий (специфичность), так как эти свойства определяют как ключевые для зеркальных нейронов (Dinstein et al., 2008; Oosterhof et al., 2013; Coll et al., 2017). Стоит отметить, что функциональное соответствие между двигательной реакцией и реакцией восприятия было продемонстрировано в работе Мукамеля и соавторов во время регистрации ответов отдельных нейронов в медиальной лобной и височной коре головного мозга человека во время выполнения и наблюдения за движениями (Mukamel et al., 2010). Колл и коллеги использовали классификацию паттернов ЭЭГ для оценки специфичности ответа мю-ритма на разные типы действий: успешная классификация паттернов наблюдалась для записей ЭЭГ с наличием и отсутствием тактильной стимуляции, но не для разных типов действий, при этом кроссмодальная классификация типа действия была успешна для альфа-ритма (группа левых теменно-затылочных каналов, но не центральных) (Coll et al., 2017). И хотя сами авторы отмечают, что анализу на уровне каналов ЭЭГ может не хватать пространственного разрешения, чтобы продемонстрировать кросс-модальную классификацию более слабых эффектов, тем не менее, основываясь на полученных данных, было высказано предположение, что мю-ритм вместо активности СЗН индексирует соматосенсорные, а не двигательные особенности действия, и определяет сенсорную обработку, а не двигательную активность (Cook et al., 2014; Coll et al., 2017).
Одновременные записи ЭЭГ и фМРТ были использованы в качестве подхода, направленного на исследование вклада активности СЗН в десинхронизацию мю-ритма. Используя этот подход, было показано, что активация различных областей за пределами моторной коры (т.е. первичной соматосенсорной коры) коррелирует с подавлением мю-ритма, что противоречило идее, что зеркальные нейроны в области Бродмана 44 являются основным источником десинхронизации мю-ритма (Arnstein et al., 2011; Yin et al., 2016). Типичные результаты пассивного наблюдения за движением и экспериментов с имитацией выявляют многие области коры, которые демонстрируют большие ответы фМРТ во время наблюдения и имитации, включая области, которые, как считается, не содержат зеркальных нейронов, например, первичную зрительную кору (Dinstein et al., 2008). В работе (Braadbaart et al., 2013) записывали ЭЭГ и фМРТ во время имитации или наблюдения за действиями; было показано, что подавление мю-ритма неспецифично для активации системы зеркальных нейронов: подавление мю-ритма коррелировало с BOLD-ответом в правой нижней теменной доле, премоторной коре и нижней лобной извилине – предполагаемых областях системы зеркальных нейронов, а также в других областях: мозжечке, левой медиальной лобной извилине, правой височной доле и таламусе, что, по мнению авторов, говорит о том, что подавление мю-ритма включает в себя ряд структур, которые модулируют двигательную подготовку и чувствительны к визуальному вводу, включая, но не ограничиваясь системой зеркальных нейронов (Braadbaart et al., 2013). Интересно, что исследования и анатомический анализ СЗН обезьян также показали, что другие регионы, включая дорсальную и медиальную премоторную кору, первичную моторную кору, вторичную соматосенсорную кору, срединно-дорсальную часть островковой доли и вентролатеральную префронтальную кору, а также подкорковые структуры, такие как моторные и полисенсорные ядра таламуса и средне-дорсальный клауструм, помимо традиционной теменно-премоторной сети, имеют “зеркальную активность” и, по мнению авторов, могут быть частью “расширенной” СЗН, через которую информация, касающаяся текущих движений, социального контекста, непредвиденных обстоятельств окружающей среды, абстрактных правил и внутренних состояний, может влиять на активность зеркальных нейронов и вносить вклад в различные социально-когнитивные функции (Bruni et al., 2018; Livi et al., 2019). Кроме того, в работе на обезьянах, используя одновременную регистрацию multi unit activity (MUA), local field potentials (LFP) и ЭЭГ, было показано, что активность различных популяций нейронов в вентральной премоторной коре способствует генерации мю-ритма, что, по мнению авторов, означает, что нейроны в вентральной премоторной коре могут представлять собой один из ключевых узлов “расширенной зеркальной сети”, участвующей в десинхронизации мю-ритма ЭЭГ (Bimbi et al., 2018).
Проблема потенциального смешения активности систем внимания и зеркальной системы стоит особенно остро в многочисленных исследованиях на младенцах, связывающих десинхронизацию мю-ритма с работой системы зеркальных нейронов (Rayson et al., 2017; John et al., 2016; Bowman et al., 2017), поскольку во второй половине первого года жизни быстро развивается как внимание, так и понимание того, что действия являются преднамеренными и целенаправленными (Debnath et al., 2019). Оценивая плотность источников тока (current source density, CSD), было показано, что наблюдение за движением экспериментатора вызывает активацию зеркальной системы у 9-месячных младенцев, которая не является простым распространением альфа-активации из затылочной коры (Debnath et al., 2019). Но в целом исследователи, даже придерживающиеся противоположных точек зрения, отмечают требование применения более строгих подходов к выделению мю-ритма, а также необходимость с осторожностью подходить к интерпретации существующих исследований мю-ритма в случае отсутствия такого контроля (Fox et al., 2016; Hobson, Bishop, 2016).
Таким образом, использование подавления мю-ритма в качестве индекса активации системы зеркальных нейронов хотя и остается открытым вопросом, подвергается достаточно серьезной критике, в том числе связанной с методическими проблемами, возникающими при исследовании мю-ритма. В разделах, посвященных экспериментальным работам, отметим связь интерпретаций полученных данных с СЗН.
ОТ МОТОРНЫХ ФУНКЦИЙ ДО ЯЗЫКОВЫХ ПРОЦЕССОВ И ЭМОЦИЙ
В соответствии с изложенными в предыдущих главах теоретическими и методологическими аспектами мы провели анализ современных исследований, анализирующих мю-ритм (табл. 1). Мы ограничили выбор экспериментальными работами, опубликованными за 2016–2021 гг., выполненными на здоровых взрослых испытуемых и использовавших только метод ЭЭГ (исключили МЭГ, ТМС и т.д.). Работы, посвященные методическим аспектам, интерфейсу “мозг-компьютер”, изучению измененных состояний сознания (гипноз), были исключены. Поиск осуществлялся по ключевым словам “мю-ритм” (“mu rhythm”) и “ЭЭГ” (“EEG”) в базе Pubmed (актуальность поиска: апрель 2021 г.). Заявленным критериям соответствовали 54 статьи.
Таблица 1.
Характеристики включенных в анализ исследований на здоровых испытуемых: частотный диапазон, процедура анализа мю-ритма, связь с системой зеркальных нейронов Table 1. Characteristics of included studies on healthy subjects: frequency range, mu rhythm analysis, association with the mirror neuron system
| Авторы | Частотный диапазон | Анализ мю-ритма1 | Связь с СЗН2 |
|---|---|---|---|
| Моторные функции | |||
| Coll et al., 2017 | 8–13 Гц, 15–25 Гц | 2, 3 | Нет |
| Lin et al., 2020 | 8–12 Гц | 3 | Н/У |
| Aridan et al., 2018 | 8–10 Гц, 11–12 Гц, 15–25 Гц | 2 | Н/У |
| Park et al., 2018 | 8–13 Гц | 1 | Н/У |
| Cuellar et al., 2016 | 8–13 Гц, 15–25 Гц | 2, 3 | Н/У |
| Rimbert et al., 2018 | 7–13 Гц, 15–30 Гц | 1 | Н/У |
| Iwane et al., 2019 | 10–18 Гц, 18–30 Гц | 3 | Н/У |
| Kooiman et al., 2020 | 9–13 Гц | 3 | Н/У |
| Моторные функции, восприятие | |||
| Wu et al., 2016 | 9–11 Гц | 1 | Да |
| Wamain et al., 2018 | 8–12 Гц | 2 | Н/У |
| Angelini et al., 2018 | 8–13 Гц, 15–20 Гц | 2 | Да |
| Isoda et al., 2016 | 10–12 Гц | 1 | Да |
| Kim J., Kim S., 2016 | 8–13 Гц | 1 | Да |
| Krol et al., 2020 | 8–13 Гц | 2 | Да |
| Sestito et al., 2018 | 8–13 Гц, 18–25 Гц | 2 | Да |
| Моторные функции, обучение | |||
| Alhajri et al., 2018 | 8–13 Гц | 1 | Н/У |
| Jochumsen et al., 2017 | 8–13 Гц | 1 | Н/У |
| Wu et al., 2017 | 9.8–11.7 Гц | 1 | Да |
| Behmer, Fournier, 2016 | 8–12 Гц | 3 | Да |
| Brunsdon et al., 2020 | 8–13 Гц, 13–35 Гц | 2 | Да |
| Восприятие | |||
| Shibuya et al., 2019 | 8–13 Гц | 2, 3 | Н/У |
| Heimann et al., 2019 | 8–14 Гц, 14–20 Гц, 18–24 Гц | 2 | Да |
| Marini et al., 2019 | 8–13 Гц | 1 | Н/У |
| Simon, Mukamel, 2016 | 8–13 Гц, 15–25 Гц | 2 | Да |
| Denis et al., 2017 | 8–13 Гц, 15–25 Гц | 2, 3 | Да |
| Heimann et al., 2017 | 8–14 Гц, 15–24 Гц | 2 | У |
| Riečanský et al., 2020 | 7–12 Гц, 13–30 Гц | 3 | Н/У |
| Восприятие, социальное взаимодействие | |||
| Pomiechowska, Csibra, 2017 | 8–12 Гц | 1 | Да |
| Shen et al., 2017 | 8–14 Гц | 1 | Н/У |
| Smyk et al., 2018 | 8–13 Гц, 14–22 Гц | 2 | Н/У |
| Kompatsiari et al., 2021 | 8–12 Гц | 2 | Да |
| Внимание, восприятие | |||
| Wen et al., 2017 | пик ~10 Гц | 1 | Н/У |
| Pereira et al., 2018 | 8–12 Гц | 1 | Н/У |
| Forschack et al., 2017 | 8–15 Гц, 16–30 Гц | 3 | Н/У |
| Cebolla et al., 2016 | пик ~10 Гц | 1 | Н/У |
| Malcolm et al., 2018 | 8–12 Гц | 2, 3 | Н/У |
| Социальное взаимодействие | |||
| Yin et al., 2017 | 8–13 Гц | 2 | Да |
| Peled-Avron et al., 2018 | 8–13 Гц | 2 | Н/У |
| Fitzpatrick et al., 2019 | 8–10 Гц, 10–12 Гц | 2 | У |
| Gutsell et al., 2020 | 8–13 Гц | 2 | Н/У |
| Эмоции | |||
| Moore et al., 2016 | 7.5–12.5 Гц | 3 | Да |
| Karakale et al., 2019 | 8–13 Гц | 3 | Да |
| Siqi-Liu et al., 2018 | 9–12 Гц, 16–20 Гц | 2 | У |
| Эмоции, социальное взаимодействие | |||
| Ensenberg et al., 2017 | 8–13 Гц | 2 | Да |
| Язык и речь | |||
| Cuellar, Del Toro, 2017 | 8–13 Гц, 15–25 Гц | 3 | Да |
| Kittilstved et al., 2018 | 8–13 Гц, 15–25 Гц | 3 | Н/У |
| Bechtold et al., 2018 | 8–10 Гц, 18–25 Гц | 2 | Н/У |
| Bowers et al., 2019 | пики ~10 Гц, ~20 Гц | 3 | Н/У |
| Thornton et al., 2018 | 7–25 Гц | 3 | Н/У |
| Язык и речь, рабочая память, внимание | |||
| Jenson et al., 2019 | пики ~ 10 Гц, ~ 20 Гц | 3 | Н/У |
| Принятие решений | |||
| Zhang, Gu, 2018 | пики ~ 10 Гц, ~ 20 Гц | 2, 3 | Н/У |
| Принятие решений, обучение | |||
| van de Vijver et al., 2018 | 9–14 Гц | 1 | Н/У |
| Индивидуальные различия | |||
| Weiss et al., 2020 | 8–14 Гц | 1 | Н/У |
| Nishimura et al., 2018 | 8–13 Гц | 2 | Да |
Примечание.1 1 – авторы анализируют мю-ритм только в центральных отведениях, без использования математических методов для разделения мю- и альфа-ритмов; 2 – авторы сообщают о значениях мю-ритма не только для центральных электродов; 3 – авторы используют математические методы для выделения мю-ритма с учетом индивидуальной топографии (например, анализ независимых компонент). Note.1 1 – authors report mu rhythm values for central scalp locations only, without using mathematical methods to separate mu and alpha rhythms; 2 – authors report mu rhythm values for non-central scalp locations; 3 – authors use mathematical methods to isolate the mu rhythm, taking into account individual topography (for example, analysis of independent components). Примечание.2 “Да” – авторы связывают полученные данные о подавлении мю-ритма с системой зеркальных нейронов, “Н/У” – не упоминают СЗН, “Нет” – опровергают связь показателя подавления мю-ритма с СЗН, “У” – единичные упоминания СЗН в тексте без связи с собственными результатами. Note.2 “Yes” – authors associate of the obtained data on mu suppression with the system of mirror neurons, “N/M” – authors do not mention the mirror neuron system; “No” – authors refute the relation of the obtained data on mu suppression with the system of mirror neurons; “M” – authors mention the mirror neuron system in the text without reference to their results.
Проведенный анализ показал, что примерно в каждой второй работе изучается только альфа-составляющая мю-ритма (табл. 1). В ряде работ, хотя и анализировали обе составляющие мю-ритма, не выявили специфических эффектов для бета-составляющей (например, Aridan et al., 2018; Coll et al., 2017; Rimbert et al., 2018; Sestito et al., 2018; Jenson et al., 2019; Bechtold et al., 2018; Heimann et al., 2019). Однако в некоторых работах при анализе двух частотных диапазонов были обнаружены отличия в их модуляции. При изучении влияния зрительной перспективы наблюдаемого действия было показано, что наибольшее подавление альфа-субкомпонента наблюдалось в условии перспективы от первого лица (по сравнению с перспективой от третьего лица и боковыми перспективами), в то время как на модуляцию бета-составляющей больше влияло направление действий в пространстве относительно наблюдателя (Angelini et al., 2018). Специфические паттерны активации в альфа- и бета-диапазонах мю-ритма были показаны при изучении речевых актов. По сравнению с контрольным условием (обычная речь), проговаривание вместе с записью и с отсроченной звуковой обратной связью вызвало увеличение десинхронизации альфа-компонента в правом полушарии, что авторы связывают с изменением сенсомоторного контроля, а в условиях имитации заикания в левом полушарии наблюдалось увеличение десинхронизации бета-составляющей, что, по мнению авторов, может быть результатом различных характеристик движения в этом условии (Kittilstved et al., 2018).
При этом большинство работ приводят результаты, касающиеся в основном десинхронизации или подавления мю-ритма; лишь в единичных работах приводятся данные, например, и о синхронизации: было показано, что при раскачивании маятника в своем темпе выражена синхронизация мю-ритма в альфа-диапазоне, тогда как во время преднамеренной координации движений маятника с партнером – десинхронизация (Fitzpatrick et al., 2019).
В исследованиях принимали участие как люди, не обладающие специальными навыками, так и профессионалы в своей области деятельности: пианисты (Wu et al., 2016), теннисисты (Denis et al., 2017), космонавты (Cebolla et al., 2016), пилоты (Sestito et al., 2018). Среди используемых экспериментальных парадигм наиболее распространены просмотр видео (Angelini et al., 2018; Isoda et al., 2016; Kim J., Kim S., 2016; Shibuya et al., 2019; Simon, Mukamel, 2016; Denis et al., 2017; Heimann et al., 2017; Riečanský et al., 2020; Pomiechowska, Csibra, 2017; Yin et al., 2017; Gutsell et al., 2020), изображений (Sestito et al., 2018) и реальных объектов (Kompatsiari et al., 2021); выполнение определенных действий (Lin et al., 2020; Park et al., 2018; Cuellar et al., 2016; Rimbert et al., 2018; Kooiman et al., 2020; Wen et al., 2017; Pereira et al., 2018; Cebolla et al., 2016; Peled-Avron et al., 2018; Fitzpatrick et al., 2019; Nishimura et al., 2018), а также сочетание выполнения и наблюдения за движением (Coll et al., 2017; Aridan et al., 2018; Krol et al., 2020; Malcolm et al., 2018). Кроме того, для модуляции мю-ритма используется тактильная стимуляция (Coll et al., 2017; Shibuya et al., 2019; Riečanský et al., 2020; Shen et al., 2017; Forschack et al., 2017; Smyk et al., 2018; Peled-Avron et al., 2018; Weiss et al., 2020), слуховая стимуляция (Wu et al., 2016; Thornton et al., 2018; Jenson et al., 2019), пассивные движения (Iwane et al., 2019), различного рода обучение или тренировка определенных действий (Alhajri et al., 2018; Jochumsen et al., 2017; Wu et al., 2017; Behmer, Fournier, 2016; Brunsdon et al., 2020; Bechtold et al., 2018), просмотр объектов с различными зрительными признаками (Wamain et al., 2018; Heimann et al., 2019; Marini et al., 2019; van de Vijver et al., 2018) и эмоциональных стимулов (Moore et al., 2016; Karakale et al., 2019; Siqi-Liu et al., 2018; Ensenberg et al., 2017). Используются парадигмы, требующие от испытуемого наименования предъявляемых действий (Cuellar, Del Toro, 2017), принятия решения для получения вознаграждения (Zhang, Gu, 2018), а также проговаривания как про себя, так и вслух (Kittilstved et al., 2018; Bowers et al., 2019).
В большинстве современных работ для отделения мю-ритма от альфа-активности используются математические методы или по крайней мере указываются значения мю-ритма не только для центральных, но и для других электродов (табл. 1).
В большинстве работ нет упоминания СЗН или есть единичные упоминания, во многих она используется лишь для теоретического обоснования, но некоторые авторы напрямую связывают полученные результаты о подавлении мю-ритма с системой зеркальных нейронов. Например, сообщается, что слуховые стимулы могут активировать систему зеркальных нейронов человека, когда звуки связаны с действиями (Wu et al., 2016); активация СЗН связана с предсказуемостью действия (Krol et al., 2020); кратковременная физическая подготовка усиливает активацию зеркальной системы для наблюдения за действиями (Brunsdon et al., 2020); интенсивность реакции зеркальной системы во время наблюдения за действием уменьшается с уровнем сознательности восприятия наблюдателя (Simon, Mukamel, 2016).
Мы проанализировали, какие процессы изучают с помощью показателей мю-ритма (блоки табл. 1). Стоит отметить, что это деление в некоторых случаях достаточно условное: мы опирались на те результаты, которые обсуждают авторы как наиболее значимые, и те ключевые слова, которые они использовали в своих работах. Наибольшее число работ связаны с восприятием (23) и моторными функциями (20). Были показаны отличия паттернов десинхронизации мю-ритма для разных видов движений. Так, при изучении концентрических и эксцентрических сокращений двуглавой мышцы было показано, что десинхронизация мю-ритма начинается раньше при выполнении эксцентрических сокращений, чем концентрических сокращений. Кроме того, только во время повторной серии выполнения наблюдались отличия топографии для двух типов движения: двусторонняя десинхронизация для эксцентрических сокращений, правосторонняя (отведение С4) во время концентрических сокращений; степень десинхронизации не отличалась для разных типов сокращений (Park et al., 2018). Десинхронизация мю-ритма была больше при глотании по сравнению с постукиванием языком, преимущественно в правом полушарии (Cuellar et al., 2016). Было выявлено снижение мощности мю-ритма во время предварительного замаха протезной ногой по сравнению с ходьбой без протеза, что может указывать на усиление моторного планирования и сенсомоторной интеграции (Kooiman et al., 2020). Также выявлена зависимость степени десинхронизации мю-ритма от скорости пассивного движения (Iwane et al., 2019), от предсказуемости выполняемого и наблюдаемого действия (Krol et al., 2020), от степени сознательности восприятия наблюдателя (Simon, Mukamel, 2016), от визуальных особенностей наблюдаемых действий (например, различной визуальной перспективы) (Angelini et al., 2018; Heimann et al., 2019; Heimann et al., 2017; Riečanský et al., 2020) и объектов (например, “конфликтность” аффордансов вызывала уменьшение десинхронизации мю-ритма (Wamain et al., 2018), а реальность объектов вызывала увеличение десинхронизации (Marini et al., 2019)), от опыта испытуемых, касающегося предлагаемой им экспериментальной задачи (Wu et al., 2016; Sestito et al., 2018; Denis et al., 2017). Большая десинхронизация альфа-составляющей мю-ритма наблюдалась в условии выполнения действий с закрытыми глазами по сравнению с открытыми; стоит отметить, что для бета-составляющей мю-ритма этих различий не наблюдалось (Rimbert et al., 2018).
Отдельное направление работ посвящено влиянию обучения и определенных его видов на подавление мю-ритма. Выполнение движения в качестве обучения вызывало большую десинхронизацию по сравнению с обучением в виде наблюдения выполнения (Brunsdon et al., 2020; Alhajri et al., 2018), обучение простым операциям в целом приводило к увеличению десинхронизации мю-ритма (Behmer, Fournier, 2016), при этом длительность тренировки не оказывала влияния на подавление мю-ритма (Jochumsen et al., 2017). Музыкальное обучение, являющееся достаточно сложным, не усиливало подавление мю-ритма у испытуемых, не являвшихся музыкантами (Wu et al., 2017).
В работах, посвященных изучению социального взаимодействия, были выявлены большие эффекты десинхронизации мю-ритма для координированных взаимодействий по сравнению с действиями без координации с партнером (Yin et al., 2017; Fitzpatrick et al., 2019); показано влияние зрительного контакта на модуляцию десинхронизации (Kompatsiari et al., 2021; Ensenberg et al., 2017); усиление подавления мю-ритма во время утешительного прикосновения у утешающего партнера (Peled-Avron et al., 2018). При ожидании стимуляции большая десинхронизация наблюдалась, если она должна была быть применена к своей руке по сравнению с рукой партнера (Shen et al., 2017), а в ожидании стимуляции от партнера-человека подавление мю-ритма было больше, чем при ожидании стимуляции со стороны робота-партнера (Smyk et al., 2018). Оригинальную парадигму с предварительным написанием эссе использовали Гуцелл и соавторы: после составления рассказа от первого лица о представителе другой расы нежели сами испытуемые наблюдалось значительное подавление мю-ритма при просмотре действий представителей другой этнической группы (Gutsell et al., 2020).
Интерес представляют работы, так или иначе затрагивающие процессы внимания (6), в которых особенно требуется контролировать смешение эффектов подавления мю- и альфа-ритмов, при этом лишь в половине из них авторы контролировали эти эффекты при анализе мю-ритма (Forschack et al., 2017; Malcolm et al., 2018; Jenson et al., 2019). Малькольм и соавторы, используя анализ независимых компонент и кластерный анализ для выделения корковых источников мю-ритма, показали большее подавление мю-ритма в условии повышенной сенсорной нагрузки (движущийся оптический поток) (Malcolm et al., 2018). В другой работе, выполненной с участием космонавтов, без контроля затылочных отведений и без дополнительной обработки, было показано, что десинхронизация мю-ритма увеличивалась в условиях невесомости, что по мнению авторов свидетельствует о большем участии моторной коры из-за высоких требований к постоянной корректировке позы тела в невесомости (Cebolla et al., 2016), однако такой эффект мог быть достигнут из-за большей десинхронизации альфа-ритма в сложных условиях невесомости, требующих большего внимания, эффекты которого авторы не контролировали, поэтому к их выводам следует подходить с осторожностью.
Появляются работы, использующие анализ мю-ритма для изучения эмоций (4), процессов, связанных с языком и речью (6). Была показана большая десинхронизация для речевых стимулов по сравнению с неречевыми как в альфа-, так и в бета-диапазоне мю-ритма (Thornton et al., 2018). При сравнении нейтральных и эмоциональных стимулов были получены противоречивые данные: в одной работе десинхронизация мю-ритма была больше при просмотре эмоциональных движений по сравнению с нейтральными (Siqi-Liu et al., 2018), при этом в другой работе при просмотре нейтральных лиц подавление мю-ритма было больше, чем при просмотре счастливых и грустных (Karakale et al., 2019). Большее подавление мю-ритма при предъявлении эмоциональных лиц, чем при предъявлении эмоциональных слов, было обнаружено в работе Мура и соавт. (Moore et al., 2016).
Единичные работы посвящены процессам принятия решений, рабочей памяти и индивидуальным различиям. Так, по мнению некоторых авторов, динамика принятия решения отражается в изменениях осцилляторной активности, в том числе мю-ритма (Zhang, Gu, 2018), а индивидуальные особенности, связанные с исполнительными функциями и скоростью обработки информации, могут оказывать влияние на модуляцию мю-ритма (Weiss et al., 2020).
Таким образом, в настоящее время анализ мю-ритма используется для изучения широкого спектра процессов, от моторных функций, традиционно связываемых с сенсомоторными ритмами, до языковых процессов и эмоций. Стоит отметить наметившиеся тенденции включения в анализ бета-составляющей мю-ритма наравне с альфа-составляющей, активное использование математических методов для выделения мю-ритма, а также обсуждение результатов без соотнесения подавления мю-ритма с активностью системы зеркальных нейронов.
МЮ-РИТМ В КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ
Для клинических работ, как и в предыдущей главе, представлена информация об исследуемых частотных диапазонах, применении специальных методов для выделения мю-ритма из смеси с альфа-ритмом, связи с системой зеркальных нейронов (табл. 2).
Таблица 2.
Характеристики включенных в анализ клинических исследований: частотный диапазон, процедура анализа мю-ритма, связь с системой зеркальных нейронов3Table 2. Characteristics of included clinical studies: frequency range, mu rhythm analysis, association with the mirror neuron system3
| Авторы | Частотный диапазон | Анализ мю-ритма | Связь с СЗН |
|---|---|---|---|
| Двигательные нарушения в результате ОНМК | |||
| Либуркина и др., 2018 | 4–40 Гц | 3 | Н/У |
| Bartur et al., 2019 | 12–20 Гц, 10–12 Гц | 1 | У |
| Frenkel-Toledo et al., 2016 | 8–10 Гц | 2 | Да |
| Remsik et al., 2019 | 8–12 Гц, 18–26 Гц | 1 | Н/У |
| Фролов и др., 2017a | 5–30 Гц | 3 | Н/У |
| Церебральный паралич | |||
| Jongsma et al., 2020 | пик ~10 Гц | 1 | У |
| Диспраксия | |||
| Lust et al., 2019 | 7.5–12.5 Гц | 1 | Да |
| СДВГ | |||
| Yordanova et al., 2013 | 8–12 Гц | 1 | Н/У |
| Заикание | |||
| Saltuklaroglu et al., 2017 | 3–34 Гц | 3 | Н/У |
| Jenson et al., 2020 | 8–13 Гц, 14–25 Гц | 3 | У |
| Пограничное расстройство личности | |||
| Martin et al., 2017 | 8–13 Гц | 1 | Да |
| РАС | |||
| Oberman et al., 2013 | 8–13 Гц | 1 | Да |
| Bernier et al., 2007 | 8–13 Гц | 1 | Да |
| Cole et al., 2018 | 8–10 Гц, 10–12 Гц | 1 | Да |
| de Vega et al., 2019 | 8–13 Гц, 15–20 Гц | 2 | Да |
| Dumas et al., 2014 | 8–10 Гц, 11–13 Гц | 2 | Да |
| Sotoodeh et al., 2020 | 8–10 Гц, 10–13 Гц, 15–25 Гц | 1 | Да |
| Hudac et al., 2017 | 10–12 Гц, 8–10 Гц | 1 | Да |
| Ruysschaert et al., 2014 | пик ~8.58 Гц | 1 | Да |
| Шизофрения | |||
| Horan et al., 2014 | 8–13 Гц | 1 | Да |
| Brown et al., 2016 | 8–13 Гц | 1 | Да |
| Гарах и др., 2014 | 8–13 Гц | 3 | У |
| McCormick et al., 2012 | 8–13 Гц | 1 | Да |
| Mitra et al., 2015 | Н/У | 1 | Да |
| Singh et al., 2011 | 8–13 Гц | 2 | Н/У |
| Zaytseva et al., 2017 | 6–14 Гц | 3 | Да |
Для пациентов с утраченными или нарушенными моторными функциями вследствие очаговых поражений (при нарушении мозгового кровообращения) мю-ритм используется в качестве диагностического маркера для оценки степени нарушения сенсомоторной функции, а также ее пластичности (восстановления или перестройки) в процессе реабилитации. У пациентов с нарушениями движений рук в результате ОНМК (острое нарушение мозгового кровообращения) или травматической болезни спинного мозга десинхронизация мю-ритма характеризуется меньшим топографическим распределением по сравнению со здоровыми испытуемыми, что авторы связывают с общим снижением уровня сенсомоторной десинхронизации при представлении движения (Либуркина и др., 2018). Десинхронизация альфа- и бета-составляющих мю-ритма у пациентов с ОНМК в пораженном полушарии коррелировала с остаточной моторной функцией в паретичной верхней конечности (оценивалась согласно стандартным клиническим тестам) (Bartur et al., 2019), а использование устройств с интерфейсом “мозг-компьютер” в их реабилитации приводило к увеличению десинхронизации мю-ритма в ипсилезионном полушарии во время попыток движения поврежденной рукой (Remsik et al., 2019). Было обнаружено сниженное подавление мю-ритма при имитации движений у пациентов с идеомоторной апраксией после инсульта с поражением правой нижней теменной извилины и правой нижней лобной извилины, т.е. областей, которые предположительно входят в систему зеркальных нейронов и связаны с процессом имитации движений, затрудненным у пациентов с идеомоторной апраксией – они не могут повторить простые действия экспериментатора (Frenkel-Toledo et al., 2016). Показано, что у постинсультных больных снижена по сравнению со здоровыми испытуемыми основная частота мю-ритма как в состоянии покоя, так и при воображении движения кистью правой или левой руки, степень подавления мю-ритма при воображении движения в первичных соматосенсорных областях также была меньше у пациентов (Фролов и др., 2017a).
Исследование мю-ритма также представляет научный интерес и практическую ценность при исследовании двигательных нарушений у детей вследствие заболеваний нейроразвития. В обзоре Демас и соавторов отмечается, что наиболее часто у пациентов с односторонним церебральным параличом наблюдается снижение десинхронизации и синхронизации мю-ритма, но также обнаруживается его атипичная топография (Démas et al., 2019). При детском церебральном параличе с односторонним поражением спектральная мощность мю-ритма в пораженном полушарии не изменялась в ответ на моторные задания вне зависимости от задействованной конечности, при этом мощность мю-ритма повышалась в интактном полушарии, подтверждая гипотезу о том, что интактное полушарие берет на себя функцию тормозного контроля моторного поведения (Jongsma et al., 2020). У детей с диспраксией, характеризующейся проблемами с моторным контролем при различных формах поведения, таких как походка, поза, контроль движений глаз и воображаемое действие, выявляется более низкий уровень подавления, а также когерентности мю-ритма в лобно-теменных отделах в задании на имитацию наблюдаемого действия по сравнению с типично развивающимися сверстниками, что, по мнению этих авторов, отражает атипичное функционирование СЗН (Lust et al., 2019). У детей с синдромом дефицита внимания и гиперактивности в отличие от контрольной группы увеличение десинхронизации мю-ритма наблюдалось на стимулы, которые не требовали двигательной реакции, поскольку обладали только частью характеристик целевых стимулов (Yordanova et al., 2013). Вероятно, такие особенности сложных стимулов вызывают у этих детей не относящуюся к задаче двигательную активацию (Yordanova et al., 2013).
К нейрофизиологическим механизмам заикания относят нарушения работы базальных ганглиев и сенсомоторной системы, поэтому при данном нарушении речи важное значение имеет изучение мю-ритма (Jenson et al., 2020). В задачах пассивного прослушивания и слуховой дискриминации у взрослых с заиканием выявили повышенную десинхронизацию бета-составляющей мю-ритма при пассивном аудировании, а также пониженную синхронизацию альфа-составляющей мю-ритма в условиях дискриминации слуховых стимулов, что указывает на снижение сенсорной фильтрации (sensory gating) (Saltuklaroglu et al., 2017). У этих же испытуемых в другом исследовании было показано снижение десинхронизации альфа- и бета-составляющих мю-ритма в левом полушарии как при воспроизведении слов вслух, так и про себя, что, по мнению авторов, говорит о том, что нарушения сенсомоторной активности есть даже при беглой речи (пробы, в которых испытуемые заикались, были исключены из анализа) и могут приводить к сбивчивой речи (Jenson et al., 2020). Стоит отметить, что эта группа исследователей для выделения двух составляющих мю-ритма использовала анализ независимых компонент в отличие от многих других клинических работ, в которых мю-ритм анализировался только в центральных отведениях без дополнительной обработки (табл. 2).
При психических расстройствах со сложной клинической картиной мю-ритм часто изучается как потенциальный физиологический коррелят того или иного симптома, часто напрямую не связанного с моторными функциями, но, как предполагают многие авторы, ассоциированного с функцией системы зеркальных нейронов (табл. 2). Исследование пациентов с пограничным расстройством личности, состояние которых нередко характеризуется сложностями в проявлении эмпатии, которое связывают с активностью СЗН, не выявило значимых отличий мю-ритма от нормы, хотя у пациентов отмечался тренд временной задержки подавления мю-ритма в задании на наблюдение за действиями (Martin et al., 2017). Уильямс и соавторы впервые предположили, что дисфункция системы зеркальных нейронов лежит в основе нарушений процесса имитации при аутизме, проявляющихся в трудностях копирования действий, а также подавления более стереотипного подражания, такого как эхолалия (Williams et al., 2001). В работе Оберман было показано снижение мю-ритма для детей с расстройствами аутистического спектра (РАС) по сравнению с контрольной группой здоровых детей для условия наблюдения за действием, но не для выполнения, при этом увеличение подавления мю-ритма в зависимости от возраста наблюдалось в двух группах, что, по мнению авторов, отражает общий процесс развития, но не нормализацию работы системы зеркальных нейронов при РАС (Oberman et al., 2013). У взрослых с высокофункциональным аутизмом при восприятии движения (но не его воспроизведении) также обнаруживалось снижение подавления мю-ритма по сравнению с нейротипичными здоровыми, а их способность к имитации движений коррелировала с индексом подавления мю-ритма при восприятии движения (Bernier et al., 2007). Похожие данные были получены и в другом исследовании, однако снижение подавления мю-ритма при наблюдении движений у взрослых людей с аутизмом по сравнению с контрольной группой наблюдалось только для верхнего поддиапазона альфа-составляющей мю-ритма, но не для нижнего поддиапазона 8–10 Гц, поэтому авторы предполагают, что физиологические процессы, связанные с анализом движений, нарушаются не глобально, а избирательно (только при восприятии движений), а также ставят под сомнение утверждение о глобальной дисфункции СЗН при аутизме (Dumas et al., 2014). Коул и соавторы также не обнаружили отличий подавления мю-ритма в нижнем поддиапазоне 8–10 Гц у взрослых с РАС, однако сниженное подавление мю-ритма в этом поддиапазоне во фронтальных отведениях в правом полушарии во время наблюдения за действием, с последующим решением о намерении человека, выполняющего действие, у этих пациентов коррелировало с меньшей способностью распознавать намерения других (Cole et al., 2018). Степень выраженности аутистических симптомов, по всей видимости, оказывает влияние и на физиологические механизмы обработки стимулов, связанных с целенаправленными движениями. Так, было показано, что у взрослых с высоким уровнем аутистических симптомов не происходит подавления альфа- и бета-составляющих мю-ритма в ответ на восприятие действий с предметами, а также в ответ на восприятие объектов, с которыми можно производить какие-либо целенаправленные действия (например, фен) (de Vega et al., 2019).
Стоит отметить, что большинство работ, посвященных РАС у детей и взрослых, анализируют мю-ритм только в центральных отведениях, без дополнительной обработки (табл. 2), однако в некоторых работах для контроля эффектов, связанных с вниманием, использовалось отслеживание движений глаз (например, Cole et al., 2018; Sotoodeh et al., 2020). В одной из таких работ было показано, что две составляющие мю-ритма при восприятии движения не отличались у детей с РАС и контрольной группы, а затем, используя айтрекер, было обнаружено, что дети с РАС уделяли меньшее внимание стимулам с движением, что, по мнению авторов, может ставить под сомнение результаты предыдущих ЭЭГ-исследований, которые не контролировали зрительное внимание и обнаружили возможный дефицит функций СЗН у людей с РАС (Sotoodeh et al., 2020). В другом исследовании, хотя и анализировали только альфа-составляющую мю-ритма, также не выявили отличий реактивности мю-ритма у детей с РАС и детей контрольной группы как во время выполнения, так и при наблюдении целенаправленных действий (Ruysschaert et al., 2014). Помимо недостаточного контроля эффектов внимания такие противоречия в результатах связывают с фенотипической и генетической гетерогенностью РАС, а также с функциональными различиями нижних и верхних поддиапазонов альфа-составляющей мю-ритма: предполагают, что аберрантные паттерны при РАС специфичны для верхней мю-полосы, тогда как нижняя полоса отражает менее атипичные паттерны (Hudac et al., 2017; Dumas et al., 2014).
Нарушения обработки социальной и эмоциональной информации при шизофрении связывают с аномально функционирующей системой зеркальных нейронов, что обусловливает большую часть энцефалографических исследований мю-ритма при данной патологии (McCormick et al., 2012; табл. 2). Отмечают увеличенное подавление мю-ритма над сенсомоторной корой левого полушария у пациентов в остром психотическом состоянии по сравнению со здоровыми испытуемыми и пациентами в ремиссии, которое было связано с позитивными симптомами (McCormick et al., 2012). Авторы предположили, что аномальная активность СЗН может наблюдаться во время активной (психотической) фазы болезни и коррелирует с тяжестью психоза (McCormick et al., 2012). В других исследованиях отличий показателя реактивности мю-ритма у хронических больных в ремиссии и здоровых испытуемых также обнаружено не было (Horan et al., 2014; Brown et al., 2016). В работе Сингх и соавторов у больных шизофренией с первым эпизодом было обнаружено, напротив, сниженное подавление мю-ритма при наблюдении за биологическим движением по сравнению со здоровыми испытуемыми (Singh et al., 2011), при этом степень десинхронизации мю-ритма коррелировала с выраженностью негативных симптомов (Assessment of Negative Symptoms, SANS) и показателями социальной адаптации (Social Adjustment Scale – Self report, SAS-SR). Было показано, что реактивность мю-ритма до и после антипсихотической терапии не отличалась у пациентов с первыми психотическими эпизодами, однако большее подавление мю-ритма в остром состоянии коррелировало с лучшим восстановлением процесса мышления (оценивалось по шкале PANSS) в результате антипсихотической терапии (Mitra et al., 2015). Стоит отметить, что в этих работах мю-ритм анализировался без дополнительной обработки (табл. 2). С использованием анализа главных компонент для выделения мю-ритма нами было показано сниженное подавление мю-ритма при воображении движения у больных шизофренией с первым приступом по сравнению со здоровыми испытуемыми, а также отсутствие межполушарной асимметрии мю-ритма у праворуких пациентов с шизофренией, что может быть связано с нарушением нисходящего контроля над сенсомоторными зонами левого полушария (Гарах и др., 2014). В описанных нами клинических случаях кататонической шизофрении, в которых моторные нарушения были одним из ключевых клинических симптомов, подавление мю-ритма при воображении движения было менее выражено у этих пациентов во фронтальных и центральных отведениях по сравнению не только со здоровыми испытуемыми, но и по сравнению с больными параноидной шизофренией (Zaytseva et al., 2017).
Таким образом, в клинических исследованиях показатель подавления мю-ритма используется для оценки сохранности двигательной функции и динамики ее восстановления при нарушениях мозгового кровообращения, нарушениях нейроразвития (ДЦП и некоторых процессов с изолированными нарушениями моторики или моторного компонента речи). Мю-ритм имеет, как правило, отклонения в пораженном полушарии, могут страдать его временные характеристики, обусловливая патологические проявления (например, импульсивность). При психических расстройствах данные о реактивности мю-ритма носят достаточно противоречивый характер. С одной стороны, такие противоречия могут быть связаны с гетерогенностью выборки пациентов без учета особенностей их клинической картины. С другой стороны, анализ мю-ритма во многих клинических исследованиях был ограничен центральными отведениями, без дополнительной обработки, а эффекты изменения внимания не всегда контролировались должным образом. Оценка реактивности мю-ритма в гомогенных клинических группах, а также на различных стадиях заболевания с применением математических методов анализа может дать более достоверные результаты.
ЗАКЛЮЧЕНИЕ
Мю-ритм, описанный 70 лет назад, является удобным инструментом для изучения моторных функций. Подавление мю-ритма вызывается как активным, так и пассивным движением или даже простой мыслью о движении. В настоящее время анализ десинхронизации мю-ритма находит практическое применение при реабилитационных мероприятиях, используется для изучения нормального развития и различных заболеваний. В современных экспериментальных работах показаны связь этого ритма и его возможная роль для широкого спектра процессов – восприятия, обучения, социального функционирования, и даже эмоций, и процессов принятия решений. Нам представляется важным изучение не только альфа-, но и бета-составляющей мю-ритма, учитывая возможный риск упустить потенциально значимые эффекты. Одна из ключевых проблем заключается в том, надежно ли мю-ритм отличается от альфа-активности. С ней связаны возникающие методические вопросы, к решению которых не все авторы подходят добросовестно, анализируя мю-ритм. В том числе из-за этой проблемы использование показателя подавления мю-ритма в качестве индекса активации системы зеркальных нейронов ставится под сомнение. Важным для будущих исследований являются использование современных методологических подходов для анализа мю-ритма и контроль параметров, сопряженных с процессами внимания.
Работа выполнена в рамках государственного задания Министерства образования и науки Российской Федерации на 2021–2023 гг. (АААА-А17-117092040004-0).
Список литературы
Александров А.А., Тугин С.М. Изменения мю-ритма при различных формах двигательной активности и наблюдении движений. Российский физиологический журнал им. И.М. Сеченова. 2010. 96 (11): 46–54.
Аликина М.А., Махин С.А., Павленко В.Б. Амплитудно-частотные, топографические, возрастные особенности и функциональное значение сенсомоторного ритма ЭЭГ. Ученые записки Крымского федерального университета им. В.И. Вернадского. Биология. Химия. 2016. 2 (2): 3–24.
Гарах Ж.В., Зайцева Ю.С., Новотоцкий-Власов В.Ю., Хаердинова О.Ю., Гурович И.Я., Шмуклер А.Б., Стрелец В.Б. Подавление мю-ритма ЭЭГ при представлении движения у больных шизофренией. Социальная и клиническая психиатрия. 2014. 24 (3): 5–11.
Керечанин Я.В., Гусек Д., Бобров П.Д., Федотова И.Р., Фролов А.А. Источники электрической активности областей мозга, вовлеченных в воображение движений. Журн. высш. нерв. деят. им. И.П. Павлова. 2019. 69 (6): 711–725.
Лебедева Н.Н., Буркитбаев С.Е., Каримова Е.Д. Активация зеркальной системы мозга зависит от способа предъявления стимулов: непосредственно экспериментатором или как видеоролик. Журн. высш. нерв. деят. им. И.П. Пав-лова. 2020. 70 (4): 460–472.
Лебедева Н.Н., Каримова Е.Д., Карпычев В.В., Мальцев В.Ю. Зеркальная система мозга при наблюдении, выполнении и представлении моторных задач – нейрофизиологическое отражение восприятия чужого сознания. Журн. высш. нерв. деят. им. И.П. Павлова. 2018. 68 (2): 204–215.
Либуркина С.П., Васильев А.Н., Каплан А.Я., Иванова Г.Е., Чуканова А.С. Пилотное исследование идеомоторного тренинга в контуре интерфейса мозг–компьютер у пациентов с двигательными нарушениями. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2018. 118 (9): 63–68.
Мокиенко О.А., Черникова Л.А., Фролов А.А., Бобров П.Д. Воображение движения и его практическое применение. Журн. высш. нервн. деят. им. И.П. Павлова. 2013. 63 (2): 195–204.
Фролов А.А., Азиатская Г.А., Бобров П.Д., Люкманов Р.Х., Федотова И.Р., Гусек Д., Снашел В. Электрофизиологическая активность мозга при управлении интерфейсом мозг-компьютер, основанным на воображении движений. Физиология человека. 2017a. 43 (5): 17–28.
Фролов А.А., Федотова И.Р., Гусек Д., Бобров П.Д. Ритмическая активность мозга и интерфейс мозг-компьютер, основанный на воображении движений. Успехи физиол. наук. 2017b. 48 (3): 72–91.
Aflalo T., Zhang C.Y., Rosario E.R., Pouratian N., Orban G.A., Andersen R.A. A shared neural substrate for action verbs and observed actions in human posterior parietal cortex. Sci Adv. 2020. 6 (43): eabb3984.
Alhajri N., Hodges N.J., Zwicker J.G., Virji-Babul N. Mu Suppression Is Sensitive to Observational Practice but Results in Different Patterns of Activation in Comparison with Physical Practice. Neural plasticity. 2018. 2018: 8309483.
Angelini M., Fabbri-Destro M., Lopomo N.F., Gobbo M., Rizzolatti G., Avanzini P. Perspective-dependent reactivity of sensorimotor mu rhythm in alpha and beta ranges during action observation: an EEG study. Scientific reports. 2018. 8 (1): 1–11.
Aridan N., Ossmy O., Buaron B., Reznik D., Mukamel R. Suppression of EEG mu rhythm during action observation corresponds with subsequent changes in behavior. Brain research. 2018. 1691: 55–63.
Arnstein D., Cui F., Keysers C., Maurits N.M., Gazzola V. μ-suppression during action observation and execution correlates with BOLD in dorsal premotor, inferior parietal, and SI cortices. J Neurosci. 2011. 31 (40): 14243–14249.
Avanzini P., Fabbri-Destro M., Dalla Volta R., Daprati E., Rizzolatti G., Cantalupo G. The dynamics of sensorimotor cortical oscillations during the observation of hand movements: an EEG study. 2012. PLoS One. 7 (5): e37534.
Bartur G., Pratt H., Soroker N. Changes in mu and beta amplitude of the EEG during upper limb movement correlate with motor impairment and structural damage in subacute stroke. Clinical neurophysiology. 2019. 130 (9): 1644–1651.
Bechtold L., Ghio M., Lange J., Bellebaum C. Event-related desynchronization of mu and beta oscillations during the processing of novel tool names. Brain and language. 2018. 177: 44–55.
Behmer Jr.L.P., Fournier L.R. Mirror neuron activation as a function of explicit learning: changes in mu-event-related power after learning novel responses to ideomotor compatible, partially compatible, and non-compatible stimuli. European Journal of Neuroscience. 2016. 44 (10): 2774–2785.
Bernier R., Dawson G., Webb S., Murias M. EEG mu rhythm and imitation impairments in individuals with autism spectrum disorder. Brain and cognition. 2007. 64 (3): 228–237.
Bimbi M., Festante F., Coudé G., Vanderwert R.E., Fox N.A., Ferrari P.F. Simultaneous scalp recorded EEG and local field potentials from monkey ventral premotor cortex during action observation and execution reveals the contribution of mirror and motor neurons to the mu-rhythm. NeuroImage. 2018. 175: 22–31.
Boonstra T.W., Daffertshofer A., Breakspear M., Beek P.J. Multivariate time-frequency analysis of electromagnetic brain activity during bimanual motor learning. Neuroimage. 2007. 36 (2): 370–377.
Bowers A., Saltuklaroglu T., Jenson D., Harkrider A., Thornton D. Power and phase coherence in sensorimotor mu and temporal lobe alpha components during covert and overt syllable production. Experimental brain research. 2019. 237 (3): 705–721.
Bowman L.C., Bakermans-Kranenburg M.J., Yoo K.H., Cannon E.N., Vanderwert R.E., Ferrari P.F., van IJzendoorn M.H., Fox N.A. The mu-rhythm can mirror: Insights from experimental design, and looking past the controversy. Cortex. 2017. 96: 121–125.
Braadbaart L., Williams J.H., Waiter G.D. Do mirror neuron areas mediate mu rhythm suppression during imitation and action observation? International Journal of Psychophysiology. 2013. 89 (1): 99–105.
Brinkman L., Stolk A., Dijkerman H.C., de Lange F.P., Toni I. Distinct roles for alpha- and beta-band oscillations during mental simulation of goal-directed actions. J. Neurosci. 2014. 34 (44): 14783–14792.
Brismar T. Review The human EEG–physiological and clinical studies. Physiol Behav. 2007. 92 (1–2): 141–147.
Brown E.C., Gonzalez-Liencres C., Tas C. Reward modulates the mirror neuron system in schizophrenia: A study into the mu rhythm suppression, empathy, and mental state attribution. Soc. Neurosci. 2016. 11 (2): 175–186.
Bruni S., Gerbella M., Bonini L., Borra E., Coudé G., Ferrari P.F., Rozzi S. Cortical and subcortical connections of parietal and premotor nodes of the monkey hand mirror neuron network. Brain Structure and Function. 2018. 223 (4): 1713–1729.
Brunsdon V.E.A., Bradford E.E.F., Smith L., Ferguson H.J. Short-term physical training enhances mirror system activation to action observation. Soc Neurosci. 2020. 15 (1): 98–107.
Buneo C.A., Jarvis M.R., Batista A.P., Andersen R.A. Direct visuomotor transformations for reaching. Nature. 2002. 416: 632–636.
Capotosto P., Babiloni C., Romani G.L., Corbetta M. Frontoparietal cortex controls spatial attention through modulation of anticipatory alpha rhythms. J. Neurosci. 2009. 29: 5863–5872.
Carlqvist H., Nikulin V.V., Strömberg J.O., Brismar T. Amplitude and phase relationship between alpha and beta oscillations in the human electroencephalogram. Med Biol Eng Comput. 2005. 43 (5): 599–607.
Caspers S., Zilles K., Laird A.R., Eickhoff S.B. ALE meta-analysis of action observation and imitation in the human brain. NeuroImage. 2010. 50: 1148–1167.
Cebolla A.M., Petieau M., Dan B., Balazs L., McIntyre J., Chéron G. Cerebellar contribution to visuo-attentional alpha rhythm: insights from weightlessness. Scientific reports. 2016. 6 (1): 1–10.
Chatrian G.E., Petersen M.C., Lazarte J.A. The blocking of the rolandic wicket rhythm and some central changes related to movement. Electroencephal. Clin. Neurophysiol. 1959. 11: 497–510.
Cochin S., Barthelemy C., Roux S., Martineau J. Observation and execution of movement: similarities demonstrated by quantified electroencephalography. Eur J Neurosci. 1999. 11: 1839–1842.
Cole E.J., Barraclough N.E., Enticott P.G. Investigating Mirror System (MS) Activity in Adults with ASD When Inferring Others’ Intentions Using Both TMS and EEG. Journal of autism and developmental disorders. 2018. 48 (7): 2350–2367.
Coll M.P., Press C., Hobson H., Catmur C., Bird G. Crossmodal classification of mu rhythm activity during action observation and execution suggests specificity to somatosensory features of actions. Journal of Neuroscience. 2017. 37 (24): 5936–5947.
Cook R., Bird G., Catmur C., Press C., Heyes C. Mirror neurons: from origin to function. Behav Brain Sci. 2014. 37: 177–192.
Cuellar M.E., Del Toro C.M. Time-Frequency Analysis of Mu Rhythm Activity during Picture and Video Action Naming Tasks. Brain Sci. 2017. 7 (9): 114.
Cuellar M., Harkrider A.W., Jenson D., Thornton D., Bowers A., Saltuklaroglu T. Time–frequency analysis of the EEG mu rhythm as a measure of sensorimotor integration in the later stages of swallowing. Clinical Neurophysiology. 2016. 127 (7): 2625–2635.
Cuevas K., Cannon E.N., Yoo K., Fox N.A. The infant EEG mu rhythm: methodological considerations and best practices. Dev. Rev. 2014. 34 (1): 26–43.
Debnath R., Salo V.C., Buzzell G.A., Yoo K.H., Fox N.A. Mu rhythm desynchronization is specific to action execution and observation: Evidence from time-frequency and connectivity analysis. Neuroimage. 2019. 184: 496–507.
Démas J., Bourguignon M., Périvier M., De Tiège X., Dinomais M., Van Bogaert P. Mu rhythm: State of the art with special focus on cerebral palsy. Annals of physical and rehabilitation medicine. 2019. 63 (5): 439–446.
Denis D., Rowe R., Williams A.M., Milne E. The role of cortical sensorimotor oscillations in action anticipation. Neuroimage. 2017. 146: 1102–1114.
De Vega M., Padrón I., Moreno I.Z., García-Marco E., Domínguez A., Marrero H., Hernández S. Both the mirror and the affordance systems might be impaired in adults with high autistic traits. Evidence from EEG mu and beta rhythms. Autism research. 2019. 12 (7): 1032–1042.
Dillon D.G., Pizzagalli D.A. Inhibition of action, thought, and emotion: a selective neurobiological review. Applied and Preventive Psychology. 2007. 12 (3): 99–114.
Dinstein I., Thomas C., Behrmann M., Heeger D.J. A mirror up to nature. Current Biology. 2008. 18 (1): R13–R18.
Di Pellegrino G., Fadiga L., Fogassi L., Gallese V., Rizzolatti G. Understanding motor events: a neurophysiological study. Experimental brain research. 1992. 91 (1): 176–180.
Dumas G., Soussignan R., Hugueville L., Martinerie J., Nadel J. Revisiting mu suppression in autism spectrum disorder. Brain research. 2014. 1585: 108–119.
Engel A.K., Fries P. Beta-band oscillations–signalling the status quo? Current opinion in neurobiology. 2010. 20: 156–165.
Ensenberg N.S., Perry A., Aviezer H. Are you looking at me? Mu suppression modulation by facial expression direction. Cognitive, Affective, & Behavioral Neuroscience. 2017. 17 (1): 174–184.
Fitzpatrick P., Mitchell T., Schmidt R.C., Kennedy D., Frazier J.A. Alpha band signatures of social synchrony. Neuroscience letters. 2019. 699: 24–30.
Forschack N., Nierhaus T., Müller M.M., Villringer A. Alpha-Band Brain Oscillations Shape the Processing of Perceptible as well as Imperceptible Somatosensory Stimuli during Selective Attention. J Neurosci. 2017. 37 (29): 6983–6994.
Fox N.A., Bakermans-Kranenburg M.J., Yoo K.H., Bowman L.C., Cannon E.N., Vanderwert R.E., Ferrari P.F., van IJzendoorn M.H. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychol Bull. 2016. 142 (3): 291–313.
Frenkel-Toledo S., Bentin S., Perry A., Liebermann D.G., Soroker N. Dynamics of the EEG power in the frequency and spatial domains during observation and execution of manual movements. Brain Res. 2013. 1509: 43–57.
Frenkel-Toledo S., Liebermann D.G., Bentin S., Soroker N. Dysfunction of the Human Mirror Neuron System in Ideomotor Apraxia: Evidence from Mu Suppression. Journal of cognitive neuroscience. 2016. 28 (6): 775–791.
Garakh Z., Novototsky-Vlasov V., Larionova E., Zaytseva Y. Mu rhythm separation from the mix with alpha rhythm: Principal component analyses and factor topography. Journal of Neuroscience Methods. 2020. 346: 108892.
Gastaut H. Étude électrocorticographique de la réativité des rhythmes rolandiques. Rev. Neurologique. 1952. 87: 176–182.
Gehringer J.E., Arpin D.J., Heinrichs-Graham E., Wilson T.W., Kurz M.J. Practice modulates motor-related beta oscillations differently in adolescents and adults. J Physiol. 2019. 597 (12): 3203–3216.
Gutsell J.N., Simon J.C., Jiang Y. Perspective taking reduces group biases in sensorimotor resonance. Cortex. 2020. 131: 42–53.
Hanakawa T. Organizing motor imageries. Neuroscience research. 2016. 104: 56–63.
Hari R., Salmelin R. Human cortical oscillations: a neuromagnetic view through the skull. Trends in neurosciences. 1997. 20 (1): 44–49.
Heimann K.S., Uithol S., Calbi M., Umiltà M.A., Guerra M., Gallese V. “Cuts in Action”: A High-Density EEG Study Investigating the Neural Correlates of Different Editing Techniques in Film. Cogn Sci. 2017. 41 (6): 1555–1588.
Heimann K., Uithol S., Calbi M., Umiltà M.A., Guerra M., Fingerhut J., Gallese V. Embodying the camera: An EEG study on the effect of camera movements on film spectators sensorimotor cortex activation. PloS one. 2019. 14 (3): e0211026.
Heinrichs-Graham E., Wilson T.W. Coding complexity in the human motor circuit. Hum Brain Mapp. 2015. 36 (12): 5155–5167.
Hobson H.M., Bishop D.V.M. Mu suppression – A good measure of the human mirror neuron system? Cortex. 2016. 82: 290–310.
Hobson H.M., Bishop D.V. The interpretation of mu suppression as an index of mirror neuron activity: past, present and future. R Soc Open Sci. 2017. 4 (3): 160662.
Horan W.P., Pineda J.A., Wynn J.K., Iacoboni M., Green M.F. Some markers of mirroring appear intact in schizophrenia: evidence from mu suppression. Cognitive, affective & behavioral neuroscience. 2014. 14 (3): 1049–1060.
Hudac C.M., Stessman H.A.F., DesChamps T.D., Kresse A., Faja S., Neuhaus E., Webb S.J., Eichler E.E., Bernier R.A. Exploring the heterogeneity of neural social indices for genetically distinct etiologies of autism. J Neurodev Disord. 2017. 9: 24.
Isoda K., Sueyoshi K., Ikeda Y., Nishimura Y., Hisanaga I., Orlic S., Higuchi S. Effect of the hand-omitted tool motion on mu rhythm suppression. Frontiers in human neuroscience. 2016. 10: 266.
Iwane F., Lisi G., Morimoto J. EEG sensorimotor correlates of speed during forearm passive movements. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 2019. 27 (9): 1667–1675.
Jensen O., Mazaheri A. Shaping functional architecture by oscillatory alpha activity: gating by inhibition. Front Hum Neurosci. 2010. 4: 186.
Jenson D., Bowers A.L., Harkrider A.W., Thornton D., Cuellar M., Saltuklaroglu T. Temporal dynamics of sensorimotor integration in speech perception and production: independent component analysis of EEG data. Front Psychol. 2014. 5: 656.
Jenson D., Bowers A.L., Hudock D., Saltuklaroglu T. The Application of EEG Mu Rhythm Measures to Neurophysiological Research in Stuttering. Frontiers in human neuroscience. 2020. 13: 458.
Jenson D., Thornton D., Harkrider A.W., Saltuklaroglu T. Influences of cognitive load on sensorimotor contributions to working memory: an EEG investigation of mu rhythm activity during speech discrimination. Neurobiology of learning and memory. 2019. 166: 107098.
Jochumsen M., Rovsing C., Rovsing H., Cremoux S., Signal N., Allen K., Taylor D., Niazi I.K. Quantification of Movement-Related EEG Correlates Associated with Motor Training: A Study on Movement-Related Cortical Potentials and Sensorimotor Rhythms. Front Hum Neurosci. 2017. 11: 604.
John A.M.S., Kao K., Choksi M., Liederman J., Grieve P.G., Tarullo A.R. Variation in infant EEG power across social and nonsocial contexts. J Exp Child Psychol. 2016. 152: 106–122.
Jongsma M., Steenbergen B., Baas C.M., Aarts P.B., van Rijn C.M. Lateralized EEG mu power during action observation and motor imagery in typically developing children and children with unilateral Cerebral Palsy. Clinical neurophysiology. 2020. 131 (12): 2829–2840.
Karakale O., Moore M.R., Kirk I.J. Mental simulation of facial expressions: Mu suppression to the viewing of dynamic neutral face videos. Frontiers in human neuroscience. 2019. 13: 34.
Kessler K., Biermann-Ruben K., Jonas M., Siebner H.R., Baumer T., Munchau A., Schnitzler A. Investigating the human mirror neuron system by means of cortical synchronization during the imitation of biological movements, Neuroimage. 2006. 33 (1): 227–238.
Kilavik B.E., Zaepffel M., Brovelli A., MacKay W.A., Riehle A. The ups and downs of beta oscillations in sensorimotor cortex. Experimental neurology. 2013. 245: 15–26.
Kim J., Kim S. The effects of visual stimuli on EEG mu rhythms in healthy adults. Journal of physical therapy science. 2016. 28 (6): 1748–1752.
Kittilstved T., Reilly K.J., Harkrider A.W., Casenhiser D., Thornton D., Jenson D.E., Saltuklaroglu T. The effects of fluency enhancing conditions on sensorimotor control of speech in typically fluent speakers: an EEG mu rhythm study. Frontiers in human neuroscience. 2018. 12: 126.
Klass D.W., Bickford R.G. Observations on the rolandic arceau rhythm. Electroencephalography and Clinical Neurophysiology. 1957. 9 (3): 570.
Klimesch W., Sauseng P., Hanslmayr S. EEG alpha oscillations: the inhibitiontiming hypothesis. Brain research reviews. 2007. 53: 63–88.
Kompatsiari K., Bossi F., Wykowska A. Eye contact during joint attention with a humanoid robot modulates oscillatory brain activity. Soc Cogn Affect Neurosci. 2021. 16 (4): 383–392.
Kooiman V.G.M., van Keeken H.G., Maurits N.M., Weerdesteyn V., Solis-Escalante T. Rhythmic neural activity is comodulated with short-term gait modifications during first-time use of a dummy prosthesis: a pilot study. J Neuroeng Rehabil. 2020. 17 (1): 134.
Krol M.A., Schutter D.J.L.G., Jellema T. Sensorimotor cortex activation during anticipation of upcoming predictable but not unpredictable actions. Social neuroscience. 2020. 15 (2): 214–226.
Kuhlman W.N. Functional topography of the human mu rhythm. Electroencephalogr Clin Neurophysiol. 1978. 44: 83–93.
Lin N.H., Liu C.H., Lee P., Guo L.Y., Sung J.L., Yen C.W., Liaw L.J. Backward Walking Induces Significantly Larger Upper-Mu-Rhythm Suppression Effects Than Forward Walking Does. Sensors. 2020. 20 (24): 7250.
Livi A., Lanzilotto M., Maranesi M., Fogassi L., Rizzolatti G., Bonini L. Agent-based representations of objects and actions in the monkey pre-supplementary motor area. Proceedings of the National Academy of Sciences. 2019. 116 (7): 2691–2700.
Lust J.M., van Schie H.T., Wilson P.H., van der Helden J., Pelzer B., Steenbergen B. Activation of Mirror Neuron Regions Is Altered in Developmental Coordination Disorder (DCD)-Neurophysiological Evidence Using an Action Observation Paradigm. Frontiers in human neuroscience. 2019. 13: 232.
Makeig S., Delorme A., Westerfield M., Jung T.P., Townsend J., Courchesne E., Sejnowski T.J. Electroencephalographic brain dynamics following manually responded visual targets. PLoS Biol. 2004. 2: 747–762.
Malcolm B.R., Foxe J.J., Butler J.S., Molholm S., De Sanctis P. Cognitive load reduces the effects of optic flow on gait and electrocortical dynamics during treadmill walking. J Neurophysiol. 2018. 120 (5): 2246–2259.
Marini F., Breeding K.A., Snow J.C. Distinct visuo-motor brain dynamics for real-world objects versus planar images. Neuroimage. 2019. 195: 232–242.
Marshall P.J., Meltzoff A.N. Neural mirroring mechanisms and imitation in human infants. Philos. Trans. R. Soc. Lond. B Biol. Sci. 2014. 369 (1644): 20130620.
Martin F., Flasbeck V., Brown E.C., Brüne M. Altered mu-rhythm suppression in Borderline Personality Disorder. Brain research. 2017. 1659: 64–70.
Mazaheri A., Nieuwenhuis I.L.C., van Dijk H., Jensen O. Prestimulus alpha and mu activity predicts failure to inhibit motor responses. Human brain mapping. 2009. 30 (6): 1791–1800.
McCormick L.M., Brumm M.C., Beadle J.N., Para-diso S., Yamada T., Andreasen N. Mirror neuron function, psychosis, and empathy in schizophrenia. Psychiatry research. 2012. 201 (3): 233–239.
McFarland D.J., Miner L.A., Vaughan T.M., Wolpaw J.R. Mu and beta rhythm topographies during motor imagery and actual movements. Brain Topogr. 2000. 12 (3): 177–186.
Mitra S., Haque Nizamie S., Goyal N., Tikka S.K. Event related desynchronisation of mu-wave over right sensorimotor cortex at baseline may predict subsequent response to antipsychotics in Schizophrenia. Asian journal of psychiatry. 2015. 14: 19–21.
Mizuhara H. Cortical dynamics of human scalp EEG origins in a visually guided motor execution. Neuroimage. 2012. 62 (3): 1884–1895.
Moisello C., Blanco D., Lin J., Panday P., Kelly S.P., Quartarone A., Di Rocco A., Cirelli C., Tononi G., Ghilardi M.F. Practice changes beta power at rest and its modulation during movement in healthy subjects but not in patients with Parkinson’s disease. Brain Behav. 2015. 5 (10): e00374.
Molenberghs P., Cunnington R., Mattingley J.B. Brain regions with mirror properties: a meta-analysis of 125 human fMRI studies. Neurosci Biobehav Rev. 2012. 36 (1): 341–349.
Moore M.R., Franz E.A. Mu rhythm suppression is associated with the classification of emotion in faces. Cognitive, Affective, & Behavioral Neuroscience. 2016. 17 (1): 224–234.
Moreno I., de Vega M., León I. Understanding action language modulates oscillatory mu and beta rhythms in the same way as observing actions. Brain Cogn. 2013. 82 (3): 236–242.
Mukamel R., Ekstrom A.D., Kaplan J., Iacoboni M., Fried I. Single-Neuron Responses in Humans during Execution and Observation of Actions. Current Biology. 2010. 20 (8): 750–756.
Mulder T. Motor imagery and action observation: cognitive tools for rehabilitation. J Neural Transm (Vienna). 2007. 114 (10): 1265–1278.
Muthukumaraswamy S.D., Johnson B.W. Changes in rolandic mu rhythm during observation of a precision grip, Psychophysiology. 2004. 41 (1): 152–156.
Muthukumaraswamy S.D., Johnson B.W., McNair N.A. Mu rhythm modulation during observation of an object-directed grasp. Cognitive brain research. 2004. 19 (2): 195–201.
Muthukumaraswamy S.D., Singh K.D. Modulation of the human mirror neuron system during cognitive activity. Psychophysiology. 2008. 45 (6): 896–905.
Nishimura Y., Ikeda Y., Higuchi S. The relationship between inhibition of automatic imitation and personal cognitive styles. J Physiol Anthropol. 2018. 37 (1): 1–10.
Oberman L.M., Hubbard E.M., McCleery J.P., Altschuler E.L., Ramachandran V.S., Pineda J.A. EEG evidence for mirror neuron dysfunction in autism spectrum disorders. Brain Research. Cognitive Brain Research. 2005. 24 (2): 190–198.
Oberman L.M., McCleery J.P., Hubbard E.M., Bernier R., Wiersema J.R., Raymaekers R., Pineda J.A. Developmental changes in mu suppression to observed and executed actions in autism spectrum disorders. Social cognitive and affective neuroscience. 2013. 8 (3): 300–304.
Oberman L.M., Pineda J.A., Ramachandran V.S. The human mirror neuron system: A link between action observation and social skills. Social Cognitive and Affective Neuroscience. 2007. 2 (1): 62–66.
Oosterhof N.N., Tipper S.P., Downing P.E. Crossmodal and action-specific: neuroimaging the human mirror neuron system. Trends Cogn Sci. 2013. 17(7): 311–318.
Park J.H., Cynn H.S., Cha K.S., Kim K.H., Jeon H.S. Event-related desynchronization of mu rhythms during concentric and eccentric contractions. Journal of motor behavior. 2018. 50 (4): 457–466.
Park W., Kwon G.H., Kim D.H., Kim Y.H., Kim S.P., Kim L. Assessment of cognitive engagement in stroke patients from single-trial EEG during motor rehabilitation. IEEE Trans Neural Syst Rehabil Eng. 2015. 23 (3): 351–362.
Peled-Avron L., Goldstein P., Yellinek S., Weissman-Fogel I., Shamay-Tsoory S.G. Empathy during consoling touch is modulated by mu-rhythm: An EEG study. Neuropsychologia. 2018. 116: 68–74.
Pereira M., Argelaguet F., Millán J.D.R., Lécuyer A. Novice shooters with lower pre-shooting alpha power have better performance during competition in a virtual reality scenario. 2018. Frontiers in psychology. 9: 527.
Perry A., Bentin S. Does focusing on hand-grasping intentions modulate electroencephalogram mu and alpha suppressions? Neuroreport. 2010. 21 (16): 1050–1054.
Pfurtscheller G., Lopes da Silva F.H. Event-related EEG/MEG synchronization and desynchronization: basic principles. Clin Neurophysiol. 1999. 110 (11): 1842–1857.
Pfurtscheller G., Neuper C., Krausz G. Functional dissociation of lower and upper frequency mu rhythms in relation to voluntary limb movement. Clin Neurophysiol. 2000. 111 (10): 1873–1879.
Pilacinski A., Lindner A. Distinct contributions of human posterior parietal and dorsal premotor cortex to reach trajectory planning. Sci Rep. 2019. 9: 1962.
Pineda J.A. The functional significance of mu rhythms: translating “seeing” and “hearing” into “doing”. Brain Res Brain Res Rev. 2005. 50 (1): 57–68.
Pollok B., Latz D., Krause V., Butz M., Schnitzler A. Changes of motor-cortical oscillations associated with motor learning. Neuroscience. 2014. 275: 47–53.
Pomiechowska B., Csibra G. Motor activation during action perception depends on action interpretation. Neuropsychologia. 2017. 105: 84–91.
Proverbio A.M. Tool perception suppresses 10–12 Hz mu rhythm of EEG over the somatosensory area. Biol Psychol. 2012. 91 (1): 1–7.
Rashid M., Sulaiman N., Majeed A.P.A., Musa R.M., Nasir A.F.A., Bari B.S., Khatun S. Current status, challenges, and possible solutions of EEG-based brain-computer interface: a comprehensive review. Front Neurorobot. 2020. 14.
Rayson H., Bonaiuto J.J., Ferrari P.F., Murray L. Early maternal mirroring predicts infant motor system activation during facial expression observation. Sci Rep. 2017. 7 (1): 1–11.
Reid V.M., Striano T., Iacoboni M. Neural correlates of dyadic interaction during infancy. Developmental Cognitive Neuroscience. 2011. 1 (2): 124–130.
Remsik A.B., Williams Jr.L., Gjini K., Dodd K., Thoma J., Jacobson T., Prabhakaran V. Ipsilesional mu rhythm desynchronization and changes in motor behavior following post stroke bci intervention for motor rehabilitation. Frontiers in neuroscience. 2019. 13: 53.
Ricci S., Mehraram R., Tatti E., Nelson A.B., Bossini-Baroggi M., Panday P., Lin N., Ghilardi M.F. Aging Does Not Affect Beta Modulation during Reaching Movements. Neural Plast. 2019. 2019: 1619290.
Riečanský I., Lengersdorff L.L., Pfabigan D.M., Lamm C. Increasing self-other bodily overlap increases sensorimotor resonance to others' pain. Cogn Affect Behav Neurosci. 2020. 20 (1): 19–33.
Rimbert S., Al-Chwa R., Zaepffel M., Bougrain L. Electroencephalographic modulations during an open-or closed-eyes motor task. PeerJ. 2018. 6: e4492.
Ritter P., Moosmann M., Villringer A. Rolandic alpha and beta EEG rhythms' strengths are inversely related to fMRI-BOLD signal in primary somatosensory and motor cortex. Human brain mapping. 2009. 30 (4): 1168–1187.
Rizzolatti G., Craighero L. The Mirror-neuron system. Annual Reviews of Neuroscience. 2004. 27: 169–192.
Rizzolatti G., Sinigaglia C. The functional role of the parieto-frontal mirror circuit: interpretations and misinterpretations. Nat Rev Neurosci. 2010. 11 (4): 264–274.
Rüther N.N., Brown E.C., Klepp A., Bellebaum C. Observed manipulation of novel tools leads to mu rhythm suppression over sensory-motor cortices. Behavioural brain research. 2014. 261: 328–335.
Ruysschaert L., Warreyn P., Wiersema J.R., Oostra A., Roeyers H. Exploring the role of neural mirroring in children with autism spectrum disorder. Autism research. 2014. 7 (2): 197–206.
Saltuklaroglu T., Harkrider A.W., Thornton D., Jenson D., Kittilstved T. EEG Mu (µ) rhythm spectra and oscillatory activity differentiate stuttering from non-stuttering adults. NeuroImage. 2017. 153: 232–245.
Sauseng P., Klimesch W., Stadler W., Schabus M., Doppelmayr M., Hanslmayr S., Gruber W.R., Birbaumer N. A shift of visual spatial attention is selectively associated with human EEG alpha activity. Eur J Neurosci. 2005. 22: 2917–2926.
Sestito M., Harel A., Nador J., Flach J. Investigating Neural Sensorimotor Mechanisms Underlying Flight Expertise in Pilots: Preliminary Data From an EEG Study. Front Hum Neurosci. 2018. 12: 489.
Shen G., Saby J.N., Drew A.R., Marshall P.J. Exploring potential social influences on brain potentials during anticipation of tactile stimulation. Brain Res. 2017. 1659: 8–18.
Shibuya S., Unenaka S., Zama T., Shimada S., Ohki Y. Sensorimotor and posterior brain activations during the observation of illusory embodied fake hand movement. Frontiers in human neuroscience. 2019. 13: 367.
Simon S., Mukamel R. Power modulation of electroencephalogram mu and beta frequency depends on perceived level of observed actions. Brain Behav. 2016. 6 (8): e00494.
Singh F., Pineda J., Cadenhead K.S. Association of impaired EEG mu wave suppression, negative symptoms and social functioning in biological motion processing in first episode of psychosis. Schizophrenia research. 2011. 130 (1–3): 182–186.
Siqi-Liu A., Harris A.M., Atkinson A.P., Reed C.L. Dissociable processing of emotional and neutral body movements revealed by μ-alpha and beta rhythms. Social cognitive and affective neuroscience. 2018. 13 (12): 1269–1279.
Smyk N.J., Weiss S.M., Marshall P.J. Sensorimotor oscillations during a reciprocal touch paradigm with a human or robot partner. Frontiers in psychology. 2018. 9: 2280.
Sotoodeh M.S., Taheri-Torbati H., Hadjikhani N., Lassalle A. Preserved action recognition in children with autism spectrum disorders: Evidence from an EEG and eye-tracking study. Psychophysiology. 2020. 58 (3): e13740.
Tangwiriyasakul C., Verhagen R., van Putten M.J.A.M., Rutten W.L.C. Importance of baseline in eventrelated desynchronization during a combination task of motor imagery and motor observation. Journal of Neural Engineering. 2013. 10 (2): 026009.
Tan H., Wade C., Brown P. Post-movement beta activity in sensorimotor cortex indexes confidence in the estimations from internal models. J Neurosci. 2016. 36 (5): 1516–1528.
Tatti E., Ricci S., Nelson A.B., Mathew D., Chen H., Quartarone A., Ghilardi M.F. Prior practice affects movement-related beta modulation and quiet wake restores it to baseline. Front Syst Neurosci. 2020. 14: 61.
Thornton D., Harkrider A.W., Jenson D., Saltuklaroglu T. Sensorimotor activity measured via oscillations of EEG mu rhythms in speech and non-speech discrimination tasks with and without segmentation demands. Brain and language. 2018. 187: 62–73.
Tiihonen J., Kajola M., Hari R. Magnetic mu rhythm in man. Neuroscience. 1989. 32 (3): 793–800.
Turella L., Pierno A.C., Tubaldi F., Castiello U. Mirror neurons in humans: consisting or confounding evidence? Brain Lang. 2009. 108: 10–21.
Tzagarakis C., West S., Pellizzer G. Brain oscillatory activity during motor preparation: effect of directional uncertainty on beta, but not alpha, frequency band. Front Neurosci. 2015. 9: 246.
Ulloa E.R., Pineda J.A. Recognition of point-light biological motion: mu rhythms and mirror neuron activity. Behavioural brain research. 2007. 183 (2): 188–194.
Van de Vijver I., Van Schie H.T., Veling H., Van Dooren R., Holland R.W. Go/no-go training affects frontal midline theta and mu oscillations to passively observed food stimuli. Neuropsychologia. 2018. 119: 280–291.
Van Overwalle F., Baetens K. Understanding others’ actions and goals by mirror and mentalizing systems: A meta-analysis. NeuroImage. 2009. 48: 564–584.
Wamain Y., Sahaï A., Decroix J., Coello Y., Kalénine S. Conflict between gesture representations extinguishes μ rhythm desynchronization during manipulable object perception: an EEG study. Biological psychology. 2018. 132: 202–211.
Weiss S.M., Laconi R.N., Marshall P.J. Individual differences in anticipatory mu rhythm modulation are associated with executive function and processing speed. Cognitive, Affective, & Behavioral Neuroscience. 2020. 20 (5): 901–916.
Wen W., Yamashita A., Asama H. Measurement of the Perception of Control during Continuous Movement using Electroencephalography. Front Hum Neurosci. 2017. 11: 392.
Williams J.H., Whiten A., Suddendorf T., Perrett D.I. Imitation, mirror neurons and autism. Neuroscience & Biobehavioral Reviews. 2001. 25 (4): 287–295.
Wu C.C., Hamm J.P., Lim V.K., Kirk I.J. Mu rhythm suppression demonstrates action representation in pianists during passive listening of piano melodies. Experimental brain research. 2016. 234 (8): 2133–2139.
Wu C.C., Hamm J.P., Lim V.K., Kirk I.J. Musical training increases functional connectivity, but does not enhance mu suppression. Neuropsychologia. 2017. 104: 223–233.
Yang C.Y., Decety J., Lee S., Chen C., Cheng Y. Gender differences in the mu rhythm during empathy for pain: an electroencephalographic study. Brain research. 2009. 1251: 176–184.
Yin J., Ding X., Xu H., Zhang F., Shen M. Social coordination information in dynamic chase modulates EEG mu rhythm. Scientific reports. 2017. 7 (1): 1–9.
Yin S., Liu Y., Ding M. Amplitude of sensorimotor mu rhythm is correlated with BOLD from multiple brain regions: a simultaneous EEG-fMRI study. Frontiers in Human Neuroscience. 2016. 10: 364.
Yordanova J., Kolev V., Rothenberger A. Event-related oscillations reflect functional asymmetry in children with attention deficit/hyperactivity disorder. Supplements to Clinical neurophysiology. 2013. 62: 289–301.
Zaytseva Y., Morozova A., Bendova M., Garakh Z. Is motor imagery different in catatonic schizophrenia? PsyCh journal. 2017. 6 (2): 137–138.
Zhang D., Gu R. Behavioral preference in sequential decision-making and its association with anxiety. Human brain mapping. 2018. 39 (6): 2482–2499.
Zhang K., Xu G., Zheng X., Li H., Zhang S., Yu Y., Liang R. Application of Transfer Learning in EEG Decoding Based on Brain-Computer Interfaces: A Review. Sensors (Basel). 2020. 20 (21): 6321.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


