Журнал высшей нервной деятельности им. И.П. Павлова, 2022, T. 72, № 1, стр. 117-129
Эффекты пренатального воздействия экзогенного гонадотропина на развитие мозга у мышей
С. В. Окотруб 1, 2, И. Н. Рожкова 1, Е. Ю. Брусенцев 1, А. М. Горностаева 1, Д. С. Рагаева 1, Э. А. Чуйко 1, С. Я. Амстиславский 1, *
1 Федеральное государственное бюджетное научное учреждение
“Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук”
г. Новосибирск, Россия
2 Федеральное государственное автономное образовательное учреждение высшего образования
“Новосибирский национальный исследовательский государственный университет”
г. Новосибирск, Россия
* E-mail: amstis@bionet.nsc.ru
Поступила в редакцию 03.03.2021
После доработки 18.08.2021
Принята к публикации 05.10.2021
- EDN: DBOOUF
- DOI: 10.31857/S0044467722010087
Аннотация
В исследовании представлены данные о влиянии стимуляции яичников хорионическим гонадотропином человека (ХГЧ) на постнатальное развитие потомства у мышей. Данное воздействие имело следствием лишь незначительные эффекты на созревание у потомства неонатальных рефлексов, таких, как рефлекс переворачивания на поверхности и в воздухе, а также на открытие глаз и формирование зрелой позы. Потомки обоих полов, полученные от самок, которым вводили ХГЧ, отставали от контрольных животных по массе тела в первую неделю после рождения. Кроме того, число нейронов в коре головного мозга потомков-самцов, полученных после введения матерям ХГЧ, было значительно больше на 42-й день жизни без изменения размера нейронов. Число нейронов в CA1 области гиппокампа у потомков из группы ХГЧ было меньше, а размер нейронов был больше по сравнению с таковым в контроле на 21-й день жизни. Результаты этого исследования показывают, что пренатальное воздействие ХГЧ практически не влияло на неонатальное развитие потомков, за исключением некоторого отставания в наборе массы тела в первую неделю жизни. Однако у потомков-самцов наблюдалось отставание в наборе массы тела в конце периода вскармливания, а также изменения числа нейронов в СА1 области гиппокампа и в префронтальной коре в конце периода вскармливания и в возрасте полутора месяцев.
ВВЕДЕНИЕ
В настоящее время около семи миллионов детей рождено в результате применения вспомогательных репродуктивных технологий (ВРТ) (Berntsen et al., 2019). Хотя некоторые исследователи пытались установить причинно-следственную связь между использованием ВРТ и частотой неврологических расстройств у детей, лишь некоторые из них подтвердили ее возможное существование (Sandin et al., 2013; Liu et al., 2017; Emberti Gialloreti et al., 2019). Данные, полученные на людях, противоречивы и трудны для интерпретации. Влияние ВРТ на повышение частоты возникновения тех или иных патологий тяжело отделить от воздействия других факторов. В частности, материнский фактор, здоровье и возраст родителей, а также их уровень образования играют важную роль в послеродовой жизни ребенка (Ponjaert-Kristoffersen et al., 2005; Barbuscia, Mills, 2017). Поэтому необходимы эксперименты на лабораторных животных, чтобы понять влияние некоторых элементов ВРТ на развитие нервной системы, поведение и функционирование мозга у потомков (Ramos-Ibeas et al., 2019; Sunde, 2019; Раннева и др., 2020).
Стимуляция яичников гонадотропинами – это основная репродуктивная технология, используемая как в медицине, так и в экспериментах на животных (Amer, 2007; Luo et al., 2011; Behringer et al., 2018). Часто для этих целей выбирают хорионический гонадотропин человека (ХГЧ) (Awonuga et al., 2018; Quaas, Legro, 2019). Этот гонадотропин описывается как гликопротеин с молекулярной массой 36.7 кДа, состоящий из субъединиц α и β. ХГЧ является функциональным и структурным аналогом лютеинизирующего гормона (ЛГ), однако имеет уникальную рецептор-специфическую β-субъединицу по сравнению с ним (Quaas, Legro, 2019). ХГЧ индуцирует заключительную стадию созревания ооцитов, от стадии герминального везикула – GV (профаза I мейоза) до стадии MII (метафазы II мейоза), воздействуя на рецепторы к ЛГ, процесс, который у людей занимает около 36 ч (Quaas, Legro, 2019). У человека ХГЧ продуцируется эмбрионом на ранних сроках беременности, преимущественно после имплантации, когда образуется ткань хориона; его концентрация увеличивается в несколько тысяч раз к 10–12-й неделе беременности, а затем начинает постепенно снижаться (Fournier et al., 2015).
Суперовуляция у мышей индуцируется “двухэтапным” протоколом с использованием вначале гонадотропина сыворотки жеребых кобыл – ГСЖК, а затем ХГЧ (Behringer et al., 2018) или анти-ингибиновой сыворотки и ХГЧ (Hasegawa et al., 2016). В некоторых исследованиях изучали эффекты стандартной схемы индукции суперовуляции с использованием ГСЖК и ХГЧ, вводимых самкам мышей линии CD1 и межлинейным гибридам, на созревание их ооцитов и преимплантационное развитие эмбрионов, полученных в результате суперовуляции (Wang et al., 2006; Lee et al., 2017). В других работах сообщалось о влиянии лишь ХГЧ на развитие ооцитов и эмбрионов мышей различных линий (Ertzeid, Storeng, 1992; Ezoe et al., 2014; Ma et al., 2015; Амстиславский и др., 2019; Tantitham et al., 2020). В раннем исследовании на мышах C57Bl было показано, что стимуляция яичников только с помощью ХГЧ увеличивала долю аномальных преимплантационных эмбрионов, снижала общее число живых плодов, а также повышала показатели постимплантационной смертности (Ertzeid, Storeng, 1992). Подобные изменения также наблюдали у мышей линии ICR (другое название линии СD1) после эмбриотрансфера самкам-реципиентам, стимулированным ХГЧ, что привело к снижению частоты имплантации и ухудшению развития плодов (Ezoe et al., 2014). Однако наше недавнее исследование показало более высокое качество овуляции и более зрелые формы ооцитов у мышей линии CD1, стимулированных ХГЧ (Амстиславский и др., 2019). Результаты этих работ противоречивы и требуют дальнейшей проверки.
Примечательно, что мозг взрослых млекопитающих, в частности крыс Sprague-Dawley, содержит рецепторы к ЛГ, с которыми также связывается и ХГЧ, что играет важную роль в нейроэндокринной регуляции и поведении, в частности, исследовательской активности и стереотипии (Al-Hader, 1997; Lei, Rao, 2001). Было показано, что экзогенный ХГЧ, введенный взрослым самкам крыс линии Sprague-Dawley проникает через гематоэнцефалический барьер, и, действуя на рецепторы ЛГ/ХГЧ, повышенная плотность которых имеется в гиппокампе, может приводить к снижению у них двигательной, исследовательской активности и стереотипии, а также к уменьшению неофобии (Lukacs et al., 1995).
Поскольку стимуляция яичников гонадотропинами является существенным элементом комплекса ВРТ, применяемого в медицине, важно понимать, как эта процедура может влиять на потомков. Введение экзогенного ХГЧ изменяет пренатальную гормональную среду, и, как было показано ранее на мышах линии CF-1, приводит к снижению числа нейронов в коре головного мозга у потомства (Mainigi et al., 2016). Также предполагается, что введение экзогенного ХГЧ во время беременности мышам C57Bl может предохранять от индуцированной гипоксической ишемии мозга и снижать потери нейрональной ткани у потомков (Movsas et al., 2017). Поскольку данные о долгосрочных эффектах пренатального воздействия экзогенного ХГЧ на развитие центральной нервной системы скудны, необходимо проведение дальнейших исследований.
Данное исследование было направлено на изучение долгосрочных эффектов материнской стимуляции яичников при помощи ХГЧ у мышей. В частности, оценивали влияние гормона на такие показатели у потомков как: 1) рост и развитие в период вскармливания; 2) созревание неонатальных рефлексов; 3) размер и число нейронов в префронтальной коре и гиппокампе головного мозга мышей. Для оценки общего развития центральной нервной системы были выбраны такие структуры головного мозга, как префронтальная кора, которая играет важную роль в модуляции социального (Bicks et al., 2015) и когнитивного (Reinert et al., 2021) поведения у грызунов, а также гиппокамп, ответственный за обучение и память (Zemla, Basu, 2017).
МЕТОДИКА
Экспериментальные животные. Всего для получения потомства использовали 11 самок мышей аутбредной линии CD1 в возрасте 10 недель: пять самок в экспериментальной группе (ХГЧ группа) и шесть в контрольной. Линия мышей CD1 характеризуется плодовитостью и высокой материнской заботой, именно этими качествами был обусловлен ее выбор для нашего исследования. Некоторые эффекты ХГЧ уже исследовали ранее на этой линии (Амстиславский и др., 2019). Для спаривания с самками использовали четыре самца той же линии с доказанной фертильностью и того же возраста. Животных содержали в клетках размером 36 см × × 25 см × 14 см (длина × ширина × высота), с подстилом из древесной стружки. Самок с детенышами содержали индивидуально в конвенциональном виварии Института цитологии и генетики (ИЦиГ), Новосибирск, при температуре 20–22°C, на стандартной диете (ЧАРА, Россия), по графику 12: 12 ч (день:ночь), доступ к воде ad libitum. Эксперименты были одобрены Комитетом по биоэтике ИЦиГ (протокол № 12 от 6 декабря 2012 г.) и соответствовали Европейской конвенции о защите позвоночных животных, используемых в экспериментальных и других научных целях.
Стимуляция яичников. Стадию эстрального цикла для каждой самки оценивали путем проверки мазков из влагалища. Стадии цикла классифицировали следующим образом: проэструс, вагинальный мазок состоял преимущественно из ядерных эпителиальных клеток; эструс, безъядерные ороговевшие клетки в мазке; метэструс, три типа клеток, т.е. лейкоциты, ороговевшие и ядросодержащие эпителиальные клетки; и диэструс, мазок из влагалища, состоящий преимущественно из лейкоцитов (Caligioni, 2009).
На стадии эструса самкам экспериментальной группы вводили внутрибрюшинно 5 МЕ ХГЧ (Chorulon, Intervet, Новая Зеландия) в 0.1 мл раствора 0.9% NaCl. Самкам контрольной группы вводили только 0.1 мл 0.9% раствора NaCl. Всем самкам инъекцию делали по одному графику: с 14:00 до 15:00. После этого самок обеих групп помещали в индивидуальные клетки на ночь с самцами мышей той же линии с проверенной фертильностью, а утром исследовали на наличие вагинальных пробок. Самок с вагинальными пробками содержали в индивидуальных клетках до рождения потомства. Потомство оставляли в домашней клетке с матерью до отъема и отсаживали на 21-й день после рождения (Д21). Молодняк самцов и самок содержали раздельно группами до пяти особей в клетке до конца эксперимента, т.е. до 42-го дня после рождения (Д42).
Исследование потомков: измерение массы тела и оценка неонатальных рефлексов. Массу тела оценивали у 22 потомков-самцов и 24 потомков-самок из шести пометов контрольной группы и у 21 потомка-самца и 17 потомков-самок из пяти пометов экспериментальной группы с 6-го по 21-й день постнатального развития (Д6-Д21). Мышат взвешивали с Д6 по Д21 с помощью портативных цифровых весов (с точностью до 0.1 г; ScoutPro SPS2001 F, Ohaus Corporation, США). Кроме того, измеряли массу тела и мозга на Д21 и Д42 и рассчитывали отношение массы мозга к массе тела у потомков-самцов обеих групп, которые были распределены случайным образом и подвергнуты эвтаназии либо на Д21, либо на Д42.
Неонатальные рефлексы оценивали у 22 потомков-самцов и 26 потомков-самок из шести пометов контрольной группы и у 21 потомка-самца и 17 потомков-самок из пяти пометов экспериментальной группы. Рефлексы новорожденных оценивали, как описано ранее (Fox, 1965; Heyser, 2004; Feather-Schussler, Ferguson, 2016). Мышат осматривали ежедневно с Д3 по Д17. Все тесты проводили в 14:00.
Были проведены следующие тесты:
1) Тест на переворачивание тела (рефлекс переворачивания на поверхности) проводили следующим образом (Д3–Д7): мышонка располагали спиной на ровной поверхности. Регистрировали время, необходимое ему, чтобы вернуться на четыре конечности. Время теста – 30 с.
2) Тест на переворачивание тела в воздухе (рефлекс переворачивания в воздухе) проводили следующим образом (Д7-Д12): мышонка держали вверх лапами на высоте 30 см над поверхностью и бросали на мягкую поверхность. Регистрировали, успешно ли он приземлялся на свои четыре конечности (тест пройден), либо падал на спину или бок (тест не зачтен).
4) Тест на зрелость позы при движении (Д15–Д17): мышонка помещали на плоскую поверхность и легонько подталкивали, побуждая двигаться. Движение оценивали по следующим критериям: ползание с асимметричным движением конечностей, медленное ползание с симметричным движением конечностей и быстрое ползание/ходьба. Передвижение животного считали зрелым, когда мышонок достигал симметричных движений конечностей или ходьбы в течение двух последовательных дней (Feather-Schussler, Ferguson, 2016).
5) Отслеживали открывание глаз (Д13–Д15): фиксировали день, когда мышонок открывал глаза.
Гистологический анализ. Число пирамидных нейронов в гиппокампе и префронтальной коре на Д21 и Д42 оценивали у 4–6 потомков-самцов контрольной и экспериментальной групп, взятых из разных пометов. Для оценки были использованы только неповрежденные участки мозга с интересующими областями. В тех областях, где была выявлена значительная разница по числу пирамидных нейронов, измеряли размер отдельных нейронов, с целью выяснить, связано ли изменение плотности нейронов с изменением их размера.
Потомков мышей подвергали эвтаназии при помощи декапитации, препарировали мозг, фиксировали его в течение 48 ч в параформальдегиде (10%) на PBS, а затем для удобства дальнейшей работы делили на две части по корональной плоскости с помощью лезвия и помещали в гистологические кассеты. Образцы подвергали гистологической обработке на автомате для проводки тканей карусельного типа (ThermoScientific™ Citadel 2000, США) следующим образом: этанол 70% – 24 ч, этанол 80% – 24 ч, этанол 90% – 24 ч, этанол 96% – 2 ч, н-бутанол – 2 ч, н-бутанол+о-ксилол – 2 ч, о-ксилол – 1–1.5 ч, о-ксилол – 1.5–2 ч, о-ксилол+парафин 37°C – 2 ч, парафин 56°C – 7 ч. Мозг встраивали в блоки с парафиновой средой Histomix Extra (BioVitrum, Россия) с помощью Embedding Workstation (HistoStar™ ThermoScientific™, США). Парафиновые срезы префронтальной коры и гиппокампа (толщиной 4 мкм) нарезали серийно с помощью ротационного микротома MicromHM340E (ThermoScientific, США) и помещали на предметные стекла для подсчета нейронов. Для каждого животного делали пять или шесть срезов на исследуемую область мозга. Затем срезы окрашивали по Нисслю для идентификации нейронов в префронтальной коре и гиппокампе. Производили подсчет нейронов в областях CA1, CA2, CA3, DG гиппокампа, а также в третьем слое префронтальной коры (Mazumder et al., 2019). Срезы изготовляли в соответствии с атласом (Paxinos, Franklin, 2012) и координатами мозга по Allen Atlas Brain: AP (Bregma) = +2.8 мм для префронтальной коры и AP (Bregma) = = –1.94 для гиппокампа. Были сделаны изображения идентичных полей областей мозга с помощью микроскопа Zeiss Scope A1 (Carl Zeiss, Германия) и цветной камеры Zeiss Axiocam 512 (Carl Zeiss, Германия). Пирамидные нейроны определяли с учетом морфологических критериев визуально на срезе как самые крупные из окрашенных клеточных элементов и подсчитывали вручную в области интереса. С помощью программы ImageJ (NIH, США) задавали стандартные области интереса: площадью 5361.17 мкм2 для зоны CA1, 2901.37 мкм2 для зоны CA2, 4585.55 мкм2 для зоны CA3 и 4554.11 мкм2 для DG. Число пирамидных нейронов префронтальной коры измеряли на площади 11948.64 мкм2. Полученные значения рассчитывали как число нейронов в 1 мм2 без учета толщины среза, которая была во всех случаях стандартной (4 мкм). Диаметр пирамидных нейронов измеряли с помощью программы ImageJ (NIH, США). Всего было проанализировано 360 и 300 пирамидных нейронов для области CA1 гиппокампа и 410 и 290 пирамидных нейронов для префронтальной коры в контрольной и ХГЧ группах соответственно.
Статистический анализ. Анализ результатов проводили с использованием программного обеспечения STATISTICA v. 6.0 (StatSoft, Inc., США). Все массивы данных были проверены на нормальность с помощью W-критерия Шапиро–Уилка. Вариации массы тела и мозга, отношение массы мозга к массе тела и числу пирамидных нейронов в префронтальной коре между группами оценивали с помощью t-критерия Стьюдента. Данные по массе тела и мозга, по соотношению массы мозга к массе тела, а также по числу пирамидных нейронов в префронтальной коре представлены как среднее значение ± ± стандартная ошибка среднего (M ± SEM). Различия между группами по тесту переворачивания тела в воздухе, открытию глаз и зрелости позы анализировали с помощью критерия хи-квадрат. Данные по тесту переворачивания тела в воздухе, открытию глаз и зрелости позы представлены как доля от общего числа животных, успешно выполнивших тест в каждой группе. Результаты по тесту переворачивания тела и числу пирамидных нейронов в гиппокампе были оценены непараметричеки с помощью U-критерия Манна–Уитни и представлены в виде медианы и квартилей 25–75% (Me [Q1; Q3]). Уровень значимости принимали как p <0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Измерение массы тела потомков мышей
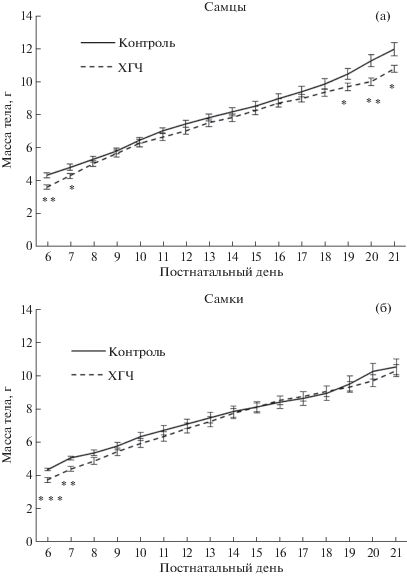
Данные о массе тела потомков представлены на рис. 1 (a, б). На Д6 (p < 0.01), Д7 (p < < 0.05), Д19 (p < 0.05), Д20 (p < 0.01) и Д21 (p < < 0.05) потомки-самцы из ХГЧ-группы имели меньшую массу тела по сравнению с контролем. Тогда как потомки-самки из ХГЧ-группы имели меньшую массу тела только на Д6 (p < 0.001) и Д7 (p < 0.01) по сравнению с контролем.
Рис. 1.
Эффекты ХГЧ, вводимого самкам, на развитие их потомков в период вскармливания. (а) – потомки-самцы, (б) – потомки-самки. *p < 0.05, **p < 0.01 и ***p < 0.001 по сравнению с контролем каждого возраста.
Fig. 1. Effects of maternal treatment with hCG on offspring growth during the suckling period. (а) – male offspring, (б) – female offspring. *p < 0.05, **p < 0.01 and ***p < 0.001 as compared with controls at the same age.
Данные по массе мозга и соотношению массы мозга и тела у потомков-самцов представлены в табл. 1. Не было обнаружено статистически достоверных отличий между группами по весу мозга на Д21 и Д42. Однако потомки-самцы из ХГЧ-группы имели более высокое отношение массы мозга к телу (p < < 0.01) на Д21 по сравнению с контролем.
Таблица 1.
Эффекты ХГЧ, вводимого самкам, на массу мозга и соотношение массы мозга к массе тела у их потомков-самцов Table 1. Effects of maternal treatment with hCG on the brain weight and brain-to-body ration in the male offspring
| День | Группа | Масса мозга, г | Соотношение мозга к телу |
|---|---|---|---|
| Д21 | Контроль (n = 11) | 0.41 ± 0.01 | 0.030 ± 0.002 |
| ХГЧ (n = 10) | 0.43 ± 0.01 | 0.040 ± 0.001** | |
| Д42 | Контроль (n = 11) | 0.45 ± 0.01 | 0.010 ± 0.001 |
| ХГЧ (n = 11) | 0.46 ± 0.01 | 0.010 ± 0.001 |
Неонатальные рефлексы
Время, необходимое на переворачивание тела у потомков обоих полов, уменьшалось за период исследования в обеих группах. Начиная с Д7, всем потомкам требовалось менее 5 сек. для выполнения этого теста, что указывает на созревание данного рефлекса. Согласно нашим наблюдениям, потомкам-самцам из ХГЧ-группы требовалось больше времени на Д5, но меньше времени на Д7 для выполнения рефлекса переворачивания по сравнению с контролем (p < 0.05; табл. 2). Время выполнения этого рефлекса было одинаковым у потомков-самок обеих групп.
Таблица 2.
Созревание рефлексов переворачивания на поверхности и в воздухе у потомков Table 2. Maturation of righting reflexes on surface and air in offspring
| Группа | Рефлекс переворачивания на поверхности (время, с) | |||||||
|---|---|---|---|---|---|---|---|---|
| Д3 | Д4 | Д5 | Д6 | Д7 | ||||
| 1 | Контроль (n = 22) | 5.9 [2.5; 10.0] | 3.5 [2.1; 6.3] | 2.4 [1.9; 4.0] | 1.9 [1.5; 2.4] | 1.6 [1.3; 2.0] | ||
| ХГЧ (n = 21) | 8.9 [4.8; 16.6] | 4.3 [3.1; 7.1] | 4.5 [3.4; 6.1]* | 3.4 [1.5; 4.4] | 1.2 [1.0; 1.4]* | |||
| 2 | Контроль (n = 26) | 6.7 [4.5; 13.2] | 4.8 [3.0; 7.9] | 3.0 [2.1; 4.7] | 1.9 [1.5; 2.4] | 1.6 [1.2;2.0] | ||
| ХГЧ (n = 17) | 11.8 [3.8; 22.5] | 3.5 [2.5; 14.5] | 3.1 [2.1; 12.5] | 1.5 [1.2; 1.9] | 1.2 [0.8;1.9] | |||
| Рефлекс переворачивания в воздухе (число (%) потомков) | ||||||||
| Д7 | Д8 | Д9 | Д10 | Д11 | Д12 | Д13 | ||
| 1 | Контроль (n = 22) | 3 (13.6) | 10 (45.5) | 12 (54.5) | 14 (63.6) | 18 (81.8) | 20 (90.9) | 22 (100) |
| ХГЧ (n = 21) | 5 (23.8) | 5 (23.8) | 9 (42.9) | 13 (61.9) | 19 (90.5) | 18 (85.7) | 21 (100) | |
| 2 | Контроль (n = 26) | 7 (26.9) | 12 (46.2) | 12 (46.2) | 17 (65.4) | 20 (76.9) | 22 (84.6) | 26 (100) |
| ХГЧ (n = 17) | 5 (29.4) | 4 (23.5) | 6 (35.3) | 10 (58.8) | 8 (47.1)* | 13 (76.5) | 17 (100) | |
Примечание. *p < 0.05 по сравнению с контролем того же возраста. Данные по рефлексу переворачивания на поверхности представлены как Me [Q1; Q3]. 1 – потомки-самцы; 2 – потомки-самки. Note. *p < 0.05 as compared with controls at the same age. The data are presented as Me [Q1; Q3]. 1 – male offspring; 2 – female offspring.
Самцы обеих групп не различались по результатам теста переворачивания тела в воздухе на Д7–Д12. Однако у потомков-самок из ХГЧ-группы процент животных, успешно совершавших переворачивание, был ниже (p < < 0.05) на Д11 по сравнению с контролем. У всех потомков обоих полов на Д13 наблюдалось созревание этого рефлекса (табл. 2).
Доля самцов и самок с открытыми глазами в ХГЧ-группе на Д14 была меньше (p < 0.05 и p < 0.01 соответственно) по сравнению с контролем. Доля детенышей с открытыми глазами увеличивалась за период наблюдения (Д13-Д15) в обеих группах; у всех исследуемых потомков глаза были открыты на Д15 (табл. 3).
Таблица 3.
Открытие глаз и зрелость позы у потомков Table 3. Eyes opening and ambulation test in offspring
| Группа | Открытие глаз (число (%) потомков) | |||
|---|---|---|---|---|
| Д13 | Д14 | Д15 | ||
| 1 | Контроль (n = 22) | 8 (36.4) | 22 (100) | 22 (100) |
| ХГЧ (n = 21) | 9 (42.9) | 17 (86.0)* | 21 (100) | |
| 2 | Контроль (n = 26) | 8 (30.8) | 26 (100) | 26 (100) |
| ХГЧ (n = 17) | 6 (35.3) | 13 (76.5)** | 17 (100) | |
| Зрелость позы (число (%) потомков) | ||||
| Д15 | Д16 | Д17 | ||
| 1 | Контроль (n = 22) | 14 (63.6) | 18 (81.8) | 22 (100) |
| ХГЧ (n = 21) | 3 (14.3)*** | 21 (100)* | 38 (100) | |
| 2 | Контроль (n = 24)# | 16 (66.7) | 20 (83.3) | 24 (100) |
| ХГЧ (n = 17) | 4 (23.5)** | 15 (88.2) | 17 (100) | |
Примечание. *p < 0.05, **p < 0.01 и ***p < 0.001 по сравнению с контролем того же возраста. 1 – потомки-самцы; 2 – потомки-самки. #по техническим причинам два потомка были исключены из эксперимента. Note. *p < 0.05, **p < 0.01 and ***p < 0.001 as compared with controls at the same age. 1 – male offspring; 2 – female offspring. #two pups were discarded from the experiment by technical reasons.
Зрелость позы при движении наблюдалась у всех потомков, протестированных в период Д15–Д17. Доля потомков-самцов со зрелой позой в ХГЧ-группе была ниже (p < 0.001) на Д15, но выше (p < 0.05) на Д16 по сравнению с контролем (табл. 3). Доля потомков-самок со зрелым передвижением в ХГЧ-группе была ниже (p < 0.01) на Д15 по сравнению с контролем.
Анализ числа и размера нейронов в префронтальной коре и гиппокампе взрослых мышей
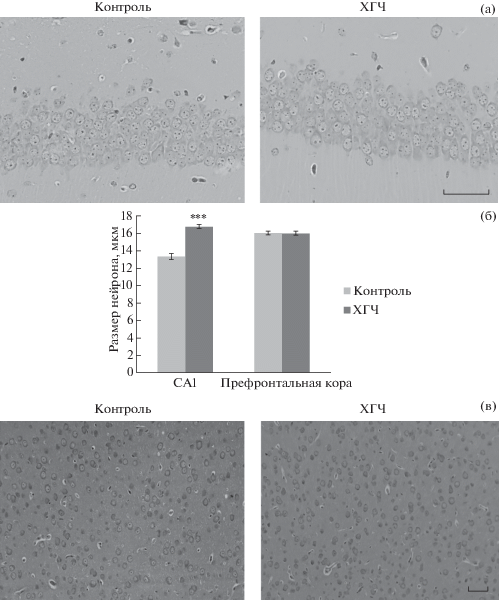
Число пирамидных нейронов в областях CA1, CA2, CA3 и DG гиппокампа на Д21 и Д42 представлено в табл. 4. Число пирамидных нейронов в области CA1 гиппокампа у потомков ХГЧ-группы было меньше (p < < 0.05) по сравнению с контролем на Д21 (рис. 2 (а)). Межгрупповых различий по числу нейронов в других областях гиппокампа обнаружено не было. Размер пирамидных нейронов в области CA1 гиппокампа у потомков ХГЧ-группы был больше (p < 0.001) по сравнению с контролем на Д21 (рис. 2 (б)). Число пирамидных нейронов в префронтальной коре у потомков обеих групп на Д21 и Д42 представлено в табл. 4. Данные по числу пирамидных нейронов правой и левой сторон префронтальной коры были объединены. На Д21 различий между группами не наблюдалось. Однако на Д42 было значительно больше (p < 0.05) пирамидных нейронов в коре головного мозга ХГЧ-группы (рис. 2 (в)). Межгрупповых различий в диаметре нейронов в префронтальной коре не наблюдалось (рис. 2 (б)).
Таблица 4.
Число нейронов в CA1, CA2, CA3 и DG областях гиппокампа и префронтальной коры у потомков Table 4. The number of neurons in the hippocampal CA1, CA2, CA3, DG areas, and prefrontal cortex in offspring
| Область гиппокампа | Группа | |||
|---|---|---|---|---|
| Д21 | Д42 | |||
| Контроль (n = 6)1 | ХГЧ (n = 4) | Контроль (n = 5) | ХГЧ (n = 4) | |
| CA1 | 6457 [5969; 7047]2 | 4488 [4395; 4756]* | 4044 [3779; 4798] | 4008 [3398; 4609] |
| CA2 | 8539 [6032; 10053] | 5687 [5407; 6721] | 5902 [5831; 6118] | 4969 [4653; 5245] |
| CA3 | 5196 [4071; 5307] | 3707 [3626; 3738] | 6506 [6175; 6592] | 6611 [5515; 6893] |
| DG | 17 847 [14 190; 18 050] | 15 631 [15 041; 16 482] | 19 387 [18 411; 20 335] | 19 646 [18 894; 20 680] |
| Контроль (n = 5) | ХГЧ (n = 5) | Контроль (n = 5) | ХГЧ (n = 5) | |
| Префронтальная кора | 3640 ± 180 | 3501 ± 90 | 2907 ± 69 | 4397 ± 386* |
Примечание. *p < 0.05 по сравнению с контролем. Данные по числу нейронов в гиппокампе представлены как Me [Q1; Q3]. Данные по числу нейронов в префронтальной коре представлены как M ± SEM. 1n – число исследованных мозгов в группе. 2Данные представлены как число нейронов на 1 мм2. Note. *p < 0.05 as compared with controls. The data on the number of neurons in the hippocampus are presented in the form Me [Q1; Q3]. The data of the number of neurons in the prefrontal cortex are presented in the form M ± SEM. 1n – the number of studied brains. 2The data are presented as the number of neurons in 1 mm2.
Рис. 2.
(а) – Нейроны, окрашенные по Нисслю в СА1 области гиппокампа на Д21. Шкала = 50 мкм. (б) – Размер нейронов в СА1 области гиппокампа на Д21 и в префронтальной коре на Д42. (в) – Пирамидные нейроны, окрашенные по Нисслю в префронтальной коре на Д42. Шкала = 50 мкм. ***p < 0.001 по сравнению с контролем.
Fig. 2. (а) – Nissl-stained neurons in the CA1 area of the hippocampus on the P21. Scale bar = 50 µm. (б) – Neuronal size in the CA1 area of the hippocampus on the P21 and the prefrontal cortex on the P42. (в) – Nissl-stained pyramidal neurons in the prefrontal cortex on the P42. Scale bar = 50 µm. ***p < 0.001 as compared with controls.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Экзогенный ХГЧ может приводить к некоторым эпигенетическим изменениям в клетках кумулюс-ооцитного комплекса (КОК) млекопитающих (Lussier et al., 2017; Huo et al., 2020). В частности, введение ХГЧ мышам C57Bl в дозировке 5 МЕ вызывает тенденцию к изменению уровня метилирования ДНК в зрелых ооцитах (Huo et al., 2020). Более того, экзогенный ХГЧ приводит к повышению уровня транскрипции некоторых генов в клетках гранулезы КОК крупного рогатого скота (Lussier et al., 2017). В другой работе, проведенной на мышах линии BALB, было обнаружено, что после протокола суперовуляции с использованием ХГЧ в качестве второго гормона была снижена экспрессия ДНК-метилтрансферазы в незрелых ооцитах и зиготах, а также повышена в двухклеточных эмбрионах (Uysal et al., 2018). Применение подобного протокола суперовуляции на мышах линии C57Bl приводило к более сильному снижению общего уровня метилирования ДНК в эмбрионах восьмиклеточной стадии по сравнению с контролем (Yu et al., 2019). Существуют предпосылки, что введение экзогенного ХГЧ женщинам на фоне повышенного прогестерона приводит к усиленному метилированию некоторых генов в эндометрии матки, играющих важную роль в процессе имплантации эмбриона (Xiong et al., 2020).
По нашим данным, потомки обоих полов ХГЧ-группы были легче на Д6–Д7; кроме того, самцы из ХГЧ-группы были легче на Д19–Д21 по сравнению с контролем. Эти наблюдения указывают на общую задержку неонатального развития потомства, рожденного от самок, получавших экзогенный ХГЧ. Ранее было показано, что отставание во время внутриутробного развития может вызывать подобную задержку и в постнатальный период у мышей (Burkus et al., 2015). Таким образом, наблюдаемая задержка неонатального развития у потомков ХГЧ-группы может быть обусловлена проблемами пренатального онтогенеза. Действительно, в ранних исследованиях на мышах было выявлено снижение скорости пренатального развития после воздействия на организм матери экзогенным ХГЧ (Ertzeid, Storeng, 1992) или комбинации гонадотропинов, в которую входил ХГЧ (Ertzeid, Storeng, 2001). Экзогенные гонадотропины могут влиять на выработку эндогенных стероидов яичниками (Santos et al., 2010), что может являться механизмом, лежащим в основе наблюдаемой в нашей работе задержки раннего постнатального развития у потомства.
Для оценки развития нервной системы у грызунов обычно используют рефлексы переворачивания (на поверхности и в воздухе) и тест на зрелость позы при движении (Fox, 1965; Heyser, 2004; Feather-Schussler, Ferguson, 2016). У мышей рефлекс переворачивания является незрелым при рождении, но созревание происходит к третьему дню жизни, когда детеныши более эффективно кормятся и определяют местонахождение соска (Fox, 1965). По нашим наблюдениям, после воздействия ХГЧ на мать не наблюдалось существенных эффектов на созревание рефлексов и позы при движении у потомства.
Рецепторы ЛГ/ХГЧ присутствуют на клетках преимплантационных эмбрионов мышей, при этом их число активно увеличивается при переходе от стадии морулы до бластоцисты (SenGupta et al., 1978). Влияние ХГЧ через ЛГ/ХГЧ рецепторы на ранних стадиях пренатального развития является важным для дифференцировки эмбриона и процесса нейруляции (Gallego et al., 2010). В нашей работе было показано большее число пирамидных нейронов в префронтальной коре у потомков ХГЧ-группы. Ранее было установлено, что воздействие на мышей ГСЖК и ХГЧ для индукции суперовуляции приводило к уменьшению числа пирамидных нейронов префронтальной коры головного мозга у потомства, а также к изменению экспрессии генов, участвующих в развитии нервной системы (Mainigi et al., 2016). Это несоответствие результатов исследований может быть связано с методическими различиями. Майниги и соавторы использовали двухэтапный протокол суперовуляции в сочетании с другими процедурами ВРТ, такими как эмбриотрансфер (Mainigi et al., 2016). Однако в настоящей работе использовали только стимуляцию ХГЧ без дополнительных процедур ВРТ для того, чтобы определить вклад только этого фактора.
В нашей работе была проведена оценка числа пирамидных нейронов во всех областях гиппокампа у потомства ХГЧ-группы. Было обнаружено, что число пирамидных нейронов в области СА1 гиппокампа у мышей ХГЧ-группы на Д21 было значительно меньше, но размер этих нейронов был больше по сравнению с контролем. По мнению некоторых исследователей, существует отрицательная корреляция между числом пирамидных нейронов и их размером в некоторых областях мозга у хомяков (Ptacek, Fagan-Dubin, 1974). Возможно, увеличение диаметра пирамидных нейронов может быть связано с некоторым повышением числа синаптических контактов (Ptacek, Fagan-Dubin, 1974). Следовательно, увеличенный размер пирамидных нейронов и уменьшение их числа могут указывать на высокую функциональную активность области СА1 гиппокампа у потомства ХГЧ-группы.
Ранее было показано, что введение ХГЧ в относительно высокой дозе детенышам мышей в неонатальном периоде после индуцированного гипоксически-ишемического поражения головного мозга оказывает защитное действие на префронтальную кору, что приводит к увеличению числа пирамидных нейронов и нейритов по сравнению с контролем (Movsas et al., 2017). Более того, воздействие ХГЧ in vitro при культивировании нейронов, полученных из коры и гиппокампа, способствовало росту нейрональных волокон после нейродегенерации, опосредованной N-метил-d-аспартатом (Movsas et al., 2017).
Чувствительность нейронов гиппокампа к экзогенному ХГЧ подтверждена также на модели болезни Альцгеймера у крыс (Jahanshahi et al., 2019). В исследовании было показано, что экзогенный ХГЧ оказывает защитное действие на вызванную стрептозотоцином болезнь Альцгеймера у крыс Wistar за счет увеличения числа рецепторов ЛГ/ХГЧ в префронтальной коре головного мозга (Jahanshahi et al., 2019). Однако роль ХГЧ в функционировании мозга млекопитающих по-прежнему вызывает споры и может зависеть от вида и линии животного. Также было обнаружено, что введение экзогенного ХГЧ в гиппокамп самок крыс снижает пространственную память, указывая на то, что ЛГ/ХГЧ может напрямую влиять на гиппокамп и когнитивные функции (Burnham et al., 2017). Мы считаем, что воздействие на самку экзогенного ХГЧ непосредственно перед наступлением беременности, не усугубляемое другими процедурами, может положительно влиять на развитие мозга потомства. Этот вывод согласуется с нашими наблюдениями, представленными здесь, а также с более ранними работами, которые продемонстрировали протективное действие ХГЧ на мозг при введениии его в постнатальный период некоторым лабораторным животным.
ЗАКЛЮЧЕНИЕ
Результаты исследования показывают, что воздействие ХГЧ на самок мышей изменяет пренатальную среду, влияет на рост потомков и развитие их нервной системы. Самцы и самки, рожденные после воздействия ХГЧ, характеризовались отставанием в росте в первую неделю жизни; у самцов, рожденных после такого воздействия, наблюдалось отставание в росте также в конце периода вскармливания. У данных мышей в возрасте 21 и 42 дней изменилось число нейронов в коре головного мозга и СА1 области гиппокампа; при этом в СА1 области гиппокампа был увеличен и размер нейронов. Представленные результаты призваны стимулировать будущие клинические исследования, направленные на выяснение эффектов введения ХГЧ на развитие нервной системы у детей, зачатых при помощи ВРТ.
Работа выполнена при поддержке Российского фонда фундаментальных исследований № 20-015-00162, бюджетного проекта ФИЦ ИЦиГ СО РАН № 0259-2021-0015 с использованием оборудования ЦКП “Центр генетических ресурсов лабораторных животных” ФИЦ ИЦиГ СО РАН, поддержанного Минобрнауки России (Уникальный идентификатор проекта RFMEFI62119X0023).
Список литературы
Амстиславский С.Я., Раннева С.В., Рагаева Д.С., Чуйко Э.А., Попкова А.М., Брусенцев Е.Ю. Влияние экзогенного хорионического гонадотропина человека на характер овуляции у мышей. Вавиловский журнал генетики и селекции. 2019. 23 (8): 1006–1010. https://doi.org/10.18699/VJ19.577
Раннева С.В., Брусенцев Е.Ю., Игонина Т.Н., Рагаева Д.С., Рожкова И.Н., Ершов Н.И., Левинсон А.Л., Амстиславский С.Я. Влияние культивирования эмбрионов на онтогенез потомства у млекопитающих. Онтогенез. 2020. 51 (6): 417–439. https://doi.org/10.31857/S0475145020060075
Al-Hader A.A., Lei Z.M., Rao Ch.V. Novel expression of functional luteinizing hormone/chorionic gonadotropin receptors in cultured glial cells from neonatal rat brains. Biol. Reprod. 1997. 56: 501–507. https://doi.org/10.1095/biolreprod56.2.501
Amer S. Gonadotropin induction of ovulation. Obstet. Gynaecol. Reprod. Med. 2007. 17 (7): 205–210. https://doi.org/10.1016/j.ogrm.2007.06.001
Awonuga A.O., Wheeler K., Thakur M., Jeelani R., Diamond M.P., Puscheck E.E. The value of delaying hCG administration to enable maturation of medium-sized follicles in patients undergoing superovulation for IVF/ICSI. J. Assist. Reprod. Genet. 2018. 35 (2): 289–295. https://doi.org/10.1007/s10815-017-1056-6
Barbuscia A., Mills M.C. Cognitive development in children up to age 11 years born after ART-a longitudinal cohort study. Hum. Reprod. 2017. 24: 1–7. https://doi.org/10.1093/humrep/dex102
Behringer R., Gertsenstein M., Nagy K., Nagy A. Administration of gonadotropins for superovulation in mice. Cold Spring Harbor Protocols. 2018. (1): 2018. 24–27. https://doi.org/10.1101/pdb.prot092403
Berntsen S., Soderstrom-Anttila V., Wennerholm U.B., Laivuori H., Loft A., Oldereid N.B., Romundstad L.B., Bergh C., Pinborg A. The health of children conceived by ART: “the chicken or the egg?” Hum. Reprod. Update. 2019. 25 (2): 137–158. https://doi.org/10.1093/humupd/dmz001
Bicks L.K., Koike H., Akbarian S., Morishita H. Prefrontal cortex and social cognition in mouse and man. Front. Psychol. 2015. 6: 1805. https://doi.org/10.3389/fpsyg.2015.01805
Burkus J., Kacmarova M., Kubandova J., Kokosova N., Fabianova K., Fabian D., Koppel J., Cikos S. Stress exposure during the preimplantation period affects blastocyst lineages and offspring development. J. Reprod. Dev. 2015. 61 (4): 325–331. https://doi.org/10.1262/jrd.2015-012
Burnham V., Sundby C., Laman-Maharg A., Thornton J. Luteinizing hormone acts at the hippocampus to dampen spatial memory. Horm. Behav. 2017. 85: 55–63. https://doi.org/10.1016/j.yhbeh.2016.11.007
Caligioni C.S. Assessing reproductive status/stages in mice. Curr. Protoc. Neurosci. 2009. Appendix 4 Appendix 4I. https://doi.org/10.1002/0471142301.nsa04is48
Emberti Gialloreti L., Mazzone L., Benvenuto A., Fasano A., Alcon A.G., Kraneveld A., Moavero R., Raz R., Riccio M.P., Siracusano M., Zachor D.A., Marini M., Curatolo P. Risk and protective environmental factors associated with autism spectrum disorder: evidence-based principles and recommendations. J. Clin. Med. 2019. 8 (2): 217. https://doi.org/10.3390/jcm8020217
Ertzeid G., Storeng R. Adverse effects of gonadotrophin treatment on pre-and postimplantation development in mice. J. Reprod. Fertil. 1992. 96: 649–655. https://doi.org/10.1530/jrf.0.0960649
Ertzeid G., Storeng R. The impact of ovarian stimulation on implantation and fetal development in mice. Hum. Reprod. 2001. 16 (2): 221–225. https://doi.org/10.1093/humrep/16.2.221
Ezoe K., Daikoku T., Yabuuchi A., Murata N., Kawano H., Abe T., Okuno T., Kobayashi T., Kato K. Ovarian stimulation using human chorionic gonadotrophin impairs blastocyst implantation and decidualization by altering ovarian hormone levels and downstream signaling in mice. Mol. Hum. Reprod. 2014. 20 (11): 1101–1116. https://doi.org/10.1093/molehr/gau065
Feather-Schussler D.N., Ferguson T.S. A battery of motor tests in a neonatal mouse model of cerebral palsy. J. Vis. Exp. 2016. (117): 53569. https://doi.org/10.3791/53569
Fournier T., Guibourdenche J., Evain-Brion D. Review: hCGs: different sources of production, different glycoforms and functions. Placenta. 2015. 36 (1): 60. https://doi.org/10.1016/j.placenta.2015.02.002
Fox W.M. Reflex-ontogeny and behavioural development of the mouse. Anim. Behav. 1965. 13 (2): 234–241. https://doi.org/10.1016/0003-3472(65)90041-2
Gallego M.J., Porayette P., Kaltcheva M.M., Bowen R.L., Vadakkadath Meethal S., Atwood C.S. The pregnancy hormones human chorionic gonadotropin and progesterone induce human embryonic stem cell proliferation and differentiation into neuroectodermal rosettes. Stem. Cell. Res. Ther. 2010. 1 (4): 28. https://doi.org/10.1186/scrt28
Hasegawa A., Mochida K., Inoue H., Noda Y., Endo T., Watanabe G., Ogura A. High-yield superovulation in adult mice by anti-inhibin serum treatment combined with estrous cycle synchronization. Biol. Reprod. 2016. 94 (1): 21. https://doi.org/10.1095/biolreprod.115.134023
Heyser C.J. Assessment of developmental milestones in rodents. Curr. Protoc. Neurosci. 2004. Chapter 8 Unit 8: 18. https://doi.org/10.1002/0471142301.ns0818s25
Huo Y., Yan Z.Q., Yuan P., Qin M., Kuo Y., Li R., Yan L.Y., Feng H.L., Qiao J. Single-cell DNA methylation sequencing reveals epigenetic alterations in mouse oocytes superovulated with different dosages of gonadotropins. Clin. Epigenetics. 2020. 12: 75. https://doi.org/10.1186/s13148-020-00866-w
Jahanshahi M., Saeidi M., Nikmahzar E., Babakordi F., Bahlakeh G. Effects of hCG on reduced numbers of hCG receptors in the prefrontal cortex and cerebellum of rat models of Alzheimer’s disease. Biotech. Histochem. 2019. 94 (5): 360–365. https://doi.org/10.1080/10520295.2019.1571228
Lee M., Ahn J.I., Lee A.R., Ko D.W., Yang W.S., Lee G., Ahn J.M., Lim J.M. Adverse effect of superovulation treatment on maturation, function and ultrastructural integrity of murine oocytes. Mol. Cells. 2017. 40 (8): 558–566. https://doi.org/10.14348/molcells.2017.0058
Lei Z.M., Rao C.V. Neural actions of luteinizing hormone and human chorionic gonadotropin. Semin. Reprod. Med. 2001. 19 (1): 103–9. https://doi.org/10.1055/s-2001-13917
Liu L., Gao J., He X., Cai Y., Wang L., Fan X. Association between assisted reproductive technology and the risk of autism spectrum disorders in the offspring: a meta-analysis. Sci. Rep. 2017. 7: 46207. https://doi.org/10.1038/srep46207
Lukacs H., Hiatt E.S., Lei Z.M., Rao Ch.V. Peripheral and intracerebroventricular administration of human chorionic gonadotropin alters several hippocampus-associated behaviors in cycling female rats. Horm. Behav. 1995. 29 (1): 42–58. https://doi.org/10.1006/hbeh.1995.1004
Luo C., Zuniga J., Edison E., Palla S., Dong W., Parker-Thornburg J. Superovulation strategies for 6 commonly used mouse strains. J. Am. Assoc. Lab. Anim. Sci. 2011. 50 (4): 471–478. PMID: 21838974
Lussier J.G., Diouf M.N., Levesque V., Sirois J., Ndiaye K. Gene expression profiling of upregulated mRNAs in granulosa cells of bovine ovulatory follicles following stimulation with hCG. Reprod. Biol. Endocrinol. 2017. 15: 88. https://doi.org/10.1186/s12958-017-0306-x
Ma M., Wang J., Xu L., Zhang Q., Du B., Jiang X., Shi Q., Zhou L., Li B., Saito H., Kurachi H. Effects of two human chorionic gonadotropin doses administered to the ovarian states during the in vitro fertilization and embryo transfer program. Biomed. Rep. 2015. 3 (2): 215–219. https://doi.org/10.3892/br.2014.391
Mainigi M., Rosenzweig J.M., Lei J., Mensah V., Thomaier L., Talbot Jr C.C., Olalere D., Ord T., Rozzah R., Johnston M.V., Burd I. Peri-implantation hormonal milieu: elucidating mechanisms of adverse neurodevelopmental outcomes. Reprod. Sci. 2016. 23 (6): 785–794. https://doi.org/10.1177/1933719115618280
Mazumder A.G., Patial V., Singh D. Mycophenolate mofetil contributes to downregulation of the hippocampal interleukin type 2 and 1β mediated PI3K/AKT/mTOR pathway hyperactivation and attenuates neurobehavioral comorbidities in a rat model of temporal lobe epilepsy. Brain. Behav. Immun. 2019. 75: 84–93. https://doi.org/10.1016/j.bbi.2018.09.020
Movsas T.Z., Weiner R.L., Greenberg M.B., Holtzman D.M., Galindo R. Pretreatment with human chorionic gonadotropin protects the neonatal brain against the effects of hypoxic-ischemic injury. Front. Pediatr. 2017. 5: 232. https://doi.org/10.3389/fped.2017.00232
Paxinos G., Franklin K. Mouse Brain in Stereotaxic Coordinates, 4th ed., Academic Press, 2012.
Ponjaert-Kristoffersen I., Bonduelle M., Barnes J., Nekkebroeck J., Loft A., Wennerholm U-B., Tarlatzis B.C., Peters C., Hagberg B.S., Berner A., Sutcliffe A.G. International collaborative study of intracytoplasmic sperm injection-conceived, in vitro fertilization-conceived, and naturally conceived 5-year-old child outcomes: cognitive and motor assessments. Pediatrics. 2005. 115 (3): e283–289. https://doi.org/10.1542/peds.2004-1445
Ptacek J.M., Fagan-Dubin L. Developmental changes in neuron size and density in the visual cortex and superior colliculus of the postnatal golden hamster. J. Comp. Neurol. 1974. 158 (3): 237–242. https://doi.org/10.1002/cne.901580302
Quaas A.M., Legro R.S. Pharmacology of medications used for ovarian stimulation. Best. Pract. Res. Clin. Endocrinol. Metabol. 2019. 33: 21–33. https://doi.org/10.1016/j.beem.2018.10.002
Ramos-Ibeas P., Heras S., Gomez-Redondo I., Planells B., Fernandez-Gonzalez R., Pericuesta E., Laguna-Barraza R., Perez-Cerezales S., Gutierrez-Adan A. Embryo responses to stress induced by assisted reproductive technologies. Mol. Reprod. Dev. 2019. 86 (10): 1292–1306. https://doi.org/10.1002/mrd.23119
Reinert S., Hubener M., Bonhoeffer T., Goltstein P.M. Mouse prefrontal cortex represents learned rules for categorization. Nature. 2021. 593: 411–417. https://doi.org/10.1038/s41586-021-03452-z
Sandin S., Nygren K.G., Iliadou A., Hultman C.M., Reichenberg A. Autism and mental retardation among offspring born after in vitro fertilization. JAMA. 2013. 310: 75–84. https://doi.org/10.1001/jama.2013.7222
Santos I.W., Binsfeld L.C., Weiss R.R., Kozicki L.E. Fertility rates of ewes treated with medroxyprogesterone and injected with equine chorionic gonadotropin plus human chorionic gonadotropin in anoestrous season. Vet. Med. Int. 2010. 2010: 978520. https://doi.org/10.4061/2010/978520
SenGupta J., Gupta P.D., Manchanda S.K., Talwar G.P. Immunocytochemical localization of binding ‘sites’ for LH and hCG in preimplantation mouse embryos. J. Reprod. Fertil. 1978. 52 (1): 163–165. https://doi.org/10.1530/jrf.0.0520163
Sunde A. Embryo culture and phenotype of the offspring. In Vitro Fertilization. 2019. 877–889. https://doi.org/10.1007/978-3-319-43011-9_74
Tantitham C., Panunumpa S., Satirapod C. The effect of human chorionic gonadotropin on the in vitro development of immature to mature human oocytes: a randomized controlled study. J. Hum. Reprod. Sci. 2020. 13 (2): 133–137. https://doi.org/10.4103/jhrs.JHRS_1_20
Uysal F., Ozturk S., Akkoyunlu G. Superovulation alters DNA methyltransferase protein expression in mouse oocytes and early embryos. J. Assist. Reprod. Genet. 2018. 35: 503–513. https://doi.org/10.1007/s10815-017-1087-z
Wang Y., Ock S.A., Chian R.C. Effect of gonadotrophin stimulation on mouse oocyte quality and subsequent embryonic development in vitro. Reprod. Biomed. Online. 2006. 12 (3): 304–314. https://doi.org/10.1016/s1472-6483(10)61002-4
Xiong Y., Hu L., Zhang T., Wang M., Xu H., Li T.C., Sun Y., Wang C.C. Effects of high progesterone in in-vitro fertilization cycle on DNA methylation and gene expression of adhesion molecules on endometrium during implantation window. J. Assist. Reprod. Genet. 2020. 37: 33–43. https://doi.org/10.1007/s10815-019-01623-6
Yu B., Smith T.H., Battle S.L., Ferrell S., Hawkins R.D. Superovulation alters global DNA methylation in early mouse embryo development. Epigenetics. 2019. 14: 780–790. https://doi.org/10.1080/15592294.2019.1615353
Zemla R., Basu J. Hippocampal function in rodents. Curr. Opin. Neurobiol. 2017. 43: 187–197. https://doi.org/10.1016/j.conb.2017.04.005
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


