Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 6, стр. 846-857
Реконсолидация памяти после обучения разной интенсивности зависит от длительности интервала до напоминания
Х. Л. Гайнутдинов 1, *, В. В. Андрианов 1, Т. Х. Богодвид 1, 2, И. Б. Дерябина 1, Л. Н. Муранова 1
1 Институт фундаментальной медицины и биологии, Федеральное государственное автономное образовательное учреждение высшего образования Казанский (Приволжский) федеральный университет
Казань, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
Поволжский университет физической культуры, спорта и туризма
Казань, Россия
* E-mail: kh_gainutdinov@mail.ru
Поступила в редакцию 29.01.2020
После доработки 17.03.2021
Принята к публикации 26.04.2021
Аннотация
Было проведено две серии экспериментов формирования условного рефлекса на обстановку у виноградной улитки с использованием двух протоколов обучения с разным количеством безусловных стимулов. В каждой экспериментальной серии для инициации реконсолидации памяти производили “напоминание” обстановки обучения в разное время – на 3-и и 6-е сутки после обучения – с последующей блокадой синтеза белков анизомицином. Процедура “напоминания” обстановки обучения в сочетании с инъекцией анизомицина, производимая на 3-и сутки после обучения по обоим протоколам, приводила к нарушению реконсолидации памяти (забыванию). Однако при “напоминании” обстановки обучения при условии блокады синтеза белков на 6-е сутки после обучения наблюдается сохранение памяти у животных, получавших меньше подкреплений при обучении, что указывает на отсутствие запуска процесса реконсолидации памяти. В то же время у животных, получавших существенно больше подкреплений при обучении, “напоминание” в условиях блокады синтеза белков на 6-е сутки после обучения приводило к забыванию, т.е. нарушению нормальной реконсолидации памяти. Таким образом, показано, что реконсолидация контекстуальной памяти у виноградной улитки зависит от интенсивности обучения, связанной с выбором протокола обучения с разным количеством безусловных стимулов. Высказано предположение о разных нейронных путях для процессов консолидации и реконсолидации.
ВВЕДЕНИЕ
Консолидацией памяти называют процесс постепенной стабилизации долговременной памяти при переходе ее из кратковременной формы в долговременную (McGaugh, 2000). Вновь полученная информация какое-то время существует в лабильном состоянии. Однако со временем она становится стабильной, нечувствительной к разрушающим агентам, например, к электрошоку, блокаторам синтеза белка (Nadel et al., 2012; McGaugh, 2015). Этап консолидации долговременной памяти нуждается в экспрессии генов и синтезе новых белков (Pearce et al., 2017). Давно возникал вопрос, каким образом новая информация взаимодействует со старой памятью, как она в нее включается. Несмотря на имеющуюся тенденцию рассматривать память как точное описание прошлых событий, научный анализ предполагает, что воспоминания не являются фиксированными объектами, а представляют собой динамический процесс обновления памяти (Alberini, 2011; Lee et al., 2017; Балабан, 2017). Фактически, если воспоминания, которые стали устойчивыми к ингибиторам экспрессии генов, извлекаются повторно, то они снова становятся лабильными в течение ограниченного времени (Alberini, 2011; Зайченко и др., 2020б; Barense, Sinclair, 2019). Выяснение природы и временной эволюции биологических изменений является ключом к пониманию формирования памяти (Suzuki et al., 2004; Alberini, 2011; Lee et al., 2017; Kukushkin, Carew, 2017).
Консолидированная память может подвергаться процессу реорганизации или дестабилизации (Dudai, 2006; McGaugh, 2015; Bessières et al., 2020). Процесс, посредством которого реактивированная лабильная память со временем стабилизируется, известен как реконсолидация памяти (Sara, 2000; Nader, Hardt, 2009; Balaban et al., 2014). Реконсолидация контекстуальной памяти была показана и у беспозвоночных животных (Child et al., 2003; Gainutdinova et al., 2005; Kemenes et al., 2006; Lukowiak et al., 2007; Cai et al., 2012; Dodd, Lukowiak, 2015; Balaban et al., 2016; Nikitin et al., 2018). Рассмотрение процесса формирования памяти и ее реконсолидации у моллюсков привлекательно также в связи с возможностью поиска корреляций с механизмами памяти на клеточном и молекулярном уровнях и на уровне рецепторов (Балабан, Коршунова, 2011; Гайнутдинов и др., 2011; Andrianov et al., 2015; Bogodvid et al., 2017; Carhart-Harris, Nutt, 2017; Dyakonova et al., 2019; Bessières et al., 2020; Orlandi et al., 2020).
Интенсивно обсуждаются вопросы, связанные с механизмами реконсолидации. С одной стороны – это взаимосвязь реконсолидации и забывания, процессы амнезии (Lattal, Wood, 2013; Almeida-Corrrêa, Amaral, 2014; Зюзина, Балабан, 2015; Wideman et al., 2018; Nikitin et al., 2020; Zuzina et al., 2020). Обязательным условием для реактивации памяти является напоминание (Nader et al., 2000; Anokhin et al., 2002; Воробьева и др., 2016; Hemstedt et al., 2017). Напоминание может привести к реконсолидации исходной памяти вследствие ряда молекулярных и клеточных процессов, которые приведут к стабилизации памяти или ее угасанию (Tronson, Taylor, 2007; Lattal, Wood, 2013; Hu et al., 2018; Бородинова, Балабан, 2020). Другое направление исследований связано с поиском временных окон, когда напоминание может привести к реконсолидации и/или забыванию памяти, либо оно не будет эффективно (Suzuki et al., 2004; Dudai, 2006; Alberini, LeDoux, 2013; Lee et al., 2017; Rodriguez-Ortiz, Bermúdez-Rattoni, 2017; Зайченко и др., 2020б; Deryabina et al., 2020). Были предприняты также шаги по поиску воздействий, влияющих на возможность реконсолидации на уровне внутриклеточных сигнальных систем, рецепторов NMDA (Kemenes et al., 2006; Tronson, Taylor, 2007; Шевченко и др., 2009; Huang et al., 2017; Nikitin et al., 2018; Zhang et al., 2018). Рассматривается динамика реконсолидации у моллюсков при нарушениях систем серотонина и оксида азота (Balaban et al., 2014; 2016; Bal et al., 2017; Schmidt et al., 2017; Nikitin et al., 2018; Deryabina et al., 2018; Zuzina et al., 2019). Показано также, что реконсолидация нарушается при взаимодействии с безусловным сигналом (Gainutdinova et al., 2005) и при предъявлении стрессорного сигнала (Dodd, Lukowiak, 2015).
Временная динамика реконсолидации памяти зависит от ряда параметров, для этого феномена существует много противоречивых данных (Воробьева и др., 2016; Balaban et al., 2016; Travaglia et al., 2018). Результаты разных авторов демонстрируют, что память тем труднее дестабилизировать, чем сильнее она фиксирована или чем больше времени прошло между запоминанием и реактивацией (Nader, Hardt, 2009; Inda et al., 2011; Зюзина, Балабан, 2015). С другой стороны, было показано, что раннюю аверсивную контекстную память у детенышей крыс можно восстановить с помощью напоминания, представленного позже в ходе развития (Alberini, Travaglia, 2017; Travaglia et al., 2018). Другим таким параметром может являться “сила памяти” после обучения (Suzuki et al., 2004; Alberini, LeDoux, 2013). Отсюда возникает вопрос, память от каких форм обучения подвержена реконсолидации, а какая память остается постоянной, а также в каких случаях память становится окончательно консолидированной, а также в каких случаях она остается лабильной.
Таким образом, исходя из анализа нерешенных аспектов в механизмах реконсолидации памяти, мы поставили задачу исследования реконсолидации долговременной контекстуальной памяти у виноградной улитки после выработки условного оборонительного рефлекса на обстановку с использованием разных протоколов его формирования, отличающихся интенсивностью стимулов.
МЕТОДИКА
Эксперименты проводились на виноградной улитке Helix lucorum. Для экспериментов отбирались животные примерно одного веса (около 20–25 г). Перед началом экспериментов моллюски не менее двух недель находились в активном состоянии во влажной атмосфере, при комнатной температуре и избытке пищи. У всех животных вырабатывали условный оборонительный рефлекс на обстановку по контекстуальной парадигме “на шаре” в ситуации, когда животные были жестко закреплены за раковину. При этом у них сохранялась свобода передвижения по поверхности шара, плавающего в воде, они полностью вытягивались из раковины. За два дня до сессии обучения и во время обучения (в течение 5 дней) экспериментальных животных переставали кормить, что определяется необходимостью активного состояния животного (Balaban et al., 2016; Deryabina et al., 2018).
Обучение заключалось в предъявлении электрических стимулов (в качестве безусловного стимула) на протяжении пяти дней при нахождении улитки в определенном контексте – на шаре. Животным предъявляли электрические стимулы (1–2 мА, 1 с, 50 Гц, импульсы прямоугольной формы, 10 мс) прикосновением двух макроэлектродов к дорзальным областям передней и задней частей ноги (Gainutdinova et al., 2005, Deryabina et al., 2020). Время от размещения животных в данной обстановке до первого стимула, а также между последующими раздражениями составляло около 15–20 мин. Интенсивность тока стимуляции подбиралась достаточной для запуска оборонительной реакции, связанной с втягиванием передней части тела, но не вызывающей повреждений кожи животных (Гайнутдинов, Береговой, 1994). Животные контрольных групп на протяжении всего эксперимента содержались в тех же условиях, что и животные экспериментальных групп.
До начала экспериментов и через сутки после обучения проводили тестирование уровня оборонительной реакции втягивания омматофор как показателя сформированной долговременной памяти в ответ на тактильную стимуляцию (рис. 1). Для этого измеряли амплитуду втягивания омматофор в ответ на тактильную стимуляцию, которая представляла собой касательное движение волоска кисточки по кожному покрову дорзальной стороны передней части ноги со стандартной скоростью (Муранова и др., 2019). Волосок при движении касался кожи животного на протяжении примерно 1 см и двигался с примерной скоростью 1 см/с. При этом за 100% принимали максимальную величину втягивания омматофор. Тестирование поведенческих реакций проводили: 1) на шаре, 2) на плоской поверхности крышки террариума (т.е. в условиях, отличных от обстановки обучения).
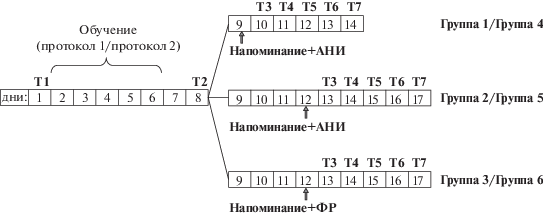
Рис. 1.
Схема экспериментов. В клетках указаны дни эксперимента. “Т1–Т7” – тестирование уровня оборонительной реакции животных в разное время эксперимента при нахождении на шаре и на плоской поверхности. “Т1”, день 1-й – тестирование начального уровня оборонительной реакции животных. “Обучение (протокол 1/протокол 2)”, дни 2–6-й – выработка обстановочного условного рефлекса по двум разным протоколам. “Протокол 1” и “Протокол 2” – соответственно предъявление 5 или 3 электрических раздражений на протяжении 5 дней при нахождении животных в определенном контексте – на шаре. 7-й день – день отдыха животных. “Т2”, 8-й день – тестирование уровня оборонительной реакции после процедуры обучения и отдыха. “Группа 1/ Группа 4”: “Напоминание + АНИ”, 9-й день – напоминание обстановки обучения с последующей инъекцией АНИ; “Т3–Т7”, дни 10–14-й – тестирование уровня оборонительной реакции животных. “Группа 2/Группа 5”: “Напоминание+АНИ”, 12-й день – напоминание обстановки обучения с последующей инъекцией АНИ, “Т3–Т7”, дни 13–17-й – тестирование уровня оборонительной реакции животных. “Группа 3/Группа 5”: “Напоминание+ФР”, 12-й день – напоминание обстановки обучения с последующей инъекцией ФР, “Т3–Т7”, дни 13–17-й – тестирование уровня оборонительной реакции животных.
Fig. 1. The scheme of experiments. In the boxes indicated the days of the experiment. “T1–T7” – testing the level of the defensive reaction of animals at different times of the experiment as on the ball and on a flat surface. “T1”, day 1 – testing the initial level of the defensive reaction of animals. “Training (protocol1/protocol2)”, days 2–6 – development of a conditioned reflex according to two different protocols. “Protocol 1” and “Protocol 2” – respectively presentation of 5 or 3 electrical stimuli for 5 days when the animals are in a certain context - on the ball. Day 7 – the day of rest of the animals. “T2”, day 8 – testing the level of the defensive reaction after the training and rest procedure. “Group 1/Group 4”: “Reminder + ANI”, day 9 – reminder of the learning environment followed by ANI injection; “T3–T7”, days 10–14 – testing the level of the defensive reaction of animals. “Group 2/Group 5”: “Reminder + ANI”, day 12 – a reminder of the learning environment followed by an injection of ANI, “T3–T7”, days 13–17 – testing the level of the defensive reaction of animals. “Group 3/Group 5”: “Reminder + SS”, day 12 – reminder of the learning environment followed by SS injection, “T3–T7”, days 13–17 – testing the level of the defensive reaction of animals.
Ранее мы вырабатывали условный рефлекс на обстановку по одному протоколу “применение 5 стимулов в день в течение 5 дней” (Гайнутдинова и др., 2004; Deryabina et al., 2018). В данной работе было проведено 2 серии экспериментов с использованием двух протоколов обучения: 1) “применение 5 стимулов в день в течение 5 дней” и 2) “применение 3 стимулов в день в течение 5 дней”. Вторая схема была применена с целью уменьшить интенсивность обучения (общее число стимулов – 15 вместо 25) и, таким образом, получить другую “силу памяти” (Suzuki et al., 2004).
Эксперимент начинался с тестирования уровня оборонительных реакций животных в ответ на тактильную стимуляцию при нахождении животных в ситуациях как на плоскости, так и на шаре – Т1 (1-й день) (рис. 1). После процедуры обучения следовал день отдыха, а на следующий день проводились тесты Т2, которые в проведенных экспериментах подтверждали успешную выработку условного оборонительного рефлекса на обстановку. Затем тестирование продолжалось до 12 сут – тесты Т3-Т7 в течение пяти дней.
Для исследования феномена реконсолидации долговременной памяти на обстановку, выработанную после обучения, производили “напоминание” обстановки обучения, которая заключалась в помещении животных на 20 мин в ситуацию обучения – на шар. Животные были, так же как и при обучении, жестко закреплены за раковину, с сохранением свободы передвижения по поверхности шара, плавающего в воде. Однако при этом животные не получали ни тактильных, ни электрических стимулов. Затем, после процедуры напоминания, блокировали биосинтез белка. Для блокады белкового синтеза в работе был использован анизомицин (АНИ) (anisomycin 2-(p-Methoxybenzyl)-3,4-pyrrolidinediol 3-acetate, Sigma)). Растворы АНИ применялись в дозе 16 мг/кг веса животного (0.4 мг/на улитку), растворенные в 0.2 мл ФР. Контрольным животным вводили 0.2 мл ФР. Внутригемоцельные инъекции растворов выполнялись в область синусного узла улитки, обычно скрытую под раковиной (Balaban et al., 2016; Deryabina et al., 2018).
В каждой экспериментальной серии для инициации реконсолидации памяти производили “напоминание” обстановки обучения в разное время (2 группы животных): 1) на следующий день после тестирования в конце обучения, подтверждающего выработку условного рефлекса на обстановку (на 3-и сутки после обучения), и 2) на 6-е сутки после обучения; эти “напоминания” сопровождали последующей инъекцией АНИ или ФР. На другой и в последующие дни после “напоминания” обстановки обучения снова проводили тестирование уровня оборонительной реакции как показателя сохраненной долговременной памяти. Наблюдаемое при этом значительное снижение уровня условной оборонительной реакции демонстрирует наличие процесса реконсолидации контекстуальной памяти, зависящей от белкового синтеза (Balaban et al., 2016). Поведенческие эксперименты проводились с применением метода двойного слепого контроля, процедура подробно описана нами ранее (Гайнутдинова и др., 2004; Deryabina et al., 2020).
Результаты были статистически обработаны, они представлены как среднее ± SEM. Достоверность различий оценивали по t-критерию Стьюдента и U-критерию Манна–Уитни. Была использована программа SigmaStat32. Статиcтическая значимость оценивалась по p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Тестирование оборонительных реакций втягивания омматофор после обучения в ответ на тактильную стимуляцию показывает достоверное возрастание оборонительных реакций, когда виноградная улитка находится на шаре, как после обучения по протоколу с более сильным подкреплением (рис. 2, p < < 0.001), так и после обучения по протоколу с более слабым подкреплением (рис. 3, p < < 0.01). Этот результат демонстрирует выработку у улитки условного рефлекса на обстановку – достоверное отличие было показано при тестировании одной и той же экспериментальной группы в разных обстановках (на плоскости, т.е. в нейтральной обстановке, и на шаре – в обстановке, в которой происходило обучение). Ранее нами было показано, что помещение улиток на шар, которое сопровождается предъявлением электрических или тактильных стимулов, в том числе тестирование, не сопровождается реконсолидацией (Gainutdinova et al., 2005, Deryabina et al., 2020). Обстановочный рефлекс сохраняется после напоминания с последующей инъекцией ФР в течение 12 дней (рис. 2, 3); данный результат аналогичен результату, полученному ранее нами для условного рефлекса пищевой аверзии (Гайнутдинова и др., 2003).
Рис. 2.
Уровень оборонительной реакции (амплитуда реакции отдергивания омматофор) улиток в двух обстановках (на шаре и плоскости) для улиток, обучавшихся по протоколу 1 “5 стимулов в течение 5 дней” при инъекции улиткам АНИ после сеанса “Напоминания” на 3-и (n = 13) и 6-е (n = 10) сутки после обучения и при инъекции ФР после сеанса “Напоминания” на 6-е (n = 10) сутки после обучения. Т1 – тестирование до начала обучения, Т2 – тестирование через 1 сутки после обучения, Т3-Т7 – тестирование животных после инъекций веществ и напоминания на 8-е – 12-е сутки после обучения. Стрелки указывают момент напоминания и инъекции АНИ или ФР. * – достоверность отличия от Т1 p < 0.05. ** – достоверность отличия от Т1 p < 0.01. *** – достоверность отличия от Т1 p < 0.001. ## – достоверность отличия от Т2 p < 0.01.
Fig. 2. The level of defensive response (the amplitude of response of ommatophores withdrawal) of snails in two contexts, on the ball and flat surface for the snails learned according to the protocol 1 “5 stimuli for 5 days” after reminder and injection of ANI on 3d (n = 13) – 6th (n = 10) days after training and injection of SS after the “Reminder” session on 6 (n = 10) days after training. T1 - initial testing before the beginning of training, T2 – testing 1 day after training, T3-T7 – testing of animals after the injections of drugs and reminder on the 8th – 12th days after training. Arrows indicate: SS – time of injection of saline solution, ANI – time of injection of anisomycin. Hash signs indicate significant difference from T1 (p < 0.05; p < 0.01; p < 0.001). Asterisks signs indicate significant difference from T2 (p < 0.01).
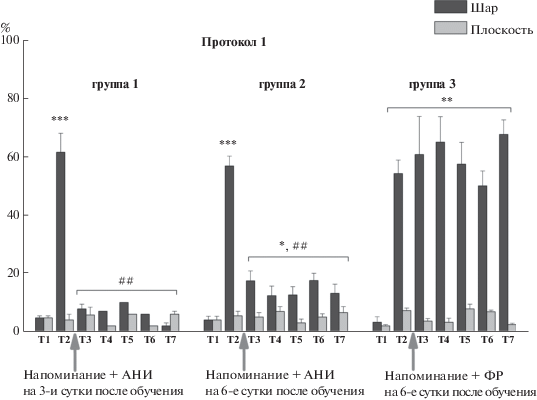
Рис. 3.
Уровень оборонительной реакции (амплитуда реакции отдергивания омматофор) улиток в двух обстановках (на шаре и плоскости) для улиток, обучавшихся по протоколу 2 “3 стимула в течение 5 дней” при инъекции улиткам АНИ после сеанса “Напоминания” на 3-и (n = 10) и 6-е (n = 10) сутки после обучения и при инъекции ФР после сеанса “Напоминания” на 6-е (n = 10) сутки после обучения. Т1 – тестирование до начала обучения, Т2 – тестирование через 1 сутки после обучения, Т3–Т7 – тестирование животных после инъекций веществ и напоминания на 8-е – 12-е сутки после обучения. Стрелки указывают момент напоминания и инъекции АНИ или ФР. * – достоверность отличия от Т1 p < 0.05. ** – достоверность отличия от Т1 p < 0.01. ## – достоверность отличия от Т2 p < 0.01.
Fig. 3. The level of defensive response (the amplitude of response of ommatophores withdrawal) of snails in two contexts, on the ball and flat surface for the snails learned according to the protocol 2 “3 stimuli for 5 days” after reminder and injection of ANI on 3d (n = 10) – 6th (n = 10) days after training and injection of SS after the “Reminder” session on 6 (n = 10) days after training. T1 – initial testing before the beginning of training, T2 – testing 1 day after training, T3–T7 – testing of animals after the injections of drugs and reminder on the 8th – 12th days after training. Arrows indicate: SS – time of injection of saline solution, ANI – time of injection of anisomycin. Hash signs indicate significant difference from T1 (p < 0.05; p < 0.01). Asterisks signs indicate significant difference from T2 (p < 0.01).
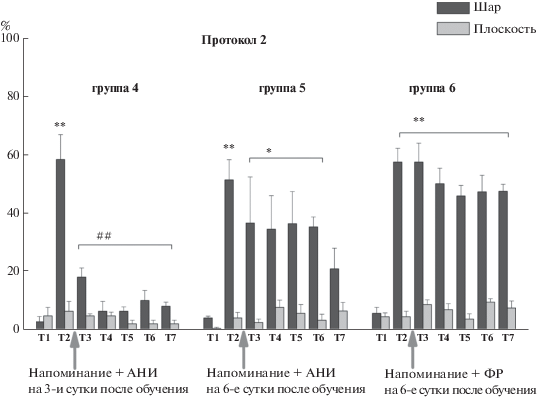
Затем производили “напоминание” обстановки обучения в разное время: на 3-и сутки после обучения и на 6-е сутки после обучения с последующей инъекцией АНИ или ФР. Улитки, получившие после напоминания инъекцию ФР, демонстрируют сохранение памяти (уровень оборонительной реакции) после обучения по обоим протоколам (рис. 2, 3). Этот результат показывает, с одной стороны, длительное сохранение результатов обучения и, с другой стороны, что инъекция ФР после напоминания условного сигнала (обстановки) не препятствует реконсолидации. Тестирование в течение 5 сут после напоминания и инъекции АНИ, которые были произведены на 3-и сутки после обучения, показало достоверное, в среднем в 6 раз, снижение оборонительных реакций при тестировании на шаре для улиток, обученных по обоим протоколам (n = 13 и n = 10) (рис. 2, 3). Этот результат демонстрирует полную достоверную потерю приобретенной контекстуальной памяти в обеих экспериментальных сериях.
В случае тестирования в течение 5 сут после напоминания и инъекции АНИ, которые были произведены на 6-е сутки после обучения, результаты были иными. В этом случае у улиток, обученных по протоколу с более сильным подкреплением (n = 10), также наблюдалось достоверное, в среднем в 3–4 раза, снижение оборонительных реакций при тестировании на шаре (рис. 2). В то же время у животных, обученных по протоколу с более слабым подкреплением (n = 10), не происходило достоверного снижения оборонительных реакций при тестировании на шаре (рис. 3). Уровень оборонительных реакций у этих улиток достоверно отличался от первоначального уровня оборонительных реакций на шаре до обучения.
Таким образом, нами было найдено, что у улиток, обученных по протоколу с более сильным подкреплением, возможность реконсолидации контекстуальной памяти сохраняется в течение большего времени, чем после обучения по протоколу с более слабым подкреплением.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На сегодняшний день установлено, что реактивация сохраненной памяти в мозге в результате напоминания может сделать ее временно лабильной (Nader, Hardt, 2009; Balaban et al., 2014; Zhang et al., 2018). Вследствие этого время, которое требуется для восстановления памяти, может быть различным для разных форм и протоколов обучения (Suzuki et al., 2004; Alberini, 2011; Lee et al., 2017). Эксперименты показывают, что реактивация и реконсолидация не являются синонимами, т.е. процессы, запускаемые после напоминания, могут протекать по-разному в зависимости от конкретных условий эксперимента (Elsey, Kindt, 2015). Напоминание может привести к процессам, которые приведут к стабилизации памяти (реконсолидации) либо к ее угасанию (Lattal, Wood, 2013; Зюзина, Балабан, 2015). Изменение в выражении памяти связано с изменениями в мозге, коррелятами долговременной памяти. Ряд авторов полагают, что такая пластичность, обусловленная поиском, идеально подходит для обновления памяти новой информацией (Lee et al., 2017; Barense, Sinclair, 2019). Воспоминания легко искажаются. Возникает вопрос: в каких условиях это может происходить? При исследованиях реконсолидации были использованы неполные напоминания, чтобы выявить ошибку прогноза, обновлять и укреплять воспоминания. Были приведены свидетельства того, что неполные напоминания управляют обновлением памяти человека, от классической обусловленности до натуралистических эпизодов (Barense, Sinclair, 2019). Это совпадает с мнением, что реконсолидация памяти и обновление памяти – это две стороны одной и той же медали (Bermúdez-Rattoni, McGaugh, 2017). Было высказано предположение, что реконсолидация является консолидацией как бесконечный процесс модификации схемы (McKenzie, Eichenbaum, 2011).
Параметры процессов, ведущих к реконсолидации памяти, изучены недостаточно и являются предметом интенсивных исследований. В частности, извлечение памяти считается необходимым условием для инициирования повторной консолидации. Это предположение имеет смысл, поскольку только релевантные сигналы будут вызывать реконсолидацию определенной памяти (Rodriguez-Ortiz, Bermúdez-Rattoni, 2017). Так, была показана возможность ухудшения первично выработанного инструментального навыка (“старой” памяти) после реактивации, в том числе за счет формирования “новой” памяти (Зайченко и др., 2018; 2020а). Имеются две не взаимоисключающие гипотезы, которые были предложены для объяснения функции реконсолидации. Согласно одной из них, память становится лабильной, потому что благодаря повторной консолидации новая информация интегрируется в фон прошлого, что позволяет обновлять память. Другая предполагает, что память после восстановления становится сильнее и устойчивее к сбоям (Sara, 2000; Dudai, 2004; Alberini, 2011; Bavassi et al., 2020).
Мы тоже попытались приблизиться к вопросу о том, память от каких форм обучения подвержена реконсолидации или является лабильной, а какая память остается постоянной, окончательно консолидированной. Для ответа на эти вопросы была выбрана модель обучения, в которой условным стимулом является запоминание обстановки (Гайнутдинова и др., 2004; Balaban et al., 2014; 2016; Deryabina et al., 2020). Модели, в которых для животных применяется обстановка в качестве условного сигнала при обучении и дальнейшем напоминании, используют во многих экспериментах, и в некоторых случаях первоначальное запоминание обстановки и ее последующая ассоциация с безусловным стимулом могут быть разнесены на большие интервалы времени (Воробьева и др., 2016). Нами было показано, что при обучении меньшей интенсивности окно лабильности памяти, при котором возможна инициация процесса реконсолидации, сужается, память переходит в стабильную консолидированную форму раньше. Одним из объяснений этого феномена может служить предположение, выдвинутое Alberini (2011), о том, что, когда память достигает асимптотического уровня, она устойчива к разрушению при амнезии после реактивации. Возможно, что после обучения меньшей интенсивности память быстрее достигает этого уровня и поэтому менее подвержена реконсолидации. Другой причиной может быть разная скорость амнезии после реактивации, и эффекты блокады синтеза белков анизомицином могут отличаться в разных экспериментах в зависимости от внутреннего физиологического состояния (Lee et al., 2017). Инструментами для воздействия на процессы реконсолидации являются воздействия на медиаторы: серотонин, оксид азота, глутамат (Balaban et al., 2014; 2016; Bal et al., 2017; Nikitin et al., 2018; Палихова, 2020; Deryabina et al., 2020). Такими инструментами являются также воздействия на внутриклеточную сигнальную систему, например, пропроналолом (Huang et al., 2017). Сравнение полученных нами результатов с нашими более ранними о влиянии блокады синтеза серотонина на реконсолидацию памяти (Deryabina et al., 2018; 2020) и данными, полученными в лаборатории проф. П.М. Балабана о влиянии нейротоксического аналога серотонина и его предшественника на реконсолидацию памяти (Balaban et al., 2016; Zuzina et al., 2019), позволяет высказать предположение о разных нейронных путях для процессов консолидации и реконсолидации. В пользу такого предположения служат также результаты Bavassi и соавт. (2020). Используя функциональную магнитно-резонансную томографию (фМРТ), они изучили активность определенных областей, активируемых во время поиска, и проанализировали функциональную связность различных отделов мозга. Они нашли, что память после реконсолидации является более сильной, чем без таковой, и предположили, что процесс реконсолидации позволяет охватить более эффективную (полную) локальную сеть, которая лучше обменивается информацией по сравнению с воспоминаниями, которые не подвергались воздействию (Bavassi et al., 2020). Также с применением метода фМРТ к предположению о разных путях для процессов консолидации и реконсолидации пришли другие авторы (Liu et al., 2016).
Было высказано предположение, что напоминание не является унитарным процессом, а состоит из двух разных компонентов; один из них приводит к экспрессии памяти, а другой – к реконсолидации (Rodriguez-Ortiz, Bermúdez-Rattoni, 2017). Имеющиеся данные подчеркивают, что не только процессы формирования и угасания памяти, но и процессы реконсолидации памяти являются динамичными (Suzuki et al., 2004; Alberini, 2011). В настоящей работе показано, что возможность запуска реконсолидация контекстуальной памяти зависит от времени напоминания, прошедшего после обучения, и от интенсивности проведенного обучения.
Актуальность полученных данных согласуется со значительным числом исследований механизмов и временной динамики реконсолидации и широким обсуждением этой проблемы. Полученные нами результаты, а также данные литературы (Sorg, 2012; Lattal, Wood, 2013) привели нас к выводу, что возможность запуска реконсолидация долговременной памяти зависит от интенсивности обучения или “силы памяти” (Suzuki et al., 2004; Alberini, 2011). Таким образом, показано, что реконсолидация контекстуальной памяти у виноградной улитки зависит от интенсивности обучения, связанной с выбором протокола обучения с разным количеством безусловных стимулов.
ЗАКЛЮЧЕНИЕ
Возможность запуска реконсолидации контекстуальной памяти зависит от времени, прошедшего после обучения до напоминания, и от интенсивности проведенного обучения. Показано, что у улиток, обученных по протоколу с более сильным подкреплением, возможность реконсолидации контекстуальной памяти сохраняется в течение большего времени, чем после обучения по протоколу с более слабым подкреплением.
Работа поддержана за счет средств Программы стратегического академического лидерства Казанского (Приволжского) федерального университета.
Список литературы
Балабан П.М. Молекулярные механизмы модификации памяти. Журнал высшей нервной деятельности им. И.П. Павлова. 2017. 67 (2): 131–140.
Балабан П.М., Коршунова Т.А. Сетевые, клеточные и молекулярные механизмы пластичности в простых нервных системах. Успехи физиологических наук. 2011. 42 (4): 3–19.
Бородинова А.А., Балабан П.М. Эпигенетическая регуляция как основа долговременных изменений в нервной системе: в поисках механизмов специфичности. Биохимия. 2020. 85 (9): 1139–1158.
Воробьева Н.С., Ивашкина О.И., Торопова К.А., Анохин К.В. Долговременная обстановочная память у мышей: продолжительность и способность к ассоциации с подкрепляющим воздействием. Журнал высшей нервной деятельности им. И.П. Павлова. 2016. 66 (3): 352–360.
Гайнутдинов Х.Л., Андрианов В.В., Гайнутдинова Т.Х. Изменение возбудимости нейрональной мембраны как клеточный механизм обучения и памяти. Успехи физиологических наук. 2011. 42 (1): 33–50.
Гайнутдинов Х.Л., Береговой Н.А. Долговременная сенситизация у виноградной улитки: электрофизиологические корреляты в командных нейронах оборонительного поведения. Журнал высшей нервной деятельности им. И.П. Павлова. 1994. 44 (2): 307–315.
Гайнутдинова Т.Х., Андрианов В.В., Гайнутдинов Х.Л., Мухамедшина Д.И., Тагирова Р.Р. Длительность сохранения изменений электрических характеристик командных нейронов при выработке условного оборонительного рефлекса у улитки. Журнал высшей нервной деятельности им. И.П. Павлова. 2003. 53 (3): 388–391.
Гайнутдинова Т.Х., Тагирова Р.Р., Исмаилова А.И., Муранова Л.Н., Гайнутдинов Х.Л., Балабан П.М. Зависимая от белкового синтеза реактивация обстановочного условного рефлекса у виноградной улитки. Журнал высшей нервной деятельности им. И.П. Павлова. 2004. 54 (6): 795–800.
Зайченко М.И., Григорьян Г.А., Маркевич В.А. Влияние МК-801 на реконсолидацию пространственной памяти в 8-канальном радиальном лабиринте зависит от условий ее реактивации. Журнал высшей нервной деятельности им. И.П. Павлова. 2018. 68 (2): 216–226.
Зайченко М.И., Закиров Ф.Х., Маркевич В.А., Григорьян Г.А. МК-801 нарушает реконсолидацию “новой” памяти и влияет на “старую” память при инструментальном пищевом поведении в 8-канальном радиальном лабиринте у крыс. Журнал высшей нервной деятельности им. И.П. Павлова. 2020a. 70 (6): 770–782.
Зайченко М.И., Маркевич В.А., Григорьян Г.А. Реактивация и реконсолидация памяти в оборонительном и пищевом инструментальном поведении. Успехи физиологических наук. 2020б. 51 (1): 1–16.
Зюзина А.Б., Балабан П.М. Угашение и реконсолидация памяти. Журнал высшей нервной деятельности им. И.П. Павлова. 2015. 65 (5): 564–576.
Муранова Л.Н., Андрианов В.В., Богодвид Т.Х., Дерябина И.Б., Лазутин С.А., Гайнутдинов Х.Л. Изменение мембранного и порогового потенциалов командных нейронов виноградной улитки при выработке условного оборонительного рефлекса на обстановку. Бюллетень экспериментальной биологии и медицины. 2019. 168 (12): 664–667.
Палихова Т.А. Влияние монодиет с разным содержанием триптофана на окрас раковины, поведение и нейронную активность виноградной улитки. Журнал высшей нервной деятельности им. И.П.Павлова. 2020. 70 (5): 650–654.
Шевченко К.Г., Данилова А.Б., Гринкевич Л.Н. Пост-трансляционная модификация гистона H3 при консолидации и реконсолидации памяти у моллюска Helix. Вестник ВОГиС. 2009. 13 (4): 723–730.
Alberini C.M. The role of reconsolidation and the dynamic process of long-term memory formation and storage. Front. Behav. Neurosci. 2011. 5 (12). https://doi.org/10.3389/fnbeh.2011.00012
Alberini C.M., LeDoux J.E. Memory reconsolidation. Current Biology. 2013. 23 (17): R746–R750.
Alberini C.M., Travaglia A. Infantile Amnesia: A Critical Period of Learning to Learn and Remember. J. Neurosci. 2017. 37 (24): 5783–5795. https://doi.org/10.1523/JNEUROSCI.0324-17.2017
Almeida-Corrrêa S., Amaral O.B. Memory labilization in reconsolidation and extinction – Evidence for a common plasticity system? J. Physiol. – Paris. 2014. 108: 292–306. https://doi.org/10.1016/j.jphysparis.2014.08.006
Andrianov V.V., Bogodvid T.Kh., Deryabina I.B., Golovchenko A.N., Muranova L.N., Tagirova R.R., Vinarskaya A.Kh., Gainutdinov Kh.L. Modulation of defensive reflex conditioning in snails by serotonin. Front. Behav. Neurosci. 2015. 9 (279): 1–12. https://doi.org/10.3389/fnbeh.2015.00279
Anokhin K.V., Tiunova A.A., Rose S.P.R. Reminder effects–reconsolidation or retrieval deficit? Pharmacological dissection with protein synthesis inhibitors following reminder for a passive-avoidance task in young chicks. Eur. J. Neurosci. 2002. 15: 1759–1765.
Balaban P.M., Roshchin M.V., Timoshenko A.Kh., Gainutdinov Kh.L., Bogodvid T.Kh., Muranova L.N., Zuzina A.B., Korshunova T.A. Nitric oxide is necessary for labilization of a consolidated context memory during reconsolidation in terrestrial snails. Eur. J. Neurosci. 2014. 40: 2963–2970. https://doi.org/10.1111/ejn.12642
Balaban P.M., Vinarskaya A.Kh., Zuzina A.B., Ierusalimsky V.N., Malyshev A.Yu. Impairment of the serotonergic neurons underlying reinforcement elicits extinction of the repeatedly reactivated context memory. Sci. Rep. 2016. 6: 36933. https://doi.org/10.1038/srep36933
Bal N.V., Rysakova M.P., Vinarskaya A.Kh., Ivanova V., Zuzina A.B., Balaban P.M. Cued memory reconsolidation in rats requires nitric oxide. Eur. J. Neurosci. 2017. 45: 643–647. https://doi.org/10.1111/ejn.13503
Barense M.D., Sinclair A. Prediction Error and Reconsolidation of Episodic Memories. Trends in Neurosci. 2019. 42 (10). https://doi.org/10.1016/j.tins.2019.08.007
Bavassi L., Forcato C., Fernández R.S., De Pino G., Pedreira M.E., Villarreal M.F. Retrieval of retrained and reconsolidated memories are associated with a distinct neural network. Sci. Rep. 2019. 9: 784. https://doi.org/10.1038/s41598-018-37089-2
Bessières B., Travaglia A., Mowery T.M., Zhang X., Alberini C.M. Early life experiences selectively mature learning and memory abilities. Nature Communications. 2020. 11: 628. https://doi.org/10.1038/s41467-020-14461-3
Bogodvid T.Kh., Andrianov V.V., Deryabina I.B., Muranova L.N., Silantyeva D.I., Vinarskaya A.Kh., Balaban P.M., Gainutdinov Kh.L. Responses of premotor interneurons to serotonin application in naïve and learned snails are different. Front. Cell. Neurosci. 2017. 11: 403. https://doi.org/10.3389/fncel.2017.00403
Cai D., Pearce K., Chen S., Glanzman D.L. Reconsolidation of long-term memory in Aplysia. Curr. Biol. 2012. 22: 1783–1788. https://doi.org/10.1016/j.cub.2012.07.038
Carhart-Harris R.L., Nutt D.J. Serotonin and brain function: a tale of two receptors. J. Psychopharmacol. 2017. 31: 1091–1120. https://doi.org/10.1177/02698811177
Child F.M., Epstein H.T., Kuzirian A.M., Alkon D.L. Memory reconsolidation in Hermissenda. Biol. Bull. 2003. 205: 218–219.
Deryabina I.B., Muranova L.N., Andrianov V.V., Gainutdinov Kh.L. Impairing of serotonin synthesis by p-clorphenylalanine prevents the forgetting of contextual memory after reminder and the protein synthesis inhibition. Front. Pharmacol. 2018. 9: 607. https://doi.org/10.3389/fphar.2018.00607
Deryabina I.B., Muranova L.N., Andrianov V.V., Bogodvid T.Kh., Gainutdinov Kh.L. Effects of thryptophan hydroxylase blockade by p-chlorophenylalanine on contextual memory reconsolidation after training of different intensity. Int. J. Mol. Sci. 2020. 21: 2087. https://doi.org/10.3390/ijms21062087
Dodd S.X., Lukowiak K. Sequential exposure to a combination of stressors blocks memory reconsolidation in Lymnaea. J. Experim. Biol. 2015. 218: 923–930. https://doi.org/10.1242/jeb.114876
Dudai Y. Reconsolidations: the advantage of being refocused. Curr. Opinion in Neurobiol. 2006. 16: 174–178. https://doi.org/10.1016/j.conb.2006.03.010
Dyakonova T.L., Sultanakhmetov G.S., Mezheritskiy M.I., Sakharov D.A., Dyakonova V.E. Storage and erausure of behavioral experiences at the single neuron level. Sci. Rep. 2019. 9: 14733. https://doi.org/10.1038/s41598-019-51331-5
Elsey J.W.B., Kindt M. Tackling maladaptive memories through reconsolidation: from neural to clinical science. Neurobiol. Learn. Mem. 2017. 142: 108–117. https://doi.org/10.1016/j.nlm.2017.03.007
Gainutdinova T.H., Tagirova R.R., Ismailova A.I., Muranova L.N., Samarova E.I., Gainutdinov K.L., Balaban P.M. Reconsolidation of a context long-term memory in the terrestrial snail requires protein synthesis. Learn. Mem. 2005. 12: 620–625.
Hemstedt T.J., Lattal K.M., Wood M.A. Reconsolidation and extinction: Using epigenetic signatures to challenge conventional wisdom. Neurobiol. Learn. Mem. 2017. 142: 55–65. https://doi.org/10.1016/j.nlm.2017.01.007
Hu J., Wang W., Homan P., Wang P., Zheng X., Schiller D. Reminder duration determines threat memory modification in humans. Sci. Rep. 2018. 8: 8848. https://doi.org/10.1038/s41598-018-27252-0
Huang B., Zhu H., Zhou Y., Liu X., Ma L. Unconditioned- and Conditioned-Stimuli Induce Differential Memory Reconsolidation and _-AR-Dependent CREB Activation. Front. Neural Circuits. 2017. 11: 53. https://doi.org/10.3389/fncir.2017.00053
Inda M.C., Muravieva E.V., Alberini C.M. Memory retrieval and the passage of time: from reconsolidation and strengthening to extinction, J. Neurosci. 2011. 31 (5): 1635–1643.
Kemenes G., Kemenes I., Michel M., Papp A., Mueller U. Phase-dependent molecular requirements for memory reconsolidation: differential roles for protein synthesis and protein kinase A activity. J. Neurosci. 2006. 26: 6298–6302.
Kukushkin N.V., Carew T.J. Memory takes time. Neuron. 2017. 95: 259–279.
Lattal K.M., Wood M.A. Epigenetics and persistent memory: implications for reconsolidation and silent extinction beyond the zero. Nature Neurosci. 2013. 16: 124–129. https://doi.org/10.1038/nn.3302
Lee J.L.C., Nader K., Schiller D. An update on memory reconsolidation updating. Trends in Cognitive Sciences. 2017. 1677: 1–15. https://doi.org/10.1016/j.tics.2017.04.006
Liu Y., Lin W., Liu C., Luo Y., Wu J., Bayley P.J., Qin S. Memory consolidation reconfigures neural pathways involved in the suppression of emotional memories. Nature Communications. 2016. 7: 13375. https://doi.org/10.1038/ncomms13375
Lukowiak K., Fras M., Smyth K., Wong C., Hittel K. Reconsolidation and memory infidelity in Lymnaea. Neurobiol. Learn. Memory. 2007. 87: 547–560.
McGaugh J.L. Memory: A century of consolidation. Science. 2000. 287: 248–251.
McGaugh J.L. Consolidating memory. Annu. Rev. Psychol. 2015. 66: 1-24.
McKenzie S., Eichenbaum H. Consolidation and reconsolidation: Two lives of memories? Neuron. 2011. 71 (2): 224–233. https://doi.org/10.1016/j.neuron.2011.06.037
Nadel L., Hupbach A., Gomez R., Newman-Smith K. Memory formation, consolidation and transformation. Neurosci. Biobehav. Rev. 2012. 36: 1640–1645.
Nader K., Schafe G.E., LeDoux J.E. Fear memories require protein synthesis in the amygdala for reconsolidation after retrieval. Nature. 2000. 406: 722–726.
Nader K., Hardt O. A single standard for memory: the case for reconsolidation. Nat. Rev. Neurosci. 2009. 10: 224–234.
Nikitin V.P., Solntseva S.V., Kozyrev S.A., Nikitin P.V., Shevelkin A.V. NMDA or 5-HT receptor antagonists impair memory reconsolidation and induce various types of amnesia. Behavioural Brain Res. 2018. 345: 72–82. https://doi.org/10.1016/j.bbr.2018.02.036
Nikitin V.P., Solntseva S.V., Kozyrev S.A., Nikitin P.V. Long-term memory consolidation or reconsolidation impairment induces amnesia with key characteristics that are similar to key learning characteristics. Neurosci. Biobehav. Rev. 2020. 108: 542–558. https://doi.org/10.1016/j.neubiorev.2019.12.005
Orlandi I.R., Fullio C.L., Schroeder M.N., Giurfa M., Ballarini F., Moncada D. Behavioral tagging underlies memory reconsolidation. Proc. Nat. Acad. Ssi. 2020. 117 (30): 18029–18036. https://doi.org/10.1073/pnas.2009517117
Pearce K., Cai D., Roberts A.C., Glanzman D.L. Role of protein synthesis and DNA methylation in the consolidation and maintenance of long-term memory in Aplysia. Elife. 2017. 6: e18299.
Rodriguez-Ortiz C.J., Bermúdez-Rattoni F. Determinants to trigger memory reconsolidation: The role of retrieval and updating information. Neurobiol. Learn. Mem. 2017. 142: 4–12. https://doi.org/10.1016/j.nlm.2016.12.005
Sara S.J. Retrieval and reconsolidation: toward a neurobiology of remembering. Learn. Mem. 2000. 7: 73–84.
Schmidt S.D., Furini C.R.G., Zinn C.G., Cavalcante L.E., Ferreira F.F., Behling J.A.K., Myskiw J.C., Izquierdo I. Modulation of the consolidation and reconsolidation of fear memory by three different serotonin receptors in hippocampus. Neurobiol. Learn. Mem. 2017. 142 (Pt A): 48–54. https://doi.org/10.1016/j.nlm.2016.12.017
Sorg B.A. Reconsolidation of drug memories. Neurosci. Biobehav. Rev. 2012. 36: 1400–17. Epub 2012 Feb 10.https://doi.org/10.1016/j.neubiorev.2012.02.004
Suzuki A., Josselyn S.A., Frankland P.W., Masushige S., Silva A.J., Kida S. Memory reconsolidation and extinction. Have distinct temporal and biochemical signatures. J. Neurosci. 2004. 24: 4787–4795.
Travaglia A., Steinmetz A.B., Miranda J.M., Alberini C.M. Mechanisms of critical period in the hippocampus underlie object location learning and memory in infant rats. Learn. Mem. 2018. 25: 176–182. https://doi.org/10.1101/lm.046946.117
Tronson N.C., Taylor J.R. Molecular mechanisms of memory reconsolidation. Nat. Rev. Neurosci. 2007. https://doi.org/10.1038/nrn2090
Wideman C.E., Jardine K.H., Winters B.D. Involvement of classical neurotransmitter systems in memory reconsolidation: Focus on destabilization. Neurobiol. Learn. Mem. 2018 156: 68–79. https://doi.org/10.1016/j.nlm.2018.11.001
Zhang J.J., Haubrich J., Bernabo M., Finnie P.S.B., Nader K. Limits on lability: boundaries of reconsolidation and the relationship to metaplasticity. Neurobiol. Learn. Mem. 2018. 154: 78–86. https://doi.org/10.1016/j.nlm.2018.02.018
Zuzina A.B., Vinarskaya A.Kh., Balaban P.M. Increase in serotonin precursor levels reinstates the context memory during reconsolidation. Invertebrate Neurosci. 2019. 19: 8. https://doi.org/10.1007/s10158-019-0227-9
Zuzina A.B., Vinarskaya A.Kh., Balaban P.M. Histone deacetylase inhibitors rescue the impaired memory in terrestrial snails. J. Compar. Physiol. A: Sensory, Neural, and Behavioral Physiology. 2020. 206 (4): 639–649.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


