Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 6, стр. 858-872
Влияние зеркальной иллюзии на сенсомоторные ритмы ЭЭГ при произвольном и непроизвольном движении пальцев руки
Н. В. Сыров 1, 2, *, А. Н. Васильев 1, 3, А. А. Соловьева 1, А. Я. Каплан 1, 2
1 Московский государственный университет имени М.В. Ломоносова
Москва, Россия
2 Балтийский федеральный университет имени И. Канта
Калининград, Россия
3 МЭГ-центр, Московский психолого-педагогический университет
Москва, Россия
* E-mail: kolascoco@gmail.com
Поступила в редакцию 05.04.2021
После доработки 16.04.2021
Принята к публикации 26.04.2021
Аннотация
Выполнено исследование ритмических паттернов сенсомоторной ЭЭГ активности у 25 испытуемых в эксперименте с зеркальной иллюзией движения. В ходе эксперимента испытуемые выполняли произвольные сжатия кисти правой руки и в момент движения наблюдали перед собой покоящуюся левую руку или зеркальное отражение движущейся правой руки. В условиях с непроизвольными движениями сжатие запускалось посредством функциональной нервно-мышечной электрической стимуляции (ФЭС). ЭЭГ-сигнал испытуемых был подвергнут пространственной фильтрации с выделением компонентов, содержащих чувствительную к движению активность: связанную с событием десинхронизацию (ССД)/синхронизацию (ССС) в частотных диапазонах, соответствующих мю- и бета-ритмам ЭЭГ. Анализ частотных характеристик выделенных пространственных источников показал, что ССД в бета-диапазоне возникает в более высоких частотах, чем ССС. Локализация источников также различалась: источники бета-ССС располагались в ростро-медиальном направлении относительно источников бета-ССД, которые, в свою очередь, имели почти идентичную c “мю-ритмами” центрально-теменную локализацию. Фактор зеркальной иллюзии не оказывал влияния на амплитуду и пространственно-временные характеристики сенсомоторной ЭЭГ-активности, регистрируемой во время совершения движения, но статистически значимо проявлялся в уменьшении отставленной бета-ССС. Таким образом, развитие зеркальной иллюзии привело к уменьшению мощности бета-синхронизации как при активных, так и при вызванных ФЭС движениях, но не оказало влияния на амплитуду мю-/бета-ССД. Полученные результаты свидетельствуют о потенциальной применимости отсроченной бета-ССС в качестве ЭЭГ-маркера развития зеркальной иллюзии при проведении зеркальной терапии, в том числе в рамках комплексных методик постинсультной реабилитации, включающих зеркальную терапию и ФЭС.
ВВЕДЕНИЕ
Десинхронизация электроэнцефалографической активности в центральных отведениях, проявляющаяся в виде снижения амплитуды в частотных диапазонах 7–13 и 15–50 Гц (Pfùrtscheller, LopesdaSilva, 1999), традиционно является маркером активации сенсомоторных областей коры. Данная ЭЭГ-реакция проявляется в ответ на выполнение субъектом движений, на тактильную стимуляцию, а также возникает при планировании и представлении движений (при их мысленном воспроизведении) (Neuper et al., 2006; Jarmolowska, Miladinovi, 2020). Особенностью реакции десинхронизации является ее соматотопическая специфичность: за 1.5–2 с до начала движения десинхронизация появляется в контралатеральном полушарии и во время движения развивается билатерально с контралатеральным преобладанием (Neuper et al., 2006).
Десинхронизацию сенсомоторных ритмов ЭЭГ принято считать отражением работы системы зеркальных нейронов – совокупности ассоциативных связей, обеспечивающих активацию моторных областей коры при наблюдении за чужими движениями (Bowman et al., 2017). Так, существует большое число работ, демонстрирующих стойкую альфа-ССД при наблюдении движений (Chaisaen et al., 2020), локализация и амплитудно-частотные характеристики которой идентичны таковым при выполнении испытуемыми реальных движений. Этот феномен – активация коры при наблюдении за движениями – лежит в основе целого ряда методов постинсультной реабилитации (Mancuso et al., 2021). Предполагается, что активация тех же нейрональных контуров лежит в основе эффекта зеркальной иллюзии движения. Зеркальная иллюзия движения – феномен, который лежит в основе терапии фантомных болей (Ramachandran et al., 1996) и методики восстановления подвижности парализованной после инсульта конечности (Altschuler et al., 1999). Сам феномен заключается в том, что у пациента при совершении движений здоровой конечностью и наблюдении их зеркального отражения на месте второй, парализованной конечности, возникает иллюзия совершения бимануального движения. Исследователи данного феномена наблюдают изменения активности ипсилатерального к активной конечности полушария при наблюдении отраженного движения, что проявляется в виде развивающейся мю-/бета-десинхронизации в ЭЭГ (Lee et al., 2015) и МЭГ (Rossiter et al., 2015) исследованиях.
Помимо альфа/бета-десинхронизации существует ЭЭГ-феномен, регистрируемый после окончания движения, – так называемая бета-синхронизация, или бета-отскок – восстановление и превышение над исходным уровнем амплитуды волновой активности в бета-диапазоне частот (Neuper et al., 2006; Cardellicchio et al., 2020). Предполагается, что его возникновение определяется развитием активного торможения первичной моторной коры при завершении движения (Pfùrtscheller et al., 1996). Также, по-видимому, развитие бета-CCC связано с ингибирующим воздействием соматосенсорной коры на М1, которое развивается при получении тактильной и проприоцептивной афферентации при движении (Houdayer et al., 2006; Vinding et al., 2019). Во многих работах авторы рассматривают синхронизирующийся компонент бета-ритмики как восстановление десинхронизированной при движении активности (Müller-Putz et al., 2007). Таким образом, два этих компонента сенсомоторного ЭЭГ-паттерна (десинхронизация и последующая синхронизация) традиционно считаются отражением последовательных процессов, протекающих при планировании, реализации и окончании движения.
Однако именно глубина десинхронизации является основным критерием оценки активации сенсомоторных областей коры при разработке и проверке эффективности методик постинсультной реабилитации (Shahid et al., 2010).
В то же время результаты ТМС-исследований показывают, что величина регистрируемой в ЭЭГ испытуемых ССД не коррелирует с уровнем кортикоспинальной возбудимости, и даже при слабой десинхронизации при представлении движений амплитуда вызванных ТМС мышечных ответов может значительно увеличиваться (Vasilyev et al., 2017). Следовательно, такой показатель, как амплитуда ССД, не может напрямую отражать изменения активности первичной моторной коры.
Несмотря на большое количество работ, демонстрирующих развитие ССД при наблюдении движений (Chaisaen et al., 2020; Mancuso et al., 2021), в настоящее время нет однозначных данных о развитии мю-/бета-десинхронизации в экспериментах с зеркальной иллюзией (Rossiter et al., 2015; Lee et al., 2015; Fong et al., 2019), и неизвестно, может ли амплитуда ССД отражать яркость зеркальной иллюзии и являться показателем влияния иллюзии на активность сенсомоторных областей коры. В литературе также отсутствует информация о влиянии зеркальной иллюзии движения на динамику бета-синхронизации, несмотря на существующие свидетельства того, что этот компонент является независимой от бета-ССД активностью и может быть чувствителен к наблюдению за движениями (Hashimoto, Ushiba, 2013; Orset et al., 2020).
В настоящей работе была проведена оценка ритмической ЭЭГ-активности при создании зеркальной иллюзии движения левой руки, рассмотрено влияние зеркальной обратной связи на оба компонента сенсомоторной реакции: ССД при движении и ССС после движения. Особое внимание в работе было уделено компоненту бета-синхронизации, связанному с возбудимостью первичной моторной коры и чувствительному к наблюдению движений.
МЕТОДИКА
Испытуемые. В исследовании приняли участие 25 здоровых добровольцев (11 женщин) в возрасте 18–40 лет с доминантной правой рукой (согласно результатам самоотчета). Все испытуемые дали письменное информированное согласие на участие в исследовании. Протокол исследования был одобрен Комиссией по биоэтике биологического факультета МГУ имени М.В. Ломоносова.
Регистрация ЭЭГ. Регистрация ЭЭГ осуществлялась при помощи электроэнцефалографа NVX-52 (МКС, Зеленоград, Россия) и 30 точечных Ag+/AgCl электродов (MCSCAP-E) в позициях на скальпе, соответствующих неполному набору международной системы “10-10”: F3, F4, FC5, FC3, FC1, FCz, FC2, FC4, FC6, C5, C3, C1, Cz, C2, C4, C6, CP5, CP3, CP1, CPZ, CP2, CP4, CP6, P5, P3, P1, PZ, P2, P4, P6. В качестве референта использовался электрод в позиции Тр10. Контактное сопротивление для всех электродов не превышало 10 кОм. Частота дискретизации составляла 500 Гц, при полосе пропускания от 0 до 200 Гц (по уровню -3dB). Применялся встроенный в усилитель режекторный (notch) фильтр 50 Гц для подавления помехи электросети.
Функциональная электростимуляция. Для моделирования пассивного движения пальцев кисти (сгибания) применялась функциональная электрическая нервно-мышечная стимуляция (ФЭС). ФЭС осуществлялась с помощью блока токового стимулятора из состава комплекса “Нейро-МВП-4” (Нейрософт, Иваново, Россия) и двух одноразовых токовых электродов: один устанавливался в области сухожилий запястья, второй – выше и медиальнее по предплечью, в области брюшка m. flexor digitorum superficialis (FDS). Параметры стимуляции подбирались таким образом, чтобы вызвать сжатие пальцев кисти, по амплитуде движения и скорости максимально приближенное к естественному. Как правило, частота и амплитуда стимуляции составляли соответственно 45–60 Гц, 30–65 мА, а длительность – 1 с.
Для точной регистрации моментов начала движений (мышечных сокращений) с поверхности кожи предплечья регистрировалась электромиограмма (ЭМГ) посредством биполярных электродов, установленных дистально – на внутренней стороне запястья – и проксимально – в месте пальпации брюшка FDS. Заземляющий электрод устанавливался в области той же мышцы левой руки.
Структура исследования. Во время экспериментальной сессии испытуемый располагался за столом, расположив обе руки на его поверхности так, чтобы предплечье полностью находилось на плоскости и руки были расслаблены. За кистью левой руки испытуемого находился экран монитора на расстоянии 50 см от глаз, на котором в ходе эксперимента предъявлялись инструкции. Голова испытуемого была развернута влево на 30 градусов так, чтобы он мог видеть инструкции на экране перед собой, при этом в поле его зрения попадала левая рука. Правая рука испытуемого была видна лишь периферическим зрением. Для исключения правой руки из поля зрения на голове испытуемого с правой стороны закреплялась перегородка, закрывающая лишь часть периферического поля. Перегородка не влияла на область активного зрительного внимания и была необходима для исключения эффектов, вызванных наблюдением движений правой руки. Положение и угол поворота перегородки сохранялись в течение всего эксперимента, таким образом, все экспериментальные условия не отличались по данному фактору.
Эксперимент включал в себя два условия: в первом условии испытуемому было необходимо совершать сжатие кисти правой руки (произвольное сжатие), во втором кисть испытуемого сжималась под действием функциональной электростимуляции. Каждое из условий эксперимента включало два режима, отличающихся наличием/отсутствием зеркала. Зеркало располагалось на столе между правой и левой руками испытуемого таким образом, чтобы в его отражении испытуемые могли видеть совершаемое ими сжатие правой руки. Так, в ходе эксперимента в поле зрения испытуемого находилась либо неподвижная левая рука (правая рука была скрыта), либо отраженное движение правой руки на месте левой (левая рука была скрыта за зеркалом).
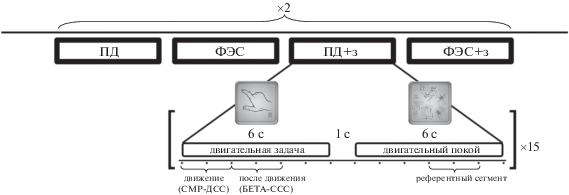
Экспериментальная сессия состояла из 8 независимых блоков (по два на каждое из основных условий), в ходе которых испытуемый с короткими паузами непрерывно выполнял последовательность задач в ответ на команды, предъявляемые на экране монитора. Команды к совершению движения чередовались в случайном порядке с командами, обозначающими двигательный покой. Последние представляли собой абстрактное изображение, содержащее большое число элементов (“зрительная сцена”). При появлении изображения испытуемым необходимо было заниматься подсчетом его элементов, не совершая движений руками. Каждый экспериментальный блок включал в себя 30 таких стимулов-команд (15 команд с движением и 15 команд “зрительная сцена”), длительность нахождения на экране монитора стимула-команды составляла 6 с, межстимульный интервал – 1 с, последовательность предъявления псевдослучайная (см. рис. 1). Предъявление стимулов, запуск электростимуляции и ведение записей осуществлялись с помощью программы BCI2000.
Рис. 1.
Схема эксперимента с демонстрацией отрезков записей ЭЭГ, использованных в анализе. ПД – условие с совершением произвольного движения, ФЭС – условие, когда движение вызывалось функциональной электростимуляцией, ПД+з – произвольное движение отражалось в зеркале. Референтный сегмент – отрезок ЭЭГ-записи во время состояния двигательного покоя, используемый для расчета ССД и ССС, СМР-ДСС – десинхронизация сенсомоторных ритмов (альфа/бета).
Fig. 1. Experimental design with demonstration of the EEG segments used in the analysis. “ПД” – condition with voluntary movement, “ФЭС” – condition, when movement was triggered by functional electro-stimulation, “ПД+з” – voluntary movement was reflected in the mirror. “Референтный сегмент” – a segment of an EEG recorded during a motor rest condition, used to calculate ERD and ERS, “СМР-ДСС” – desynchronization of sensorimotor rhythms (alpha/beta).
Анализ данных. Определение начала сокращений (произвольных или вызванных ФЭС) проводилось по ЭМГ-сигналу, подвергнутому среднеквадратичному преобразованию (RMS). Моментом начала движения считалась точка резкого возрастания сигнала, следующая за стимулом-командой. Попытка отклонялась, если максимальная амплитуда отфильтрованного RMS-преобразованного сигнала при сокращении не превышала предстимульные значения в 100–300 раз (таким образом удалялись попытки, где испытуемые случайно могли не выполнить сжатие). Напротив, попытки в условии “двигательный покой” отклонялись, если в них детектировалось какое-либо движение.
Обработка ЭЭГ проводилась по алгоритму со следующими этапами:
Предобработка и фильтрация
1) Выполнялась фильтрация zero-phase FIR-фильтром в диапазоне 0.5–40 Гц (расчет оптимального порядка и коэффициентов фильтра определялся по процедуре Паркса-Макклеллана со следующими целевыми показателями: ширина переходных зон 0.8 Гц, допустимая неравномерность в зоне пропускания – 0.002 дБ и зонах подавления 0.02 дБ).
2) Выделялись эпохи сигнала в диапазоне от –0.5 до 6 c относительно инициации движения (для условий с движением) или относительно момента предъявления стимула (для “зрительной сцены”).
3) Для каждой эпохи вычислялась ковариационная матрица (попарная ковариация для 30 отведений ЭЭГ-сигнала).
4) Вычислялось евклидово расстояние ковариационных матриц отдельных попыток и усредненной ковариационной матрицы. Расстояния стандартизовались. Попытки на расстоянии более 2 стандартных отклонений от среднего исключались из анализа (в среднем, 35% от всех попыток) (Krauledat et al., 2007).
Пространственная фильтрация
5) Вычислялась средняя ковариационная матрица попыток c экспериментальными условиями с движением (Cactive) и при двигательном покое (задача “зрительная сцена” – Cpassive).
6) Рассчитывались обобщенные собственные векторы для ковариационных матриц так, что
(1)
$\Lambda = \arg \max \left\{ {\frac{{{{W}^{T}}{{C}_{{{\text{active}}}}}W}}{{{{W}^{T}}{{C}_{{{\text{passive}}}}}W}}} \right\}$К данным применялись полученные таким образом пространственные фильтры (столбцы матриц W), которые являлись проекциями статистических источников десинхронизации или синхронизации. В качестве источников десинхронизации/синхронизации рассматривались соответственно первые/последние пять фильтров с минимальными/максимальными отношениями $\frac{{{{C}_{{{\text{active}}}}}}}{{{{C}_{{{\text{passive}}}}}}}$, указывающие на пространственные проекции с наибольшими различиями в дисперсии между изучаемым и контрольным состоянием (“зрительная сцена”) (Muralidharan et al., 2019). Однако не все отобранные здесь фильтры применялись к данным, часть из них исключалась из рассмотрения (см. пункт 13).
7) Матрица А ≈ W–T ≈ WT${{C}_{{{\text{active}}}}}$ являлась аппроксимацией прямой модели источников и использовалась для идентификации локализации источника.
Анализ в частотном домене
8) Проводилось вейвлет-преобразование эпох. Применялся сет комплексных вейвлетов Морле с вариабельным числом циклов для разных частот (вычислялось геометрическое среднее, по схеме, предложенной в (Moca et al., 2021).
9) Значения time-frequency матрицы для усредненной эпохи каждого изучаемого состояния нормализовались (делением) на медианное значение такой же матрицы для попыток в состоянии двигательного покоя (“зрительная сцена”) в диапазоне 3–5 с, после чего проводилась конверсия значений в децибелы логарифмированием. Положительные значения интерпретировались как синхронизация (ССС), а отрицательные – как десинхронизация (ССД) относительно состояния “зрительная сцена”.
10) Визуализировался усредненный time-frequency график для попыток каждого человека. По нему вручную отбирались уточненные индивидуальные целевые диапазоны для изучаемых частот (выбирались диапазоны частот, где при совершении движения наблюдалось изменение спектральной мощности относительно состояния покоя):
i. Mu-ССД (μD) – поддиапазон из диапазона 6–15 Гц, первые 5 источников (фильтров), в первые 2–3 с после инициации движения;
ii. Бета-ССД (βD) – поддиапазон из диапазона 15–35 Гц, первые 5 источников, в первые 2–3 с после инициации движения;
iii. Alpha-ССС – поддиапазон из диапазона 6–15 Гц, последние 5 источников, в первые 2–3 с после инициации движения;
iv. Бета-ССС (βS) – поддиапазон из диапазона 10–25 Гц, последние 5 источников, через 3–5 с после инициации движения. Временной диапазон также уточнялся вручную, с шагом 0.25 с и длительностью 2 с, таким образом, чтобы эпизод синхронизации захватывался полностью, а в тех случаях, когда эпизод был короче двух секунд, он захватывался интервалом симметрично относительно своих границ.
11) Повторялись шаги 5–10 для данных, отфильтрованных в четырех отобранных в п.10 диапазонов.
12) На основе визуальной инспекции прямых моделей (первых пяти для ССД или последних пяти для ССС) столбцов матрицы A из п. 7) размечались три типа источников:
i. Без выраженной сенсомоторной топографии: с максимумами на краевых ЭЭГ-сенсорах (с индексами 5 и 6, на левой и правой половине скальпа соответственно) или с центром тяжести, смещенным на P-ряд. Такие источники исключались из дальнейшего рассмотрения (15–32% из отобранных 10 источников для каждого из испытуемых);
ii. Максимальный по амплитуде ССД/ССС источник с контралатеральной топографией;
iii. Максимальный по амплитуде ССД/ССС источник с ипсилатеральной топографией.
13) Для дальнейшего статистического анализа значения усреднялись в рамках выделенных временных и/или частотных диапазонов для отобранных источников.
14) Статистический анализ проводился при помощи парного критерия Вилкоксона, р-значения были скорректированы на множественные сравнения поправкой Бонферрони (не проводилось прямых сравнений между условиями с произвольными движениями и ФЭС, так как ФЭС имеет дополнительный тактильный компонент и прямое сравнение этих условий в рамках анализа изменений сенсомоторных ритмов при зеркальной иллюзии некорректно).
В результате стадий обработки 5–10 определялись высокоселективные пространственные проекции с реакциями десинхронизации или синхронизации, наблюдаемые в изучаемых активных состояниях по сравнению со “зрительной сценой”. Таким образом, состояние “двигательный покой” служило контрастирующим условием (localizer task), позволяющим идентифицировать общие для изучаемых активных условий пространственные координаты реакций (де-)синхронизации, одновременно понижая пространственную размерность сигнала. Выделяемые пространственные фильтры с максимальной амплитудой реакции (первые/последние пять) служили репрезентативным подпространством многомерного сигнала. Для его топографической визуализации коэффициенты прямой модели этих фильтров (столбцы матрицы А в п. 7, за вычетом исключенных в п. 12i) брались по модулю, нормировались на единичную сумму коэффициентов всех каналов и взвешивались в соответствии с амплитудой изучаемой реакции (ССД/ССС).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В табл. 1 сведены значения индивидуальных диапазонов частот, используемых для построения высокоселективных фильтров, а затем – для выделения соответствующих для этих диапазонов значений. Таблица демонстрирует межиндивидуальную вариабельность реактивных частотных диапазонов. В то же время можно заметить, что для всех испытуемых бета-ССС, по сравнению с бета-ССД, имеет более низкий по частоте диапазон колебаний.
Таблица 1.
Реактивные частотные диапазоны, задействованные в связанных с движением реакциях синхронизации и десинхронизации. Все значения в герцах (Гц)
| Мю-ССД (смр) | Бета-ССД (смр) | Альфа-ССС (зрит) | Бета-ССС (смр) | |||||
|---|---|---|---|---|---|---|---|---|
| Код испыт. | нижн. ч. | верх. ч. | нижн. ч. | верх. ч. | нижн. ч. | верх. ч. | нижн. ч. | верх. ч. |
| ais | 11 | 15 | 24 | 28 | 7.5 | 17 | 15 | 26 |
| bau | 7.5 | 15 | 22.5 | 30 | 7.5 | 15 | 15 | 25 |
| bdo | 8 | 14 | 20 | 25 | 7.5 | 17.5 | 14 | 21 |
| bvr | 10 | 15 | 22.5 | 26 | 6 | 15 | 15.5 | 22 |
| cda | 10 | 16 | 22.5 | 27.5 | 7.5 | 22.5 | 16 | 24.5 |
| dyv | 9 | 15 | 21 | 27 | 5 | 15 | 14 | 22 |
| eea | 9.5 | 13.5 | 20 | 25 | 6 | 17.5 | 15 | 22.5 |
| hpo | 10 | 14.5 | 21 | 26 | 7.5 | 20 | 15 | 24 |
| kaa | 7.5 | 15 | 17.5 | 25 | 7.5 | 20 | 13 | 19 |
| kao | 8.5 | 13.5 | 20 | 25 | 10 | 20 | 14 | 20 |
| kav | 9 | 14 | 18 | 25 | 7.5 | 15 | 14.5 | 22 |
| kia | 10 | 15 | 20 | 27.5 | 6 | 12.5 | 16 | 22.5 |
| koe | 8.5 | 14.5 | 20 | 25 | 10 | 22.5 | 15 | 21 |
| lma | 9 | 13.5 | 27.5 | 30 | 7.5 | 22.5 | 13 | 25 |
| mae | 8.5 | 15 | 20 | 26.5 | 7.5 | 20 | 15 | 22.5 |
| mav | 8 | 13 | 18 | 23 | 7.5 | 18 | 13 | 18.5 |
| odd | 10.5 | 15 | 24 | 28 | 10 | 15 | 16 | 25 |
| rdr | 9 | 14 | 20 | 25 | 10 | 16 | 14 | 20.5 |
| sai | 9 | 13 | 21 | 27.5 | 6 | 12 | 13 | 22.5 |
| sda | 9 | 14 | 21.5 | 27 | 7.5 | 16 | 15 | 23 |
| snv | 9 | 15 | 20 | 25 | 5 | 10 | 15 | 23 |
| ssk | 10 | 15.5 | 22 | 27.5 | 7.5 | 15 | 15 | 27 |
| sya | 9 | 14 | 20 | 25 | 7.5 | 16 | 14 | 21 |
| van | 9 | 14 | 20 | 26 | 7.5 | 13.5 | 15 | 22 |
| zvv | 8 | 13.5 | 17.5 | 24 | 8 | 16 | 12 | 19 |
| среднее | 9.10 | 14.4 | 20.8 | 26.3 | 7.50 | 16.8 | 14.5 | 22.4 |
| Стд. откл. | 0.91 | 0.79 | 2.24 | 1.73 | 1.40 | 3.30 | 1.06 | 2.20 |
| Диапазон частот, ср ± ст. откл. | 5.3 ± 0.95 | 5.4 ± 1.25 | 9.3 ± 2.92 | 7.9 ± 1.82 | ||||
На рис. 2 (а) представлен пример испытуемого mav, для которого бета-синхронизация была хорошо видна в источниках, выделенных по интервалам десинхронизации. Можно увидеть, что бета-ССС появляется уже после движения: по миографическому сигналу на рис. 2 (а) видно, что произвольное движение завершается к 2 с эпохи, следом за ним затухает бета-десинхронизация, и затем через 1 с в более низкочастотном диапазоне развивается бета-ССС.
Рис. 2.
Изменение спектральной мощности реактивной сенсомоторной ЭЭГ-активности. (а) – пример динамики мощности спектра относительно начала произвольного движения у испытуемого mav. Изображен источник с максимальной десинхронизацией в мю-диапазоне, серая кривая на графике отражает усредненные значения RMS-преобразования ЭМГ-сигнала. Пунктиром выделены наиболее реактивные частотно-временные регионы, взятые для анализа. Периодограммы под графиком соответствуют средним значениям по интервалам [0–2]с и [3–5]c для активных состояний и [3–5]c для “зрительной сцены”. В правом верхнем углу изображена прямая модель источника. реф/реф+з – референтный сегмент задачи на внимание из условия без зеркала/с зеркалом соответственно. (б) – средние значения (n = 25) амплитуд десинхронизации при движении и синхронизации после прекращения движения в частотах бета-диапазона для условия произвольного сжатия руки без зеркала.
Fig. 2. Changes in the spectral power of reactive sensorimotor EEG patterns. (а) – an example of the dynamics of the spectral power of the subject “mav” during voluntary movement. Activity corresponds to the source with maximum mu-desynchronization, the gray curve on the graph reflects the averaged values of the RMS conversion of the EMG. The dotted line marks the most reactive time-frequency regions taken for analysis. Periodograms under the graph correspond to the average values for the intervals [0–2] s and [3–5] s for active states and [3–5] s for the “visual scene”. The direct model of the source is shown in the upper right corner. “реф”/ “реф+з” – a reference segment of an EEG recorded during a motor rest from the condition without / with a mirror, respectively. (б) – Average values (n = 25) of desynchronization and synchronization amplitudes in the beta-band frequencies for the condition with voluntary hand movements without a mirror.
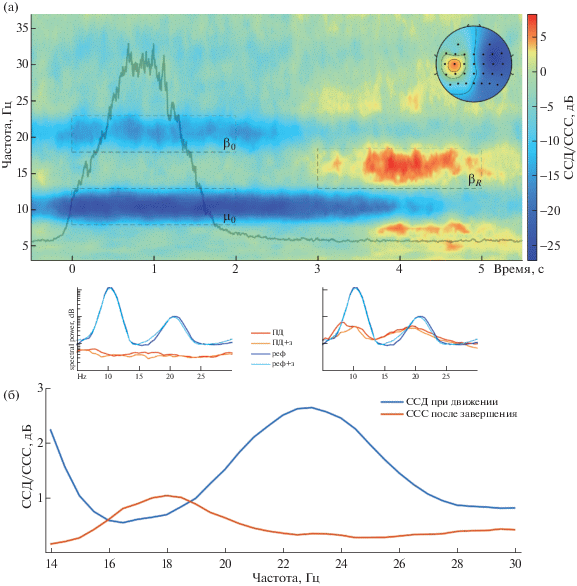
Для статистической оценки различий в частотных диапазонах бета-десинхронизации и синхронизации после окончания движения была проведена следующая процедура: у каждого испытуемого были рассмотрены значения CCД/ССС (в дБ, по модулю) в расширенном бета-диапазоне 14–30 Гц в двух временных интервалах: ССД в интервале 0–2 с от начала движения, ССС в двухсекундном интервале, следующем за остановкой движения. Далее, для значений амплитуд вычислялась взаимокорреляционная функция – коэффициенты корреляции рядов значений ССД и ССС для частот из диапазона 14–30 Гц, для каждого из сдвигов этих рядов, кратного дискретизации частот (0.5 Гц). В том случае, если бы ССС после окончания движения происходила в том же частотном поддиапазоне, что и ССД при движении, то максимальное значение взаимокорреляционной функции приходилось бы на сдвиг в 0 Гц (нулевая гипотеза). Для условия произвольного сжатия руки без зеркала максимум взаимокорреляционной функции в среднем приходился на сдвиг в 4.96 Гц, что на групповом уровне (n = 24, у одного испытуемого не было синхронизации) статистически значимо отличалось от нуля (t-тест, p = 1.65 × 10–12); средние значения для ССД/ССС представлены на рис. 2 (б). Для других экспериментальных условий закономерность и статистическая значимость были аналогичны. Таким образом, было показано, что десинхронизация при движении и синхронизация после его завершения возникают в статистически достоверно различающихся диапазонах частот.
Выделенные источники мю- и бета-десинхронизации латерализованы (электроды C3, CP3, см. рис. 3 (а)) и совпадают по своим топографическим координатам. В то время как источники бета-синхронизации расположены более фронтально, они имеют больший охват и менее латерализованы. Важно отметить высокую согласованность паттернов между разными экспериментальными условиями, что говорит об активации общих нейросетей при пассивном и произвольном движениях.
Рис. 3.
Усредненные (n = 25) источники синхронизации и десинхронизации для экспериментальных условий (а) и усредненные (n = 25) спектры для источников в исследуемых условиях (б). Для ССД взят интервал 0–2 c, для синхронизации – индивидуальный (около 3–5 c).
Fig. 3. Averaged (n = 25) sources of synchronization and desynchronization for experimental conditions (а) and averaged (n = 25) spectra for these sources (б). The interval 0–2 s was taken for the ERD, the individual interval was taken for ERS (about 3–5 s).
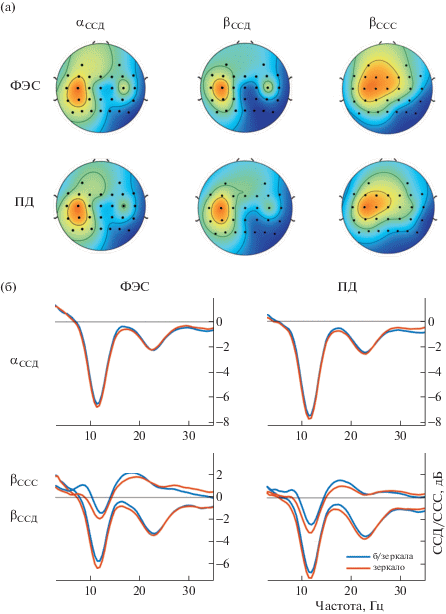
На рис. 3 (б) приведены усредненные периодограммы для выделенных источников синхронизации и десинхронизации. Можно видеть, что средние значения амплитуды альфа- и бета-десинхронизации похожи во всех условиях, однако стоит отметить, что эти графики не учитывают индивидуальных частотных диапазонов. Интересным является то, что для выделенных источников бета-синхронизации не наблюдается снижения амплитуды активности в бета-диапазоне, что указывает на существование двух функционально различных компонентов сенсомоторной активности: один из них реагирует только после окончания движения (синхронизацией), а для другого характерны развитие десинхронизации при выполнении движения и постепенное восстановление после его окончания.
На рис. 4 представлены выборочные характеристики исследуемых процессов и приведены результаты статистического анализа. Так, для реакций десинхронизации в альфа- и бета-диапазонах частот не было обнаружено значимых изменений при формировании зеркальной иллюзии движения. В то же время уменьшение бета-синхронизации, вызванное наблюдением зеркальной обратной связи, оказалось значимым (p < 0.05) для всех состояний как в ипси-, так и в контралатеральных источниках.
Рис. 4.
Различия альфа (а) и бета (б) десинхронизации и бета-синхронизации (в) в условиях эксперимента при наличии или отсутствии зеркальной обратной связи. Данные представлены для контра- и ипсилатерального по отношению к активной конечности полушария. * – p < 0.05 (парный критерий Вилкоксона, р-значения скорректированы поправкой Бонферрони).
Fig. 4. Differences between alpha (a) and beta (б) desynchronization and beta synchronization (в) under experimental conditions with or without mirror feedback. Data are presented for the contra- and ipsilateral hemispheres. * – p < 0.05 (paired Wilcoxon test, p-values are corrected by the Bonferroni correction).
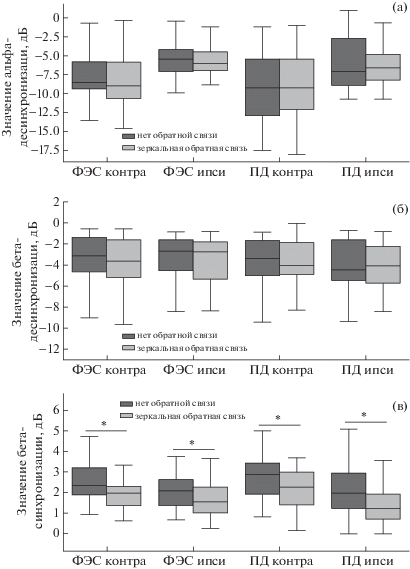
Таким образом, наблюдение движения в рамках зеркальной иллюзии не влияло значимо на десинхронизацию сенсомоторной ЭЭГ-активности ни в одном из исследованных диапазонов. Анализ бета-синхронизации после движения выявил значимое снижение мощности ЭЭГ-активности в данном диапазоне в условиях с зеркалом. Эти различия проявились в обоих полушариях как при произвольных, так и при вызванных ФЭС движениях.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Источники (де-)синхронизации
При реализации движения, как произвольного, так и вызванного ФЭС, было обнаружено развитие десинхронизации в альфа- и бета-диапазонах, источники которой были локализованы в центральных ЭЭГ-отведениях (преимущественно с контралатеральной стороны) и имели хорошо выраженную латерализацию. Этот результат согласуется с работами других исследователей (Neuper et al., 2006; Болдырева и др., 2014; Либуркина и др., 2017). Также было отмечено, что в первую секунду после окончания движения развивается стойкая бета-синхронизация, обозначаемая некоторыми авторами как “бета-отскок” (англ. “beta-rebound”) (Parkes et al., 2006). Такое повышение мощности в бета-диапазоне развивалось уже после завершения мышечной активности и расслабления, о чем свидетельствуют миографические данные (рис. 2 (а)), и поддерживалось выше уровня покоя на протяжении 1–2 с. Во многих работах “бета-отскок” описывается как продолжение бета-десинхронизации, развивающейся при движении (Müller-Putz et al., 2007; Torrecillos et al., 2015; Vinding et al., 2018), и предполагается, что и ССД и ССС – изменения, отражающие последовательные события интеграции афферентных и эфферентных сигналов (Vinding et al., 2018). Тем не менее в ряде исследований (Müller-Putz et al., 2007; Hashimoto, Ushiba, 2013), как и в настоящей работе, было отмечено, что бета-синхронизация после движения происходит в более низком частотном диапазоне, чем бета-ССД (18–22 и 24–28 Гц соответственно (Hashimoto, Ushiba, 2013)). Это говорит об активации при этих событиях разных нейронных популяций. В данной работе показано, что при помощи линейных преобразований можно выделить компонент ритмической активности, связанный с синхронизацией, который не имеет фазы десинхронизации, и компонент, связанный с десинхронизацией, с характерным медленным возвратом амплитуд мю- и бета-колебаний к уровням моторного покоя после окончания движения. Паттерны синхронизации регистрируются, так же как и ССД, в центральных ЭЭГ-отведениях, билатерально с преобладанием в контралатеральной к активной конечности области. Однако источники бета-ССС сдвинуты в ростральном направлении и к центру (см. рис. 3, где показана локализация коэффициентов прямых моделей отобранных пространственных фильтров), что согласуется с (Jurkiewicz et al., 2006), где авторы заключают, что, по-видимому, бета-синхронизация отражает активность нейронов прецентральной извилины, анатомического центра моторной коры.
Многими авторами предполагалось, что бета-ССС тесно связана с кожно-мышечной афферентацией и воздействием соматосенсорной коры на первичную моторную (Houdayer et al., 2006). Эта гипотеза поддерживается работами, где бета-отскок возникал при пассивных движениях, при тактильной стимуляции, а также появлялся при совершении долгих движений еще до окончания моторного акта (Cassim et al., 2000; Pakenham et al., 2019). Наконец, было показано, что этот бета-ССС исчезает после деафферентации при развитии ишемии чувствительного нерва (Cassim et al., 2001).
Однако появление бета-ССС не определяется исключительно сенсорными потоками, и в (Salmelin et al., 1995) показано, что данный тип активности связан с торможением заранее запланированных моторных актов (дезактивация двигательных контуров).
В настоящей работе наблюдались идентичные паттерны бета-синхронизации как при произвольных, так и при вызванных ФЭС. В последнем случае движения были непроизвольными, соответственно, наблюдаемая бета-ССС здесь не может быть связана с развитием активного торможения моторной коры при произвольной остановке движения (что, как предполагают авторы (Salmelin et al., 1995), необходимо для предотвращения лишнего движения).
Произвольное и непроизвольное движение тесно ассоциировано с проприоцептивной и тактильной чувствительностью, более того, ФЭС имеет значительный тактильный компонент, связанный с высокочастотным воздействием электрического тока. Таким образом, результаты настоящей работы говорят скорее в пользу гипотезы о сенсомоторном ингибировании М1 как о причине возникновения бета-ССС.
Отсутствие влияния на десинхронизацию
В настоящей работе не было обнаружено влияния зеркальной обратной связи на глубину десинхронизации в альфа- и бета-диапазонах. Эффект зеркальной обратной связи в виде увеличения десинхронизации сенсомоторных ритмов в ипсилатеральных отведениях, по мнению авторов (Rossiter et al., 2015), проявляется в виде снятия избыточного ингибирования пораженного полушария со стороны здорового – контралатерального. Такое нарушение баланса активации/торможения в межполушарных связях – одно из последствий инсульта и один из факторов, затрудняющих восстановление подвижности (Duque et al., 2005). У здоровых людей межполушарные взаимодействия менее чувствительны к наблюдению отраженного движения и, как предполагают авторы (Rossiter et al., 2015), это может быть причиной отсутствия эффектов зеркальной обратной связи у здоровых участников исследования.
Альфа-десинхронизация – реакция, связанная с активацией сенсомоторных отделов коры, и эти области коры могут быть нечувствительны к наблюдению отраженного движения. В ряде работ сообщается о чувствительности мю-ритма к наблюдению прикосновений (Pomper et al., 2013), а авторы исследования (Coll et al., 2015) показали, что развитие мю-десинхронизации при наблюдении движений связано именно с мысленным воспроизведением связанной с движением афферентации, и в данном контексте такая реакция ССД кажется более логичной.
В то же время полученный в настоящем исследовании результат не согласуется с результатами работы (Lee et al., 2015), где авторы докладывают о росте мю-/бета-десинхронизации при наблюдении зеркальной обратной связи, однако их результат мог быть связан с влиянием затылочной альфа-активности, десинхронизирующейся при увеличении концентрации внимания в момент наблюдения отраженного движения (такой эффект наблюдался в настоящей работе на этапе первичной обработки данных). Применение пространственной фильтрации позволило отделить источники реактивных ритмов, локализованные в центральных отведениях, и амплитуда десинхронизации активности этих источников не изменялась при наблюдении зеркальной обратной связи.
Уменьшение бета-синхронизации
Бета-ССС возникает после совершения движения (Pfùrtscheller et al., 1996) и отражает торможение моторных областей коры после движения. Также бета-ССС связана с ингибированием М1 при активации кожно-мышечных рецепторов. Таким образом, существуют две причины появления бета-ССС после движения, и если во втором случае – это влияние соматосенсорной коры, то в первом, по-видимому, ингибирующее воздействие оказывается со стороны премоторной и дополнительной моторной области (ДМО). Участие этих отделов коры подтверждается исследованиями (Koelewijn et al., 2008; Solis-Escalante et al., 2012; Doyle et al., 2005), где авторы показали влияние процесса планирования движения на развитие бета-ССС, а также продемонстрировали появление бета-ССС при наблюдении движений, при экспертизе наблюдаемых действий, а также после актов представления движений (Solis-Escalante et al., 2012; Orset et al., 2020). Динамика и локализация бета-ССС при этом аналогичны синхронизации, развивающейся после реального движения. Существует предположение, что торможение М1 под действием премоторной коры при наблюдении движений функционально важно для того, чтобы факт наблюдения не приводил к реальному его выполнению (чтобы активация системы зеркальных нейронов не приводила к непроизвольной имитации) (Archibald et al., 2001).
Два этих источника торможения М1 как причины развития бета-ССС – премоторная и соматосенсорная кора – действуют, по-видимому, независимо, приводя к возникновению одного и того же ЭЭГ-феномена. Эта гипотеза независимого ингибирования со стороны двух центров подтверждается результатами работ, где вызванная стимуляцией афферентных волокон срединного нерва бета-ССС снижалась в тех случаях, когда сохранялась нагрузка на моторную кору: при выполнении (Pakenham et al., 2019) и при наблюдении движения (Muthukumaraswamy, Johnson, 2004). В настоящей работе было получено подтверждение тому, что бета-ССС чувствительна к наблюдению движений. Наблюдаемое снижение амплитуды бета-синхронизации в условиях с зеркалом говорит о повышении возбудимости моторной коры у испытуемых при наблюдении отраженного движения. По-видимому, наблюдение зеркальной обратной связи через систему ассоциативных связей, обеспечивающих зрительно-моторную интеграцию, приводит к снижению величины торможения моторной коры, которое развивается после движения. В работе (Tominaga et al., 2009) авторы также исследовали влияние зеркальной обратной связи на бета-ССС и обнаружили, что возникающая при стимуляции нерва синхронизация снижается при наблюдении отраженной конечности на месте скрытой. Недостатком этой работы является то, что испытуемым демонстрировали неподвижную конечность, и, таким образом, авторы не исследовали феномен бета-ССС при “классической” зеркальной иллюзии движения.
Отсутствие влияния зеркальной иллюзии на амплитуду десинхронизации и наличие при этом значимых изменений амплитуды бета-синхронизации дают основание использовать амплитуду бета-ССС в качестве ЭЭГ-маркера развития зеркальной иллюзии движения при проведении зеркальной терапии.
Зеркальная иллюзия при активных и пассивных движениях
В данной работе не было обнаружено различий в динамике и локализации сенсомоторных ритмов при зеркальной иллюзии между условиями с произвольными и вызванными ФЭС движениями. Традиционно зеркальная терапия предлагается к использованию пациентам, имеющим интактную конечность, так как проведение терапии требует совершения произвольных движений. При непроизвольных движениях будет отсутствовать фактор намерения, и неизвестно, окажет ли это влияние на аффективность зеркальной обратной связи. Проведенное исследование подтвердило возможность использования вызываемых функциональной электростимуляцией пассивных движений для формирования аффективной зеркальной обратной связи; это может позволить в будущем предложить зеркальную терапию для пациентов с двусторонним парезом конечностей. ФЭС входит в перечень используемых реабилитационных методик, совмещение ее с зеркальной терапией в рамках единой терапевтической процедуры, возможно, позволит повысить эффективность и скорость восстановления подвижности после инсульта.
ВЫВОДЫ
1. Обнаружено, что феномены десинхронизации и синхронизации центрального бета-ритма ЭЭГ реализуются в различных частотных поддиапазонах. В совокупной бета-активности ЭЭГ был выделен компонент, связанный с десинхронизацией, и компонент, амплитуда которого не изменялась при движении, но возрастала после его окончания.
2. Наблюдение отраженного движения вызывало снижение амплитуды бета-синхронизации, развивающейся после окончания движения, но не влияло на амплитуду мю-/бета-десинхронизации, регистрируемой во время движения.
3. Наблюдение зеркальной обратной связи как при активных, так и при вызываемых ФЭС движениях руки приводит к аналогичным изменениям сенсомоторной ЭЭГ-активности.
Список литературы
Болдырева Г.Н., Шарова Е.В., Жаворонкова Л.А., Челяпина М.В., Дубровская Л.П., Симонова О.А., Смирнов А.С., Трошина Е.М., Корниенко В.Н. ФМРТ и ЭЭГ реакции мозга здорового человека при активных и пассивных движениях ведущей рукой. Журн. высш. нервн. деят. им. И.П. Павлова. 2014. 64 (5): 488–499.
Либуркина С.П., Васильев А.Н., Яковлев Л.В., Гордлеева С.Ю., Каплан А.Я. Интерфейс мозг-компьютер на основе представления движения с вибротактильной модальностью стимулов. Журн. высш. нервн. деят. им. И.П. Павлова. 2017. 67 (4): 414–429.
Altschuler E.L., Wisdom S.B., Stone L., Foster C., Galasko D., Llewellyn D.M.E., Ramachandran V.S. Rehabilitation of Hemiparesis after Stroke with a Mirror. The Lancet. 1999. 353 (9169): 20–36.
Archibald S.J., Mateer C.A., Kerns K.A. Utilization Behavior: Clinical Manifestations and Neurological Mechanisms. Neuropsychology Review. 2001. 11 (3): 4–16.
Bowman L.C., Bakermans-Kranenburg M.J., Yoo K.H., Cannon E.N., Vanderwert R., Ferrari, P.F. Fox, N.A The Mu-Rhythm Can Mirror: Insights from Experimental Design, and Looking Past the Controversy. Cortex. 2017. 96: 121–125.
Cardellicchio P., Hilt P.M. Dolfini E. Fadiga L., D’Ausilio A. Beta Rebound as an Index of Temporal Integration of Somatosensory and Motor Signals. Frontiers in Systems Neuroscience. 2020. 14 (September): 1–12.
Cassim F., Monaca C., Szurhaj W., Bourriez J.L., Defebvre L., Derambure P., Guieu J. D. Does Post-Movement Beta Synchronization Reflect an Idling Motor Cortex? NeuroReport. 2001. 12 (17): 3859–3863.
Cassim F., Szurhaj W., Sediri H., Devos D., Bourriez J.L., Poirot I., Guieu J. D. Brief and Sustained Movements: Differences in Event-Related (de)Synchronization (ERD/ERS) Patterns. Clinical Neurophysiology. 2000. 111 (11): 2032–2239.
Chaisaen R., Autthasan P., Mingchinda N., Leelaarporn P., Kunaseth N., Tammajarung S., Wilaiprasitporn T. Decoding EEG Rhythms During Action Observation, Motor Imagery, and Execution for Standing and Sitting. IEEE Sensors Journal. 2020. 20 (22): 13776–13786.
Coll M.P., Bird G., Catmur C., Press C. Cross-Modal Repetition Effects in the Mu Rhythm Indicate Tactile Mirroring during Action Observation. Cortex. 2015. 63: 121–131.
Doyle L.M., Yarrow K., Brown P. Lateralization of Event-Related Beta Desynchronization in the EEG during Pre-Cued Reaction Time Tasks. Clinical Neurophysiology. 2005. 116 (8): 1879–1888.
Duque J., Hummel F., Celnik P., Murase N., Mazzocchio R., Cohen, L.G. Transcallosal Inhibition in Chronic Subcortical Stroke. NeuroImage. 2005. 28 (4): 940–946.
Fong K.N.K., Ting K.H., Chan C.C.H., Li L.S.W. Mirror therapy with bilateral arm training for hemiplegic upper extremity motor functions in patients with chronic stroke. Hong Kong Med J. 2019. 25 (3): 30–34.
Hashimoto Y., Ushiba J. EEG-Based Classification of Imaginary Left and Right Foot Movements Using Beta Rebound. Clinical Neurophysiology. 2013. 124 (11): 2153–2160.
Houdayer E., Labyt E., Cassim F., Bourriez J.L., Derambure P. Relationship between Event-Related Beta Synchronization and Afferent Inputs: Analysis of Finger Movement and Peripheral Nerve Stimulations. Clinical Neurophysiology. 2006. 117 (3): 628–636.
Jarmolowska J., Miladinović A., Valvason E., Busa, P., Ajčević M., Battaglini P.P., Accardo A. Effects of Mirror Therapy on Motor Imagery Elicited ERD / S : An EEG Study on Healthy Subjects. European Medical and Biological Engineering Conference. 2020. 3: 449–461.
Jurkiewicz M.T., Gaetz W.C., Bostan A.C., Cheyne D. Post-Movement Beta Rebound Is Generated in Motor Cortex: Evidence from Neuromagnetic Recordings. NeuroImage. 2006. 32 (3): 1281–89.
Koelewijn T., van Schie H.T., Bekkering H., Oostenveld R., Jensen O. Motor-Cortical Beta Oscillations Are Modulated by Correctness of Observed Action. NeuroImage. 2008. 40 (2): 767–775.
Krauledat M., Dornhege G., Blankertz B., Müller K.R. Robustifying EEG data analysis by removing outliers. Chaos and Complexity Letters. 2007 2 (3): 259–274.
Lee H.M., Li P.C., Fan S.C. Delayed Mirror Visual Feedback Presented Using a Novel Mirror Therapy System Enhances Cortical Activation in Healthy Adults. Journal of NeuroEngineering and Rehabilitation. 2015. 12 (1): 1–11.
Mancuso M., Tondo S.D., Costantini E., Damora A., Sale P., Abbruzzese L. Action Observation Therapy for Upper Limb Recovery in Patients with Stroke : A Randomized Controlled Pilot Study. Brain Sciences. 2021. 11 (3): 290–302.
Moca V.V., Bârzan, H., Nagy-Dăbâcan A., Mureșan R.C. Time-Frequency Super-Resolution with Superlets. Nature Communications. 2021. 2 (1): 1–18.
Müller-Putz G.R., Zimmermann D., Graimann B., Nestinger K., Korisek G., Pfurtscheller G. Event-Related Beta EEG-Changes during Passive and Attempted Foot Movements in Paraplegic Patients. Brain Research. 2007. 1137 (1): 84–91.
Muralidharan V., Xinze Yu, Cohen M.X., Aron A.R. Preparing to stop action increases beta band power in contralateral sensorimotor cortex. Journal of cognitive neuroscience. 2019. 31 (5): 657–668.
Muthukumaraswamy Suresh D., Blake W. Johnson. Primary Motor Cortex Activation during Action Observation Revealed by Wavelet Analysis of the EEG. Clinical Neurophysiology. 2004. 115 (8): 1760–1766.
Neuper C., Wörtz M., Pfurtscheller G. ERD/ERS Patterns Reflecting Sensorimotor Activation and Deactivation. Progress in Brain Research. 2006. 159: 211–222.
Orset B., Lee K., Chavarriaga R., Millán J. D. R. User Adaptation to Closed-Loop Decoding of Motor Imagery Termination. IEEE Transactions on Biomedical Engineering. 2020. 68 (1): 3–10.
Pakenham D.O., Quinn A.J., Fry A., Francis S.T., Woolrich M.W., Brookes M.J., Mullinger K.J. Post-Stimulus Beta Responses Are Modulated by Task Duration. NeuroImage. 2019. 206 (1): 1–15.
Parkes L.M., Bastiaansen M.C., Norris D.G. Combining EEG and FMRI to Investigate the Post-Movement Beta Rebound. NeuroImage. 2006. 29 (3): 685–696.
Perkins T., Stokes M., McGillivray J., Bittar R. Mirror Neuron Dysfunction in Autism Spectrum Disorders. Journal of Clinical Neuroscience. 2010. 17 (10): 1239–1243.
Pfurtscheller G., Da Silva F.L. Event-Related EEG/MEG Synchronization and Desynchronization: Basic Principles. Clinical Neurophysiology : Official Journal of the International Federation of Clinical Neurophysiology. 1999. 110 (11): 1842–1857.
Höfle M., Pomper U., Hauck M., Engel AK., Senkowski D. Event-Related Synchronization (ERS) in the Alpha Band - an Electrophysiological Correlate of Cortical Idling: A Review. International Journal of Psychophysiology. 1996. 24 (1996): 39–46.
Höfle M., Pomper U., Hauck M., Engel A.K., Senkowski D. “Spectral Signatures of Viewing a Needle Approaching One ’ s Body When Anticipating Pain.” European Journal of Neuroscience. 2013. 38 (7): 3089–98.
Ramachandran V.S. and Rogers-Ramachandran D. Synaesthesia in Phantom Limbs Induced with Mirrors. Proceedings of the Royal Society of London. 1996. 263 (1369), 377–86.
Rossiter H.E., Borrelli M.R., Borchert R.J., Bradbury D., Ward N.S. Cortical Mechanisms of Mirror Therapy after Stroke. Neurorehabilitation and Neural Repair. 2015. 29 (5): 444–52.
Salmelin R., Hámáaláinen M., Kajola M., Hari R. Functional Segregation of Movement-Related Rhythmic Activity in the Human Brain. NeuroImage. 1995. 2 (4): 237–43.
Shahid S., Sinha R.K., Prasad G. Mu and Beta Rhythm Modulations in Motor Imagery Related Post-Stroke EEG : A Study under BCI Framework for Post-Stroke Rehabilitation. 2010. 11 (Suppl 1): 1–2.
Solis-Escalante T., Müller-Putz G.R., Pfurtscheller G., Neuper C. Cue-Induced Beta Rebound during Withholding of Overt and Covert Foot Movement. Clinical Neurophysiology. 2012. 123 (6): 1182–90.
Tominaga W., Matsubayashi J., Deguchi Y., Minami C., Kinai T., Nakamura M., Mitani A. A Mirror Reflection of a Hand Modulates Stimulus-Induced 20-Hz Activity. NeuroImage. 2009. 46(2): 500–504.
Torrecillos F., Alayrangues J., Kilavik B.E., Malfait N. Distinct Modulations in Sensorimotor Postmovement and Foreperiod β-Band Activities Related to Error Salience Processing and Sensorimotor Adaptation. Journal of Neuroscience. 2015. 35 (37): 12753–65.
Vasilyev A., Liburkina S., Yakovlev L., Perepelkina O., Kaplan A. Assessing Motor Imagery in Brain-Computer Interface Training: Psychological and Neurophysiological Correlates. Neuropsychologia. 2017. 97 (February): 56–65.
Vinding M.C., Tsitsi P., Piitulainen H., Waldthaler J., Jousmäki V., Ingvar M., Lundqvist D. Attenuated Beta Rebound to Proprioceptive Afferent Feedback in Parkinson’s Disease. Scientific reports. 2019. 9 (1), 1–11.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


