Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 6, стр. 830-845
Фазовая когерентность ритмической активности мозга как показатель различения звуковых стимулов в oddball-парадигме
Л. Б. Шестопалова 1, *, Е. А. Петропавловская 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: shestopalovalb@infran.ru
Поступила в редакцию 28.01.2021
После доработки 16.02.2021
Принята к публикации 02.03.2021
Аннотация
Исследовалось влияние акустического контекста на вызванную ритмическую активность мозга человека, лежащую в основе различения неподвижных и движущихся звуковых стимулов в условиях oddball-парадигмы. Изменение контекста создавалось путем перестановки местами стандартных и девиантных стимулов в разных сериях. Проанализированы вызванное спектральное возмущение (event-related spectral perturbation, ERSP) и фазовая когерентность (inter-trial phase coherence, ITC), вычисленные на основе частотно-временного разложения записи ЭЭГ. Движущийся стандартный стимул вызывал большую когерентность альфа- и тета-колебаний по сравнению с неподвижным стандартом. Предъявление движущегося стимула в качестве девианта приводило к дополнительному росту когерентности вызванных колебаний. В прямой конфигурации при предъявлении девиантов наблюдалась синхронизация, а в обратной – десинхронизация медленных колебаний. Предположительно, степень фазовой когерентности можно считать объективным показателем различения движущихся и неподвижных звуковых стимулов.
Соотношение объективных и субъективных показателей различения стимулов является одним из основных вопросов когнитивной психофизиологии. Первичная обработка слуховой информации происходит на предсознательном уровне, поэтому одним из способов оценки объективной способности к различению звуковых сигналов считается генерируемый на предсознательном уровне потенциал негативности рассогласования (Mismatch negativity, MMN). MMN представляет собой негативный компонент слуховых вызванных потенциалов, возникающий в ответ на изменение поступающей в слуховую систему информации. Для регистрации MMN используется экспериментальный прием, известный как oddball-парадигма, при котором в контекст повторяющихся стимулов (“стандартов”) изредка включаются отличающиеся по тем или иным характеристикам “девиантные” стимулы (см. обзоры Näätänen et al., 2007; Шестопалова, Петропавловская, 2019). В результате сравнения сенсорной информации о стимуле и о контексте, в котором он был предъявлен, происходит генерация MMN как реакция на нарушение обнаруженных закономерностей звуковой стимуляции. Наименьшая величина акустических различий между стандартом и девиантом, приводящая к возникновению MMN, чаще всего соответствует психофизическому порогу различения (напр., длительности, частоты, пространственного положения и т.п.). Поэтому MMN принято считать показателем субъективного (осознанного) различения стимулов или их параметров.
Для корректного сопоставления результатов психофизических измерений с параметрами MMN такие измерения должны проводиться в одинаковых экспериментальных условиях, т.е. при обнаружении девиантов в потоке стандартов. Наша предыдущая работа в этом направлении была посвящена пространственным акустическим различиям: в ней использовались неподвижные звуковые стимулы и движущиеся стимулы двух скоростей (Шестопалова и др., 2017). Показатели объективного и субъективного различения звуковых сигналов исследовались в условиях oddball-парадигмы при перестановке местами стандартных и девиантных стимулов. При этом физические различия между сигналами оставались неизменными, а их функциональные отношения менялись на противоположные. Было обнаружено, что в случае наибольших различий между стандартом и девиантом величина MMN сильно зависит от контекста: при перестановке местами стандарта и девианта выраженный потенциал MMN в одной конфигурации может полностью исчезать в обратной конфигурации. Однако субъективное различение этих же сигналов, хотя и изменялось при смене контекста, но всегда оставалось на надпороговом уровне. Таким образом, вопрос о том, можно ли считать MMN нейрональным коррелятом психофизического различения, остается открытым.
Процессы осознанного обнаружения различий звука не всегда находят отражение в MMN, в том числе при действии пространственных стимулов (Shestopalova et al., 2015; Шестопалова и др., 2017). Одной из причин этого является потеря части информации, содержащейся в ЭЭГ, в ходе усреднения при вычислении суммарных ответов. Как известно, вызванные потенциалы в принципе отражают закономерности активности мозга, имеющие четкую временную связь с сенсорными событиями, в то время как в основе различения могут лежать вызванные колебания (ВК; английский эквивалент – event-related oscillations, EROs), которые могут быть не строго синхронизованы по времени и фазе с изменениями стимуляции (Makeig et al., 2004; Herrmann et al., 2005). Более полную картину нейрональной активности, обеспечивающей слуховое различение, можно получить с помощью частотно-временного разложения сигналов ЭЭГ и измерения динамически изменяющихся характеристик различных ритмов мозга (см. обзоры Bendixen et al., 2012; Hanslmayr et al., 2016).
Синхронизированная с событием подстройка фазы колебаний (phase resetting, phase alignment) оценивается по величине фазовой когерентности отдельных эпох (inter-trial phase coherence, ITC). ITC представляет собой независимый от амплитуды колебаний показатель, способный выявить фазовое согласование даже очень слабых колебаний. Применительно к пространственному слуху фазовая когерентность медленных колебаний ЭЭГ может рассматриваться как индикатор реакции мозга человека на начало движения звукового стимула (Shestopalova et al., 2020; Шестопалова и др., 2020). Другой показатель динамики ЭЭГ отражает модуляции спектральной мощности, связанные с внешним воздействием, и носит название “вызванное спектральное возмущение” (event-related spectral perturbation, ERSP) (Makeig et al., 2004).
Оба спектральных показателя неоднократно применялись при исследовании ЭЭГ в пассивной oddball-парадигме (см. обзор Herrmann et al., 2014). В некоторых случаях анализ мозговых ритмов может иметь преимущество перед измерением MMN: в работе Bishop, Hardiman (2010) была изучена ситуация, когда испытуемые успешно распознавали акустические девианты при отсутствии MMN в их реакциях. Увеличение реакции, связанное с обнаружением девиантов, наблюдалось в 82% случаев по показателю фазовой когерентности в тета-диапазоне и только в 70% случаев – в суммарной активности.
Характерные особенности ВК в условиях oddball-парадигмы состоят в следующем. Во-первых, стандартные и девиантные стимулы вызывают усиление колебаний в тета-диапазоне, причем в реакции на девианты тета-колебания больше по мощности и значительно сильнее синхронизованы в интервале 150–200 мс (Fuentemilla et al., 2008; Lin et al., 2007, Hsiao et al., 2009; Ko et al., 2012). Во-вторых, в реакции на стандартные стимулы во временном интервале 20–80 мс регистрируются ВК гамма-диапазона, имеющие кортикальное происхождение (Yabe et al., 2005; Schadow et al., 2009; Kaiser, Lutzenberger, 2005). Предполагается, что при совпадении акустической информации с содержанием сенсорной памяти генерируются ранние колебания гамма-диапазона, а при несовпадении – поздние ВК тета-диапазона (Yordanova et al., 2012). Получены также данные о тесном функциональном взаимодействии ВК в тета- и гамма-диапазонах (Canolty, 2006; Demiralp, 2007; Sauseng, 2010, обзор), физиологический смысл которого остается предметом дальнейших исследований.
Опираясь на имеющиеся экспериментальные результаты, мы поставили задачу измерить спектральную мощность и фазовую подстройку ВК, регистрируемых при различении неподвижных и движущихся звуковых стимулов в условиях odd-ball парадигмы. Для этого мы применили частотно-временное разложение на основе вейвлетных функций к записям ЭЭГ, полученным в нашей недавней работе (Шестопалова и др., 2017). Целью настоящего исследования был поиск нейронального коррелята различения движущихся звуковых стимулов при смене функциональных ролей стандартных и девиантных стимулов. Предполагалось, что таким коррелятом может быть фазовая подстройка нейрональной активности тета-диапазона.
МЕТОДИКА
Подготовка эксперимента. В экспериментах приняли участие восемь праворуких испытуемых (женщин) с нормальным слухом в возрасте от 20 до 43 лет. Все исследования проведены в соответствии с принципами Хельсинкской декларации 1964 г. и ее последующих обновлений и одобрены Этическим комитетом Санкт-Петербургского государственного университета. Каждый участник представил письменное информированное согласие, подписанное им после разъяснения ему характера предстоящего исследования. Испытуемых располагали в комфортном кресле в экранированной звукоизолированной камере. В ходе регистрации ЭЭГ им предлагали читать книгу по своему выбору. Звуковые сигналы предъявлялись испытуемым дихотическим способом.
На предварительном этапе каждого эксперимента у всех испытуемых измеряли пороги слышимости для обоих ушей. Разница порогов левого и правого уха не превышала 6 дБ. Далее выставляли уровень интенсивности 50 дБ над порогом на обоих каналах, дихотически предъявляли идентичные шумовые посылки и проводили центрирование звукового образа. Процедура центрирования состояла в том, что испытуемый должен был сообщать нажатием клавиш на клавиатуре, ощущает ли он положение звука как “центральное” (звуковой образ расположен по средней линии головы) или правее/левее центра. В зависимости от отчетов испытуемого, для каждого из ушей проводилась коррекция интенсивности таким образом, чтобы стимул занял центральное положение.
Стимулы. Звуковые стимулы синтезированы с частотой дискретизации 96 кГц на основе отрезков белого шума. Длительность всех звуковых посылок была одинакова и равна 200 мс, не считая фронтов нарастания и спада, которые составляли 10 мс и сглаживались косинусоидальной функцией.
Пространственное положение стимулов задавалось величиной межушной задержки (ΔT) между бинаурально предъявляемыми сигналами. По характеру изменения ΔT стимулы подразделялись на два типа, которые в дальнейшем будут именоваться “неподвижный” и “скачок”:
– стимулы, моделировавшие неподвижный звуковой образ, расположенный по средней линии головы (ΔT = 0). Исходные сигналы фильтровали в полосе 100–1300 Гц и предъявляли на оба уха.
– стимулы, моделировавшие мгновенное перемещение звукового образа влево или вправо от средней линии на угловое расстояние, соответствующее ΔT = 200 мкс. Эффект резкого (мгновенного) перемещения звукового образа создавался за счет того, что в одном канале в середине стимула (через 100 мс от начала) из исходной шумовой посылки вырезали фрагмент длительностью 200 мкс, что приводило к смещению второй половины стимула на ту же величину. В результате в этом канале формировался опережающий сдвиг отсчетов, составляющих вторую половину сигнала, без паузы в середине (подробное описание в статье Альтмана и др., 2007). После сдвига выполнялись переоцифровка и сплайн-интерполяция отсчетов. Затем сигналы со сдвигом и исходные сигналы фильтровали в полосе 100–1300 Гц. Данный алгоритм синтеза обеспечивал отсутствие акустического щелчка в стимуле. При предъявлении на одно ухо сигнала со сдвигом, а на другое ухо – исходного сигнала, возникал скачок межушной задержки в дихотическом стимуле, причем момент скачка приходился всегда на его середину. Таким образом, первые 100 мс физические характеристики неподвижного и перемещающегося стимулов были идентичны, различия появлялись только в середине стимула и сохранялись до конца звучания.
Стимулы, содержавшие скачкообразное изменение межушной задержки, создавали у всех испытуемых ощущение резкого смещения звукового образа в левую или правую сторону. Поскольку слуховая система в силу инерционных свойств обрабатывает мгновенные изменения в положении звукового источника путем их сглаживания (Saberi, Hafter, 1997), скачкообразное изменение ΔT субъективно ощущается как быстрое движение стимула, а не как последовательная смена его положения. По причине сглаживания становится невозможным в точности определить момент начала девиации при сравнении неподвижного и перемещающегося стимулов. В связи с этим латентности всех компонентов потенциала, включая MMN и P3a, измеряются относительно включения стимула.
Синтезированные сигналы преобразовывали в аналоговую форму при помощи многоканальной аудиоплаты Gina24 (Echo Audio, США). Для подачи стимулов непосредственно к барабанной перепонке применяли звукоизлучатели ER-2 (Etymotic Research Inc., США) с амплитудно-частотными характеристиками, имеющими в диапазоне 0.1–10 кГц неравномерность ±3 дБ. Ушные вкладыши звукоизлучателей обеспечивали дополнительное подавление внешних шумов на 30 дБ. На предварительном этапе каждого эксперимента у всех испытуемых измеряли пороги слышимости обоих ушей. Интенсивность сигналов устанавливалась на уровне 50 дБ над порогом слышимости на каждом ухе испытуемого.
Процедура получения негативности рассогласования
Звуковые стимулы предъявляли испытуемым дихотическим способом, согласно классической oddball-парадигме в прямой и обратной конфигурации. Каждая серия состояла из 420 стандартных (вероятность предъявления 0.84) и по 40 девиантных стимулов двух видов (вероятность предъявления каждого вида 0.08). В сериях с неподвижным стандартом (прямая конфигурация) девиантами служили стимулы типа “скачок”, по 40 девиантов, перемещавшихся влево и вправо от средней линии головы. Направление перемещения девиантов устанавливалось в квазислучайном порядке. В сериях, где стандартом являлся скачок влево или вправо (обратная конфигурация), девиантами служили 40 неподвижных центральных стимулов (рис. 1, вверху). Еще 40 девиантов в этих сериях (медленное движение) были использованы для другого исследования и в настоящей работе не рассматриваются. Левосторонние и правосторонние серии в обратной конфигурации предъявлялись в квазислучайном порядке. Для каждого испытуемого было записано по шесть-семь серий каждого вида. Длительность серии составляла около 8 мин.
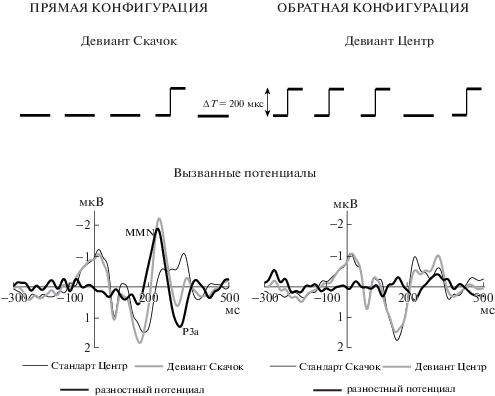
Рис. 1.
Вызванные потенциалы в прямой и обратной конфигурации. Вверху: схема стимуляции в прямой и обратной oddball-парадигме. Стимулы либо были расположены по средней линии головы (Центр), либо резко смещались влево или вправо на угол, соответствующий ΔT = 200 мкс (Скачок). Внизу: вызванные потенциалы в реакции на стандарты и девианты, а также соответствующие разностные потенциалы, усредненные по фронто-центральному кластеру (AF3, F3, FC1, AF4, F4, FC2, Fz) и по всей группе испытуемых. Негативность вверх.
Fig. 1. Grand-averaged ERPs recorded with the reversed oddball stimulation. Top panel: schematic of ITD patterns of the sound stimuli used in the experiment. The stimuli were either located near the head midline (Центр) or displaced abruptly leftward or rightward covering the angle corresponding to ITD = 200 μs (Скачок). Bottom panel: the ERPs elicited by standards and deviants, and the difference potentials averaged over the frontocentral group of electrodes (AF3, F3, FC1, AF4, F4, FC2, Fz). Negativity upward.
Регистрация ЭЭГ. Регистрацию ЭЭГ проводили при помощи хлорсеребряных электродов, в 32 точках по международной системе 10–20, с заменой точек отведения PO3/PO4 на C5/C6. Дополнительные электроды располагали на мочках ушей и на носу. Горизонтальную и вертикальную электроокулограммы записывали при помощи электродов, установленных над правым глазом и под левым глазом. Активность регистрировалась с помощью энцефалографа ActiveTwo (BIOSEMI, Голландия) и специально разработанной программы, обеспечивающей фильтрацию сигналов и запись на жесткий диск компьютера. ЭЭГ оцифровывалась в полосе 0–102 Гц с частотой дискретизации 2048 Гц с последующим понижением до частоты 512 Гц.
Анализ данных. Непрерывную запись ЭЭГ разбивали на эпохи длительностью 1000 мс, включая участок длительностью 300 мс до начала стимула и 700 мс после. После этого проводили вычисление потенциала на каждом канале относительно усредненного потенциала всех электродов и фильтровали в диапазоне 0.5–45 Гц. Затем проводили коррекцию ЭЭГ относительно базовой линии по предстимульному участку. Дальнейшая обработка ЭЭГ существенно отличалась от той, которая проводилась в предыдущем исследовании, исходные данные которого мы используем здесь (Шестопалова и др., 2017). Артефакты корректировали при помощи метода анализа независимых компонент (ICA), основанного на алгоритме infomax и реализованного в модуле EEGLab среды MATLAB (Delorme et al., 2007). Алгоритм оптимизирован для выявления движений глаз, морганий и нарушений контакта кожи с электродами. Независимые компоненты, соответствующие этим артефактам, удаляли (не более 5 компонентов из 37). Эпохи, содержащие нестереотипные артефакты (вызванные движением испытуемого или временным нарушением контакта), удаляли целиком с помощью приложения EEGLab (не более 2% эпох в каждой серии). После устранения артефактов ЭЭГ восстанавливали и принимали в качестве референса усредненный потенциал электродов на мочках ушей. Затем эпохи ЭЭГ сортировали по видам стимулов. Чтобы сбалансировать размер выборки между реакциями на стандарты и девианты, реакции на стандарты анализировали только по эпохам, непосредственно предшествующим эпохам с реакциями на девианты. Последующий анализ выполнялся по выборкам из 270±15 эпох одного вида в среднем для одного испытуемого.
Вызванные потенциалы. Для получения вызванных потенциалов на стандартные и девиантные стимулы ЭЭГ дополнительно фильтровали в полосе 2–30 Гц. После фильтрации записи ЭЭГ усредняли отдельно для каждого испытуемого во фронто-центральном кластере электродов (AF3, F3, FC1, AF4, F4, FC2, Fz), поскольку в этих отведениях наблюдается максимальная выраженность потенциала MMN (Näätänen et al., 2007). Негативность рассогласования (MMN) вычисляли как разностную волну, получаемую вычитанием ответа на стандарт из ответа на девиант. Затем производили усреднение по группе испытуемых для получения гранд-усредненных кривых.
Достоверность возникновения MMN оценивали путем сравнения ответов на стандарт и девиант. Интервал достоверности для амплитуды MMN определяли при помощи скользящего t-теста Стьюдента. Для этого по индивидуальным кривым находили средние значения амплитуды ответа на стандарт и девиант во временном окне шириной 50 мс, последовательно сдвигая положение окна по временной оси с шагом в 1 отсчет (приблизительно 2 мс). Статистическое сравнение индивидуальных ответов на стандарт и девиант выполнялось на каждом шаге. Интервал между отсчетами, где значимость различий достигала p < 0.05, считался интервалом достоверности MMN.
Частотно-временной анализ. Средние величины вызванных изменений спектральной мощности (ERSP) для каждой эпохи вычисляли для стандартов и девиантов каждой серии в каждом канале при помощи частотно-временного вейвлет-преобразования (функция EEGlab “pop_newtimef” (Delorme et al., 2007)). Вейвлетному преобразованию подвергались записи ЭЭГ, фильтрованные в диапазоне 0.5–45 Гц. В качестве спектральной базовой линии принимали среднюю мощность на предстимульном участке длительностью 300 мс. Двести пятьдесят отсчетов ERSP получали в интервале от –48 мс до 446 мс (относительно начала стимула) для 83 логарифмических частот в диапазоне от 4 до 45 Гц, используя 1.8 цикла вейвлета Морле на нижней частоте и 11.25 цикла на верхней. Ширина окна вейвлета составила 505 мс. Спектральные преобразования включали нормировку относительно усредненной спектральной мощности на участке базовой линии с получением показателя ERSP в шкале децибел (дБ).
Степень фазовой когерентности колебаний одиночных эпох для 83 логарифмических частот (от 4 до 45 Гц) вычисляли аналогичным образом при помощи функции ‘pop_newtimef’. Для каждой эпохи отсчет фазы колебания производился от момента начала стимула. Показатель когерентности (ITC) выражен в относительных безразмерных единицах в пределах от 0 до 1.
Таким образом были получены частотно-временные представления (ЧВП) величин ERSP и ITC по индивидуальным данным для стандартов и девиантов в прямой и обратной конфигурации. Разностные ЧВП для ERSP и ITC вычисляли вычитанием соответствующих ЧВП ответа на стандарт из ответа на девиант. Затем эти данные усреднялись между электродами фронто-центрального кластера (AF3, F3, FC1, AF4, F4, FC2, Fz). Индивидуальные ЧВП (как исходные, так и разностные) усредняли в пяти частотных полосах (тета: 4–7 Hz, нижняя альфа-полоса: 7–10 Hz, верхняя альфа-полоса: 10–13 Hz, бета: 13–30 Гц, гамма: 30–45 Гц) для получения индивидуальных кривых ERSP и ITC в каждой полосе. Затем индивидуальные данные усредняли по всей группе для получения гранд-усредненных кривых. Интервал достоверности для различий ERSP и ITC в реакциях на стандарты и девианты в прямой и обратной конфигурациях определяли в каждой частотной полосе так же, как и в случае разностного потенциала, при помощи скользящего t-теста Стьюдента с временным окном шириной 52 мс.
Для каждого испытуемого были вычислены средние величины разностных ERSP и ITC путем усреднения разностных кривых ЧВП во временном окне 150–300 мс от включения сигнала. Выбор временного окна определялся тремя факторами: 1) традиционное окно формирования MMN составляет 150–200 мс (Näätänen et al., 2007), но в случае пространственной девиации оно может быть несколько шире, достигая 300 мс (Shestopalova et al., 2012); 2) в области низких частот ЧВП имеют меньшее разрешение по времени, чем на высоких; 3) часть вызванных колебаний, представляющих интерес, может быть слабо синхронизирована с событием.
Средние величины разностных ERSP и ITC анализировали по отдельности с помощью 2-факторного дисперсионного анализа (rmANOVA) с факторами Полоса (тета, нижняя альфа, верхняя альфа, бета, гамма) и Конфигурация (прямая, обратная). Для степеней свободы применяли поправку Гринхауза-Гайсера. При проведении множественных сравнений применяли поправку Бонферрони. Все сравнения проводили с уровнем значимости p < 0.05.
Аналогичными способами было проведено сравнение ответов на стандартные стимулы между собой для выявления различий, связанных с физическими свойствами сигналов, а не их ролями в потоке стимулов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Суммарные вызванные ответы на стандарты и девианты, а также разностные потенциалы, приведены на рис. 1 внизу. В прямой конфигурации в интервале 194–260 мс получен достоверно идентифицируемый негативный компонент MMN (p < 0.05) c пиковой латентностью 239 ± 5 мс (относительно начала стимула) и амплитудой 2.1 ± 0.2 мкВ. В обратной конфигурации статистически значимой MMN не обнаружено. Достоверных различий между вызванными потенциалами на неподвижный и движущийся стандарты также выявлено не было (скользящий t-тест Стьюдента, p > 0.05).
ЧВП реакций на стандарты и девианты приведены на рис. 2 и 3. Пунктирными линиями выделены временные интервалы 150–300 мс, в которых производилось усреднение спектральных показателей для дисперсионного анализа. Сравнивая реакции на стандарты обеих конфигураций в области формирования MMN, следует отметить более высокую синхронизацию медленных колебаний, вызываемую стандартом-скачком (по сравнению с центральным стандартом) (рис. 3, верхние панели), при несколько меньшей мощности (рис. 2, верхние панели). Дисперсионный анализ (rmANOVA) средних величин ERSP ответов на стандарты (усредненных по полосам частот во временном интервале 150–300 мс) с факторами Полоса (тета, нижняя альфа, верхняя альфа, бета, гамма) и Стандарт (неподвижный, движущийся) не выявил значимых эффектов и взаимодействий, однако попарные сравнения показали, что различия мощности в тета-диапазоне достигли уровня значимости (p < 0.05). Дисперсионный анализ средних значений ITC выявил пограничную значимость эффекта Стандарт (F (1, 7) = 4.87, p = 0.063), высокую значимость эффекта Полоса (F (1.61, 11.30) = = 13.47, p < 0.01) и значимое взаимодействие Полоса*Стандарт(F(1.91, 13.42) = 7.90, p < < 0.01). В попарных сравнениях подтвердилась более высокая синхронизация в реакции на движущийся стандарт (скачок) в тета- и нижней альфа-полосе (p < 0.05).
Рис. 2.
Частотно-временные представления (ЧВП) вызванного спектрального возмущения в реакциях на стандарты (вверху), девианты (в середине), а также разность между ними (внизу); усреднение по фронто-центральному кластеру и по всей выборке. Пунктирными линиями показаны временные интервалы 150–300 мс, в которых производилось усреднение спектральных показателей для дисперсионного анализа. Черные и белые контуры очерчивают области, в пределах которых обнаружены достоверные различия между спектральными показателями в реакциях на стандарты и девианты. Градиентные шкалы показывают мощность спектрального возмущения в дБ.
Fig. 2. Grand-averaged time-frequency plots of the spectral perturbation (ERSP) evoked in the frontocentral group of electrodes (AF3, F3, FC1, AF4, F4, FC2, Fz) by standards (top panel) and deviants (middle panel) and difference time-frequency plots (bottom panel) obtained in the reversed oddball experiment. Here and in the next figures: “Прямая конфигурация” means Direct oddball sequence and “Обратная конфигурация” means Reversed sequence of the stimuli. The dashed lines show the 150–300-ms time windows used to compute the averaged values entered into the ANOVAs. Black and white contours outline the time-frequency regions in which the moving average t-test yielded significant differences between responses to standards and deviants. Gradient scales show the ERSP power expressed in dB.
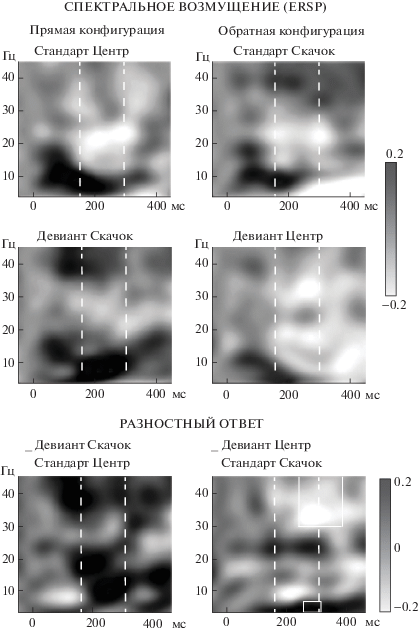
Рис. 3.
Частотно-временные представления (ЧВП) фазовой когерентности в реакциях на стандарты (вверху), девианты (в середине), а также разность между ними (внизу). Градиентные шкалы показывают степень когерентности в относительных единицах. Выборка данных и обозначения – как на рис. 2.
Fig. 3. Grand-averaged time-frequency plots of the phase coherence (ITC, bottom panel) evoked in the frontocentral group of electrodes. Gradient scales show the ITC values expressed in relative units. Panels arrangement, data averaging and indications are similar to those of Fig. 2.
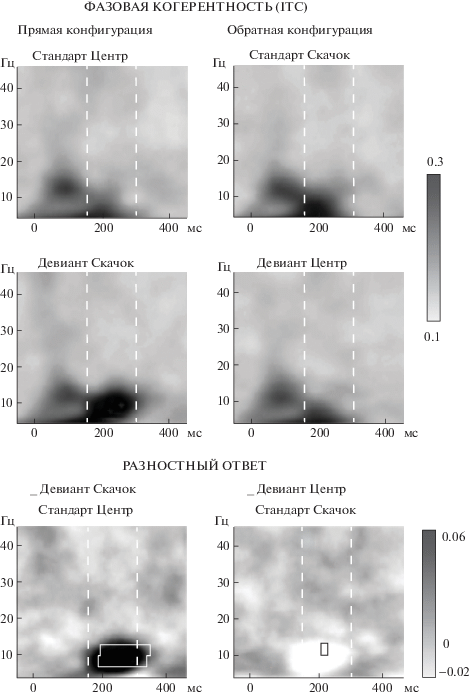
Обращает также на себя внимание тот факт, что в прямой конфигурации девиант-скачок вызывал заметное усиление (рис. 2, левая средняя панель) и выраженную синхронизацию альфа-колебаний во временном интервале суммарного ответа (MMN) (рис. 3, левая средняя панель). В обратной конфигурации этот же стимул (скачок), использованный в качестве стандарта, вызывал значительно меньшие изменения как ERSP, так и ITC в альфа-диапазоне. Неподвижный центральный стимул слабее отражался на спектральных показателях (по сравнению со скачком) в обеих конфигурациях.
Разностные ЧВП приведены на рис. 2 и 3 на нижних панелях. В результате усреднения этих данных в пределах каждой из частотных полос получены гранд-усредненные кривые (рис. 4), иллюстрирующие вклад каждого из мозговых ритмов в формирование разностного потенциала. Важно отметить, что в прямой конфигурации максимум как спектрального возмущения, так и фазовой когерентности в интервале формирования MMN (150–300 мс) приходился на долю альфа-колебаний. В обратной конфигурации в этом временном промежутке фазовая когерентность реакций на девиант была ниже, чем на стандарт, причем десинхронизация в основном приходилась тоже на диапазон альфа-частот.
Рис. 4.
Вызванные колебательные ответы в каждой из пяти частотных полос (усреднение по фронто-центральному кластеру и по всей выборке). Серой обводкой около кривых показаны интервалы достоверности различий между ЧВП реакций на стандарт и девиант (скользящий t-тест, p < 0.05).
Fig. 4. Grand-averaged evoked oscillatory responses in five frequency ranges. Grey areas show the time intervals in which the responses to standards and deviants differed significantly (paired t-tests in the 52-ms sliding window, p < 0.05).
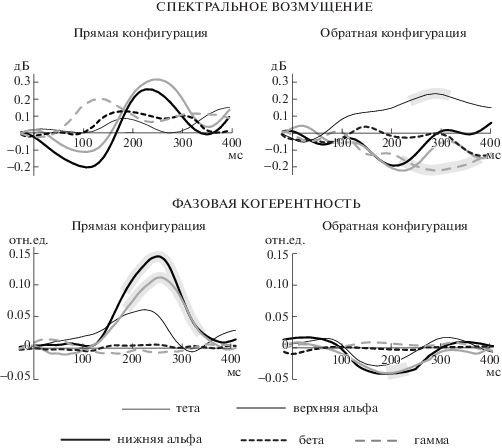
Серой обводкой около кривых на рис. 4 показаны интервалы достоверности (p < 0.05) различий между ЧВП реакций на стандарт и девиант, установленные при помощи скользящего t-теста в каждой из пяти частотных полос. Спектральное возмущение демонстрировало значимые различия в реакциях на стандарт и девиант только в обратной конфигурации: в тета-полосе различия были достоверны в интервале 246–306 мс, а в гамма-полосе – в интервале 234–376 мс. Фазовая когерентность реакций на стандарт и девиант в прямой конфигурации различалась в интервалах 192–328 мс и 196–334 мс в нижней и верхней альфа-полосах соответственно. В обратной конфигурации различия когерентности были достоверны только в верхней альфа-полосе в интервале 205–221 мс.
Дисперсионный анализ (rmANOVA) средних величин ERSP и ITC в разностных ЧВП (усредненных по полосам частот) с факторами Полоса (тета, нижняя альфа, верхняя альфа, бета, гамма) и Конфигурация (прямая, обратная) не выявил значимых различий для ERSP (p > 0.05). В то же время для ITC обнаружен эффект Полосы (F(1.68, 11.75) = 8.60, p < 0.01) и Конфигурации (F(1, 7) = 18.45, p < < 0.01), а также их взаимодействие (F(1.98, 13.84) = 16.37, p < 0.001). Согласно попарным сравнениям, взаимодействие было связано с тем, что только в бета- и гамма-полосах отсутствовал эффект Конфигурации (p > 0.05), а в тета-альфа-полосах когерентность была выше в прямой конфигурации, чем в обратной (p < 0.05). Кроме того, в обратной конфигурации отсутствовали достоверные различия по степени когерентности у разных ритмов (p > 0.05), в то время как в прямой конфигурации когерентность колебаний в нижней альфа-полосе была достоверно выше, чем в тета-, бета- и гамма-полосах (p > > 0.05), а когерентность в верхней альфа-полосе – выше, чем в бета-полосе (p > 0.05). Таким образом, различия когерентности между конфигурациями максимальны в альфа-диапазоне. В диапазоне бета- и гамма-колебаний дисперсионный анализ ITC не выявил никаких эффектов (p > 0.05). Однако различия гамма-ERSP между стандартом и девиантом были значимы только в обратной конфигурации (p < 0.05 по результатам t-теста), следовательно, смена контекста все же оказывала влияние на этот показатель.
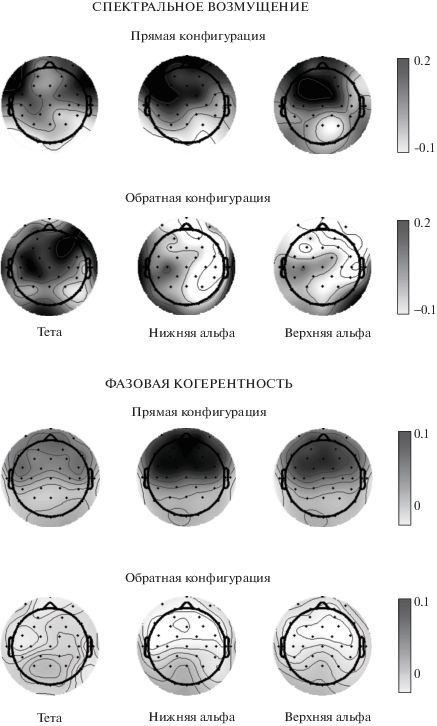
Различия спектральных показателей в прямой и обратной конфигурации наглядно иллюстрирует рис. 5, на котором приведены пространственные распределения ERSP и ITC, вычисленные для разностных величин, усредненных в окне 150–300 мс. Описанные выше значимые различия когерентности в реакциях на стандарт и девиант нашли отражение в обширном фронто-центральном распределении разностной ITC, симметрично охватывающем не только точки AF3, F3, FC1, AF4, F4, FC2 и Fz, по которым проводился статистический анализ, но и более латеральные отведения FC5, FC6, F7 и F8.
Рис. 5.
Топограммы разностных вызванных колебательных ответов, усредненных во временном интервале 150–300 мс. Вверху – топограммы разностных величин полного ERSP, внизу – ITC. Усреднение произведено по фронто-центральному кластеру и по всей выборке. Масштабы для разных частотных полос не совпадают. Градиентные шкалы – как на рис. 2.
Fig. 5. Scalp distributions of the evoked difference oscillatory responses averaged over the 150–300-ms time window. Top panel: difference ERSP topograms. Bottom panel: difference ITC topograms. “Тета” is for theta-, “Нижняя альфа” is for lower alpha- and “Верхняя альфа” is for upper alpha-band. Note the differences in scaling for theta- and alpha oscillations. Gradient scales are similar to those of Fig. 2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование посвящено влиянию перестановки стандартных и девиантных стимулов на вызванное спектральное возмущение (ERSP) и фазовую когерентность (ITC) мозговых ритмов, регистрируемых в традиционной oddball-парадигме. Стандартами и девиантами служили дихотические стимулы, моделирующие неподвижный звуковой образ, расположенный по средней линии головы, и мгновенное перемещение (скачок) звукового образа влево или вправо от средней линии головы.
Принципиально важный результат при анализе суммарных ответов состоял в том, что смена ролей стандартов и девиантов в oddball-парадигме кардинальным образом отражалась на разностном потенциале: когда стандартом был неподвижный центральный стимул, генерировалась хорошо выраженная MMN, а когда стандартом становился скачок, MMN отсутствовала. Этот эффект подробно описан в наших предыдущих работах (Shestopalova et al., 2015; Шестопалова и др., 2017). Ранее нами было показано также (Шестопалова и др., 2017), что психофизическое (осознанное) различение этих стимулов тоже ухудшается при смене контекста, но все же остается выше порога: процент правильно распознанных девиантов составлял 95%, когда скачок был девиантом, и 77%, когда он становился стандартом. MMN часто рассматривается как коррелят предсознательного обнаружения различий в поступающем потоке стимулов, являющийся основой для их последующего осознанного обнаружения. Однако в обратной конфигурации, когда скачок служил стандартом, осознанное различение было зарегистрировано в отсутствие выраженного потенциала MMN.
Имеющиеся в литературе исследования мозговых ритмов указывают, что акустическая oddball-стимуляция может приводить как к усилению медленных ВК, так и к реорганизации их фазы при предъявлении девиантов (Herrmann et al., 2014). Вызванные потенциалы на стандарт и девиант можно рассматривать как результат изменений колебательной активности мозга, которая модулируется двумя независимыми факторами: физическими свойствами стимулов (в нашем случае это неподвижный сигнал и скачок) и их контекстными ролями (стандарт или девиант). Сравнивая между собой ответы на разные стандарты, можно оценить различия колебательной активности, связанные с физическими свойствами стимулов, т.е. преимущественно с восходящей сенсорной обработкой поступающих сигналов.
Сравнивая полученные нами ЧВП реакций на стандарты и девианты, следует прежде всего подчеркнуть, что различия в реакциях в большой степени связаны с разной фазовой подстройкой в ответ на разные типы стимулов – неподвижный и скачок. Независимо от роли в потоке стимулов, скачок вызывал максимальную подстройку фазы в тета- и альфа-диапазонах с латентностью около 200 мс от включения, т.е. через 100 мс после скачка в сигнале. В ответах на неподвижные стимулы в этом временном интервале наблюдаются меньшие значения ITC для тех же диапазонов частот.
Необходимо также отметить, что различия, наблюдавшиеся между ответами на стандарты и девианты в oddball-парадигме, не исчерпывались различиями ответов на скачок и неподвижный стимул в роли стандартов. При предъявлении скачка в роли девианта увеличение когерентности медленных колебаний по сравнению с реакцией на неподвижный сигнал было гораздо большим (практически в два раза), чем при его действии в роли стандарта. В ответ на неподвижный девиант на фоне движущихся стандартов мощность альфа-колебаний падает, а степень синхронизации не меняется по сравнению с реакцией на неподвижный стандарт. Другими словами, наблюдаемые нами различия когерентности в реакциях на неподвижный стимул и скачок в роли стандартов усиливаются при их предъявлении в роли девиантов.
Предположительно, различия в степени когерентности ВК в реакциях на два типа стандартов являлись определяющими для предсознательного различения сигналов в двух противоположных конфигурациях. Когда на фоне неподвижного стандарта предъявлялся девиант-скачок, возникала дополнительная синхронизация медленных ВК, и вследствие этого формировалась значимая MMN как результат усреднения когерентных ВК одиночных эпох. В обратной конфигурации, при предъявлении неподвижного девианта, происходила десинхронизация медленных ВК, и усреднение слабо когерентных ВК не позволяло наблюдать суммарный потенциал. Однако можно предположить, что вызванное неподвижным девиантным стимулом снижение когерентности является достаточным условием для предсознательного различения (не нашедшего отражения в MMN), которое может стать основой для формирования поведенческого ответа. Выполненное ранее психофизическое тестирование показывало вполне уверенное различение пространственных признаков звука в обратной конфигурации (Шестопалова и др., 2017).
Отдельно следует остановиться на степени вовлеченности разных нейрональных ритмов в процессы предсознательного различения. К настоящему времени в литературе имеется единственная обобщающая гипотеза относительно спектрального возмущения (ERSP), вызванного предъявлением девиантного стимула (Herrmann et al., 2014). Гипотеза состоит в том, что ранние (20–80 мс) ВК гамма-диапазона (около 40 Гц) отражают совпадение поступающей при предъявлении стандартов акустической информации с содержанием сенсорной памяти. В ряде работ установлено, что в реакции на девианты гамма-колебания отсутствуют или они намного слабее, чем в реакции на стандарты (Yabe et al., 2005; Schadow et al., 2007, 2009; Kaiser, Lutzenberger, 2005). С другой стороны, поздние ВК тета-диапазона (150–200 мс) предположительно отражают несовпадение обнаруженных признаков девиантных стимулов со сформировавшимся сенсорным следом (Fuentemilla et al., 2008; Lin et al., 2007, Hsiao et al., 2009; Ko et al., 2012). Таким образом, данная гипотеза напрямую связывает генерацию гамма- и тета-колебаний со структурой последовательности, безотносительно характеристик самих сигналов. Следовательно, в рамках этой гипотезы при смене конфигурации на противоположную должна по-прежнему наблюдаться генерация ранних гамма- и поздних тета-колебаний при действии поменявшихся ролями стандартов и девиантов.
Согласно нашим результатам, достоверные различия между ERSP в реакциях на стандарты и девианты в тета- и гамма-полосах обнаружены только в обратной конфигурации, когда стандартом служил скачок. Однако ослабление гамма-частот при предъявлении неподвижных девиантов было статистически значимым не в раннем временном интервале, как предсказывает гипотеза, а в позднем, между 234 и 376 мс, причем этот промежуток перекрывал интервал достоверности различий ERSP в тета-полосе (рис. 4). В раннем интервале (менее 100 мс) ослабление гамма-колебаний тоже имело место, но не достигало уровня значимости. В прямой конфигурации различий между ERSP в реакциях на стандарты и девианты не обнаружено ни в тета-, ни в гамма-полосе. Таким образом, изменения спектральной мощности в oddball-парадигме определялись преимущественно пространственными признаками девиантных и стандартных стимулов (см. выше) и кардинально зависели от смены ролей. Предъявление скачка в качестве повторяющегося стандарта приводило к появлению гамма-колебаний на протяжении значительной части эпохи анализа, а в случае неподвижного стандарта ничего подобного не происходило. Предъявление скачка в качестве девианта вызывало усиление тета-колебаний по сравнению с действием неподвижного стандарта.
Накопленные в литературе экспериментальные данные относительно фазовой подстройки (ITC) указывают, что при действии девиантных стимулов возрастает когерентность медленных колебаний, особенно в тета-диапазоне (Lin et al., 2007; Fuentemilla et al., 2008; Hsiao et al., 2009; Ko et al., 2012; Zhang et al., 2019). Иными словами, существующая гипотеза связывает когерентность тета-колебаний с предсознательным обнаружением девиантных стимулов. Настоящее исследование показало, что в прямой конфигурации когерентность медленных ВК действительно возрастает, но наиболее выраженная реорганизация фазы происходила в альфа-, а не в тета-полосе. В нижнем и верхнем альфа-диапазоне ITC при предъявлении девианта-скачка была достоверно выше, чем при действии неподвижного стандарта. В тета-полосе наблюдалась аналогичная тенденция, но без статистически значимых различий. В то же время в обратной конфигурации более высокая когерентность возникала при действии скачка в роли стандарта, причем этот эффект достигал значимости только в верхнем альфа-диапазоне. Следовательно, как и в случае ERSP, существующая в литературе интерпретация функциональной роли различных ритмов мозга в ходе предсознательного различения стимулов не выдерживает проверки сменой структуры последовательности на противоположную.
До некоторой степени удивительным представляется обнаруженное нами преобладание фазовых эффектов в альфа-, а не в тета-диапазоне, как можно было ожидать на основании данных литературы (Wang et al., 2018; Clouter et al., 2017; Yan et al., 2017; Roberts et al., 2018). Поскольку усиление когерентности альфа-колебаний наблюдалось только в прямой конфигурации, оно не могло быть связано с временной структурой последовательности (она одинаковая в обеих конфигурациях) или с бинауральной природой пространственных признаков. Синхронизация альфа-частот возникала при предъявлении девианта-скачка в контексте неподвижных стандартов, но не наоборот. Следовательно, можно предположить, что именно наличие динамических изменений девиантного стимула явилось причиной фазовой подстройки в более высокочастотном диапазоне, чем описано в большинстве работ. Однако в ряде работ, использовавших изменения длительности коротких стимулов (менее 100 мс) либо стимулы с динамическими изменениями (Fuentemilla et al., 2008; Hsiao et al., 2009; Ko et al., 2012; Granados et al., 2018), описана максимальная выраженность подстройки именно тета-полосы. Поэтому маловероятно, что быстрые изменения в сигнале сами по себе могли привести к сдвигу фазовых эффектов в сторону альфа-диапазона.
Другое важное отличие прямой конфигурации от обратной состоит в том, что только при действии девианта-скачка формируется выраженный позитивный компонент P3a (рис. 1), отсутствующий в случае неподвижного девианта. Этот компонент считается индикатором непроизвольного переключения внимания и может отражать как сенсорные, так и когнитивные аспекты сенсорного события (Barcelo et al., 2006; Friedman et al., 2001; Polich, 2007). Ранее мы уже описывали особенности генерации P3a при использовании скачка в качестве девианта (Шестопалова и др., 2015). В настоящем исследовании латентность P3a составила около 320 мс, а следовательно, развитие процессов переключения внимания перекрывалось по времени с интервалом достоверности фазовых различий стандарт-девиант в альфа-диапазоне.
Как известно, колебания альфа-диапазона считаются отражением ритмических флуктуаций деполяризации мембран тормозных нейронов, и синхронизация альфа-колебаний традиционно интерпретировалась как показатель работы мозга в режиме покоя, при минимальной информационной нагрузке (Klimesch et al., 2007). Поэтому усиление альфа-активности в ходе интенсивных когнитивных процессов, связанных с различением акустических сигналов при одновременном чтении книги, может представляться несколько парадоксальным. Однако, согласно современным представлениям, альфа-колебания связаны с активизацией нисходящего (top-down) контроля, и их роль как тормозного фильтра состоит в функциональном торможении определенных зон коры. Усиление альфа-колебаний в связи с вовлечением рабочей памяти и внимания приводит к избирательному подавлению обработки, не относящейся к основной задаче информации, тем самым способствуя формированию высокоизбирательной нейронной сети (Lenartowicz et al., 2018; Deiber et al., 2020). Наблюдавшаяся реорганизация фазы ВК вероятнее всего отражает перестройку возбудимости областей коры, обеспечивающих пространственное различение в oddball-парадигме. Состояние возбуждения или торможения согласованно изменяется точно в тех временных интервалах, где восходящая сенсорная обработка взаимодействует с нисходящими процессами. Фазовая перестройка альфа-частот, ответственная частично за рост амплитуды вызванных потенциалов, обеспечивает таким образом точное временное согласование процессов предсознательного различения.
Основные ограничения настоящего исследования связаны с небольшим размером выборки (n = 8). Чтобы выяснить, насколько универсальными являются обнаруженные нами закономерности, следует провести эксперименты в oddball-парадигме на большей выборке и с использованием других видов звуковых стимулов, например, различающихся по интенсивности, по спектральному составу или положению в пространстве. Важное значение при этом будут иметь различия реакций на стандартные стимулы, определяющие акустический контекст.
ЗАКЛЮЧЕНИЕ
Проведенное исследование не подтверждает имеющуюся в литературе гипотезу относительно связи генерации гамма- и тета-колебаний со структурой oddball-последовательности, предполагающую, что ранние ВК гамма-диапазона отражают совпадение поступающей информации с содержанием сенсорной памяти, а поздние ВК тета-диапазона отражают их несовпадение. Генерация ВК в условиях обратной oddball-стимуляции не соответствовала этой концепции.
Наблюдавшиеся различия в синхронизации низкочастотных колебаний были связаны не только с реакцией мозга на совпадение и несовпадение, но и с конкретным стимульным контекстом. Влияние контекста могло определяться как восходящей сенсорной обработкой стандартов и девиантов, так и нисходящими процессами, повышающими эффективность нейронной сети при решении определенной задачи.
Результаты исследования указывают на то, что объективным показателем различения движущихся звуковых стимулов в oddball-парадигме можно считать степень фазовой когерентности медленных колебаний. В прямой конфигурации предсознательному различению соответствовал выраженный рост когерентности медленных колебаний, который, вероятно, послужил основой формирования MMN. В обратной конфигурации показателем обнаружения девиантов являлось падение когерентности (десинхронизация) альфа-диапазона и в меньшей степени – тета-диапазона. Успешное психофизическое различение девиантов в потоке стандартов было получено в обеих конфигурациях. Предположительно, вызванные стимулом синхронизация и десинхронизация медленных колебаний отражают взаимодействие восходящих и нисходящих процессов, необходимое для формирования поведенческого ответа.
Список литературы
Альтман Я.А., Вайтулевич С.Ф., Варфоломеев А.Л., Петропавловская Е.А., Шестопалова Л.Б. Негативность рассогласования как показатель различительной локализационной способности слуховой системы человека. Физ. Чел. 2007. 33 (5): 22–30.
Шестопалова Л.Б., Петропавловская Е.А. Негативность рассогласования и пространственный слух. Успехи физиологических наук. 2019. 50 (3):14–33.
Шестопалова Л.Б., Петропавловская Е.А., Вайтулевич С.Ф., Никитин Н.И. Активное и пассивное различение движущихся звуковых стимулов: суммарные реакции мозга человека. Росс. физиол. журн. им. И.М. Сеченова. 2015. 101 (9): 1079–1091.
Шестопалова Л.Б., Петропавловская Е.А., Семенова В.В., Никитин Н.И., Вайтулевич С.Ф. Влияние акустического контекста на перцептивные различия пространственных звуковых сигналов. Физ. Чел. 2017. 43 (6): 1–11.
Шестопалова Л.Б., Петропавловская Е.А., Семенова В.В., Никитин Н.И. Ритмическая активность мозга человека, связанная с движением звуковых стимулов. Журнал высш. нервн. деят. им. И.П. Павлова. 2020. 70 (5): 616–634. https://doi.org/10.31857/S0044467720050111
Barcelo F., Escera C., Corral M.J., Periáñez J.A. Task switching and novelty processing activate a common neural network for cognitive control. J Cognitive Neurosci. 2006. 18: 1734–1748.
Bendixen A., SanMiguel I., Schröger E. Early electrophysiological indicators for predictive processing in audition: a review. Int J Psychophysiol. 2012. 83: 120–131.
Bishop D.V.M., Hardiman M.J. Measurement of mismatch negativity in individuals: a study using single-trial analysis. Psychophysiology. 2010. 47: 697–705.
Canolty R.T., Edwards E., Dalal S.S., Soltani M., Nagarajan S.S., Kirsch H.E., Berger M.S., Barbaro N.M., Knight R.T. High gamma power is phase-locked to theta oscillations in human neocortex. Science. 2006. 313: 1626–1628.
Clouter A., Shapiro K.L, Hanslmayr S. Theta Phase Synchronization Is the Glue that Binds Human Associative Memory. Curr Biol. 2017. 27 (20): 3143–3148. https://doi.org/10.1016/j.cub.2017.09.001
Deiber M.-P., Hasler R., Colin J., Dayer A., Aubry J.-M., Baggio S., Perroud N., Ros T. Linking alpha oscillations, attention and inhibitory control in adult ADHD with EEG neurofeedback. NeuroImage: Clinical. 2020. 25: 1021–45. https://doi.org/10.1016/j.nicl.2019.102145
Delorme A., Sejnowski T., Makeig S. Enhanced detection of artifacts in EEG data using higher-order statistics and independent component analysis. Neuroimage. 2007. 34 (4): 1443–1449. https://doi.org/10.1016/j.neuroimage.2006.11.004
Demiralp T., Bayraktaroglu Z., Lenz D., Junge S., Busch N.A., Maess B., Ergen M., Herrmann C.S. Gamma amplitudes are coupled to theta phase in human EEG during visual perception. Int J Psychophysiol. 2007. 64: 24–30.
Friedman D., Cycowicz Y.M., Gaeta H. The novelty P3: an event-related brain potential (ERP) sign of the brain’s evaluation of novelty. Neurosci Biobehav R. 2001. 25: 355–373.
Fuentemilla L., Marco-Pallare’s J., Münte T.F., Grau C. Theta EEG oscillatory activity and auditory change detection. Brain Res. 2008. 1220: 93–101.
Granados D., Lugo S.Z., Morales P.T., Castañeda-Villa N. Time-frequency analysis of Mismatch Negativity (MMN) in healthy Mexican preschool children. Revista Mexicana de Neurociencia. 2018. 20 (3): 21–34. https://doi.org/10.31190/rmn.2018.19.3.21.34
Hanslmayr S., Staresina B.P., Bowman H. Oscillations and Episodic Memory: Addressing the Synchronization/Desynchronization Conundrum. Trends Neurosci. 2016. 39 (1):16–25. https://doi.org/10.1016/j.tins.2015.11.004
Herrmann C.S., Busch N.A., Grigutsch M. EEG oscillations and wavelet analysis. In: Handy T.C. (ed.) Event-related potentials: a methods handbook. 2005. MIT Press, Cambridge. 229–259.
Herrmann C.S., Rach S., Vosskuhl J., Strüber D. Time–Frequency Analysis of Event-Related Potentials: A Brief Tutorial. Brain Topogr. 2014. 27: 438–450.
Hsiao F.J., Wu Z.A., Ho L.T., Lin Y.Y. Theta oscillation during auditory change detection: An MEG study. Biol. Psychol. 2009. 81: 58–66.
Kaiser J., Lutzenberger W. Human gamma-band activity: a window to cognitive processing. NeuroReport. 2005. 16: 207–211.
Klimesch W., Sauseng P., Hanslmayr S. EEG alpha oscillations: the inhibition-timing hypothesis. Brain Res. Rev. 2007. 53: 63–88.
Ko D., Kwon S., Lee G.-T. Im C.H., Kim K.H., Jung K.-Y. Theta oscillation related to the auditory discrimination process in mismatch negativity: oddball versus control paradigm. J Clin Neurol. 2012. 8: 35–42.
Lenartowicz A., Mazaheri A., Jensen O., Loo S.K. Aberrant modulation of brain oscillatory activity and attentional impairment in ADHD. Biol Psychiatry Cogn Neurosci Neuroimaging. 2018. 3 (1): 19–29. https://doi.org/10.1016/j.bpsc.2017.09.009
Lin Y.-Y., Hsiao F.-J., Shih Y.-H., Yiu C.-H., Yen D.-J., Kwan S.-Y., Wong T.-T., Wu Z.-A., Ho L.-T. Plastic phase-locking and magnetic mismatch response to auditory deviants in temporal lobe epilepsy. Cereb Cortex. 2007. 17: 2516–2525.
Makeig S., Debener S., Onton J., Delorme A. Mining event-related brain dynamics. Trends Cogn. Sci. 2004. 8 (5): 204–210. https://doi.org/10.1016/j.tics.2004.03.008
Näätänen R., Paavilainen P., Rinne T., Alho K. The mismatch negativity (MMN) in basic research of central auditory processing: A review. Clin. Neurophysiol. 2007. 118: 2544–2590.
Polich J. Updating P300: an integrative theory of P3a and P3b. Clin Neurophysiol. 2007. 118: 2128–2148.
Roberts B.M., Clarke A., Addante R.J., Ranganath C. Entrainment enhances theta oscillations and improves episodic memory. Cogn. Neurosci. 2018. 9 (3–4): 181–193. https://doi.org/10.1080/17588928.2018.1521386
Saberi K., Hafter E.R. In: Binaural and spatial hearing in real and virtual environments. Gilkey R.H., Anderson T.R. (Eds.). NJ. Erlbaum Publ. 1997. 315.
Sauseng P., Griesmayr B., Freunberger R., Klimesch W. Control mechanisms in working memory: A possible function of EEG theta oscillations. Neurosci. Biobehav. Rev. 2010. 34: 1015–1022.
Schadow J., Lenz D., Dettler N., Fründ I., Herrmann C.S. Early gamma-band responses reflect anticipatory top-down modulation in the auditory cortex. Neuroimage. 2009. 47: 651–658.
Schadow J., Lenz D., Thaerig S., Busch N.A., Fründ I., Herrmann C.S. Stimulus intensity affects early sensory processing: sound intensity modulates auditory evoked gamma-band activity in human EEG. Int. J. Psychophysiol. 2007. 65: 152–161.
Shestopalova L.B., Petropavlovskaia E.A., Semenova V.V., Nikitin N.I. Lateralization of brain responses to auditory motion: A study using single-trial analysis. Neuroscience Research. 2020. https://doi.org/10.1016/j.neures.2020.01.007
Shestopalova L.B., Petropavlovskaia E.A., Vaitulevich S.Ph., Nikitin N.I. Contextual effects on preattentive processing of sound motion as revealed by spatial MMN. Int. J. Psychophysiol. 2015. 96: 49–56. https://doi.org/10.1016/j.ijpsycho.2015.02.021
Shestopalova L.B., Petropavlovskaia E.A., Vaitulevich S.Ph., Vasilenko Yu.A., Nikitin N.I., Altman J.A. Discrimination of auditory motion patterns: mismatch negativity study. Neuropsychologia. 2012. 50: 2720–2729. http://dx.doi.org/.neuropsychologia.2012.07.043.https://doi.org/10.1016/j
Yabe H., Sutoh T., Matsuoka T., Asai R., Hiruma T., Sato Y., Iwasa H., Kaneko S. Transient gamma-band response is dissociated from sensory memory as reflected by MMN. Neurosci Lett. 2005. 380: 80–82.
Yan T., Feng Y., Liu T., Wang L., Mu N., Dong X., et al. Theta oscillations related to orientation recognition in unattended condition: A vMMN study. Frontiers in Behav. Neurosci. 2017. 11: 166. https://doi.org/10.3389/fnbeh.2017.00166
Yordanova J., Kolev V., Kirov R. Brain oscillations and predictive processing. Front Psychol. 2012. 3: 416.
Wang D., Clouter A., Chen Q., Shapiro K.L., Hanslmayr S. Single-Trial Phase Entrainment of Theta Oscillations in Sensory Regions Predicts Human Associative Memory Performance. J. Neurosci. 2018. 38 (28): 6299–6309. https://doi.org/10.1523/JNEUROSCI.0349-18.2018
Zhang Z., Guo G., Zhang J., Li C., Huang Q., Go R., Fukuyama H., Funahashi S., Yan T., Wu J. Do theta oscillations explain the somatosensory change detection mechanism? Biol. Psychol. 2019. 143: 103–112. https://doi.org/10.1016/j.biopsycho.2019.02.001
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


