Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 5, стр. 680-689
Влияние даларгина на изменение тревожности у крыс с различными индивидуально-типологическими особенностями поведения в модели ПТСР
О. Г. Семенова 1, *, А. В. Вьюшина 1, А. В. Притворова 1, В. В. Ракицкая 1, Н. Э. Ордян 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: SemenovaOG@infran.ru
Поступила в редакцию 09.07.2020
После доработки 05.02.2021
Принята к публикации 02.03.2021
Аннотация
В Т-образном лабиринте из общей популяции крыс-самцов линии Вистар по индексам поведенческой активности (ИПА) и пассивности (ИПП) отбирали активных и пассивных животных, которые в ПКЛ были разделены на группы низкотревожных (активные (АНТ), пассивные (ПНТ)) и высокотревожных (активные (АВТ), пассивные (ПВТ)). Для формирования экспериментального аналога ПТСР использовали водно-иммерсионное воздействие в парадигме “стресс-рестресс”. Через 20 сут после первого стресса опытным крысам в течение недели внутримышечно вводили раствор даларгина в дозе 0.1 мг/кг, а контрольным – физиологический раствор в эквивалентном объеме. Спустя 2 сут после недельного курса инъекций все животные были протестированы в ПКЛ. В модели ПТСР у АНТ крыс наблюдалось только снижение общей моторно-исследовательской активности, воздействие даларгина в модели ПТСР способствовало повышению у них реактивной тревожности. У АВТ крыс в модели ПТСР одновременно с уменьшением общей моторно-исследовательской активности усилилась их исходно высокая тревожность, а даларгин оказал на этих животных антистрессорное воздействие. У ПНТ крыс в модели ПТСР уменьшилась общая моторно-исследовательская активность и повысилась реактивная тревожность, инъекции даларгина ускорили и усилили развитие ПТСР-подобного состояния. У ПВТ крыс в модели ПТСР заметного изменения поведенческих характеристик не наблюдалось, инъекции даларгина видимого влияния на поведение этих животных в ПКЛ тоже не оказали.
Основная роль в адаптационных процессах, восстанавливающих гомеостаз организма после стрессорного воздействия, принадлежит кортикостероидам, секреция которых в результате стресс-реакции усиливается. Сильный или хронический стресс способен привести к серьезному нарушению гормональной функции гипофизарно-адренокортикальной системы (ГАС) с последующим развитием постстрессорных психопатологий. Развитие постстрессорного депрессивного расстройства связывают с гиперактивацией ГАС в результате снижения чувствительности мозговых структур к кортикостероидам (в первую очередь гиппокампа) и возникающего вследствие этого нарушения регуляции механизмами “обратной связи” (Шаляпина, 2005; Belanoff et al., 2001; Osterlund et al., 2016; Young, Vazquez, 1996). Посттравматическое стрессовое расстройство (ПТСР) характеризуется, наоборот, снижением гормональной функции ГАС в связи с развитием ее гиперчувствительности к сигналам “обратной связи” и включением быстрого глюкокортикоидного торможения, что уже на ранних стадиях нарушает нормальную динамику реакции ГАС и ее адаптивные функции (Рыбникова и др., 2010; Deslauriers et al., 2018; Liberzon et al., 1997; Moulton et al., 2018; Yehuda, Antelman, 1993). В обоих случаях существует опасность разрушения стероид-чувствительных структур мозга (Bremner, 2006; Kino, 2015) либо при длительном повышении уровня кортикостероидов в случае развития постстрессорного депрессивного состояния, либо в результате внезапного повышения стрессореактивности ГАС с интенсивным выбросом гормонов в кровь у пациентов с ПТСР. Одним из эндогенных факторов, ограничивающих развитие стрессорной реакции и включающих центральные и периферические механизмы адаптации, являются эндогенные опиоидные пептиды (Ласукова, Маслов, 2007; Лишманов и др., 2012; Маслов и др., 2002; Французова и др., 2010). Известно, что опиоидная система тесно взаимодействует с кортиколиберинергическими структурами гипоталамуса и всеми моноаминергическими подкорковыми системами, притормаживая секрецию кортиколиберина и норадреналина (Шаляпина, 2005). Одновременно при стрессорном воздействии массивный выброс катехоламинов сопровождается увеличением содержания β-эндорфина в крови (Соколова и др., 2002). Хорошо известна способность опиоидов при стрессе ограничивать гистотоксическое действие катехоламинов (Соколова и др., 2002) и снижать уровень кортикостероидов в крови (Лишманов и др., 2012), блокируя выведение последних из коры надпочечников. Предполагается, что стресс-лимитирующий эффект опиоидов связан с активацией периферических опиоидных рецепторов (Ласукова, Маслов, 2007; Лишманов и др., 2012). Синтетический аналог лей-энкефалина фармакологический препарат “Даларгин” плохо проникает через гематоэнцефалический барьер, не вызывает физической зависимости (Лишманов и др., 2012; Маслов и др., 2002) и взаимодействует преимущественно с µ- и δ-опиоидными рецепторами (Ласукова, Маслов, 2007; Лихванцев и др., 2012; Маслов и др., 2002). В условиях хронического стресса даларгин предупреждает истощение депо катехоламинов и глюкокортикоидов в надпочечниках, ограничивает проявление стресс-реакции и повышает выживаемость животных в экстремальных условиях (Лихванцев и др., 2012; Лишманов и др., 2012; Французова и др., 2010).
В основе поведенческой стратегии лежит вовлечение разных медиаторов возбуждающего или тормозного характера (Шаляпина, 2005). У пассивных животных в регуляторной системе преобладают тормозные механизмы, связанные с усилением регуляции ГАС-сигналами обратной связи, что объясняет малоподвижность и низкую пластичность их стресс-системы (Шаляпина, 2005; Шаляпина и др., 2006б). У активных особей в системе регуляции ГАС преобладают возбудительные механизмы (Семенова и др., 2018; Шаляпина и др., 2006б). Кривая гормонального стрессорного ответа у этих животных характеризуется более быстрым и высоким подьемом и более медленным снижением (Шаляпина, Ракицкая, 2003). Высокий уровень кортикостероидов обеспечивает активным особям яркое восприятие внешних стимулов, хотя в условиях хронического стресса может стать основой длительной гиперкортизолемии (Belanoff et al., 2001) с последующим нарушением механизмов “обратной связи” и развитием психопатологии.
Общая популяция крыс состоит из неравномерных групп, различающихся по показателям поведенческой активности и тревожности. Мы предполагаем, что влияние даларгина на эти группы в модели ПТСР будет отличаться. В задачу данного исследования входило изучение влияния даларгина в модели ПТСР “стресс-рестресс” на постстрессорную тревожность у крыс, различающихся по показателям поведенческой активности и тревожности.
МЕТОДИКА
Работа проведена на животных из биоколлекции “Коллекция лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН. В исследовании использовали крыс-самцов линии Вистар весом 250–280 г, в возрасте 2.5 мес, с соблюдением рекомендаций по этике работы с животными (Directive 2010/63/ЕU of the European Parliament and of the Council on the protection of animals used for scientific purposes). Животные содержались в пластиковых клетках, по 6 штук, на стандартной диете при свободном доступе к воде и пище и при обычном 12-часовом световом режиме. Поведенческие тесты проводились в период с 13 до 17 ч.
После недельного периода адаптации к условиям лаборатории у крыс определяли стратегию приспособительного поведения в Т-образном лабиринте (Шаляпина и др., 2006а). Лабиринт выполнен из непрозрачного пластика с прозрачной верхней крышкой для наблюдения и состоит из трех рукавов, два из которых образуют основной коридор (140 × 10 × 15 см), разделенный посередине перпендикулярно расположенным третьим рукавом (19 × 4 × 4 см). Крыса входит в лабиринт через средний рукав, время нахождения в котором фиксируется как латентный период. Для облегчения задачи анализа соотношения поведенческих показателей и определения стратегии приспособительного поведения была использована статистико-вероятностная модель, рассматривающая поведенческую активность и пассивность как функцию времени (Великжанин, 2004). Были предложены нормированные индексы поведенческой активности (ИПА) и поведенческой пассивности (ИПП), которые определяли у каждого животного по результатам тестирования в Т-образном лабиринте (Шаляпина и др., 2006а). К поведенческой активности относили все формы вертикальной и горизонтальной активности, исключая груминг, а ИПА рассчитывали как процент времени, когда животное совершало побежки, стойки и двигалось на месте (за исключением груминга), от общего времени наблюдения (ИПА = (180 – – (LP + tN + Gr)) × 100/180; где 180 – общее время наблюдения, с; LP – латентный период входа в лабиринт, с; tN – время неподвижности, с; Gr – продолжительность реакции груминга, с). ИПП рассчитывали как процент времени, когда животное было неподвижно, от общего времени тестирования (ИПП = = (LP + tN) × 100/180; где 180 – общее время наблюдения, с; LP – латентный период входа в лабиринт, с; tN – время неподвижности, с). Поскольку распределения полученных индексов резко асимметричны, данные были прологарифмированы и на их основании рассчитаны границы групп. В качестве границ групп были взяты 25%-ные квантили и среднее, которые делят распределение на части: Х1 = М – 0.67SD, X2 = M ± SD, X3 = M + + 0.67SD, где М – среднее значение, а SD – среднее квадратичное отклонение (стандартное отклонение). По рассчитанным индексам из всех протестированных крыс были отобраны животные с высокой (интервал значений ИПА от 85 до 100%, интервал значений ИПП от 0 до 4.6%) и низкой активностью (интервал значений ИПА от 70 до 0%, интервал значений ИПП от 15 до 100%). Таким образом, из взятой в эксперимент популяции крыс (n = 140) были отобраны группы активных (n = 56) и пассивных (n = 36) особей, а животные, не входящие в их число, были удалены.
Для определения исходного уровня тревожности крысы были протестированы в приподнятом крестообразном лабиринте (ПКЛ), установка которого состояла из двух открытых и двух закрытых рукавов размерами 50 × 14 и 50 × 14 × 33 см соответственно, соединенных центральной площадкой размером 14 × 14 см. Лабиринт был приподнят над уровнем пола на высоту 60 см. Во время тестирования открытые рукава лабиринта дополнительно освещались лампами 40 Вт, расположенными на высоте 30 см. В течение 5 мин регистрировали время нахождения животных в открытых (ОР) и закрытых (ЗР) рукавах ПКЛ, продолжительность реакции замирания, частоту дефекаций. Известно, что продолжительность нахождения особей в ОР ПКЛ обратно пропорциональна уровню тревожности, а паттерн “замирание” характеризует уровень тревожности и страха (Pellow et al., 1985; Rodgers, Johnson, 1995). По результатам тестирования в ПКЛ были сформированы группы, различающиеся по уровню тревожности: активные низкотревожные (АНТ, n = 27); активные высокотревожные (АВТ, n = 29); пассивные низкотревожные (ПНТ, n = 18); пассивные высокотревожные (ПВТ, n = 18). Поведенческие характеристики АНТ, АВТ, ПНТ и ПВТ животных представлены в табл. 1. Результаты выражены через Mean ± SEM, анализ данных был сделан с применением t-критерия Стьюдента. Уровень общей моторно-исследовательской активности оценивался по сумме показателей (общая моторно-исследовательская активность = N1 + N2 + N3 + N4 + + N5 + N6 ; где N1 – число заходов в ОР ПКЛ; N2 – число заходов в ЗР ПКЛ, N3 – число выглядываний из ЗР ПКЛ; N4 – количество реакций свешивания с ОР ПКЛ; N5 – число вертикальных стоек; N6 – число переходов через центр ПКЛ). Каждая группа была разделена на три подгруппы, равнозначные по показателям реактивной тревожности и общей моторно-исследовательской активности: 1 подгруппа – контроль 1, К1 (интактные крысы), 2 подгруппа – активный контроль 2, К2 (стресс-рестресс + инъекции физиологического раствора) и 3 подгруппа – Опыт (стресс-рестресс + инъекции даларгина).
Таблица 1.
Поведенческие характеристики активных (АНТ, АВТ) и пассивных (ПНТ, ПВТ) крыс в приподнятом крестообразном лабиринте (ПКЛ) Table 1. Behavioral characteristics of active (ALA, AHA) and passive (PLA, PHA) rats in the elevated plus maze (EPM)
| Показатели поведения | АНТ, n = 27 | АВТ, n = 29 | ПНТ, n = 18 | ПВТ, n = 18 |
|---|---|---|---|---|
| Время нахождения в ОР ПКЛ, с | 18.3 ± 6.6 | 0* | 12.9 ± 3.1 | 0** |
| Время нахождения в ЗР ПКЛ, с | 268.9 ± 8.0 | 293.8 ± 3.0* | 272.0 ± 7.0 | 295.2 ± 1.8** |
| Σ продолжительность реакции замирания, с | 2.3 ± 1.3 | 25.3 ± 9.1* | 17.6 ± 12.7 | 39.5 ± 16.7 |
| Частота дефекации, n | 0 | 1.8 ± 0.8* | 0 | 4.3 ± 1.5** |
| Число заходов в ОР ПКЛ, n | 2.4 ± 0.5 | 0* | 1.9 ± 0.4 | 0** |
| Число заходов в ЗР ПКЛ, n | 7.3 ± 1.2 | 5.2 ± 0.4* | 5.3 ± 0.7 | 3.5 ± 0.5** |
| Число реакций свешиваний с ОР ПКЛ, n | 2.7 ± 0.8 | 0* | 1.5 ± 0.6 | 0** |
| Число стоек, n | 18.8 ± 2.9 | 16.5 ± 2.0 | 14.2 ± 1.8 | 12.6 ± 2.5 |
| Число выглядываний из ЗР ПКЛ, n | 7.6 ± 1.2 | 4.8 ± 0.6* | 5.6 ± 1.1 | 1.8 ± 0.6** |
| Число переходов через центр ПКЛ, n | 1.8 ± 0.5 | 0* | 1.3 ± 0.4 | 0** |
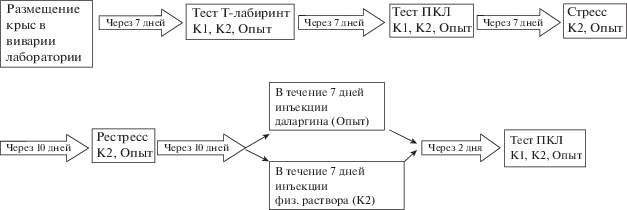
Для формирования экспериментального аналога ПТСР использовали водно-иммерсионное воздействие в парадигме стресс-рестресс: опытных и животных из группы активного контроля (К2) жестко фиксировали в железных пеналах и погружали по шею на 1 ч в воду (16°С), через 10 сут повторная процедура длилась в течение 30 мин. Тяжесть первого стресса по температурному режиму и продолжительности была экспериментально подобрана в предыдущих исследованиях с целью предотвращения летальных исходов в группе пассивных животных (Шаляпина и др., 2006 а,б). Согласно проведенным в нашей лаборатории исследованиям через 20 сут после первого стресса у животных формируется ПТСР-подобное состояние. Поэтому через 20 сут после первого стресса опытным крысам в течение недели один раз в день внутримышечно вводили раствор даларгина в дозе 0.1 мг/кг, а животным из группы К2 – физиологический раствор в эквивалентном объеме. Следует отметить, что при системном введении в дозах до 1 мг/кг даларгин не проникает через гематоэнцефалический барьер (Лишманов и др., 2012; Маслов и др., 2002) и взаимодействует с опиоидными рецепторами только на периферии. Спустя 2 сут после недельного курса инъекций все животные были протестированы в ПКЛ. На рис. 1 представлена схема опыта.
Рис. 1.
Схема опыта. Примечание: К1 – подгруппа 1 (интактные крысы), К2 – подгруппа 2 (стресс-рестресс + инъекции физиологического раствора), Опыт – подгруппа 3 (стресс-рестресс + инъекции даларгина).
Fig. 1. Experiment scheme. Note: K1 – subgroup 1 (intact rats), K2 – subgroup 2 (stress-restress + injections saline), Experiment – subgroup 3 (stress-restress + injections dalargin).
Статистическая обработка полученных результатов производилась с использованием пакета программ STATISTICA 8.0 (StatSoft Inc.). Сравнение проводилось между подгруппами К1 (интактные крысы) и К2 (стресс-рестресс + иньекции физиологического раствора), а также между подгруппами К2 и Опыт (стресс-рестресс + инъекции даларгина) отдельно для каждой из групп – АНТ, АВТ, ПНТ и ПВТ. Данные анализировали с помощью t-критерия Стьюдента или непараметрического U-теста Манна–Уитни после того, как была проведена оценка нормальности распределения значений в выборках с помощью критерия Шапиро–Уилкса. Данные представлены в виде средних (Mean) и стандартных ошибок среднего (SEM), а также медиан (Me) и интерквартильного размаха (IQR) между значениями 25 и 75 перцентилей. Различия считались статистически значимыми при p < 0.05, при 0.05 ≤ p ≤ 0.1 отмечали наличие тенденции.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Группа АНТ. Сравнение подгрупп К2 и К1. У АНТ крыс в модели ПТСР снизилась общая моторно-исследовательская активность (р < < 0.05) и увеличилась продолжительность реакции замирания (р < 0.05), тогда как время нахождения в ОР ПКЛ (р = 0.284) и частота дефекаций (р = 0.17) не изменились (табл. 2).
Таблица 2.
Поведенческие характеристики активных низкотревожных (АНТ) крыс при тестировании в приподнятом крестообразном лабиринте (ПКЛ) Table 2. Behavioral characteristics of active low-anxiety (ALA) rats in the elevated plus maze (EPM)
| Показатели поведения | К1, n = 10 | К2, n = 9 | Опыт, n = 8 |
|---|---|---|---|
| Время нахождения в ОР ПКЛ, с | 14.2 ± 1.5 | 10.8 ± 3.9 | 1.8 ± 0.4** |
| Время нахождения в ЗР ПКЛ, с | 272.6 ± 3.4 | 269.7 ± 14.2 | 289.6 ± 2.6 |
| Σ продолжительность реакции замирания, с | 2.4 ± 0.5 | 17.1 ± 3.3* | 77.5 ± 9.1** |
| Частота дефекации, n | 0.0 (0–0) | 1.0 (0.0–4.0) | 0.0 (0.0–4.5) |
| Общая моторно-исследовательская активность, n | 40.7 ± 3.1 | 19.6 ± 2.8* | 16.4 ± 3.5 |
Примечание: показатель “Частота дефекации” выражен через Ме (IQR); остальные показатели поведения выражены через Mean ± SEM, К1 – подгруппа 1 (интактные крысы), К2 – подгруппа 2 (стресс-рестресс + инъекции физиологического раствора), Опыт – подгруппа 3 (стресс-рестресс + инъекции даларгина). * – отличие от группы К1; ** – отличие от группы К2; различия считаются статистически значимыми при р < 0.05. Note: defecation frequency is presented as Ме (IQR); other data are presented as Mean ± SEM, K1 – subgroup 1 (intact rats), K2 – subgroup 2 (stress-restress + injections saline), Experiment – subgroup 3 (stress-restress + injections dalargin). * – in contrast of K1; ** – in contrast of K2; differences are statistically significant (р < 0.05).
Сравнение подгрупп Опыт и К2. Введение даларгина вызвало уменьшение времени нахождения АНТ крыс в ОР ПКЛ (р < 0.05) и увеличение продолжительности их реакции замирания (р < 0.05), вместе с тем время нахождения в ЗР ПКЛ (р = 0.19), частота дефекаций (р = 0.55) и общая моторно-исследовательская активность (р = 0.48) не изменились (табл. 2).
Группа АВТ. Сравнение подгрупп К2 и К1. У АВТ крыс в модели ПТСР увеличились продолжительность реакции замирания (р < < 0.05) и частота дефекаций (р < 0.05), а общая моторно-исследовательская активность уменьшилась (р < 0.05), тогда как показатели времени нахождения в ЗР (р = 0.53) и ОР (р = = 0.24) ПКЛ не изменились (табл. 3).
Таблица 3.
Поведенческие характеристики активных высокотревожных (АВТ) крыс при тестировании в приподнятом крестообразном лабиринте (ПКЛ) Table 3. Behavioral characteristics of active high-anxiety (AHA) rats in the elevated plus maze (EPM)
| Показатели поведения | К1, n = 10 | К2, n = 9 | Опыт, n = 10 |
|---|---|---|---|
| Время нахождения в ОР ПКЛ, с | 0.0 (0–0) | 4.0 (2.0–6.0) | 1.0 (0.0–3.0) |
| Время нахождения в ЗР ПКЛ, с | 293.9 ± 0.9 | 292.7 ± 1.9 | 291.8 ± 2.7 |
| Σ продолжительность реакции замирания, с | 25.4 ± 3.9 | 94.0 ± 16.4* | 52.2 ± 15.9** |
| Частота дефекации, n | 1.7 ± 0.1 | 4.6 ± 0.9* | 1.6 ± 0.2** |
| Общая моторно-исследовательская активность, n | 26.6 ± 1.6 | 11.0 ± 1.9* | 17.6 ± 3.1 |
Примечание: показатель “Время нахождения в ОР ПКЛ” выражен через Ме (IQR); остальные показатели поведения выражены через Mean ± SEM, К1 – подгруппа 1 (интактные крысы), К2 – подгруппа 2 (стресс-рестресс + инъекции физиологического раствора), Опыт – подгруппа 3 (стресс-рестресс + инъекции даларгина). * – отличие от группы К1; ** – отличие от группы К2; различия считаются статистически значимыми при р < 0.05. Note: time spent in the open arms of the maze is presented as Ме (IQR); other data are presented as Mean ± SEM, K1 – subgroup 1 (intact rats), K2 – subgroup 2 (stress-restress + injections saline), Experiment – subgroup 3 (stress-restress + injections dalargin). * – in contrast of K1; ** – in contrast of K2; differences are statistically significant (р < 0.05).
Сравнение подгрупп Опыт и К2. Введение даларгина вызвало у АВТ крыс уменьшение продолжительности реакции замирания (р = = 0.04) и частоты дефекаций (р < 0.05), одновременно наблюдалась тенденция к увеличению общей моторно-исследовательской активности (р = 0.09), тогда как показатели времени нахождения АВТ крыс в ЗР (р = 0.81) и ОР (р = 0.87) ПКЛ не изменились (табл. 3).
Группа ПНТ. Сравнение подгрупп К2 и К1. У ПНТ крыс в модели ПТСР время нахождения в ОР ПКЛ (р < 0.05) и общая моторно-исследовательская активность (р < 0.05) снизились, а продолжительность реакции замирания (р < 0.05) и частота дефекаций (р < 0.05) увеличились (табл. 4).
Таблица 4.
Поведенческие характеристики пассивных низкотревожных (ПНТ) крыс при тестировании в приподнятом крестообразном лабиринте (ПКЛ) Table 4. Behavioral characteristics of passive low-anxiety (PLA) rats in the elevated plus maze (EPM)
| Показатели поведения | К1, n = 6 | К2, n = 6 | Опыт, n = 6 |
|---|---|---|---|
| Время нахождения в ОР ПКЛ, с | 12.9 ± 2.2 | 6.8 ± 0.8* | 0.7 ± 0.1** |
| Время нахождения в ЗР ПКЛ, с | 272.1 ± 5.0 | 277.8 ± 6.8 | 295.0 ± 1.8** |
| Σ продолжительность реакции замирания, с | 17.6 ± 4.2 | 86.7 ± 19.0* | 137.8 ± 4.7** |
| Частота дефекации, n | 0.3 ± 0.1 | 1.8 ± 0.3* | 5.3 ± 1.3** |
| Общая моторно-исследовательская активность, n | 26.6 ± 1.9 | 16.3 ± 3.7* | 6.5 ± 1.9** |
Примечание: результаты выражены через Mean ± SEM, К1 – подгруппа 1 (интактные крысы), К2 – подгруппа 2 (стресс-рестресс + инъекции физиологического раствора), Опыт – подгруппа 3 (стресс-рестресс + инъекции даларгина). * – отличие от группы К1; ** – отличие от группы К2; различия считаются статистически значимыми при р < 0.05. Note: Data are presented as Mean ± SEM, K1 – subgroup 1 (intact rats), K2 – subgroup 2 (stress-restress + injections saline), Experiment – subgroup 3 (stress-restress + injections dalargin). * – in contrast of K1; ** – in contrast of K2; differences are statistically significant (р < 0.05).
Сравнение подгрупп Опыт и К2. Введение даларгина вызвало у ПНТ крыс уменьшение времени нахождения в ОР ПКЛ (р < 0.05) и снижение их общей моторно-исследовательской активности (р < 0.05), при этом время нахождения в ЗР ПКЛ (р < 0.05), продолжительность реакции замирания (р < 0.05) и частота дефекаций (р < 0.05) увеличились (табл. 4).
Группа ПВТ. У ПВТ крыс ни в модели ПТСР, ни после введения даларгина достоверных отличий исследованных параметров поведения не выявлено (табл. 5).
Таблица 5.
Поведенческие характеристики пассивных высокотревожных (ПВТ) крыс при тестировании в приподнятом крестообразном лабиринте (ПКЛ) Table 5. Behavioral characteristics of passive high-anxiety (PHA) rats in the elevated plus maze (EPM)
| Показатели поведения | К1, n = 6 | К2, n = 6 | Опыт, n = 6 |
|---|---|---|---|
| Время нахождения в ОР ПКЛ, с | 0.0 (0–0) | 5.0 (2.0–5.0) | 1.0 (1.0–1.0) |
| Время нахождения в ЗР ПКЛ, с | 295.2 ± 1.0 | 289.8 ± 4.0 | 291.8 ± 3.3 |
| Σ продолжительность реакции замирания, с | 39.5 ± 11.8 | 72.8 ± 17.4 | 80.2 ± 24.0 |
| Частота дефекации, n | 4.3 ± 0.8 | 3.5 ± 0.6 | 3.7 ± 0.4 |
| Общая моторно-исследовательская активность, n | 17.9 ± 2.4 | 11.3 ± 1.2 | 11.7 ± 1.8 |
Примечание: показатель “Время нахождения в ОР ПКЛ” выражен через Ме (IQR); остальные показатели поведения выражены через Mean ± SEM, К1 – подгруппа 1 (интактные крысы), К2 – подгруппа 2 (стресс-рестресс + инъекции физиологического раствора), Опыт – подгруппа 3 (стресс-рестресс + инъекции даларгина). Note: time spent in the open arms of the maze is presented as Ме (IQR); other data are presented as Mean ± SEM, K1 – subgroup 1 (intact rats), K2 – subgroup 2 (stress-restress + injections saline), Experiment – subgroup 3 (stress-restress + injections dalargin).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что ПТСР возникает как отставленная реакция на тяжелое стрессорное воздействие (Пшенникова, 2000). Важную роль в развитии этого патологического тревожного состояния играет условно-рефлекторный страх. Условными сигналами становятся события и предметы, сопутствующие травматической ситуации. При каждом столкновении с этими условными сигналами воспроизводится первичная причина потрясения, что служит фактором прогрессирования психопатологии во времени. У больных с ПТСР отмечают повышенную активность симпато-адреналовой системы и недостаточную функцию ГАС (Пшенникова, 2000; Шаляпина, 2005; Bhattacharya et al., 2019). Для исследования развития этой тревожной патологии у крыс с различными индивидуально-типологическими особенностями поведения мы использовали распространенную модель ПТСР – “стресс-рестресс” (Миронова, Рыбникова, 2008; Deslauriers et al., 2018; Liberzon et al., 1997), формирующую устойчивое тревожное состояние у грызунов, сходное с ПТСР человека. В данной модели у животных наблюдали нарастающее с течением времени увеличение тревожности, пониженный уровень кортикостерона в крови, усиленное торможение ГАС глюкокортикоидными гормонами, изменение в экспрессии минерало- и глюкокортикоидных рецепторов гиппокампа (Миронова, Рыбникова, 2008; Deslauriers et al., 2018; Harvey et al., 2003; Liberzon et al., 1997). Известно, что важную роль в предрасположенности к развитию ПТСР играет исходное состояние стресс-системы (Пшенникова, 2000; Шаляпина, 2005; Bhattacharya et al., 2019). Было отмечено, что данная психопатология развивается на фоне слабой стресс-реакции после одиночного стресса, а на фоне высокого выброса кортизола ПТСР никогда не развивается (Пшенникова, 2000; Шаляпина, 2005).
В нашей работе, по результатам тестирования в ПКЛ, мы наблюдали у ПНТ крыс после стресс-рестресса (К2 ПНТ) резкое увеличение тревожности. Есть данные (Шаляпина, 2005; Шаляпина и др., 2006б), что у пассивных особей после стресс-рестресса одновременно происходит снижение функциональной активности ГАС (уменьшение содержания кортикостерона в крови), повышается чувствительность ГАС к сигналам обратной связи и развивается десенситизация ее к кортиколиберину. Было также замечено, что после одиночного стресса уровень кортикостерона в крови уменьшается только у пассивных животных (Семенова и др., 2005). Одновременно было показано, что при хроническом стрессе резкое снижение содержания кортикостерона в крови пассивных животных протекает по типу дистрофической патологии и завершается истощением гормональной функции коры надпочечников (Семенова и др., 2005). Сопоставив данные литературы с нашими наблюдениями, мы можем предположить у ПНТ животных развитие ПТСР-подобного состояния.
Для активных особей характерны повышенное содержание кортикостерона в крови и сохранение чувствительности к кортиколиберину как на протяжении длительного периода после одиночного стресса (Шаляпина, Ракицкая, 2003), так и в парадигме “стресс-рестресс” (Шаляпина и др., 2006б). В наших опытах у стрессированных АНТ крыс (К2 АНТ), по сравнению с интактными животными (К1 АНТ), наблюдалось уменьшение общей моторно-исследовательской активности без развития признаков реактивной тревожности, тогда как активные крысы, демонстрирующие высокую реактивную тревожность (АВТ группа), реагировали на стрессорное воздействие в модели ПТСР (К2 АВТ), по сравнению с К1 АВТ, повышением уровня эмоциональной тревожности и страха с одновременным снижением в 2 раза общей моторно-исследовательской активности. В литературе есть данные, что линейные высокотревожные крысы high anxiety behavior (HAB) отличаются от низкотревожных low anxiety behavior (LAB) повышенным базальным уровнем кортикостероидов и нарушением регуляции ГАС по механизму обратной связи (Keck et al., 2002; Wegener et al., 2012). Возможно, в модели ПТСР нарушения поведения у АВТ особей также связаны с дисрегуляцией у них отрицательной обратной связи в ГАС и повышением уровня кортикостероидов в крови. Это предположение нуждается в дальнейшем изучении.
По данным опубликованных исследований, у животных, демонстрирующих адаптацию к стрессу, содержание эндорфинов в крови и тканях увеличивается (Лишманов и др., 2012; Пшенникова, 2000; Соколова и др., 2002), т.е. повышается функциональная активность периферического звена стресс-лимитирующей опиоидной системы, предупреждающей стресс-индуцированные повреждения в организме. Известно также, что фармакологический препарат “Даларгин”, воздействуя только на периферические опиоидные рецепторы (Лишманов и др., 2012; Маслов и др., 2002), способен блокировать выработку глюкокортикоидов и нормализовать их содержание в крови стрессированных животных (Лишманов и др., 2012). В нашем исследовании иньекции даларгина оказали на АВТ крыс антистрессорное воздействие, снизив их эмоциональное напряжение. Вероятно, этот препарат возместил недостаток эндогенных опиоидов (Лишманов и др., 2012; Соколова и др., 2002) и смягчил последствия стрессогенной ситуации для АВТ особей. Интересно, что у АНТ крыс в модели ПТСР тревожная патология не развивается. При этом инъекции даларгина резко повысили реактивную тревожность АНТ крыс. Известно, что при синдроме ПТСР тревожное состояние сопровождается патологически быстрым торможением выведения глюкокортикоидов из коры надпочечников и, как следствие, увеличением выброса кортиколиберина для экстренного запуска стресс-системы в связи с восстановлением необходимого для адаптации уровня глюкокортикоидов в крови (Рыбников и др., 2010). В наших опытах инъекции даларгина в модели ПТСР у АНТ животных, возможно, вызвали слишком быстрое падение уровня глюкокортикоидов в крови, с последующим увеличением реактивной тревожности у этих крыс. Возможно, что ПТСР-подобное состояние развивается у животных с высокой стрессореактивностью ГАС в условиях сильного дисбаланса между периферическим и центральным звеньями опиоидной системы. В нашем исследовании такой дисбаланс в группе АНТ был спровоцирован инъекциями даларгина. Это предположение не противоречит литературным данным, согласно которым, при развитии ПТСР функциональность центрального звена опиоидной системы снижена (Пшенникова, 2000; Kung et al., 2010) и, соответственно, в результате реципрокного взаимодействия центрального и периферического отделов эндогенной опиоидной системы (Судаков, Тригуб, 2008), можно предположить высокую активность периферического отдела. Таким образом, в нашем исследовании мы наблюдали поведенческую реакцию, характерную для особей с ПТСР-подобным состоянием, только у стрессированных ПНТ крыс (К2 ПНТ) и у стрессированных АНТ крыс с введением даларгина (т.е. при искусственном повышении уровня эндогенных опиоидных пептидов на периферии). Инъекции даларгина ПНТ крысам в модели ПТСР ускорили развитие тревожной патологии. Блокируя выведение глюкокортикоидных гормонов из надпочечников, даларгин, возможно, предохраняет ГАС от истощения, хотя ПТСР-подобное состояние у ПНТ крыс при этом усиливается.
Для лучшего понимания процессов адаптации животных с различными индивидуально типологическими особенностями поведения необходимо проведение дополнительных исследований с определением содержания глюкокортикоидов и опиоидов у исследуемых нами групп крыс в экспериментальной модели ПТСР “стресс-рестресс”.
ВЫВОДЫ
1. Инъекции даларгина в модели ПТСР у АНТ крыс вызвали повышение реактивной тревожности.
2. На АВТ крыс инъекции даларгина в модели ПТСР оказали антистрессорное воздействие, снизив повышенную реактивную тревожность, наблюдаемую после стресс-рестресса.
3. Развитие ПТСР-подобного состояния, проявляющегося в повышенной тревожности, мы наблюдали только у крыс ПНТ, а инъекции даларгина усилили проявление этого состояния.
4. У крыс из группы ПВТ не было выявлено изменения в поведении, ни при стрессорном воздействии, ни после инъекций даларгина.
Список литературы
Великжанин В.И. Генетика поведения сельскохозяйственных животных (этология. Темперамент, продуктивность). Спб. 2004. 203 с.
Ласукова Т.В., Маслов Л.Н. Опиоидные рецепторы и устойчивость сердца к патогенным воздействиям. Сибирский медицинский журн. 2007. 22 (3): 46–50.
Лихванцев В.В., Гребенчиков О.А., Шапошников А.А., Борисов К.Ю., Черпаков Р.А., Шульгина Н.М. Фармакологическое прекондиционирование: роль опиоидных пептидов. Общая реаниматология. 2012. VIII (3): 51–54.
Лишманов Ю.Б., Маслов Л.Н., Нарыжная Н.В., Пей Ж.-М., Колар Ф., Жанг И., Портниченко А.Г., Ванг Х. Эндогенная опиоидная система как звено срочной и долговременной адаптации организма к экстремальным воздействиям. Перспективы клинического применения опиоидных пептидов. Вестник РАМН. 2012. 6: 73–82.
Маслов Л.Н., Лишманов Ю.Б., Гросс Г.Дж., Стефано Дж. Феномен повышенной устойчивости сердца к аритмогенному действию ишемии и реперфузии при активации периферических опиатных рецепторов. Вестник аритмологии. 2002. 26: 77–90.
Миронова В.И., Рыбникова Е.А. Устойчивые модификации экспрессии нейрогормонов в гипоталамусе крыс в модели посттравматического стрессового расстройства. Рос. физиол. журн. им. И.М. Сеченова. 2008. 94 (11): 1277–1284.
Пшенникова М.Г. Феномен стресса, эмоциональный стресс и его роль в патологии. Актуальные проблемы патофизиологии (избранные лекции). М.: Медицина. 2000. 220–353.
Рыбникова Е.А., Миронова В.И., Пивина С.Г. Тест для выявления нарушений саморегуляции гипофизарно-адренокортикальной системы. Журн. высш. нервн. деят. им. И.П. Павлова. 2010. 60 (4): 500–506.
Семенова М.Г., Ракицкая В.В., Шаляпина В.Г. Морфофункциональные изменения коры надпочечников в ходе развития постстрессорных депрессий у крыс с активной и пассивной стратегиями приспособительного поведения. Рос. физиол. журн. им. И.М. Сеченова. 2005. 91 (5): 551–557.
Семенова О.Г., Вьюшина А.В., Притворова А.В., Ордян Н.Э. Влияние блокады ГАМКА-рецепторов на изменения ориентировочно-исследовательской активности и тревожности, вызванных кортиколиберином. Рос. физиол. журн. им. И.М. Сеченова. 2018. 104 (12): 1478–1488.
Соколова Н.А., Маслова М.В., Маклакова А.С., Ашмарин И.П. Пренатальный гипоксический стресс: физиологические и биохимические последствия, коррекция регуляторными пептидами. Успехи физиологических наук. 2002. 33 (2): 56–67.
Судаков С.К., Тригуб М.М. Гипотеза реципрокного взаимодействия центрального и периферического звена эндогенной опиоидной системы. Бюлл. Экспер. Биол. и Мед. 2008. 146 (12): 604–607.
Французова Т.И., Чистяков С.И, Балашов В.П., Овсянникова Л.А. Фармакологические способы профилактики стресс-индуцированных состояний в эксперименте. Медицинские науки. 2010. 4 (16): 26–35.
Шаляпина В.Г. Кортиколиберин в регуляции приспособительного поведения и патогенезе пост-стрессорной психопатологии. В кн.: Основы нейроэндокринологии. Ред. В.Г. Шаляпина, П.Д. Шабанов. Элби-СПб. 2005. 84–146.
Шаляпина В.Г., Вершинина Е.А., Ракицкая В.В., Рыжова Л.Ю., Семенова М.Г., Семенова О.Г. Изменение приспособительного поведения активных и пассивных крыс Вистар в водно-иммерсионной модели депрессии. Журн. высш. нервн. деят. им. И.П. Павлова. 2006а. 56 (4): 543–547.
Шаляпина В.Г., Ракицкая В.В. Реактивность гипофизарно-адренокортикальной системы на стресс у крыс с активной и пассивной стратегиями поведения. Рос. физиол. журн. им. И.М. Сеченова. 2003. 89 (5): 585–590.
Шаляпина В.Г., Ракицкая В.В., Семенова М.Г., Семенова О.Г. Гормональная функция гипофизарно-адренокортикальной системы в патогенетической гетерогенности постстрессорных депрессий. Рос. физиол. журн. им. И.М. Сеченова. 2006б. 92 (4): 480–487.
Belanoff J.K., Kalehzan M., Sund B., Ficek S.K.F., Schatzberg A.F. Cortisol activity and cognitive changes in psychotic major depression. Amer. J. Psychiatry. 2001. 158 (10): 1612–1616.
Bhattacharya S., Fontaine A., MacCallum Ph.E., Drover J., Blundell J. Stress across generations: DNA methylation as a potential mechanism underlying intergenerational effects of stress in both post-traumatic stress disorder and pre-clinical predator stress rodent models. Front. Behav. Neurosci. 2019. 13: 113. https://doi.org/10.3389/fnbeh.2019.00113
Bremner J.D. Stress and brain atrophy. CNS Neurol. Disord. Drug Targets. 2006. 5 (5): 503–512.
Deslauriers J., Toth M., Der-Avakian A., Risbrough V.B. Current status of animal models of PTSD: behavioral and biological phenotypes, and future challenges in improving translation. Biol. Psychiatry. 2018. 83 (10): 895–907. https://doi.org/10.1016/j.biopsych.2017.11.019
Harvey B.H., Naciti C., Brand L., Stein D.J. Endocrine, cognitive and hippocampal/cortical 5HT1A/2A receptor changes evoked by a time-dependent sensitisation (TDS) stress model in rats. Brain Res. 2003. 983: 97–107.
Keck M.E., Wigger A., Welt T., Muller M.B., Gesing A., Reul J.M., Holsboer F., Landgraf R., Neumann I.D. Vasopressin mediates the response of the combined dexamethasone/CRH test in hyper-anxious rats: implications for pathogenesis of affective disorders. Neuropsychopharmacology. 2002. 26 (1): 94–105. https://doi.org/10.1016/S0893-133X(01)00351-7
Kino T. Stress, glucocorticoid hormones, and hippocampal neural progenitor cells: implications to mood disorders. Front. Phsiol. 2015. 6: 230. https://doi.org/10.3389/fphys.2015.00230
Kung J-C., Chen T-C., Shyu B-C., Hsiao S., Huang A.C.W. Anxiety- and depressive-like responses and c-fos activity in preproenkephalin knockout mice: oversensitivity hypothesis of enkephalin deficit-induced posttraumatic stress disorder. Journal of Biomedical Science. 2010. 17–29. https://doi.org/10.1186/1423-0127-17-29
Liberzon I., Krstov M., Young E.A. Stress-restress: effects on ACTH and fast feedback. Psychoneuroendocrinol. 1997. 22 (6): 443–453.
Moulton E., Chamness M., Knox D. Characterizing changes in glucocorticoid receptor internalization in the fear circuit in an animal model of posttraumatic stress disorder. PLOS ONE. 2018. 13 (12): e0205144. https://doi.org/10.1371/j.pone.0205144
Osterlund C.D., Rodriguez-Santiago M., Woodruff E.R., Newsom R.J., Chadayammuri A.P., Spencer R.L. Glucocorticoid fast feedback inhibition of stress-induced ACTH secretion in the male rat: rate independence and stress-state resistance. Endocrinol. 2016. 157 (7): 2785–2798.
Pellow S., Chopin P., File S.E., Briley M. Validation of open : closed arm entries in the elevated plus-maze as measure of anxiety in the rat. J. Neurosci. Methods. 1985. 14 (3): 149–167.
Rodgers R.J., Johnson N.J. Factor analysis of spatiotemporal and ethological measures in the murine elevated plus-maze test of anxiety. Pharmacol. Biochem. Behav. 1995. 52 (2): 297–303.
Wegener G., Mathe A.A., Neumann I.D. Selectively bred rodents as models of depression and anxiety. Curr Topics Behav Neurosci. 2012. https://doi.org/10.1007/7854_2011_192
Yehuda R., Antelman S.M., Criteria for rationally evaluating animal models of posttraumatic stress disorder. Biol. Psychiatry. 1993. 33 (7): 479–486.
Young E.A., Vazquez D. Hypercortisolemia, Hippocampal Glucocorticoid Receptors, and Fast Feedback. Mol. Psychiatry. 1996. 1 (2): 149–159.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


