Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 5, стр. 690-709
ВЛИЯНИЕ СОЦИАЛЬНОЙ ИЗОЛЯЦИИ И ОБОГАЩЕННОЙ СРЕДЫ НА ТРЕВОЖНО-ДЕПРЕССИВНОЕ ПОВЕДЕНИЕ КРЫС В НОРМЕ И ПОСЛЕ РАННЕГО ПРОВОСПАЛИТЕЛЬНОГО СТРЕССА
И. В. Павлова 1, *, Н. Д. Брошевицкая 1, М. И. Зайченко 1, Г. А. Григорьян 1
1 Федеральное государственное бюджетное учреждение науки Институт высшей нервной деятельности
и нейрофизиологии РАН
Москва, Россия
* E-mail: pavlovfml@mail.ru
Поступила в редакцию 14.12.2020
После доработки 04.02.2021
Принята к публикации 02.03.2021
Аннотация
Исследовали влияние содержания в различных условиях (стандартные, социальная изоляция, кратковременное пребывание в обогащенной среде) в возрасте с 1.5 до 3.5 мес на тревожно-депрессивное поведение взрослых крыс, перенесших ранний провоспалительный стресс. На 3-й и 5-й день от рождения одной группе крысят вводили бактериальный липополисахарид (50 мкг/кг, группа ЛПС), другой группе – физиологический раствор (группа ФИЗ, контроль). Тестирование в возрасте 3–3.5 мес в “Открытом поле” и “Приподнятом крестообразном лабиринте” показало, что содержание в условиях социальной изоляции по сравнению со стандартными условиями приводило к увеличению тревожности крыс и поведения по оценке риска (вытягивания), к некоторому снижению двигательной и исследовательской активности. Наибольшие изменения после социальной изоляции происходили у крыс ЛПС-групп. Кратковременное пребывание в условиях обогащенной среды у крыс ФИЗ-групп не влияло на уровень тревожности, но у самок ЛПС-группы при этом в “Открытом поле” наблюдалось увеличение тревожности. Тест на предпочтение сахарозы выявил признаки депрессивно-подобного поведения у самок ЛПС-группы после социальной изоляции и обогащения среды. Содержание в социальной изоляции приводило к наибольшему увеличению уровня кортикостерона в крови после дополнительного стрессирующего воздействия (теста вынужденного плавания). Таким образом, перенесенный ранний провоспалительный стресс увеличивал реактивность на негативные стрессирующие воздействия во взрослом возрасте, при этом самки были наиболее уязвимы.
Стрессы и отрицательные воздействия в раннем возрасте оказывают серьезное влияние на здоровье и поведение взрослого человека и животных (Kessler et al., 2012). Они могут приводить к развитию тревожных расстройств, депрессии, посттравматического синдрома и ряда других психоневрологических заболеваний. Известно, что ранний стресс вызывает дисрегуляцию гипоталамо-гипофизарной надпочечниковой системы (ГГНС) и нарушает нормальное развитие и функционирование иммунной системы (см. обзор Григорьян, 2020). В результате происходит изменение чувствительности (сенситизация) нейровоспалительной системы, которая чрезмерно или неадекватно реагирует на повторные негативные воздействия (Fonken et al., 2018).
В настоящее время для создания нейровоспалительного процесса в раннем или ином возрасте наиболее часто используется модель провоспалительного стресса, вызываемого путем введения бактериального липополисахарида (ЛПС) крысам в разные периоды развития (см. обзор Григорьян, 2020, Tishkina et al., 2016; Custódio et al., 2018; Брошевицкая и др., 2020 и др.). Липополисахариды являются составными компонентами внешней части мембраны грамотрицательных бактерий, и их введение приводит к высвобождению большого числа эндогенных провоспалительных медиаторов (цитокины, хемокины и др.) через TLR4*MD-2-комплекс (Alexander, Rietschel, 2001).
В литературе имеются сведения о том, что введение ЛПС в раннем онтогенезе приводит к увеличению тревожности и уменьшению социальных взаимодействий у взрослых крыс, усилению депрессивно-подобного поведения (Tishkina et al., 2016; Custódio et al., 2018). Причем в одних случаях реактивность на ранний провоспалительный стресс была больше выражена у самцов (Walker et al., 2009; Custódio et al., 2018), а в других – у самок (Tenk et al., 2013). В наших предыдущих исследованиях было показано (Брошевицкая и др., 2020), что введение ЛПС на 3-й и 5-й дни жизни вызывает снижение двигательной активности, уменьшение исследовательского поведения и увеличение тревожности и депрессивно-подобного поведения крыс в подростковом возрасте (1–1.5 мес). У самцов изменения в поведении проявились в большей степени, чем у самок.
В настоящее время остается до конца не ясным, как проявляются последствия раннего стресса в дальнейшей жизни животных при столкновении с различными воздействиями. Как будут реагировать животные после раннего провоспалительного стресса на негативные стрессирующие воздействия? Можно ли ослабить последствия провоспалительного стресса путем содержания в особых условиях? Рассматриваемая проблема имеет непосредственное отношение к пониманию механизмов влияния ранних стрессов на возможное возникновение различных психопатологий у человека во взрослом возрасте.
Среди многих хронических стрессирующих воздействий, применяемых в экспериментах на грызунах, широко используется социальная изоляция. Показано, что социальная изоляция, проведенная с раннего возраста, способна вызывать у взрослых животных повышенную тревожность и признаки депрессивно-подобного поведения (Bledsoe et al., 2011; Lukkes et al., 2012; Zhang et al., 2012; Guarnieri et al., 2020; Wang et al., 2017; Mileva, Bielajew, 2015; Takatsu-Coleman et al., 2013). Наоборот, проживание в условиях обогащенной среды может противодействовать развитию тревожного и депрессивно-подобного поведения (Guarnieri et al., 2020; Wukitsch et al., 2020; Mileva, Bielajiw, 2015; Grippo et al., 2014; Brenes et al., 2009; 2020). Исходя из этих данных, следует ожидать, что социальная изоляция будет усиливать, а обогащенная среда, наоборот, ослаблять тревожное и депрессивно-подобное поведение у взрослых крыс, получавших ЛПС-стресс в раннем неонатальном периоде. Причем эти процессы, по-видимому, должны проходить неодинаково у самцов и самок, поскольку данные литературы указывают на то, что нейровоспалительный процесс у них протекает по-разному, у самцов повышена реактивность микроглии, у самок процессы выражены слабее, на что существенно влияют женские половые гормоны (Fonken et al., 2018; Berkiks et al., 2019; Vegeto et al., 2001).
Целью настоящей работы было изучить влияние длительной социальной изоляции и кратковременного пребывания в обогащенной среде на тревожно-депрессивное поведение крыс, перенесших ранний провоспалительный стресс. В задачи работы входило: 1) проанализировать влияние раннего провоспалительного стресса и измененных условий содержания (с 1.5 до 3.5 мес) на тревожно-депрессивное поведение взрослых крыс в тестах “Открытое поле” (ОП), “Приподнятый крестообразный лабиринт” (ПКЛ), тесте на предпочтение сахарозы (ТПС) и в тесте вынужденного плавания (ТВП); 2) сопоставить влияние различных условий содержания на поведение самцов и самок; 3) проанализировать влияние различных условий содержания на уровень кортикостерона в плазме крови.
МЕТОДИКА
Объект исследования. В опытах участвовало 153 крысы линии Вистар в возрасте от 25 дней до 3.5 мес (81 самец и 72 самки). Крысята (18 пометов) были выведены в виварии ИВНД и НФ от родителей, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА, Россия. На 3-й и 5-й дни жизни у одной половины крысят из помета вызывали провоспалительный стресс путем введения бактериального липополисахарида (ЛПС) в дозе 50 мкг/кг в объеме 10 мкл/г (группа ЛПС, всего 75 крысят). Во время этой процедуры крысят отлучали от матери на 15–20 мин, взвешивали на электронных весах с точностью до 0.01 г, и они получали подкожную инъекцию ЛПС в холку с помощью инсулинового шприца. Этих крысят дополнительно метили с помощью подкожного введения у основания хвоста 10 мкл черной краски, которая используется для татуировок. Другой половине крысят из помета в этом же возрасте подкожно вводили физиологический раствор в объеме 10 мкл/г (группа ФИЗ, контроль, всего 78 крысят). При разделении помета старались уравнять число самцов и самок в группах ЛПС и ФИЗ. Разделение пометов делали с целью ослабить влияние генетического фактора на результаты экспериментов. В возрасте 25 дней крысят отлучали от матери, и формировали клетки таким образом, что в одной клетке проживали 4–6 крыс одного пола из 2–3 пометов из одной группы (либо ЛПС, либо ФИЗ). В дальнейшем животных содержали в виварии при обычном 12-часовом световом режиме в свободном доступе к воде и стандартному корму. В отличие от ранее проведенных исследований (Брошевицкая и др., 2020), в настоящей работе не было создано группы интактного контроля, поскольку ранее мы не наблюдали статистически значимых различий между крысами группы ФИЗ и интактными животными.
В возрасте 45 дней каждую группу крыс делили на три группы в зависимости от условий содержания, которые оставались неизменными до конца экспериментов (до 3.5 мес). Одну группу крыс содержали в стандартных групповых условиях содержания (СТАНД, n = 90), вторую кратковременно помещали в обогащенную среду (группа ОС, n = 34), третью подвергали социальной изоляции (группа СИ, n = 29). В обогащенную среду помещали 4–6 крыс (1 клетка) на 20 мин через день, ее создавали в пластиковой коробке размером 51 × 40.5 × 30 см, в которой находились лесенки, беличье колесо, трубки, материал для зарывания (опилки, пенопластовый наполнитель, бумага и др.). Параллельно с исследованием обогащенной среды крыс приручали к рукам экспериментатора (handling). При социальной изоляции крыс содержали поодиночке в клетках размером 30 × × 30 × 17.5 см, каждая из которых была оборудована индивидуальной вытяжкой. Животные, находящиеся в изоляции, не могли контактировать с другими крысами ни визуально, ни тактильно, ни посредством запахов. Таким образом, в работе анализировали поведение 6 групп крыс: ФИЗ + СТАНД (46 крыс), ФИЗ + ОС (18 крыс), ФИЗ + СИ (14 крыс), ЛПС + СТАНД (44 крысы), ЛПС + + ОС (16 крыс), ЛПС + СИ (15 крыс). В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU) и положения ИВНД и НФ РАН о работе с экспериментальными животными.
Тестирование уровня тревожности. В работе изучали поведение крыс в двух тестах на тревожность: в “Открытом поле” (ОП) и в “Приподнятом крестообразном лабиринте” (ПКЛ). Крыс тестировали в возрасте 30–40 дней (подростковый возраст, до помещения в обогащенную среду и изоляцию) и 90–100 дней (взрослые, при разных условиях содержания). Первое тестирование было необходимым для формирования групп, равноценных по уровню тревожности, которые в дальнейшем помещали в разные условия содержания. Перед первым тестированием для снижения стрессирующей нагрузки на животных проводили 10–15-минутное приручение (хендлинг) в течение 3–4 дней. Использовали общепринятые размеры и конфигурации ПКЛ и ОП. Время наблюдения в каждом тесте – 5 мин. Для фиксирования траектории движения крыс и элементов поведения использовали программу Etho Vision, а также видеорегистрацию. Анализировали показатели, отражающие тревожность/смелость крыс (время нахождения на периферии ОП, число и длительность выходов в центр ОП, число и длительность выходов в открытые рукава ПКЛ), двигательную активность крыс (пройденную дистанцию, скорость движения, время движения, число переходов между рукавами в ПКЛ), исследовательское поведение (стойки, выглядывания в открытые рукава в ПКЛ), поведение по оценке риска (свешивания в ПКЛ, вытягивания (stretch-attend postures)), элементы “смещенной активности” (число эпизодов и длительность груминга), а также ряд показателей, отражающих вегетативные реакции (число дефекаций и уринаций). При дальнейшей обработке для оценки тревожности в ПКЛ подсчитывали процент времени нахождения в открытых рукавах от общего времени нахождения в открытых и закрытых рукавах, а также процент заходов в открытые рукава от общего числа заходов в открытые и закрытые рукава. Всегда вначале тестировали крысу в ОП, а через 2–3 дня – в ПКЛ. Перед помещением в камеру животного другого пола, кроме обычной влажной и сухой уборки, лабиринт протирали 20%-м раствором этилового спирта. Для переноски самцов и самок из вивария в экспериментальную комнату и для ожидания своей очереди использовали разные клетки.
Тест на предпочтение сахарозы. Для оценки депрессивно-подобного поведения проводили тест на ангедонию у крыс в возрасте 40–45 и 100–102 дней. Тест проводили в течение одних суток. В клетку помещали 2 бутылки, одну с 1%-м раствором сахарозы, другую с водой. Два раза в сутки (утром и вечером) бутылки взвешивали и меняли местами. Определяли объем выпитого раствора сахарозы и воды за сутки каждой крысой, а также процент выпитой сахарозы от общего объема потребленной жидкости.
Тест вынужденного плавания проводили в возрасте 102–105 дней, для этих целей использовали цилиндры из оргстекла диаметром 20 см и высотой 50 см, которые заполняли водой температурой 25–26°С до уровня 30 см. Крыс помещали в воду на 5 мин. При зависании (неподвижности) в ходе плавания крысы осуществляли лишь слабые движения лапами и хвостом для коррекции положения тела около поверхности воды. Во время опыта проводили видеорегистрацию. При обработке данных подсчитывали время зависания крыс поминутно и суммарно за весь опыт, число эпизодов зависания и среднюю длительность таких эпизодов за опыт.
Иммуноферментный анализ крови. Забор крови проводили у взрослых крыс за один день до начала тестирования и через 30–40 мин после теста вынужденного плавания. Для этого крыс наркотизировали с помощью изофлуранового ингаляционного наркоза (Аерран), на кончике хвоста делали косые надрезы скальпелем и собирали периферическую кровь в объеме 0.5 мл. Затем кровь центрифугировали 15 мин при 4°С и 1500 g для получения сыворотки. Аликвоты сыворотки хранили при –80°С до проведения иммуноферментного анализа.
Для определения уровня кортикостерона в сыворотке крови использовали наборы для иммуноферментного анализа (DRG, Германия), с помощью которых детектировали как свободный, так и связанный с транспортными белками кортикостерон методом конкурентного иммуноферментного анализа.
Статистическая обработка результатов. Для вторичной обработки результатов использовали стандартную программу STATISTICA 8.0. Распределение исследованных параметров было проверено на нормальность по критерию Колмогорова–Смирнова (Basic Statistics, раздел Descriptive Statistics). Если анализируемый параметр удовлетворял данному критерию, то при сравнении групп крыс использовали дисперсионный анализ ANOVA, раздел factorial ANOVA. При post-hoc анализе применяли критерий Newman–Keuls test. Различия считали статистически значимыми при р < 0.05, отмечали наличие тенденции при 0.05 ≤ р < 0.1. Во всех экспериментах анализировали влияние факторов ПОЛ, ГРУППА, УСЛОВИЯ СОДЕРЖАНИЯ, в некоторых случаях также анализировали влияние факторов ВОЗДЕЙСТВИЕ и ВРЕМЯ. При отсутствии нормальности распределения поведенческих параметров использовали Kruskal–Wallis test, с последующим сравнением групп с помощью Multiple Comparisons (Nonparametric Statistics). При сравнении веса самцов и самок пользовались t-test (Basic statistics). Данные на рисунках представлены в виде средних значений ± ошибки средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Влияние условий содержания на вес крыс. Вес самцов в три месяца был значительно больше, чем у самок (t-test, t = 23.7, p = 0.000). Влияние фактора ГРУППА (крыс) не было выявлено, но фактор УСЛОВИЯ СОДЕРЖАНИЯ оказывал влияние на вес как самцов (F2.64 = 5.72, р = 0.005), так и самок (F2.55 = = 15.12, р = 0.000). Post hoc анализ показал, что кратковременное содержание в условиях ОС приводило к увеличению (р < 0.05) веса у самцов (в среднем 356.9 ± 6.4 г) и самок (258.5 ± 5.9 г) по сравнению с животными в стандартных условиях (333.1 ± 4.0 г и 223.6 ± ± 4.8 г соответственно). СИ вызывала увеличение веса (р < 0.05) только у самцов (354.9 ± ± 6.7 г), но не сказалась на весе самок (227.4 ± ± 6.5 г) по сравнению с животными в стандартных условиях (333.1 ± 4.0 г и 223.6 ± 4.8 г соответственно).
Влияние условий содержания на поведение крыс в открытом поле. Из всех анализируемых показателей поведения в ОП только часть имела нормальное распределение. С помощью Factorial ANOVA анализировали влияние факторов УСЛОВИЯ СОДЕРЖАНИЯ, ПОЛ, ГРУППА на эти параметры, значения F и р представлены в табл. 1. Остальные параметры анализировали с помощью Kruskal–Wallis test и последующим сопоставлением групп по Multiple Comparisons. Из таблицы видно, что фактор ПОЛ оказывал существенное влияние на все параметры поведения. У самок по сравнению с самцами были больше (р < 0.05) пройденная дистанция, скорость и время движения, число стоек и поворотов. У самок были больше выходов в центр и меньше время, проведенное на периферии поля (р < 0.05, Mann–Whitney test). Таким образом, самки отличались меньшей тревожностью и большей двигательной и исследовательской активностью. Более подробно половые различия в поведении крыс в ОП были описаны нами ранее (Павлова и др., 2020).
Таблица 1.
Значения F и р при анализе с помощью Factorial ANOVA некоторых показателей поведения в ОП и ПКЛ у крыс, содержащихся в разных условиях Table 1. F and р values of some parameters of behavior in the OF and EPM of rats in different housing conditions (Factorial ANOVA)
| Тест | Показатель поведения | Факторы | ||||
|---|---|---|---|---|---|---|
| УСЛОВИЯ СОДЕРЖАНИЯ | ПОЛ | ГРУППА | УСЛОВИЯ СОДЕРЖАНИЯ × × ПОЛ | УСЛ.СОД × × ПОЛ × × ГРУППА | ||
| ОП | Дистанция | F2.141 = 3.9 p = 0.021 | F1.141 = 69.9 p = 0.000 | – | – | – |
| Скорость | F2.141 = 4.1 р = 0.020 | F1.141 = 64.9 р = 0.000 | – | – | – | |
| % Т движения | – | F1.141 = 32.3 р = 0.000 | – | – | – | |
| Стойки | F2.141 = 8.5 р = 0.000 | F1.141 = 25.9 р = 0.000 | – | – | – | |
| Число поворотов | – | F1.141 = 19.6 р = 0.000 | – | F2.141 = 4.0 р = 0.020 | – | |
| ПКЛ | % Т выходов в ОР | F2.141 = 10.1 р = 0.000 | F1.141 = 8.7 р = 0.004 | – | – | – |
| Дистанция | – | F1.141 = 48.0 р = 0.000 | – | – | – | |
| Скорость | – | F1.141 = 46.2 р = 0.000 | – | – | – | |
| % Т движения | – | F1.141 = 27.9 р = 0.000 | – | – | – | |
| Число поворотов | F2.141 = 7.6 р = 0.001 | F1.141 = 63.2 р = 0.000 | – | – | – | |
| Число переходов через центр | F2.141 = 9.1 р = 0.000 | F1.141 = 35.1 р = 0.000 | – | – | – | |
| Т выглядывания в ОР | F2.141 = 3.1 р = 0.049 | – | – | – | – | |
На большинство показателей также влиял фактор УСЛОВИЯ СОДЕРЖАНИЯ (табл. 1). Проведенный post hoc анализ показал (рис. 1), что социальная изоляция вызывала существенные изменения в поведении крыс в ОП, которые отличались у животных в группах ФИЗ и ЛПС (табл. 2). У самцов группы ФИЗ + СИ по сравнению с группой ФИЗ + + СТАНД было меньше стоек (рис. 1 (д)), также несколько больше вытягиваний (тенденция, рис. 1 (е)). Кроме того, у самцов группы ФИЗ + СИ была больше латентность ухода из центра (рис. 1 (г), р = 0.002, Н(2, n = = 44) = 12.51, p = 0.001), куда крысу сажали в самом начале эксперимента, что отражало, по-видимому, торможение двигательной активности крысы при попадании в аверсивную обстановку. Замирания при этом не наблюдали, животное совершало небольшие движения, крутилось на месте. У самок группы ФИЗ + СИ, по сравнению с группой ФИЗ + + СТАНД, так же, как у самцов, были больше латентность ухода из центра (рис. 1 (г), р = = 0.001, Н(2, n = 34) = 13.88, p = 0.001), число вытягиваний (тенденция, рис. 1 (е), р = 0.06, Н(2, n = 23) = 6.1, p = 0.047) и длительность пребывания на периферии поля (тенденция, рис. 1 (б), р = 0.06, Н(2, n = 34) = 5.4, p = = 0.067). СИ у крыс группы ЛПС вызывала более значительные изменения в поведении. У самцов группы ЛПС + СИ по сравнению с группой ЛПС + СТАНД были больше время нахождения на периферии поля (рис. 1 (б), р = = 0.006, Н(2, n = 37) = 9.65, p = 0.008) и латентность ухода из центра в начале эксперимента (рис. 1 (г), р = 0.001, Н(2, n = 37) = 13.3, p = 0.001). У самок группы ЛПС + СИ в отличие от группы ЛПС + СТАНД было меньше выходов в центр (рис. 1 (а), р = 0.008, Н(2, n = = 38) = 10.31, p = 0.006), время нахождения в центре (р = 0.016, Н(2, n = 38) = 9.95, p = = 0.007), пройденная дистанция (рис. 1 (в)) и скорость движения, вместе с тем было больше время на периферии (рис. 1 (б), р = 0.005, Н(2, n = 38) = 14.32, p = 0.001), латентность ухода из центра (рис. 1 (г), р = 0.000, Н(2, n = = 38) = 18.86, p = 0.000) и число вытягиваний (рис. 1 (е), р = 0.044, Н(2, n = 24) = 7.35, p = = 0.025).
Рис. 1.
Влияние условий содержания крыс на различные параметры поведения (а–е) в открытом поле. ФИЗ – группа крыс с постнатальным введением физиологического раствора, ЛПС – с введением липополисахарида. СТАНД – стандартные условия содержания, ОС – обогащенная среда, СИ – социальная изоляция. * – статистически значимые различия (р < 0.05) по сравнению со стандартными условиями содержания, # – тенденция (0.05 < р < 0.1). $ – различия между самцами и самками в сходных условиях содержания.
Fig. 1. The effects of the rats housing conditions on various parameters of behavior (а–е) in an open field. ФИЗ – a group of rats with postnatal injections of saline, ЛПС – with injections of lipopolysaccharide. СТАНД – standard grouped housing, ОС – enriched environment, СИ – social isolation. * – the significant difference (р < 0.05) relative to standard housing conditions, # – the marginal difference (0.05 < р < 0.1). $ – the difference between males and females in the same housing conditions.
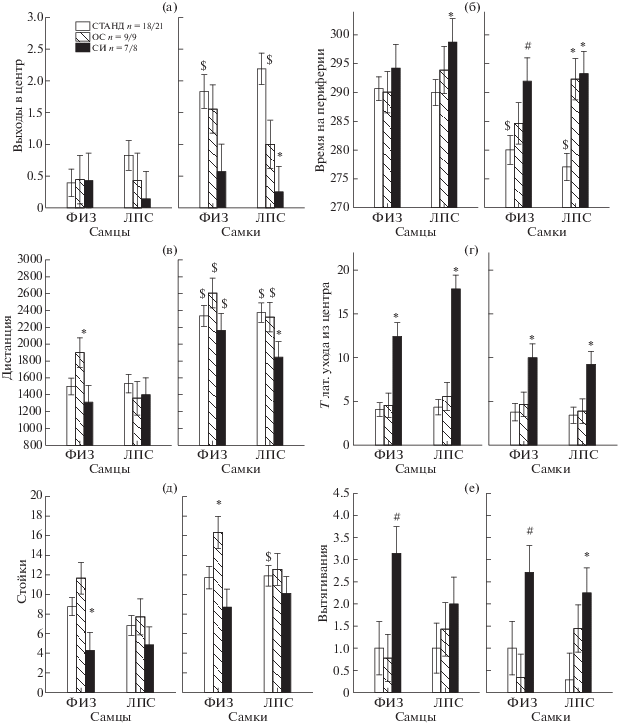
Таблица 2.
Изменение различных показателей поведения крыс после СИ и кратковременного пребывания в ОС по сравнению со стандартными условиями содержания. ↑↓ – увеличение/снижение, = без изменений, ↑ = ↓ = – тенденция к увеличению/снижению Table 2. Changes in various indicators of rat behavior after СИ and short-term stay in the ОС in comparison with standard housing conditions. ↑↓ – increase / decrease, = no change, ↑ = ↓ = – trend to increase/decrease
| Тест | Показатель поведения | Группы самцов | Группы самок | ||||||
|---|---|---|---|---|---|---|---|---|---|
| ФИЗ + + СИ | ЛПС + + СИ | ФИЗ + + ОС | ЛПС + + ОС | ФИЗ + + СИ | ЛПС + + СИ | ФИЗ + + ОС | ЛПС + + ОС | ||
| ОП | Выходы в центр | = | = | = | = | = | ↓ | = | = |
| Время на периферии | = | ↑ | = | = | ↑= | ↑ | = | ↑ | |
| Дистанция | = | = | ↑ | = | = | ↓ | = | = | |
| Скорость | = | = | ↑ | = | = | ↓ | = | = | |
| Латентность ухода из центра (с) | ↑ | ↑ | = | = | ↑ | ↑ | = | = | |
| Вытягивания | ↑= | = | = | = | ↑= | ↑ | = | = | |
| Стойки | ↓ | = | = | = | = | = | ↑ | = | |
| Груминг (с) | = | = | = | = | = | = | = | ↑= | |
| Уринации | = | = | = | = | = | = | = | = | |
| Дефекации | = | = | ↑ | ↑= | = | = | = | = | |
| ПКЛ | % выходов в ОР | = | ↓ | = | = | ↓= | ↓= | = | = |
| % Т в ОР | ↓ | ↓ | = | = | ↓ | ↓ | = | = | |
| Дистанция | = | = | ↑= | = | = | = | = | = | |
| Скорость | = | = | ↑= | = | = | = | = | = | |
| Переходы через центр | = | = | = | = | ↓ | ↓ | = | = | |
| Стойки | = | = | = | = | = | = | = | = | |
| Свешивания | = | = | ↑ | ↑ | = | = | ↑ | ↑ | |
| Выглядывания | = | = | = | = | = | = | ↑ | = | |
| Вытягивания | ↑ | ↑ | = | = | ↑ | ↑= | = | = | |
| Груминг (с) | = | ↑= | = | = | = | = | = | = | |
| Уринации | = | = | = | = | = | = | = | = | |
| Дефекации | = | = | = | = | = | = | = | = | |
Таким образом, животные ЛПС-группы были более чувствительны к СИ (табл. 2). Под влиянием изоляции у них происходило увеличение тревожности, снижение двигательной активности, торможение двигательной активности в начале эксперимента, а также увеличение поведения по оценке риска. СИ у контрольных животных вызывала меньшие изменения в поведении: увеличивалось число элементов по оценке риска (вытягивания), уменьшалась исследовательская активность, тормозилась двигательная активность в самом начале эксперимента. Самки ЛПС-группы по сравнению с самцами ЛПС-группы были более подвержены изменениям в связи с СИ.
Из рис. 1 видно, что кратковременное обогащение среды вызывало небольшие изменения в поведении у крыс группы ФИЗ в открытом поле: у самцов группы ФИЗ + ОС по сравнению с группой ФИЗ + СТАНД были больше длина пройденной дистанции (рис. 1 (в), р < 0.05, post hoc анализ), скорость движения, у самок – число стоек (рис. 1 (д), р < 0.05, post hoc анализ). По основным показателям, отражающим уровень тревожности (число и длительность выходов в центр, время на периферии поля), в группах ФИЗ + ОС и ФИЗ + + СТАНД различий не наблюдали (рис. 1 (а), (б)). У самцов группы ЛПС + ОС и ЛПС + + СТАНД не наблюдали различий по показателям двигательной активности, а у самок этих же групп – по показателям исследовательского поведения. Вместе с тем у самок группы ЛПС + ОС по сравнению с группой ЛПС + СТАНД было больше время нахождения на периферии (рис. 1 (б), р = 0.009, Н(2, n = 38) = 10.31, p = 0.006) и меньше время в центре поля (тенденция, р = 0.10, Н(2, n = 38) = = 9.95, p = 0.007), что свидетельствовало об увеличении тревожности.
В ОП условия содержания не оказывали влияния на число и длительность актов груминга, а также число уринаций, иногда их влияние проявлялось только на уровне тенденции.
Таким образом, кратковременное ОС вызывало различные реакции у крыс ФИЗ- и ЛПС-групп (табл. 2). У контрольных животных происходило некоторое увеличение двигательной активности и исследовательского поведения без изменения уровня тревожности. ОС у самцов группы ЛПС не было способно вызвать такие изменения, а у самок наблюдалась неадекватная реакция – происходило увеличение тревожности.
Влияние условий содержания на поведение крыс в приподнятом крестообразном лабиринте. На рис. 2 показаны изменения основных параметров поведения под влиянием различных условий содержания, а в табл. 1 указаны F и р при анализе с помощью Factorial ANOVA показателей, имеющих нормальное распределение. Из табл. 1 видно, что фактор ПОЛ оказывал существенное влияние на большинство параметров поведения. Как и ранее (Павлова и др., 2020), самки больше (р < 0.05) времени проводили в открытых рукавах, проходили большую дистанцию, с большей скоростью, больше времени находились в движении, совершали больше поворотов и переходов через центр, т.е. отличались меньшей тревожностью и большей двигательной активностью. Кроме того, на большинство показателей оказывал влияние фактор УСЛОВИЯ СОДЕРЖАНИЯ (табл. 1).
Рис. 2.
Влияние условий содержания крыс на различные параметры поведения (а–е) в приподнятом крестообразном лабиринте. Остальные обозначения как на рис. 1.
Fig. 2. The influence of the rats housing conditions on various parameters of behavior (а–е) in an elevated plus maze. The rest designations are the same as in Fig. 1.
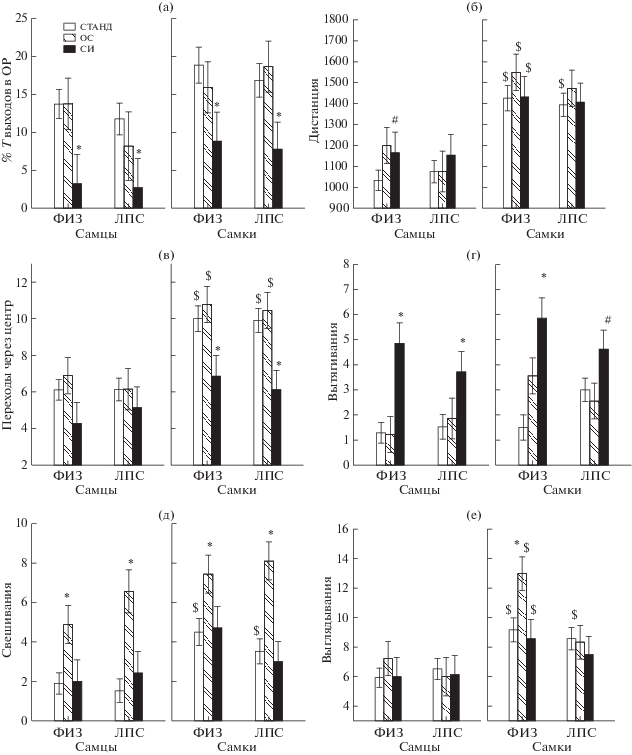
Социальная изоляция вызывала значительные изменения в поведении крыс в ПКЛ (табл. 2). Проведенный post hoc анализ показал, что процент времени выходов в открытые рукава был ниже после изоляции у самцов и самок как в группах ФИЗ + СИ, так и ЛПС + СИ (рис. 2 (а)) по сравнению с аналогичными группами животными, содержащимися в стандартных условиях. Число переходов через центр было ниже после изоляции только у самок как в группе ЛПС + СИ по сравнению с ЛПС + СТАНД, так и в группе ФИЗ + СИ по сравнению с ФИЗ + СТАНД (рис. 2 (в)). Число поворотов было меньше после изоляции только у самок в группе ЛПС + + СИ по сравнению с группой ЛПС + СТАНД. Характерной особенностью поведения крыс после изоляции были вытягивания (рис. 2 (г)). Число вытягиваний было больше у самцов в группе ФИЗ + СИ по сравнению с ФИЗ + + СТАНД (р = 0.001, Н(2, n = 44) = 14.11, p = = 0.001) и в группе ЛПС + СИ по сравнению с ЛПС + СТАНД (р = 0.006, Н(2, n = 33) = = 9.92, p = 0.007). У самок число вытягиваний было больше только в группе ФИЗ + СИ по сравнению с ФИЗ + СТАНД (р = 0.001, Н(2, n = 34) = 12.71, p = 0.002).
Таким образом, СИ вызывала у всех групп крыс увеличение тревожности, элементов поведения по оценке риска (вытягивания). Некоторое снижение двигательной активности происходило только у самок (табл. 2).
Кратковременное обогащение среды не приводило к изменениям уровня тревожности у контрольных групп крыс. Процент времени выходов в открытые рукава (рис. 2 (а)) и процент выходов в открытые рукава у самцов и самок в группах ФИЗ + ОС и ФИЗ + + СТАНД не отличался. После ОС у самцов в группе ФИЗ + ОС по сравнению с самцами ФИЗ + СТАНД была несколько больше (на уровне тенденции) длина пройденной дистанции (рис. 2 (б)), а также скорость движения и число поворотов. У самцов группы ЛПС + ОС указанные показатели двигательной активности не отличались от группы ЛПС + СТАНД. После ОС число свешиваний у самцов было больше в группе ФИЗ + ОС по сравнению с группой ФИЗ + СТАНД (рис. 2 (д), р = 0.013, Н(2, n = 44) = 8.41, p = 0.015) и в группе ЛПС + ОС по сравнению с группой ЛПС + СТАНД (р = 0.015, Н(2, n = 37) = 8.20, p = 0.017). У самок число свешиваний также было больше в группе ЛПС + ОС по сравнению с группой ЛПС + СТАНД (р = 0.012, Н(2, n = 38) = 10.71, p = 0.005) и в группе ФИЗ + ОС по сравнению с группой ФИЗ + СТАНД (тенденция, р = 0.08, Н(2, n = 34) = 5.37, p = 0.068). После ОС число выглядываний в открытые рукава у самок группы ФИЗ + ОС превышало данный показатель у самок группы ФИЗ + + СТАНД (рис. 2 (е)).
В ПКЛ не было обнаружено влияния условий содержания крыс на число и длительность актов груминга, а также число дефекаций и уринаций.
Таким образом, ОС не влияло на уровень тревожности крыс, но вызывало слабое увеличение двигательной активности и исследовательского поведения у контрольных групп крыс (табл. 2). У групп после провоспалительного стресса указанных изменений не наблюдалось. У всех групп животных увеличивалось поведение по оценке риска (свешивания).
Влияние условий содержания крыс на предпочтение сахарозы. При анализе процента выпитой сахарозы было обнаружено взаимодействие факторов УСЛОВИЯ СОДЕРЖАНИЯ × × ГРУППА (F2.131 = 3.74, р = 0.026). Post hoc анализ показал (рис. 3 (а)), что различные условия содержания не повлияли на процент выпитой сахарозы у самцов как в группе ФИЗ, так и ЛПС. У самок в группе ЛПС + СИ и ЛПС + ОС процент выпитой сахарозы был ниже, чем в группе ЛПС + СТАНД, а в группе ФИЗ + СИ несколько меньше (тенденция), чем в группе ФИЗ + СТАНД.
Рис. 3.
Влияние условий содержания крыс на процент потребленной сахарозы в тесте на предпочтение сахарозы. Остальные обозначения как на рис. 1.
Fig. 3. The effects of the rats housing conditions on percentage of sucrose consumption in a sucrose preference test. The rest designations are the same as in Fig. 1.
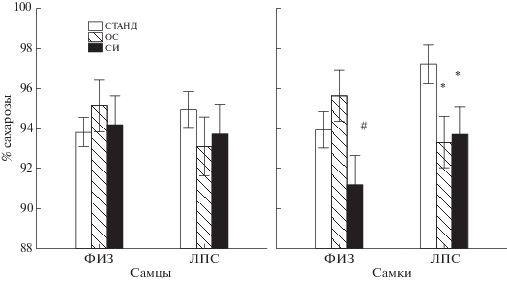
Таким образом, тест на предпочтение сахарозы выявил признаки депрессивно-подобного поведения только у самок ЛПС-группы после СИ и ОС.
Влияние условий содержания крыс на поведение в тесте вынужденного плавания. На время зависания крыс в течение пяти минут теста вынужденного плавания существенное влияние оказывали факторы УСЛОВИЯ СОДЕРЖАНИЯ (F2.399 = 17.5, p = 0.000), ВРЕМЯ (F4.399 = 211.7, p = 0.000), ГРУППА (F1.399 = 12.5, p = 0.000), наблюдалось взаимодействие факторов ПОЛ × ГРУППА (F1.399 = 7.3, p = 0.007), УСЛОВИЯ СОДЕРЖАНИЯ × ГРУППА (F2.399 = 3.4, p = 0.036). Согласно результатам post hoc анализа, у самцов и самок после ОС в группах ФИЗ и ЛПС на второй минуте теста время зависания было больше (рис. 4 (а), (б)), чем у животных в стандартных условиях содержания. Наибольшее влияние условия содержания оказывали на самок ЛПС-группы. У самок ЛПС группы после содержания в условиях ОС общее время зависания в тесте было больше (рис. 4 (в)), а латентность первого зависания меньше (рис. 4 (г)) по сравнению с самками, содержащимися в стандартных условиях. СИ не привела к изменениям во времени зависания у самцов группы ФИЗ и ЛПС, а также самок группы ФИЗ (рис. 4 (а), (б)). У самок ЛПС-группы после изоляции время зависания было меньше на пятой минуте теста, чем у группы ЛПС + СТАНД (рис. 4 (б)).
Рис. 4.
Влияние условий содержания крыс на время зависания в тесте вынужденного плавания. (а) – время зависания поминутно в тесте у самцов, (б) – у самок. (в) – суммарное время зависания в тесте. (г) – латентность первого эпизода зависания. По оси абсцисс на (а) и (б) – время, мин. Остальные обозначения как на рис. 1.
Fig. 4. The effects of the rats housing conditions on immobility time in a forced swimming test. (а) – an immobility time measured by minutes during test in males. (б) – in females. (в) – a total amount of immobility time in test. (г) – a latency of the first episode of immobility. On horizontal axis – on (а) and (б) – time, min. The rest designations are the same as in Fig. 1.
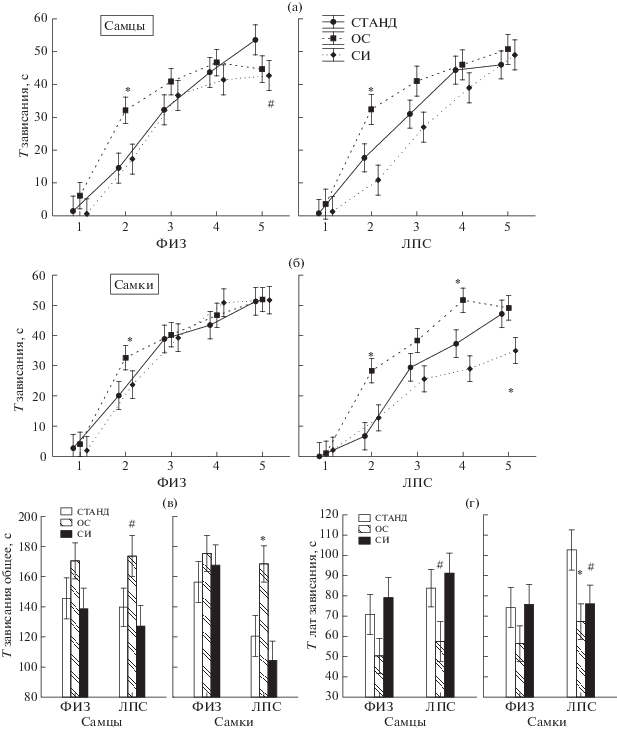
Таким образом, судя по результатам теста вынужденного плавания, содержание в условиях ОС приводило к появлению признаков депрессивно-подобного поведения. Наибольшие изменения в поведении наблюдались у самок ЛПС-группы.
Влияние условий содержания на уровень кортикостерона в сыворотке крови. Анализ уровня кортикостерона до и после теста вынужденного плавания показал влияние факторов ВОЗДЕЙСТВИЕ (F1.141 = 48.1, p = 0.000), ПОЛ (F1.141 = 176.7, p = 0.000), а также взаимодействие факторов ВОЗДЕЙСТВИЕ × УСЛОВИЯ СОДЕРЖАНИЯ (F2.141 = 3.3, p = 0.040), УСЛОВИЯ СОДЕРЖАНИЯ × ПОЛ (F2.141 = = 5.5, p = 0.005), УСЛОВИЯ СОДЕРЖАНИЯ × × ПОЛ × ГРУППА × ВОЗДЕЙСТВИЕ (F2,141 = 5.0, p = 0.008). Через 30–40 мин после теста вынужденного плавания в среднем наблюдалось увеличение содержания кортикостерона в крови, при этом у самок уровень кортикостерона был выше (р < 0.05), чем у самцов, как до (1150.9 ± 39.1 и 729.5 ± 39.6 нмоль/л соответственно), так и после воздействия (1442.5 ± 40.1 и 897.0 ± 39.1 нмоль/л соответственно) (рис. 5). Подробный post hoc анализ показал (рис. 5 (а)), что до воздействия (базовый уровень) содержание в условиях СИ или в ОС могло оказывать влияние на уровень кортикостерона, причем это наблюдалось только в группах ЛПС. У самцов в группе ЛПС после содержания в ОС или СИ уровень кортикостерона был ниже, чем у животных, содержащихся в стандартных условиях. У самок в группе ЛПС после содержания в ОС, наоборот, уровень кортикостерона был выше, чем после стандартных условий. После стрессирующего воздействия (рис. 5 (б)) статистически значимое увеличение уровня кортикостерона наблюдалось у всех групп крыс после СИ – как у ФИЗ-, так и ЛПС-групп, как у самцов, так и самок. У крыс, содержащихся в стандартных условиях, прирост кортикостерона наблюдался только у самок ЛПС-группы. У крыс, содержащихся в ОС, увеличение уровня кортикостерона наблюдалось у самцов ЛПС-группы и самок ФИЗ-группы.
Рис. 5.
Влияние условий содержания на уровень кортикостерона в сыворотке крови до (а) и после (б) теста вынужденного плавания. * – статистически значимые различия (р < 0.05) по сравнению со стандартными условиями содержания, + – в ЛПС-группе по сравнению с ФИЗ-группой в сходных условиях содержания, ↑ – увеличение после теста вынужденного плавания. n – число крыс в группе (ФИЗ/ЛПС).
Fig. 5. The influence of housing conditions on the level of corticosterone in blood samples before (а) and after (б) a forced swimming test. * – the significant difference (р < 0.05) relative to standard housing conditions, + – in the ЛПС group relative to ФИЗ group at the same housing conditions, ↑ – increase after a forced swimmimg test, n – a number of rats in a group (ФИЗ/ЛПС).
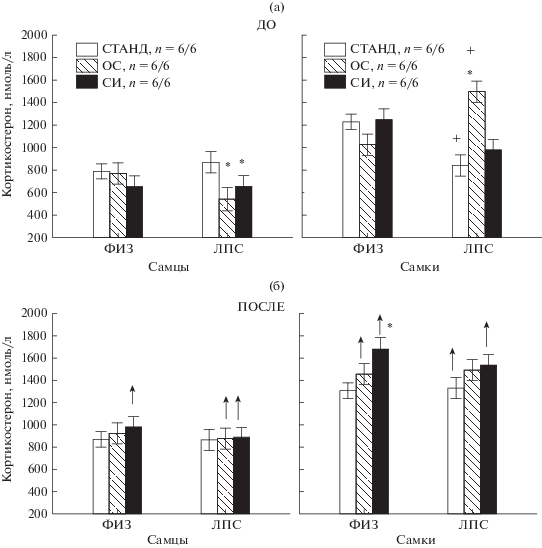
Таким образом, содержание крыс в измененных условиях не влияло на базовый уровень кортикостерона у ФИЗ-групп, но могло приводить к изменениям данного уровня в ЛПС-группах, что свидетельствует о том, что животные после раннего провоспалительного стресса наиболее уязвимы к измененным условиям содержания. Стрессирующее воздействие в виде теста вынужденного плавания выявило наибольший прирост уровня кортикостерона у крыс после СИ как в ФИЗ-, так и ЛПС-группах. Таким образом, содержание в СИ приводило к увеличению реактивности ГГН-оси на стрессирующее воздействие при вынужденном плавании.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В наших опытах социальная изоляция приводила к увеличению уровня тревожности в ПКЛ у всех групп крыс, а в ОП – только у животных ЛПС-групп. Кроме того, характерной особенностью поведения крыс в обоих тестах после СИ являлось увеличение числа вытягиваний (stretch attend postures), что в литературе рассматривается как признаки поведения по оценке рисков, принятия решения (Rodgers, Johnson, 1995). По-видимому, такие вытягивания в сторону открытого рукава ПКЛ или в сторону центра ОП заменяли полноценные выходы в аверсивную часть лабиринта или поля, и, исходя из этого, такие вытягивания можно рассматривать как косвенные признаки увеличения тревожности. Эти предположения подтверждают данные об уменьшении числа вытягиваний под влиянием анксиолитиков и об их увеличении при действии некоторых анксиогенов (Molewijk et al., 1995). В ОП после СИ у всех групп крыс также увеличивалась латентность ухода из центра поля, куда экспериментатор сажал животное в самом начале опыта. Такое увеличение латентности можно рассматривать как торможение двигательной активности при попадании в аверсивную обстановку, признак безынициативности животного, замирания при этом не наблюдали. Вероятно, торможение двигательной активности в начале опыта было следствием увеличения уровня тревожности. Важно подчеркнуть, что в наших опытах СИ не приводила к увеличению двигательной активности животных как в ОП, так и в ПКЛ, а у отдельных групп даже, наоборот, вызывала ее снижение.
В литературе имеются неоднозначные данные по влиянию СИ на проявления тревожного поведения у грызунов. В большинстве работ СИ усиливала тревожность (Bledsoe et al., 2011; Lukkes et al., 2012; 2009; Zhao et al., 2009; Rau et al., 2015; Brenes et al., 2020; Zhang et al., 2012; Weiss et al., 2004; Хоничева и др., 2002), в особенности если изоляция начиналась в раннем возрасте. Считается, что в раннем возрасте СИ, подобно другим стрессирующим воздействиям, вызывает сенситизацию механизмов мозга, связанных со стрессом и негативными эмоциями (моноаминергические системы мозга, структуры гипоталамо-гипофизарной надпочечниковой и иммунной системы, и др.), которые в зрелом возрасте приводят к более серьезным реакциям на повторные стрессы. После СИ показано увеличение возбудимости пирамидных нейронов базолатерального ядра миндалины, что связывают с нарушениями функционирования Са-каналов (Rau et al., 2015). Однако имеются данные как об уменьшении (Võikar et al., 2005; Thorsell et al., 2006; Kulesskaya et al., 2011; Weintraub et al., 2010), так и неизменности уровня тревожности после СИ (Alshammari et al., 2020; Pietropaolo et al., 2008). Анализ столь противоречивых данных позволяет сделать вывод о том, что на результаты СИ влияет возраст начала изоляции и ее длительность. Высказывалось предположение, что СИ в раннем подростковом возрасте является анксиогенной, а в позднем – анксиолитической. Требуется не меньше трех недель СИ для выявления поведенческого эффекта (Gorlova et al., 2018), краткосрочная изоляция в течение 10 дней не имела поведенческих эффектов (Alshammari et al., 2020).
В большинстве работ СИ вызывала у животных гиперлокомоцию, проявляющуюся в виде усиления двигательной и исследовательской активности в тестах на тревожность (Kulesskaya et al., 2011; Zhao et al., 2009; Voikar et al., 2005; Heidbreder et al., 2000; Krupina et al., 2020; Jahng et al., 2012 и др.). Реже наблюдалось снижение двигательной активности (Хоничева и др., 2002) или отсутствие эффекта (Weiss et al., 2004). Такие противоречивые данные объясняются особенностями аппарата (ОП, ПКЛ) тестирования, продолжительностью изоляции, возрастом, полом, линией животных и другими факторами (Lukkes et al., 2009).
В наших опытах СИ вызывала наибольшие изменения в поведении в тестах на тревожность у крыс ЛПС-групп. Применительно к влиянию двойного (ЛПС и СИ) стресса на тревожное поведение в зрелом возрасте нам известна только одна работа (Walker et al., 2009). Как и в наших опытах, крысы линии Вистар получали на третий и пятый дни жизни инъекции ЛПС (50 мкг/кг) или физиологического раствора. В возрасте 85 дней часть животных получала в течение трех дней стресс иммобилизации (restraint stress) (30 мин) и СИ. Хотя условия изоляции в наших опытах и в работе (Walker et al., 2009) существенно отличались, результаты были схожими. Крысы ЛПС-группы, получавшие в зрелом возрасте комбинированный стресс, проявляли тревожное поведение в большей степени, чем контрольные животные, что можно рассматривать как подтверждение гипотезы “двойного удара”. Это происходило, на наш взгляд, потому, что провоспалительный ЛПС-стресс в раннем возрасте вызывает сенситизацию иммунной и гипоталамо-гипофизарной надпочечниковой системы, из-за чего реакция на второй стресс оказывается более сильной, чем в случае одиночного стресса (Walker et al., 2009; Брошевицкая и др., 2020). СИ сама по себе приводила к увеличению провоспалительных цитокинов в крови (Alshammari et al., 2020). В двух других работах введение ЛПС использовали в качестве второго стресса в комбинации с СИ, которая служила первым стрессом (Gibb et al., 2008; Gandhi et al., 2007). При этом СИ длительностью в 2–4 нед усиливала эффекты “болезненного состояния”, вызываемого интоксикацией ЛПС или введением poly I:C, а также увеличивала уровни кортикостерона и провоспалительных цитокинов IL-6, IL-1бета, фактора некроза опухоли альфа. То есть также наблюдалась синергия двух эффектов.
Кратковременное помещение в обогащенную среду в наших опытах у контрольных крыс не оказывало существенного влияния на основные показатели, отражающие уровень тревожности, но вызывало слабое увеличение двигательной активности, исследовательского поведения, поведение по оценке риска (свешивания). Рост числа свешиваний в ПКЛ, по-видимому, был связан с увеличением исследовательского поведения после ОС. Другая реакция на ОС наблюдалась у крыс ЛПС-групп: у самцов изменений двигательной и исследовательской активности под влиянием ОС не наблюдалось, а у самок в открытом поле неожиданно увеличивался уровень тревожности. ОС подействовала на самок ЛПС-группы как стрессирующий фактор, сходный с СИ. Эти данные свидетельствуют о неадекватной реакции самок ЛПС-группы, сходной в чем-то с психопатологическими реакциями у человека. В большинстве работ с ОС животные помещались в обогащенную обстановку для постоянного проживания, в нашей же работе крысы пребывали в ОС через день по 20 мин, что, по-видимому, дало более слабый эффект, влияние на тревожность не выявлялось даже у контрольных групп. Тем не менее влияние ОС все же проявилось не только в поведении крыс, но и в увеличении веса их тела, что, возможно, было связано с увеличением мышечной массы.
В литературе представлено много работ, в которых показано, что ОС вызывает улучшение когнитивных функций и уменьшение тревожности (Mora-Callegos et al., 2019; Leger et al., 2015; Grippo et al., 2014; Pritchard et al., 2013; Hellemans et al., 2004; Hendershott et al., 2016). Показано, что ОС, предпринятое после СИ, способно ослабить его негативные последствия (Hellemans et al., 2004; Cao et al., 2017; Brenes et al., 2020). В опытах на мышах было установлено, что трехнедельное ОС является оптимальным временем для улучшения когнитивных функций и проявления антитревожных эффектов (Leger et al., 2015). Однако в ряде работ ОС не вызывало анксиолитических влияний (Mileva, Bielajew, 2015; Yildirim et al., 2012), а в других, наоборот, приводило к увеличению тревожности. Например, ОС в течение двух месяцев у самок-мышей приводило к увеличению тревожности (Pietropaolo et al., 2006). Что касается влияний ОС на тревожное поведение в условиях раннего ЛПС-стресса, то подобных работ в литературе нам не известно.
В нашей работе, судя по уменьшению предпочтения раствора сахарозы в тесте на ангедонию, признаки депрессивно-подобного поведения наблюдались только у самок ЛПС-группы, находящихся в СИ или ОС. То есть опять, как и в случае тревожности, именно в этой группе происходили наибольшие изменения в поведении после пребывания в новых условиях содержания. Наблюдаемое нами увеличение веса тела у самцов после СИ может быть связано как с гиперфагией и проявлением депрессивного состояния (Jahng et al., 2012; Brenes et al., 2020), так и c их низкой физической активностью и увеличением процента жира в весе тела (Grippo et al., 2014). В тесте вынужденного плавания, судя по небольшому увеличению общего времени иммобильности и уменьшению латентности первого эпизода зависания у крыс ЛПС-групп после ОС, можно предположить депрессивно-подобное поведение у самцов и самок после ОС. После СИ отличий со стандартными условиями содержания не возникало. Однако такая трактовка результатов не единственная. Подробный поминутный анализ времени зависания обнаружил наибольшие различия только на второй минуте теста, в конце теста различий не наблюдалось. Возможно, крысы, содержащиеся в ОС, быстрее обучались экономить силы в неизбегаемой ситуации пребывания в воде, тем более что данные литературы свидетельствуют об улучшении когнитивных способностей у животных, находящихся в ОС (Yildirim et al., 2012; Kulesskaya et al., 2011).
В литературе в большинстве работ показано, что СИ оказывает депрессивное действие, что проявляется в уменьшении предпочтения раствора сахарозы и увеличении суммарного времени зависания в тесте вынужденного плавания, иногда проявляется только один признак (Guarnieri et al., 2020; Wang et al., 2017; Mileva, Bielajew, 2015; Takatsu-Coleman et al., 2013). Имеются работы, в которых у крыс при СИ могло увеличиваться потребление раствора сахарозы без изменения процента предпочтения сахарозы, что рассматривается как нарушение порога подкрепления, компенсация за нарушение чувствительности к подкреплению (Hong et al., 2012; Yildirim et al., 2012; Brenes et al., 2020). В ряде работ, однако, различий в уровне потребления сахарозы и времени зависания под влиянием СИ обнаружено не было (Alshammari et al., 2020; Gorlova et al., 2018). В других работах при СИ уменьшалось общее время зависания в тесте вынужденного плавания (Huang et al., 2017; Voikar et al., 2005; Hong et al., 2012), что авторы трактуют как проявление антидепрессивного эффекта. В ряде работ была показана большая чувствительность самок к стрессу СИ (Hong et al., 2012; Huang et al., 2017). Это соответствует нашим данным: только самки ЛПС-группы показали признаки депрессивно-подобного поведения. Во многих работах животные, помещенные в ОС, проявляли меньше депрессивно-подобного поведения, чем животные после СИ или содержащиеся в стандартных условиях, что могло выявляться как в тесте вынужденного плавания, так и в тесте предпочтения сахарозы (Mileva, Bielajiw, 2015; Brenes et al., 2020). Содержание в ОС до или после СИ было способно предотвратить либо, соответственно, ослабить эффекты изоляции (Grippo et al., 2014).
Нам удалось найти только одну работу с комбинированным стрессом (СИ и провоспалительным стрессом, вызванным введением ЛПС), в которой изучалось депрессивно-подобное поведение. В опытах на мышах исследовали влияние ранней восьмидневной СИ совместно с действием ЛПС, который вводили за пять часов до начала теста у животных в возрасте 8–10 нед (Gong et al., 2018). Судя по уменьшению количества потребленной сахарозы и увеличению времени иммобильности в тесте вынужденного плавания, одиночные влияния как СИ, так и ЛПС вызывали депрессивные эффекты. Совместное же влияние двух стрессов вызывало не депрессивные, а наоборот, антидепрессивные эффекты (Gong et al., 2018). Авторы большое значение в развитии депрессивных эффектов после СИ придают потере микроглии в гиппокампе, которая после начальной активации претерпевает апоптоз. В ответ на ЛПС происходит пролиферация микроглии, число клеток микроглии не уменьшается после СИ, и исчезают поведенческие депрессивные эффекты. К сожалению, сравнивать с нашими данными невозможно ввиду больших методических отличий.
Анализ уровня кортикостерона в плазме крови показал, что не у всех групп животных наблюдался прирост после стрессирующего воздействия – ТВП. Возможно, меньшая реакция на стресс по сравнению с нашими ранее проведенными экспериментами связана с однодневным протоколом тестирования (Брошевицкая и др., 2020). Тем не менее статистически значимый прирост уровня кортикостерона наблюдался у всех групп крыс после СИ, что свидетельствовало об их большей реактивности на стрессирующее воздействие по сравнению с другими группами. В литературе имеются сведения о том, что СИ вызывает изменение функционирования ГГН-оси. Так, у крыс-изолянтов базовый уровень кортикостерона мог быть понижен (Martin, Brown, 2010; Roeckner et al., 2017; Mileva et al., 2017) либо увеличен, а ответ на острый стресс при этом сглажен (Jahng et al., 2012). В нашей работе пониженный базовый уровень кортикостерона наблюдался после СИ и ОС только у самцов ЛПС-группы. Другие авторы также отмечают пониженный базовый уровень кортикостерона и АКТГ после СИ, ответ на стрессирующие стимулы был увеличенный (Boero et al., 2018), при этом наблюдался длительный ответ по кортикостерону, АКТГ и кортикотропин-релизинг-гормону. Авторы приходят к выводу, что СИ меняет базовую активность ГГН-оси и нарушает отрицательную обратную связь после острого стресса, опосредованную глюкокортикоидными рецепторами. Увеличенное выделение кортикостерона после стресса наблюдали у самцов-изолянтов и в другой работе (Weiss et al., 2004).
ВЫВОДЫ
1. Тестирование крыс в открытом поле и приподнятом крестообразном лабиринте показало, что социальная изоляция приводила к увеличению тревожности животных, поведения по оценке риска (вытягивания), снижению двигательной и исследовательской активности. Наибольшие изменения после социальной изоляции происходили у крыс ЛПС-групп.
2. Содержание в условиях обогащенной среды у контрольных крыс не влияло на уровень тревожности, но вызывало слабое увеличение двигательной активности, исследовательского поведения и поведения по оценке риска (свешивания). После провоспалительного стресса у самцов изменений двигательной и исследовательской активности не наблюдалось, а у самок в открытом поле возникала неадекватная реакция – происходило увеличение тревожности.
3. Признаки депрессивно-подобного поведения согласно тесту на предпочтение сахарозы выявились у самок ЛПС-группы после социальной изоляции и обогащения среды.
4. Самки ЛПС-группы были наиболее подвержены влиянию условий содержания, у этой группы изменения показателей тревожно-депрессивного поведения были наиболее выражены.
5. Содержание в различных условиях могло приводить к изменениям базового уровня кортикостерона в плазме крови у крыс только в ЛПС-группах. Содержание крыс в условиях социальной изоляции приводило к наибольшему приросту уровня кортикостерона после теста вынужденного плавания, что свидетельствовало об увеличении реактивности ГГН-оси на стрессирующее воздействие.
Работа выполнена в рамках государственного задания ИВНД и НФ РАН по теме “Фундаментальные нейробиологические механизмы поведения, памяти и обучения в норме и при патологии (номер государственной регистрации АААА-А17-117-92040002-6) и при частичной поддержке Российского фонда фундаментальных исследований (проекты № 19-015-00129А и № 19-34-90022).
Список литературы
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Груздева В.А., Григорьян Г.А. Влияние раннего провоспалительного стресса на тревожное и депрессивно-подобное поведение крыс разного возраста. Рос. физиол. журн. им. И.М. Сеченова. 2020. 106 (6): 823–842.
Григорьян Г.А. Половые различия в поведении и биохимических маркерах у животных в ответ на нейровоспалительный стресс. Успехи физиол. наук. 2020. 51 (1): 18–32.
Павлова И.В., Брошевицкая Н.Д., Онуфриев М.В., Моисеева Ю.В. Половые различия в тревожно-депрессивном и оборонительном поведении крыс Вистар. Журнал высшей нервной деятельности им. И.П. Павлова. 2020. 70 (2): 243–258.
Хоничева Н.М., Чабак-Гарбач Р., Крупина Н.А. Поведенческие последствия изоляции в раннем онтогенезе у крыс: селективность тревожных состояний. Журнал высшей нервной деятельности им. И.П. Павлова. 2002. 52 (6): 743–749.
Alexander C., Rietschel E.T. Bacterial lipopolysaccharides and innate immunity. J. Endotoxin. Res. 2001. 7 (3): 167–202.
Alshammari T.K., Alghamdi H., Alkhader L.F., Alqahtani Q., Alrasheed N.M., Yacoub H., Alnaem N., AlNakiyah M., Alshammari M.A. Analysis of the molecular and behavioral effects of acute social isolation on rats. Behav. Brain Res. 2020. 377: 112191.
Berkiks I., Garcia-Segura L.M., Nassiri A., Mesfioui A., Ouichou A., Boulbaroud S., Bahbiti Y., Lopez-Rodriguez A.B., Hasnaoui E., El Hessni A. The sex differences of the behavior response to early Life immune stimulation: Microglia and astrocytes involvement. Physiol. Behav. 2019. 199: 386–394.
Bledsoe A.C., Oliver K.M., Scholl J.L., Forster G.L. Anxiety states induced by post-weaning social isolation are mediated by CRF receptors in the dorsal raphe nucleus. Brain Res. Bull. 2011.85 (3–4): 117–222.
Boero G., Pisu M.G., Biggio F., Muredda L., Carta G., Banni S., Paci E., Follesa P., Concas A., Porcu P., Serra M. Impaired Glucocorticoid-mediated HPA axis negative feedback induced by juvenile social isolation in male rats. Neuropharmacology. 2018. 133: 242–253.
Brenes J.C., Fornaguera J., Sequeira-Cordero A. Environmental enrichment and physical exercise attenuate the depressive-like effects induced by social isolation stress in rats. Front. Pharmacol. 2020. 11: 804.
Cao M., Pu T., Wang L., Marshall C., He H., Hu G., Xiao M. Early enriched physical environment reverses impairments of the hippocampus, but not medial prefrontal cortex, of socially-isolated mice. Brain Behav. Immun. 2017: 232–243.
Custódio C.S., Mello B.S.F., Filho A.J.M.C., de Carvalho Lima C.N., Cordeiro R.C., Miyajima F., Réus G.Z., Vasconcelos S.M.M., Barichello T., Quevedo J., de Oliveira A.C., de Lucena D.F., Macedo D.S. Neonatal immune challenge with lipopolysaccharide triggers long-lasting sex- and age related behavioral and immune/neurotrophic alterations in mice: relevance to autism spectrum disorders. Mol. Neurobiol. 2018. 55 (5): 3775–3788.
Fonken L.K., Frank M.G., Gaudet A.D., D’Angelo H.M., Daut R.A., Hampson E.C., Ayala M.T., Watkins L.R., Maier S.F. Neuroinflammatory priming to stress is differentially regulated in male and female rats // Brain Behav. Immun. 2018. 70: 257–267.
Gandhi R., Hayley S., Gibb J., Merali Z., Anisman H. Influence of poly I:C on sickness behaviors, plasma cytokines, corticosterone and central monoamine activity: moderation by social stressors. Brain Behav. Immun. 2007. 21 (4): 477–489.
Gibb J., Hayley S., Gandhi R., Poulter M.O., Anisman H. Synergistic and additive actions of a psychosocial stressor and endotoxin challenge: Circulating and brain cytokines, plasma corticosterone and behavioral changes in mice. Brain Behav. Immun. 2008. 22 (4): 573–589.
Gong Y., Tong L., Yang R., Hu W., Xu X., Wang W., Wang P., Lu X., Gao M., Wu Y., Xu X., Zhang Y., Chen Z., Huang C. Dynamic changes in hippocampal microglia contribute to depressive-like behavior induced by early social isolation. Neuropharmacology. 2018.135: 223–233.
Gorlova A.V., Pavlov D.A., Zubkov E.A., Morozova A.Y., Inozemtsev A.N., Chekhonin V.P. Three-week isolation does not lead to depressive-like disorders in rats. Bull. Exp. Biol. Med. 2018. 165 (2): 181–183.
Grippo A.J., Ihm E., Wardwell J., McNeal N., Scotti M.A., Moenk D.A., Chandler D.L., LaRocca M.A., Preihs K. The effects of environmental enrichment on depressive and anxiety-relevant behaviors in socially isolated prairie voles. Psychosom. Med. 2014. 76 (4): 277–284.
Guarnieri L.O., Pereira-Caxeta A.R., Medeiros D.C., Aquino N.S.S., Szawka R.E., Mendes E.M.A., Moraes M.F.D., Pereira G.S. Pro-neurogenic effect of fluoxetine in the olfactory bulb is concomitant to improvements in social memory and depressive-like behavior of socially isolated mice. Transl. Psychiatry. 2020. 10 (1): 33.
Hendershott T.R., Cronin M.E., Langella S., McGuinness P.S., Basu A.C. Effects of environmental enrichment on anxiety-like behavior, sociability, sensory gating, and spatial learning in male and female C57BL/6J mice. Behav. Brain Res. 2016. 314: 215–225.
Hellemans K.G., Benge L.C., Olmstead M.C. Adolescent enrichment partially reverses the social isolation syndrome.Brain Res.Dev.Brain Res. 2004. 150 (2): 103–115.
Hong S., Flashner B., Chiu M., ver Hoeve E., Luz S., Bhatnagar S. Social isolation in adolescence alters behaviors in the forced swim and sucrose preference tests in female but not in male rats. Physiol. Behav. 2012. 105 (2): 269–275.
Huang Q., Zhou Y., Liu L.Y. Effect of post-weaning isolation on anxiety- and depressive-like behaviors of C57BL/6J mice. Experimental Brain Research. 2017. 235: 2893–2899.
Jahng J.W., Yoo S.B., Ryu V., Lee J.H. Hyperphagia and depression-like behavior by adolescence social isolation in female rats. Int. J. Dev. Neurosci. 2012. 30: 47–53.
Kessler R.C., Petukhova M., Sampson N.A., Zaslav-sky A.M., Wittchen H.-U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. Int. J. Methods Psychiatr. Res. 21 (3): 169–184. 2012.
Krupina N.A., Shirenova S.D., Khlebnikova N.N. Prolonged social isolation, started early in life, impairs cognitive abilities in rats depending on sex. Brain sciences. 2020. 10: 799.
Kulesskaya N., Rauvala H., Voikar V. Evaluation of social and physical enrichment in modulation of behavioural phenotype in C57BL/6J female mice. PLoS One. 2011. 6 (9): e24755.
Leger M., Paizanis E., Dzahini K., Quiedeville A., Bouet V., Cassel J.C., Freret T., Schumann-Bard P., Boulouard M. Environmental enrichment duration differentially affects behavior and neuroplasticity in adult mice. Cereb. Cortex. 2015. 25 (11): 4048–4061.
Lukkes J.L., Watt M.J., Lowry C.A., Forster G.L. Consequences of post-weaning social isolation on anxiety behavior and related neural circuits in rodents. Front. Behav. Neurosci. 2009. 3: 18.
Lukkes J.L., Engelman G.H., Zelin N.S., Hale M.W., Lowry C.A. Post-weaning social isolation of female rats, anxiety-related behavior, and serotonergic systems. Brain Res. 2012. 1443: 1–17.
Martin A.L., Brown R.E. The lonely mouse: verification of separation-unduced model of depression in female mice. Behav. Brain Res. 2010. 207 (1): 196–207.
Mileva G.R., Bielajew C. Environmental manipulation affects depressive-like behaviours in female Wistar-Kyoto rats. Behav Brain Res. 2015. 293: 208–216.
Mileva G.R., Rooke J., Ismail N., Bielajew C. Corticosterone and immune cytokine characterization following environmental manipulation in female WKY rats. Behav. Brain Res. 2017. 316: 197–204.
Molewijk H.E., van der Poel A.M., Olivier B. The ambivalent behavior “stretched approach posture” in the rat as a paradigm to characterize anxiolytic drugs. Psychopharmacology. (Berl). 1995. 121 (1): 81–90.
Mora-Gallegos A., Fornaguera J. The effects of environmental enrichment and social isolation and their reversion on anxiety and fear conditioning. Behav. Processes. 2019. 158: 59–69.
Pietropaolo S., Feldon J., Yee B.K. Nonphysical contact between cagemates alleviates the social isolation syndrome in C57BL/6 male mice. Behav Neurosci. 2008. 122 (3): 505–515.
Pietropaolo S., Feldon J., Alleca E., Cirulli F., Yee B.K. The role of voluntary exercise in enriched rearing: a behavioral analysis, Behav. Neurosci. 2006. 4: 787–803.
Pritchard L.M., Van Kempen T.A., Zimmerberg B. Behavioral effects of repeated handling differ in rats reared in social isolation and environmental enrichment. Neurosci. Lett. 2013. 536: 47–51.
Rau A.R., Chappell A.M., Butler T.R. Ariwodola O.J., Weiner J.L. Increased basolateral amygdale pyramidal cell excitability may contribute to the anxiogenic phenotype induced by chronic early-life stress. J. Neurosci. 2015 35 (26): 9730–9740.
Rodgers R.J., Johnson N.J.T. Factor analysis of spatiotemporal and ethological measures in the murine elevated plus-maze test of anxiety. Pharmacol. Biochem. Behav. 1995. 52: 297–303.
Roeckner A.R., Bowling A., Butler T.R. Chronic social instability increases anxiety-like behavior and ethanol preference in male Long Evans rats. Physiol. Behav., 2017. 73: 179–187.
Takatsu-Coleman A.L., Patti C.L., Zanin K.A., Zager A., Carvalho R.C., Borçoi A.R., Ceccon L.M., Berro L.F., Tufik S., Andersen M.L., Frussa-Filho R. Short-term social isolation induces depressive-like behaviour and reinstates the retrieval of an aversive task: mood-congruent memory in male mice? J. Psychiatry Neurosci. 2013. 38 (4): 259–268.
Tenk C.M., Kavaliers M., Ossenkopp K.P. Neonatal treatment with lipopolysaccharide differentially affects adult anxiety responses in the light-dark test and taste neophobia test in male and female rats. Int. J. Dev. Neurosci. 2013. 31 (3): 171–180.
Tishkina A., Stepanichev M., Kudryashova I., Freiman S., Onufriev M., Lazareva N., Gulyaeva N. Neonatal proinflammatory challenge in male Wistar rats: Effects on behavior, synaptic plasticity, and adrenocortical stress response. Behav. Brain Res. 2016. 304: 1–10.
Thorsell A., Slawecki C.J., El Khoury A., Mathe A.A., Ehlers C.L. The effects of social isolation on neuropeptide Y levels, exploratory and anxiety-related behaviors in rats. Pharmacol. Biochem. Behav. 2006. 83: 28–34.
Vegeto E., Bonincontro C., Pollio G., Sala A., Viappiani S., Nardi F., Brusadelli A., Viviani B., Ciana P., Maggi A. Estrogen prevents the lipopolysaccharide-induced inflammatory response in microglia. J. Neurosci. 2001. 21 (6): 1809–1818.
Võikar V., Polus A., Vasar E., Rauvala H. Long-term individual housing in C57BL/6J and DBA/2 mice: assessment of behavioral consequences. Genes Brain Behav. 2005. 4 (4): 240–252.
Walker A.K., Nakamura T., Byrne R.J., Sundresan Naicker, Tynan R.J., Hunter M., Hodgson D.M. Neonatal lipopolysaccharide and adult stress exposure predisposes rats to anxiety-like behaviour and blunted corticosterone responses: implications for the double-hit hypothesis. Psychoneuroendocrinology. 2009. 34 (10): 1515–1525.
Wang H.T., Huang F.L., Hu Z.L., Zhang W.J., Qiao X.Q., Huang Y.Q., Dai R.P., Li F., Li C.Q. Early-life social isolation-induced depressive-like behavior in rats results in microglial activation and neuronal histone methylation that are mitigated by minocycline. Neurotox Res. 2017. 31 (4): 505–520.
Weintraub A., Singaravelu J., Bhatnagar S. Enduring and sex-specific effects of adolescent social isolation in rats on adult stress reactivity. Brain Res. 2010. 1343: 83–92.
Weiss I.C., Pryce C.R., Jongen-Relo A.L., Nanz-Bahr N.I., Feldon J. Effect of social isolation on stress-related behavioural and neuroendocrine state in the rat. Behav. Brain Res. 2004. 152: 279–295.
Wukitsch T.J., Brase E.C., Moser T.J., Kiefer S.W., Cain M.E. Differential rearing alters taste reactivity to ethanol, sucrose, and quinine. Psychopharmacology (Berl). 2020. 237 (2): 583–597.
Yildirim E., Erol K., Ulupinar E. Effects of sertraline on behavioral alterations caused by environmental enrichment and social isolation. Pharmacol. Biochem. Behav. 2012. 101 (2): 278–287.
Zhang Y., Zu X., Luo W., Yang H., Luo G., Zhang M., Tang S. Social isolation produces anxiety-like behaviors and changes PSD-95 levels in the forebrain. Neurosci. Lett. 2012. 514: 27–30.
Zhao X., Sun L., Jia H., Meng Q., Wu S., Li N., He S. Isolation rearing induces social and emotional function abnormalities and alters glutamate and neurodevelopment-related gene expression in rats. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2009. 3: 1173–1177.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


