Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 5, стр. 710-719
Хронические социальные стрессы изоляции и скученности у крыс по-разному влияют на научение инструментальному поведению и состояние гипоталамо-гипофизарно-адренокортикальной системы
В. В. Гаврилов 1, М. В. Онуфриев 2, Ю. В. Моисеева 2, Ю. И. Александров 1, Н. В. Гуляева 2, *
1 ФГБУН Институт психологии РАН (Лаборатория психофизиологии им. В.Б. Швыркова)
Москва, Россия
2 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
(Лаборатория функциональной биохимии нервной системы)
Москва, Россия
* E-mail: nata_gul@ihna.ru
Поступила в редакцию 23.11.2020
После доработки 20.04.2021
Принята к публикации 26.04.2021
Аннотация
Социальный стресс – широко распространенная проблема в современном мире; он разнообразен и определяется спецификой условий существования как у людей, так и у животных. Активно и эффективно моделируемыми на взрослых грызунах хроническими состояниями являются стресс изоляции и стресс скученности. Задачей настоящей работы было исследование влияния этих типов социального стресса у крыс на скорость научения совершать одно и то же инструментальное пищедобывательное поведение в одиночку и кооперируя с конспецификом. В крови животных определяли уровни кортикостерона и АКТГ для оценки состояния стресс-реализующей гипоталамо-гипофизарно-адренокортикальной системы (ГГАКС), а также нейротрофинов и провоспалительных цитокинов. Изоляционный стресс в отличие от скученности вызывал снижение эффективности научения – формирования нового опыта, как в индивидуальном, так и в кооперативном поведении. При этом усиления функционирования ГГАКС у стрессированных животных в обеих группах обнаружено не было. Более того, у животных в условиях скученности достоверно снижался уровень кортикостерона и возрастал уровень провоспалительного цитокина ИЛ-1бета. Полученные результаты позволяют предположить, что механизмы действия хронического стресса изоляции и скученности различны как на уровне стресс-реализующих систем организма, так и на уровне их влияния на интегративную функцию мозга.
ВВЕДЕНИЕ
Социальный стресс представляет собой существенную проблему для существования и развития человеческого общества. В частности, для современного человека важными являются как социальная изоляция, так и скученность – существование большого числа людей в малом пространстве. Обе эти проблемы широко распространены. Социальный стресс такого рода может служить важным звеном развития психопатологий. В связи с важностью проблемы необходимы исследования физиологических и молекулярных механизмов последствий социального стресса на моделях изоляции и скученности на грызунах. У социально организованных млекопитающих основными стрессорами являются не столько физические события, сколько изменения социального окружения животного. Как изоляция, так и скученность приводят к развитию стресса с существенными психосоциальными компонентами, сопровождающегося изменениями эмоционального состояния. В зависимости от природы, силы и продолжительности исходного стимула они могут изменять ответ гипоталамо-гипофизарно-адренокортикальной системы (ГГАКС) как в сторону увеличения, так и снижения (Bugajski, 1999), а также способствовать развитию различных патологических состояний. Например, в экспериментах на крысах показано, что стресс социальной изоляции и скученности стимулирует повышенное потребление алкоголя (Anacker, Ryabinin, 2010).
ГГАКС, обеспечивающая ответ организма на стрессорные факторы разной модальности, принципиально важна для реализации обучения и памяти как высшей формы нейропластичности (Gulyaeva, 2017). Одной из ключевых стадий каскадной нейроэндокринной системы трансдукции нейрогормональных сигналов из высших отделов мозга является выброс глюкокортикоидов в кровь (кортизола у человека, кортикостерона – у грызунов). Глюкокортикоиды, поступающие с кровью в мозг, связываются со специфическими рецепторами, плотность которых максимальна в отвечающих за эмоциональное состояние и обучение структурах лимбической системы (в первую очередь гиппокампе и амигдале), а также фронтальной коре, и таким образом оказывают прямое влияние на функционирование этих структур и регуляцию поведения (см. обзор Gulyaeva, 2019а). Глюкокортикоиды могут стимулировать воспалительные процессы, в том числе в гиппокампе, и нейровоспаление рассматривается как один из важнейших механизмов неблагоприятного действия хронического стресса на обучение и память (Gulyaeva, 2019 a,b).
Задача данной работы – исследовать влияние хронического стресса изоляции и скученности на скорость научения крысами инструментальному пищедобывательному поведению в одиночку и кооперируя с конспецификом, а также оценить состояние ГГАКС и уровни провоспалительных цитокинов и нейротрофинов в крови животных.
МЕТОДИКА
Эксперименты проводили с соблюдением принципов гуманности, изложенных в директивах Европейского Сообщества (86/609/ЕС) и одобренных Комитетом по медицинской этике в соответствии с положением Института психологии и Института высшей нервной деятельности и нейрофизиологии РАН о работе с экспериментальными животными.
В экспериментах участвовали 24 взрослых самца крыс Long Evans из вивария Института психологии РАН, которые в возрасте 1 мес были отсажены от матери и сибсов и рассажены в одинаковые клетки из пластика размером 35 × 26 × 20 см. Условия содержания: 12-часовой цикл день-ночь с неограниченным доступом к воде и пище до начала обучения. Животные были разделены на три группы: крысы первой группы (изоляты, n = 8) с месячного возраста находились в домашних клетках в одиночестве, крысы из второй группы (контроль, n = 8) содержались в таких же домашних клетках по 4 особи, крысы из третьей группы (скученные, n = 8) содержались все вместе в одной клетке. Крысы все время с момента рассадки по клеткам в возрасте 1 мес до декапитации в 5–6-месячном возрасте находились в одних и тех же условиях (по 1, 4 или 8 особей в одной клетке) в зависимости от группы.
Исследование проводилось в экспериментальной клетке кубической формы с ребром 60 см, разделенной на две равные части прозрачной перегородкой. В каждой половине клетки по углам располагались кормушка и педаль, нажатие на которую приводило к автоматической подаче пищи в кормушку. Крысы помещались в клетку и самостоятельно (без помощи экспериментатора) должны были научиться нажимать на педаль для получения порции пищи. В исследуемом дефинитивном поведении научившиеся крысы совершали многократные побежки от педали к кормушке и обратно. При научении совместному поведению предварительно обученные крысы в разных половинах клетки должны были одновременно нажать на педали, что приводило к подаче порции пищи им обеим.
Животные подвергались частичной пищевой депривации при ежедневном контроле веса и состояния животного (снижение не более 20% от первоначального на начало обучения). Обучение проводили ежедневно в вечернее время обычно после 16 ч. Экспериментальная сессия у каждой крысы длилась 30 мин. Крысы обучались добывать себе пищу (кусочки сыра размером 1–2 мм3) индивидуально каждая в своей половине клетки, после чего уже индивидуально обученные крысы должны были научиться “кооперировать” – синхронизировать нажатие на свою педаль с нажатием “партнера” на свою педаль, поскольку только при одновременном нажатии на педали они получали порцию пищи. Отмечали номер сессии, в которой крыса при индивидуальном научении начинала регулярно совершать циклическое поведение “педаль-кормушка”, а при научении кооперировать – номер сессии, в которой число “эффективных” нажатий (одновременных нажатий, приводящих к получению порции пищи) превышало 50% от числа всех нажатий, хотя бы одним из животных в паре. Видеозапись поведения проводили с использованием камеры Sony DСR-SR68, вмонтированной в потолок экспериментальной клетки, а также осуществляли фотоэлектрическую регистрацию отметок нажатия на педаль и опускания головы в кормушку для подсчета числа однотипных актов поведения.
Учитывая временные затраты на научение, поведенческая часть проводилась в 2 этапа: сначала обучались 14, потом 10 крыс (на каждом этапе были крысы из всех трех групп). Разница во времени между этапами составляла 1 мес. Для каждого этапа отбирались крысы одного возраста, так чтобы на начало обучения всем крысам было по 3 мес. Длительность одной сессии обучения как в индивидуальном, так и в кооперативном поведении одной крысы была 30 мин ежедневно. Пары для кооперативного научения формировались по мере научения и готовности к следующей стадии исследования из крыс той же группы и сходным временем научения индивидуальному поведению. Состав пар крыс оставался стабильным на протяжении всего эксперимента.
После завершения научения всех животных декапитировали (возраст на момент декапитации 5–6 мес, процедура проводилась с 10 до 12 ч утра) и собирали кровь (в течение 30 сек сразу после декапитации), которую центрифугировали при 1500 × g, а полученную сыворотку хранили при –80°C. Уровни кортикостерона и АКТГ в сыворотке определяли при помощи соответствующих наборов для иммуноферментного анализа (EIA-5186 и EIA-3647; DRG Systems, Germany) в соответствии с инструкцией производителя. Концентрации нейротрофинов BDNF и NGF в сыворотке крови измеряли с использованием Total BDNF Quantikine ELISA Kit and Rat beta-NGF DuoSet ELISA kit (DBNT00 и DY556; R&D Systems, USA), а провоспалительных цитокинов IL-1beta, IL-6 и TNF-alpha при помощи соответствующих наборов для иммуноферментного анализа (RLB00, R6000B и RTA00; R&D Systems).
Обработка и анализ поведенческих данных проводились двумя экспериментаторами независимо, после чего результаты сопоставлялись. Материал для биохимического исследования передавался без указания на принадлежность животных к той или иной группе.
Для определения значимости различий поведенческих показателей между группами крыс использовали U-критерий Манна–Уитни. Сравнивали скорости научения по медианам распределений в группах. Полученные биохимические результаты после проверки на нормальность распределения (Shapiro-Wilk W-test) анализировали при помощи однофакторного дисперсионного анализа (one-way ANOVA) с последующим апостериорным тестом Tukey (HSD multiple comparison test). При выявлении значимых эффектов проводили межгрупповые апостериорные сравнения с коррекцией Bonferroni для множественных сравнений. Оценивали корреляции между параметрами с помощью анализа по Pearson. Данные представлены в виде, соответствующем использованному статистическому анализу. Различия считали значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
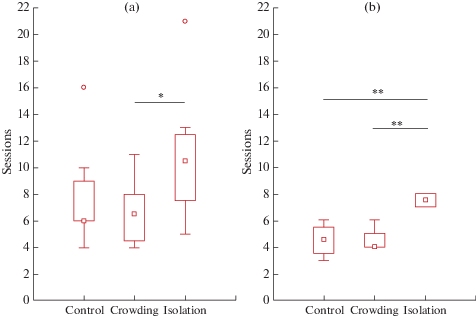
Крысы, находившиеся в условиях изоляции, достоверно дольше научались инструментальному пищедобывательному поведению как индивидуально, так и кооперируя с сородичами. Увеличение времени индивидуального научения в группе “изолятов” по сравнению с контролем было статистически недостоверно (рис. 1).
Рис. 1.
Скорость научения индивидуальному (а) и кооперативному (b) инструментальному пищедобывательному поведению у крыс. По оси абсцисс – условия содержания крыс: контроль, скученность, изоляция; по оси ординат – число 30-минутных сессий, потребовавшихся для научения исследуемому поведению. Показаны значения медианы – $\square $ , значения квартилей 25–75%, минимумы – $ \bot $, максимумы – $ \top $ и выбросы – $\bigcirc $. Статистически значимые различия U-критерия Манна–Уитни в сравниваемых группах (* – p < 0.05; ** – p < 0.01).
Fig. 1. The rate of learning individual (а) and cooperative (b) instrumental food-obtaining behavior in rats. On the X-axis – the conditions of keeping rats: control, crowding, isolation; on the Y-axis – the number of 30-minute sessions required to learn the behavior under study. Median values – $\square $, quartile values of 25–75%, min. value – $ \bot $ , max. value – $ \top $ , and outliers – $\bigcirc $ are shown. Statistically significant differences in the Mann–Whitney U-test in the compared groups (* – p < 0.05; ** – p < 0.01).
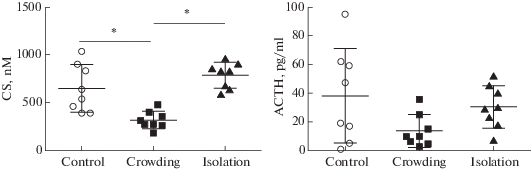
У крыс, подвергнутых воздействию скученности или изоляции, предполагаемой активации ГГАКС по уровню кортикостерона и АКТГ в крови не произошло (рис. 2). В результате дисперсионного анализа выявлено влияние социального стресса на уровень кортикостерона в крови крыс (F(2.21) = 15.77; p < < 0.001), но не на уровень АКТГ (F(2.21) = = 2.60; p = 0.097). Кроме того, в группе “скученных” уровень кортикостерона в крови был статистически значимо ниже (более чем в 2 раза), а уровень АКТГ в 2.8 раза ниже (хотя и недостоверно из-за разброса данных), чем уровень данных гормонов в контрольной группе. Ни уровень кортикостерона, ни уровень АКТГ в крови крыс после изоляции существенно не отличались от контроля.
Рис. 2.
Влияние скученности и изоляции на уровень кортикостерона (CS) и АКТГ (ACTH) в крови крыс. Показаны значения среднего и индивидуальные значения для каждого животного. Проведен однофакторный дисперсионный анализ с последующим апостериорным тестом Tukey и коррекцией Bonferroni для множественных сравнений. * p < 0.05 – различия между группами.
Fig. 2. The effects of crowding and isolation on the levels of corticosterone (CS) and ACTH in the blood of rats. The values of the average and individual values for each animal are shown. A single-factor analysis of variance was performed, followed by a posteriori Tukey test and Bonferroni correction for multiple comparisons. * p < 0.05 – differences between groups.
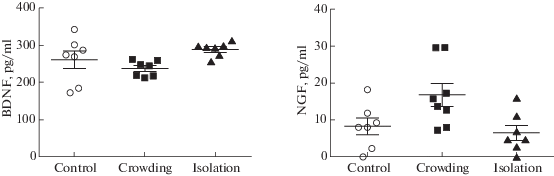
Социальный стресс не оказал значимого влияния на уровень BDNF (F(2.18) = 2.97; p = = 0.076) и NGF (F(2.19) = 4.67; p = 0.22) в крови крыс (рис. 3). Воздействие скученности или изоляции не повлияло на уровни нейротрофинов, которые статистически значимо не отличались от контрольных значений.
Рис. 3.
Влияние скученности и изоляции на уровень BDNF и NGF в крови крыс. Показаны значения среднего и индивидуальные значения для каждого животного. Проведен однофакторный дисперсионный анализ с последующим апостериорным тестом Tukey и коррекцией Bonferroni для множественных сравнений.
Fig. 3. The effects of crowding and isolation on the levels of BDNF and NGF in the blood of rats. M ± SEM and individual values for each animal are shown. A single-factor analysis of variance was performed, followed by a posteriori Tukey test and Bonferroni correction for multiple comparisons.
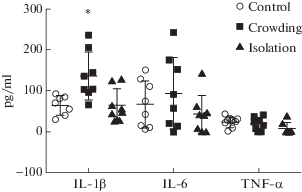
Дисперсионный анализ показал, что социальный стресс оказывал статистически значимое влияние только на уровень IL-1β (F(2.20) = 6.7; p < 0.01), но не на уровень IL-6 (F(2.21) = 1.2; p = 0.32) и TNF-α (F(2.21) = 2.3; p = 0.12) (рис. 4). Из двух типов стресса только воздействие скученности вызвало статистически значимое увеличение в 2.12 раза уровня IL-1β по сравнению с контролем, а изоляция не оказала значимого эффекта.
Рис. 4.
Влияние скученности и изоляции на уровень IL-1β, IL-6 и TNF-α в крови крыс. Показаны значения среднего и индивидуальные значения для каждого животного. Проведен однофакторный дисперсионный анализ с последующим апостериорным тестом Tukey и коррекцией Bonferroni для множественных сравнений.* p < 0.05–отличие от контроля.
Fig. 4. The effects of crowding and isolation on the level of IL-1β, IL-6, and TNF-α in the blood of rats. M ± SEM and individual values for each animal are shown. * p < 0.05 – statistically significant differences between groups (one-way ANOVA followed by Tukey test and Bonferroni correction for multiple comparisons).
В результате корреляционного анализа по Пирсону были выявлены статистически значимые положительные корреляции между уровнем кортикостерона и АКТГ (r = 0.67) и уровнем NGF и IL-1β (r = 0.58). При анализе корреляций отдельно в группах, в контроле отмечена положительная корреляция между уровнем BDNF и TNF (r = 0.67), а в группе изоляция между уровнем кортикостерона и АКТГ (r = 0.88).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Задачей настоящей работы было исследование эффективности научения у крыс, с раннего возраста содержащихся в стрессогенных условиях изоляции или скученности, совершать инструментальное пищедобывательное поведение в одиночку или кооперируя с конспецификом. Результаты такого исследования, подкрепленные биохимическими данными о состоянии стресс-реализующих систем, могут способствовать выяснению специфики стрессорных состояний, возникающих при социальной изоляции и перенаселении. Установлено, что самцы крыс Long Evans, с месячного возраста содержащиеся в условиях изоляции или скученности, при научении их начиная с 3-месячного возраста инструментальному пищедобывательному поведению, показывают разные результаты, а именно, изолированные учатся дольше, чем крысы из контрольной группы, и крысы, содержащиеся скученно, между которыми, в свою очередь, не выявлено достоверных различий по скорости научения как индивидуальному, так и совместному поведению.
В обзорах исследований стресса, в том числе, социального, связанного с разными условиями содержания животных (Шабанов, Лебедев, 2007; Sandi, Haller, 2015; Lupien et al., 2009), отмечается, что проявления стресса зависят от стадии развития особи, на которой она подверглась стрессу (в неонатальном, ювенильном или взрослом периоде жизни), что приводит к изменениям активности преимущественно разных гуморальных регуляторных систем и проявляется в виде разных поведенческих паттернов, включающих такие характеристики, как степень агрессивности, уровень социальной мотивации и социальных взаимодействий, а также антисоциальных проявлений. В большинстве исследований с изоляцией и скученностью анализировалась реализация поведения, а не его формирование (научение). Одним из первых среди немногочисленных исследований связи условий содержания животных с научением было исследование (Goeckner et al., 1973), в котором при научении крыс поведениям разной сложности были получены данные, свидетельствующие о том, что при скученности ухудшается научение сложному поведению (решение проблем в лабиринте), при этом скорость научения более простому поведению (избегание электрошока или торможение избегательного поведения) значимо не отличается от контроля. При изоляции в раннем онтогенезе затрудняется формирование инструментальных навыков (Шабанов, Лебедев, 2007). В доступной нам литературе мы не нашли полученных в рамках одного исследования данных о скорости научения инструментальному поведению крыс, социально депривированных (“изолятов”) или содержащихся в стесненных условиях (“скученных”).
Считается, что длительный социальный стресс вызывает тревожность и депрессию. Botelho и соавт. (Botelho et al., 2007) исследовали поведение в приподнятом крестообразном лабиринте у половозрелых самцов Wistar, содержавшихся в одинаковых домашних клетках по 1, 2, 3, 4, 6, 8, 12, 16 или 24 особи. Изменения в поведении были обнаружены только у крыс, содержавшихся в одиночку или вдвоем, а также в группах из 16 и 24 особей. Уменьшение числа заходов и времени пребывания в открытых рукавах лабиринта авторы связывают с усилением тревожности у крыс в этих группах. Было установлено, что длительность проживания в таких условиях влияла на величину эффекта. Анксиогенный эффект изоляции и скученности на время пребывания в открытых рукавах лабиринта был показан в ряде работ (Armario et al., 1984; Ferrari et al., 1998; Ruis et al., 1999; Weiss et al., 2004). Однако в других исследованиях (Morrison, Thatcher, 1969; Pellow et al., 1985; Hilakiv et al., 1989), напротив, наблюдалось увеличение времени пребывания в открытых рукавах у крыс из этих групп. Противоречивость данных может быть связана не только с числом животных, содержащихся в клетке, но и их видовой принадлежностью, полом и возрастом, содержанием в обедненной или обогащенной среде, а также типом теста и особенностями его проведения.
В ряде работ было показано, что крысы способны кооперировать для достижения результата (Schuster, 2002), в том числе, в инструментальном поведении (Гаврилов, Арутюнова, 2013; Lopuch, Popik, 2011). В этих исследованиях взрослые самцы крыс Long Evans содержались в индивидуальных клетках, и им требовалось значительно больше времени научиться кооперировать в инструментальном поведении по сравнению с научением этому же поведению в одиночку. Это наше исследование является первым, в котором изучалось влияние социального стресса на научение инструментальному кооперативному поведению. Использованная нами модель кооперативного инструментального пищедобывательного поведения была во многом сходна с описанной в работе Lopuch и Popik (2011). В их исследовании, целью которого было изучение влияния на формирование кооперации таких факторов, как зрительный, обонятельный и слуховой контакт животных, на половозрелых самцах крыс Sprague-Dawley, содержавшихся в клетках по 4 особи, было установлено, что крысы могут кооперировать – одновременно засовывать нос в отверстия с поилками, расположенными на одной из стенок клетки, что являлось условием получениями ими капли сахарозы. Следует отметить, что показатель степени кооперации, измеряемый как отношение успешных одновременных актов к общему числу актов, на протяжении всего исследования был сравнительно низок – около 20%, по сравнению с таковым в нашем исследовании – около 50%, которого достигали крысы во всех исследованных нами группах, хотя крысам-изолятам для достижения такого результата требовалось достоверно больше времени, чем крысам из других групп.
В нашем исследовании крыс, которые были подвержены хроническому социальному стрессу изоляции или скученности в течение 2 мес, в дальнейшем ежедневно в течение 30 мин обучали инструментальному пищедобывательному поведению как индивидуально, так и в кооперации с сородичами, находившимися в соседних отсеках клетки. Различные этапы обучения животных осуществлялись в течение 1 мес, причем после окончания каждой экспериментальной сессии крыс возвращали в условия изоляции или скученности. В связи с этим и изолированные животные, и крысы, подверженные стрессу скученности, на протяжении последнего месяца перед выведением из эксперимента были ежедневно на короткий срок извлечены из условий, обеспечивающих стрессорный эффект. Этот факт следует учесть при интерпретации полученных результатов. В первую очередь, это касается отсутствия достоверных изменений показателей ГГАКС при изоляционном стрессе. Возможно, с вышеназванными условиями эксперимента связано и то, что ни один из типов хронического социального стресса не оказал статистически значимого влияния на уровень циркулирующих BDNF и NGF, а также IL-6 и TNF-α.
Некоторые авторы считают, что хронический стресс изоляции является более повреждающим, чем стресс скученности, и реактивность ГГАКС и провоспалительного ответа на последующий гетеротипический стресс усиливается у животных, перенесших изоляционный стресс (Gądek-Michalska et al., 2019; 2017; Dronjak, Gavrilović, 2005). Cреди патофизиологических механизмов, формирующихся в результате социальной изоляции, выявили увеличение чувствительности гипофиза к кортикотропин-рилизинг гормону и нарушение регуляции ГГАКС по типу отрицательной обратной связи (Serra et al., 2005). По данным нашего биохимического исследования из двух типов примененного социального стресса более выраженный эффект на состояние ГГАКС и провоспалительный ответ оказал стресс скученности, а не стресс изоляции.
В исследованиях других авторов различный по длительности стресс изоляции оказывал разнонаправленный эффект на активность ГГАКС и провоспалительный ответ. Показано, что в результате 11 дней изоляционного стресса в крови крыс не изменился уровень кортикостерона и АКТГ, но существенно возрос уровень IL-1β (Gądek-Michalska et al., 2017). Увеличение протяженности изоляции на срок до 2 мес привело к снижению уровня кортикостерона в крови и к уменьшению реактивности ГГАКС на последующий иммобилизационный стресс (Sánchez et al., 1998). После более длительной (13 нед) изоляции также зарегистрированы снижение уровня кортикостерона и повышение уровня АКТГ в крови крыс (Miachon et al., 1993). По нашим данным, совмещение изоляции с обучением животных, в котором задействованы регионы мозга, отвечающие за регуляцию ГГАКС, по-видимому, могло компенсировать возможное снижение реактивности ГГАКС.
Длительность стресса скученности также по-разному влияла на динамику изменения уровня кортикостерона, АКТГ и IL-1β в крови крыс. Так, уровень кортикостерона и IL-1β повышался только на 3-й день стресса и снижался до контрольного уровня на 7-й и 14-й день стресса, а уровень АКТГ возрос только через 14 дней стрессирования животных (Gądek-Michalska et al., 2017). В более раннем исследовании 7-дневный стресс скученности также не вызвал изменений уровня кортикостерона и АКТГ в крови крыс (Bugajski et al., 2002). Применение “жестких” условий скученности, длительность которой была 27 дней, индуцировало увеличение уровня кортикостерона в крови и повышение аккумуляции стресс-гормона в шерсти крыс (Uarquin et al., 2016). Результаты нашего эксперимента свидетельствуют о снижении уровня кортикостерона, повышении уровня IL-1β при отсутствии изменений в уровне IL-6 и TNF-α в крови крыс после хронического стресса скученности, что может указывать на модулирующее действие периферического IL-1β на центральные механизмы регуляции активности ГГАКС (Gądek-Michalska et al., 2011). Известно, что провоспалительные цитокины, в том числе и IL-1β, индуцируют провоспалительный ответ в эндотелиальных клетках сосудов, формирующих ГЭБ. Кроме того, провоспалительные цитокины могут напрямую проникать в мозг через циркумвентрикулярные органы и стимулировать воспалительный ответ в регионах мозга (McCusker, Kelley, 2013; Quan, Bank, 2007). С другой стороны, катехоламины при стрессе опосредуют повышение периферического и центрального уровня провоспалительных цитокинов (Johnson et al., 2005). Поскольку в условиях острого стресса экспериментально показана активация воспалительных процессов при избытке глюкокортикоидов и активации вегетативной нервной системы (см. обзор Gulyaeva, 2019b), в наших экспериментах достаточно неожиданное на первый взгляд сочетание снижения активности ГГАКС и повышенного IL-1β может свидетельствовать о том, что запущенные в остром периоде и сохраняющиеся при хронизации стресса скученности провоспалительные процессы становятся независимыми от повышенного уровня глюкокортикоидов и сохраняются даже при истощении ГГАКС. Важно также отметить, что провоспалительный тренд прослеживался только на уровне IL-1β, а уровни IL-6 и TNF-α не были повышены. Изменения различных цитокинов в крови описаны при различных формах острого и хронического стресса, но, к сожалению, до сих пор не сформулирована концепция, которая позволила бы установить общие закономерности динамики отдельных цитокинов при действии стрессорных факторов. Результаты, хотя и достаточно многочисленные, в основном, феноменологические, разрозненные, и, по-видимому, зависят от линии, пола и возраста животных, специфических особенностей и периода действия стрессорного фактора, что мешает найти общие закономерности.
Сопоставляя результаты поведенческого и биохимического исследования, можно констатировать, что мы получили весьма неожиданный результат, который, несомненно, требует дальнейшего анализа и более глубокого исследования. Оказалось, что хронический социальный стресс скученности, объективно более тяжелый как по состоянию ГГКАС (функционирование этой системы подавлено в этой группе животных), так и по выраженному усилению воспалительных процессов, не влиял на инструментальное обучение в использованной в данной работе парадигме. С другой стороны, хроническая изоляция на фоне адаптированной к этому стрессорному воздействию ГГКАС и отсутствии провоспалительного тренда, достоверно ухудшала обучение. Эти данные добавляют новые факты в большой пул работ о неоднозначном влиянии стрессорных факторов на процессы обучения. Интерпретация этих данных, в частности, может включать и ранее приведенные нами теоретические и эмпирические аргументы в пользу того, что стрессорный компонент, обусловливая обратимую блокаду части наиболее “сложного” имеющегося у индивида опыта, может при определенной выраженности стресса увеличивать скорость и эффективность обучения, упрощать его в новой для индивида ситуации (Александров и др., 2017).
Как и в случае неоднозначных соотношений между функционированием ГГАКС и уровнями цитокинов при стрессе, необходимость учесть разнообразные формы стресса (вызванного стрессорными факторами различной модальности, силы и длительности) и различные формы обучения оказалась существенным препятствием для формулировки общей концепции влияния стрессорных факторов на обучение, которая так и не была сформулирована до настоящего времени. Тем не менее работы по исследованию влияния на когнитивную функцию социально значимых форм стресса несомненно необходимы не только для установления фундаментальных закономерностей, но и для трансляции полученных результатов в медицину и социальную сферу.
ЗАКЛЮЧЕНИЕ
В данной работе впервые проведено параллельное исследование хронического стресса изоляции и скученности у крыс на скорость научения совершать одно и то же инструментальное пищедобывательное поведение в одиночку и кооперируя с конспецификом и сопоставлено с активностью ГГАКС и уровнем цитокинов в крови у этих животных. Изоляционный стресс в отличие от скученности вызывал снижение эффективности научения – формирования нового опыта, как в индивидуальном, так и в кооперативном поведении без активации ГГАКС у стрессированных животных в обеих группах. В условиях скученности достоверно снижался уровень кортикостерона и возрастал уровень провоспалительного цитокина ИЛ-1бета. Полученные результаты указывают на различие механизмов действия хронического стресса изоляции и скученности как на уровне стресс-реализующих систем организма, так и на уровне их влияния на интегративную функцию мозга.
Исследование поддержано грантами РФФИ 18-00-00125 КОМФИ, 18-00-00245 КОМФИ, 18-00-00246 (K).
Список литературы
Александров Ю.И., Сварник О.Е., Знаменская И.И., Колбенева М.Г., Арутюнова К.Р., Крылов А.К., Булава А.И. Стресс, болезнь и научение как условия регрессии. Вопросы психологии. 2017. № 4. С. 87–101.
Гаврилов В.В., Арутюнова К. Р. Формирование индивидуального опыта в модели кооперативного поведения у крыс. Эволюционная и сравнительная психология в России: традиции и перспективы. М.: Изд-во Институт психологии РАН, 2013. с. 106–112.
Шабанов П.Д., Лебедев А.A. Зоосоциальное поведение крыс. Обзоры по клинической фармакологии и лекарственной терапии. 2007. 5 (31): 2–77.
Anacker A.M., Ryabinin A.E. Biological contribution to social influences on alcohol drinking: evidence from animal models. Int. J. Environ. Res. Public Health. 2010.7 (2): 473–493.
Armario A., Castelhanos J.M., Balasch J. Effect of crowding on emotional reactivity in male rats. Neuroendocrinology, 1984. 39: 330–333.
Botelho S., Estanislau C., Morato S. Effects of under- and overcrowding on exploratory behavior in the elevated plus-maze. Behavioural Processes, 2007. V. 74. P. 357–362. https://doi.org/10.1016/j.beproc.2006.12.006
Bugajski J. Social stress adapts signaling pathways involved in stimulation of the hypothalamic-pituitary-adrenal axis. J. Physiol. Pharmacol., 1999. 50 (3): 367–379.
Bugajski J., Gadek-Michalska A., Bugajski A.J. Effect of constitutive- and inducible-cyclooxygenase in the carbachol-induced pituitary-adrenocortical response during social stress. J Physiol Pharmacol. 2002 Sep. 53 (3): 453–462.
Dronjak S., Gavrilović L. Activity of pituitary–adrenal axis in rats chronically exposed to different stressors, Acta Vet. 55 (2005): 121–129.
Ferrari P.F., Palanza P., Parmagiani S., Rodgers R.J. Interindividual variability in Swiss male mice: relationship between social factors, aggression, and anxiety. Physiol. Behav., 1998. 5: 821–827.
Gądek-Michalska A., Tadeusz J., Bugajski A., Bugajski J. Chronic Isolation Stress Affects Subsequent Crowding Stress-Induced Brain Nitric Oxide Synthase (NOS) Isoforms and Hypothalamic-Pituitary-Adrenal (HPA) Axis Responses Neurotoxicity Research, 2019. 36: 523–539.
Gądek-Michalska A., Bugajski A., Tadeusz J., Rachwalska P., Bugajski J. Chronic social isolation in adaptation of HPA axis to heterotypic stress. Pharmacol Rep. 2017 Dec. 69 (6): 1213–1223.
Gądek-Michalska A., Tadeusz J., Rachwalska P., Spyrka J., Bugajski J. Effect ofprior stress on interleukin-1β and HPA axis responses to acute stress. Pharmacol Rep. 2011. 63 (6): 1393–1403.
Goeckner D.J., Greenough W.T., Mead W.R. Deficits in learning tasks following chronic overcrowding in rats. J. Personality and Social Psychol., 1973. 28 (2): 256–261.
Gulyaeva N.V. Molecular Mechanisms of Neuroplasticity: An Expanding Universe.Biochemistry (Moscow). 2017. 82 (3): 237–242. https://doi.org/10.1134/S0006297917030014
Gulyaeva N.V. Functional Neurochemistry of the Ventral and Dorsal Hippocampus: Stress, Depression, Dementia and Remote Hippocampal Damage. Neurochem Res. 2019a; 44 (6):1306–1322. https://doi.org/10.1007/s11064-018-2662-0
Gulyaeva N.V. Biochemical Mechanisms and Translational Relevance of Hippocampal Vulnerability to Distant Focal Brain Injury: The Price of Stress Response. Biochemistry (Mosc). 2019b. 84 (11): 1306–1328.
Hilakiv L.A., Ota M., Lister R.G. Effect of isolation on brain monoamines and the behavior of mice in tests osf exploration, locomotion, anxiety and behavior ‘despair’. Pharmacol. Biochem. Behav., 1989. 33: 371–374.
Johnson J.D., Campisi J., Sharkey C., Kennedy S.L., Nickerson M., Greenwood B., Fleshner M. Catecholamines mediate stress-induced increases in peripheral and centralinflammatory cytokines. Neuroscience 2005. 135: 1295–1307.
Łopuch S., Popik P. Cooperative Behavior of Laboratory Rats (Rattus norvegicus) in an Instrumental Task. Journal of Comparative Psychology, 2011. 125 (2). P. 250–253.
Lupien S.J., McEwen B.S., Gunnar M.R., Heim C. Effects of stress throughout the lifespan on the brain, behaviour and cognition. Nature Rev. Neurosci., 2009. 10: 434–445. https://doi.org/10.1038/nrn2639
McCusker R.H., Kelley K.W. Immune-neural connections: how the immune system’s response to infectious agents influences behavior. J Exp Biol 2013. 216: 84–98.
Miachon S., Rochet T., Mathian B., Barbagli B., Claustrat B. Long-term isolation ofWistar rats alters brain monoamine turnover, blood corticosterone, and ACTH.Brain Res Bull. 1993. 32 (6): 611–614.
Morrison B.J., Thatcher K. Overpopulation effect on social reduction of emotionality in the albino rat. J. Comp. Physiol. Psychol., 1969. 69, 658–662.
Pellow S., Chopin P., File S.E., Briley M. Validation of open: closed arm entries in an elevated plus-maze as a measure of anxiety in the rat. J. Neurosci. Meth., 1985. 14: 149–167.
Quan N., Banks W.A. Brain-immune communication pathways. Brain Behav Immun. 2007. 21: 727–735.
Ruis M.A., te Brake J.H., Buwalda B., De Boer S.F., Meerlo P., Korte S.M., Blokhuis H.J., Koolhaas J.M. Housing familiar male wildtype rats together reduces the long-term adverse behavioural and physiological effects of social defeat. Psychoneuroendocrinology, 1999. 24: 285–300.
Sánchez M.M., Aguado F., Sánchez-Toscano F., Saphier D. Neuroendocrine and immunocytochemical demonstrations of decreased hypothalamo-pituitary-adrenal axis responsiveness to restraint stress after long-term social isolation. Endocrinology. 1998 Feb. 139 (2): 579–587.
Sandi C., Haller J. Stress and the social brain: behavioural effects and neurobiological mechanisms. Nature Reviews Neuroscience, 2015, 16 (5): 290–304. https://doi.org/10.1038/nrn3918
Schuster R. Cooperative coordination as a social behavior. Human Nature, 2002. 13: 47–83.
Serra M., Pisu M.G., Floris I., Biggio G. Social isolation-induced changes in the hypothalamic-pituitary-adrenal axis in the rat. Stress. 2005. 8 (4): 259–264.
Uarquin D.G., Meyer J.S., Cardenas F.P., Rojas M.J. Effect of Overcrowding on Hair Corticosterone Concentrations in Juvenile Male Wistar Rats. J Am Assoc Lab Anim Sci. 2016 Nov. 55 (6): 749–755.
Weiss I.C., Pryce C.R., Jongen-Relo A.L., Nanz-Bahr N.I., Feldon J. Effect of social isolation on stress-related behavioural and neuroendocrine state in the rat. Behav. Brain Res., 2004. 152: 279–295.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


