Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 3, стр. 400-414
Влияние умеренного хронического стресса самок крыс до и во время беременности на сенсомоторное развитие, уровень тревожности и когнитивные функции потомства
О. В. Яковлева 1, *, К. С. Богатова 1, В. В. Скрипникова 1, Г. Ф. Ситдикова 1
1 Кафедра физиологии человека и животных, ИФМиБ, Казанский (Приволжский) федеральный университет
Казань, Россия
* E-mail: a-olay@yandex.ru
Поступила в редакцию 30.11.2020
После доработки 23.02.2021
Принята к публикации 02.03.2021
Аннотация
В нашей работе исследовали влияние умеренного непредсказуемого хронического стресса у самок крыс в течение двух недель до наступления и двух недель во время беременности на развитие потомства в период от рождения до 3 месяцев жизни. Воздействие прегестационного стресса приводило к повышению тревожности самок уже к началу беременности, которая сохранялась и в первую неделю лактации. Пренатальный стресс приводил к уменьшению размера помета, снижению массы тела детенышей, отставанию в физическом развитии и созревании некоторых сенсомоторных рефлексов в первые две недели после рождения. Сниженная в первые две недели двигательная активность восстанавливалась к 26-му дню жизни (Р), изменений мышечной силы и двигательной координации у крыс не выявили. Во всех анализируемых возрастах (Р16, 26, 80) наблюдали снижение исследовательской активности и повышение уровня тревожности. Нарушение процессов обучения, пространственной и непространственной памяти было показано в тесте водный лабиринт Морриса (Р21–22) и тесте на распознавание нового объекта (Р72–90). Таким образом, полученные нами результаты свидетельствуют о том, что умеренный стресс самок до и во время беременности приводит не только к нарушениям физического и неврологического развития в раннем онтогенезе, но также и повышению уровня тревожности и когнитивным дисфункциям, сохраняющимся во взрослом периоде жизни потомства.
ВВЕДЕНИЕ
В последние десятилетия большое внимание уделяется проблеме воздействия стресса, переживаемого матерью, на потомков. Значительный объем эпидемиологических данных и экспериментальных исследований показал, что стресс матери во время беременности приводит к нарушению поведения, психическим и когнитивным расстройствами у несовершеннолетних и взрослых потомков (Weinstock, 2005; 2008; Ордян, 2006; Meyers, 2018; Стратилов и др., 2020). Так, показано, что материнский стресс приводит к преждевременным родам (до 37-й недели), рождению детей с низкой массой тела (менее 2.5 кг) (Rondo et al., 2003), беспокойству детей в первые полгода жизни (Davis et al., 2007), замедлению развития ходьбы, речи, приучения к туалету (Meyers, 2018). Ряд исследователей связывают материнский стресс с появлением у детей эмоциональных проблем, гиперактивности, дефицита внимания и синдрома Тауретта (Davis, Sandman, 2012, Meyers, 2018; Стратилов и др, 2020). Кроме того, пренатальный стресс ассоциируют с более высоким риском заболевания шизофренией, инсультом и болезнью Паркинсона (Shrira, 2019), депрессиями и злоупотреблением наркотиками в поздний постнатальный период (Стратилов и др., 2020) и сердечно-сосудистыми заболеваниями (Czarzasta et al., 2019).
Для моделирования пренатального стресса у животных часто используют инъекции гидрокортизона, воздействие одного стрессора (иммобилизация) (Ордян и др., 2006; Czarzasta et al., 2019) или комбинацию двух стрессоров (иммобилизация и инъекция, иммобилизация и яркий свет) (Fride, Weinstock, 1984; Holubova et al., 2017). Однако воздействие одного и того же фактора может приводить к привыканию животных (Fride, Weinstock, 1984). Поэтому для создания хронического умеренного непредсказуемого стресса применяют различные меняющиеся стрессоры, которые характеризуются небольшой силой и действуют в течение длительного времени, не вызывая адаптации (Willner, 2017; Huang et al., 2010).
Как правило, моделирование стресса у самок начинается со второй/третьей недели беременности, что исключает развитие стресса в начальный период беременности, а кроме того, такие исследования в основном фокусируются на отдельных возрастных периодах развития потомства (Hougaard et al., 2005; 2011; Николаева, Белолюбская, 2012; Jafari et al., 2019). При этом только несколько работ посвящены изучению прегестационного стресса самок на развитие потомства. В одном из таких исследований оценивали влияние умеренного хронического непредсказуемого стресса в течение трех недель до беременности на когнитивные функции взрослых потомков (Huang et al. 2010), а в другой использовали иммобилизационный стресс в прегестационный период для оценки депрессии у самок и развитие потомства (Czarzasta et al., 2019).
Целью нашей работы было проанализировать влияние умеренного хронического непредсказуемого стресса самок до и во время беременности на физическое и сенсомоторное развитие, силу мышц и координацию движений, уровень тревожности и когнитивные способности их потомства в ранний и отсроченный постнатальный периоды. Мы также оценили уровень тревожности самок до и во время беременности, а также в период лактации.
МЕТОДИКА
Объектом исследования были крысы линий Wistar обоего пола в возрасте от 2 до 90 дней жизни (Р). Животные содержались в условиях вивария КФУ в полипропиленовых клетках (32 × 40 × 18 см) при стабильной комнатной температуре, 12-часовом режиме дня/ночи и свободном доступе к корму и воде. Эксперименты проводились в соответствии с Директивой ЕС 2010/63/EU для проведения экспериментов на животных и одобрены Локальным этическим комитетом КФУ.
Самок крыс Wistar содержали по 2–3 особи в клетке в стандартных условиях вивария. Cамок разделили на две группы – контрольную (n = 8) и с моделью хронического стресса (n = 9). До начала эксперимента самки были протестированы на уровень тревожности с помощью тестов темно-светлая камера и открытое поле. Для формирования умеренного хронического стресса крысы подвергались действию непредсказуемых стимулов с еженедельным тестированием на уровень тревожности в течение 14 дней. Затем в каждую клетку подсаживали самца для спаривания на одну неделю (Czarzasta et al., 2019), и через неделю после отсадки воздействие стресса повторялось еще 14 дней (рис. 1 (а)). У 7 самок из контрольной группы и 6 самок из группы животных, подвергающихся хроническому стрессу, наступила беременность. Уровень тревожности самок оценивали каждую неделю во время беременности и через неделю после родов во время лактации согласно схеме (рис. 1 (а–в)). За 1–2 дня до родов беременных самок рассаживали в индивидуальные клетки. После рождения крысята находились с матерью 30 дней без ограничения доступа к воде и пище.
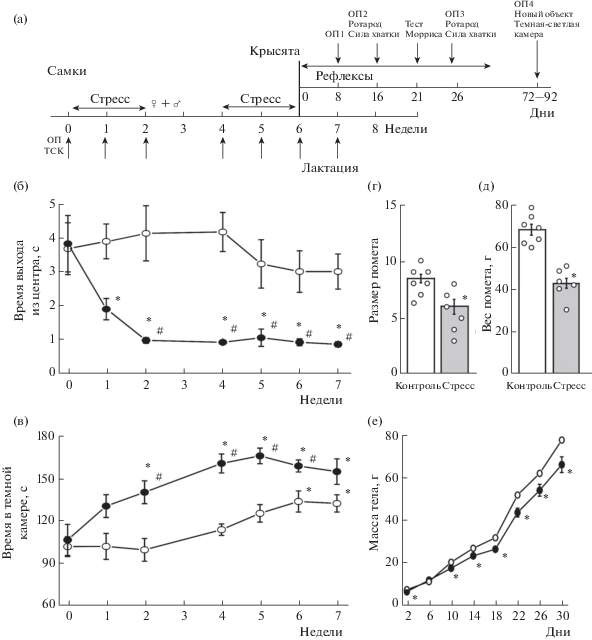
Рис. 1.
Влияние непредсказуемого хронического умеренного стресса на уровень тревожности самок
крыс, на размер и вес их помета. (а) – схема эксперимента (ОП 1–4 – открытое поле
в возрастах 8, 16, 26, 80 дней жизни, соответственно, НО – тест новый объект, ТСК
– тест темно-светлая камера,  +
+  – подсадка самца). (б) – время выхода из центра открытого поля и (в) – время нахождения
в темной камере в тесте темно-светлая камера самок крыс до, во время беременности
и в первую неделю лактации группы Контроля (белый круг) и группы Стресс (черный круг).
По оси Х указаны недели эксперимента, где 0 – это исходные показатели. * p < 0.05 относительно исходного уровня, # p < 0.05 относительно контрольной группы. Размер (г) и вес помета (д), рожденного от
самок группы Контроль (белый столбик) и самок группы Стресс (серый столбик). Результаты
представлены в виде среднего значения и ошибки среднего, белые кружки – оригинальные
данные размера и веса помета в группах. * – p < 0.05 относительно контрольной группы. (е) – масса крыс, рожденных от самок группы
Контроль (белый круг) и самок группы Стресс (серый круг) в первый месяц жизни. * –
p < 0.05 относительно контрольной группы. Результаты представлены в виде среднего значения
и ошибки среднего.
– подсадка самца). (б) – время выхода из центра открытого поля и (в) – время нахождения
в темной камере в тесте темно-светлая камера самок крыс до, во время беременности
и в первую неделю лактации группы Контроля (белый круг) и группы Стресс (черный круг).
По оси Х указаны недели эксперимента, где 0 – это исходные показатели. * p < 0.05 относительно исходного уровня, # p < 0.05 относительно контрольной группы. Размер (г) и вес помета (д), рожденного от
самок группы Контроль (белый столбик) и самок группы Стресс (серый столбик). Результаты
представлены в виде среднего значения и ошибки среднего, белые кружки – оригинальные
данные размера и веса помета в группах. * – p < 0.05 относительно контрольной группы. (е) – масса крыс, рожденных от самок группы
Контроль (белый круг) и самок группы Стресс (серый круг) в первый месяц жизни. * –
p < 0.05 относительно контрольной группы. Результаты представлены в виде среднего значения
и ошибки среднего.
Fig. 1. The effect of unpredictable mild chronic stress on the anxiety level of female rats,
the size and weight of their litter. (a) – experimental design (OP 1–4 – open field
at the ages of 8, 16, 26, 80 days of life, NO – test new object, DLCh – test dark-light
chamber,  +
+  – mating. (б) the time of leaving the center of the open field and (в) – the time
spent in the dark chamber Dark-light chamber test of female rats before, during pregnancy
and in the first week of lactation of the control group (white circle) and stress
group (black circle). The X-axis indicates the weeks of the experiment, where 0 is
the initial values. * p < 0.05 compared to initial value, # p < 0.05 compared to the control group. Size (г) and weight of litter (д) born from
control females (white bar) and females from the stress group (gray bar), Results
are presented as mean and error of mean, white circles are original data on litter
size and weight in groups. * – p < 0.05 compared to the control group. (е) – weight of rats born from females of the
control group (white circle) and females of the stress group (gray circle) in the
first month of life. * – p < 0.05 compared to the control group. Results are presented as mean and SEM.
– mating. (б) the time of leaving the center of the open field and (в) – the time
spent in the dark chamber Dark-light chamber test of female rats before, during pregnancy
and in the first week of lactation of the control group (white circle) and stress
group (black circle). The X-axis indicates the weeks of the experiment, where 0 is
the initial values. * p < 0.05 compared to initial value, # p < 0.05 compared to the control group. Size (г) and weight of litter (д) born from
control females (white bar) and females from the stress group (gray bar), Results
are presented as mean and error of mean, white circles are original data on litter
size and weight in groups. * – p < 0.05 compared to the control group. (е) – weight of rats born from females of the
control group (white circle) and females of the stress group (gray circle) in the
first month of life. * – p < 0.05 compared to the control group. Results are presented as mean and SEM.
Умеренный хронический непредсказуемый стресс формировали путем воздействия следующих факторов: белый шум, наклон клетки под углом 30°, искусственная освещенность в течение темного периода суток и затемненность в течение светлого периода суток, пищевая депривация, отсутствие подстилки в клетке. Время действия каждого стрессора составило 12 ч в сутки в течение 6 дней. При этом один и тот же стрессор не повторялся в течение недели для того, чтобы не возникло привыкание (Ragan et al., 2013).
Потомство было разделено на 2 группы: 1) контрольная – крысята (n = 61, N = 7, где n – количество крысят в эксперименте, N – количество пометов), рожденные контрольными самками; 2) Стресс – крысята (n = 36, N = 6), рожденные от самок, находящихся 14 дней до и 14 дней во время беременности в условиях хронического умеренного непредсказуемого стресса (рис. 1 (а)). У животных всех групп определяли вес при рождении и количество животных в помете, регистрировали день отлипания ушной раковины, появления первичного волосяного покрова, прорезывания резцов и открытия глаз.
Для исследования созревания соматосенсорной системы использовали стандартную батарею тестов, которая позволяет оценить поведенческий фенотип крыс в период вскармливания и включает следующие тесты: переворачивание на плоскости, отрицательный геотаксис, избегание обрыва, реакция на акустический стимул, обонятельная реакция, визуальное избегание обрыва, переворот в свободном падении, маятник (Миронов, Бунатян, 2012; Gerasimova et al., 2017; Яковлева и др., 2019). Тесты проводили за 2 дня до возраста формирования рефлекса в контроле согласно методическим указаниям (Миронов, Бунатян, 2012) и литературным данным (Gerasimova et al., 2017). Регистрировали возраст крысят, в котором впервые появлялся наблюдаемый рефлекс. Тесты проводили до полного формирования рефлекса во всех пометах. Тестирование проводили в одно и то же время суток в тихой затемненной комнате под нагреваемой лампой. Для снижения времени отделения от матери на выполнение теста крысятам давалось от 10 до 60 сек. Параллельно с опытным проводилось тестирование помета от контрольной самки. Анализ половых различий потомства проводили у животных, достигших половой зрелости, в тестах открытое поле, темно-светлая камера и распознавание нового объекта.
Тест открытое поле позволяет оценить динамику и выраженность элементарных поведенческих актов у грызунов в стрессовых условиях (Naik et al., 2015). Тест проводили на самках и потомстве возраста Р8, 16, 26 и 80. Крыс помещали в центр круглой арены диаметром 30 см (Р8), 60 см (Р16, Р26) или в центр квадратного поля (Р80) площадью 100 × 100 см, которые разлинованы на квадраты размером 5 × 5 см, 10 × 10 см, 20 × 20 см, соответственно (Open Science, Россия). Оценивали вертикальную и горизонтальную двигательную активность, исследование отверстий, время выхода из центра поля, акты груминга. Каждый тест записывался с помощью цветной видеокамеры Sony SSC-G118 (Китай), захватывающей приставки и программы Pinnacle Studio (Corel Corporation, Ottawa, Canada) на персональном компьютере и обсчитывался после проведения эксперимента независимым исследователем. Тест проводили в течение 1 или 3 мин в зависимости от возраста. После каждой пробы манеж очищали от продуктов дефекации/уринации и тщательно протирали 70% этиловым спиртом.
Тест темно-светлая камера основан на врожденной неприязни грызунов к ярко освещенным областям, поэтому применяется для оценки уровня тревожности (Bourin, Hascoet, 2003). Исследование эмоционального состояния проводилось при помощи аппаратно-программного комплекса “Шелтер” (Нейроботикс, Москва, Россия) у самок и потомства возраста Р72-90. Испытательная установка представляет собой замкнутое пространство размером 40 × 20 × 20 см (Ширина × Высота × Глубина), состоящее из двух камер, разделенных перегородкой, в которой имеется проход. Тест проводили в течение 3 мин, регистрировали длительность пребывания в светлой камере.
Тест удержание на горизонтальной сетке проводился для оценки развития мышечной силы в возрастах Р8, Р16 и Р26. Животное помещалось на проволочной сетке, которая мягко встряхивалась, чтобы дать крысе возможность зацепиться за проволоку (Weydt et al., 2003). Сетка переворачивалась на 180° и удерживалась на высоте 45 см над дном клетки. Записывалось время в секундах, проведенное на сетке. Для анализа использовалось наибольшее значение из трех попыток в течение одного подхода.
Тест на координацию движений проводили на аппарате Ротарод (Neurobotix, Россия) в возрастах Р16 и Р26. Данный тест показывает общую моторную функцию конечностей, а также двигательно-координационные нарушения (Karl, 2003). Регистрировали время удержания животного (в секундах) и расстояние (в см) на цилиндре, вращающемся со скоростью 5 об/мин. Проводили три сессии с интервалом 20–30 мин. Лучший результат записывался.
Тест на распознавание нового объекта используется для анализа непространственной памяти, который основан на естественной потребности животных исследовать новые объекты, и не требует внешней мотивации, награды или наказания (Antunes, Biala, 2012; Lueptow, 2017). Исследование проводили на крысах Р72–90. Тест представляет собой две 10-минутные сессии, которые проводят в домашней клетке. Первую сессию проводили для адаптации и запоминания крысой двух одинаковых объектов, помещенных в противоположные углы клетки. По истечении 10 минут крысу вынимали, заменяли один из знакомых объектов на незнакомый. В ходе второй 10-минутной сессии проводили запись эксперимента на камеру. При обработке видеозаписи регистрировали время (в секундах), потраченное на исследование нового и знакомого объектов (Lueptow, 2017).
Тест водный лабиринт Морриса является одной из основных моделей для изучения пространственной памяти и процесса обучения у лабораторных грызунов (Terry, 2009; Ивлиева и др., 2016, Yakovleva et al., 2020). Исследование проводили на крысах возраста Р21–22. Тест проводили в цилиндрической емкости диаметром 1 м и высотой 0.4 м (Open Science, Россия), которая была заполнена водой (температура 26–28°С), подкрашенной нежирным молоком. По периметру емкости располагались ориентиры для навигации различной формы и цвета. Устанавливали спасательную платформу так, чтобы уровень платформы был ниже уровня воды (Terry, 2009).
Крыс осторожно опускали в воду и позволяли искать платформу в течение 180 с (Terry, 2009). Обучение включало 6 подходов с перерывами в 15 с для оценки кратковременной памяти. Через 1 ч и через 24 ч после окончания обучения проводилась проверка запоминания положения платформы для оценки долговременной памяти. Каждый тест записывался с помощью цветной видеокамеры Sony SSC-G118 (Китай), захватывающей приставки и программы Pinnacle Studio (Corel Corporation, Ottawa, Canada) на персональном компьютере, и обсчитывался после проведения эксперимента независимым исследователем.
Траектория плавания была проанализирована вручную у 15 животных из каждой группы, и были определены четыре основных типа стратегии поиска: тигмотаксис, когда животное проводит большую часть времени у стены (некогнитивная форма); вторжение (случайный поиск), когда животное плавает вдоль стены, но также двигается и в центральные области; сканирование, при котором исследуются центральные области арены; и сканирование цели (направленный поиск) – плавание вблизи платформы (Terry, 2009; Ивлиева и др., 2016, Yakovleva et al., 2020).
Статистическую обработку проводили при помощи непараметрических и параметрических методов с использованием пакета прикладных программ Origin Pro software (OriginLab Corp, USA). Для проверки выборки на нормальное распределение применяли тест Колмогорова–Смирнова и F-тест для равных дисперсий. При нормальном распределении групповые данные сравнивались с использованием однофакторного дисперсионного анализа (One Way ANOVA) с последующим анализом Бонферрони для оценки достоверных различий. При ненормальном распределении групповые данные сравнивались при помощи ANOVA по Kruskal–Wallis test с последующим анализом U-критерия Манна–Уитни. Различия считались статистически значимыми при p < 0.05 для параметрического и P < 0.05 для непараметрического методов анализа; n – количество животных. Результаты представлены в виде M ± m, где М – среднее значение, m – ошибка среднего либо М (Q1–Q2), где М – медиана, Q – квартиль.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Влияние умеренного непредсказуемого стресса до и во время беременности на уровень тревожности самок
Время выхода из центра открытого поля в группе контроля не изменялось в течение всего периода наблюдений и составило 3.8 ± ± 0.8 с (n = 8) в начале эксперимента, 4.1 ± 0.6 с (n = 7, р > 0.05) во время беременности и 3.0 ± ± 0.5 с (n = 7, р > 0.05) в первую неделю после родов (рис. 1 (б)). В группе самок, подвергшихся влиянию стресса, время выхода из центра снизилось с 3.6 ± 0.7 с (n = 9) до 1.9 ± ± 0.3 с (n = 6, p < 0.05) через одну неделю воздействия умеренного непредсказуемого стресса, через две недели – до 1.0 ± 0.1 с (p < < 0.05, n = 6), и далее не изменялось как во время беременности, так и после родов (0.9 ± ± 0.1 с, p < 0.05, n = 6, рис. 1 (б)).
Количество актов груминга в открытом поле в группе контроля не изменялось в течение всего периода наблюдений и составило 1.9 ± 0.8 (n = 8) в начале эксперимента, 2.2 ± ± 0.4 (n = 7, р > 0.05) во время беременности и 2.4 ± 0.8 (n = 7, р > 0.05) в первую неделю после родов. При действии стресса у самок в прегестационный период груминг не менялся: 1.7 ± 0.3 актов (n = 9) до начала и 1.1 ± 0.4 (n = 8, p > 0.05) через две недели воздействия, но с наступлением беременности количество актов груминга увеличивалось до 2.7 ± 0.5 (n = 6, p < 0.05) и далее не изменялось во время беременности и после родов (2.9 ± 0.9, p < < 0.05, n = 6).
В тесте темно-светлая камера у контрольных крыс время, проведенное в темной камере, достоверно повысилось к концу беременности (с 102.3 ± 7.1 с, n = 8 до 134.2 ± 8.4 с, n = 7, p < 0.05) и сохранялась на высоком уровне после родов (рис. 1 (в)). У самок, подвергающихся действию стрессовых факторов, время, проведенное в темной камере, увеличилось уже в прегестационный период с 107.2 ± ± 11.4 с до 140.3 ± 8.2 с, n = 9, p < 0.05, рис. 1 (в)) и сохранялось на высоком уровне в период беременности и лактации, достоверно отличаясь от значений контрольной группы (n = = 6, рис. 1 (в)).
Размер помета и вес крысят. Размер помета у крыс с хроническим умеренным стрессом оказался меньше (6.0 ± 1.0 крысят, n = 6, p < < 0.05), чем у контрольных самок 8.6 ± 1.2 (n = 7, рис. 1 (г)). Масса тела при рождении, являющаяся важным показателем соматического развития, была достоверно снижена в группе Стресс и составила 7.0 ± 0.1 г (n = 36, р < 0.05), а в группе Контроль 7.9 ± 0.6 г (n = 61, рис. 1 (д)). В результате суммарный вес всего помета в группе Стресс составил 42.5 ± 2.3 г (n = 6, p < 0.05), что достоверно меньше, чем в группе Контроль – 67.5 ± 2.6 г (n = 7). Сниженная масса тела потомства группы Стресс сохранялась в течение 4 нед после рождения (рис. 1 (е)). Смертность крысят группы Стресс (16.6%) не отличалась от контрольных значений (16%).
Оценка физического развития крысят в группе Стресс выявила отставание во времени отлипания ушной раковины и появления первичного волосяного покрова (р < 0.05, табл. 1). Более поздно регистрируемые показатели, такие как прорезывание резцов и открытие глаз не отличались от контрольных значений (р > 0.05, табл. 1).
Таблица 1.
Параметры физического развития крысят Table 1. Physical development of pups
| Параметр, день после рождения | Группа Контроль | Группа Стресс |
|---|---|---|
| Отлипание ушной раковины | 2 (2–2), n = 61 | 4 (2–4), n = 36* |
| Появление первичного волосяного покрова | 4 (4–4), n = 57 | 6 (6–6), n = 36* |
| Прорезывание резцов | 8 (8–8), n = 53 | 8 (8–10), n = 35 |
| Открытие глаз | 14 (12–14), n = 53 | 14 (14–16), n = 32 |
Развитие сенсомоторных рефлексов. Рефлексы новорожденных необходимы для выживания после родов и адаптации к новым условиям среды. Слабовыраженные или поздно сформированные рефлексы свидетельствуют о различных патологиях ЦНС (Миронов, Бунатян, 2012; Gerasimova et al., 2017; Яковлева и др., 2019; Yakovleva et al., 2018) (табл. 2). В тестах избегание обрыва и отрицательный геотаксис отличий в дне формирования рефлекса выявлено не было. День формирования рефлекса переворачивание на плоскости не отличался в обеих группах, однако увеличивалось время переворота у крысят группы Стресс (табл. 2). Кроме того, наблюдали замедление созревания рефлекса реакция на акустический стимул у крысят группы Стресс (12.9 ± 0.2 день, p < 0.05, n = 32) по сравнению с контрольной группой животных (9.5 ± 0.2 день, n = 53). В возрасте 14 сут и выше наблюдались значительные различия во времени формирования таких рефлексов, как визуальный обрыв, обонятельная реакция и переворот в свободном падении (табл. 2).
Таблица 2.
Эффекты материнского хронического стресса на формирование рефлексов у потомства Table 2. Effects of maternal chronic stress on the formation of the offspring reflexes
| Регистрируемые параметры | Контроль | Стресс |
|---|---|---|
| Переворот на плоскости, день формирования | 6 (4–7), n = 57 | 4 (4–6), n = 36 |
| Время, потраченное на выполнение, с | 1.40 ± 0.09, n = 57 | 2.41 ± 0.24*, n = 36 |
| Избегание обрыва, день формирования | 6 (5–7), n = 57 | 4 (4–8), n = 36 |
| Отрицательный геотаксис, день формирования | 6 (5–7), n = 57 | 6 (4–6), n = 35 |
| Реакция на акустический стимул, день формирования | 10 (8–10), n = 53 | 12 (12–14)*, n = 32 |
| Маятниковый рефлекс проводится на 8-й день, количество поворотов головы | 7 (5–11), n = 53 | 8 (4–11), n = 32 |
| Избегание обрыва, вызванное визуальным стимулом, день формирования | 14 (12–15), n = 53 | 16 (14–16)*, n = 32 |
| Переворот в падении, день формирования | 12 (12–16), n = 53 | 14 (14–16)*, n = 32 |
| Обоняние, день формирования | 14 (12–15), n = 53 | 16 (14–17)*, n = 32 |
Анализ поведенческих реакций в тестах открытое поле и темно-светлая камера. В тесте открытое поле у животных группы Стресс наблюдалось снижение горизонтальной двигательной активности на 8-й и 16-й дни жизни (7.6 ± 0.9 и 31.0 ± 3.6 квадратов, n = 33 и n = = 30 соответственно, p < 0.05) относительно контрольных значений (12.9 ± 1.1 и 45.4 ± 3.2 квадратов, n = 53 и n = 53 соответственно, рис. 2 (а)). В старших возрастных группах (Р26 и Р80) этот параметр достоверно не отличался от контроля (рис. 2 (а)).
Рис. 2.
Влияние хронического пренатального стресса на двигательную и исследовательскую активность, уровень тревожности в тестах открытое поле и темно-светлая камера. Количество пересеченных квадратов (а) вертикальных стоек (б), исследованных отверстий – норок (в), актов груминга (г) и время выхода из центра открытого поля (д) в тесте открытое поле. (е) – время пребывания в светлой камере в тесте темно-светлая камера. Р8, Р16, Р26, Р80 – возрастные периоды. Белый столбик – контрольная группа, серый столбик – группа Стресс. * – p < 0.05 относительно контрольной группы. Результаты представлены в виде среднего значения и ошибки среднего.
Fig. 2. Effects of the chronic prenatal stress on motor and exploratory activity, level of anxiety in the open field and light/dark transition test.The number of quadrat crosses (а), rearing (б), dips (в), grooming acts (г) and time spent in the central zone (д) in the open field test. Time spent in the light chamber (е) in the light/dark transition test. Р8, Р16, Р26, Р80 – age periods. White column – control group, gray column – Stress group. * – p < 0.05 compared to the control group. Results are presented as mean and SEM.
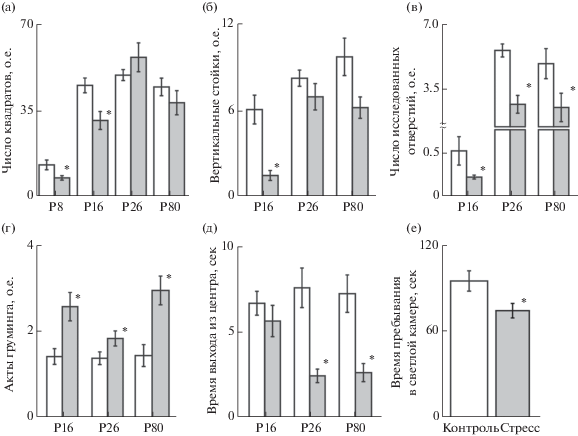
У животных группы Стресс наблюдалось снижение исследовательской активности, показателем которой являются поднятие головы, вертикальные стойки и исследуемые норки. Количество поднятий головы в группе Стресс на 8-й день жизни было достоверно ниже (0.2 ± 0.1, n = 32, p < 0.05) по сравнению с контролем (1.9 ± 0.2, n = 53), а к 16-му дню жизни количество поднятий головы 15.2 ± 2.3 не отличалось от контрольных значений (12.6 ± 0.7, р > 0.05). Снижение вертикальных стоек у животных группы Стресс наблюдалось только в младшей возрастной группе (Р16, рис. 2 (б)), тогда как у животных Р26 и Р80 этот параметр достоверно не отличался от контроля (рис. 2 (б)). В то же время у животных с пренатальным хроническим стрессом во всех возрастных группах количество исследуемых норок было ниже (p < 0.05, n = = 29) по сравнению с контрольной группой (n = 53, рис. 2 (в)).
Уровень тревожности был достоверно повышен у животных группы Стресс во всех возрастных периодах (рис. 2 (г, д)). Количество актов груминга было достоверно выше во всех исследуемых возрастах (рис. 2 (г)), а время выхода из центра поля снижалось у животных Р26 и Р80 (рис. 2 (д)). Нами не было выявлено достоверных отличий у животных разного пола в параметрах ОП, отражающих тревожность животного. Количество актов груминга составило у самок 3.3 ± 0.6 (n = 14), у самцов 2.3 ± 0.7 (n = 15, p > 0.05), время выхода из центра 1.2 ± 0.3 и 2.2 ± 0.4 (p > 0.05) соответственно.
Результаты, указывающие на повышение уровня тревожности, подтвердились и в тесте темно-светлая камера, где снижалось время, проведенное в светлой камере у животных группы Стресс (Р72-90, рис. 2 (е)). В данном тесте также не было выявлено гендерных отличий во времени пребывания в светлой камере и количестве переходов между камерами. Время пребывания в светлой камере составило у самок 107.5 ± 7.9 с (n = 15) и у самцов – 103.3 ± 7.4 с (n = 17, p > 0.05), а количество переходов 4.0 ± 0.6 (n = 15) и 3.8 ± 0.4 (n = 17, p > 0.05) соответственно.
Исследование мышечной силы и двигательной координации. В контрольной группе в тесте удержание на горизонтальной сетке с возрастом увеличивалось время пребывания крысы на сетке: с 14.9 ± 1.9 с (Р16) до 106.4 ± ± 6.1 с (Р26, n = 53). В группе Стресс время пребывания крысят на горизонтальной сетке соответствовало контрольным значениям (17.9 ± 2.9 с и 110.3 ± 20.1 с, соответственно, n = 29, p > 0.05).
В тесте ротарод не было выявлено достоверных различий между группами как по времени пребывания на вращающемся цилиндре, так и по пройденному расстоянию. Время пребывания на вращающемся цилиндре у животных Р16 и Р26 составило 17.9 ± 5.9 с и 102.4 ± 6.3 с в контроле (n = 53) и 17.6 ± 1.4 с и 121.3 ± 12.7 с в группе Стресс (n = 29, p > > 0.05). Пройденное расстояние составило 0.4 ± 0.1 см и 2.8 ± 0.1 см в контроле и 0.4 ± ± 0.1 см и 2.9 ± 0.3 см в группе Стресс (p > 0.05).
Анализ когнитивных функций. Коэффициент отношения времени исследования нового объекта к старому снижался в группе Стресс (548 ± 81%, n = 30) по сравнению с контролем (754 ± 81%, n = 45, р < 0,05, рис. 3 (а)). Достоверных различий у животных разного пола в тесте на распознавание нового объекта не было выявлено.
Рис 3.
Эффект пренатального стресса на когнитивные функции крыс в тестах новый объект и водный лабиринт Морриса. (а) – Отношение времени исследования нового объекта к старому у крыс групп Контроль (белый столбик) и Стресс (серый столбик), (б) – Изменение времени поиска платформы в ходе обучения в тесте водный лабиринт Морриса у крыс групп Контроль (белые круги) и Стресс (черные круги). Во вкладке показан процент обучившихся крыс (белый сектор диаграммы), (в) – Процент животных групп Контроль и Стресс, нашедших (белый сектор диаграммы) и не нашедших (серый сектор диаграммы) платформу через 1 и 24 ч после обучения. (г) – Время поиска платформы через 1 и 24 ч после обучения крысами групп Контроль (белый столбик) и Стресс (серый столбик) групп. * – p < 0.05 относительно контроля. Результаты представлены в виде среднего значения и ошибки среднего.
Fig. 3. Effect of prenatal stress on the cognitive function of rats in the new object and water maze tests. (а) – The ratio of the research time of a new object to an old one of rats from the control (white column) and Stress (gray column) groups, (б) – Latency to find the platform during training in the Morris water maze test in rats from the control (white circles) and stress (black circles) groups. Insert: the white sectors of the circles show the percentage of trained rats, (в) – the percentage of animals in the control and stress groups who found (white sector of the circle) and did not find (gray sector of the circle) the platform location in 1 and 24 hours after training. (г) – Latency to find the platform in 1 and 24 hours after training in the control (white column) and Stress (gray column) groups. * – p < 0.05 compared to the control group. Results are presented as mean and SEM.
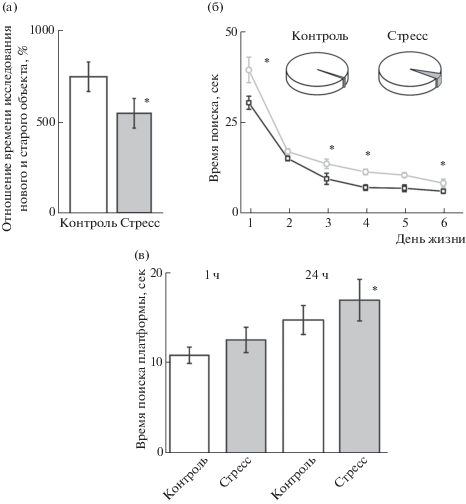
Анализ обучения в тесте Морриса выявил снижение времени поиска платформы у животных обеих групп, однако в группе Стресс время поиска было достоверно больше по сравнению с группой контроля. В группе Контроль время поиска платформы снизилось с 30.5 ± 1.8 с в первом подходе до 9.6 ± 1.5 с (n = 45) в третьем, а в группе Стресс – с 39.5 ± ± 3.5 с до 13.8 ± 1.3 с, соответственно (n = 30, p < 0.05, рис. 3 (б)). К концу обучения у крыс групп Контроль и Стресс время поиска платформы составило 6.2 ± 0.6 c и 8.4 ± 1.1 с (p < < 0.05, рис. 3 (б)) соответственно. Расстояние, пройденное животными в начале обучения, составило 201.8 ± 25.7 см в контрольной группе и 301.2 ± 23.1 см в группе Стресс (p < < 0.05) и к концу обучения 44.2 ± 5.3 см и 76.0 ± 7.3 см соответственно (p < 0.05).
Анализ стратегии поиска платформы показал, что у животных контрольной группы в первых подходах наблюдались три базовых стратегии поиска платформы в равной степени всеми крысятами: тигмотаксис, случайный поиск и сканирование (у 14 из 15 анализируемых животных). В группе Стресс наблюдались такие же стратегии поиска, и 13 из 15 животных использовали стратегии тигмотаксис и случайный поиск, а более выгодная в поиске стратегия сканирование встречалась лишь у 8 животных. К концу обучения (5–6 подходы) основной стратегией контрольной группы стал направленный поиск, который является наиболее эффективным для поиска платформы (10 животных), а также применялись стратегии сканирования (7 животных) и случайный поиск (5 животных из 15), тигмотаксис не применялся ни одним животным. В группе Стресс соотношение стратегий к концу обучения также изменилось: у 6 животных из 15 появилась стратегия направленный поиск, у 4 – сканирование, у 8 – случайный поиск и у 8 животных сохранилась стратегия тигмотаксис. Процент обучившихся крыс не отличался в группах Контроль и Стресс (рис. 3 (б), вкладка).
В ходе проверки запоминания положения платформы было выявлено, что через 1 ч после обучения время поиска платформы в контрольной группе увеличилось до 10.9 ± 0.9 с, а в группе Стресс – до 12.6 ± 1.4 с (p > 0.05, рис. 3 (г)). Через 24 ч крысы контрольной группы тратили на поиск платформы 14.6 ± ± 1.7 с, а крысы группы Стресс достоверно больше – 17.4 ± 1.6 с (p < 0.05, рис. 3 (г)). Расстояние, пройденное животными группы Стресс при поиске платформы, оказалось больше (93.1 ± 9.9 см через 1 ч и 146.4 ± ± 16.9 см через 24 часа, p < 0.05), чем в группе Контроль (63.3 ± 6.2 см через 1 ч и 92.3 ± ± 12.1 см через 24 часа). Процент животных, которые помнили расположение платформы, в группе Стресс составил 71% через 1 ч и 45% через 24 ч что значительно меньше контрольных значений (99 и 70% соответственно, рис. 3 (в)).
Анализ стратегий поиска платформы, применяемой через 1 и 24 ч после обучения, показал, что животные контрольной группы использовали все четыре стратегии в равной степени. У животных группы Стресс через 1 и 24 ч после обучения преобладали стратегии тигмотаксис (у 13 и 12 животных из 15 соответственно) и случайный поиск (у 9 и 12 животных соответственно); одновременно снижалось использование стратегий сканирование (у 7 и 3 животных соответственно) и направленный поиск (у 5 и 0 животных соответственно).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании мы использовали модель депрессии матери во время беременности для оценки вклада в развитие потомства. Несмотря на то что пренатальный стресс является одним из интенсивно исследуемых факторов, вызывающих нарушения развития на различных этапах онтогенеза, большая часть исследований сосредоточена на моделировании стресса у самок крыс, начиная со второй недели беременности (Hougaard et al., 2005; 2011; Николаева, Белолюбская, 2012; Jafari et al., 2019; Ордян, 2006), в то время когда первая неделя беременности является наиболее критическим и чувствительным периодом для развития плода (St-Pierre et al., 2016). Поэтому в нашей работе мы подвергали самок крыс хроническому стрессу как до наступления, так и во время беременности, что приводило к повышению тревожности уже до начала беременности, которая сохранялась и в первую неделю лактации.
Известно, что последствия материнского стресса на развитие потомства зависят как от вида стрессовой стимуляции, так и периода стрессового воздействия (Fride, Weinstock, 1984; Willner, 2017, Luo et al., 2017). В нашей модели непредсказуемый умеренный хронический стресс, действующий как до, так и во время беременности, приводил к уменьшению размера и веса помета, а также снижению массы тела новорожденных крысят, что может быть обусловлено увеличением смертности плодов и/или снижением имплантаций (Hougaard et al., 2005). Известно, что одним из последствий стресса у самок крыс является нарушение фолликулогенеза, уменьшение фертильности и ановуляторные циклы (Николаева, Белолюбская, 2012). У женщин депрессия также может приводить к ановуляции, аменорее и другим нарушениям менструального цикла (Allsworth et al., 2007). Известно, что стресс матери приводит к рождению детей массой ниже 2.5 кг (Weinstock, 2005). Подобное действие пренатального стресса наблюдали и у грызунов, и низших приматов (Gong et al, 2012; Amugongo et al., 2014), однако, в других работах значительных изменений веса потомства не наблюдали (Fride, Weinstock, 1984; Сolomina et al., 2005; Fatima, 2017). В нашей модели стресс у матери сформировался уже к моменту зачатия, и, как результат, высокие уровни гормонов стресса, и в том числе кортикостерона, влияли на потомство уже в период раннего эмбрионального развития (Huang, 2012). Высокие уровни кортикостерона не только вызывают внутриутробную гипоксию, ухудшение плацентарного кровоснабжения, но и, проникая через плацентарный барьер, приводят к нарушению развития мозга плода (Charil et al., 2006; Weinstock, 2008; Статилов и др., 2020).
Комплексная оценка развития рефлексов у новорожденных крысят (Миронов, Бунатян, 2012) в нашей модели показала, что ранние безусловные рефлексы формируются согласно возрастной норме (отрицательный геотаксис, избегание обрыва и переворот на плоскости). В то же время рефлексы, связанные с функционированием отдельных сенсорных систем, формировались достоверно позже контрольной группы. Это может быть связано как с отставанием животных группы Стресс в физическом развитии (более позднее отлипание ушной раковины приводит к задержке акустического рефлекса вздрагивания), так и неврологическими нарушениями (отставание в формировании обонятельного рефлекса). Подобная задержка в развитии стартл-рефлекса была также показана у потомства, полученного от крыс при использовании стресса до беременности (Czarzasta et al., 2019). Интересно, что в моделях стресса в период беременности наблюдалось как отставание в созревании некоторых сенсомоторных рефлексов, так и ускорение развития ранних двигательных способностей у потомства (Fride, Weinstock, 1984; Gong et al, 2012). Пренатальный стресс может тормозить моторное развитие за счет действия кортикостерона на мозжечок, характеризующийся высокой экспрессией рецепторов глюкокортикоидов (Bennett et al., 2017). Действительно, мы наблюдали отставание в развитии рефлекса, связанного с координацией движений – переворота в падении, а также снижение горизонтальной и вертикальной активности у крыс 8- и 16-дневного возраста. Однако уже к 21-м суткам жизни двигательная активность в тесте открытое поле не отличалась от контрольных значений, а такие тесты, как сила хвата и ротарод, не выявили нарушений в силе мышц и координации движений. По-видимому, ранние патологические изменения в развивающемся мозжечке, такие как снижение количества и активности олигодендроцитов и астроцитов (Sudarov, Joyner, 2007), восстанавливаются в ходе взросления (Bennett et al., 2017). Ранее было показано, что материнский стресс также не влиял на двигательную активность взрослых детенышей (Р120) в тесте открытое поле (Hougaard et al., 2005).
Гипоталамо-гипофизарная система, гиппокамп, префронтальная кора, миндалина вовлечены в ответ на острый и хронический стресс, подвергаясь структурному ремоделированию, которое изменяет поведенческие и физиологические реакции (Николаева, Белолюбская, 2012; Graignic-Philippe et al., 2014). В нашей модели повышение тревожности наблюдалось у животных всех возрастных групп, в отличие от действия пренатального стресса во время беременности, где тревожность усиливалась только у взрослых потомков (Р80) (Bennett et al., 2017). Подобный эффект пренатального стресса наблюдался у потомства возраста Р9-10, где тревожность оценивали по времени и частоте вокализации (Harmon et al., 2009). Хронический стресс в течение 21 дня до беременности также приводил к депрессии у двухмесячного потомства за счет снижения фосфорилирования CREB (Cyclic AMP responsive element-binding protein) в гиппокампе (Huang 2010; Li et al., 2010). Эти особенности поведения, по-видимому, связаны с долговременными изменениями в уровне дофамина, серотонина и норадреналина, а также нарушениями в ГАМК-ергической системе (Weinstock, 2008; Решетников и др., 2018).
Ухудшение умственных способностей у детей, матери которых во время беременности подвергались воздействию стрессовых факторов, наблюдалось от младенческого до подросткового возраста (Raikkonen et al., 2011). В нашей модели нарушение когнитивных функций было выявлено во всех возрастных группах. На ранних этапах развития было показано снижение исследовательской активности крыс группы Стресс в тесте открытое поле (Р16, 26), ухудшение способности к обучению, выбору наиболее успешной стратегии поиска и долговременной пространственной памяти в водном лабиринте Морриса (Р22). В возрасте 80–90 дней у крыс уменьшалось время исследования нового объекта, что свидетельствует о нарушении непространственной памяти.
Активные манипуляции с потомством в ранний постнатальный период могут приводить к изменениям поведения у взрослых животных. Однако анализ сенсомоторного развития проводился одновременно и в контрольной, и в экспериментальной группах. Кроме того, имеются данные о том, что кратковременное отделение детенышей от матери в возрасте от 2-го до 21-го дня не только не влияет, но может даже улучшать отдельные виды памяти у взрослых потомков (Решетников и др., 2018). Более того, сходные нарушения когнитивных функций и повышенная тревожность у взрослых особей наблюдались и в других работах по анализу пренатального стресса, где воздействий на потомство в ранний постнатальный период не проводилось (Hougaard et al., 2005; 2011; Николаева, Белолюбская, 2012; Jafari et al., 2019; Guan et al., 2016; Fatima, 2017, 2020). Поэтому можно думать, что полученные нами изменения являются результатом именно пренатального стресса.
Молекулярные механизмы повреждения нейронов и, как следствие, когнитивных и других дисфункций в результате пренатальных стрессорных воздействий включают такие факторы, как развитие окислительного стресса, изменение уровня нейротрофинов, экспрессии рецепторов к гормонам и нейромедиаторам, эпигенетические процессы, включающие метилирование ДНК, ацетилирование гистонов, регуляцию микроРНК (Ордян и др., 2006; Guan et al., 2016; Yakovleva et al., 2018, 2020; Lin, Wang, 2014; Fatima, 2017; Fatima et al., 2020). Снижение экспрессии нейротрофического фактора мозга (BDNF, Brain-derived neurotrophic factor) и NR2B cубъединицы НМДА-рецепторов глутамата в гиппокампе было обнаружено и в модели прегестационного стресса, и эти изменения коррелировали с нарушениями памяти у взрослых животных (Huang et al., 2010).
В нашей модели мы не выявили гендер-зависимых эффектов пренатального стресса. Данные литературы по влиянию пренатального стресса на поведение самцов и самок неоднозначны (Bowman et al., 2004; Zagron, Weinstock, 2006; Brunton et al., 2006; Salomon et al., 2011; Benoit et al., 2015). Дефицит обучения преимущественно наблюдался у самцов, а уровень тревожности у самок, однако, эти проявления зависели от времени, вида и интенсивности стресса и возраста тестирования потомков (Brunton et al., 2006; Salomon et al., 2011). Подобные эффекты наблюдались при использовании пренатального иммобилизационного стресса (Bowman et al., 2004; Zagron, Weinstock, 2006). При этом влияние пренатального стресса на память самок сильно коррелировало с возрастом: нарушения памяти наблюдались у молодых крыс обоих полов, но с возрастом у самок память улучшалась, что объясняется снижением нейрональной пластичности в гиппокампе у самцов и ее повышением – у самок (Darnaudéry, Maccari, 2008). С другой стороны, в модели умеренного стресса до и во время беременности у мышей нарушения обучения и памяти не зависели от пола потомков (Benoit et al., 2015). В недавнем исследовании эффектов хронического умеренного непредсказуемого стресса на уровень тревожности и депрессивно-подобное поведение у взрослых потомков авторы не выявили гендерных различий в поведенческих тестах, а также в структурных и нейрохимических изменениях мозга (Soares-Cunha et al., 2018).
ЗАКЛЮЧЕНИЕ
Полученные нами результаты свидетельствуют о том, что последствия непредсказуемого умеренного хронического стресса самок до и во время беременности наблюдаются не только в раннем онтогенезе, но сохраняются и во взрослом периоде жизни потомства, проявляясь многочисленными нарушениями высшей нервной деятельности. В связи с тем, что на протяжении последних десяти лет отмечается непрекращающийся рост патологий центральной нервной системы у детей, данный аспект исследований представляет не только теоретический, но и практический интерес.
Работа выполнена за счет средств субсидии, выделенной Казанскому федеральному университету для выполнения государственного задания № 0671-2020-0059 в сфере научной деятельности.
Список литературы
Ивлиева А.Л., Петрицкая Е.Н., Рогаткин Д.А., Демин В.А. Методические особенности применения водного лабиринта Морриса для оценки когнитивных функций у животных. Рос. физиол. журн. им. И.М. Сеченова. 2016. 102 (1): 3–17.
Миронов А.Н., Бунатян Н.Д. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К. 2012. 944 с.
Николаева И.В., Белолюбская Д.С. Влияние пренатального эмоционального стресса на развитие головного мозга, надпочечников и гонад крыс в постнатальном онтогенезе. Вестник СВФУ. 2012. 9 (1): 68–73.
Ордян Н.Э., Пивина С.Г., Акулова В.К., Галеева А.Ю. Влияние пренатального стресса на активность гипоталамо-гипофизарно-адренокортикальной системы крыс: роль глюкокортикоидных рецепторов мозга. Рос. физиол. журн. им. И.М. Сеченова. 2006. 92 (9): 1100.
Решетников В.В., Лепешко А.А., Рябушкина Ю.А., Студеникина А.А., Меркулова Т.И., Бондарь Н.П. Отсроченные эффекты раннего постнатального стресса на когнитивные способности и экспрессию генов глутаматергической системы у мышей. Нейрохимия. 2018. 35 (2): 140–150.
Стратилов В.А., Тюлькова Е.И., Ветровой О.В. Пренатальный стресс как фактор развития аддиктивных состояний. Журн. эволюц. биохим. и физиол. 2020. 56 (6): 413–429.
Яковлева О.В., Зиганшина А.Р., Герасимова Е.В., Арсланова А.Н., Ярмиев И.З., Зефиров А.Л., Ситдикова Г.Ф. Влияние витаминов группы В на раннее развитие крысят с пренатальной гипергомоцистеинемией. Рос. физиол. журн. им. И.М. Сеченова. 2019. 105 (10): 1247–1261.
Allsworth J.E., Clarke J., Peipert J.F., Hebert R., Cooper A., Boardman L.A. The influence of stress on the menstrual cycle among newly incarcerated women. Womens Health Issues. 2007. 17: 202–209.
Amugongo S.K., Hlusko L.J. Impact of maternal prenatal stress on growth of the offspring. Aging Dis. 2014. 5 (1): 1–16.
Antunes M., Biala G. The novel object recognition memory: neurobiology, test procedure, and its modifications. Cogn. Process. 2012. 13 (2): 93–110.
Bennett G.A., Palliser H.K., Shaw J.C., Palazzi K.L., Walker D.W., Hirst J.J. Maternal stress in pregnancy affects myelination and neurosteroid regulatory pathways in the guinea pig cerebellum. Stress. 2017. 20 (6): 580–588.
Benoit J.D., Rakic P., Frick K.M. Prenatal stress induces spatial memory deficits and epigenetic changes in the hippocampus indicative of heterochromatin formation and reduced gene expression. Behav. Brain Res. 2015. 281: 1–8.
Bourin M., Hascoet M. The mouse light/dark box test. Eur. J. Pharmacol. 2003. 463 (1–3): 55–65.
Bowman R., MacLusky N., Sarmiento Y., Frankfurt M., Gordon M., Luine V. Sexually dimorphic effects of stress on cognition, hormonal responses and central neurotransmitters. Endocrinology. 2004. 45: 3778–3787.
Brunton P.J., Russell J.A. Prenatal social stress in the rat programmes neuroendocrine and behavioural responses to stress in the adult offspring: sex-specific effects. J. Neuroendocrinol. 2010. 22 (4): 258–271.
Charil A., Laplante D.P., Vaillancourt C., King S. Prenatal stress and brain development. Brain Res. Rev. 2010. 65 (1): 56–79.
Soares-Cunha C., Coimbra B., Borges S., Domingues A.V., Silva D., Sousa N., Rodrigues A.J. Mild Prenatal Stress Causes Emotional and Brain Structural Modifications in Rats of Both Sexes. Front Behav Neurosci. 2018. 12: 129.
Czarzasta K., Makowska-Zubrycka M., Kasarello K., Skital V.M., Tyszkowska K., Matusik K., Jesion A., Wojciechowska M., Segiet A., Wrzesien R., Biały M., Krzascik P., Wisłowska-Stanek A., Sajdel-Sulkowska E.M. A rat model to study maternal depression during pregnancy and postpartum periods, its comorbidity with cardiovascular diseases and neurodevelopmental impact in the offspring. Physiol. Behav. 2019. 199: 258–264.
Darnaudery M., Maccari S. Epigenetic programming of the stress response in male and female rats by prenatal restraint stress. Brain Res. Rev. 2007. 57 (2): 571–585.
Davis E.P., Glynn L.M., Schetter C.D., Hobel C., Chicz-Demet A., Sandman C.A. Prenatal exposure to maternal depression and cortisol influences infant temperament. J. Am. Acad. Child. Adolesc. Psychiatry. 2007. 6 (46): 737–746.
Davis E.P., Sandman C.A. Prenatal psychobiological predictors of anxiety risk in preadolescent children. Psychoneuroendocrinol. 2012. 8 (37): 1224–1233.
Fatima M., Srivastav S., Mondal A.C. Prenatal stress and depression associated neuronal development in neonates. Int. J. Dev. Neurosci. 2017. 60: 1–7.
Fatima M., Ahmad M.H., Srivastav S., Rizvi M.A., Mondal A.C. A selective D2 dopamine receptor agonist alleviates depression through upregulation of tyrosine hydroxylase and increased neurogenesis in hippocampus of the prenatally stressed rats. Neurochem. Int. 2020. 136: 104730.
Fride E., Weinstock M. The effects of prenatal exposure to predictable or unpredictable stress on early development in the rat. Dev. Psychobiol. 1984. 17 (6): 651–660.
Gao Y., Bezchlibnyk Y.B., Sun X., Wang J.-F., McEwend B.S., Young L.T. Effects of restraint stress on the expression of proteins involved in synaptic vesicle exocytosis in the hippocampus. Neurosci. 2006. 141: 1139–1148.
Gerasimova E., Yakovleva O., Burkhanova G., Ziyatdinova G., Khaertdinov N., Sitdikova G. Effects of maternal hyperhomocysteinemia on the early physical development and neurobehavioral maturation of rat offspring. BioNanoScience. 2017. 7: 155–158.
Gong Y., Sun X.-L., Wu F.-F., Su Ch.-J., Ding J.-H., Hu G. Female Early Adult Depression Results in Detrimental Impacts on the Behavioral Performance and Brain Development in Offspring. CNS Neurosci. Ther. 2012. 18: 461–470.
Graignic-Philippe R., Dayan J., Chokron S., Jacquet A.Y., Tordjman S. Effects of prenatal stress on fetal and child development: A critical literature review. Neurosci. Biobehav. Rev. 2014. 43: 137–162.
Guan S.Z., Ning L., Tao N., Lian Y.L., Liu J.W., Ng T.B. Effects of maternal stress during pregnancy on learning and memory via hippocampal BDNF, Arc (Arg3.1) expression in offspring. Environ. Toxicol. Pharmacol. 2016. 46: 158–167.
Harmon K.M., Greenwald M.L., Mcfarland A., Beckwiht T., Cromwell H.C. The effects of prenatal stress on motivation in the rat pup. Stress. 2009. 12(3): 250–258.
Holubova A., Sevcikova M., Macuchova E., Hrebickova I., Pometlova M., Slamberova R. Effects of perinatal stress and drug abuse on maternal behavior and sensorimotor development of affected progeny. Physiol. Res. 2017. 66 (Suppl. 4): S481–S491.
Hougaard K.S., Andersen M.B., Hansena A.M., Hassc U., Wergeb T., Lund S.P. Effects of prenatal exposure to chronic mild stress and toluene in rats. Neurotoxicol. Teratol. 2005. 27 (1): 153–167.
Hougaard K.S., Mandrup K.R., Kjaer S.L., Bogh I.B., Rosenberg R., Wegener G. Gestational chronic mild stress: effects on acoustic startle in male offspring of rats. Int. J. Dev. Neurosci. 2011. 29 (4): 495–500.
Huang Y., Shi X., Xu H., Yang H., Chen T., Chen S., Chen X. Chronic unpredictable stress before pregnancy reduce the expression of brain-derived neurotrophic factor and N-methyl-D-aspartate receptor in hippocampus of offspring rats associated with impairment of memory. Neurochem. Res. 2010. 35 (7): 1038–1049.
Jafari Z., Kolb B.E., Mohajerani M.H. Life-course contribution of prenatal stress in regulating the neural modulation network underlying the prepulse inhibition of the acoustic startle reflex in male Alzheimer’s disease Mice. Cereb. Cortex. 2019. 30 (1): 311–325.
Karl T. Behavioral phenotyping of mice in pharmacological and toxicological research. Exp. Toxic. Pathol. 2003. 55 (1): 69–83.
Li H., Zhang L., Fang Z., Lin L., Wu C., Huang Q. Behavioral and neurobiological studies on the male progeny of maternal rats exposed to chronic unpredictable stress before pregnancy. Neurosci. Lett. 2010. 469 (2): 278–282.
Lin Y.L., Wang S. Prenatal lipopolysaccharide exposure increases depression-like behaviors and reduces hippocampal neurogenesis in adult rats. Behav. Brain Res. 2014. 259: 24–34.
Lueptow L.M. Novel object recognition test for the investigation of learning and memory in mice. J. Vis. Exp. 2017. 126: 55718.
Luo L., Sun T., Guan X., Ni Y., Yang L., Zhao Q., Kong X., Chen Y., Zhang J. Advanced parental age impaired fear conditioning and hippocampal LTD in adult female rat offspring. Neurochem. Res. 2017. 42 (10): 2869–2880.
Meyers T. Stress: The health epidemic of the 21st century. Community. 2018. 15: 61–65.
Naik A.A., Patro I.K., Patro N. Slow physical growth, delayed reflex ontogeny, and permanent behavioral as well as cognitive impairments in rats following intra-generational protein malnutrition. Front. Neurosci. 2015. 9: 446.
Pani L., Porcella A., Gessa G.L. The role of stress in the pathophysiology of the dopaminergic system. Mol. Psychiatry. 2000. 5: 14–21.
Ragan A.R., Lesniak A., Bochynska-Czyz M., Kosson A., Szymanska H., Pysniak K., Gajewska M., Lipkowski A.W., Sacharczuk M. Chronic mild stress facilitates melanoma tumor growth in mouse lines selected for high and low stress-induced analgesia. Stress. 2013. 16: 572–578.
Raikkonen K., Seckl J.R., Pesonen A.-K., Simons A., Van den Bergh B.R.H. Stress, glucocorticoids and liquorice in human pregnancy: programmers of the offspring brain. Stress. 2011. 14 (6): 590–603.
Rondo P.H., Ferreira R.F., Nogueira F., Ribeiro M.C., Lobert H., Artes R. Maternal psychological stress and distress as predictors of low birth weight, prematurity and intrauterine growth retardation. Eur. J. Clin. Nutr. 2003. 57: 266–272.
Salomon S., Bejar C., Schorer-Apelbaum D., Weinstock M. Corticosterone mediates some but not other behavioural changes induced by prenatal stress in rats. J. Neuroendocrinol. 2011. 23 (2): 118–128.
Shrira A. Parental PTSD, health behaviors and successful aging among offspring of Holocaust survivors. Psychiatry Res. 2019. 271: 265–271.
St-Pierre J., Laurent L., King S., Vaillancourt C. Effects of prenatal maternal stress on serotonin and fetal development. Placenta. 2016. 48 (Suppl. 1): S66–S71.
Sudarov A., Joyner A.L. Cerebellum morphogenesis: The foliation pattern is orchestrated by multi-cellular anchoring centers. Neural Dev. 2007. 2: 26.
Terry A.V. Spatial navigation (water maze) tasks. Methods of behavior analysis in neuroscience. 2nd ed. Boca Raton, FL: CRC Press. 2009. Chapt. 13. 267–280 pp.
Weinstock M. The long-term behavioural consequences of prenatal stress. Neurosci. Biobehav. Rev. 2008. 32 (6): 1073–1086.
Weinstock M. The potential influence of maternal stress hormones on development and mental health of the offspring. Brain Behav. Immun. 2005. 19 (4): 296–308.
Weydt P., Hong S.Y., Kliot M., Moller T. Assessing disease onset and progression in the SOD1 mouse model of ALS. Neuroreport. 2003. 14 (7): 1051–1054.
Willner P. Reliability of the chronic mild stress model of depression: A user survey. Neurobiol. Stress. 2017. 6: 68–77.
Yakovleva O., Bogatova K., Mukhtarova R., Yakovlev A., Shakhmatova V., Gerasimova E., Ziyatdinova G., Hermann A., Sitdikova G. Hydrogen sulfide alleviates anxiety, motor, and cognitive dysfunctions in rats with maternal hyperhomocysteinemia via mitigation of oxidative stress. Biomolecules. 2020. 10 (7): 995.
Yakovleva O.V., Ziganshina A.R., Dmitrieva S.A., Arslanova A.N., Yakovlev A.V., Minibayeva F.V., Khaertdinov N.N., Ziyatdinova G.K., Giniatullin R.A., Sitdikova G.F. Hydrogen sulfide ameliorates developmental impairments of rat offspring with prenatal hyperhomocysteinemia. Oxid. Med. Cel. Long. 2018. 2018: 2746873.
Zagron G., Weinstock M. Maternal adrenal hormone secretion mediates behavioural alterations induced by prenatal stress in male and female rats. Behav. Brain Res. 2006. 175 (2): 323–328.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


