Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 3, стр. 415-427
Пренатальная гипоксия нарушает обонятельную функцию в постнатальном онтогенезе крыс
Н. М. Дубровская 1, *, Д. С. Васильев 1, Н. Л. Туманова 1, О. С. Алексеева 1, Н. Н. Наливаева 1, **
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: ndub@mail.ru
** E-mail: n.n.nalivaeva@leeds.ac.uk
Поступила в редакцию 08.02.2021
После доработки 02.03.2021
Принята к публикации 02.03.2021
Аннотация
Анализ возрастной динамики обонятельного поведения в тестах предпочтения запахов и поиска пищи показал, что все самцы крыс линии Вистар, независимо от возраста, из 8 запахов эфирных масел предпочитают запах валерианы, компоненты которого обладают свойствами феромонов у грызунов, а молодые крысы демонстрируют лучшую результативность поиска пищи, чем взрослые и старые животные. Острая пренатальная гипоксия (ПГ) на Е14 (7% О2, 3 ч) приводила к нарушению предпочтения запаха валерианы во всех исследованных возрастных группах крыс, а также к снижению результативности поиска пищи. После ПГ в пириформной коре крыс наблюдались процессы нейродегенерации, снижения числа нейронов и увеличение глиальных элементов. Подобные изменения были обнаружены нами ранее в энторинальной коре и гиппокампе, но не в обонятельных луковицах. Это позволяет предположить, что снижение обонятельной функции у крыс, вызванное ПГ, может быть результатом нарушений формирования центральных звеньев обонятельного анализатора в ходе первых месяцев постнатального онтогенеза.
ВВЕДЕНИЕ
Обонятельная функция является одной из основных сенсорных модальностей животных, обеспечивая им возможность выживания и точной ориентации в окружающей среде, а также осуществления разных форм социальной коммуникации. При этом определенные запахи могут изменять поведенческие реакции животных (Беляков и др., 2015). Различные запаховые стимулы воспринимаются большим числом обонятельных рецепторов, входящих в состав одного из наиболее представительных мультигенных семейств у млекопитающих (Niimura, 2009). Восприятие обонятельных сигналов начинается в обонятельном эпителии, где расположены обонятельные рецепторы, откуда их сигналы передаются в обонятельные луковицы и далее в кортикальные отделы мозга, где осуществляются их анализ и запоминание (Mori, Sakano, 2011; Suzuki, Osumi, 2015; Takahashi et al., 2018).
Развитие обонятельной системы животных и человека начинается еще в эмбриональный период и к рождению она достаточно хорошо сформирована, обеспечивая новорожденному организму быструю ориентацию вне материнского организма (Sarnat, Flores-Sarnat, 2019). Обонятельная чувствительность и восприятие запахов подвержены онтогенетической динамике (Apfelbach et al., 1991) и могут изменяться в зависимости от физиологического состояния животного (Brennan, Kendrick, 2006), а также в зависимости от окружающей запаховой среды или предшествующей истории обонятельных контактов (Соколов, Вознесенская, 1996). Нарушение обоняния приводит к существенным изменениям в поведении животных. Так, удаление обонятельных луковиц влияет как на моторные реакции животных, вызывая гиперлокомоцию, так и на их психоэмоциональное состояние (Недогреева и др., 2020). Исследования бульбэктомированных животных выявили широкий спектр морфологических и биохимических изменений мозга, которые также наблюдаются при развитии нейродегенеративных заболеваний человека (для обзора см. Гуляева и др., 2017).
Ранее в работах нашей лаборатории было показано, что пренатальная гипоксия (ПГ) на 14-й день эмбрионального развития приводит у крыс к нарушениям формирования и морфофункциональных свойств теменной и энторинальной коры, а также гиппокампа, которые в ходе постнатального онтогенеза сопровождаются снижением плотности дендритных шипиков и отставанию нейрогенеза и формирования пластичности нервной ткани (Васильев и др., 2020; Туманова и др., 2021; Vasilev et al., 2016). ПГ также существенным образом изменяет молекулярные характеристики нервной ткани, приводя к нарушениям в холинэргической (Morozova et al., 2020) и пептидэргической системах. В частности, у крыс, перенесших ПГ, снижаются экспрессия и активность нейропептидазы неприлизина (НЕП) (Nalivaeva et al., 2012; Vasilev et al., 2021), которая расщепляет один из медиаторов ольфакторной передачи соматостатин (Barnes et al., 1995; Nocera et al., 2019). На поведенческом уровне ПГ приводит к нарушению когнитивных функций у крыс в постнатальном онтогенезе (Дубровская, Журавин, 2009), однако исследований влияния ПГ на обонятельное поведение крыс в ходе постнатального развития, а также на формирование структур, обеспечивающих проведение обонятельных стимулов, не проводилось.
Целью данного исследования являлось изучение обонятельного поведения крыс (предпочтение запахов и поиск пищи по запаху) на разных этапах онтогенеза (препубертатный период, период половозрелости, старение) в ходе нормального постнатального развития и после острой ПГ на 14-й день беременности. Также проводился анализ структуры пириформной коры крыс, являющейся важным звеном их обонятельного анализатора.
МЕТОДИКА
Животные. В работе использовали крыс линии Вистар из питомника “Рапполово”. Животных содержали в стандартных условиях вивария ИЭФиБ РАН при световом режиме (12 час день/12 часов ночь) по 4–5 особей в клетках со свободным доступом к воде и пище за исключением условий, особо оговоренных в тексте. Эксперименты осуществляли согласно протоколу использования лабораторных животных ИЭФиБ им. И.М. Сеченова РАН, основанного на директиве Европейского Сообщества по гуманному обращению с экспериментальными животными (European Communities Council Directive #86/609 for the Care of Laboratory Animals).
Модель пренатальной острой нормобарической гипоксии. Для получения потомства, отвечающего требованиям эксперимента, виргильных самок в возрасте 3–4 мес весом 250–260 г ссаживали с самцами попарно в клетках вивария. Первым днем беременности считали день обнаружения сперматозоидов в вагинальных мазках. Оплодотворенных самок размещали по 4–5 особей в клетках вивария. На 14-е сутки беременности (Е14) самок экспериментальной группы (пренатальная гипоксия – ПГ) подвергали действию нормобарической гипоксии в специальной камере (7% О2, 3 ч) как описано ранее (Дубровская, Журавин, 2009). Беременные самки контрольной группы (К) находились такое же время в камере при нормальном содержании кислорода. На 20-е сутки беременности самок экспериментальной и контрольной групп рассаживали по отдельным клеткам. Считая нулевым день появления крысят на свет, на 2-е сутки после рождения (Р2) в каждом выводке оставляли по 8 особей. Крысят отлучали от матерей на Р25, разделяли по полу и помещали по 4–5 особей в отдельные клетки при стандартных условиях, при этом в одной клетке могли содержаться самцы из разных выводков. В процессе проведения экспериментов летальности в потомстве животных не наблюдалось. Исследования крыс (самцов) обеих групп (К и ПГ) проводили на разных этапах онтогенеза в возрасте: 1 мес – препубертатный период (“молодые”), 3 мес – период половозрелости (“взрослые”) и 1.5 года – старение (“старые”). Количество животных в каждой группе указано в подписях к рисункам.
Тест на предпочтение запахов. В парадигме “предпочтение запаха” животным один раз в течение 8 дней предъявляли одновременно образцы запахов в восьми открытых стеклянных плошках (∅ = 30, h = 30 мм), содержащих эфирные масла апельсина, гвоздики, жасмина, мяты, эвкалипта, полыни, лаванды или валерианы в объеме 0.1 мл. Плошки располагались по кругу на равном расстоянии друг от друга и от стенок специальной камеры 500 × × 500 × 200 мм (для молодых животных) или 1000 × 1000 × 400 мм (для взрослых и старых крыс). Животное сажали в центр камеры и в течение 15 мин регистрировали количество подходов/принюхиваний к каждой плошке. При каждом новом предъявлении расположение плошек с образцами запахов не повторялось. После каждого животного пол камеры протирали 50% раствором этилового спирта. Привлекательность для каждого запаха выражали в процентах от общего числа принюхиваний, усредняя их по всем дням тестирования. Из всего набора запахов только валериана обладала функционально значимым феромональным эффектом для грызунов (Мельник и др., 2009).
Тест результативности поиска пищи. В парадигме “поиск пищи” использовали модифицированную нами методику поиска корма (Sun et al., 2016). Тестирование животных проводили в специальной камере площадью 100 × 100 см с 16 отверстиями диаметром 2 см и непрозрачными стенками высотой 30 см. Во время эксперимента в два отверстия в полу закладывали по одному кусочку овсяного печенья диаметром 0.5 см. Кусочки печенья находились под слоем опилок ниже поверхности пола камеры на 0.5 см, и их расположение меняли при каждом новом тестировании. Перед тестированием крысы проходили 2-суточную пищевую депривацию. В ходе ежедневного 15-мин тестирования (один раз в течение 6 сут) оценивали в баллах количество добытых кусочков корма (0, 1 или 2) и регистрировали время, затраченное на их нахождение. Кроме того, за цикл тестирования подсчитывали общее число обнюхиваний всех отверстий в полу экспериментальной камеры. После нахождения второго кусочка печенья тестирование прекращалось. Перед каждым предъявлением пол камеры протирали 50% раствором этилового спирта и меняли верхний слой опилок.
Световая микроскопия. Светооптическое исследование проводили на крысах в возрасте Р20, 1 мес (Р35) и 3 мес (Р90) контрольной (n = 8 в каждой возрастной группе) и экспериментальной групп (n = 9 в каждой возрастной группе). Мозг после транскардиальной перфузии раствором параформальдегида (4% в 0.1 М фосфатном буфере, рН 7.4) фиксировали в том же растворе в течение 4 сут, а затем помещали на сутки в 20%-й раствор сахарозы. Замороженные фронтальные срезы мозга толщиной 20 мкм изготавливали на криостате Leica CM 1510S (Leica Microsystems, Germany). Для исследования отбирали срезы пириформной коры мозга (2.3–4.5 мм от брегмы) (Paxinos, Watson, 2007) и проводили окрашивание по Нисслю. С использованием микроскопа ImagerA (Zeiss, Германия) оценивали состояние нервной ткани на серии срезов толщиной 20 мкм, выбирая первый срез серии случайно. Расстояние между последующими срезами в серии составляло 40 мкм. При проведении анализа использовали программу VideoTest Master-Morphology (VideoTest, Санкт-Петербург, Россия). Для каждого животного по шести срезам вычисляли средние величины общего количества клеток на участке ткани площадью 10 000 мкм2, как описано нами ранее (Васильев и др., 2008). При подсчете учитывали только клетки в случае прохождения среза через клеточное ядро. В группу пирамидных нейронов включали клетки с вытянутыми телами, площадью профильного поля тела клетки более 25 мкм2 и соотношением длинной и короткой осей тела клетки более 2. В группу непирамидных нейронов включали округлые клетки с площадью тела более 25 мкм2 и соотношением длинной и короткой осей тела клетки менее 2. Клетки с площадью окрашенной области профильного поля менее 25 мкм2 считали как глиальные.
Статистическая обработка данных. Статистическую обработку полученных данных проводили с помощью пакета программ SPSS SigmaStat 3,0 или GraphPad Prism 9, используя однофакторную ANOVA (one-way ANOVA) с последующим Fisher LSD post hoc тестом для поведенческих экспериментов или U-тест Манна–Уитни для морфологических экспериментов. Для анализа значений с нормальным распределением использовались методы параметрической статистики. Значимыми считались различия при p ≤ 0.05. Все данные представлены как среднее ± ошибка среднего, кроме случаев, специально оговоренных в тесте.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Исследование предпочтения запахов в постнатальном онтогенезе контрольных крыс. Сравнительный анализ поведения молодых, взрослых и старых крыс в тесте предпочтения запахов показал, что всех интактных крыс, независимо от их возраста, больше всего привлекало валериановое масло (рис. 1 (а)), число подходов к которому преобладало над остальными и составляло: у молодых животных – 19.9 ± 2.0% (F7; 127 = 11.1, р < 0.001); у взрослых – 20.0 ± 0.04% (F7; 103 = 11,8, р < 0.001); и у старых животных – 25.5 ± 0.02% (F7; 103 = = 8.3, р < 0.001). У взрослых крыс особым предпочтением также пользовался запах эвкалипта со средним числом подходов к плошке с этим запахом 16.5 ± 0.02% (F7; 103 = 11.8, р < 0.05). Статистически значимых различий в количественном выражении предпочтения запаха валерианы у животных разного возраста выявлено не было.
Рис. 1.
Возрастная динамика обонятельного поведения крыс. (а) – Поведение в тесте предпочтения запахов молодых (n = 16), взрослых (n = 13) и старых (n = 13) крыс контрольной группы. Ось ординат: число подходов к каждой плошке с запахом, выраженное в % от суммарного числа подходов ко всем плошкам, взятого за 100%. Ось абсцисс: запахи 1 – апельсина, 2 – гвоздики, 3 – жасмина, 4 – мяты, 5 – эвкалипта, 6 – полыни, 7 – лаванды, 8 – валерианы. * – р < 0.001 – различия между запахом валерианы и другими запахами в каждой возрастной группе. (б–г) – Поведение в тесте поиска пищи молодых (n = 15), взрослых (n = 13) и старых (n = 14) крыс контрольной группы. (б) – Средняя результативность поиска пищи, выраженная в баллах (ось ординат) для каждой возрастной группы (ось абсцисс), * – р < 0.05 – различия между группами; (в) – доля крыс в % от общего количества крыс в каждой группе (ось ординат), достигших результата от 0 до 2 (ось абсцисс). (а–б) – Данные представлены в виде медиан и интерквартильных размахов, с указанием разбросов между минимальным и максимальным значениями. (в–г) – Данные представлены в виде среднего ± ошибка среднего. * – p < 0.05, ** – p < 0.01, *** – p < 0.001 – различия между молодыми и взрослыми или молодыми и старыми крысами; # – p < 0.05, ## – p < 0.01 – различия между взрослыми и старыми крысами. (г) – Индекс поисковой активности (ось ординат). * – p < 0.001 – различия между молодыми и взрослыми или молодыми и старыми животными.
Fig. 1. Age dynamics of olfactory behavior in rats. (a) Behavior in the odor preference test of young (n = 16), adult (n = 13) and old (n = 13) rats of the control group. Ordinate: the number of approaches to each vial with a specific odor, expressed as % of the total number of approaches to all vials during the testing period. Abscissa: the numbers indicate the corresponding odors – 1 – orange, 2 – carnations, 3 – jasmine, 4 – mint, 5 – eucalyptus, 6 – wormwood, 7 – lavender, 8 – valerian. * – p < 0.001 – statistically significant differences between valerian and other odors in each age group. (б–г) – Behavior in the food search test of young (n = 15), adult (n = 13) and old (n = 14) control rats. (б) – averaged food search performance in score points (ordinate) for each age group (abscissa), * – p < 0.05 – differences between age groups; (в) – the number of rats that achieved a certain search result, expressed in % of the total number of rats in each group (ordinate) achieved the score from 0 to 2 (abscissa). (а–б) – data presented as medians and interquartile ranges with the spreads indicating the minimum and maximum values. (в–г) – data presented as mean ± SEM. * – p <0.05, ** – p <0.01, *** – p < 0.001 – differences between young and old rats; # – p <0.05, ## – p < 0.01 – differences between adult and old rats. (г) Index of search activity (ordinate). * – p <0.001 – differences between young and adult or between young and old rats.
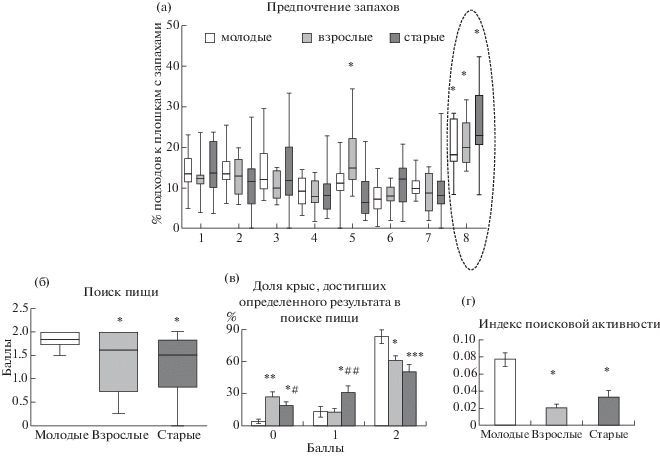
Изменение результативности поиска пищи в постнатальном онтогенезе крыс. В контрольной группе животных наблюдалась возрастная динамика результативности поиска пищи (F2; 41 = 4.5, р = 0.017) (рис. 1 (б)). Сравнение среднего балла результативности поиска пищи в разных возрастных группах показало, что молодые крысы демонстрировали лучшие результаты, чем взрослые (р = 0.013) и старые животные (р = 0.014). При этом среди молодых животных преобладали особи, выполнявшие поиск корма с результативностью 100% (F2; 16 = 9.9, р < 0.01) и было меньше животных с нулевым результатом поиска (р < < 0.05) (рис. 1 (в)). Взрослые и старые животные не различались по среднему баллу результативности (рис. 1 (б)), однако среди старых крыс было примерно в два раза больше (F2; 16 = 7.6, р < 0.01) особей, выполнявших поиск с 50%-м результатом, по сравнению с молодыми и взрослыми крысами (рис. 1 (в)), в то время как среди взрослых крыс было больше особей, выполнявших безрезультатный поиск корма (F2; 16 = 11.4, р < 0.05) (рис. 1 (в)).
Для оценки поисковой активности рассчитывали отношение суммарного числа обнюхиваний всех отверстий ко времени тестирования, выраженном в секундах, и рассматривали его в качестве индекса, отражающего мотивацию поиска пищи у животных. У молодых контрольных крыс индекс поисковой активности был в 3.7 и 2.3 раза выше этого показателя у взрослых и старых животных, соответственно (F2; 41 = 22.2; р < 0.01) (рис. 1 (г)).
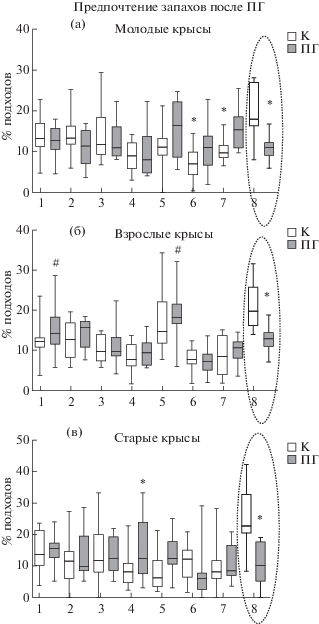
Влияние ПГ на предпочтение запахов в постнатальном онтогенезе крыс. У ПГ крыс наблюдалось существенное изменение поведения в тесте на предпочтение запахов. Так, молодые (рис. 2 (а)) и старые (рис. 2 (в)) ПГ крысы не отдавали предпочтения ни одному из предъявляемых запахов, а у взрослых крыс наблюдалось предпочтение (F7; 111 = 11.0, р < 0.001) к запахам апельсина и эвкалипта по сравнению с другими запахами (рис. 2 (б)). При этом предпочтение к запаху валерианы у ПГ крыс было ниже на 45% у молодых (F15; 203 = = 5.6, р < 0.001); на 23% у взрослых (F15; 215 = = 10.8, р < 0.001) и на 38% у старых крыс (F15; 191 = 4.5, р < 0.001) по сравнению с контролем. Также по сравнению с контролем молодые ПГ животные больше интересовались) запахами полыни и лаванды (F15; 203 = 5.6, p < < 0.001), а для старых животных наиболее привлекательным был запах мяты (F15; 191 = = 4.5, р < 0.033). Нарушение предпочтения запаха валерианы среди прочих индифферентных одорантов интерпретировалось как свидетельство нарушения нормальной работы обонятельного анализатора.
Рис. 2.
Сравнительный анализ предпочтения запахов на разных этапах онтогенеза между контрольными и ПГ крысами. (а) – Сравнение молодых контрольных (n = 16) и ПГ (n = 10) животных. (б) – Сравнение взрослых контрольных (n = 13) и ПГ (n = 14) животных. (в) – Сравнение старых контрольных (n = 13) и ПГ (n = 11) животных. Остальные обозначения как на рис. 1. # – р < 0.05, ## – р < 0.01 – различия между запахом валерианы и другими запахами в группе взрослых ПГ животных. * – р < 0.05 ** – р < 0.001 – различия между контрольной и ПГ группами.
Fig. 2. Comparative analysis of odor preferences at different stages of ontogenesis between control and PH rats. (a) – Comparison of young control (n = 16) and PH (n = 10) rats. (б) – Comparison of adult control (n = 13) and PH (n = 14) rats. (в) – Comparison of old control (n = 13) and PH rats. All indication as in Fig. 1. # – р < 0.05, ## – р < 0.01 – differences between preference to valerian and other odors in the group of adult PH rats. * – р < 0.05 ** – р < 0.001 – differences between the control and PH groups.
Влияние пренатальной гипоксии на результативность поиска пищи в постнатальном онтогенезе крыс. Анализ поведения ПГ животных выявил отсутствие возрастной динамики по результативности поиска пищи (F2; 32 = 0.3, р = 0.758). В среднем ПГ крысы из разных возрастных групп набирали меньше баллов, чем их контрольные сверстники (F5; 74 = 7.2, р < 0.001). У молодых животных наблюдалось снижение этого показателя на 43% (р < 0.01), у взрослых – на 40% (р = 0.018) и у старых – на 41% (р < 0.01) (рис. 3 (а)). Более детальный анализ показал, что в ПГ группе отсутствовали различия по количеству крыс, выполнявших безуспешный или 100% поиск (рис. 3 (б, г)). Однако по количеству крыс, находивших только 1 кусок печенья, были выявлены возрастные изменения (F2; 16 = 3.7, р = 0.05) и число молодых животных с таким результатом было меньше по сравнению со старыми животными (р < 0.01) (рис. 3 (в)). На всех исследуемых этапах онтогенеза при сопоставлении с контрольными сверстниками ПГ крысы чаще (F5; 33 = 11.7, р < 0.001) демонстрировали безуспешный поиск с нулевым результатом (рис. 3 (б)) и реже (F5; 33 = 10.5, р < 0.001) находили оба куска печенья (рис. 3 (г)).
Рис. 3.
Сравнительный анализ эффективности поиска пищи у контрольных и ПГ крыс. (а) – Ось ординат: усредненная по возрастным группам результативность поиска в баллах. Остальные обозначения как на рис. 1. * – р < 0.05; *** – р < 0.001 – различия между контрольной и ПГ группами. (б–г) – Ось ординат: доля крыс (%), достигших определенного результата в поиске пищи от общего количества крыс в каждой возрастной группе, принятого за 100%. (б) – молодые контрольные (n = 16) и ПГ (n = 10) крысы; (в) – взрослые контрольные (n = 13) и ПГ (n = 14) крысы; (г) – старые контрольные (n = 13) и ПГ (n = 11) крысы. Данные представлены в виде среднего ± ошибка среднего. # – р < 0.05, ## – р < 0.01 – различия между молодыми и старыми ПГ крысами; *– р < 0.05, ** – р < 0.01, *** – p <0.001 – различия между контрольной и ПГ группами. (д) – По оси ординат: индекс поисковой активности. * – р < 0.001.
Fig. 3. Comparative analysis of food search efficacy in control and PH rats. (a) – Ordinate: averaged food search performance in each age group expressed in score points. All indications as in Fig. 1. * – p < 0.05; *** – p < 0.001 – statistically significant differences between the control and hypoxic groups. (б–г) – Ordinate: number of rats (%) that achieved a certain search result in each age group from the total number of rats n the group taken as 100%. (б) – young control (n = 16) and PH (n = 10) rats; (в) – adult control (n = 13) and PH (n = 14) rats; (г) – old control (n = 13) and PH (n = 11) rats. Data are presented as mean ± SEM. # – р < 0.05, ## – р < 0.01 – differences between young and old PH rats; *– р < 0.05, **– р < 0.01, ***– p < 0.001 – differences between control and PH groups. (д) – Ordinate: index of search activity. * – р < 0.001.
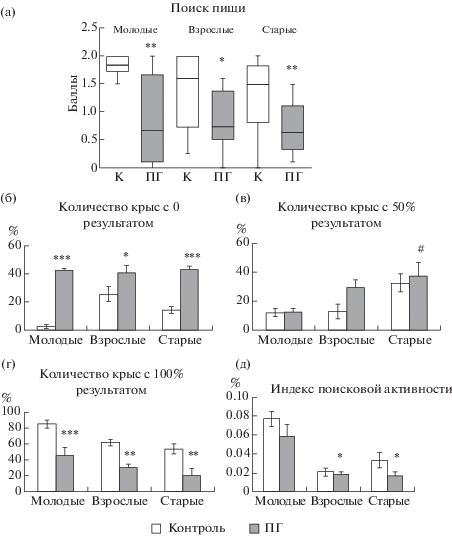
По индексу поисковой активности ПГ животные не отличались от контрольных сверстников и у них наблюдалась сходная с ними онтогенетическая динамика этого показателя (F5; 74 = 16.9; р < 0.01). У молодых ПГ крыс этот параметр был в 3.1 и 3.7 раза выше, чем у взрослых и старых крыс соответственно (рис. 3 (д)).
Анализ структуры пириформной коры крыс в ходе постнатального онтогенеза. Изучение светооптическим методом Ниссля клеточной организации пириформной коры крыс, являющейся центром, куда направлены обонятельные пути из обонятельных луковиц, показало, что на Р20 у крыс после ПГ по сравнению с контролем имеются признаки деструкции нервных клеток, в частности, вздутые нейроны с отекшими отростками. В цитоплазме этих нейронов появлялись вакуоли и наблюдался лизис органоидов (хроматолиз) (рис. 4 (д)). На этой стадии также отмечалось большое количество глиальных клеток, расположенных вблизи набухших нейронов. На Р35 количество глиальных клеток увеличивалось, а количество нейронов снижалось (рис. 4 (и)). На Р90 в пириформной коре ПГ крысят имело место затухание нейродегенеративных процессов и исчезали скопления глиальных клеток, однако еще встречались отдельные нейроны в состоянии хроматолиза (рис. 4 (г, ж)).
Рис. 4.
Структурные изменения в пириформной коре в постнатальном онтогенезе крыс в норме и после ПГ. (а) – схема связей в обонятельном анализаторе крыс. OЛ – обонятельные луковицы, Тал – таламус, Гип – гиппокамп, ЭК – энторинальная кора, ПК – пириформная кора. (б)–(ж) –микрофотографии участка пириформной коры крыс, окраска по Нисслю, масштаб 30 мкм. (б–г) – микрофотография участков пириформной коры контрольных крыс на Р20 (б), Р35 (в) и Р90 (г). (д–ж) – микрофотография участков пириформной коры ПГ крысы на Р20 (д), Р35 (е) и Р90 (ж). В левом верхнем углу рисунков (д) и (е) – увеличенные фрагменты микрофотографий со скоплениями глиальных элементов и дегенерирующими нейронами. Тонкие черные стрелки – непирамидные нейроны, черные треугольники – пирамидные нейроны, * – скопления глиальных клеток. (з) – схема расположения исследуемой области пириформной коры, взятой для морфометрического анализа. (и) – изменение числа разных популяций клеток (ось абсцисс) на исследуемом участке пириформной коры крыс на Р35. Ось ординат – результаты изменений после ПГ в % от уровня контроля, принятого за 0%, выраженные в виде среднее ± ошибка среднего. * p < 0.05, ** p < 0.01.
Fig. 4. Structural changes in the piriform cortex in postnatal ontogenesis of rats under normal conditions and after PH. (a) – diagram of connections of the olfactory bulb with the piriform cortex. OЛ – olfactory bulbs, Тал – thalamus, Гип – hippocampus, ЭК – entorhinal cortex, ПК – piriform cortex. (б–ж) –microphotographs of the sections of the rat piriform cortex, Nissl staining, scale 30 µm. (б–г) – microphotographs of the piriform cortex in control rats on P20 (б), P35 (в) and P90 (г). (д–ж) – microphotographs of the piriform cortex in rats subjected to prenatal hypoxia. Animal age is: P20 (д), P35 (е) and P90 (ж). In the upper left corner of the figures (д) and (е), enlarged fragments of microphotographs with shown glial elements and degenerating neurons. Thin black arrows – non-pyramidal neurons, black triangles – pyramidal neurons, * – conglomerates of glial cells. (з) – schematic presentation of piriform cortex area taken for the morphometric analysis. (и) – changes in the number of different cell populations (abscissa) in the piriform cortex of rats on P35. Ordinate – changes in cell number after PH in % of the control levels taken as 0% expressed as mean ± standard error of the mean. * p < 0.05, ** p < 0.01.
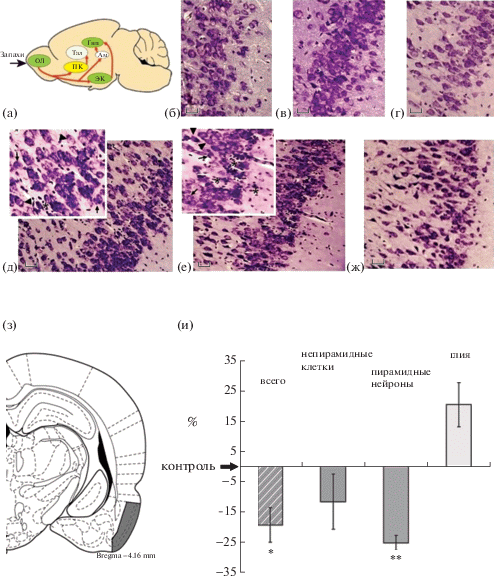
Морфометрическое исследование клеточного состава ткани пириформной коры крыс после ПГ. Анализ клеточного состава пириформной коры ПГ крыс на Р35 показал снижение на 19.3% общего числа клеток по сравнению с контролем (критерий Манна–Уитни, U = 12.4, p = 0.03) (рис. 4 (з, и)). У ПГ крыс отмечалось также снижение количества пирамидных нейронов на 25.2% от уровня контроля (критерий Манна–Уитни, U = 8.2, p < 0.01), при отсутствии статистически различий в количестве непирамидных нейронов (критерий Манна–Уитни, U = 21.0, p < 0.08). Это свидетельствует о гибели проекционных пирамидных нейронов в пириформной коре ПГ крыс в ходе первого месяца развития. В то же время среднее количество глиальных клеток у таких животных было в среднем на 20.4% выше, чем в контроле (рис. 4 (б)), однако в силу неоднородности распределения этих клеток статистической значимости различий выявить не удалось (рис. 4 (д–е).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Снижение обонятельной функции животных и человека наблюдается как в ходе нормального старения, так и в более раннем возрасте при развитии вирусных инфекций, что особенно ярко проявилось в ходе пандемии COVID-19 (Koralnik, Tayler, 2020), а также нейродегенеративных заболеваний, таких как болезни Альцгеймера (БА) (Murphy, 2019), Паркинсона (Doty, 2012) и других патологий нервной системы (Barresi et al., 2012, Bsteh et al., 2019; Carnemolla et al., 2020). Расстройства обоняния в патогенезе нейродегенеративных заболеваний проявляются намного раньше, чем когнитивные или двигательные нарушения (Bsteh et al., 2019). Существует мнение, что в их основе лежат отличные от нормального старения молекулярно-клеточные механизмы (Parvand, Rankin, 2020), что делает исследования на животных моделях важным направлением в данной области нейробиологии.
Поскольку формирование обонятельной системы начинается уже в эмбриональный период, повреждающие пренатальные воздействия на организм могут приводить к существенным перестройкам в развитии нейрональных сетей, принимающих участие в проведении обонятельных стимулов (Akers et al., 2011; Liu et al., 2013) и нарушению обонятельной функции в последующем онтогенезе (Franks, Isaacson, 2005). Проведенное нами исследование показало, что пренатальная гипоксия существенным образом изменяет обонятельное поведение крыс. Использованные в нашей работе методики тестирования обонятельного поведения крыс были основаны как на их способности распознавать физиологически значимые одоранты, так и на целенаправленном поиске пищи по запаху. Было показано, что среди восьми запахов натуральных эфирных масел наиболее привлекательным для всех интактных крыс, независимо от возраста, является валериановое масло. Такой результат вполне закономерен в связи с тем, что компоненты валерианового масла, в частности, изовалериановая кислота, имеют феромональное значение для этого вида животных и широко используются при исследовании обонятельной функции у грызунов (Борякова и др., 2007; Мельник и др., 2009; Мельник и др., 2012). ПГ существенно влияла на предпочтения запахов во всех возрастных группах. Примечательно, что после ПГ молодые и старые крысы не отдавали предпочтения ни одному из предъявляемых запахов, и только взрослые животные обнаруживали предпочтение к запахам апельсина и эвкалипта. Таким образом, ПГ нивелировала предпочтение к физиологически значимому для нормальных животных запаху валерианы, что может пагубно влиять на их половое поведение.
Анализ обонятельного поведения крыс по поиску пищи, на результативность которого может влиять как мотивация животного, так и состояние его обонятельной системы (Roesch et al., 2007; Bianchi et al., 2014), показал, что эффективность поиска пищи у контрольных животных, также как и индекс поисковой активности, снижаются с возрастом. Поэтому можно предположить, что снижение поисковой мотивации у взрослых и старых крыс обусловливает и более низкую их результативность. ПГ не изменяла возрастную динамику индекса поисковой активности крыс, однако результативность поиска пищи у ПГ животных была значительно ниже, чем у интактных сверстников, и результат поиска у них чаще оказывался нулевым и реже 100%-ным. Полученные результаты позволяют сделать вывод, что ПГ нарушает у животных именно обонятельную функцию, а не мотивацию пищевого поиска. Это согласуется с немногочисленными данными литературы о том, что ПГ и другие патологические воздействия нарушают более сложные формы обонятельного поведения, связанные с ассоциативным обучением и памятью (Тюлькова и др., 2010; Akers et al., 2011).
Работа обонятельного анализатора затрагивает многие отделы головного мозга, однако наиболее значимыми считаются обонятельные луковицы, где происходит начальная обработка сигналов, поступающих от рецепторных клеток обонятельного эпителия носовой полости и вомероназального органа, пириформная и энторинальная области коры, в которых расположены проекционные нейроны, передающие сигналы в таламические ядра и гиппокамп, а также гипоталамические ядра и миндалина, осуществляющие модуляцию поступающей информации (Arzi, Sobel, 2011; Ghosh et al., 2011; Sosulski et al., 2011) (рис. 4 (а)). К сожалению, информация о влиянии пренатальной гипоксии на данные отделы головного мозга в литературе крайне скудна. Ранее нами было показано, что ПГ на Е14 вызывает нарушение генерации и миграции нейробластов при формировании энторинальной области коры мозга крыс, а также гибель нейронов в первый месяц постнатального онтогенеза (Васильев и др., 2020; Туманова и др., 2021). В ходе настоящего исследования на той же модели показано, что ПГ приводит к гибели нейронов и в пириформной области коры мозга крыс. Это свидетельствует в пользу существования общих молекулярно-клеточных механизмов нарушения формирования кортикальной пластинки в различных областях коры головного мозга грызунов в ходе эмбрионального развития. Во всех случаях изменения в структурной организации коры после ПГ наиболее сильно выражены во второй половине первого месяца постнатального развития крысят (Р20-30). В это время у них также наблюдаются наиболее выраженные моторные и когнитивные дисфункции (Дубровская, Журавин, 2009), а также нарушения поиска пищи по запаху и изменение предпочтения к одорантам, что показано в данной работе. Тем не менее при всей схожести характера структурных изменений в кортикальной пластине, паттерны изменения клеточного состава в различных отделах коры головного мозга после ПГ различаются. Так, в теменной коре наиболее чувствительными к действию ПГ являются проекционные пирамидные нейроны, особенно в V-VI слоях, при отсутствии выраженного глиоза (Vasilev et al., 2016), а в энторинальной коре отмечается заметное снижение числа непирамидных клеток (Васильев и др., 2020; Туманова и др., 2021). В пириформной области коры, согласно данному исследованию, ПГ также приводит к снижению численности проекционных пирамидных нейронов, однако для нее характерно наличие локальных скоплений глиальных клеток (Туманова и др., 2021).
Полученные нами ранее результаты также свидетельствуют о том, что ПГ вызывает патологические изменения не только в пириформной и энторинальной коре, но и в гиппокампе (Туманова и др., 2021), т.е. в отделах мозга, участвующих в процессе обработки обонятельной информации. В то же время ПГ не вызывала существенных изменений в составе обонятельных луковиц, характеризующихся высокой степенью нейрогенеза в ходе всего постнатального развития (Bianchi et al., 2014). Можно предположить, что гибель проекционных нейронов в кортикальных отделах и является одной из причин нарушений поиска пищи по запаху и различения одорантов, которые наблюдались в ходе данного исследования.
Еще одним важным звеном в проведении обонятельных стимулов является нейропептидаза неприлизин (НЕП), расщепляющая соматостатин – важный медиатор пептидэргической передачи в разных отделах мозга, включая обонятельные луковицы (Barnes et al., 1995; Nocera et al., 2019). В мозге развивающегося эмбриона крыс НЕП начинает экспрессироваться еще до рождения именно в структурах обонятельных луковиц (Dutriez et al., 1992). Как было показано нами ранее, в этой части обонятельного анализатора крыс уровень экспрессии НЕП намного превышает экспрессию в кортикальных структурах мозга в ходе всего постнатального периода и снижается только у старых крыс, коррелируя со снижением остроты их обонятельной функции (Vasilev et al., 2021). ПГ на Е14 существенно снижала уровень экспрессии НЕП в энторинальной и теменной коре, а также в гиппокампе крыс в первые месяцы после рождения, но при этом не влияла на уровень экспрессии НЕП в обонятельных луковицах (Vasilev et al., 2021). Эти данные подтверждают нашу гипотезу о том, что ПГ в основном изменяет свойства центральных звеньев обонятельного анализатора. Поскольку НЕП является одним из основных амилоид-деградирующих ферментов в ткани мозга, а дефицит его содержания и активности играет важную роль в патогенезе БА (см. обзор: Nalivaeva, Turner, 2019), снижение его экспрессии в обонятельных структурах мозга индивидуумов, перенесших пренатальный стресс, а также в ходе нормального старения, может способствовать накоплению в них β-амилоидного пептида, гибели нервных клеток и нейродегенерации, увеличивая риск развития БА и способствуя снижению обонятельной функции (Saiz-Sanchez et al., 2010).
ЗАКЛЮЧЕНИЕ
В ходе постнатального развития крыс наблюдается снижение эффективности обонятельной функции, проявляющееся в более низкой результативности поиска пищи. Гипоксия в пренатальный период приводит к снижению эффективности поиска пищи, начиная с ранних этапов онтогенеза и до старости, при этом на всех исследованных этапах нарушается распознавание запаха валерианы, имеющего феромональное значение. Вызванные ПГ нарушения коррелируют с изменениями структуры и клеточного состава пириформной коры, являющейся важной составной частью обонятельного анализатора, а также энторинальной коры и гиппокампа, но не обонятельных луковиц. Это позволяет сделать вывод, что ПГ в период активного формирования корковых структур мозга крыс существенно нарушает процессы развития и биохимические характеристики центральных отделов обонятельного анализатора, не затрагивая существенным образом его периферические отделы, приводя к нарушению реализации обонятельного поведения животных.
Список литературы
Беляков В.И., Макеева Ю.В., Грибанов И.А. Влияние различных одорантов на особенности поведенческих реакций крыс. Евразийский Союз Ученых. 2015. 4 (13): 6–11. https://doi.org/10.31618/esu.2411-6467.8.53.1
Борякова Е.Е., Гладышева О.С., Крылов В.Н. Возрастная динамика обонятельной чувствительности у самок лабораторных мышей и крыс к запаху изовалериановой кислоты. Сенс. сист. 2007. 21 (4): 341–346.
Васильев Д.С., Туманова Н.Л., Калинина Д.С. Пренатальная гипоксия приводит к нарушению формирования нервной ткани энторинальной области коры мозга крыс. Росс. физиол. ж. 2020. 106 (10.): 1278–1288. https://doi.org/10.31857/S086981392010012X
Васильев Д.С., Туманова Н.Л., Журавин И.А. Структурные изменения нервной ткани новой коры в онтогенезе крыс после гипоксии на разных сроках онтогенеза. Ж. эвол. биох. физиол. 2008. 44 (3): 258–266.
Гуляева Н.В., Бобкова Н.В., Колосова Н.Г., Самохин А.Н., Степаничев М.Ю., Стефанова Н.А. Молекулярно-клеточные механизмы патогенеза спорадической формы болезни Альцгеймера: исследования in vivo на моделях грызунов. Биохимия. 2017. 82: 1427–1443.
Дубровская Н.М., Журавин И.А. Онтогенетические особенности поведения крыс, перенесших гипоксию на 14-е или 18-е сутки эмбриогенеза. Журнал высшей нервной деятельности им. И.П. Павлова. 2009. 58 (5): 616–625. https://doi.org/10.1007/s11055-009-9235-2
Мельник С.А., Гладышева О.С., Крылов В.Н. Возрастные изменения обонятельной чувствительности самцов мышей к запаху изовалериановой кислоты. Сенсорные системы. 2009. 23 (2): 151–155.
Мельник С.А., Гладышева О.С., Крылов В.Н. Влияние предварительного воздействия паров изовалериановой кислоты на обонятельную чувствительность самцов домовой мыши. Сенсорные системы. 2012. 26 (1): 52–56.
Недогреева О.А., Степаничев М.Ю., Гуляева Н.В. 2020. Удаление обонятельных луковиц у мышей приводит к изменениям эмоционального поведения. Журнал высшей нервной деятельности им. И.П. Павлова. 70 (1): 104–114. https://doi.org/10.31857/S0044467720010116
Туманова Н.Л., Васильев Д.С., Дубровская Н.М., Наливаева Н.Н., Журавин И.А. Влияние пренатальной гипоксии на цитоархитектонику и ультраструктурную организацию отделов мозга, связанных с обонятельной функцией у крыс. Цитология. 2021. 71 (2) 71 (2): 163–175. https://doi.org/10.31857/S0041377121020085.
Тюлькова Е.И., Ватаева Л.А., Самойлов М.О., Отеллин В.А. Механизмы формирования реакций мозга на действие гипербарической гипоксии в различные сроки пренатального периода развития у крыс. Журнал акушерства и женских болезней. 2010. 59 (4): 99.
Соколов В.Е., Вознесенская В.В. Роль раннего ольфакторного опыта в индивидуальном распознавании серой крысы. 1996. Докл. Акад. наук. 348 (5): 140–142.
Akers K.G., Kushner S.A., Leslie A.T., Clarke L., van der Kooy D., Lerch J.P., Frankland P.W. Fetal alcohol exposure leads to abnormal olfactory bulb development and impaired odor discrimination in adult mice. 2011. Mol. Brain. 4: 29. http://www.molecularbrain.com/content/4/1/29
Apfelbach R., Russ D., Slotnick B.M. Ontogenetic changes in odorsensitivity, olfactory receptor area and olfactory receptor density in the rat. Chem. Senses. 1991.16: 209–218. https://doi.org/10.1093/chemse/16.3.209
Arzi A., Sobel N. Olfactory perception as a compass for olfactory neural maps. Trends Cogn. Sci. 2011. 15: 537–545. https://doi.org/10/1016/j.tics.2011.09.007
Barnes K., Doherty S., Turner A.J. Endopeptidase-24.11 is the integral membrane peptidase initiating degradation of somatostatin in the hippocampus. J. Neurochem. 1995. 64: 1826–1832. https://doi.org/10/1046/j.1471-4159.1995.64041826.x
Barresi M., Ciurleo R., Giacoppo S., FotiCuzzola V., Celi D., Bramanti P., Marino S. Evaluation of olfactory dysfunction in neurodegenerative diseases. J. Neurol. Sci. 2012. 323 (1–2): 16–24. https://doi.org/10/1016/j.jns.2012.08.028
Bianchi P., Bettini S., Guidi S., Ciani E., Trazzi S., Stagni F., Ragazzi E., Franceschini V., Bartesaghi R. Age-related impairment of olfactory bulb neurogenesis in the Ts65Dn mouse model of Down syndrome. Exp. Neurol. 2014. 251: 1. https://doi.org/10.1016/j.expneurol.2013.10.018
Brennan P.A., Kendrick K.M. Mammalian social odours: attraction and individual recognition. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2006. 361 (1476): 2061–2078. https://doi.org/10.1098/rstb.2006.1931
Bsteh G., Hegen H., Ladstätter F., Berek K., Amprosi M., Wurth S., Auer M., Di Pauli F., Deisenhammer F., Reindl M., Berger T., Lutterotti A. Change of olfactory function as a marker of inflammatory activity and disability progression in MS. Mult. Scler. 2019. 25 (2): 267–274. https://doi.org/10.1177/1352458517745724
Carnemolla S.E., Hsieh J.W., Sipione R., Landis B.N., Kumfor F., Piguet O., Manuel A.L. Olfactory dysfunction in frontotemporal dementia and psychiatric disorders: A systematic review. Neurosci. Biobehav. Rev. 2020. 118: 588–611. https://doi.org/10.1016/j.neubiorev.2020.08.002
Doty R.L. Olfactory dysfunction in Parkinson disease. Nat. Rev. Neurol. 2012. 8: 329. https://doi.org/10.1038/nrneurol.2012.80
Dutriez I., Salès N., Fournié-Zaluski M.C., Roques B.P. Pre- and post-natal ontogeny of neutral endopeptidase 24-11 (“enkephalinase”) studied by in vitro autoradiography in the rat. Experientia. 1992. 48: 290. https://doi.org/10.1007/BF01930479
Franks K.M., Isaacson J.S. Synapse-specific downregulation of NMDA receptors by early experience: a critical period for plasticity of sensory input to olfactory cortex. Neuron. 2005.47: 101–114. https://doi.org/10.1016/j.neuron.2005.05.024
Ghosh S., Larson S.D., Hefzi H., Marnoy Z., Cutforth T., Dokka K., Baldwin K.K. Sensory maps in the olfactory cortex defined by long-range viral tracing of single neurons. Nature. 2011. 472: 217. https://doi.org/10.1038/nature09945
Koralnik I.J., Tyler K.L. COVID-19: A Global Threat to the Nervous System. Ann. Neurol. 2020. 88: 1. https://doi.org/10.1002/ana.25807
Liu Y.-H., Lai W.-S., Tsay H.-J., Wang T.-W., Yu J.-Y. Effects of maternal immune activation on adult neurogenesis in the subventricular zone–olfactory bulb pathway and olfactory discrimination. Schiz. Res. 2013. 151 (1–3): 1–11.
Morozova A.Yu., Arutyunyan A.V., Morozova P.Yu., Kozina L.S., Zhuravin I.A., Nalivaeva N.N. Effect of Prenatal Hypoxia on Activity of the Soluble Forms of Cholinesterases in Rat Brain Structures during Early Postnatal Ontogenesis. J. Evol.Biochem.Physiol. 2020. 56 (6): 531–540. https://doi.org/10.1134/S002209302006006X
Mori K., Sakano H. How is the olfactory map formed and interpreted in the mammalian brain? Annu. Rev. Neurosci. 2011. 34: 467–499. https://doi.org/10.1146/annurev-neuro-112210-112917
Murphy C. Olfactory and other sensory impairments in Alzheimer disease. Nat. Rev. Neurol. 2019. 15: 11–24. https://doi.org/10.1038/s41582-018-0097-5
Nalivaeva N.N., Belyaev N.D., Lewis D.I., Pickles A.R., Makova N.Z., Bagrova D.I., Dubrovskaya N.M., Plesneva S.A., Zhuravin I.A., Turner A.J. Effect of sodium valproate administration on brain neprilysin expression and memory in rats. J. Mol. Neurosci. 2012. 46: 569–577. https://doi.org/10.1007/s12031-011-9644-x
Nalivaeva N.N., Turner A.J. Targeting amyloid clearance in Alzheimer’s disease as a therapeutic strategy. Br. J. Pharmacol. 2019. 176: 3447–3463. https://doi.org/10.1111/bph.14593
Niimura Y. Evolutionary dynamics of olfactory receptor genes in chordates: interaction between environments and genomic contents. Hum Genomics. 2009. 4 (2):107–118. https://doi.org/10.1186/1479-7364-4-2-107
Nocera S., Simon A., Fiquet O., Chen Y., Gascuel J., Datiche F., Schneider N., Epelbaum J., Viollet C. Somatostatin Serves a Modulatory Role in the Mouse Olfactory Bulb: Neuroanatomical and Behavioral Evidence. Front. Behav. Neurosci. 2019. 13: 61. https://doi.org/10.3389/fnbeh.2019.00061
Parvand M., Rankin C.H. Is There a Shared Etiology of Olfactory Impairments in Normal Aging and Neurodegenerative Disease? J. Alzheimers Dis. 2020. 73: 1–21. https://doi.org/10.3233/JAD-190636
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. 6th Edition. Amsterdam: Academic Press-Elsevier Inc., 2007, 456 p.
Roesch M.R., Stalnaker T.A., Schoenbaum G. Associative encoding in anterior piriform cortex versus orbitofrontal cortex during odor discrimination and reversal learning Cereb. Cortex. 2007. 17 (3): 643–652. https://doi.org/10.1093/cercor/bhk009
Saiz-Sanchez D., Ubeda-Bañon I., de la Rosa-Prieto C., Argandoña-Palacios L., Garcia-Muñozguren S., Insausti R., Martinez-Marcos A. Somatostatin, Tau, and β-amyloid within the anterior olfactory nucleus in Alzheimer disease. Exp. Neurol. 2010. 223: 347. https://doi.org/10.1016/j.expneurol.2009.06.010
Sarnat H.B., Flores-Sarnat L. Development of the human olfactory system Handb. Clin. Neurol. 2019. 164: 29–45. https://doi.org/10.1016/B978-0-444-63855-7.00003-4
Sosulski D.L., Lissitsyna Bloom M., Cutforth T., Axel R., Datta S.R. Distinct representations of olfactory information in different cortical centres. Nature. 2011. 472: 213. https://doi.org/10.1038/nature09868
Sun S., Li T., Davies H., Li W., Yang J., Li S., Ling S. Altered Morphologies and Functions of the olfactory bulb and hippocampus induced by miR-30c. Front. Neurosci. 2016. 10: 207. https://doi.org/10.3389/fnins.2016.00207
Suzuki J., Osumi N. Neural crest and placode contributions to olfactory development. Curr. Top. Dev. Biol. 2015. 111: 351–74. https://doi.org/10.1016/bs.ctdb.2014.11.010
Takahashi H., Yoshihara S., Tsuboi A. The Functional Role of Olfactory Bulb Granule Cell Subtypes Derived From Embryonic and Postnatal Neurogenesis. Front. Mol. Neurosci. 2018.11: 229. https://doi.org/10.3389/fnmol.2018.00229
Vasilev D.S., Dubrovskaya N.M., Tumanova N.L., Zhuravin I.A. Prenatal hypoxia in different periods of embryogenesis differentially affects cell migration, neuronal plasticity, and rat behavior in postnatal ontogenesis Front. Neurosci. 2016. 10: 126. https://doi.org/10.3389/fnins.2016.00126
Vasilev D.S., Dubrovskaya N.M., Zhuravin I.A., Nalivaeva N.N. Developmental Profile of Brain Neprilysin Expression Correlates with Olfactory Behaviour of Rats. J. Mol. Neurosci. 2021. https://doi.org/10.1007/s12031-020-01786-3
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


