Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 3, стр. 387-399
Зависимое от пола влияние стресса самцов крыс на память и экспрессию гена инсулиноподобного фактора роста 2 в мозге потомков
Н. Э. Ордян 1, *, О. В. Малышева 1, 2, Г. И. Холова 1, В. К. Акулова 1, С. Г. Пивина 1
1 Федеральное государственное бюджетное учреждение науки “Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Федеральное государственное бюджетное научное учреждение “Институт акушерства, гинекологии
и репродуктологии им. Д.О. Отта”
Санкт-Петербург, Россия
* E-mail: neo@infran.ru
Поступила в редакцию 26.11.2020
После доработки 17.12.2020
Принята к публикации 02.03.2021
Аннотация
Изучены последствия стрессирования самцов крыс в парадигме “стресс-рестресс” (модель посттравматического стрессового расстройства, ПТСР) на память и экспрессию гена инсулиноподобного фактора роста 2 (Igf2) в отдельных структурах мозга их половозрелых потомков обоего пола. Экспрессию гена Igf2 дополнительно исследовали у новорожденных потомков. Показано, что стресс отца вызывает дефицит памяти в тестах “Реакция пассивного избегания” и “Распознавание нового объекта” преимущественно у потомков-самцов. У потомков-самок дефицит памяти обнаружен только в тесте “Распознавание нового объекта”. Только у потомков-самцов выявлено снижение экспрессии гена Igf2 в гиппокампе и неокортексе в половозрелом возрасте, но не у новорожденных потомков-самцов. Полученные результаты свидетельствуют о секс-специфических эффектах ПТСР-подобного состояния самцов-отцов на память и экспрессию гена Igf2 в мозге половозрелых потомков.
В последние годы инсулиноподобный фактор роста 2 (ИФР2) и его участие в процессах, связанных с когнитивными функциями и памятью, привлекают пристальное внимание. В научной литературе появились доказательства участия ИФР2 гиппокампа и медиальной префронтальной коры в когнитивных процессах. Так, при исследовании post mortem головного мозга больных шизофренией, характеризующейся выраженными когнитивными нарушениями, было показано снижение экспрессии гена Igf2 в префронтальной коре (Fromer et al., 2016). Посмертное исследование образцов мозга пациентов с болезнью Альцгеймера, вызывающей деменцию, также выявило снижение уровня мРНК и самого белка ИФР2 в гиппокампе (Steen et al., 2005). В генетических исследованиях на здоровых добровольцах была обнаружена связь между когнитивными функциями и полиморфизмом участка ApaI в гене Igf2 (Алфимова и др., 2012). В этом исследовании выявлено, что лица с генотипом АА, которые характеризуются повышенным содержанием в крови ИФР2, отличаются повышенной продуктивностью избирательного зрительного внимания.
Основные данные, указывающие на участие ИФР2 в когнитивных процессах, были получены на лабораторных животных. Показано, что в гиппокампе крыс после обучения в тесте “Оборонительная реакция пассивного избегания” примерно через 20 ч с момента обучения увеличивается содержание ИФР2, и это является необходимым условием для формирования долгосрочной гиппокамп-зависимой памяти (Chen et al., 2011). При билатеральном введении в дорсальный гиппокамп рекомбинантного ИФР2, но не ИФР1, с последующим тестированием крыс в тесте “Реакция пассивного избегания” наблюдается улучшение консолидации следов памяти и долговременного хранения информации, проявляющееся в значительном увеличении латентного периода перехода в темный отсек камеры, в том числе через 3 нед после обучения (Lee et al., 2015; Stern et al., 2014). Показано также, что мыши, лишенные регуляторов циркадного ритма Sharp 1 и 2, характеризуются повышенной экспрессией гена Igf2 в передней цингулярной коре и усилением консолидации памяти при выработке условнорефлекторной реакции страха (Shahmoradi et al., 2015). В исследованиях Ouchi и соавт. (Ouchi et al., 2013) установлено снижение экспрессии Igf2 в гиппокампе взрослых нокаутных по гену Dgcr8 мышей, являющихся моделью шизофрении, что сопровождалось снижением клеточной пролиферации и нейрогенеза в гиппокампе и ухудшением зависимых от этой мозговой структуры форм обучения.
Помимо когнитивных функций, ИФР2 играет значительную роль в росте и развитии эмбриона. Снижение экспрессии гена Igf2 в период внутриутробного развития приводит к задержке роста плода и даже его гибели (Bergman et al., 2013). Полагают, что низкий вес новорожденных детей может быть обусловлен, в том числе, изменением содержания ИФР2 в тканях самого плода или в плаценте (Moore et al., 2015 White et al., 2018). ИФР2 в эмбриональный период экспрессируется во многих соматических тканях, но вскоре после рождения экспрессия гена Igf2 здесь значительно снижается, и функцию посредника между гормоном роста и тканями-мишенями начинает выполнять белок ИФР1. В тканях ЦНС относительно высокий уровень экспрессии гена Igf2 сохраняется у взрослых особей, хотя и на значительно меньшем уровне, чем в эмбриональный и ранний неонатальный периоды (Ye et al., 2015).
Следует отметить, что низкий вес при рождении служит фактором риска развития в последующей жизни многих заболеваний, таких как метаболический синдром (Gluckman, Hanson, 2004), сердечно-сосудистые заболевания (Alexander et al., 2015) и депрессия (Loret de Mola et al., 2014). Имеются доказательства того, что низкий вес новорожденных может быть обусловлен различными факторами, воздействующими на мать во время беременности (Braithwaite et al., 2018; Sprya et al., 2020). Не только состояние матери во время беременности, но и состояние отца может обусловливать определенную задержку развития. Так, нами показано, что воздействие на самцов крыс сильного травматического стресса в парадигме “стресс-рестресс”, являющегося моделью посттравматического стрессового расстройства (ПТСР), задолго (больше месяца) до оплодотворения ими здоровых самок приводит к снижению веса у их потомков мужского и женского пола в неонатальный период развития (Ордян и др., 2020). Кроме того, в наших исследованиях было установлено, что стрессирование самцов крыс в парадигме “стресс-рестресс” перед спариванием значительно ухудшает консолидацию памяти у их потомков-самцов в тесте оборонительной реакции пассивного избегания, усиливает уровень тревожности и депрессивность поведения, что сопровождается снижением экспрессии гена Igf2 в гиппокампе и неокортексе (Ордян и др., 2020а). Поскольку у самок – потомков стрессированных отцов – мы также обнаружили изменения в поведении (Ордян и др., 2020б), можно полагать, что способность к обучению и память у этих животных также будут нарушены. Кроме того, остается неизвестным, характерно ли снижение экспрессии гена Igf2 в мозге в результате отцовского стресса только для взрослых потомков, или изменение экспрессии гена Igf2 наблюдается и у новорожденных крысят.
В связи с этим в настоящем исследовании было изучено влияние стрессорного воздействия на самца-отца в отношении памяти его потомков обоего пола. Кроме того, в целом мозге новорожденных потомков и в гиппокампе и неокортексе половозрелых потомков изучена экспрессия гена Igf2.
МЕТОДИКА
Работа выполнена на крысах линии Вистар из ЦКП “Биоколлекция” Института физиологии им. И.П. Павлова РАН. Животных содержали в стандартных условиях вивария без ограничения доступа к воде и пище и со сменой темной и светлой фаз суток 12/12 ч. Все манипуляции с животными были проведены с соблюдением требований, изложенных в директиве Европейского сообщества 2010 г. (2010/63/EEC), и согласно правилам, изложенным в “Guide for the Care and Use of Laboratory Animals”. Протоколы опытов утверждены Комиссией по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН.
Формирование состояния, подобного ПТСР, у самцов проводили с использованием парадигмы “стресс-рестресс” по методике, описанной ранее (Ордян и др., 2013). Самцов (n = 10) в возрасте 3 мес и весом 250–260 г подвергали комбинированному стрессорному воздействию, которое состояло из трех последовательно сменяющихся стрессоров, а именно: двухчасовая иммобилизация в узких пластиковых пеналах, двадцатиминутное плавание в стеклянных цилиндрах диаметром 40 см и глубиной 60 см, заполненных водой с температурой 24 ± 2°С, а после небольшой паузы – эфирный стресс в течение 1 мин. На 7-е сутки после комбинированного стресса производили тридцатиминутную иммобилизацию – так называемый “рестресс”, который служит триггером для развития стойкого ПТСР-подобного состояния (Liberzon et al., 1997). Контрольных животных (n = 10) оставляли интактными.
Ранее нами было показано, что в парадигме “стресс-рестресс” у самцов уже на 10-й день после рестресса выявляются нарушения функции сперматогенного эпителия, преимущественно в отношении ранних стадий сперматогенеза (Пивина и др., 2019). Для того чтобы у стрессированных животных прошел полный цикл сперматогенеза с учетом его длительности у крыс (48 дней), спаривание контрольных и подопытных самцов с интактными самками осуществляли через 46–48 сут после комбинированного стресса. С этой целью самцов подсаживали поодиночке к двум регулярно циклирующим самкам, находящимся в стадии проэструс-эструс. На следующий день у самок отбирали мазки из влагалища с целью обнаружения сперматозоидов. Беременных самок сразу отсаживали от самцов в клетки по 4–5 особей, а с 17-го дня беременности – в индивидуальные клетки.
Полученные пометы на 2-й день жизни выравнивали до 8–10 крысят с равным соотношением полов. От контрольных самцов было получено 20 пометов (каждый самец покрыл 2 самки), а от подопытных самцов – 18 (2 самца покрыли по одной самке). Из каждого помета на 2-й день жизни по 1 самцу и 1 самке умерщвляли, из черепной коробки извлекали целый мозг, который в дальнейшем использовали для анализа экспрессии гена Igf2. Немедленно после получения образцы помещали в пробирки с реагентом IntactRNA (“Евроген”, Россия) и хранили до выделения РНК при –80°С.
Пометы содержали с матерями до 30-дневного возраста, а далее по 6–7 особей в клетке. В эксперимент брали самцов в возрасте 2.5 мес и весом 230–250 г, а также самок того же возраста и весом 200–220 г, формируя группы таким образом, чтобы в каждой группе присутствовало не более 2 животных из каждого помета с целью исключения влияния поведения матери на крысят. Перед началом тестирования крыс подвергали ежедневному взятию в руки в течение 10 дней. У самок такую процедуру совмещали с исследованием вагинальных мазков, по характеру которых определяли стадию эстрального цикла. В экспериментах использовали только регулярно циклирующих самок, тестирование которых проводили в стадии диэструс в каждом из поведенческих тестов. Каждая экспериментальная группа состояла из 10 самцов и 10 самок.
Вначале проводили изучение памяти в тесте “Распознавание нового объекта”. Этот тест основан на естественном для грызунов исследовании нового объекта (предпочтении новизны) (Cohen et al., 2015). Тест выполняли в установке “Открытое поле”, которая представляла собой четырехугольную камеру размером 90 × 90 × 50 см. В центре “поля” на высоте 50 см помещали источник света (150 лк). Использовали три объекта округлой формы, выполненных из пластика. Животных предварительно помещали в установку на 5 мин, что способствовало привыканию к ней и снижению стрессорного воздействия новизны обстановки. В первую фазу “ознакомления”, которую проводили через 24 ч после первого помещения животного в установку, крысам позволяли исследовать два незнакомых объекта в течение 5 мин. Фиксировали время исследования каждого объекта (с). Затем крысу помещали в домашнюю клетку. Во второй, “тестовой” фазе, которую проводили через 24 ч после первой фазы, тот объект, который крыса исследовала меньше, меняли на новый объект, сохраняя позиционное положение объектов. После чего в течение 5 мин регистрировали время исследования знакомого и нового объектов. Перед началом теста для каждой последующей крысы установку и объекты протирали перекисью водорода. Для оценки памяти крыс использовали коэффициент распознавания (Кр), отражающий разницу между временем исследования нового и знакомого объектов по отношению к суммарному времени их исследования. Чем меньше Кр, тем хуже память распознавания животного (Cohen et al., 2013).
Оборонительную реакцию пассивного избегания (РПИ) вырабатывали в экспериментальной установке, состоящей из двух отсеков: светлого отсека размером 50 × 50 см и темного отсека размером 15 × 15 см. Отсеки были разделены автоматически открывающейся дверцей. Пол темного отсека содержал металлические прутья, подключенные к источнику электрического тока. Предварительно животное помещали на 3 мин в светлый отсек камеры с открытой дверцей в темный отсек и регистрировали время перехода крысы в темный отсек. На следующий день проводили обучение (первая сессия): крысу помещали в светлый отсек, через 10 с дверцу в темный отсек открывали. После перехода крысы в темный отсек дверцу закрывали, а животное подвергали электрокожному раздражению током 0.9 мА и длительностью 2 с. Затем животное возвращали в домашнюю клетку. Через 24 ч после первого тестирования крысу вновь помещали в светлый отсек (вторая сессия). Фиксировали латентный период входа животного в темный отсек. Максимальная длительность тестирования составляла 300 с. Результаты теста представлены в процентах, где общее время тестирования принимали за 100%. Поведение животных фиксировали с помощью видеокамеры (СANON, Япония), расположенной над соответствующей установкой, с последующим просмотром видео и анализом параметров поведения на ПК.
Для изучения влияния ПТСР-подобного состояния отцов на экспрессию гена Igf2 в гиппокампе и неокортексе их половозрелых потомков использовали отдельную группу потомков самцов и самок, рожденных от контрольных или подопытных отцов-самцов. В каждой группе число животных составило по 7 самцов и самок. Количественный анализ экспрессии гена Igf2 оценивали с применением метода ПЦР в реальном времени с обратной транскрипцией.
Крыс декапитировали, из черепной коробки извлекали мозг, из которого на льду выделяли гиппокамп и часть неокортекса, содержащую фронтальную и медиальную префронтальную области. Полученные области мозга помещали в пробирки с реагентом IntactRNA (“Евроген”, Россия) и хранили до выделения РНК при –80°С. Кровь, собранную при декапитации, центрифугировали (1000 × g, 20 мин, +4°С) и далее плазму хранили при температуре –20°С до момента определения содержания в ней тестостерона или эстрадиола. Самок декапитировали в стадии диэструс.
Для выделения тотальной РНК использовали набор Pure Link RNA Mini Kit (ThermoFisher Scientific, США) согласно протоколу фирмы производителя.
Обратную транскрипцию проводили с помощью набора High Capacity Reverse Transcription Kit (Thermo Fisher Scientific, США). Каждую реакцию проводили в объеме 20 мкл, в присутствии 10 ммоль dNTP, 200 Е/мл обратной транскриптазы MMLV, рассеянной затравки (3 мг/мл) и с добавлением от 100 до 500 нг тотальной РНК. Полученную кДНК использовали для проведения ПЦР в реальном времени.
ПЦР в реальном времени проводили на приборе Real-Time PCR System 7500 (Applied Biosystems, США) с использованием расходных материалов производства ThermoFisher Scientific, США. Для исследования экспрессии гена Igf2 использовали набор зондов и праймеров (Rn01454518_m1, TaqMan® Gene Expression Assays, ThermoFisher Scientific, США). В качестве внутреннего контроля использовали ген Hprt1 (Rn01527840_m1, TaqMan® Gene Expression Assays, ThermoFisher Scientific, США). Относительный уровень экспрессии мРНК рассчитывали методом 2–ΔΔСt . Измерения проводили не менее чем в трех параллельных пробах для каждого образца.
Содержание тестостерона в плазме самцов и эстрадиола в плазме самок анализировали методом ИФА, используя стандартные наборы производства “ХЕМА”, Россия, и анализатор Multickan FS (Thermo Fisher Scientific, Финляндия).
Статистический анализ проводили с использованием параметрических критериев ANOVA и t-критерия Стьюдента и программы “STATISTICA 8.0”. Для проверки гипотезы нормальности распределения данных в выборках использовали критерий Шапиро–Уилка. Для оценки межгрупповых различий (фактор ГРУППА или ПОЛ) в тестах РПИ и “Распознавание нового объекта” использовали однофакторный анализ ANOVA. Результаты показателей экспрессии гена Igf2 и уровень половых стероидов в плазме крови оценивали с использованием непарного t-критерия Стьюдента. Статистически значимыми считали различия при p < 0.05. Данные представлены в виде M ± m.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Выполненные исследования показали, что в тесте “Распознавание нового объекта” межполовые различия отсутствуют по всем анализируемым параметрам. В контрольной группе животных у самцов обнаружены статистически значимые различия во времени исследования “нового” и “знакомого” объекта в “тестовой” фазе (F1.19 = 10.3, p = 0.005, рис. 1). Сходные различия были выявлены и у самок – потомков контрольных самцов-отцов (F1.19 = 4.8, p = 0.03, рис. 2).
Рис. 1.
Влияние стресса отца на память распознавания у потомков-самцов в тесте “Распознавание нового объекта”. (а) – суммарное время исследования объектов в ознакомительной фазе теста. (б) – коэффициент распознавания (Кр). (в) – исследование объектов в “тестовой” фазе. По оси ординат – время в с. По оси абсцисс (в): 1 – время исследования нового объекта; 2 – время исследования знакомого объекта. Светлые столбики – потомки контрольных самцов. Темные столбики – потомки стрессированных отцов. * – статистически значимые различия между потомками контрольных и стрессированных отцов (p < 0.05), ** – p < 0.01. ^ – статистически значимые различия во времени исследования нового и знакомого объекта (p < 0.01).
Fig. 1. The influence of paternal stress on recognition memory in the male offspring in novel object recognition task. (a) – total time of the objects examination in the “introductory” phase of the task. (б) – the recognition rate. (в) – the objects examination in the “test” phase of the task. On vertical axis – time in s. On horizontal axis (в): 1 – exploration time of a new object examination; 2 – exploration time of a familiar object. Light bars – the offspring of control fathers. Dark bars – the offspring of stressed fathers. * – the significant differences between the offspring of control and stressed fathers (p < 0.05), ** – p <0.01. ^ – the significant differences between exploration time of a novel and a familiar objects (p < 0.01).
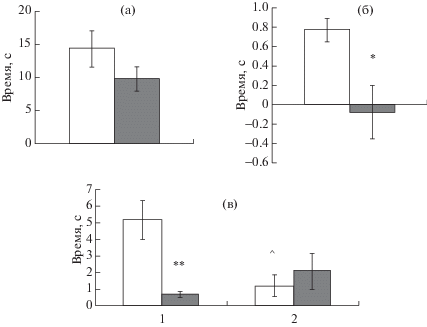
Рис. 2.
Влияние стресса отца на память распознавания у потомков-самок в тесте “Распознавание нового объекта”. (а) – суммарное время исследования объектов в ознакомительной фазе теста. (б) – коэффициент распознавания (Кр). (в) – исследование объектов в “тестовой” фазе. По оси ординат – время в с. По оси абсцисс (в): 1 – время исследования нового объекта; 2 – время исследования знакомого объекта. Светлые столбики – потомки контрольных самцов. Темные столбики – потомки стрессированных отцов. * – статистически значимые различия между потомками контрольных и стрессированных отцов (p < 0.05), ** – p < 0.01. ^ – статистически значимые различия во времени исследования нового и знакомого объекта (p < 0.01).
Fig. 2. The influence of paternal stress on recognition memory in the female offspring in novel object recognition task. (a) – total time of the objects examination in the “introductory” phase of the task. (б) – the recognition rate. (в) – the objects examination in the “test” phase of the task. On vertical axis – time in s. On horizontal axis (в): 1– exploration time of a new object examination; 2 – exploration time of a familiar object. Light bars – the offspring of control fathers. Dark bars – the offspring of stressed fathers. * – the significant differences between the offspring of control and stressed fathers (p < 0.05), ** – p < 0.01. ^ – the significant differences between exploration time of a novel and a familiar objects (p < 0.01).
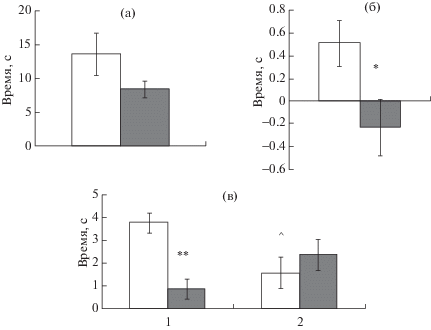
У самцов – потомков самцов-отцов с ПТСР-подобным состоянием – и потомков контрольных самцов-отцов различий в суммарном времени исследования объектов в “ознакомительной” фазе теста не обнаружено (рис. 1 (а)), так же как и у самок, рожденных от стрессированных или контрольных самцов-отцов (рис. 2 (а)). Различий во времени исследования “нового” и “знакомого” объекта в “тестовой” фазе не выявлено ни у самцов – потомков стрессированных самцов-отцов (F1.19 = 1.12, p = 0.31), ни у самок, которые родились от стрессированных самцов-отцов (F1.19 = 3.25, p = 0.09). При этом Кр статистически значимо различался между потомками контрольных и стрессированных самцов-отцов (потомки-самцы F1.19 = 7.5, p = = 0.014; потомки-самки F1.19 = 5.3, p = 0.035).
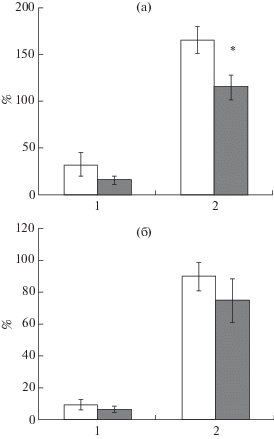
Результаты экспериментов, где исследовали выработку РПИ у потомков подопытных и контрольных самцов-отцов, представлены на рис. 3. Однофакторный дисперсионный анализ ANOVA не выявил межполовых различий в выработке РПИ у животных – потомков контрольных или стрессированных самцов. Статистический анализ показателей экспериментальных групп выявил, что латентный период захода в темный отсек камеры во время второй сессии обучения был снижен у самцов – потомков стрессированных отцов – по сравнению с контрольными крысами (F(1.19) = 5.8, p = 0.02). У самок однофакторный анализ ANOVA не выявил статистически значимого влияния фактора ГРУППА на латентный период захода в темный отсек камеры во второй день тестирования (F(1.19) = 1.9, p = 0.2).
Рис. 3.
Выработка рефлекса пассивного избегания самцов (а) и самок (б) крыс – потомков отцов, подвергнутых стрессированию в парадигме “стресс-рестресс”. По оси ординат – латентный период захода в темный отсек камеры в % от общего времени тестирования (300 с). По оси абсцисс – день тестирования. Светлые столбики – потомки контрольных самцов. Темные столбики – потомки стрессированных отцов. * – статистически значимые различия между потомками контрольных и стрессированных отцов (p < 0.05).
Fig. 3. Acquisition of passive avoidance in the male (a) and female (б) offspring of fathers exposed to stress in the “stress-restress” paradigm. On vertical axis – latency to enter the dark compartment of the chamber, % of total test duration (300 s). On horizontal axis – day of testing. Light bars – the offspring of control fathers. Dark bars – the offspring of stressed fathers. * – the significant differences between the offspring of control and stressed fathers (p < 0.05).
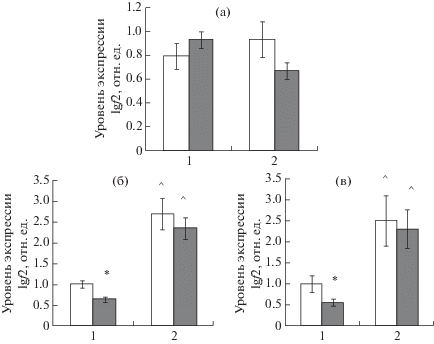
Анализ экспрессии гена Igf2 у новорожденных крысят не выявил статистически значимых различий ни между самцами и самками, родившимися от контрольных самцов, ни между животными – потомками контрольных или стрессированных самцов-отцов (рис. 4 (а)). Тем не менее у половозрелых крыс обнаружены статистически значимые различия между самцами и самками, где экспрессия гена Igf2 была существенно более высокой у самок как в неокортексе (рис. 4 (б)), так и в гиппокампе (рис. 4 (в)). Кроме того, экспрессия гена Igf2 у самцов – потомков стрессированных отцов – была достоверно снижена в неокортексе (фронтальная и медиальная префронтальная кора) и гиппокампе по сравнению с потомками контрольных отцов, тогда как у самок статистически значимых различий в экспрессии исследованного гена не выявлено ни в одной из исследованных структур мозга.
Рис. 4.
Влияние стресса отца на уровень экспрессии гена Igf2 в мозге потомков. (а) – новорожденные крысята (2-й день жизни). (б) – уровень экспрессии Igf2 в неокортексе взрослых крыс; (в) – в гиппокампе. По оси абсцисс: 1 – самцы крыс, 2 – самки крыс. Светлые столбики – потомки контрольных самцов. Темные столбики – потомки стрессированных отцов. * – статистически значимые различия между потомками контрольных и стрессированных отцов (p < 0.05). ^ – статистически значимые различия между самцами и самками крыс (p < 0.01).
Fig. 4. The influence of paternal stress on the Igf2 gene expression in the offspring brain. (a) – newborn rats (2nd day of life). (б) – Igf2 expression in the neocortex of adult rats. (в) – in the hippocampus. On horizontal axis: 1 – male rats; 2 – female rats. Light bars – the offspring of control fathers. Dark bars – the offspring of stressed fathers. * – the significant differences between the offspring of control and stressed fathers (p < 0.05). ^ – the significant differences between male and female rats (p < 0.01).
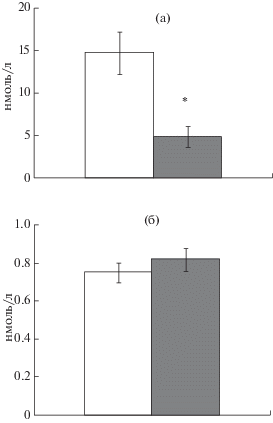
Анализ содержания тестостерона в плазме крови потомков-самцов показал статистически значимое снижение уровня гормона у самцов – потомков стрессированных отцов (рис. 5 (а)). Статистически значимых различий в уровне эстрадиола между самками – потомками контрольных или стрессированных отцов – не выявлено (рис. 5 (б)).
Рис. 5.
Содержание половых стероидных гормонов в плазме крови потомков контрольных и стрессированных отцов. (а) – уровень тестостерона в крови самцов. (б) – уровень эстрадиола в крови самок. Светлые столбики – потомки контрольных самцов. Темные столбики – потомки стрессированных отцов. * – статистически значимые различия между потомками контрольных и стрессированных отцов (p < 0.01).
Fig. 5. Plasma level of sex steroid hormones in the offspring of control and stressed fathers. (a) – testosterone level in male rats. (б) – estradiol level in female rats. Light bars – the offspring of control fathers. Dark bars – the offspring of stressed fathers. * – the significant differences between the offspring of control and stressed fathers (p < 0.01).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наши исследования показали, что стрессирование самцов-отцов в период сперматогенеза оказывает существенное влияние на память потомков. Значительные изменения в процессах памяти были обнаружены у потомков обоего пола в тесте “Распознавание нового объекта”. Самцы и самки, родившиеся от стрессированных отцов, демонстрируют ухудшение памяти об объектах, что проявлялось в снижении Кр, отражающего различение нового и знакомого объекта. Такое изменение памяти подопытных крыс, вероятнее всего, не связано с изменением их исследовательской активности, так как в “ознакомительной” фазе тестирования они исследовали объекты такое же время, как и потомки контрольных самцов. Кроме того, в предыдущих исследованиях мы обнаружили влияние стресса отца только на локомоторную активность потомков-самцов в тесте “Открытое поле”, но не на исследовательскую, оцениваемую по числу вертикальных стоек. При этом у потомков-самок эти показатели ориентировочно-исследовательской активности не менялись (Ордян и др., 2020). Нельзя исключить, что снижение Кр, свидетельствующее о нарушении памяти об объекте у самцов – потомков стрессированных самцов-отцов, связано с нарушением внимания у этих животных, учитывая данные, полученные М.В. Алфимовой и соавт. в исследованиях на людях, о роли ИФР2 именно в продуктивности избирательного внимания при зрительном поиске (Алфимова и др., 2012).
Межполовые различия в эффектах стресса отца нами обнаружены при исследовании выработки РПИ, где наиболее существенные изменения были выявлены у потомков-самцов. У этих животных обнаружен дефицит памяти, что проявилось в сниженном латентном периоде захода в темный отсек камеры на следующий день после обучения. При этом самки – потомки стрессированных отцов – не отличались от контрольных самок показателем консолидации следов памяти в этом тесте.
Следует отметить, что снижение экспрессии гена Igf2 в неокортексе и гиппокампе было выявлено только у самцов, родившихся от стрессированных самцов-отцов, по сравнению с потомками контрольных крыс, тогда как у самок изменений по этому показателю не обнаружено. Различия в экспрессии гена Igf2 в мозге самцов – потомков подопытных или контрольных отцов – наблюдали только у взрослых животных, тогда как у новорожденных крыс такие различия выявлены не были.
Исследователями предпринимались попытки выявить влияние стресса отца до зачатия на способность к обучению их потомков. Однако данные, полученные в этих исследованиях, противоречивы. Yeshurun и соавт. показали, что длительное введение с питьем самцам мышей кортикостерона с целью моделирования хронического стресса нарушает процесс реконсолидации памяти только у потомков-самок при тестировании пространственной памяти в водном лабиринте Морриса (Yeshurun et al., 2017). Другие авторы, используя хроническое умеренное стрессирование самцов крыс в течение 27 дней (ежедневная иммобилизация в условиях повышенной освещенности в течение 30 мин дважды в день), не выявили изменений в обучении в аналогичном тесте у их потомков, самцов и самок (Harker et al., 2018). Кроме того, рядом авторов показано, что изменения в поведенческом фенотипе в результате стрессирования отцов до зачатия более выражены у самцов, чем у самок (Short et al., 2016), или вовсе не проявляются (Rodgers et al., 2013).
В литературе имеются указания на значимость неблагоприятных воздействий на организм матери или отца в отношении экспрессии гена Igf2 в гиппокампе потомков. Так, в исследованиях, где изучали последствия ограничения калорийности питания у самок крыс во время беременности (8–21-й день), показано повышение экспрессии этого гена в гиппокампе потомков-самок первого и второго поколения, но не потомков-самцов (Harper et al., 2014). Также было проведено исследование, где изучены последствия стрессирования мышей-отцов, которое моделировали хроническим введением кортикостерона, на экспрессию гена Igf2 в гиппокампе потомков обоего пола (Short et al., 2016). Эти авторы показали, что в возрасте 8 нед у потомков-самок наблюдается снижение экспрессии этого гена, а у потомков-самцов – напротив, повышение. Интересно, что в этом исследовании существенных изменений в поведении и выработке условно-рефлекторной реакции страха у самок этого возраста не обнаружено, тогда как у самцов выявлено повышение уровня тревожности и депрессивности поведения.
Вероятно, подобные различия определяются тем, что в указанных работах авторы использовали разные парадигмы стрессорных воздействий. Кроме того, в этих исследованиях самцов-отцов подвергали воздействиям, создающим хронически повышенный уровень глюкокортикоидных гормонов в крови, тогда как использованная нами парадигма “стресс-рестресс”, являющаяся экспериментальной моделью ПТСР, подразумевает применение к крысам комбинированного стресса, который включает несколько последовательно применяющихся стрессорных процедур разной модальности и общей длительности воздействия более 2 ч, а также повторного стрессорного воздействия через 7 сут, что приводит к длительному снижению уровня кортикостерона в крови (Ордян и др., 2013; Пивина и др., 2014). Однако что в данном случае является критическим для нарушения памяти потомков – характер стрессорного воздействия или сниженный уровень кортикостерона в крови отцов – еще предстоит выяснить.
Интересны обнаруженные нами межполовые различия в экспрессии гена Igf2 в гиппокампе и неокортексе половозрелых, но не новорожденных крыс. В исследованиях Takeo и соавт. показано, что экспрессия гена Igf2 в некоторых тканях, в том числе в нейронах гиппокампа, увеличивается под воздействием эстрадиола (Takeo et al., 2009). Именно уровнем эстрадиола, который у половозрелых самок существенно выше, чем у самцов, можно объяснить выявленные нами межполовые различия в экспрессии данного гена в мозге половозрелых животных. Кроме того, показано, что у овариэктомированных крыс улучшение памяти, вызванное введением эстрадиола, сопровождается увеличением количества ИФР2 в гиппокампе (Sárvár et al., 2015). Эти данные дают дополнительную информацию о вовлеченности ИФР2 гиппокампа в процессы, связанные с памятью. Вероятно, отсутствие существенных изменений в формировании памяти у самок – потомков стрессированных отцов – определяется в том числе сходным с контрольными самками уровнем эстрадиола крови. Может ли у подопытных самцов снижение экспрессии гена Igf2 в мозге быть связано со снижением у них уровня тестостерона – неизвестно, и хотя многие эффекты тестостерона в мозге самцов реализуются через его ароматизацию и синтез эстрадиола (Cooke et al., 2017; Frick et al., 2018), данные о влиянии уровня тестостерона на ген Igf2 в литературе отсутствуют.
Тем не менее остается неясным вопрос о механизмах нарушения памяти в тесте “Распознавание нового объекта” у самок, родившихся от стрессированных самцов. Следует отметить, что формирование памяти в данном тесте регулируется не только гиппокампом, но и периринальной корой. При этом гиппокамп ответственен за формирование “сильной” памяти в тесте “Распознавание нового объекта”, а периринальная кора – “слабой” (Cinalli et al., 2020). Использованная нами модификация теста “Распознавание нового объекта” подразумевает формирование “слабой” памяти, которая возникает при суммарном исследовании объектов в “ознакомительной” фазе теста около 10 с. При этом “сильная” память развивается при суммарном исследовании двух объектов в “ознакомительной” фазе не менее 38 с, что требует предъявления животным исследуемых объектов в течение не менее трех последовательных дней (Cohen et al., 2015).
Роль ИФР2 в формировании памяти об объектах в обоих вариантах неизвестна. Хотя недавно было показано, что эффекты ИФР2 на гиппокамп-зависимую память опосредуются через взаимодействие этого ростового фактора с ИФР2-рецептором, известным как катион-независимый рецептор маннозо-6-фосфата (М6Ф), который специфически связывает ИФР2, но не взаимодействует с ИФР1 и инсулином (Yu et al., 2020). Вовлеченность данного рецептора в гиппокамп-зависимую память эти авторы исследовали не только в отношении выработки РПИ, но и в отношении памяти в тесте “Распознавание нового объекта”. Выявлено, что мыши с дефицитом гиппокампального М6Ф/ИФР2-рецептора в результате нокдауна хуже различают новый и знакомый объект. Кроме того, эти авторы показали, что связывание данного рецептора с ИФР2 имеет критическое значение для консолидации памяти, но не влияет на сам процесс обучения и реконсолидацию памяти.
Следует отметить, что М6Ф/ИФР2-рецептор не связан ни с какими вторичными посредниками. Долгое время считалось, что основная функция этого рецептора заключается в транспорте связавшихся с ним молекул в лизосомы и их деградацию (Brown et al., 2009). Тем не менее Yu и соавт. (Yu et al., 2020) установили, что этот рецептор вовлечен в контроль увеличения синтеза de novo в гиппокампе ряда белков, являющихся продуктами ранних генов, таких как Arc, Fos и Egr1, быстрая индукция которых на уровне трансляции и транскрипции наблюдается при обучении. Показано, что такая индукция ранних генов необходима для формирования памяти (Gallo et al., 2018). Для выяснения вовлеченности М6Ф/ИФР2-рецептора в выявленные нами изменения памяти у потомков стрессированных самцов нужны дальнейшие исследования.
Обсуждая возможные механизмы действия стресса отца на различные функции потомков, отметим, что в настоящее время в качестве основного механизма рассматривается эпигенетическая модификация генома в сперматозоидах, связанная с метилированием ДНК, модификацией гистонов и экспрессией микроРНК (Day et al., 2016; Morgan et al., 2019). Такая эпигенетическая модификация генома может осуществляться только в зреющих сперматозоидах на стадиях от сперматогониев до сперматид (Bale, 2014). Поскольку в наших исследованиях спаривание стрессированных самцов с самками осуществляли после полного цикла созревания сперматозоидов, любой из этих механизмов может быть вовлечен в эффекты стресса отцов на потомков.
Кроме того, экспрессия импринтированных генов, к которым относится и ген Igf2, строго зависит от метилирования особой регуляторной последовательности на хромосоме, представляющей из себя центр импринтинга (ЦИ). Метилирование ЦИ происходит в период гаметогенеза, его паттерн различен на хромосомах материнского и отцовского происхождения, что определяет специфичность экспрессии генов, находящихся в импринтированном локусе. Ген Igf2 по-разному метилирован на аллеле отцовского и материнского происхождения, в результате чего его экспрессия осуществляется преимущественно на отцовском аллеле (Nordin et al., 2014). Однако такая моноаллельная экспрессия Igf2 характерна только для соматических тканей, тогда как в ЦНС наблюдается биаллельная экспрессия данного гена (Ye et al., 2015). Вопрос о том, за счет отцовского или материнского аллеля снижается экспрессия Igf2 у самцов, родившихся от стрессированных отцов, и наблюдается ли при этом нарушение импринтинга данного гена, требует дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Проведенные нами исследования показали, что стрессирование самцов крыс в период сперматогенеза в парадигме “стресс-рестресс” вызывает у их половозрелых потомков обоего пола нарушение памяти в тесте “Распознавание нового объекта”. Только у самцов, родившихся от стрессированных отцов, наблюдали дефицит памяти в тесте “Реакция пассивного избегания”. Снижение экспрессии гена Igf2 в неокортексе и гиппокампе было выявлено только у самцов, родившихся от стрессированных отцов, тогда как у самок влияние стресса самцов-отцов на экспрессию данного гена не обнаружено. Различия в экспрессии гена Igf2 в мозге самцов – потомков подопытных или контрольных отцов – наблюдали только у взрослых животных, тогда как у новорожденных крыс такие различия выявлены не были. Полученные данные впервые демонстрируют влияние ПТСР-подобного состояния самцов-отцов в период сперматогенеза на память их потомков, а также дают дополнительные сведения о роли снижения экспрессии ИФР2 мозга в дефиците памяти.
Исследования выполнены при финансовой поддержке гранта Российского фонда фундаментальных исследований, проект № 18-015-00186.
Список литературы
Алфимова М.В., Лежейко Т.В., Гриценко И.К., Голимбет В.Е. Ассоциация гена инсулиноподобного фактора роста II (Igf2) с когнитивными способностями человека. Генетика. 2012. 48 (8): 993–998.
Ордян Н.Э., Малышева О.В., Акулова В.К., Пивина С.Г., Холова Г.И. Способность к обучению и экспрессия гена инсулиноподобного фактора роста II в мозге самцов крыс – потомков отцов, подвергнутых стрессированию в парадигме “стресс-рестресс”. Нейрохимия. 2020а. 37 (2): 153–160.
Ордян Н.Э., Пивина С.Г., Акулова В.К., Холова Г.И. Изменение характера поведения и активности гипофизарно-адренокортикальной системы крыс – потомков отцов, подвергнутых стрессированию в парадигме “стресс–рестресс” перед спариванием. Росс. физиол. журн. им. И.М. Сеченова. 2020б. 106 (9):1085–1097.
Ордян Н.Э., Смоленский И.В., Пивина С.Г., Акулова В.К. Особенности формирования тревожно-депрессивного состояния в экспериментальной модели посттравматического стрессового расстройства у пренатально стрессированных самцов крыс. Журнал высшей нервной деятельности им. И.П. Павлова. 2013. 63 (2):1–10.
Пивина С.Г., Акулова В.К., Ракцикая В.В., Ордян Н.Э. Развитие поведенческих и гормональных нарушений в экспериментальной модели посттравматического стрессового расстройства у пренатально стрессированных самок крыс. Бюлл. Эксперим. Биол. Мед. 2014.157 (3): 289–293.
Пивина С.Г., Холова Г.И., Ракицкая В.В., Акулова В.К., Ордян Н.Э. Изменение репродуктивных функций самцов крыс при моделировании посттравматического стрессового расстройства. Журнал эвол. биохим. физиол. 2019. 55 (5): 374–376.
Alexander B.T., Dasinger J.H., Intapad S. Fetal programming and cardiovascular pathology. Compr. Physiology. 5. (2): 997–1025. 2015.
Bale T.L. Lifetime stress experience: transgenerational epigenetics and germ cell programming. Dialogues Clin. Neurosci. 2014.16: 297–305.
Bergman D., Halje M., Nordin M., Engström W. Insulin-like growth factor 2 in development and disease: a mini-review. Gerontology. 2013. 59: 240–249.
Braithwaite E.C., Jonathan Hill J., Pickles A., Glover V., Kieran O’Donnell K., Sharp H. Associations between maternal prenatal cortisol and fetal growth are specific to infant sex: findings from the Wirral child health and development study. J. Dev. Orig. Health Dis. 2018. 9 (4): 425–431.
Brown J., Jones E.Y., Forbes B.E. Interactions of IGF-II with the IGF2R/cation-independent mannose-6-phosphate receptor mechanism and biological outcomes. Vitam. Horm. 2009. 80: 699–719.
Chen D.Y., Stern S.A., Garcia-Osta A., Saunier-Rebori B., Pollonini G., Bambah-Mukku D., Blitzer R.D., Alberini C.M. A critical role for IGF-II in memory consolidation and enhancement. Nature. 2011. 469: 491–497.
Cinalli D.A., Cohen S.J., Guthrie K., Stackman R.W. Object recognition memory: distinct yet complementary roles of the mouse CA1 and perirhinal cortex. Front. Mol. Neurosci. 2020. 13: 527543.
Cohen S.J., Munchow A.H., Rios L.M., Zhang G., Ásgeirsdóttir, H.N., Robert Stackman R. W. The rodent hippocampus is essential for non-spatial object memory Curr. Biol. 2013. 23 (17): 1685–1690.
Cohen S.J., Stackman R. W. Assessing rodent hippocampal involvement in the novel object behavior. Brain Res. 2015. 285: 105–117.
Cooke P.S., Nanjappa M.K., Ko C., Prins G.S., Hess R.A. Estrogens in male physiology. Physiol. Rew. 2017. 97 (3): 995–1043.
Frick K.M., Tuscher J.J., Koss W.A., Kim J., Taxier L.R. Estrogenic regulation of memory consolidation: A look beyond the hippocampus, ovaries, and females. 2018. Physiol. Behav.187 (1): 57–66.
Fromer M., Roussos P., Sieberts S.K., Johnson J.S., Kavanagh D.H., Perumal T.M., Ruderfer D.M., Oh E.C., Topol A., Shah H.R., Klei L.L., Kramer R., Pinto D., Gümüş Z.H., Cicek A.E., Dang K.K., Browne A., Lu C., Xie L., Readhead B., Stahl E.A., Xiao J., Parvizi M., Hamamsy T., Fullard J.F., Wang Y.C., Mahajan M.C., Derry J.M., Dudley J.T., Hemby S.E., Logsdon B.A., Talbot K., Raj T., Bennett D.A., De Jager P.L., Zhu J., Zhang B., Sullivan P.F., Chess A., Purcell S.M., Shinobu L.A., Mangravite L.M., Toyoshiba H., Gur R.E., Hahn C.G., Lewis D.A., Haroutunian V., Peters M.A., Lipska B.K., Buxbaum J.D., Schadt E.E., Hirai K., Roeder K., Brennand K.J., Katsanis N., Domenici E., Devlin B., Sklar P. Gene expression elucidates functional impact of polygenic risk for schizophrenia. Nat. Neurosci. 2016. 19 (11): 1442–1453.
Day J., Savani S., Krempley B.D., Nguyen M., Kitlinska J.B. Influence of paternal preconception exposures on their offspring: through epigenetics to phenotype. Am. J. Stem Cells. 2016. 5 (1):11–18.
Gallo F.T., Katche C., Morici J.F., Medina J.H., Weisstaub N.V. Immediate early genes, memor y and psychiatric disorders: focus on c-Fos, Egr1 and arc. Front. Behav. Neurosci. 2018. 12: 180.
Gluckman P.D., Hanson M.A. The developmental origins of the metabolic syndrome. Trends Endocrinol. Metab. 2004.15 (4): 183–187.
Harker A., Carroll C., Raza S., Kolb B., Gibb R. Preconception paternal stress in rats alters brain and behavior in offspring. Neuroscience. 2018. 388: 474–485.
Harper K.M., Tunc-Ozcan E., Graf E.N., Herzing L.B., Redei E.E. Intergenerational and parent of origin effects of maternal calorie restriction on Igf2 expression in the adult rat hippocampus. Psychoneuroendocrinol. 2014. 45: 187–91.
Lee Y., Lee Y.W., Gao Q., Lee Y., Lee H.E., Ryu J.H. Exogenous insulin-like growth factor 2 administration enhances memory consolidation and persistence in a time-dependent manner. Brain Res. 2015. 1622: 466–473.
Liberzon I., Krstov M., Young E.A. Stress-restress: effects on ACTH and fast feedback. Psychoneuroendocrinology. 1997. 22 (6): 443–453.
Loret de Mola C., de França G.V., Quevedo Lde A., Horta B.L. Low birth weight, preterm birth and small for gestational age association with adult depression: systematic review and meta-analysis. Br. J. Psychiatry. 2014. 205 (5): 340–347.
Moore G.E., Ishida M., Demetriou C., Al-Olabi L., Leon L.J., Thomas A.C., Abu-Amero S., Frost J.M., Stafford J.L., Chaoqun Y., Duncan A.J., Baigel R., Brimioulle M., Iglesias-Platas I., Apostolidou S., Aggarwal R., Whittaker J.C., Syngelaki A., Nicolaides K.H., Regan L., Monk D., Stanier P. The role and interaction of imprinted genes in human fetal growth. Philos. Trans. R. Soc. Lond. Biol. Sci. 2015. 370 (1663): 20140074.
Morgan C.P., Chan J.C., Bale T.L. Driving the next generation: paternal lifetime experiences transmitted via extracellular vesicles and their small RNA. Cargo Biologic. Psychiat. 2019. 85: 164–171.
Nordin M., Bergman D., Halje M., Engström W., Ward A. Epigenetic regulation of the Igf2/H19 gene cluster. Cell Prolif. 2014. 47 (3):189–199.
Ouchi Y., Banno Y., Shimizu Y., Ando S., Hasegawa H., Adachi K., Iwamoto T. Reduced adult hippocampal neurogenesis and working memory deficits in the Dgcr8-deficient mouse model of 22q11.2 deletion-associated schizophrenia can be rescued by IGF2. J. Neurosci. 2013. 33 (22): 9408–9419.
Rodgers A.B., Morgan C.P., Bronson S.L., Revello S., Bale T.L. Paternal stress exposure alters sperm microRNA content and reprogramming offspring HPA axis stress regulation J. Neurosci. 2013. 33 (21): 9003–9012.
Sárvár M., Kalló I., Hrabovsz, E., Solymosi N., Rodoloss A., Vastag C., Auer H., Liposits Z. Hippocampal gene expression is highly responsive to estradiol replacement in middle-aged female rats. Endocrinology. 2015. 156: 2632–2645.
Shahmoradi A., Radyushkin K., Rossne, M.J. Enhanced memory consolidation in mice lacking the circadian modulators Sharp1 and -2 caused by elevated IGF2 signaling in the cortex. Proc. Natl. Acad. Sci. U. S. A. 2015. 112: E3582–3589.
Short A.K., Fennell K.A., Perreau V.M., Fox A., O’Bryan M.K., Kim J.H., Bredy T.W., Pang T.Y., Hannan A.J. Elevated paternal glucocorticoid exposure alters the small noncoding RNA profile in sperm and modifies anxiety and depressive phenotypes in the offspring. Transl. psychiatry. 2016. 6 (6): e837–e837.
Spry E.A., Wilsonc C.A., Middleton M., Moreno-Betancur M., Doyle L.W., Howard L.M., Hannan A.J., Wlodek M.E., Cheong J.L.Y., Hines L.A., Coffey C., Brown S., Olssona C.A., Patton G.C. Parental mental health before and during pregnancy and offspring birth outcomes: A 20-year preconception cohort of maternal and paternal exposure. EClinical Medicine. 2020. 27: 100564.
Steen E., Terry B.M., Rivera E.J., CannonJ.L., Neely T.R., Tavares R., Xu X.J., Wands J.R., de la Mont S.M. Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer’s disease- is this type3 diabetes? J. Alzheimer Dis. 2005. 7 (1): 63–80.
Stern S.A., Chen D.Y., Alberini C.M. The effects of insulin and insulin-like growth factors on hippocampus- and amygdale-dependent long-term memory formation. Learn. Memory. 2014. 21: 556–563.
Takeo C., Ikeda K., Horie-Inoue K., Inoue S. Identification of IGF2, Igfbp2 and Enpp2 as estrogen-responsive genes in rat hippocampus. Endocr. J. 2009. 56 (1):113–120.
White V., Jawerbaum A., Mazzucco M.B., Gauster M., Desoye G., Hiden U. IGF2 stimulates fetal growth in a sex- and organ-dependent manner. Pediatr. Res. 2018. 83 (1): 183–189.
Ye X., Kohtz A., Pollonini G., Riccio A., Alberini C.M. Insulin like growth factor 2 expression in the rat brain both in basal condition and following learning predominantly derives from the maternal allele. PLoSOne. 2015. 10: e0141078.
Yeshurun S., Rogers J., Short A.K., Hannana A.J. Elevated paternal glucocorticoid exposure modifies memory retention in female offspring. Psychoneuroendocrin. 2017. 83 (1): 9–18.
Yu X.-W., Pandey K., Katzman A.C., Alberini C.M. A role for CIM6P/IGF2 receptor in memory consolidation and enhancement. eLife. 2020. 9: e54781.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


