Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 3, стр. 342-353
Развитие и строение нервной системы у форонид: эволюционная значимость
1 Кафедра зоологии беспозвоночных, Биологический факультет,
Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
* E-mail: etemereva@hse.ru
** E-mail: temereva@mail.ru
Поступила в редакцию 27.11.2020
После доработки 22.01.2021
Принята к публикации 02.03.2021
Аннотация
Развитие и строение нервной системы традиционно используется для филогенетического анализа и реконструкции эволюционных событий. Форониды – необычная группа первичноротых животных, чьи черты организации и развития сходны с таковыми у вторичноротых животных. В настоящей работе приводится краткое описание развития и строения нервной системы у форонид на основании опубликованных результатов. Анализ имеющихся данных позволяет предполагать, что у общего предка Bilateria нервная система включала и нервный центр, и нервный плексус. Важно отметить, что нервный центр предка Bilateria гомологичен аборальному органу радиально-симметричных бластул и гаструл современных представителей группы, тогда как апикальный орган билатерально-симметричных ресничных личинок появляется как новообразование для жизни в планктоне, связи с родительскими особями и метаморфоза. Именно поэтому апикальный орган исчезает в ходе метаморфоза у большинства первичноротых и у всех вторичноротых.
ВВЕДЕНИЕ
Форониды – это отдельный тип животного царства, в составе большого ствола Lophotrochozoa (Kocot et al., 2018). Форониды обитают в море и имеют бифазный жизненный цикл: взрослые животные живут в трубках в толще субстрата, а планктотрофные личинки – актинотрохи – продолжительное время живут в толще воды. Превращение личинки во взрослое животное происходит в результате катастрофического метаморфоза. Взрослые форониды имеют необычный план строения, и изучение его формирования в онтогенезе имеет большое значение для реконструкции этапов ранней эволюции группы (Temereva, Tsitrin, 2014a), (Temereva, Malakhov, 2015). Из-за сходства анатомического строения и эмбриологии форонид традиционно рассматривали как группу, родственную вторичноротым животным. Однако молекулярная филогенетика показала, что форониды входят в состав ствола первичноротых животных. В строении нервной системы у личинок форонид проявляются характеристики, свойственные как первичноротым (Santagta, Zimmer, 2002), так и вторичноротым (Temereva, Wanninger, 2012), а взрослые форониды обладают исключительно нервным плексусом и лишены настоящих ганглиев и нервных стволов, что является признаком чрезвычайной примитивности. Поскольку строение и развитие нервной системы традиционно используется для филогенетических построений, то анализ этих черт у такой необычной группы животных, как форониды, может внести существенный вклад в реконструкцию этапов ранней радиации Bilateria. Так, организация нервной системы лофофора у форонид, брахиопод и мшанок позволила предположить гомологию лофофора и восстановить монофилию клады Lophophorata (Temereva, Tsitrin, 2015; Temereva, Kosevich, 2016; Temereva, 2017a; Temereva, 2017b). В этой работе обобщены сведения, имеющиеся в литературе и касающиеся строения и развития нервной системы форонид от ранних стадий онтогенеза до взрослых животных.
Эмбриональное развитие нервной системы
Развитие нервной системы форонид изучено у представителей трех видов этой группы, демонстрирующих разные типы эмбрионального развития: Phoronis ijimai (Phoronis vancouverensis), развитие которого происходит в эмбриональных скоплениях вплоть до стадии молодой личинки, Phoronis embryolabi, эмбрионы которого развиваются в полости тела материнского организма и который нерестится молодыми личинками (Temereva, Chichvarkhin, 2017), и Phoronopsis harmeri, у которого все стадии развития протекают в толще воды (Hay-Schmidt, 1990a; Temereva, Wanninger, 2012; Temereva, 2012; Temereva, Mala-khov, 2012; Temereva, 2015; Temereva, 2017c). Несмотря на различия в развитии, нервная система у изученных видов развивается в целом сходным образом. Первые нейроны появляются на стадии билатерально-симметричной поздней гаструлы. Это серотонин-эргические перикарии, которые располагаются на переднем конце зародыша. На ранних стадиях детектируются от двух до четырех перикариев, которые залегают среди клеток апикальной пластинки – утолщенной части покровного эпителия. Дальнейшее развитие связано с формированием сложного апикального органа, который состоит из нескольких серотонин-эргических сенсорных клеток. Они расположены на преоральной лопасти личинки полукругом, и их отростки, направленные к центру этого полукруга, формируют нейропиль (рис. 1 (а-е)). У P. harmeri первым появляется нервный тракт, подстилающий постротовой ресничный шнур, а маргинальный нерв, иннервирующий предротовой ресничный шнур, появляется позже. Интересно, что у личинок P. embryolabi нервные тракты, подстилающие предротовой и постротовой ресничные шнуры, закладываются одновременно на стадии молодой актинотрохи.
Рис. 1.
Развитие серотонин-эргической (верхний ряд) и FMRF-амид-эргической (нижний ряд) нервной системы в эмбриональном развитии Phoronopsis harmeri. По (Temereva, Wanninger, 2012) с изменениями. (а, г) – молодая актинотроха, (б, д) – 6-дневная актинотроха, (в, е) 20-дневная актинотроха. Обозначения: АО – апикальный орган, ВЛН – вентро-латеральные нейриты, ВНС – вентральный нервный ствол, ДВ – дорсальные ветви щупальцевого нервного кольца, ЗН – задний тяж маргинального нерва, КП – кольцевые нейриты пищевода, ЛР – чувствительные реснички постротового ресничного шнура, МАН – маргинальный нерв, МН – медиальный нерв, НАО – нейропиль апикального органа, НЗК – нейриты вокруг задней кишки, ОВ – оральная ветвь маргинального нерва, П – пищевод, ПМ – передний тяж маргинального нерва, ПЛ – преоральная лопасть, ПН – первые FMRF-амид-эргические перикарии, ПСК – перикарии в средней кишке, ПО – перикарии орального поля, ТНК – щупальцевое нервной кольцо, ТН – нервное кольцо телотроха, ТТ – телотрох, Щ – щупальце.
Fig. 1. Schemes of several steps of development of 5HT-like and FMRF-amide-like immunoreactive elements of the nervous system of Phoronopsis harmeri. Based on (Temereva, Wanninger, 2012) with changes. (а, г) – young actinotrocha, (б, д) – 6-days-old actinotrocha, (в, е) 20-days-old actinotrocha. Abbreviations: АО – apical organ, ВЛН – ventro-lateral neurites, ВНС – ventral nerve cord, ДВ – dorsal branches of tentacular nerve ring, ЗН – posterior part of the marginal nerve, КП – circular neurites of esophagus, ЛР – sensory cilia of postoral ciliated band, МАН – marginal nerve, МН – median nerve, НАО – neuropil of the apical organ, НЗК – neurites around hindgut, ОВ – oral branch of the marginal nerve, П – esophagus, ПМ – anterior part of the marginal nerve, ПЛ – preoral lobe, ПН – first FMRF-amide-like immunoreactive perikarya, ПСК – perikarya in the midgut, ПО – perikarya of the oral field, ТНК – tentacle nerve ring, ТН – telotroch nerve ring, ТТ – telotroch, Щ – tentacle.
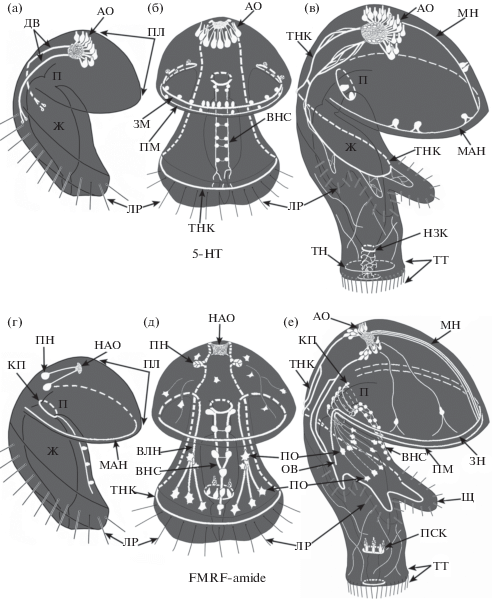
У 6-дневной личинки P. harmeri оральное поле богато иннервировано: вдоль его вентральной стороны проходит вентральный нервный ствол, ассоциированный с сериально расположенными перикариями (Temereva, 2012). По мере роста личинки у нее появляются щупальца, вдоль латеральных сторон которых проходит постротовой ресничный шнур (рис. 1 (в, е)). Постротовой нервный тракт приобретает сложную морфологию, так как формирует ответвления в щупальца. У личинки появляется часть тела под щупальцами и телотрох, с которым ассоциирован серотонин-эргический нервный тракт (рис. 1 (в, е)). У двадцатидневной личинки хорошо иннервирован пищеварительный тракт: имеются нервные кольца вокруг пищевода, средней и задней кишки (рис. 1 (в, е)).
Строение нервной системы у компетентной личинки
Нервная система личинок форонид изучена на разных стадиях личиночного развития методами гистологической техники, трансмиссионной электронной микроскопии и иммуноцитохимии (Zimmer, 1964; Hay-Schmidt, 1989; Hay-Schmidt, 1990b; Lacalli, 1991; Santagata, 2002; Santagta, Zimmer, 2002; Sonnleitner et al., 2014; Temereva, Tsitrin, 2014b; Temereva, 2015; Temereva, 2017c). Перед метаморфозом нервная система актинотрохи устроена очень сложно (рис. 2 (a)). В ходе личиночного развития усложнение нервной системы связано в основном с появлением новых нервных элементов преоральной лопасти. Считается, что перед метаморфозом именно нервные центры преоральной лопасти ответственны за выбор субстрата для оседания. Хотя общий план организации нервной системы актинотрох сходен, он довольно сильно различается в деталях, что позволяет выделить четыре основных типа организации нервной системы личинок форонид (Temereva, 2017c). Эти различия касаются строения апикального органа, иннервации щупалец, числа и расположения дополнительных нервных центров в преоральной лопасти (рис. 3 (а–г)).
Рис. 2.
Организация нервной системы у Phoronopsis harmeri на разных стадиях жизненного цикла. (а) – компетентная личинка (по Temereva, Tsitrin, 2014б с изменениями); показаны нервные элементы, выявляемые иммуноцитохимической реакцией к ацетилированному альфа-тубулину, серотонину, FMRF-амиду, а также методом трансмиссионной электронной микроскопии, (б) – ювенильное животное (по Temereva, Tsitrin, 2014а с изменениями); показаны нервные элементы, выявляемые иммуноцитохимической реакцией к ацетилированному альфа-тубулину и серотонину, а также методом трансмиссионной электронной микроскопии, (в) – головной конец тела взрослого животного (по Temereva, 2015 и Temereva, 2020 с изменениями); показаны нервные элементы, выявляемые иммуноцитохимической реакцией к ацетилированному альфа-тубулину и серотонину, (г) – схема ультраструктурной организации участка щупальцевого нервного кольца (по Темерева, Малахов, 2009 с изменениями). Обозначения (см. на рис. 1): АК – анальный кольцевой нейрит, АФ – абфронтальные нервы щупалец, В – воротничок, ВК – вспомогательная клетка, ВМ – внеклеточный матрикс, ГМП – группы межщупальцевых перикариев, ГНВ – гигантское нервное волокно, ДГ – дорсальное нервное сплетение, ДГП – дорсальные группы перикариев, ИН – вставочный нейрон, К – комиссура, КЭ – клетки эпидермиса, ЛАФ – латеро-абфронтальные нервы щупалец, ЛФ – латеро-фронтальные нервы щупалец, МК – нейриты и перикарии метасомального кармана, МНК – малое нервное кольцо, МоН – моторный нейрон, МЩН – межщупальцевые нервы, НЛТ – нейриты личиночного тела, ПК – перикарий, ПСО – передний сенсорный орган, ПФ – промежуточные филаменты, СН – чувствительный нейрон, ТНП – туловищный нервный плексус, ФН – фронтальные нервы щупалец.
Fig. 2. Organization of the nervous system at different stages of the life cycle in Phoronopsis harmeri. (а) – competent larva; based on (Temereva, Tsitrin, 2014б) with changes; elements detected by staining with acetylated alpha-tubulin, serotonin, FMRF-amide, and by transmission electron microscopy are shown, (б) – juvenile; based on (Temereva, Tsitrin, 2014а) with changes; elements detected by staining with acetylated alpha-tubulin, serotonin, and by transmission electron microscopy are shown, (в) – the head of the adult; based on (Temereva, 2015) and (Temereva, 2020) with changes; elements detected by staining with acetylated alpha-tubulin and serotonin are shown, (г) – scheme of ultrastructure of tentacle nerve ring; based on (Temereva, Malakhov, 2009) with changes. Abbreviations (see Fig. 1): АК – anal circular neurite, АФ – abfrontal tentacle nerve, В – collar fold, ВК – helper cell, ВМ – extracellular matrix, ГМП – groups of intertentacular perikarya, ГНВ – giant nerve fiber, ДГ – dorsal nerve plexus, ДГП – dorsal groups of perikarya, ИН – interneuron, К – commissure, КЭ – epidermal cells, ЛАФ – latero-abfrontal tentacle nerve, ЛФ – latero-frontal tentacle nerve, МК – neurites and perikarya of metasomal sack, МНК – minor nerve ring, МоН – motor neuron, МЩН – intertentacular nerve, НЛТ – neurites of larval body, ПК – parikaryon, ПСО – anterior sensory organ, ПФ – intermediate filaments, СН – sensory neuron, ТНП – trunk nerve plexus, ФН – frontal tentacle nerve.
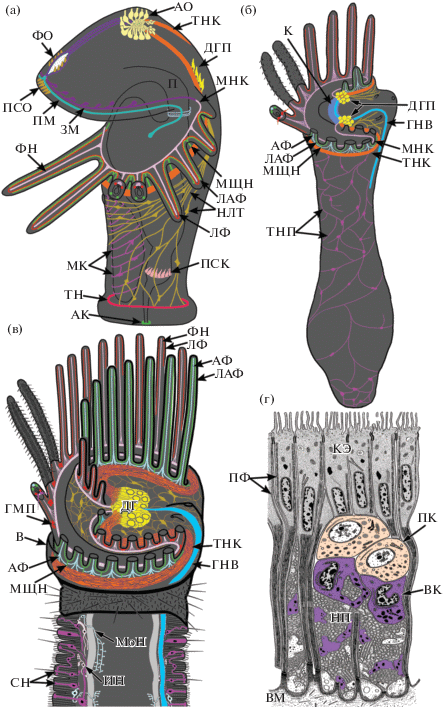
Рис. 3.
Четыре типа организации нервной системы у компетентных личинок форонид (по Temereva, 2017в с изменениями). (а) – тип-1, описанный у Actinotrocha D и Actinotrocha C (это личинки форонид, видовую принадлежность которых до сих пор не удается установить), (б) – тип-2, описанный у личинок Phoronis pallida, P. vancouverensis и P. hippocrepia, (в) – строение нервной системы у компетентных личинок Phoronopsis harmeri, (г) – строение нервной системы у компетентных личинок Phoronis embryolabi. Обозначения (см. рис. 1, 2): ДЛС – дорсо-латеральное сенсорное поле, ДЛН – дорсо-латеральные нейриты преоральной лопасти, ФО – фронтальный орган.
Fig. 3. Four types of organization of the nervous system in competent phoronid larvae. Based on (Temereva, 2017в) with changes. (а) – type-1, described in Actinotrocha D and Actinotrocha C (these are phoronid larvae, which cannot be still matched any known phoronid species), (б) – type-2, described in Phoronis pallida, P. vancouverensis, and P. hippocrepia, (в) – organization of the nervous system in competent larvae of Phoronopsis harmeri, (г) – organization of the nervous system in competent larvae of Phoronis embryolabi. Abbreviations (see Fig. 1 and Fig. 2): ДЛС – dorso-lateral sensory field, ДЛН – dorso-lateral neurites of the preoral lobe, ФО – frontal organ.
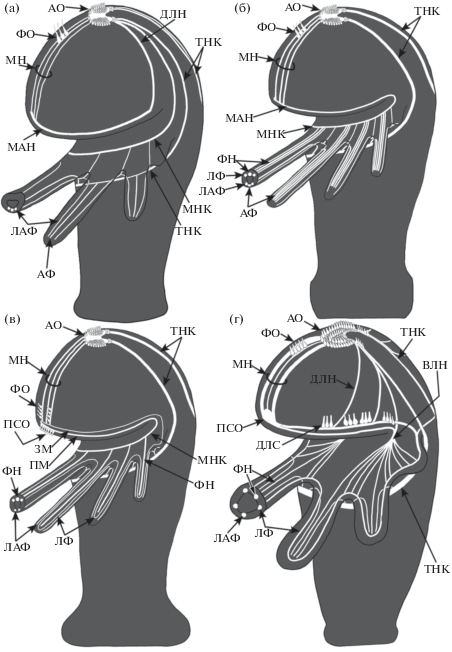
Апикальный орган становится очень крупным и у большинства изученных личинок состоит из нескольких типов перикариев: выделяют от 2 до 4 типов. Наиболее многочисленные – это сенсорные биполяры, несущие длинный жгутик; их насчитывается 30–50 (рис. 3 (а–г)). Перикарии с округлой сомой и крупным ядром занимают базальное положение и у P. harmeri формируют две латеральные группы, от которых берут начало дорсальные ветви постротового нерва (Temereva, Wanninger, 2012; Temereva, Tsitrin, 2014b). С дорсальными ветвями связаны дорсальные группы перикариев (рис. 3 (а–в)).
Вперед от апикального органа отходит медиальный нерв, строение которого сильно усложняется перед метаморфозом и связано с появлением фронтального органа (рис. 2 (а)). Фронтальный орган имеется у всех личинок форонид и в большинстве случаев располагается недалеко от апикального органа (рис. 3 (а–г)), однако может быть смещен ближе к краю преоральной лопасти (Temereva, Tsitrin, 2014b). У некоторых личинок кроме фронтального органа имеются другие нервные центры в преоральной лопасти. Наибольшее их число было выявлено у личинок P. embryolabi (Temereva, 2017c). Обилие нервных центров преоральной лопасти у личинок P. embryolabi, вероятно, связано с особым образом жизни взрослых представителей этого вида. Они живут в норах роющих креветок и для прохождения метаморфоза должны найти креветку (см. ниже).
Иннервация щупалец осуществляется по-разному (рис. 3 (а–в)). У разных личинок форонид описано 3, 5 и 6 нервных трактов, проходящих в каждом щупальце. Малое нервное кольцо дает фронтальные, латеро-абфронтальные и в некоторых случаях латеро-фронтальные щупальцевые нервные тракты. Щупальцевое нервное кольцо может давать латеро-абфронтальные и абфронтальные нервные тракты (рис. 3 (а–г)).
Метаморфоз
Последовательные стадии метаморфоза форонид изучены в основном гистологическими методами и посвящены судьбе отдельных систем органов. Однако преобразования нервной системы долгое время оставались практически неисследованными. С появлением методов иммуноцитохимии и конфокальной лазерной сканирующей микроскопии появилась возможность проследить судьбу отдельных нервных элементов личинки в метаморфозе (Santagata, 2002, 2004; Temereva, Tsitrin, 2013, 2014a).
Наиболее детально преобразование нервной системы при метаморфозе актинотрохи изучено только на одном виде форонид – P. harmeri (Temereva, Tsitrin, 2014a). Метаморфоз начинается с резкого сокращения тела личинки: ее длина уменьшается примерно в 3 раза за счет сокращения задних и передних мышц ретракторов. Сокращение приводит к повышению давления внутри туловищного целома личинки, что инициирует выворачивание метасомального кармана (Temereva, Tsitrin, 2013; Temereva, Malakhov, 2015). Метасомальный карман – это глубокое впячивание покровов тела под щупальцами, которое появляется у личинки задолго до метаморфоза, растет и занимает весь объем туловищного целома (рис. 2 (а)). Метасомальный карман хорошо иннервирован густой сетью серотонин-эргических нервных волокон и связанных с ними перикариев. Эти нейриты и перикарии дадут начало туловищному нервному плексусу взрослого животного. После выворачивания метасомального кармана происходит мацерация преоральной лопасти и ее поедание. Все нервные центры, связанные с преоральной лопастью, в ходе метамофроза поедаются формирующимся ювенильным организмом. Однако сохраняются дорсальные группы перикариев, связанные с дорсальными ветвями постротового нерва (рис. 2 (б)). Группы перикариев оказываются на спинной стороне тела ювенильного животного и соединяются друг с другом толстой поперечной комиссурой, так что формируется так называемый “комиссуральный мозг” (Temereva, Tsitrin, 2014б). В толще комиссуры на последующих стадиях обнаруживается гигантское нервное волокно, которое затем станет гигантским нервным волокном взрослого животного. В метаморфозе сохраняется также и малое нервное кольцо личинки. Щупальца личинки трансформируются. Интересно отметить, что у разных форонид личиночные щупальца претерпевают разные изменения: (1) формирующаяся ювениль может съедать щупальца целиком, и дефинитивные щупальца образуются заново из небольших бугорков; (2) дефинитивные щупальца могут закладываться еще на личиночной стадии под личиночными щупальцами, которые в метаморфозе поедаются; (3) личиночные щупальца могут напрямую трансформироваться в дефинитивные, однако из них выдавливается эпителий постротового ресничного шнура, который затем поедает ювениль. Трансформация щупалец приводит к изменению их иннервации (рис. 2 (б)). Формируются абфронтальные нервные пучки, а латеро-фронтальные оказываются не связанными ни с какими нервными трактами (см. ниже). Туловище личинки подвергается сильной редукции и сохраняется лишь как небольшой участок тела между ртом и анусом. Сохраняются и некоторые нейриты, иннервировавшие личиночное тело. Телотрох и связанные с ним нервные кольца полностью дегенерируют. Пищеварительный тракт личинки напрямую становится дефинитивной пищеварительной трубкой и, вероятно, сохраняет нервные элементы, появившиеся еще на личиночной стадии (рис. 2 (б)).
Строение нервной системы у взрослых форонид
Общая анатомия и гистология нервной системы взрослых форонид исследованы довольно полно и приведены в нескольких классических анатомических исследованиях (Selys-Longchamps, 1907; Silén, 1954; Bullock, Horridge, 1965). Наиболее подробное описание, выполненное с использованием гистологической методики, представлено в работе Силена (Silén, 1954), результаты которой вошли во многие общие сводки по форонидам (Hyman, 1959). В последние десятилетия появлялись работы, в которых отдельные элементы нервной системы были исследованы с применением методов иммуноцитохимии и трансмиссионной электронной микроскопии (Лагутенко, 1996; Лагутенко, 1997; Лагутенко, 1998; Лагутенко, 2002; Fernández et.al., 1996; Темерева, Малахов, 2009; Temereva, 2015; Temereva, 2017b; Temereva, 2020).
У взрослых форонид все элементы нервной системы залегают интраэпидермально: над слоем внеклеточного матрикса между базальными отростками клеток покровного эпителия. По сути, нервная система форонид представляет собой нервный плексус (сеть), который формирует сгущения в некоторых участках тела, образуя главные нервные элементы. У большинства форонид таких главных нервных элемента два: дорсальное нервное сплетение и щупальцевое нервное кольцо (рис. 2 (в)). Строение дорсального нервного сплетения не соответствует определению ганглия (Richter et al., 2010) и имеет иное, нежели типичный ганглий, расположение нервных элементов – перикариев и нейропиля. Дорсальное нервное сплетение располагается на морфологически дорсальной стороне тела – между ртом и анусом. От дорсального нервного сплетения вправо и влево расходятся кольцевые нервные волокна, формирующие щупальцевое нервное кольцо. Оно проходит с наружной стороны лофофора, в основании щупалец и у видов рода Phoronopsis прикрыто воротничком (рис. 2 (в)). Ко рту от дорсального нервного сплетения отходит узкий нервный тракт – внутреннее нервное кольцо, которое проходит в основании щупалец с их фронтальной стороны. От дорсального нервного сплетения вправо и влево отходят два (правое и левое), либо только одно (левое) гигантских нервных волокна (рис. 2 (в)). Важной составляющей нервной системы взрослых форонид является нервный плексус туловища и нервы, проходящие в щупальцах (см. ниже).
Щупальца иннервируются от щупальцевого нервного кольца и внутреннего нервного кольца (рис. 2 (в)). От щупальцевого нервного кольца отходят многочисленные абфронтальные нервы, из которых выделяются латеро-абфронтальные, демонстрирующие иммунореактивность к серотонину. Фронтальный нервный пучок отходит от внутреннего нервного кольца. У всех форонид имеются латеро-фронтальные нервные тракты, которые связаны либо с внутренним нервным кольцом, либо с межщупальцевыми группами перикариев, которые не связаны с нервными трактами и, возможно, характерны только для видов со сложно устроенным лофофором (Temereva, 2020). Группы межщупальцевых перикариев, вероятно, работают как автономные нервные центры, координирующие работу соседних щупалец.
Все элементы нервной системы форонид залегают в толще покровного эпителия – интраэпидермально, организованы по общему плану и состоят как бы из нескольких ярусов (Fernandez et al., 1996), (Темерева, Малахов, 2009; Temereva, 2020). Верхний ярус составляют тела эпителиальных клеток, образующих покровный эпителий (рис. 2 (г)). Согласно современным представлениям (Helm et al., 2017; Beckers et al., 2019) эти эпителиальные клетки, вероятно, являются клетками так называемой радиальной глии, поскольку в их длинных базальных отростках проходят пучки электронно-плотных промежуточных филаментов (рис. 2 (г)). Под телами эпидермальных клеток располагаются тела нервных клеток – перикарии нейронов. Типы перикариев различаются по особенностям ультраструктуры, размерам, ядерно-цитоплазматическому соотношению и т.д. В дорсальном эпителии многочисленны крупные перикарии с электронно-светлой цитоплазмой и округлым крупным ядром, тогда как основу щупальцевого кольцевого сплетения составляют относительно небольшие перикарии с электронно-плотной цитоплазмой и неправильной формы ядром. Под перикариями нейронов располагаются клетки, которые, возможно, выполняют питающую функцию для нервной ткани (рис. 2 (г)). Эти клетки образуют отростки, которые охватывают перикарии и пучки нервных волокон. Отростки этих питающих клеток содержат характерные крупные электронно-плотные включения овальной формы. Самый нижний слой составляют нервные отростки и отростки питающих клеток, которые формируют нейропиль непосредственно над базальной пластинкой (рис. 2 (б)).
ЗАКЛЮЧЕНИЕ
Форониды представляют собой уникальный пример комбинации различных планов строения на взрослой и личиночной стадиях жизненного цикла. Это касается как морфологии всего тела, так и организации нервной системы. У личинок форонид имеется сложно организованный апикальный орган – личиночный мозг. Появление первых нейронов происходит у форонид на апикальном конце личинки. Для ранних стадий развития первичноротых животных характерно формирование так называемых пионерных нейронов, которые появляются на заднем конце эмбриона и формируют нервные тракты, по которым затем будет развиваться личиночная нервная система (Незлин, 2010; Воронежская, Ивашкин, 2010). Затем пионерные нейроны исчезают. У вторичноротых первые нейроны появляются на переднем конце эмбриона, а пионерные нейроны (которые исчезают в ходе развития) не обнаружены. В этом ключе раннее развитие нервной системы форониды демонстрирует признаки, характерные для вторичноротых животных. В то же время стоит отметить, что появление апикального органа у форонид происходит не на ранних стадиях развития, а на билатеральной стадии поздней гаструлы. Радиальные стадии (а у форонид это бластула), хотя и имеют теменную пластинку и апикальный султанчик, но апикального нервного центра лишены (Temereva, Wanninger, 2012). Именно радиально-симметричных личинок – бластулу и гаструлу – следует рассматривать как настоящих личинок, свойственных жизненному циклу общего предка Bilateria, тогда как билатерально-симметричные личинки – это поднятые в толщу воды ювенили (Малахов и др., 2019). Отсутствие апикального органа на ранних стадиях развития не только у форонид, но и у других первичноротых, а также вторичноротых, ставит под сомнение идею о том, что у предка Bilateria имелся нервный центр, а не только нервный плексус (Arendt et al., 2008; Nomaksteinsky et al., 2009). Интересно, однако, что уже на ранних стадиях развития у бластулы появляется апикальная пластинка и теменной султанчик. Возможно, что на самых ранних стадиях у бластул и гаструл в области теменной пластинки дифференцируются клетки, экспрессирующие нетипичные для апикального органа нейромедиаторы. Тогда апикальный орган билатерально-симметричных ресничных личинок следует рассматривать как новообразование, появившееся, вероятно, для поддержания связи со взрослыми животными и для инициации метаморфоза (Воронежская и др., 2008). Если так, то апикальный орган личинок билатерально симметричных животных – это вовсе не первичный мозг, а вторичное приобретение. Именно поэтому апикальный орган исчезает в метаморфозе. Настоящим же первичным мозгом следует считать аборальный орган радиально-симметричных личинок Bilateria – бластул и ранних гаструл. Тем не менее апикальный орган появился еще у билатеральных личинок предка Bilateria и, конечно, не возникал независимо в разных группах (Marlow et al., 2014).
Интересен тот факт, что у личинок P. embryolabi нервные тракты, подстилающие предротовой и постротовой ресничные шнуры, появляются в эмбриональном развитии одновременно. Это, несомненно, свидетельствует о единстве ресничного аппарата околоротовой ресничной зоны актинотрох и, возможно, всех ресничных личинок Bilateria (Малахов и др., 2019).
Хотя нервная система ресничных личинок Bilateria демонстрирует существенную пластичность, принято, тем не менее, считать, что для личинок первичноротых характерно наличие малоклеточного апикального органа, состоящего из небольшого числа перикариев (от 4 до 16), тогда как у личинок вторичноротых апикальный орган состоит из большого числа перикариев (более 30) (Hay-Schmidt, 2000). В состав апикального органа у актинотрох входит более 50 перикариев до четырех различных типов, что делает его похожим на апикальный орган личинок вторичноротых. Еще одной интересной особенностью нервной системы актинотрох является наличие дорсальных групп перикариев, связанных с основаниями дорсальных ветвей щупальцевого нервного кольца. Именно эти группы перикариев в ходе метаморфоза дают дорсальное нервное сплетение взрослого животного. Наличие дорсальных групп перикариев – это “адультный” признак, который свидетельствует о том, что компетентная актинотроха – это уже не совсем личинка, поскольку она имеет многие черты строения взрослого животного. Это не только дорсальные группы перикариев, но и наличие метасомального кармана и полностью сформированной кровеносной системы (Темерева, Малахов, 2000). Личинки форонид, таким образом, представляют собой яркий пример “ларвализации” развития (Малахов и др., 2019).
Преобразования нервной системы в метаморфозе форонид приводят к появлению дефинитивной нервной системы, в которой имеет место комбинация личиночных структур и структур, формирующихся de novo. При этом апикальный орган у форонид полностью редуцируется и не входит в состав дефинитивной нервной системы. Традиционно считается, что полная утрата апикального органа характерна для вторичноротых животных, тогда как у первичноротых апикальный орган полностью или частично входит в состав нервной системы взрослого животного (Schmidt-Rhaesa, 2007; Helm et al., 2016; Magarlamov et al., 2020). С этой точки зрения форониды проявляют “вторичноротые” черты метаморфоза. Преобразование щупалец форонид в ходе метаморфоза является интересным вопросом, который важно рассмотреть в свете фундаментальной проблемы о морфологическом облике предка Bilateria: имел ли он щупальцевый аппарат или был его лишен (Малахов и др., 2019). Поскольку механизм работы щупалец и у личинок, и у взрослых форонид принципиально сходен, то смена щупалец в метаморфозе выглядит необоснованной и, возможно, свидетельствует о том, что щупальца личинки – это лишь провизорный орган, а щупальца взрослого животного появляются de novo. Такая трактовка не позволяет провести непрерывный ряд от щупалец личинки к щупальцам взрослого животного и ставит под вопрос наличие щупалец у общего предка Bilateria. Возможно, однако, преобразование личиночных щупалец свидетельствует о специализации лофофора форонид по сравнению с исходным щупальцевым аппаратом общего предка Bilateria, который, конечно, был мало специализированным и служил для сбора частиц пищи с поверхности грунта.
Нервная система взрослых форонид представляет собой один из наиболее ярких примеров плексусного типа организации нервного аппарата. У форонид нет ни ганглиев, ни настоящих нервных стволов. Вероятно, сохранение нервного плексуса у форонид отражает общую примитивность тканевой организации этих животных. Сходное строение демонстрирует нервная система ближайших родственников форонид – брахиопод, у которых так называемые ганглии образованы нейроэпителием или стратифицированным нейроэпителием (Kuzmina, Temereva, 2021). Возможно, плексусная интраэпидермальная организация нервной системы взрослых форонид является отражением анцестрального для всех Bilateria паттерна организации нервной системы (Martín-Durán, Hejnol, 2019). С другой стороны, такая нервная система у форонид могла возникнуть вследствие малоподвижного сидячего образа жизни.
Таким образом, форониды, будучи принадлежащими стволу первичноротых животных, демонстрируют многие черты строения и развития нервной системы, характерные для вторичноротых. Наличие сходных черт у представителей двух главных стволов Bilateria позволяет предполагать, что они отражают исходный для всех билатерий паттерн и были присущи общему предку билатерально-симметричных животных. Это, в том числе, позволяет реконструировать нервную систему общего предка Bilateria как содержащую нервный центр и нервный плексус. Важно отметить, что нервный центр предка Bilateria гомологичен аборальному органу бластул и гаструл современных представителей группы, тогда как апикальный орган билатерально-симметричных ресничных личинок появляется как новообразование для жизни в планктоне и связи с родительскими особями.
Работа выполнена при поддержке Российского научного фонда (проект № 18-14-00082).
Список литературы
Воронежская Е., Ивашкин Е. Пионерные нейроны: основа или лимитирующий фактор разнообразия нервных систем Lophotrochozoa. Онтогенез. 2010. 41 (6): 403–413.
Воронежская Е.Е., Незлин Л.П., Хабарова М.Ю. “Что говорят улитки своим личинкам”. Природа. 2008. 2: 14–22.
Лагутенко Ю.П. Клеточная организация афферентного звена в кожном нервном плексусе метасомы форонид (Tentaculata, Phoronidea). Журн. эвол. биохим. физиол. 1996. 32 (4): 440–447.
Лагутенко Ю.П. Система двигательных нейронов в кожном нервном слое (плексусе) форонид (Tentaculata, Phoronidea). Журн. эвол. биохим. и физиол. 1997. 33 (2): 218–227.
Лагутенко Ю.П. Интерневральная система в кожном нервном плексусе форонид (Tentaculata, Phoronidea) и проблема возникновения ассоциативной связи у низших Bilateria. Журн. эвол. биохим. физиол. 1998. 33 (1): 64–75.
Лагутенко Ю.П. Ранние формы эволюции базиэпидермального нервного сплетения Bilateria как возможное свидетельство первичного разнообразия его исходного строения. Журн. эвол. биохим. физиол. 2002. 38 (3): 354–363.
Малахов В.В., Богомолова Е.В., Кузьмина Т.В., Темерева Е.Н. Эволюция жизненных циклов Metazoa и происхождение пелагических личинок. Онтогенез. 2019. 50 (6): 383–397.
Незлин Л.П. Золотой век сравнительной морфологии: лазерная сканирующая микроскопия и нейрогенез трохофорных животных. Онтогенез. 2010. 41: 370–380.
Темерева Е.Н., Малахов В.В. Кровеносная система личинок форонид. Докл. Акад. наук. 2000. 375 (5): 712–714.
Темерева Е.Н., Малахов В.В. Микроскопическая анатомия и ультраструктура нервной системы Phoronopsis harmeri Pixell, 1912 (Lophophorata, Phoronida). Биол. моря. 2009. 35 (5): 388–404.
Arendt D., Denes A.S., Jekely G., Tessmar-Raible K. The evolution of nervous system centralization. Phil. Trans. Roy. Soc.: Biol. Sci. 2008. 363: 1523–1528.
Beckers P., Helm C., Purschke G., Worsaae K., Hutchings P., Bartolomaeus Th. The central nervous system of Oweniidae (Annelida) and its implications for the structure of the ancestral annelid brain. Frontiers in Zoology (2019) 16 (6): https://doi.org/10.1186/s12983-019-0305-1
Bullock H., Horridge G.A. Structure and function in the nervous system of invertebrates (Vol. 1). San Francisco: W.H. Freeman, 1965. 1719 pp.
Fernández I., Pardos F., Benito J., Roldan C. Ultrastructural observation on the phoronid nervous system. J. Morphol. 1996. 230: 265–281.
Hay-Schmidt A. The nervous system of the actinotroch larva of Phoronis muelleri (Phoronida). Zoomorphol. 1989. 108: 333–351.
Hay-Schmidt A. Catecholamine-containing, serotonin-lake and FMRFamide-like immunoreactive neurons and processes in the nervous system of the early actinotroch larva of Phoronis vancouverensis (Phoronida): distribution and development. Can. J. Zool. 1990a. 68 (7): 1525–1536.
Hay-Schmidt A. Distribution of catecholamine containing, serotonin-like and neuropeptide FMRFamide-like immunoreactive neurons and processes in the nervous system of the actinotroch larva of Phoronis muelleri (Phoronida). Cell and Tissue Res. 1990b. 259: 105–118.
Hay-Schmidt A. The evolution of the serotonergic nervous system. Philosophical Transactions of the Royal Society B: Biol. Sci. 2000. 267: 1071–1079.
Helm C., Vöcking O., Kourtesis I., Hausen H. Owenia fusiformis – a basally branching annelid suitable for studying ancestral features of annelid neural development. BMC Evol. Biol. 2016. 16: 1–19. https://doi.org/10.1186/s12862-016-0690-4
Helm C., Karl A., Beckers P., Kaul-strehlow S., Ulbricht E., Kourtesis I., Kuhrt H., Hausen H., Bartolomaeus Th., Reichenbach F., Bleidorn Ch. Early evolution of radial glial cells in Bilateria. Proc. R. Soc. B. 2017. 284 (20170743). https://doi.org/10.1098/rspb.2017.0743
Hyman L.H. Phoronida. The invertebrates. V. 5. Smaller coelomate groups. Ed. Boell E.J. New York: McGraw-Hill, 1959. 228–274 pp.
Kocot K.M., Struck T.H., Merkel L., Waits D.S., Todt C., Brannock P.M., Weese D.A., Cannon J.T., Moroz L.L., Lieb B., Halanych K.M. Phylogenomics of Lophotrochozoa with consideration of systematic error. Syst. Biol. 2018. 66 (2): 256–282.
Kuzmina T.V., Temereva E.N. Ultrastructure of ganglia in the brachiopod Coptothyris grayi and its phylogenetic significance. J. Zool. Syst. Evol. Res. 2021. 59 (2): 376–386.
Lacalli T.C. Structure and organization of the nervous system in the actinotroch larva of Phoronis vancouverensis. Phil. Trans. Roy. Soc. 1991. 327: 655–685.
Magarlamov T.Y., Dyachuk V., Chernyshev A.V. Does the frontal sensory organ in adults of the hoplonemertean Quasitetrastemma stimpsoni originate from the larval apical organ? Front. Zool. 2020. 17: 2. https://doi.org/10.1186/s12983-019-0347-4
Marlow H., Tosches M.A., Tomer R., Steinmetz P., Lauri A., Larsson T., Arendt D. Larval body patterning and apical organs are conserved in animal evolution. BMC Biol. 2014. 12 (7). https://doi.org/10.1186/1741-7007-12-7
Martín-Durán J.M., Hejnol A. A developmental perspective on the evolution of the nervous system. Dev. Biol. 2019. https://doi.org/10.1016/j.ydbio.2019.10.003
Nomaksteinsky M., Roettinger E., Dufour H.D., Chettouh Z., Lowe C.J., Martindale M.Q., Brunet J.F. Centralization of the deuterostome nervous system predates chordates. Curr. Biol. 2009. 19: 1264–1269.
Richter S., Loesel R., Purschke G., Schmidt-Rhaesa A., Scholtz G., Stach T., Vogt L., Wanninger A., Brenneis G., Döring C., Faller S., Fritsch M., Grobe P., Heuer C.M., Kaul S., Møller O.S., Müller C., VRieger V., Rothe B., Stegner M., Harzch S. Invertebrate neurophylogeny: suggested terms and definitions for a neuroanatomical glossary. Front. Zool. 2010. 7 (1): 29.
Santagata S. Structure and metamorphic remodeling of the larval nervous system and musculature of Phoronis pallida (Phoronida). Evol. Dev. 2002. 4: 28–42.
Santagata S. A waterborne behavioral cue for the actinotroch larva of Phoronis pallida (Phoronida) produced by Upogebia pugettensis (Decapoda: Thalassinidea). Biol. Bull. 2004. 207: 103–115.
Santagata S., Zimmer R.L. Comparison of the neuromuscular system among actinotroch larvae: Systematic and evolutionary implication. Evol. Dev. 2002. 4: 43–54.
Schmidt-Rhaesa A. The evolution of organ systems. Oxford: Oxford University Press, 2007. 365 pp.
Selys-Longchamps. Phoronis. Fauna Flora Golf Neapel. 1907. 30: 1–280 (1907).
Silén L. On the nervous system of Phoronis. Ark. Zool. 1954b. 6: 1–40.
Sonnleitner B., Schwaha T., Wanninger A. Inter- and intraspecific plasticity in distribution patterns of immunoreactive compounds in actinotroch larvae of Phoronida (Lophotrochozoa). J. Zool. Syst. Evol. 2014. 52 (1): 1–14.
Temereva E.N. Ventral nerve cord in Phoronopsis harmeri larvae. J. Exp. Zool. Part B, Mol. Dev. Evol. 2012. 318: 26–34.
Temereva E. Phoronida. Structure and evolution of invertebrate nervous systems. Eds. Schmidt-Rhaesa A., Harzsch S., Purschke G. London, UK: Oxford University Press, 2015. 351–359 pp.
Temereva E.N. Ground plan of the larval nervous system in phoronids: Evidence from larvae of viviparous phoronid. Evol. Dev. 2017a. 19: 171–189.
Temereva E.N. Innervation of the lophophore suggests that the phoronid Phoronis ovalis is a link between phoronids and bryozoans. Sci. Rep. 2017b. 7 (1): 1–16.
Temereva E.N. Morphology evidences the lophophorates monophyly: brief review of studies on the lophophore innervation. Invertebr. Zool. 2017c. 14: 85–91.
Temereva E.N. First data on the organization of the nervous system in juveniles of Novocrania anomala (Brachiopoda, Craniiformea). Sci. Rep. 2020. 10 (1): 1–15.
Temereva E.N., Chichvarkhin A. A new phoronid species, Phoronis embryolabi, with a novel type of development, and consideration of phoronid taxonomy and DNA barcoding. Invertebr. Syst. 2017. 31: 65–84.
Temereva E.N., Kosevich I.A. The nervous system of the lophophore in the ctenostome Amathia gracilis provides insight into the morphology of ancestral ectoprocts and the monophyly of the lophophorates. BMC Evol. Biology. 2016. 16: 1–24. https://doi.org/10.1186/s1286
Temereva E.N., Malakhov V.V. Embryogenesis in phoronids. Invertebr. Zool. 2012. 9 (1): 1–39.
Temereva E.N., Malakhov V.V. Metamorphic remodeling of morphology and the body cavity in Phoronopsis harmeri (Lophotrochozoa, Phoronida): The evolution of the phoronid body plan and life cycle. BMC Evol. Biol. 2015. 15: 1–28. https://doi.org/10.1186/s12862-015-0504-0
Temereva E.N., Tsitrin E.B. Development, organization, and remodeling of phoronid muscles from embryo to metamorphosis (Lophotrochozoa: Phoronida). BMC Dev. Biol. 2013. 13: 1–24. https://doi.org/10.1186/1471-213X-13-14
Temereva E.N., Tsitrin E.B. Organization and metamorphic remodeling of the nervous system in juveniles of Phoronopsis harmeri (Phoronida): Insights into evolution of the bilaterian nervous system. Front. Zool. 2014a. 11: 1–25. https://doi.org/10.1186/1742-9994-11-35
Temereva E.N., Tsitrin E.B. Development and organization of the larval nervous system in Phoronopsis harmeri: New insights into phoronid phylogeny. Front. Zool. 2014b. 11 (1): 3. https://doi.org/10.1186/1742-9994-11-3
Temereva E.N., Tsitrin E.B. Modern Data on the Innervation of the Lophophore in Lingula anatina (Brachiopoda) Support the Monophyly of the Lophophorates. PLoS One. 2015. 10: 1–29. https://doi.org/10.1371/journ
Temereva E., Wanninger A. Development of the nervous system in Phoronopsis harmeri (Lophotrochozoa, Phoronida) reveals both deuterostome- and trochozoan-like features. BMC Evol. Biol. 2012. 12: 121. https://doi.org/10.1186/1471-2148-12-121
Zimmer R.L. Reproductive biology and development of Phoronida. Ann Arbor: University Microfilm, 1964. 416 pp.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


