Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 3, стр. 354-358
Тревожное поведение родителей в период формирования оборонительной реакции у потомства оказывает влияние на параметры ЭЭГ птенцов мухоловки-пеструшки
Е. В. Корнеева 1, *, Л. И. Александров 1, Т. Б. Голубева 2
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Кафедра зоологии позвоночных Московского государственного университета имени М.В. Ломоносова
Москва, Россия
* E-mail: eko.ihna@mail.ru
Поступила в редакцию 01.12.2020
После доработки 09.02.2021
Принята к публикации 02.03.2021
Аннотация
Исследовали тревожное поведение взрослых мухоловок-пеструшек, воспитывающих выводки птенцов из ранних и поздних, отложенных взамен разоренных кладок, и его влияние на формирование электрической активности головного мозга птенцов. Показано, что родители поздних выводков исполняют видоспецифический сигнал тревоги более продолжительное время по сравнению с родителями ранних выводков. Количественный анализ спектральных характеристик ЭЭГ 7-суточных птенцов показал, что у птенцов из ранних и поздних выводков они различаются в большей части выделенных частотных диапазонов, что может свидетельствовать о влиянии повышенной тревожности родителей на созревание ЭЭГ.
Забота о потомстве является фундаментальным свойством эндотермных животных. У экзотермных животных – рыб, амфибий и рептилий – нередко имеет место охрана и забота о кладке, в редких случаях и забота о вылупившихся личинках, кроме того, для крокодилов описаны элементы коммуникации с потомством (Combrink et al., 2016, Farmer, 2018). У млекопитающих и человека поведение родителей при взаимоотношении с потомством усложняется настолько, что становится решающим фактором раннего онтогенеза, влияющим не только на выживание, но и на особенности развития потомства. Так, качество материнской заботы во многом способно как модифицировать раннее поведение потомства, так и оказывать влияние на поведение и способность к обучению в зрелом возрасте (Шишелова, Раевский, 2018). У птиц, другого класса эндотермных позвоночных, ведущим фактором, влияющим на развитие птенцов в раннем онтогенезе, оказывается акустическая коммуникация между матерью и потомством. Акустическая коммуникация на последних сроках эмбрионального развития выводковых птиц способствует синхронному вылуплению из яиц и нормальному поведению птенцов после вылупления (Голубева, 2006). Окружающая среда оказывает существенное влияние на поведение взрослых птиц при выкармливании, в результате может меняться стратегия выкармливания, позволяющая выжить слабым птенцам (Caro et al., 2016). Остается неизвестным, могут ли индивидуальные особенности поведения родителей более тонко, чем влияние на выживание, модулировать процессы развития потомства. Цель нашей работы заключалась в выяснении вопроса о том, могут ли вариации поведения родителей оказывать влияние на формирование ЭЭГ птенцов в период их раннего онтогенеза.
У мухоловки-пеструшки наблюдается высокий уровень гибели выводков в результате разорения гнезд хищниками (Артемьев, 2008, Голубева и др., 2017). Из-за этого формирование кладок и вылупление птенцов происходят не синхронно, а волнообразно. Вылупление птенцов из кладок первой волны происходит, как правило, в начале июня. Во второй половине июня происходит вылупление птенцов из повторных кладок, отложенных после гибели яиц, отложенных в мае. В конце июня – начале июля может иметь место третья волна вылуплений птенцов из кладок, отложенных взамен погибших птенцов (Голубева и др., 2017). Поведение родителей поздних выводков, потерявших первые выводки в результате хищничества, может отличаться от поведения родителей ранних кладок. Задача настоящей работы состояла в изучении тревожного поведения родителей ранних и поздних выводков и его влияния на формирование электрической активности головного мозга птенцов. Исследовалось исполнение родителями видоспецифического сигнала тревоги (ВСТ). Этот сигнал состоит из ритмически повторяемых акустических посылок с энергетическим максимумом 5 кГц. Частота следования посылок может изменяться в пределах 1.5–2 раза в секунду.
МЕТОДИКА
Эксперименты проводили в соответствии с международными правилами работы с лабораторными животными по протоколу, утвержденному этической комиссией ИВНД и НФ РАН. Исследовали тревожное поведение родителей ранних и поздних выводков; вылупление первых проходило в период 3–16 июня, вторых – 7–13 июля. Анализировали продолжительность издавания ВСТ взрослыми птицами при появлении около гнезда экспериментатора. Экспериментатор располагался на расстоянии 10 м от гнезда. Фиксировали время начала и окончания звучания ВСТ и количество птиц, исполняющих сигнал тревоги. Регистрацию поведения родителей проводили при возрастном интервале птенцов 7–9 сут. Исследовано тревожное поведение родителей 20 ранних и 15 поздних выводков.
Регистрацию фоновой ЭЭГ проводили в светлое время суток у 6 птенцов мухоловки-пеструшки в возрасте 7 дней. Три птенца были взяты из ранних кладок, вылупление которых проходило в начале июня, три – из поздних кладок, вылупившихся в июле. Все птенцы были из выводков, которые выкармливались двумя родителями. Птенцов в эксперименте кормили каждые 30 мин стандартными порциями корма. Вживление регистрирующих электродов проводили под нембуталовым наркозом (100 мг/кг, внутрибрюшинно). Серебряные электроды помещали в симметричные области правого и левого каудомедиального нидопаллиума (высший интегративный центр слуховой системы птиц). Референтный электрод располагался субдурально над средней линией мозга, электрод заземления – над поверхностью мозжечка. Для фильтрации и усиления сигналов использовали усилитель L-Amp (ООО “Л Кард”, Россия), полоса пропускания составляла 1–250 Гц. При анализе ЭЭГ для удаления шумовой составляющей сигналы предварительно подвергали обработке с использованием метода разложения на эмпирические моды (Грубов и др., 2012). Для частотно-временного анализа сигналов ЭЭГ использовали непрерывное вейвлетное преобразование (Павлов и др., 2012). Вычисляли энергию вейвлетного спектра во фрагментах ЭЭГ длительностью 8 с. Проводили анализ вейвлетных спектров мощности в диапазонах 1–2, 2–3, 3–5, 5–12 и 12–20 Гц.
Статистическая обработка полученных результатов проведена с использованием факторного анализа ANOVA, одновариантного анализа ANOVA и последующего LSD-теста (статистический пакет Statistica 8).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Анализ продолжительности исполнения ВСТ показал, что в ранних выводках продолжительность исполнения сигнала тревоги двумя родителями составляла в среднем 291 с (SE = 43, n = 16), в случае одного родителя его продолжительность была несколько меньше и составляла 249 с (SE = 44.7, n = 15). В поздних выводках продолжительность исполнения сигнала тревоги 2 родителями составляла 453 с (SE = 59.2, n = 6), одним родителем – 152 с (SE = 40.3, n = 9). Статистический анализ показал значимость фактора количества родителей, исполняющих ВСТ (р = 0.001812) и комбинации факторов количества родителей и ранних или поздних выводков (р = = 0.015799). LSD-test показал, что продолжительность исполнения ВСТ двумя родителями в поздних выводках была достоверно выше по сравнению как с продолжительностью исполнения ВСТ одним родителем в поздних выводках (р = 0.042209), так и с продолжительностью исполнения сигнала тревоги двумя родителями в ранних выводках (р = 0.000999) (рис. 1).
Рис. 1.
Продолжительности исполнения ВСТ родителями ранних и поздних выводков двумя родителями (темные столбики) и одним родителем (светлые столбики). * p < 0.05.
Fig. 1. Duration of alarm call by both parents (dark columns) and single parent (light columns) to early and late broods. * – p < 0.05.
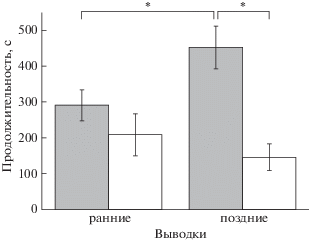
Учитывая тот факт, что повторные кладки откладываются как правило взамен разоренных хищниками, можно полагать, что такая повышенная тревожность родителей вызвана именно этим событием.
Статистический анализ вейвлетных спектров мощности показал значимое различие между ЭЭГ исследованных 7-дневных птенцов из ранних и поздних выводков (F = 10.05, p < 0.01). Для ЭЭГ птенцов из ранних выводков были характерны максимальные показатели мощности в частотных диапазонах 3–5 Гц (0.53944 SE = 0.0162) и 5–12 Гц (0.53391 SE = 0.01325). Для птенцов из поздних выводков максимальные показатели мощности были отмечены в частотных диапазонах 1–2 Гц (0.47621 SE = 0.01478) и 2–3 Гц (0.49561 SE = = 0.01653). Количественный анализ, проведенный для каждого из частотных диапазонов, выявил значимую разницу спектральных характеристик ЭЭГ птенцов из ранних и поздних выводков практически во всех частотных диапазонах (рис. 2). При этом в ЭЭГ птенцов из поздних выводков показатели спектров мощности в диапазоне 1–2 Гц были значимо выше, а в диапазонах 3–5, 5–12 и 12–20 Гц значимо ниже, чем в ЭЭГ “ранних” птенцов.
Рис. 2.
Средние значения мощности вейвлетных спектров ЭЭГ каудомедиального нидопаллиума (отн. ед. ± станд. ошибка) у птенцов из ранних (темные столбики) и поздних (светлые столбики) кладок. * – p < 0.05.
Fig. 2. Power of wavelet spectra (Mean±SE) of EEG from caudomedial nidopallium in nestlings from early (dark columns) and late (light columns) broods. * – p < 0.05.
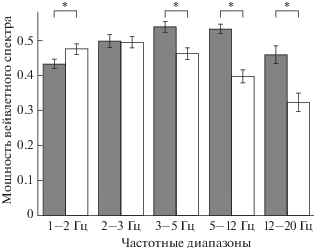
Исследование электрофизиологических коррелятов разных поведенческих состояний взрослых птиц показало, что низкоамплитудная ЭЭГ-активность с частотой выше 10–12 Гц сопровождает активное бодрствование, а высокоамплитудная активность с частотой менее 5 Гц характерна для их медленноволнового сна (Jones et al., 2010, Szymczak et al., 1992). Исследование ЭЭГ у старших птенцов мухоловки-пеструшки (11 суток) показало, что двигательная активность птенцов сопровождалась увеличением спектральной мощности в частотных диапазонах 5–10 и 12–20 Гц (Корнеева и др., 2014). Различные диапазоны максимальной спектральной мощности свидетельствуют о разнице в функциональных состояниях птенцов из ранних и повторных выводков, при этом большая выраженность низкочастотной области спектра в ЭЭГ у птенцов из повторных выводков может говорить об их менее активном функциональном состоянии. Значимо более низкая спектральная мощность в частотных диапазонах 5–10 и 12–20 Гц у птенцов из поздних кладок свидетельствует о более низкой двигательной активности этих птенцов.
Из литературных источников известно, что ритмическая стимуляция модулирует электрические колебания головного мозга, увеличивая их синхронизацию со структурой стимулов (Keitel, Quigley, 2014). Обнаруженное нами более частое исполнение ритмичного, повторяемого с частотой 1–2 Гц ВСТ родителями поздних выводков может способствовать увеличению в биоэлектрической активности мозга таких птенцов ритмической компоненты, соответствующей частоте ВСТ, которая соответствует частотному диапазону 1–2 Гц. В норме такое усвоение ритма внешнего стимула сохраняется достаточно недолго. Однако мы полагаем, что длительная ритмическая стимуляция в ходе раннего онтогенеза биологически значимым акустическим сигналом, вызывающим снижение двигательной активности птенцов, может оказывать модулирующее влияние на процессы раннего развития и, как следствие, приводить к достаточно стойким изменениям ЭЭГ птенцов.
ЗАКЛЮЧЕНИЕ
Птенцы из повторных кладок, отложенных взамен разоренных хищниками, получают повышенную экспозицию видоспецифического сигнала тревоги, вызывающего снижение двигательной активности. Для фоновой ЭЭГ таких птенцов характерны более низкие показатели спектральной мощности в высокочастотных диапазонах.
Исследования выполнены за счет средств Российского фонда фундаментальных исследований, проект № 20-013-00176.
Список литературы
Артемьев А.В. Популяционная экология мухоловки-пеструшки в северной зоне ареала. М.: Наука, 2008. 267 с.
Голубева Т.Б. Сенсорное обеспечение ранней акустической коммуникации выводковых и птенцовых птиц. Развитие современной орнитологии в Северной Евразии. Ставрополь. 2006. 600–625.
Голубева Т.Б, Корнеева Е.В., Александров Л.И. Успешность и cроки гнездования мухоловки пеструшки в Приокско-Террасном государственном природном биосферном заповеднике в начале ХХI века. Динамика численности птиц в наземных ландшафтах. 30-летие программ мониторинга зимующих птиц России и сопредельных регионов, “Parus” и “Евроазиатский Рождественский учет” Материалы Всероссийской конференции. М: Товарищество научных изданий. 2017. С. 219–225.
Грубов В.В., Ситникова Е.Ю., Короновский А.А., Павлов А.Н., Храмов А.Е. Автоматическое выделение и анализ осцилляторных паттернов на нестационарных сигналах ЭЭГ с использованием вейвлетного преобразования и метода эмпирических мод. Изд. РАН. Сер. физическая. 2012. 76 (12): 1520–1523.
Корнеева Е.В., Александров Л.И., Храмов А.Е., Ситникова Е.Ю., Раевский В.В. ЭЭГ незрелорождающихся птенцов мухоловки-пеструшки при состояниях, связанных с циклом естественного поведения. Журнал высшей нервной деятельности им. И.П. Павлова. 2014. 64 (2): 208–217.
Павлов А.Н., Храмов А.Е., Короновский А.А., Ситникова Е.Ю., Макаров В.А., Овчинников А.А. Вейвлет-анализ в нейродинамике. Успехи физиол. наук. 2012. 182 (9): 905–939.
Шишелова А.Ю., Раевский В.В. Влияние пре- и постнатальных факторов на формирование ранних поведенческих реакций. ДАН. 2018. 479 (3): 351–353.
Caro S.M., Griffin A.S., Hinde C.A., West S.A. Unpredictable environments lead to the evolution of parental neglect in birds. Nat. Commun. 2016. 7:10985.
Combrink X., Warner J.K., Downs C.T. Nest predation and maternal care in the Nile crocodile (Crocodylus niloticus) at Lake St Lucia, South Africa. Behav. Processes. 2016. 133: 31–36.
Farmer C.G. Parental Care, Destabilizing Selection, and the Evolution of Tetrapod Endothermy. Physiology. 2020. 35: 160–176.
Jones S.G., Paletz E.M., Obermeyer W.H., Hannan C.T., Benca R.M. Seasonal influences on sleep and executive function in the migratory White-crowned Sparrow (Zonotrichia leucophrys gambelii). BMC Neuroscience. 2010. 11: 87.
Keitel C., Quigley C., Ruhnau P. Stimulus-driven brain oscillations in the alpha range: entrainment of intrinsic rhythms or frequency-following response? J. Neurosci. 2014. 34: 10137–10140.
Szymczak J.T., Helb H.W., Kaiser W. Electrophysiological and behavioral correlates of sleep in the blackbird (Turdus merula). Physiol. Behav. 1992. 53: 1201–1210.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


