Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 3, стр. 370-386
Хронический стресс, вызванный содержанием в условиях дефицита гнездового материала в раннем постнатальном периоде, оказывает влияние на поведение и стресс-реактивность самцов крыс
М. Ю. Степаничев 1, *, О. А. Недогреева 1, М. А. Климанова 1, Ю. В. Моисеева 1, М. В. Онуфриев 1, Н. А. Лазарева 1, Н. В. Гуляева 1
1 Федеральное государственное бюджетное учреждение науки Институт высшей нервной деятельности
и нейрофизиологии РАН
Москва, Россия
* E-mail: m_stepanichev@ihna.ru
Поступила в редакцию 16.11.2020
После доработки 26.01.2021
Принята к публикации 02.03.2021
Аннотация
Модели депривации родительской заботы на грызунах все чаще применяются для моделирования депрессивно-подобных расстройств, вызванных ранним стрессом. В данной работе использована модель последствий содержания матери и приплода в условиях дефицита гнездового материала (ДГМ) в течение длительного периода раннего постнатального онтогенеза у крыс. Задачей работы было исследовать, меняется ли с возрастом поведение самцов крыс, перенесших стресс, обусловленный содержанием в условиях ДГМ в раннем постнатальном периоде, и связаны ли эти изменения с нарушением стресс-реактивности животных. Содержание крысят в условиях ДГМ со второго по девятый постнатальный день не приводило к существенным изменениям показателей поведения, характеризующих тревожность и депрессивность, которые регистрировали в стандартных тестах (открытое поле, приподнятый крестообразный лабиринт, предпочтение раствора сахарозы), ни в подростковом возрасте, ни у взрослых животных. При этом ДГМ в раннем постнатальном периоде вызывал усиление социального предпочтения (выраженности социально-ориентированного поведения, которое проявлялось в желании больше времени проводить в присутствии незнакомой особи в новой обстановке) у 1-месячных, но не взрослых животных. Содержание в условиях ДГМ улучшало пространственное обучение, но не влияло на долговременную память у взрослых крыс при оценке способности взрослых животных к обучению решению пространственной задачи в лабиринте Барнс. Изменения стресс-реактивности животных (по динамике выброса в кровь кортикостерона) были наиболее выражены у взрослых крыс. Таким образом, ДГМ в раннем постнатальном периоде не вызывал развития тревожного и депрессивно-подобного поведения у самцов крыс в возрасте 1 и 6 мес, оказывал преходящее влияние на социальное предпочтение у молодых животных, но изменял стресс-реактивность при кратковременном действии умеренного стрессорного фактора (иммобилизации).
ВВЕДЕНИЕ
Взрывной рост психических расстройств в структуре заболеваемости большинства стран обусловливает центральную роль борьбы с этими патологиями в современной медицине, как клинической, так и фундаментальной (Vigo et al., 2016; Rehm, Shield, 2019). Нарушения эмоциональной сферы, депрессия, тревожные расстройства часто коморбидны хроническим неврологическим и соматическим заболеваниям, однако, в отличие от других заболеваний, прогресс терапии психических заболеваний происходит чрезвычайно медленно. Это связано в том числе с недостаточной клинической релевантностью используемых в фундаментальных и прикладных исследованиях моделей психических расстройств на животных (Григорьян, Гуляева, 2015; Robinson, 2018). Разработка и исследование таких моделей, несомненно, относятся к приоритетам современной нейробиологии и фундаментальной медицины.
Принято считать, что действие экстремальных факторов (стрессоров) разной природы в перинатальный/неонатальный период приводит к долговременным изменениям нейрогуморальной регуляции, которые могут формироваться в последующие периоды жизни, способствовать развитию различных психопатологий у подростков и взрослых (Малиновская и др., 2016; Kentner, Pittman, 2010; Stepanichev et al., 2014; Kraaijenvanger et al., 2020). В связи с этим в последние годы особое внимание уделяется роли перинатальных воздействий, вызывающих нарушения адаптивных возможностей, в созревании центральной нервной системы у животных. Так, популярные модели предполагают применение провоспалительных стимулов у грызунов в раннем постнатальном онтогенезе, что способствует длительному сдвигу регуляции гипоталамо-гипофизарно-надпочечниковой оси (ГГНО), сопровождающемуся изменением стресс-чувствительности особей (Onufriev et al., 2017; Tishkina et al., 2016), существенной модификацией процессов нейропластичности (Кудряшова и др., 2018, 2019; Tishkina et al., 2016; Kudryashova et al., 2019) и увеличением вероятности возникновения поведенческих нарушений в подростковом и взрослом периодах онтогенеза (Брошевицкая и др., 2020; Bilbo et al., 2005; 2006; Tishkina et al., 2016). Основной проблемой такого рода моделей является их невысокая трансляционная значимость, поскольку у человека ранние инфекционные заболевания, обладающие высоким провоспалительным потенциалом, не всегда приводят к существенным нарушениям психоэмоциональной сферы (Du Preez et al., 2016).
Одним из популярных в настоящее время направлений моделирования психопатологий является использование “натуралистичных” моделей создания у животных поведенческих нарушений, аналогичных таковым при психических расстройствах у человека. Среди таких моделей первенство, безусловно, принадлежит моделям депривации родительской заботы, а именно: “материнской” и “отцовской” депривации/сепарации (Малиновская и др., 2016; Feldman et al., 2019). Наряду с этим широко применяемым подходом, несколько групп исследователей разработали модель и активно исследуют последствия содержания матери и приплода в условиях дефицита гнездового материала (ДГМ) в течение длительного периода раннего постнатального онтогенеза (Avishai-Eliner et al., 2001; Walker et al., 2017). Предполагается, что в этих условиях мать не имеет возможности осуществлять заботу о потомстве в достаточной степени. В основе модели лежит содержание самки с приплодом на приподнятой металлической сетке в домашней клетке при наличии небольшого куска бумаги в качестве материала для строительства гнезда. Период содержания приходится обычно на 2–9-й постнатальные дни (P), после чего самку возвращают в нормальные условия с достаточным количеством опилок в качестве подстилки. Важным условием является то, что самки должны быть первородящими, т.е. не иметь предыдущего опыта выращивания потомства, поскольку это повышает выраженность игнорирования детенышей. Подобное воздействие оказывает влияние на работу ГГНО, что сопровождается повышением уровня кортикостерона (КС) в крови крысят на P10 (Molet et al., 2014; Raineki et al., 2010), которое сохраняется на более высоком уровне до P21, по крайней мере у самок (Moussaoui et al., 2017); однако такой ответ удается зафиксировать не всегда (McLaughlin et al., 2016). Было отмечено, что гипертрофия надпочечников проявлялась у аутбредных крысят Вистар и Лонг-Эванс уже к концу стрессорного периода (P9), но исчезала у взрослых (Brunson et al., 2005; Gilles et al., 1996).
Стрессорное воздействие на крысят в модели ДГМ приводит к развитию более высокой ситуативной тревожности у взрослых крыс (Guadagno et al., 2018; Dalle Molle et al., 2012). В работах на мышах результаты были противоречивы (Naninck et al., 2015; Wang et al., 2013). Взрослые крысы, в детстве содержавшиеся в условиях ДГМ в течение P2–P9, демонстрировали признаки ангедонии в тесте предпочтения сахарозы (Molet et al., 2016) при “нормальном” поведении в тесте вынужденного плавания и неизменном уровне тревожности. При этом содержание крыс в условиях ДГМ в течение P8–P12 приводило к увеличению времени иммобильности в тесте Порсолта (Raineki et al., 2012). В последнем случае также наблюдали снижение социальных взаимодействий со сверстниками как во время игр у подростков (Moriceau et al., 2009; Raineki et al., 2012), так и у взрослых особей (Raineki et al., 2012; Raineki et al., 2015; Rincón-Cortés, Sullivan, 2016). Снижение игрового поведения может быть признаком развития ангедонии. Животные, подвергнутые стрессу в моделях ДГМ, демонстрируют снижение способности обучаться в водном лабиринте (Naninck et al., 2015), выполнять тесты на распознавание объекта (Brunson et al., 2005; Bath et al., 2016; Molet et al., 2016; Naninck et al., 2015). В то же время выработка условно-рефлекторной реакции замирания, наоборот, улучшается (Arp et al., 2016; Krugers et al., 2016).
В настоящей работе мы проследили, меняется ли с возрастом поведение самцов крыс, перенесших стресс, обусловленный содержанием в условиях ДГМ в раннем постнатальном периоде, и связаны ли предполагаемые нарушения с изменением стресс-реактивности животных.
МЕТОДИКА
Экспериментальные животные и моделирование ДГМ
Все эксперименты с животными выполняли в соответствии с принципами Базельской декларации, Директивы 2010/63/EU Европейского Парламента и Совета от 22.09.2010 и приказа Минздрава РФ № 199н от 1.04.2016. Протоколы эксперимента были одобрены Этической комиссией ИВНД и НФ РАН. Схема экспериментов представлена на рис. 1 (а).
Рис. 1.
Схема проведения эксперимента: (а) – последовательность проведения экспериментальных этапов и поведенческих тестов. Р – постнатальный день, ПКЛ – приподнятый крестообразный лабиринт, ОП – открытое поле, СП – социальное предпочтение, ПС – предпочтение сахарозы; (б) и (в) – фотографии клеток для содержания крыс в контрольных условиях и условиях ДГМ соответственно.
Fig. 1. Experimental design: (a) flow-chart of experimental stages and behavioral tests. P – postnatal day; ОП – open field; СП – social preference/attachment, ПС – sucrose preference; (б) and (в) – photos of cages for housing of rats under the control and LBN conditions, respectively.
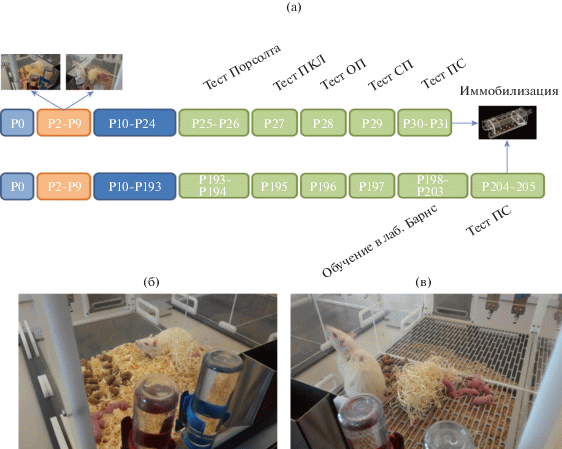
Производителей (10 самцов и 20 самок крыс Вистар) приобретали в Филиале “Столбовая” Федерального государственного бюджетного учреждения науки “Научный центр биомедицинских технологий Федерального медико-биологического агентства” (Московская обл., РФ) и размещали в конвенциональном виварии ИВНД и НФ РАН за 14 дней до начала эксперимента. Для эксперимента использовали нерожавших самок возрастом 3 мес. Самцов содержали индивидуально в течение 7 дней до скрещивания, после чего к каждому подсаживали по две самки. После скрещивания беременных самок размещали индивидуально в клетках вивария. Животных содержали в условиях постоянного доступа к неограниченному количеству пищи и воды и 12 ч светового цикла (свет 8.00–20.00) при температуре 20–22°C. Появление потомства проверяли ежедневно в дневное время суток. День появления потомства считали нулевым (P0). В возрасте двух дней (P2) определяли пол детенышей, после чего их число в помете снижали до 9 таким образом, чтобы в помете оставалось не менее 5 самцов.
Разделение пометов на две экспериментальные группы проводили в P2. Подопытную группу содержали в условиях ДГМ (Gilles et al., 1996). Самок с пометами помещали в специальные камеры, имевшие расположенный на высоте 2.5 см решетчатый пластиковый вкладыш, под которым находилось до 1 см опилок. Самок вместе с пометами, которые были определены в контрольную группу, помещали в камеры, наполненные опилками до высоты 5 см. В каждую камеру дополнительно помещали 200 мл “древесной шерсти” в качестве гнездового материала (рис. 1 (б), (в)). Вода и корм были доступны без ограничений. Камеры располагались в хорошо вентилируемом помещении, изолированном от основного помещения вивария. Освещение камер было синхронизировано с освещением основного вивария. Никаких манипуляций с животными в период P2–P9 не проводили. По истечении этого периода животных возвращали в домашние клетки вивария, где потомство содержали в одной клетке с матерью до P21. После этого мать отсаживали и разделяли детенышей на самцов и самок, которых содержали в виварии раздельно по пометам. Всего было использовано 20 пометов. Экспериментальные группы включали по 9–11 самцов крыс Вистар возрастом 1 или 6 мес, содержавшихся в нормальных условиях или в условиях ДГМ (всего 40 самцов). Каждое животное принимало участие во всех поведенческих экспериментах.
Исследование поведения
Оценку поведения крыс проводили, используя батарею тестов, предназначенных для выявления тревожности и депрессивно-подобных проявлений, а также изучения когнитивных процессов (рис. 1 (а)). В последние годы показано, что тест вынужденного плавания (ВП, или тест Порсолта) не связан непосредственно с депрессивностью грызунов, однако, как стрессорное воздействие, позволяет животным продемонстрировать различные стратегии преодоления стресса (Commons et al., 2017; Molendijk, de Kloet, 2019). Известно, что провокация таким умеренным поведенческим стрессом может вызвать ответ систем мозга, связанных с эмоциональным поведением, и более эффективно выявить имеющиеся особенности “эмоционально окрашенных” форм поведения (de Kloet, Molendijk, 2016; Commons et al., 2017; Molendijk, de Kloet, 2019; Stepanichev et al., 2016). Поэтому в качестве первого метода оценки поведения использовали тест ВП, который иногда применяется даже в качестве отдельного стрессора (Molendijk, de Kloet, 2019). Далее последовательность тестов была следующей: тест “открытое поле” (ОП), тест “приподнятый крестообразный лабиринт” (ПКЛ), тест “социальное предпочтение”, обучение в лабиринте Барнс у 6-месячных крыс, тест на ангедонию (тест предпочтения сахарозы). Подробное описание протоколов проведения тестов ВП, ОП, ПКЛ, предпочтения сахарозы приведены в предыдущих публикациях (Манолова и др., 2018; Tishkina et al., 2016). Коротко, тест ВП проводили по 2-дневному протоколу. В 1-й день крыс помещали в узкие, прозрачные цилиндры, заполненные водой до высоты 40 см, на 15 мин. На второй день крыс помещали в цилиндры с водой на 5 мин, в течение которых регистрировали время иммобильности, т.е. состояния неподвижности животного, при котором оно совершало движения, необходимые только для поддержания головы над уровнем воды. Тест ПКЛ проводили в установке с двумя открытыми и двумя закрытыми рукавами в течение 5 мин. При этом регистрировали время, проведенное в закрытых и открытых рукавах и на центральной платформе, а также число посещений рукавов. Тест ОП проводили в круглой арене. Крысу высаживали в центр арены и регистрировали длину пройденной дистанции, число вертикальных стоек, выходов в центр арены и дефекационных болюсов. Тест на предпочтение сахарозы проводили, помещая крыс индивидуально в прозрачные боксы. Каждому животному предъявляли две поилки с водой и 2%-м раствором сахарозы. Бутылки взвешивали до начала эксперимента и меняли местами каждые 12 ч, проводя дополнительные взвешивания. Предпочтение рассчитывали в процентах от общего количества выпитой жидкости.
Тест “социальное предпочтение”. Изучение поведения в тесте “социальное предпочтение” проводили согласно протоколу (Raineki et al., 2012) с использованием установки “Трехкамерный социальный тест” (ООО “Открытая наука”, РФ). Камера размером 120 × 80 × 40 см была разделена на три отсека размером 40 × 80 см. Боковые отсеки от центрального были отделены прозрачными стенками с дверцами. В оба боковых отсека помещали цилиндрические клетки высотой 30 см и диаметром 22 см с решетчатой боковой стенкой и прозрачной крышкой с отверстиями для вентиляции. Тест проводили при освещенности 50 лк. Крысу помещали в центральный отсек при закрытых дверцах в боковые отсеки и в течение 5 мин давали возможность его обследовать. После этого в одну из цилиндрических клеток помещали незнакомую для тестируемого животного крысу того же пола и возраста и открывали дверцы. В течение 10 мин поведение животных регистрировали на видео и анализировали следующие параметры: время нахождения в каждом из отсеков (без крысы, с незнакомой крысой и центральном), продолжительность собственно социального взаимодействия, т.е. время, в течение которого животное было обращено мордой к клетке с другой крысой и находилось не далее, чем в 5 см от нее, число болюсов и уринаций.
Обучение в лабиринте Барнс. Для оценки способности к пространственному обучению у взрослых самцов использовали лабиринт Барнс (Barnes, 1979; Gawel et al., 2019). Установка представляла собой круглую арену диаметром 122 см (ООО “Открытая наука”, РФ). По краям арены располагались 18 отверстий диаметром 9.5 см, к одному из которых крепилась изготовленная из черного пластика камера-убежище размером 30 × 11 × 11 см. Остальные отверстия во время опыта были закрыты пластиковыми заглушками того же цвета. Арена располагалась на высоте 113 см над полом. Платформа была ярко равномерно освещена (500 лк). Вокруг арены на трех стенах были размещены зрительные ориентиры (квадрат, треугольник, крест) черного цвета размером 60 × 60 см. Четвертая стена не имела ориентира. Во время ознакомительной попытки животное помещали в центр арены под непрозрачный пластиковый контейнер на 15 с для того, чтобы в момент начала попытки животное было случайным образом ориентировано по отношению к убежищу и дистантным зрительным стимулам. Контейнер убирали, и крысе позволяли свободно исследовать среду. Если в течение 3 мин экспериментальное животное не находило убежище или не заходило в него, экспериментатор мягко направлял крысу в убежище, где она находилась в течение 1 мин. В последующие пять дней проводили по 2 обучающие попытки с интервалом между ними 2–3 мин продолжительностью не более 2 мин. На седьмой день проводили тестовую попытку, в ходе которой камеру-убежище изымали из установки, и время исследования лабиринта сокращали до 1 мин. После каждой попытки арену очищали 70% этиловым спиртом. Между попытками одного животного лабиринт вращали на произвольный угол для дополнительного снижения вероятности ориентирования по запаховым меткам и другим возможным стимулам внутри лабиринта. При этом положение убежища не меняли по отношению к внешним ориентирам. Поведение животных в лабиринте фиксировали с помощью видеокамеры и программного пакета IC-Capture Ver. 2.2.248.1000 (“The Imaging Source Europe GmbH”, ФРГ). Анализ поведения проводили с помощью программы Ethovision XT11 (Noldus, Нидерланды). Платформу условно делили на четыре равных сектора. Целевое отверстие, ведущее в убежище, располагали так, чтобы оно делило дугу целевого сектора пополам. Также выделяли 10-сантиметровую зону вокруг целевого отверстия (целевая зона) и вокруг отверстия, расположенного напротив (зона-антипод). Анализировали латентный период (ЛП) нахождения убежища в течение 10 обучающих сеансов, время пребывания в каждом из четырех секторов и в целевой зоне, а также число посещений целевого сектора и целевой зоны в ходе тестовой попытки. Для построения кривой обучения ЛП двух попыток каждого сеанса усредняли и использовали эти значения для анализа.
Иммобилизационный стресс и оценка стресс-реактивности
На следующий день после завершения батареи тестов проводили оценку стрессоустойчивости особей. Для этого крыс подвергали иммобилизации в пластиковых домиках для 1- и 6-месячных животных (ООО “Открытая Наука”, РФ) размером 120 × 50 × 55 и 210 × 65 × 65 соответственно, в течение 1 ч. Домики были выполнены из прозрачного пластика и имели отверстия для доступа воздуха и дополнительной вентиляции. Животное в домике не могло совершать активных движений.
Оценку развития стрессорного ответа проводили по уровню глюкозы и кортикостерона (КС) в крови. Для этого сразу после помещения в домик, через 30 и 60 мин проводили забор периферической крови из хвостовой вены для биохимических измерений (Lee, Goosens, 2015). Были предприняты все усилия для того, чтобы уровень болевой стимуляции был одинаковым для всех животных одной возрастной категории. Кровь собирали в пробирки, предварительно смоченные 10 мкл гепарина, и после 30 мин отстаивания центрифугировали в течение 15 мин при 1500 × g. Плазму отбирали, замораживали и хранили до анализа при –80°С.
Уровень глюкозы в периферической крови из хвостовой вены измеряли in situ с помощью глюкометра OneTouch Select Simple и тест-полосок OneTouch Select (LifeScan, США), и ее концентрацию выражали в ммоль/л. Для этого хвост крысы протирали тампоном, смоченным теплой водой, затем тампоном со спиртом и делали надрез. Первую каплю крови снимали, а следующую наносили на тест-полоску.
Уровень КС определяли методом твердофазного иммуноферментного анализа с использованием наборов “DRG corticosterone kit” (DRG Systems, ФРГ). Система основана на принципе конкурентного связывания и измеряет содержание свободного и связанного с белком КС. Спектрофотометрический анализ проводили на планшетном ридере Hydex Sense 425-301 (Hydex Oy, Финляндия) при длине волны поглощения 450 нм. Концентрацию КС подсчитывали методом построения стандартной кривой и выражали в нмоль/л.
Статистический анализ
Распределение переменных в полученных выборках не соответствовало нормальному в абсолютном большинстве случаев (p < 0.05, тест Шапиро-Уилкса). Учитывая это, для сравнения независимых групп между собой использовали непараметрический критерий Манна–Уитни. Изменение ЛП во время обучения в лабиринте Барнс оценивали по критерию Фридмана для связанных переменных в каждой группе животных с последующим сравнением временных точек по критерию Вилкоксона, а сравнение между группами проводили по критерию Манна–Уитни. Удаление выбросов в выборках проводили меж-квартильным методом. Распределение биохимических показателей в выборках соответствовало нормальному. Анализ изменения концентрации КС и глюкозы в крови проводили с использованием дисперсионного анализа для связанных переменных (RM-ANOVA). Данные представлены в виде бокс-плотов, отражающих максимальное и минимальное значения показателя и медиану или среднее значение.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Содержание в условиях ДГМ в ранний постнатальный период не оказывает существенного влияния на тревожность и депрессивно-подобное поведение у крыс
Исследование поведения самцов крыс в тесте ВП проводили в возрасте 1 и 6 мес. Было показано, что как крысы, содержавшиеся в нормальных условиях (НУ), так и крысы, содержавшиеся в условиях ДГМ, демонстрировали сходное время иммобильности (рис. 2 (а)). Другие показатели поведения в тесте ВП, а именно: время активного плавания или плавания с царапанием стенок – также были близки у этих групп крыс (данные не представлены).
Рис. 2.
Показатели тревожности и депрессивно-подобного поведения у крыс разных возрастных групп. (а) – время иммобильности в тесте ВП; (б) и (в) – время, проведенное в закрытых (ЗР) и открытых (ОР) рукавах лабиринта в тесте ПКЛ соответственно; (г), (д) и (е) – пройденная дистанция, число стоек и число выходов в центр арены соответственно, в тесте ОП. Данные представлены в виде медианы (линия) и максимального и минимального значений для каждой группы. НУ и ДГМ – крысы, содержавшиеся в неонатальном периоде в нормальных условиях и в условиях дефицита гнездового материала соответственно. Число животных в группах НУ и ДГМ в возрасте 1 мес было n = 9 и n = 11, и в возрасте 6 мес – n = 10 и n = 10 соответственно.
Fig. 2. Indices of anxiety and depressive-like behavior in rats of different age groups. (а) – immobility duration in the FS test; (б) and (в) – time spent in the closed arms (ЗР) and open arms (ОР), respectively, in the EPM test; (г), (д) and (е) – distance traveled, rearing, and number of visits into the arena center, respectively, in the OF test. Data are presented as median (line) and maximal and minimal values for each experimental group. НУ and ДГМ, rats maintained under the normal conditions and limited bedding and nesting conditions, respectively, in the neonatal period. Number of animals in the NU and DGM groups in 1-month-old rats was n = 9 and n = 11 and in 6-month-old rats – n = 10 and n = 10, respectively.
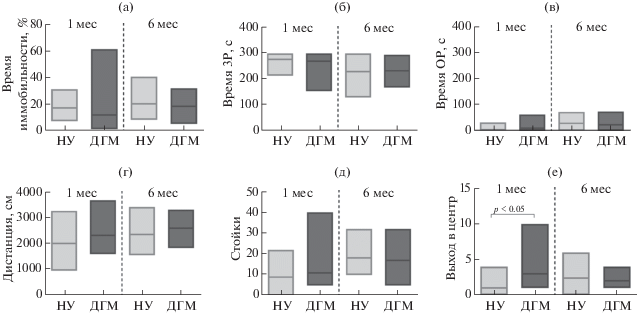
Крысы как подросткового, так и зрелого возраста демонстрировали сходный уровень тревожности при тестировании в ПКЛ. Как 1-, так и 6-месячные животные предпочитали большую часть времени проводить в закрытых рукавах ПКЛ (рис. 2 (б)), изредка посещая открытые рукава (рис. 2 (в)). При этом содержание новорожденных крысят в разных условиях не оказывало существенного влияния на поведение в ПКЛ. Число переходов между рукавами также значимо не различалось (данные не представлены).
Пребывание крыс в условиях ДГМ в течение Р2–Р9 не оказывало влияния на локомоторную активность в тесте ОП ни в возрасте 1 мес, ни в возрасте 6 мес (рис. 2 (г)). Во всех группах наблюдали сходный уровень исследовательской активности, который оценивали по числу стоек (рис. 2 (д)). Интересно, что 1-месячные крысы, содержавшиеся в условиях ДГМ в течение неонатального периода, совершали большее число выходов в центр арены по сравнению ровесниками, которых содержали в НУ (рис. 2 (е)). По другим показателям поведения в тесте ОП существенных различий не было обнаружено (данные не представлены).
Животные, содержавшиеся в НУ в неонатальном периоде, предпочитали пить подслащенный раствор в ситуации выбора между раствором сахарозы и водой как в возрасте 1 мес (уровень предпочтения 86.2% [64.7–95.8%]), так и в возрасте 6 мес (90.5% [46.8–98.8%]). Содержание новорожденных крысят в условиях ДГМ не оказывало значимого влияния на показатели предпочтения раствора сахарозы ни в подростковой группе (71.7% [19.2–95.0%]), ни в группе взрослых (89.4% [78.9–97.6%]) крыс.
Таким образом, содержание крысят в условиях ДГМ в течение Р2–Р9 не приводило к существенным изменениям показателей поведения особей, характеризующих их тревожность и депрессивность, которые регистрировали в стандартных тестах в подростковом возрасте или у взрослых животных. Единственным статистически значимым изменением было увеличение числа выходов в центр арены в тесте ОП, которое наблюдали у 1-месячных крыс, что до определенной степени могло отражать некоторое снижение тревожности в этой группе, но это изменение не подтверждалось данными теста ПКЛ. К тому же это изменение не было стойким, так как у взрослых особей оно уже не наблюдалось.
Содержание в условиях ДГМ в ранний постнатальный период вызывает усиление социального предпочтения у крыс подросткового возраста, но не у взрослых животных
В течение времени проведения теста каждая крыса имела возможность выбрать один из трех отсеков: с незнакомой крысой того же пола и возраста, с пустой клеткой без крысы или центральный. Среди 1-месячных крыс группы НУ 1 особь предпочитала находиться в отсеке с пустой клеткой, а 3 крысы оставались в центральном отсеке все время тестирования, тогда как остальные животные большую часть времени проводили в отсеке с другой крысой. Однако в целом время предпочтения отсека с другой крысой не отличалось значимо от времени, проведенного в других отсеках камеры (рис. 3 (а)). В группе ДГМ 3 крысы также находились все время в центральном отсеке, но в отличие от крыс, содержавшихся в НУ в неонатальном периоде, остальные животные этой группы предпочитали большую часть времени (по сравнению с пустым отсеком) находиться в отсеке с незнакомой особью (рис. 3 (а)).
Рис. 3.
Показатели поведения крыс возрастом 1 мес (а) и 6 мес (б) в тесте “социальное предпочтение”. П, Ц и К – пустой отсек, центральный отсек и отсек с незнакомой крысой соответственно. Число животных в группах НУ и ДГМ в возрасте 1 мес было n = 9 и n = 11 и в возрасте 6 мес – n = 10 и n = 10 соответственно. Остальные обозначения как на рис. 2.
Fig. 3. Behavior of 1- (а) and 6-month-old rats (б) in the “social preference/attachment” test. П, Ц and К – empty alley, central alley, and alley with an unknown rat, respectively. Number of animals in the NU and DGM groups in 1-month-old rats was n = 9 and n = 11 and in 6-month-old rats – n = 10 and n = 10, respectively. The other indications are similar to those in fig. 2.
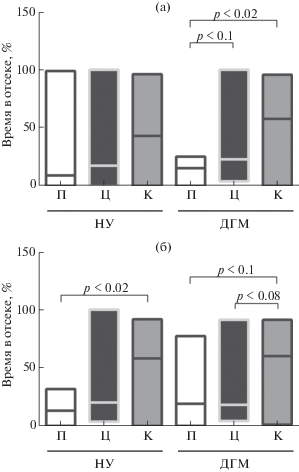
Среди 6-месячных животных лишь 1 крыса из группы НУ все время проводила в центральном отсеке, остальные значительную часть времени проводили в отсеке с другой особью. В группе НУ время, проведенное в отсеке с другой крысой, было значимо больше по сравнению с пустым отсеком, у крыс ДГМ сохранялась аналогичная тенденция (рис. 3 (б)). При этом время непосредственного контакта с незнакомой особью не отличалось ни у подростков, ни у взрослых крыс, которых содержали в разных условиях в раннем онтогенезе.
Таким образом, содержание животных в условиях ДГМ приводило к более ранней выраженности социально-ориентированного поведения, которое проявлялось в желании больше времени проводить в присутствии другой, хоть и незнакомой, особи в новой незнакомой обстановке.
Содержание в условиях ДГМ в ранний постнатальный период улучшает пространственное обучение, но не влияет на долговременную память у взрослых крыс
Для оценки когнитивных способностей взрослых животных, перенесших разные воздействия в неонатальном периоде, использовали обучение решению пространственной задачи в лабиринте Барнс. В ходе решения крыса должна научиться отыскивать убежище по внелабиринтным ориентирам. Как видно из приведенных кривых обучения, и у контрольных (НУ), и у подопытных (ДГМ) животных происходило постепенное снижение ЛП поиска убежища в процессе обучения (рис. 4 (а)). Это подтверждалось и результатами статистического анализа, выполненного с помощью критерия Фридмана, раздельно для каждой группы крыс. В группе НУ наблюдали тенденцию к снижению ЛП в процессе обучения (χ2(10, 4) = 8.31, p = 0.08). Особи подопытной группы ДГМ демонстрировали статистически значимое снижение ЛП в ходе обучения (χ2(10, 4) = 25.19, p < 0.001). На рис. 4 (б) представлены индивидуальные значения ЛП в группах НУ и ДГМ. Наблюдавшаяся тенденция к снижению ЛП выполнения задачи в группе НУ, по-видимому, была обусловлена наличием небольшой разницы в величине ЛП в последнем сеансе обучения по сравнению с первым (p = 0.07 по критерию Вилкоксона для связанных переменных). В группе ДГМ значимое снижение ЛП наблюдали и в четвертом, и в пятом сеансах обучения по сравнению с первым (p < 0.01 по критерию Вилкоксона для связанных переменных). Кроме того, ЛП нахождения убежища в последней попытке был почти вдвое выше в контрольной группе по сравнению с подопытной на уровне тенденции с учетом множественности сравнений (p < 0.05 по критерию Манна–Уитни). Таким образом, наблюдалось некоторое улучшение и/или ускорение обучения поиску убежища в лабиринте Барнс у крыс, которые были подвергнуты содержанию в условиях ДГМ.
Рис. 4.
Показатели обучения 6-месячных крыс выполнению поиска убежища в лабиринте Барнс. (а) – кривые обучения, построенные по данным ЛП поиска убежища. ЛП двух попыток каждого дня для каждой крысы усредняли, после чего получали значение медианы для группы; (б) – индивидуальные средние значения двух попыток для всех исследованных животных; (в) – число визитов в целевую зону или зону-антипод в тестовой попытке; (г) – время, проведенное в целевой зоне или зоне-антиподе в тестовой попытке. Обозначения как на рис. 2. Число животных в группах НУ и ДГМ было n = 10 и n = 10 соответственно.
Fig. 4. Training of 6-month-old rats to find a safety shelter in the Barnes’ maze. (а), learning curves representing changes in the latency to find a shelter. Latencies of two trials of each day were averaged and median values for each group were used to build the curves; (б) – averaged latencies of two trials for all trained animals; (в) – number of visits into the target zone and antipode zone in the test trial; (г) – time spent in the target zone and antipode zone in the test trial. The other indications are similar to those in fig. 2. Each group consisted of 10 male rats.
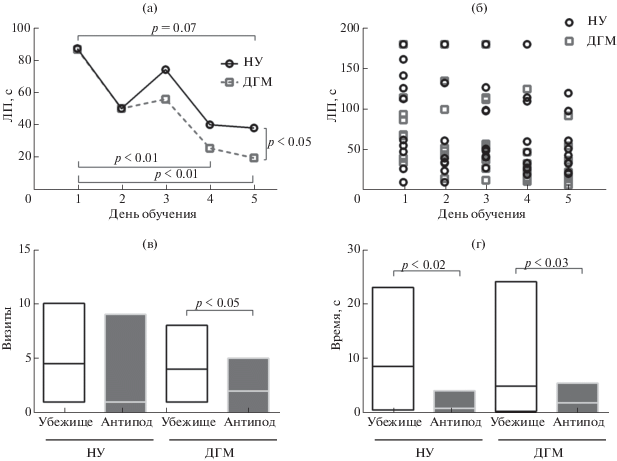
Через 24 ч после последнего сеанса обучения проводили проверку сохранности памятного следа о месте нахождения убежища в лабиринте. Как число визитов в область убежища (рис. 4 (в)), так и время, проведенное в этой области (рис. 4 (г)), были выше по сравнению с числом визитов и проведенным временем в области-антиподе в обеих группах животных. Вместе с тем в случае числа визитов эта разница была значимой только в группе ДГМ.
Содержание в условиях ДГМ в ранний постнатальный период модифицирует стрессорный ответ в зависимости от возраста
Для исследования реакции крыс на часовую мягкую иммобилизацию оценивали содержание глюкозы и КС в периферической крови. Крыс помещали в пластиковые домики, и сразу после посадки в домик, через 30 и 60 мин иммобилизации, периферическую кровь собирали и в ней измеряли указанные параметры. На рис. 5 (а, б) представлены результаты измерения концентрации глюкозы в крови крыс при экспозиции стрессору. Крысы экспериментальной и подопытной группы не различались по исходному уровню глюкозы в крови ни в возрасте 1 мес, ни в возрасте 6 мес. У 1-месячных крыс обеих групп увеличение концентрации глюкозы в крови в ответ на стрессорное воздействие было слабым и при статистическом анализе выявлялось лишь на уровне тенденции (фактор “время иммобилизации” F(2, 36) = 2.54; p = = 0.09; рис. 5 (а)). Существенной разницы между группами не наблюдали (F(1, 18) = 1.38; p = 0.26), и взаимодействие между факторами отсутствовало (F(2, 36) = 0.51; p = 0.61).
Рис. 5.
Базовый и индуцированный иммобилизационным стрессом уровни глюкозы и КС в плазме крови 1-мес ((а), (в) и (д)) и 6-мес ((б), (г) и (е)) крыс, содержавшихся в нормальных условиях или в условиях ДГМ в раннем неонатальном периоде. (а) и (б) – содержание глюкозы; (в) и (г) – содержание КС; (д) и (е) – прирост КС относительно базового уровня. Линия внутри бокса на рис. (а) – (г) обозначает среднее значение по группе. Число животных в группах НУ и ДГМ в возрасте 1 мес было n = 8 и n = 9, и в возрасте 6 мес – n = 10 и n = 10 соответственно. Обозначения как на рис. 2.
Fig. 5. Basal and restraining-induced levels of glucose and CS in blood plasma of 1- ((а), (в) and (д)) and 6-month-old ((б), (г) and (е)) rats housed under the normal or LBN conditions in the early neonatal period. (а) and (б) – glucose content; (в) and (г) – CS content; (д) and (е) – CS increase respective to the basal CS level. Lines within the boxes in (а) – (г) represent group mean values. Number of animals in the NU and DGM groups in 1-month-old rats was n = 8 and n = 9 and in 6-month-old rats – n = 10 and n = 10, respectively. The other indications are similar to those in fig. 2.
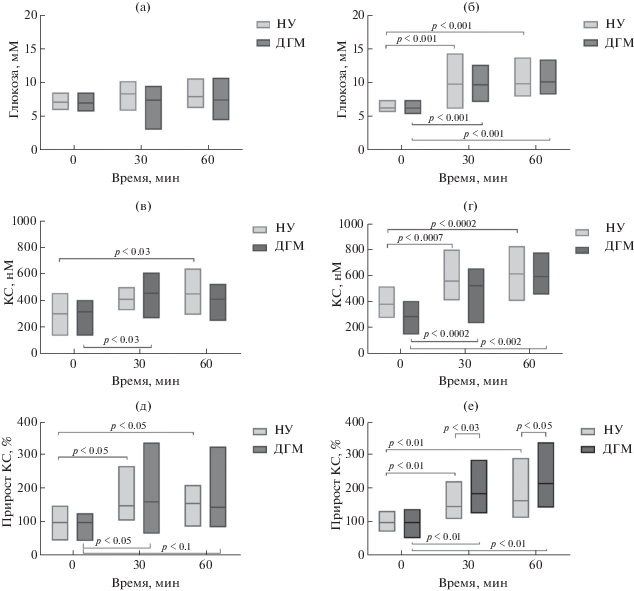
Изменения концентрации глюкозы у взрослых животных разных групп в ответ на иммобилизацию были также сходны (рис. 5 (б)). Содержание глюкозы возрастало в обеих группах через 30 мин после начала воздействия и сохранялось на том же уровне к концу периода иммобилизации (фактор “время иммобилизации” F(2, 36) = 54.81; p < 0.001). При этом эффекта фактора “группа” и взаимодействия между факторами не наблюдалось (F(1, 18) = 0.0059; p = 0.94 и F(2, 36) = 0.14; p = 0.86 соответственно). Таким образом, изменение концентрации глюкозы в ответ на действие стрессора было слабее выражено у 1-месячных крыс по сравнению с взрослыми животными. При этом характер изменения у крыс-подростков и взрослых животных был сходным в подопытной и контрольной группах.
При анализе содержания КС в периферической крови были обнаружены выбросы, которые вычисляли с учетом интерквартильного размаха. После удаления выбросов (по одному животному из каждой группы у 1-месячных крыс) распределение параметра в выборках соответствовало нормальному (p > 0.3 по критерию Шапиро–Уилка). Анализ различий концентрации КС в группах проводили с использованием RM-ANOVA. Как видно из приведенных данных, не наблюдалось существенных различий в базовом содержании КС между крысами 1-месячного возраста, которые содержались в разных условиях в неонатальном периоде (рис. 5 (в)). Иммобилизация вызывала рост содержания КС в обеих группах (фактор “время иммобилизации” F (2, 39) = 6.72, p < 0.004). При этом эффекта содержания в условиях ДГМ не наблюдалось (фактор “группа” F (1, 39) = 0.048, p = 0.83), так же как и взаимодействия между этими факторами (F (2, 39) = 0.61, p = 0.55). Апостериорное множественное сравнение средних подтвердило рост содержания КС в группе НУ, статистически значимая разница по сравнению с исходным уровнем наблюдалась через 60 мин иммобилизации (p = 0.03 по критерию Тьюки). В подопытной группе прирост становился максимальным уже через 30 мин после начала действия стрессора (p = = 0.03), и далее роста не происходило. Таким образом, в подростковом возрасте у крыс реакция на действие гетеротипичного стрессора (иммобилизации) в группе ДГМ несколько отличалась по сравнению с контролем по показателям, характеризующим динамику выброса КС.
У взрослых животных также не наблюдалось существенной разницы в базовом уровне КС в крови (рис. 5 (г)). Иммобилизация приводила к значительному росту уровня КС в крови как крыс НУ, так и крыс ДГМ по сравнению с исходным уровнем через 30 мин после начала иммобилизации, этот эффект был еще более выражен через 60 мин иммобилизации в обеих группах крыс (фактор “время иммобилизации” F(2, 54) = 27.98, p < < 0.0001). При этом эффекта содержания в условиях ДГМ не наблюдалось (фактор “группа” F (1, 54) = 2.71, p = 0.11), так же как и взаимодействия между этими факторами (F (2, 54) = 0.54, p = 0.59). Таким образом, взрослые особи обеих групп реагировали сходным нарастанием содержания КС в крови с достижением максимального уровня к концу иммобилизации.
Обратил на себя внимание тот факт, что в исходной точке усредненный уровень КС в подопытной группе был почти на 25% ниже, чем в контроле, хотя эта разница не была статистически значимой. Поэтому мы попытались оценить степень нарастания содержания КС в течение периода иммобилизации, выразив прирост в процентах от исходного уровня. Было обнаружено, что у 1-месячных крыс нарастание уровня КС происходило примерно одинаково (рис. 5 (д)) и в группе НУ (p < 0.05 для обеих точек по критерию Вилкоксона), и в группе ДГМ (p < 0.05 для 30 мин и p = 0.093 для 60 мин). Различий между группами не наблюдалось (p > 0.3 по критерию Манна–Уитни). У взрослых крыс прирост КС также был значимым и в контроле (p < 0.01 для обеих точек по критерию Вилкоксона), и в опыте (p < 0.01 для обеих точек). В то же время у взрослых животных выброс КС был явно выше у животных группы ДГМ по сравнению с НУ (рис. 5 (е); p < 0.05 по критерию Манна–Уитни для обеих исследованных точек). Таким образом, содержание крыс в условиях ДГМ в раннем постнатальном онтогенезе изменяло реакцию ГГНО на иммобилизацию на более поздних стадиях онтогенеза. При этом у молодых животных несколько менялась временная динамика выброса КС со сдвигом влево у подопытных крыс, а у взрослых крыс прирост содержания этого гормона в ответ на действие стрессора был больше у подопытных животных по сравнению с контролем.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Модель неонатального стрессорного воздействия, основанная на использовании сетчатой платформы и дефиците гнездового материала, применяется в разных лабораториях. В исходно разработанной для крыс и мышей модели (Gilles et al., 1996; Avishai-Eliner et al., 2001; Brunson et al., 2005; Ivy et al., 2008; Rice et al., 2008) самку с потомством содержат в условиях ограниченного количества подстилки и гнездового материала. Для моделирования используют первородящих самок возрастом старше 75 дней. Детенышей из разных пометов случайным образом перераспределяют между самками для уменьшения вклада индивидуальных генетических особенностей. В ходе выполнения эксперимента самок с новым пометом делят на подопытную и контрольную группы. При этом подопытную группу помещают в клетки на покрытую пластиком алюминиевую сетчатую платформу с ограниченным количеством подстилки, достаточным, чтобы тонким слоем покрыть пол клетки, а в качестве гнездового материала предлагается использовать одно бумажное полотенце (Gilles et al., 1996; Molet et al., 2014). Такие обедненные условия не позволяют самке построить нормальное гнездо, что ведет к изменению паттернов заботы о потомстве. Эпизоды взаимодействия самки с детенышами становятся фрагментарными и теряют регулярность (Ivy et al., 2008; Rice et al., 2008; Molet et al., 2016), а последовательность различных актов становится непредсказуемой (Rice et al., 2008; Baram et al., 2012). При этом достоверных свидетельств изменения суммарной длительности материнской заботы или изменений в определенных ее аспектах, таких как вылизывание, груминг и других, не наблюдается (Ivy et al., 2008; Molet et al., 2014). Важно отметить, что именно непредсказуемость и фрагментированность материнского ухода считаются отличительными особенностями материнского поведения в ситуации неглекта (пренебрежения родительскими обязанностями) и плохого обращения с детьми (Whipple, Webster-Stratton, 1991; Gaudin et al., 1996). Предполагается, что именно нарушенное материнское поведение является причиной хронического раннего стресса у детенышей грызунов, однако изменения в температурном режиме и в паттернах кормления также могут играть в его возникновении значительную роль. Последствия такого стрессорного воздействия мы и исследовали в настоящей работе.
Как и в других моделях раннего стресса, можно было ожидать, что ДГМ вызовет изменения поведения и стресс-реактивности, которые проявляются в последующие периоды жизни. Эти изменения потенциально связаны со многими регуляторными системами, в первую очередь с основными стресс-реализующими системами, такими как ГГНО и симпато-адреналовая система.
В нашем исследовании содержание в условиях ДГМ в ранний постнатальный период не оказывало существенного влияния на тревожность и депрессивно-подобное поведение у самцов крыс. Возможно, что причиной этого были незначительные отличия использованного протокола (применение пластмассовой платформы вместо металлической сетки, использование в качестве гнездового материала “древесной шерсти” вместо бумажного полотенца) от исходно описанного (Walker et al., 2017) модели. Не исключено, что эти отличия могли обеспечить более комфортное пребывание детенышей в клетке в условиях родительского неглекта и меньший стрессирующий эффект созданной среды. По-видимому, раннее физическое или провоспалительное воздействие представляет собой намного более сильный стрессор. Действительно, большинство существующих моделей депрессии базируются на представлении о стрессорной природе этого заболевания и используют стрессоры преимущественно физической природы для индукции депрессивно-подобных симптомов у лабораторных животных (Григорьян, Гуляева, 2015). Стрессовые условия ранней материнской депривации/сепарации, в основе которой лежит прерывание непосредственного контакта между телом матери и детеныша, оказывают влияние на формирование всех систем организма, повышая стрессоустойчивость индивидуума в краткосрочной перспективе и делая его уязвимым к развитию депрессии в долгосрочной перспективе (Andersen, 2015; Bergman, 2019). Означает ли это, что содержание в условиях ДГМ не оказалось стрессорным фактором для самцов крыс? Данные, полученные в настоящей работе, позволили выявить изменения, которые указывают на трансформации, произошедшие при развитии животных под влиянием постнатального содержания в условиях ДГМ.
Важно отметить, что ряд преходящих изменений был отмечен только у 1-месячных животных. Изменения поведения включали усиление социального предпочтения, т.е. реакции на незнакомую особь в незнакомой обстановке, что может указывать на изменения эмоциональной сферы в этом возрасте. Считают, что изменения в социальном поведении могут быть симптомами психических и неврологических нарушений (Andersen, 2015). Интересно, что эти изменения отсутствуют у взрослых животных, что может говорить о возрастной коррекции социального поведения.
Содержание в условиях ДГМ в ранний постнатальный период модифицировало стрессорный ответ в зависимости от возраста. Судя по динамике выброса КС в ответ на иммобилизационный стресс у животных разного возраста, взросление крыс, содержавшихся в условиях неонатального ДГМ, приводило к более выраженной реактивности ГГНО.
Важно, что довольно умеренные модификации нейрогуморальной системы и изменения стресс-реактивности наблюдались в отсутствие явных патологических изменений поведения. Более того, в лабиринте Барнс взрослые подопытные животные продемонстрировали улучшение пространственного обучения, хотя и без изменений долговременной памяти. С учетом умеренно повышенной стресс-реактивности можно предположить, что быстрая, но не чрезмерная активация ГГНО в условиях обучения может иметь благоприятный эффект, связанный с ключевым участием глюкокортикоидов и их рецепторов, прежде всего в лимбической системе, в процессе обучения (de Kloet et al., 2018). В последние годы становится все более популярной гипотеза о необходимости “двойного” или даже “тройного удара” для развития психических заболеваний, в первую очередь депрессии (“two hit” or “three-hit” hypotheses). Согласно этой гипотезе, необходимы два или более значимых воздействия на организм в период его развития для запуска патофизиологических механизмов заболевания (Daskalakis et al., 2013; Lesse et al., 2017). Первый, как принято считать, приходится на ранний период и может создать условия для реализации действия следующего неблагоприятного фактора и индукции заболевания. Исходя из этого, модель ДГМ, которая не вызывает продолжительных и драматических изменений поведения, может быть валидной в качестве “первого удара”, а трансформации, в том числе нейроэндокринной системы, вызванные содержанием в условиях ДГМ, существенно повышают уязвимость мозга к действию сильных острых или хронических стрессорных факторов (второй и последующие удары). С этой точки зрения модель ДГМ заслуживает дальнейшего исследования как база для моделей депрессии, предусматривающих последующие стрессорные “удары”. Такие исследования позволят оценить трансляционную значимость такого подхода и клиническую релевантность модели, основанной на ДГМ.
ВЫВОДЫ
1. Содержание самки с приплодом в условиях дефицита гнездового материала в течение 2–9 дней постнатального периода приводит к модификациям поведения, которые наблюдаются у самцов крыс в возрасте 1 и 6 мес. У 1-месячных животных происходит усиление социального предпочтения, которое нивелируется по мере взросления. У 6-месячных крыс наблюдается некоторое улучшение обучения поиску укрытия в лабиринте Барнс.
2. Содержание самки с приплодом в условиях дефицита гнездового материала в течение 2–9 дней постнатального периода приводит к изменениям острого стрессорного ответа, который был более выражен у взрослых особей. У 6-месячных самцов прирост содержания кортикостерона в ответ на действие стрессора был больше у подопытных животных по сравнению с контролем.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 18-00-00125).
Список литературы
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Онуфриев М.В., Моисеева Ю.В., Григорьян Г.А. Половые различия в оборонительном поведении взрослых крыс в ответ на ранний нейровоспалительный стресс. Журнал высшей нервной деятельности им. И.П. Павлова. 2020. 70: 259–276.
Григорьян Г.А., Гуляева Н.В. Моделирование депрессии на животных: методология, критерии оценки и классификации. Журнал высшей нервной деятельности им. И.П. Павлова. 2015. 65: 643–660.
Кудряшова И.В., Тишкина А.О., Гуляева Н.В. Неонатальный провоспалительный стресс и дефицит индукции долговременной потенциации в гиппокампе крыс: гендерные различия. Журнал высшей нервной деятельности им. И.П. Павлова. 2018. 68: 524–536.
Кудряшова И.В., Степаничев М.Ю., Гуляева Н.В. Неонатальный провоспалительный стресс и созревание межклеточной коммуникации в гиппокампе. Журнал высшей нервной деятельности им. И.П. Павлова. 2019. 69: 680–699.
Малиновская Н.А., Моргун А.В., Лопатина О.Л., Панина Ю.А., Волкова В.В., Гасымлы Э.Д., Таранушенко Т.Е., Салмина А.Б. Стресс раннего периода жизни: последствия для развития головного мозга. Журнал высшей нервной деятельности им. И.П. Павлова. 2016. 66: 643–668.
Манолова А.О., Степаничев М.Ю., Гуляева Н.В. Поведение крыс в тесте вынужденного плавания не является однозначным предиктором развития ангедонии при хроническом стрессе. Журнал высшей нервной деятельности им. И.П. Павлова. 2018. 68: 488–495.
Andersen S. Exposure to early adversity: Points of cross-species translation that can lead to improved understanding of depression. Dev. Psychopathol. 2015. 27: 477–491.
Avishai-Eliner S., Gilles E.E., Eghbal-Ahmadi M., Bar-El Y., Baram T.Z. Altered regulation of gene, protein expression of hypothalamic-pituitary-adrenal axis components in an immature rat model of chronic stress. J. Neuroendocrinol. 2001. 13: 799–807.
Arp J.M., Ter Horst J.P., Loi M., den Blaauwen J., Bangert E., Fernández G., Joëls M., Oitzl M.S., Krugers H.J. Blocking glucocorticoid receptors at adolescent age prevents enhanced freezing between repeated cue-exposures after conditioned fear in adult mice raised under chronic early life stress. Neurobiol. Learn. Mem. 2016. 133: 30–38.
Baram T.Z., Davis E.P., Obenaus A., Sandman C.A., Small S.L, Solodkin A., Stern H. Fragmentation, unpredictability of early-life experience in mental disorders. Am. J. Psychiatry. 2012. 169: 907–915.
Barnes C.A. Memory deficits associated with senescence: a neurophysiological and behavioral study in the rat. J. Comp. Physiol. Psychol. 1979. 93: 74–104.
Bath K.G., Manzano-Nieves G., Goodwill H. Early life stress accelerates behavioral, neural maturation of the hippocampus in male mice. Horm. Behav. 2016. 82: 64–71.
Bergman N.J. Birth practices: Maternal-neonate separation as a source of toxic stress. Birth Defects Res. 2019. 111: 1087–1109.
Bilbo S.D., Levkoff L.H., Mahoney J.H., Watkins L.R., Rudy J.W., Maier S.F. Neonatal infection induces memory impairments following an immune challenge in adulthood. Behav. Neurosci. 2005. 119: 293–301.
Bilbo S.D., Rudy J.W., Watkins L.R., Maier S.F. A behavioural characterization of neonatal infection-facilitated memory impairment in adult rats. Behav. Brain Res. 2006. 169: 39–47.
Brunson K.L., Kramár E., Lin B., Chen Y., Colgin L.L., Yanagihara T.K., Lynch G., Baram T.Z. Mechanisms of late-onset cognitive decline after early-life stress. J.Neurosci. 2005. 25: 9328–9338.
Commons K.G., Cholanians A.B., Babb J.A., Ehlinger D.G. The rodent forced swim test measures stress-coping strategy, not depression-like behavior. ACS Chem Neurosci. 2017. 8: 955–960.
Daskalakis N.P., Bagot R.C., Parker K.J., Vinkers C.H., de Kloet E.R. The three-hit concept of vulnerability and resilience: toward understanding adaptation to early-life adversity outcome. Psychoneuroendocrinology. 2013. 38: 1858–1873.
Dalle Molle R., Portella A., Goldani M., Kapczinski F., Leistner-Segala S., Salum G., Manfro G.G., Silveira P.P. Associations between parenting behavior, anxiety in a rodent model, a clinical sample: relationship to peripheral BDNF levels. Transl. Psychiatry. 2012. 2: e195.
de Kloet E.R., Meijer O.C., de Nicola A.F., de Rijk R.H., Joëls M. Importance of the brain corticosteroid receptor balance in metaplasticity, cognitive performance and neuro-inflammation. Front. Neuroendocrinol. 2018. 49: 124–145.
de Kloet E.R., Molendijk M.L. Coping with the forced swim stressor: towards understanding an adaptive mechanism. Neural Plast. 2016. 2016: 6503162.
Du Preez A., Leveson J., Zunszain P.A., Pariante C.M. Inflammatory insults and mental health consequences: does timing matter when it comes to depression? Psychol. Med. 2016. 46: 2041–2057.
Feldman R., Braun K., Champagne F.A. The neural mechanisms and consequences of paternal caregiving. Nat. Rev. Neurosci. 2019. 20: 205–224.
Gaudin J.M., Polansky N.A., Kilpatrick A.C., Shilton P. Family functioning in neglectful families. Child Abuse Neglect. 1996. 20: 363–377.
Gawel K., Gibula E., Marszalek-Grabska M., Filarowska J., Kotlinska J.H. Assessment of spatial learning and memory in the Barnes maze task in rodents-methodological consideration. Naunyn Schmiedebergs Arch/ Pharmacol. 2019. 392: 1–18.
Gilles E.E., Schultz L., Baram T.Z. Abnormal corticosterone regulation in an immature rat model of continuous chronic stress. Pediatric Neurol. 1996. 15: 114–119.
Guadagno A., Wong T.P., Walker C.-D. Morphological, functional changes in the preweaning basolateral amygdala induced by early chronic stress associate with anxiety, fear behavior in adult male, but not female rats. Progr. Neuro-Psychopharmacol. Biol. Psychiatry. 2018. 81: 25–37.
Ivy A.S., Brunson K.L., Sandman C., Baram T.Z. Dysfunctional nurturing behavior in rat dams with limited access to nesting material: a clinically relevant model for early-life stress. Neuroscience. 2008. 154: 1132–1142.
Kentner A.C., Pittman Q.J. Minireview: early-life programming by inflammation of the neuroendocrine system. Endocrinology. 2010. 151: 4602–4606.
Kraaijenvanger E.J., Pollok T.M., Monninger M., Kaiser A., Brandeis D., Banaschewski T., Holz N.E. Impact of early life adversities on human brain functioning: A coordinate-based meta-analysis. Neurosci. Biobehav. Rev. 2020. 113: 62–76.
Krugers H.J., Arp J.M., Xiong H., Kanatsou S., Lesuis S.L., Korosi A., Joels M., Lucassen P.J. Early life adversity: Lasting consequences for emotional learning. Neurobiol. Stress. 2016. 6: 14–21.
Kudryashova I., Stepanichev M., Manolova A., Gulyaeva N. Deficit of Long-Term Potentiation Induction, but not maintenance, in the juvenile hippocampus after neonatal proinflammatory stress. Dev Neurosci. 2019; 41 (5–6): 318–326.
Lee G., Goosens K.A. Sampling blood from the lateral tail vein of the rat// Journal of visualized experiments. JoVE. 2015. 99: e52766.
Lesse A., Rether K., Gröger N., Braun K., Bock J. Chronic postnatal stress induces depressive-like behavior in male mice and programs second-hit stress-induced gene expression patterns of OxtR and AvpR1a in adulthood. Mol. Neurobiol. 2017. 54: 4813–4819.
McLaughlin R.J., Verlezza S., Gray J.M., Hill M.N., Walker C.D. Inhibition of anandamide hydrolysis dampens the neuroendocrine response to stress in neonatal rats subjected to suboptimal rearing conditions. Stress. 2016. 19: 114–124.
Molendijk M.L., de Kloet E.R. Coping with the forced swim stressor: Current state-of-the-art. Behav. Brain Res. 2019. 364: 1–10.
Molet J., Maras P.M., Avishai-Eliner S., Baram T.Z. Naturalistic rodent models of chronic early-life stress. Dev. Psychobiol. 2014. 56: 1675–1688.
Moriceau S., Shionoya K., Jakubs K., Sullivan R.M. Early-life stress disrupts attachment learning: the role of amygdala corticosterone, locus ceruleus corticotropin releasing hormone, olfactory bulb norepinephrine. J. Neurosci. 2009. 29: 15745–15755.
Moussaoui N., Jacobs J.P., Larauche M., Biraud M., Million M., Mayer E., Taché Y. Chronic early-life stress in rat pups alters basal corticosterone, intestinal permeability, fecal microbiota at weaning: influence of sex. J. Neurogastroenterol. Motility. 2017. 23: 135–143.
Naninck E.F.G., Hoeijmakers L., Kakava-Georgiadou N., Meesters A., Lazic S.E., Lucassen P.J., Korossi A. Chronic early life stress alters developmental, adult neurogenesis, impairs cognitive function in mice. Hippocampus. 2015. 25: 309–328.
Onufriev M.V., Freiman S.V., Peregud D.I., Kudryashova I.V., Tishkina, A.O., Stepanichev M.Yu., Gulyaeva N.V. Neonatal proinflammatory stress induces accumulation of corticosterone and interleukin-6 in the hippocampus of juvenile rats: Potential mechanism of synaptic plasticity impairments. Biochemistry (Moscow). 2017. 82: 275–281.
Raineki C., Cortés M.R., Belnoue L., Sullivan R.M. Effects of early-life abuse differ across development: infant social behavior deficits are followed by adolescent depressive-like behaviors mediated by the amygdala. J. Neurosci. 2012. 32: 7758–7765.
Raineki C., Moriceau S., Sullivan R.M. Developing a neurobehavioral animal model of infant attachment to an abusive caregiver. Biol. Psychiatry. 2010. 67: 1137–1145.
Raineki C., Sarro E., Rincón-Cortés M., Perry R., Boggs J., Holman C.J., Wilson D.A., Sullivan R.M. Paradoxical neurobehavioral rescue by memories of early-life abuse: The safety signal value of odors learned during abusive attachment. Neuropsychopharmacology. 2015. 40: 906–914.
Rehm J., Shield K.D. Global burden of disease and the impact of mental and addictive disorders. Curr. Psychiatry Rep. 2019. 21 (2): 10.
Rice C., Sandman C.A., Lenjavi M.R., Baram T.Z. A novel mouse model for acute, long-lasting consequences of early life stress. Endocrinology. 2008. 149: 4892–4900.
Rincón-Cortés M., Sullivan R. Emergence of social behavior deficit, blunted corticolimbic activity, adult depression-like behavior in a rodent model of maternal maltreatment.Transl. Psychiatry. 2016. 6: e930.
Robinson E.S.J. Translational new approaches for investigating mood disorders in rodents and what they may reveal about the underlying neurobiology of major depressive disorder. Phil. Trans. R. Soc. B. 2018. 373: 20170036.
Stepanichev M., Dygalo N.N., Grigoryan G., Shishkina G.T., Gulyaeva N. Rodent models of depression: neurotrophic and neuroinflammatory biomarkers. BioMed Res. Int. 2014. 2014: 932757.
Stepanichev M.Y., Tishkina A.O., Novikova M.R., Levshina I.P., Freiman S.V., Onufriev M.V., Levchenko O.A., Lazareva N.A., Gulyaeva N.V. Anhedonia but not passive floating is an indicator of depressive-like behavior in two chronic stress paradigms. Acta Neurobiol. Exp. (Wars). 2016. 76: 324–333.
Tishkina A., Stepanichev M., Kudryashova I., Freiman S., Onufriev M., Lazareva N., Gulyaeva N. Neonatal proinflammatory challenge in male Wistar rats: Effects on behavior, synaptic plasticity, and adrenocortical stress response. Behav. Brain Res. 2016. 304: 1–10.
Vigo D., Thornicroft G., Atun R. Estimating the true global burden of mental illness. Lancet Psychiatry. 2016. 3: 171–178.
Walker C., Bath K.G., Joels M., Korosi A., Larauche M., Lucassen P.J., Morris M.J., Raineki C., Roth T.L., Sullivan R.M., Taché Y.F., Baram T.Z. Chronic early life stress induced by limited bedding, nesting (LBN) material in rodents: critical considerations of methodology, outcomes, translational potential. Stress. 2017. 20: 421–448.
Wang K.C., Fan L.W., Kaizaki A., Pang Y., Cai Z., Tien L.T. Neonatal lipopolysaccharide exposure induces long-lasting learning impairment, less anxiety-like response, hippocampal injury in adult rats. Neuroscience. 2013. 234: 146–157.
Whipple E.E., Webster-Stratton C. The role of parental stress in physically abusive families. Child Abuse Neglect. 1991. 15: 279–291.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


