Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 3, стр. 428-436
Ассоциированные с возрастом изменения исследовательской активности в тесте “открытое поле” у крыс, переживших пренатальную гипоксию
В. А. Стратилов 1, О. В. Ветровой 1, 2, Л. А. Ватаева 3, Е. И. Тюлькова 1, *
1 ФГБУН Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Биологичекий факультет Санкт-Петербургского государственного университета
Санкт-Петербург, Россия
3 Российский государственный педагогический университет им. А.И. Герцена
Санкт-Петербург, Россия
* E-mail: etylkova@yandex.ru
Поступила в редакцию 25.11.2020
После доработки 27.01.2021
Принята к публикации 03.02.2021
Аннотация
Многочисленные исследования показывают, что стресс во время беременности может оказывать неблагоприятное влияние на развитие мозга и являться причиной нарушения поведения и способности к обучению у потомства. Последствия влияний стрессовых факторов в пренатальный период проявляются на протяжении всей жизни, усугубляясь с возрастом и ведя к преждевременному старению и смертности. Гипоксия является одной из наиболее распространенных форм перинатального стресса. Целью настоящей работы было выявление возрастных особенностей поведения 3-месячных взрослых и 18-месячных стареющих самцов крыс в тесте “Открытое поле” в норме и после воздействия тяжелой гипобарической гипоксии на 14–16-е сутки пренатального онтогенеза (пренатальная гипоксия, ПГ). Показано, что у взрослых крыс ПГ приводит к изменениям ориентировочно-исследовательского поведения и снижению двигательной активности в первый день тестирования. У старых ПГ-крыс наблюдается еще большее угнетение ориентировочно-исследовательского поведения. При повторном тестировании у ПГ-животных не обнаруживается снижения исследовательской активности, что свидетельствует о нарушениях памяти. Таким образом, пренатальная гипоксия вызывает прогрессирующие с возрастом изменения ориентировочно-исследовательского поведения и обстановочной памяти.
Эмбриональный период является сенситивным периодом, во время которого происходит долговременная “настройка” контроля активности генов под определенную среду. Согласно концепции раннего эпигенетического “программирования” в эмбриональный период факторы внешней и внутренней среды при участии эпигенетических механизмов способны оказывать модифицирующие влияния на процесс реализации генетических программ, тем самым обеспечивая долговременные изменения в развитии организма. Эпигенетические процессы, происходящие в эмбриональный период, могут закрепиться и сохраняться в течение длительного времени и стать причиной развития различных патологических состояний в дальнейшем (Li et al., 2012).
Многочисленные исследования показали, что последствия воздействия стрессовых факторов в период пренатального онтогенеза, проявляясь уже в младенчестве, сохраняются у взрослых и усугубляются с возрастом, приводя к преждевременному старению и ранней смертности (Dudley et al., 2011; Xiong, Zhang, 2013; Warner, Ozanne, 2010; Langley-Evans, McMullen, 2010; Vetrovoy, 2021а). Гипоксия является одной из наиболее распространенных форм пренатального стресса (Zhang, 2013; Vetrovoy, 2021б). Гипоксия плода возможна при различных условиях, включая пребывание в условиях высокогорья при беременности, беременность с анемией, плацентарной недостаточностью, сдавлением пуповины, преэклампсией, заболеваниями сердца, легких и почек, а также при гемоглобинопатиях (Tomalski, Johnson, 2010; Li et al., 2012; Piešová, Mach, 2020). Нарушения развития мозга, вызванные гипоксией и асфиксией, встречаются примерно у 2% доношенных и почти у 60% недоношенных новорожденных детей. В процессе взросления эти нарушения проявляются в проблемах с обучением, нарушениях памяти и внимания, приводя к формированию неврологических и нейропсихологических заболеваний, в том числе болезни Альцгеймера, биполярного расстройства и шизофрении (Graham et al., 2008; Kurinczuk et al., 2010; Berridge, 2013, 2014; Piešová, Mach, 2020).
Одним из наиболее актуальных вопросов для современного общества является тенденция демографического старения населения вследствие роста продолжительности жизни и снижения рождаемости. Старение изменяет физиологические и патологические состояния организма, при этом конкретные проявления нарушений, вызванные воздействием различных стрессовых факторов в раннем онтогенезе, также могут меняться с возрастом. Изучение такого рода нарушений требует модельных экспериментов на животных (Панкова, Латанов, 2019).
Тест “Открытое поле” позволяет исследовать особенности двигательной и ориентировочно-исследовательской активности, а также эмоционального состояния (тревожности) животных. Цель данной работы: выявить возрастные особенности поведения 3-месячных взрослых и 18-месячных стареющих самцов крыс в тесте “Открытое поле” в норме и после воздействия тяжелой гипобарической гипоксии в пренатальный период (пренатальная гипоксия, ПГ).
МЕТОДИКА
В работе использовали крыс линии Вистар из Биоколлекции Института физиологии им. И.П. Павлова РАН. При проведении экспериментов соблюдали требования, сформулированные в Директивах Совета Европейского сообщества (86/609/ЕЕС) об использовании животных для экспериментальных исследований. Протоколы экспериментов были утверждены Комиссией по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН.
Модель пренатальной гипоксии. Животные были рождены интактными самками и самками, которых на 14–16-е сутки беременности подвергали действию тяжелой гипобарической гипоксии (пренатальная гипоксия, ПГ). Для создания тяжелой гипоксии беременных самок помещали в барокамеру проточного типа при температуре от 20° до 25°С и ступенчато понижали давление до 180 мм рт.ст. (продолжительность воздействия – по 3 ч в течение 3 сут с интервалом 24 ч между сеансами).
Крысят отлучали от кормившей их матери в возрасте 30 сут. После отлучения крысы находились в клетках размером 60 × 30 × 20 см, максимальное количество животных в клетке составляло 6 особей. Животные отбирались из разных пометов и комбинировались случайным образом. В течение всего периода проведения экспериментов крысы содержались при режиме свет/темнота 12:12 ч, температуре 20–23°С и при постоянном доступе к воде и пище. В настоящей работе эксперименты были поставлены на 3-месячных молодых половозрелых самцах с активным сперматогенезом и 18-месячных стареющих самцах контрольных и ПГ-крыс. Для каждой временной точки были использованы животные из разных пометов. Воспроизводимость результатов была оценена в двух независимых экспериментах.
Тестирование в “Открытом поле”. Эксперименты проводили в помещении, ограниченном от поступления посторонних шумов. “Открытое поле”, изготовленное ООО “НПК Открытая Наука” (OpenScience Ltr), представляло собой круглую арену диаметром 97 см с высотой стенок 42 см. Область арены поделена на 12 секций периферической зоны и 7 секций центральной зоны. Длительность теста 5 мин. Тестирование осуществлялось в течение двух дней подряд. Оценивали: 1) ориентировочно-исследовательскую реакцию по числу пересеченных квадратов в центре (центральная активность) и по периферии (латеральная активность) и по числу вертикальных стоек с упором и без упора (вертикальная двигательная активность); 2) уровень тревожности оценивали по частоте выходов в центр поля, времени груминга и количеству болюсов.
Тестирование проводилось на 10 контрольных и 8 переживших ПГ 3-месячных самцах, а также на 8 контрольных и 8 переживших ПГ 18-месячных самцах.
Статистическая обработка. Полученные результаты обработаны количественно с применением двухфакторного дисперсионного анализа посредством программного пакета для статистической обработки “Prism 9”. Нормальность распределения каждой выборки оценивалась критерием Д’Агостино-Пирсона и построением графиков квантиль-квантиль (QQ plot). В случае наличия у сравниваемых групп нормального распределения использовали двухфакторный дисперсионный анализ ANOVA для факторов группы и дня (День 1/День 2). Однородность дисперсий оценивалась построением графиков гомоскедастичности. В случае статистически значимого эффекта фактора группы для дальнейшей оценки различий между группами при post-hoc анализе использовали тест Тьюки. Для post-hoc сравнения между днями в пределах групп в случае статистически значимого эффекта фактора дня использовали тест Сидака. В случае отсутствия у сравниваемых групп нормального распределения использовался непараметрический критерий Краскела–Уоллиса с post-hoc тестом Данна (для оценки центральной активности у всех исследуемых групп) и тест Манна–Уитни для оценки вертикальной активности у старых животных. Различия между группами признавались достоверными при р < 0.05. Данные на рисунках представлены в виде среднего ± стандартное отклонение. Данные в тексте представлены в виде среднего ± стандартная ошибка среднего, на рисунках – в виде среднего ± стандартное отклонение.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
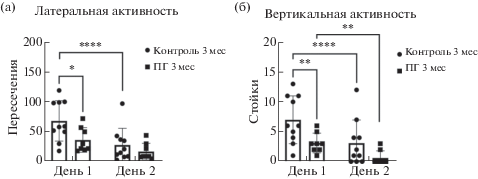
На рис. 1 представлены данные, характеризующие влияние воздействия гипоксии в пренатальный период на поведение 3-месячных крыс в “Открытом поле”. В первый день тестирования у ПГ-крыс выявлено достоверное снижение по сравнению с контролем латеральной (36.37 ± 7.24 и 68.3 ± 10.64 пересечений периферических квадратов для групп ПГ и контроль соответственно; p < 0.05, n = = 8–10, тест Тьюки) (рис. 1 (а)) и вертикальной двигательной активности (3.13 ± 0.58 и 7 ± 1.26 стоек с упором для групп ПГ и контроль соответственно; p < 0.01, n = 8–10, тест Сидака) (рис. 1 (б)). Было также показано, что крысы независимо от группы на 2-й день тестирования проявляют более низкий уровень вертикальной активности, чем в 1-й (для контрольной группы p < 0.005, n = 10; для группы ПГ p < 0.05, n = 8, тест Сидака) (рис. 1 (б)). Снижение латеральной активности на 2-й день было достоверно только у контрольной группы (p < 0.01, n = 10, тест Сидака). У ПГ-крыс изначально низкий уровень латеральной активности достоверно не изменялся (рис. 1 (а)). По количеству стоек без упора и пересеченных квадратов в центре, актов груминга и количеству оставленных на поле болюсов (дефекаций) достоверных различий между взрослыми контрольными и ПГ-крысами выявлено не было.
Рис. 1.
Влияние пренатальной гипоксии на поведение 3-месячных крыс в тесте “Открытое поле”. На рисунке представлены результаты измерения (а) латеральной (выражено в количестве пересечений периферических квадратов) и (б) вертикальной (выражено в количестве стоек с упором) активности взрослых 3-месячных контрольных и ПГ-крыс на протяжении двух последовательных дней эксперимента в “Открытом поле”. * – p < 0.05, ** – p < 0.01, *** – p < 0.005, **** – p < 0.0001, тест Тьюки для сравнения между группами, тест Сидака для сравнения между днями внутри группы.
Fig. 1. Influence of prenatal hypoxia on the behavior of 3-month-old rats in the “open field” test. The figure shows the results of measuring (а) lateral (expressed in the number of intersections of peripheral squares) and (б) vertical (expressed in the number of racks with support) activity of adult 3-month-old control and PH rats during two consecutive days of the experiment in the “open field” test. * – p < 0.05, ** – p < 0.01, *** – p < 0.005, **** – p < 0.0001, Tukey’s test for comparison between groups, Sidak’s test for comparison between days within a group.
На рис. 2 представлены данные, характеризующие влияние воздействия гипоксии в пренатальный период на поведение стареющих 18-месячных крыс в “Открытом поле”. В первый день тестирования не было выявлено достоверных различий в центральной активности между ПГ-крысами и контролем (1.25 ± 0.16 и 1.75 ± 0.31 пересечений центральных квадратов для групп ПГ и контроль соответственно; p > 0.05, n = 8, тест Манна–Уитни) (рис. 2 (а)). На 2-й день тестирования для ПГ-крыс также показано отсутствие изменений центральной активности относительно контроля (1.12 ± 0.12 и 2.37 ± 0.53 пересечений центральных квадратов для групп ПГ и контроль соответственно; p > 0.05, n = 8, тест Манна–Уитни) (рис. 2 (а)). При исследовании латеральной активности 18-месячных животных не выявлено достоверных различий между ПГ и контролем ни на 1-й, ни на 2-й дни тестирования (на 1-й и 2-й дни тестирования p = 0.48 и p = 0.91 соответственно, n = 8, тест Тьюки) (рис. 2 (а)). На 1-й, но не на 2-й день эксперимента, стареющие ПГ-крысы продемонстрировали сниженную вертикальную активность по сравнению с контролем (1.87 ± 1.31 и 3.75 ± 0.45 стоек с упором для групп ПГ и контроль на 1-й день тестирования соответственно; p < 0.005, n = 8, тест Манна–Уитни) (рис. 2 (б)).
Рис. 2.
Влияние пренатальной гипоксии на поведение 18-месячных крыс в тесте “Открытое поле”. На рисунке представлены результаты измерения (а) латеральной (выражено в количестве пересечений периферических квадратов) и (б) вертикальной (выражено в количестве стоек с упором) активности стареющих 18-месячных контрольных и ПГ-крыс на протяжении двух последовательных дней эксперимента в “Открытом поле”. * – p < 0.05, ** – p < 0.01, *** – p < 0.005, **** – p < < 0.0001, тест Тьюки для сравнения латеральной активности между группами, тест Сидака для сравнений латеральной активности между днями внутри группы, тест Манна–Уитни для сравнения вертикальной активности между группами, тест Вилкоксона для сравнения вертикальной активности между днями внутри групп.
Fig. 2. Influence of prenatal hypoxia on the behavior of 18-month-old rats in the “open field” test. The figure shows the results of measuring (а) the lateral (expressed in the number of intersections of the peripheral squares) and (б) vertical (expressed in the number of postures with support on walls) activity of aged 18-month-old control and PH rats during two consecutive days of the experiment in the “open field” test. * – p < 0.05, ** – p < 0.01, *** – p < 0.005, **** – p < 0.0001, Tukey’s test for comparison between groups in lateral activity, Sidak’s test for comparison between days within a group in lateral activity, Mann–Whitney test for comparison of vertical activity between groups, Wilcoxon test for comparison of vertical activity between days within a group.
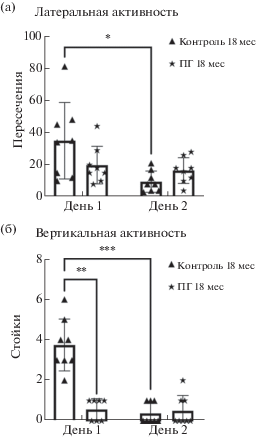
У 18-месячных контрольных крыс было выявлено достоверное снижение латеральной (p < 0.01, n = 8, тест Сидака) и вертикальной активности (p < 0.005, n = 8, тест Вилкоксона) на 2-й день тестирования по сравнению с первым днем (рис. 2 (а); 2 (б)). У ПГ-крыс достоверных изменений показателей латеральной и вертикальной активности между днями не выявлено (p = 0.98, n = 8, тест Сидака, и p > 0.9999, n = 8, тест Вилкоксона, соответственно) (рис. 2 (а); 2 (б)). По центральной активности, количеству стоек без упора, актов груминга и количеству оставленных на поле болюсов (дефекаций) достоверных различий между стареющими контрольными и ПГ-крысами выявлено не было.
На рис. 3 представлены результаты сравнения поведения взрослых 3-месячных и стареющих 18-месячных крыс. Было выявлено снижение уровня латеральной и вертикальной активности в 1-й день тестирования 18-месячных контрольных крыс по сравнению с контролем 3-месячного возраста (для всех сравнений p < 0.05, тест Тьюки) (рис. 3 (а); 3 (б)). В группе 18-месячных ПГ-крыс не выявлено изменений латеральной и вертикальной активности по сравнению с 3-месячными животными этой группы (для латеральной и вертикальной активности p = 0.55 и p = 0.14 соответственно, n = 8, тест Тьюки) (рис. 3 (а); 3 (б)).
Рис. 3.
Сравнение показателей поведения 3- и 18-месячных крыс в тесте “Открытое поле”. На рисунке представлены результаты сравнения (а) латеральной (выражено в количестве пересечений периферических квадратов), (б) вертикальной (выражено в количестве стоек с упором) активности, а также (в) уровня дефекации (выражено в количестве болюсов) взрослых 3-месячных и стареющих 18-месячных контрольных и ПГ-крыс на протяжении двух последовательных дней эксперимента в “Открытом поле”. * – p < 0.05, ** – p < 0.01, *** – p < 0.005, **** – p < 0.0001, тест Тьюки для сравнения между группами.
Fig. 3. Comparison of the behavioral indicators of 3- and 18-month-old rats in the “open field” test. The figure shows the results of comparison of (а) lateral (expressed in the number of intersections of peripheral squares), (б) vertical (expressed in the number of postures with support on walls) activity, as well as (в) the level of defecation (expressed in the number of boluses) of 3-month-old adults and aged 18-month-old control and PH rats during two consecutive days of the experiment in the “open field” test. * – p < 0.05, ** – p < 0.01, *** – p < 0.005, **** – p < 0.0001, Tukey’s test for comparison between groups.
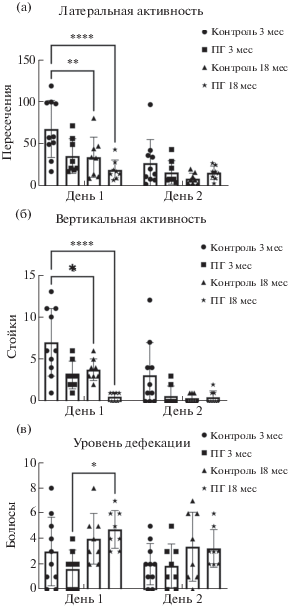
По количеству оставленных на поле болюсов (количеству актов дефекации) были выявлены достоверные различия между 18-месячными и 3-месячными крысами экспериментальной группы в первый день тестирования (p < 0.05, тест Тьюки) (рис. 3 (в)).
При проведении двухфакторного дисперсионного анализа было выявлено влияние фактора группы (F (3, 30) = 5.117, p = 0.0056) и фактора дня тестирования (F (1, 30) = 32.24, p < 0.0001) на латеральную активность для всех сравниваемых групп (3 и 18 мес), а также фактора группы (F (1, 16) = 5.553, p = 0.0315) и дня тестирования (F (1, 16) = 29.45, p < 0.0001) на вертикальную активность у 3-месячных животных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Последствия пренатального стресса изучаются в различных аспектах. Целый ряд исследований был посвящен изучению последствий стресса, перенесенного матерью во время беременности, для ребенка. Многочисленные работы были проведены на беременных экспериментальных животных. Благодаря этим исследованиям становится все более очевидной роль пренатального стресса в развитии нарушений эмоциональной сферы и поведения. Тест “Открытое поле” активно применяется для оценки уровня тревожности, исследовательской активности и локомоции животных в незнакомой обстановке. Поэтому в настоящей работе было сочтено целесообразным использовать тест “Открытое поле” для исследования проявления возрастных особенностей поведения крыс, переживших пренатальную гипоксию.
На протяжении нескольких лет, занимаясь изучением последствий влияния пренатальной гипоксии на крысах, особое внимание мы уделяли зависимости выраженности возможных нарушений от срока беременности в период стрессового воздействия. Как в неокортексе, так и в гиппокампе крыс на 14–16-е сутки гестации происходит активное деление клеток-предшественников и их миграция (Vasilev et al., 2016). В этот период закладываются все области гиппокампа (Bayer, 1980а, 1980б) и формируются V, VI слои неокортекса (Dehay, Kennedy, 2007). У потомков крыс, испытавших воздействие гипоксии на третьей неделе беременности, были выявлены связи между воздействием стрессовых факторов в различные сроки пренатального онтогенеза и конкретными изменениями как на поведенческом, так и на молекулярном уровне у взрослых животных (Тюлькова и др., 2010; 2015а, 2015б, Vetrovoy, 2021а, 2021б). При этом наиболее значимые изменения развития мозга происходят, если гипоксия предъявляется на 14–16-е сутки гестации. 14–16–е сутки гестации крыс соответствуют 5–7-й неделе беременности человека (Bayer et al., 1993; Golan, Huleihel, 2006).
В настоящем исследовании было показано, что пренатальная гипоксия приводит к изменениям ориентировочно-исследовательского поведения у 3-месячных взрослых крыс. При повторном тестировании у экспериментальных животных не обнаруживается снижения исследовательской активности, что, возможно, может свидетельствовать о нарушениях памяти. Мы наблюдали не только снижение двигательной активности в первый день тестирования, но и отсутствие научения при повторном тестировании, что можно характеризовать как отсутствие привыкания. Нарушения ориентировочно-исследовательского поведения отражают изменения функциональной активности нейронов в результате воздействия тяжелой гипоксии в пренатальном периоде развития (Vetrovoy et al., 2021а).
В представленной работе показано, что пренатальная гипоксия вызывает снижение ориентировочно-исследовательского поведения у 18-месячных крыс. При повторном тестировании у экспериментальных животных не обнаруживается снижение исследовательской активности, что свидетельствует о нарушениях памяти.
Одним из общих механизмов, с помощью которого материнский стресс может быть связан с фенотипическими изменениями в дальнейшей жизни, является эпигенетическое программирование, которое играет центральную роль в определении функционального выхода информации, хранящейся в геноме. Достаточно доказательств участия эпигенетической регуляции в реакции плода на внутриутробный стресс, приводящий к долгосрочным изменениям профилей экспрессии генов, которые потенциально приводят к заболеваниям в более позднем возрасте (Gluckman et al., 2008; Egger et al., 2004; Chen, Zhang, 2011; Ducsay et al., 2018). Ранее нами было показано, что воздействие гипоксии, а также введение синтетических глюкокортикоидов с целью моделирования пренатального стресса на 14–16-е сутки пренатального онтогенеза, вызывают долгосрочные эпигенетические модификации, а именно: метилирование ДНК, гистона Н3 по лизину 4 и 9, ацетилирование гистона Н3 по лизину 24 (Tyul’kova et al., 2020; Tyulkova et al., 2017; Ветровой и др., 2020а). Оказалось, что основные изменения проявляются в основном в отдаленные сроки после воздействия, а именно в гиппокампе и неокортексе мозга 18-месячных старых крыс. Обнаруженные эпигенетические модификации в гиппокампе и нео-кортексе после тяжелой гипобарической гипоксии на 14–16-е сутки пренатального онтогенеза коррелируют с показанными нами ранее нарушениями экспрессии глюко- и минералокортикоидных рецепторов, регулирующих экспрессию генов-мишеней, в том числе транскрипционных факторов HIF1α, снижение уровня которого у старых животных (Тюлькова и др., 2018, Ветровой и др., 2020б) говорит об ослаблении способности к адаптации. Отсроченные изменения степени метилирования гистона Н3 могут обусловливать усиливающиеся с возрастом нарушения функциональной активности мозга, приводящие к ослаблению памяти и способности к обучению животных, подвергавшихся действию тяжелой гипобарической гипоксии. Кроме того, снижение ориентировочно-исследовательского поведения и памяти у стареющих ПГ-крыс может отражать обнаруженное нами уменьшение количества нейронов в гиппокампе 18-месячных экспериментальных, но не контрольных крыс (Vetrovoy et al., 2021a).
В предыдущих работах показано, что воздействие гипоксии в пренатальном периоде, в отличие от воздействия дексаметазона, не влияет на формирование следа памяти взрослых крыс на страх (Vataeva et al., 2018), но приводит к нарушениям пространственного обучения в лабиринте Морриса (Тюлькова и др., 2015а). Отмечалось, что, в отличие от введения синтетического гормона дексаметазона на 14–16-е сутки пренатального онтогенеза, гипоксия в те же сроки не влияла на эмоциональную сферу животных (Vataeva et al., 2018).
ЗАКЛЮЧЕНИЕ
Таким образом, полученные данные в тесте “Открытое поле” свидетельствуют о том, что гипобарическая гипоксия, предъявляемая в пренатальном онтогенезе, вызывает длительные модификации в поведении потомства. При этом нарушения поведения взрослых крыс вследствие гипоксии, предъявляемой на 14–16-е сутки гестации, усиливаются в старости. Повреждающие воздействия в период формирования гиппокампа и неокортекса могут служить причиной раннего старения мозга.
Работа выполнена при поддержке гранта РФФИ № 19-315-90003.
Список литературы
Ветровой О.В., Тюлькова Е.И., Стратилов В.А., Ватаева Л.А. Пренатальное введение дексаметазона вызывает нарушение глюкокортикоидной обратной связи, ассоциированное с изменением количества кортикостероидных рецепторов в экстрагипоталамических структурах мозга взрослых крыс. Цитология. 2020а. 62 (7): 511–521.
Ветровой О.В., Нимирицкий П.П., Тюлькова Е.И., Рыбникова Е.А. Увеличение содержания гипоксия-индуцируемого фактора HIF1α и интенсивности HIF1-зависимой транскрипции сохраняются у новорожденных крысят, переживших пренатальную гипоксию на 14–16-е сутки эмбриогенеза. Нейрохимия. 2020б. 37 (3): 228–232.
Панкова Н.Б., Латанов Л.В. Развивающийся мозг как мишень экспериментального воздействия при моделировании патологических процессов. Журнал высшей нервной деятельности им. И.П. Павлова. 2019. 69 (4): 413–436.
Тюлькова Е.И., Ватаева Л.А., Ветровой О.В. Воздействия повреждающих факторов в пренатальном онтогенезе могут приводить к раннему старению. Детская медицина Северо-Запада. 2018. 7 (1): 319–320.
Тюлькова Е.И., Ватаева Л.А., Ветровой О.В., Романовский Д.Ю. Пренатальная гипоксия модифицирует рабочую память и активности полифосфоинозитидной системы гиппокампа крыс. Журн. эволюц. биохим. и физиол. им. И.М. Сеченова. 2015а. 51 (2): 115–121.
Тюлькова Е.И., Ватаева Л.А., Самойлов М.О., Отеллин В.А. Механизмы формирования реакций мозга на действие гипобарической гипоксии в различные сроки пренатального периода развития у крыс. Журнал акушерства и женских болезней. 2010. 59 (4): 99–110.
Тюлькова Е.И., Кислин М.С., Ватаева Л.А. Влияние пренатальной гипобарической гипоксии на уровень перекисного окисления липидов в неокортексе и гиппокампе крыс. Нейрохимия. 2015б. 32 (1): 64–70.
Bayer S.A. Development of the hippocampal region in the rat. II. Morphogenesis during embryonic and early postnatal life J. Comp. Neurol. 190 (1–2): 115–134. 1980a.
Bayer S.A. Development of the hippocampal region in the rat. I. Neurogenesis examined with 3H-thymidine autoradiography J. Comp. Neurol. 190 (1–2): 87–114. 1980б.
Bayer S.A., Altman J., Russo R.J., Zhang X. Timetables of neurogenesis in the human brain based on experimentally determined patterns in the rat. Neurotoxcology. 1993. 14 (1): 83–144.
Berridge M.J. Calcium signalling and psychiatric disease: bipolar disorder and schizophrenia. Cell Tissue Res. 2014. 357 (2): 477–92.
Berridge M.J. Dysregulation of neural calcium signaling in Alzheimer disease, bipolar disorder and schizophrenia. Prion. 2013. 7 (1): 2–13.
Chen M., Zhang L. Epigenetic mechanisms in developmental programming of adult disease Drug. Discov. Today. 2011. 16: 1007–1018.
Dehay C., Kennedy H. Cell-cycle control and cortical development. Nature Reviews Neuroscience. 2007. 8: 438–450.
Ducsay C.A., Goyal R., Pearce W.J., Wilson S., Hu X.Q., Zhang L. Gestational Hypoxia and Developmental Plasticity. Physiol Rev. 2018. 98 (3): 1241–1334.
Dudley K.J., Li X., Kobor M.S., Kippin T.E., Bredy T.W. Epigenetic mechanisms mediating vulnerability and resilience to psychiatric disorders. Neurosci Biobehav Rev. 2011. 35: 1544–1551.
Egger G., Liang G., Aparicio A., Jones P.A. Epigenetics in human disease and prospects for epigenetic therapy. Nature. 2004. 429: 457–463.
Gluckman P.D., Hanson M.A., Cooper C., Thornburg K.L. Effect of in utero and early-life conditions on adult health and disease. N. Engl. J. Med. 2008. 359: 61–73.
Golan H., Huleihel M. The effect of prenatal hypoxia on brain development: short- and long-term consequences demonstrated in rodent models. Developmental Science. 2006. 9 (4): 338–349.
Graham E.M., Ruis K.A., Hartman A.L., Northington F.J., Fox H.E. A systematic review of the role of intrapartum hypoxia-ischemia in the causation of neonatal encephalopathy. Am J Obstet Gynecol. 2008. 199: 587–595.
Kurinczuk J.J., White-Koning M., Badawi N. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic encephalopathy. Early Human Devel. 2010. 86: 329–338.
Langley-Evans S.C., McMullen S. Developmental origins of adult disease. Med. Princ. Pract. 2010. 19: 87–98.
Li Y., Gonzalez P., Zhang L. Fetal stress and programming of hypoxic/ischemic-sensitive phenotype in the neonatal brain: mechanisms and possible interventions. Prog Neurobiol . 2012. 98 (2): 145–165.
Piešová M., Mach M. Impact of perinatal hypoxia on the developing brain. Physiol Res. 2020. 69 (2): 199–213.
Tomalski P., Johnson M.H. The effects of early adversity on the adult and developing brain. Curr Opin Psych. 2010. 23: 233–238.
Tyul’kova E.I., Vataeva L.A., Stratilov V.A., Barysheva V.S., Vetrovoy O.V. Peculiarities of DNA and Histone H3 Methylation in the Hippocampus and Neocortex of Rats Subjected to Pathological Treatments during the Prenatal Period. Neurochemical Journal. 2020. 14 (1): 64–72.
Tyulkova E.I., Vetrovoy O.V., Sarieva K.V., Vataeva L.A., Glushchenko T.S. The characteristics of acetylation of histone H3 at Lys24 in the hippocampus and neocortex of rats that were exposed to hypoxic stress at different stages of prenatal development. Neurochemical Journal. 2017. 11 (4): 309–314.
Vasilev D.S., Dubrovskaya N.M., Tumanova N.L., Zhuravin I.A. Prenatal hypoxia in different periods of embryogenesis differentially affects cell migration, neuronal plasticity and rat behavior in postnatal ontogenesis. Frontiers in Neuroscience. 2016. 10: 126.
Vataeva L.A., Tyulkova E.I., Alekhin A.N., Stratilov V.A. Effects of Hypoxia or Dexamethasone at Different Gestation Periods on Fear Conditioning in Adult Rats. Journal of Evolutionary Biochemistry and Physiology. 2018. 54 (6): 442–448.
Vetrovoy O., Stratilov V., Nimiritsky P., Makarevich P., Tyulkova E. Prenatal hypoxia induces premature aging accompanied by disturbed function of glutamatergic system in rat hippocampus. Neurochemical Research. 2021a. https://doi.org/10.1007/s11064-020-03191-z
Vetrovoy O., Tyulkova E., Stratilov V., Baranova K., Nimiritsky P., Makarevich P., Rybnikova E. Long-term effects of the prenatal severe hypoxia on central and peripheral components of the glucocorticoid system in rats. Developmental Neuroscience. 2021б. https://doi.org/10.1159/000512223
Warner M.J., Ozanne S.E. Mechanisms involved in the developmental programming of adulthood disease. Biochem. J. 2010. 42: 333–347.
Xiong F., Zhang L. Role of the hypothalamic-pituitary-adrenal axis in developmental programming of health and disease. Frontiers in neuroendocrinology. 2013. 34: 27–46.
Yong Li, Pablo Gonzalez, Lubo Zhang. Fetal Stress and Programming of Hypoxic/Ischemic-Sensitive Phenotype in the Neonatal Brain: Mechanisms and Possible Interventions. Prog Neurobiol. 2012. 98 (2): 145–165.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


