Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 1, стр. 114-125
Влияние раннего провоспалительного стресса на проявление импульсивного поведения у крыс разного возраста и пола
В. А. Груздева 1, А. В. Шаркова 1, М. И. Зайченко 1, *, Г. А. Григорьян 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии Российской академии наук
Москва, Россия
* E-mail: mariya-zajchenko@yandex.ru
Поступила в редакцию 19.04.2020
После доработки 08.09.2020
Принята к публикации 05.10.2020
Аннотация
В опытах на крысах линии Вистар исследовали проявления импульсивного поведения в зависимости от возраста и пола у трех групп животных. Одной группе в возрасте трех и пяти дней вводили подкожно провоспалительный бактериальный липополисахарид, ЛПС, в дозе 50 мкг/кг; две другие группы были контрольными. Одной из них в те же дни и в том же объеме вводили физиологический раствор, а другой, интактной группе, ничего не вводили. Импульсивное поведение оценивали с помощью методики delay discounting. Введение ЛПС не оказывало существенного влияния на проявление импульсивного поведения у самцов и самок в молодом возрасте (2.5 мес). Однако самки в целом (с учетом данных по всем группам) в молодом возрасте были более импульсивными, чем самцы. Исследование импульсивности в зрелом возрасте (6 мес) на новых группах животных показало отсутствие у них различий по полу. Наиболее выраженной в этом возрасте импульсивность была у ЛПС-группы. Контрольные взрослые животные были менее импульсивными, чем молодые. У крыс ЛПС-группы, особенно у самцов, таких различий по возрасту не наблюдалось.
Известно, что вредные стрессовые воздействия в раннем детстве могут привести к перепрограммированию нормального развития мозга и формированию целого ряда психопатологий в зрелом возрасте (Bale et al., 2010; Kessler et al., 2010; Lovallo, 2013). Ранний стресс представляет существенный риск для злоупотребления наркотиками и алкоголем (Andersen et al., 2010) и развития синдрома дефицита внимания и гиперактивности (СДВГ) (Bock et al., 2016) в подростковом и зрелом возрасте. С другой стороны, наркомании, алкоголизм, игромании и СДВГ тесно связаны с импульсивным поведением (Bock et al., 2016; Everitt, Robbins, 2013; Hosking, Winstanley, 2011). Вопрос в том, являются ли эти двойственные отношения (Acheson et al., 2019; Hallowell et al., 2019; Zhu et al., 2016; Lovallo, 2013) логически связанными и причинно обусловленными, или в их основе лежат разные механизмы. Чтобы ответить на этот вопрос, необходимо провести прямые исследования влияний раннего стресса на интенсивность проявления импульсивного поведения во взрослой жизни. К сожалению, в литературе этому вопросу уделено мало внимания. В работах подобного типа в качестве раннего стресса применяли отлучение от матери (Boutros et al., 2017; Gondre-Lewis et al., 2016; Colorado et al., 2006), обедненные условия проживания и замещение биологической матери (Fuentes et al., 2014), социальную изоляцию (Baarendse et al., 2013), агрессию (Gonzalez-Martinez et al., 2017) и неконтролируемый болевой стресс (Sanchis-Olle et al., 2019). Для оценки импульсивного поведения использовали методику delay discounting (“когнитивная” импульсивность) (Gondre-Lewis et al., 2016; Lazzaretti et al., 2016; Lovic et al., 2011; Bridges et al., 2015) или модель, связанную с исследованием внимания и точности/своевременности выполнения инструментальных реакций в процессе дифференцировки (5-CSRT, 5-местная дифференцировка) (Sanchis-Olle et al., 2019; Baarendse et al., 2013; Boutros et al., 2017; Fuentes et al., 2014). Было показано, что стресс в результате отлучения от матери в раннем постнатальном периоде вызывал усиление “когнитивной” импульсивности и склонность к самовведению алкоголя у взрослых животных (Gondre-Lewis et al., 2016). Он также усиливал двигательную активность и ухудшал внимание (Bock et al., 2016). Усиление импульсивного поведения было в большей степени выражено у самцов, чем у самок (Spivey et al., 2009). В работе (Fuentes et al., 2014) ранний стресс вызывал усиление импульсивного поведения и у самок, и у самцов, хотя у самок оно было более выраженным в модели 5-местной дифференцировки, а у самцов – в модели delay discounting. С другой стороны, В. Лович и соавт. (Lovic et al., 2011) не обнаружили влияния материнской депривации на “когнитивную” импульсивность. Такой же результат на самцах и самках был получен в работе Н. Бриджес и соавт. (Brydges et al., 2015). Социальная изоляция с 21-го по 42-й день жизни (Baarendse et al., 2013) вела не к усилению, а к ослаблению импульсивности, оцениваемой с помощью 5-местной дифференцировки, но “когнитивная” импульсивность при этом не изменялась.
Согласно предположению ряда авторов, ранние стрессовые воздействия приводят к импульсивности в подростковом и зрелом возрасте за счет воспалительного процесса в мозге (Dunn et al., 2019; Sutin et al., 2012; Rico et al., 2010). Было показано, что введение провоспалительного бактериального липополисахарида (ЛПС) в период внутриутробного развития вызывает у потомства усиление двигательной активности и улучшение инструментального навыка в модели 5-местной дифференцировки, особенно у самок (Makinson et al., 2019). Однако если перед тестированием животные получали второй ЛПС-стресс (challenge), то дифференцировка резко ухудшалась, а импульсивное поведение усиливалось. Только в одной известной нам работе (Rico et al. 2010) исследовали связь между ранним провоспалительным стрессом, вызванным введением ЛПС на третий и пятый дни жизни, и импульсивным поведением в позднем подростковом периоде. Однако в этой работе импульсивное поведение оценивали не с помощью общепринятых методик delay discounting и/или 5-CSTR, а на основе анализа двигательной и исследовательской активности в открытом поле, в приподнятом крестообразном лабиринте и в тесте распознавания нового объекта (novel object recognition task). На основании полученных данных авторы пришли к заключению, что ранний провоспалительный ЛПС-стресс способствует проявлению импульсивного поведения в позднем подростковом периоде.
Учитывая все сказанное выше, целью настоящей работы было исследование влияния раннего провоспалительного стресса на проявление импульсивного поведения крыс линии Вистар разного возраста и пола. Провоспалительный стресс вызывали введением ЛПС на третий и пятый дни жизни, а импульсивное поведение оценивали с помощью модифицированного варианта классической модели delay discounting (Зайченко и др., 2011). В нашей работе мы использовали ЛПС в дозе 50 мкг/кг. Известно, что в этой дозе ЛПС-интоксикация не ведет к гибели животных, но стимулирует у них иммунные и стрессовые реакции, продолжающиеся 48 ч. Шенкс и соавт. (Shanks et al., 1995) первые в литературе показали, что введение ЛПС в дозе 50 мкг/кг на 3-й и 5-й дни жизни приводит к увеличению уровня кортикостерона в плазме крови. Позже такие же результаты при той же дозе и условиях введения получили Тишкина и соавт. (Tishkina et al., 2016). Полагаясь на указанные результаты, мы использовали ту же дозировку ЛПС, те же число и время введений.
МЕТОДИКА
В опытах было использовано 135 крыс линии Вистар в возрасте от 1 до 2.5 мес и от 6 до 8 мес (70 самцов и 65 самок). Крысята (15 пометов, 8–12 в помете) были выведены в виварии ИВНД и НФ от крыс, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА, Россия. 45 крысятам (4 помета) на третий и пятый дни жизни с помощью инсулинового шприца вводили в холку бактериальный липополисахарид (от Escherichia coli; серотип O26:B6, Sigma, USA) в дозе 50 мкг/кг в объеме 10 мкл/г (группа ЛПС), вызывая тем самым провоспалительный стресс. 47 крысятам (5 пометов) в этом же возрасте подкожно в том же объеме вводили физиологический раствор (группа ФИЗ, контроль 1). При проведении инъекций из домашней клетки удаляли крысу-мать, крысят по одному взвешивали и осуществляли инъекцию. Все манипуляции занимали около 1 мин, крысята оставались без матери не более 12 мин. 43 крысенка (6 пометов) оставались интактными, но их также взвешивали на третий и пятый дни жизни (группа ИНТ, контроль 2). В возрасте 25 дней крысят отлучали от матери и разделяли на подгруппы в зависимости от пола. В дальнейшем животных содержали в виварии при обычном 12-часовом световом режиме в свободном доступе к воде и стандартному корму ПК-120 в клетках размером 35 × 55 × 20 см по 4–5 крыс, в одной клетке находились крысы одного пола и, как правило, из одного помета. Во время проведения экспериментов по изучению импульсивного поведения (delay-discounting) крысам ограничивали доступ к корму так, чтобы их вес поддерживался на уровне 85% от их веса при свободном доступе к пище. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU), и положения ИВНД и НФ РАН о работе с экспериментальными животными.
После окончания экспериментов у животных проводили иммуноферментный анализ сыворотки крови.
Методика delay discounting. Экспериментальная установка представляла собой прямоугольную камеру размером 30 × 60 × 30 см. В середине передней стенки камеры была встроена кормушка, вход в которую загораживала подвижная шторка из прозрачного пластика. С двух сторон от кормушки размещались выдвижные педали. В кормушке и над каждой из педалей находились сигнальные лампочки. Управление включением ламп, выдвижением педалей, подача корма, формирование промежутков времени выполнялись с помощью персонального компьютера по программе, созданной Д.А. Ивлиевым. Крыс начинали обучать нажимать на педаль для получения пищи – стандартной таблетки (dustless precision pellets) 45 мг производства фирмы “BioServ” (США). Обучение проводилось до тех пор, пока крыса с равной вероятностью не нажимала на каждую из педалей. Этот этап обучения длился 15–20 дней. Затем режим подкрепления меняли так, что нажатие на одну из педалей предоставляло 1 таблетку, тогда как нажатие на другую – 4 таблетки, но с задержкой в 5 с. Во время ежедневной экспериментальной сессии крысам предоставляли 25 проб. Схема, по которой проводилась каждая проба, была аналогична описанной нами в предыдущих работах (Зайченко и др., 2011). Проба начиналась с включением в камере лампочки общего освещения и одновременно лампочки в кормушке. В течение 10 с животному предоставлялась возможность отодвинуть носом шторку, закрывающую доступ в кормушку. При отсутствии такой реакции действие программы останавливалось, свет гас и через 5 с начинался новый цикл. Отодвигание шторки служило сигналом для выдвижения обеих педалей, которые оставались выдвинутыми в течение 10 с. При отсутствии реакции педали задвигались, свет гас и через 5 с производился перезапуск программы. При нажатии на одну из педалей крыса получала 1 таблетку сразу, на другую – 4 таблетки с задержкой 5 с. Связь педалей с задержкой, а также время задержки задавались в начале эксперимента. Таким образом, крысам предоставлялся выбор между получением слабого, но предоставляемого сразу после нажатия подкрепления (1 таблетка), и более ценного (4 таблетки), но отсроченного корма. Регистрировали число нажатий на обе педали и число пропусков реакций (k1 – число нажатий на педаль, предоставляющую слабое, но немедленное подкрепление, k2 – число нажатий на педаль для получения более ценного, но задержанного подкрепления). Рассчитывали долю задержанных реакций – отношение k2 к числу эффективных реакций, k2/(k1 + k2), где 1 – 100% выбор задержанного подкрепления, а 0 – малоценного немедленного. После введения задержки в получении пищи при нажатии на одну из педалей требовалось 10–15 сессий для стабилизации поведения по выбору подкрепления. Затем за следующие 10 сессий подсчитывали среднюю долю выбора задержанного подкрепления. Оценка импульсивности проводилась у крыс, самцов и самок двух разных возрастных групп в двух сериях экспериментов. В первой серии исследовали крыс в возрасте 2–2.5 мес (поздний подростковый период), а во второй серии – в возрасте 6–8 мес (взрослые животные). Во всех группах приблизительно в равных долях присутствовали крысы, получавшие ранний провоспалительный стресс (ЛПС), введение физ. раствора (ФИЗ) и интактные (ИНТ) животные. В первой серии было исследовано поведение 51 молодой крысы: 24 самца (n = 8, ЛПС-группа; n = 7, ФИЗ-группа; n = 9, ИНТ-группа) и 27 самок (n = 8, ЛПС-группа; n = 10, ФИЗ-группа; n = 9, ИНТ-группа); во второй серии – поведение 84 взрослых крыс: 46 самцов (n = 15, ЛПС-группа; n = 20, ФИЗ-группа; n = 11, ИНТ-группа) и 38 самок (n = 14, ЛПС-группа; n = 10 ФИЗ-группа; n = 14 ИНТ-группа).
Иммуноферментный анализ крови. После окончания экспериментов крыс умерщвляли декапитацией и собирали периферическую кровь, которую центрифугировали 15 мин. при 4°С и 1500 g для получения сыворотки. Аликвоты сыворотки хранили при –80°С до проведения иммуноферментного анализа. Данный вид анализа был проведен у 48 крыс, остальных животных умерщвляли путем введения летальной дозы хлоралгидрата (800 мг/кг). Для определения уровня кортикостерона в сыворотке крови использовали наборы для иммуноферментного анализа (DRG, Германия), с помощью которых детектировали как свободный, так и связанный с транспортными белками кортикостерон методом конкурентного иммуноферментного анализа. Содержание провоспалительного интерлейкина-1β в сыворотке крови определяли с помощью наборов производства R&D Systems (США) согласно инструкции производителя.
Статистическая обработка результатов. При обработке результатов использовали стандартную программу STATISTICA 10.0. Распределение исследованных параметров было проверено на нормальность по критерию Колмогорова–Смирнова (Basic Statistics, раздел Descriptive Statistics). Равенство дисперсий изучаемого признака проверяли с помощью критерия Levene. Поскольку анализируемые параметры удовлетворяли данному критерию, то при сопоставлении групп крыс использовали дисперсионный анализ ANOVA, раздел factorial ANOVA. При post-hoc-анализе применяли критерий Тьюки. Различия считали статистически значимыми при р < 0.05. Исследовали влияние факторов ПОЛ, ГРУППА и ВОЗРАСТ крыс и взаимодействие этих факторов. Данные на рисунках и в таблицах представлены в виде средних значений ± ошибки средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В наших опытах, судя по поведению, крысы легко переносили интоксикацию дозой ЛПС 50 мкг/кг, хотя могло вызываться небольшое, статистически незначимое отставание в прибавке веса тела.
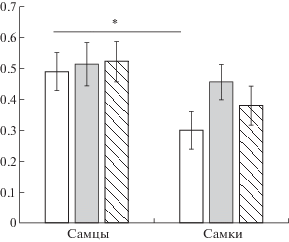
Молодые крысы. В возрасте 2–2.5 мес самки проявляли в целом более высокий уровень импульсивного поведения по сравнению с самцами, о чем свидетельствует анализ суммарного (с учетом всех групп) влияния фактора ПОЛ (F(1,45) = 6.22, p = 0.016). Доля задержанных инструментальных реакций, направленных на получение более сильного подкрепления, у самок была значительно меньше, чем у самцов (0.37 ± 0.04 и 0.51 ± 0.04 соответственно). Введение ЛПС на третий и пятый дни жизни не оказывало существенного влияния на поведение импульсивного выбора по сравнению с другими группами крыс (0.45 ± 0.046 у ЛПС-группы, 0.48 ± 0.045 у ФИЗ и 0.39 ± 0.043 у ИНТ-группы). Об этом свидетельствует анализ влияния фактора ГРУППА (F(2,45) = 1.07, p = 0.350) с учетом суммарных данных, полученных на самцах и самках. Анализ взаимодействия факторов ГРУППА × ПОЛ (F(2,45) = 1.553, p = 0.578) также показал недостоверность различий. У самцов различия между группами были минимальными. У самок разброс в показателях был более выражен с несколько большим уровнем импульсивности у ИНТ-группы. При сравнении коэффициентов импульсивности показатели импульсивности у самок ИНТ-группы статистически значимо превышали показатели импульсивности у самцов (р < 0.05) (рис. 1).
Рис. 1.
Проявления импульсивного поведения у молодых крыс (2.5 мес) в зависимости от группы и пола. Белые столбики – ИНТ-группа, серые – ФИЗ-группа, заштрихованные – ЛПС-группа. По вертикальной оси – коэффициенты импульсивности. * – статистически значимые различия, р < 0.05.
Fig. 1. The impulsive behavior in young rats (2.5 months) depending on the groups and sex. White columns – ИНТ naive group, gray columns – ФИЗ saline group, hatched columns – ЛПС lipopolysaccharides group, самцы – males, самки – females. On vertical axis – the coefficients of impulsivity. * – the significant differences, р < 0.05.
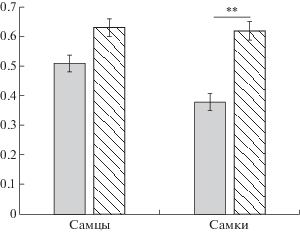
Взрослые крысы. В возрасте 6 мес проявления импульсивности были менее выражены, чем у молодых у крыс. Если для молодых животных (2–2.5 мес) коэффициент, отражающий долю выбора ценного задержанного подкрепления (обратный величине импульсивности), был равен 0.44 ± 0.02, то к 6 мес он составлял 0.62 ± 0.02. Анализ влияния фактора ВОЗРАСТ (F(1,123) = 25.791, p = 0.000) выявил высокодостоверные различия. В то же время, если в молодом возрасте наблюдались существенные различия в уровне проявления импульсивности между самцами и самками, то в возрасте 6 мес половые различия сглаживались и влияние пола (F(1,78) = 0.034, p = = 0.855) больше не проявлялось (рис. 2).
Рис. 2.
Влияние возраста и пола на проявления импульсивного поведения крыс. Светлые столбики – 2.5 мес, заштрихованные – 6 мес. По вертикальной оси – коэффициенты импульсивности. ** – статистически значимые различия, р < 0.01.
Fig. 2. Influence of age and sex on impulsive behavior of rats. The light columns – 2.5 months, the hatched columns – 6 months. Самцы – males, самки – females. On vertical axis – the coefficients of impulsivity. ** – the significant differences, р < 0.01. The rest designation are the same as in Fig. 1.
В возрасте 6 мес, однако, отчетливо проявилось влияние раннего провоспалительного ЛПС-стресса. Крысы ЛПС-группы проявляли большую импульсивность, о чем свидетельствует анализ влияния фактора ГРУППА (F(2,78) = 5.309, p = 0.0068). Post-hoc-анализ показал, что различия были статистически значимыми (р < 0.01) между ЛПС- и ИНТ-группами (рис. 3).
Рис. 3.
Проявления импульсивного поведения у крыс разных групп в возрасте 6 мес. # – различия носят характер тенденции, р < 0.10. Остальные обозначения, как на рис. 1.
Fig. 3. The manifestations of impulsive behavior in rats of different groups at the age of 6 months. # – the differences in the form of trend, р < 0.10. The rest designation are the same as in Fig. 1.
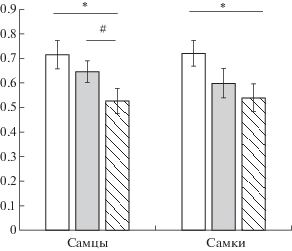
Взаимодействие факторов ПОЛ × ГРУППА было незначимым (F(2,78) = 0.189, p = = 0.827). Различия между ЛПС и другими группами раздельно у самцов и самок носили характер тенденции. Анализ влияния фактора ГРУППА у самцов показал, что различия приближались к достоверным значениям (F(2,43) = 2.575, p = 0.087). Значимые различия (р < 0.05) в результате post-hoc-анализа проявились между ЛПС- и ИНТ-группами. У самок групповые различия были маргинально достоверными, (F(2,35) = 3.205, p = 0.052). Различия между ИНТ- и ЛПС-группами были статистически значимыми (р < 0.05) (рис. 3).
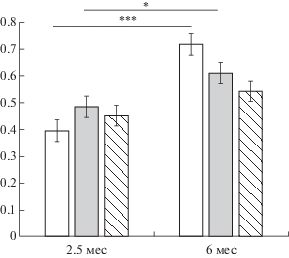
Взаимодействие факторов ПОЛ × ГРУППА × ВОЗРАСТ не выявило значимого влияния. В то же время анализ взаимодействия факторов ПОЛ × ВОЗРАСТ выявил различия на уровне тенденции (F(1,123) = 2.7614, p = = 0.09). Если у самок различия были статистически значимы (р < 0.0005): 0.37 ± 0.03 в 2.5 мес и 0.61 ± 0.03 в 6 мес, то у самцов они носили характер тенденции (р = 0.08, 0.51 ± 0.04 и 0.62 ± 0.03 соответственно).
При анализе факторов ГРУППА × ВОЗРАСТ были выявлены статистически значимые различия (F(2, 123) = 4.1554, p = 0.01). В зависимости от возраста уровень импульсивности существенно различался у интактных животных (р < 0.0005) (рис. 4). В ФИЗ-группе возрастные различия в импульсивности были менее выраженными, но статистически значимыми (р < 0.05) (рис. 4). В группе животных, получавших в раннем возрасте ЛПС-стресс, различия в импульсивности в зависимости от возраста не проявлялись (р = 0.14). Следует отметить, что у самцов группы ЛПС практически не было изменений в уровне импульсивности в возрасте 2.5 и 6 мес (0.52 ± 0.07 и 0.53 ± 0.05 соответственно). У самок этой группы происходило заметное ослабление импульсивности с 0.38 ± 0.07 в 2.5 мес до 0.56 ± 0.05 в 6 мес. Другими словами, самцы, получавшие ранний провоспалительный стресс, были более резистентными к ослаблению импульсивности в более позднем возрасте, чем самки.
Рис. 4.
Проявления импульсивного поведения у крыс разных групп в зависимости от возраста. * – статистически значимые различия, р < 0.05, *** – р < 0.0001. Остальные обозначения, как на рис. 1.
Fig. 4. The manifestations of impulsive behavior in dependence on age in rats of different groups. * – the significant differences различия, р < 0.05, *** – р < 0.0001. The rest designation are the same as in Fig. 1.
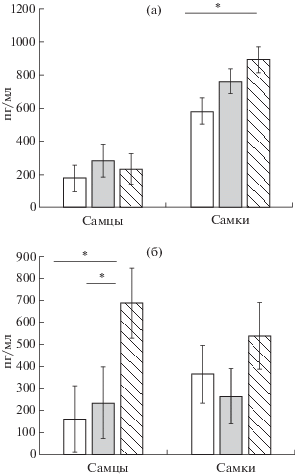
Влияние ЛПС на уровень кортикостерона и IL-1β. Ранний провоспалительный стресс оказывал разное влияние на биохимические показатели сыворотки крови у самцов и самок: у самцов уровень провоспалительного цитокина IL-1β в возрасте 6 мес оставался повышенным, а у самок выше был уровень кортикостерона (рис. 5). Более подробно результаты биохимического и иммуноферментного анализа описаны в предыдущей статье (Брошевицкая и др., 2020).
Рис. 5.
Влияние раннего провоспалительного стресса на уровни кортикостерона (а) и IL-1β (б) в сыворотке крови у взрослых самцов и самок. Остальные обозначения, как на рис. 1.
Fig. 5. The influence of an early proinflammatory stress on corticosterone (a) and IL-1β (б) levels in blood serum in matured males and females. The rest designation are the same as in Fig. 1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Введение ЛПС на третий и пятый дни жизни в наших опытах не оказывало существенного влияния на проявление импульсивного поведения (delay discounting) у молодых самцов и самок крыс линии Вистар. Однако самки в целом (при учете всех групп) в молодом возрасте были более импульсивными, чем самцы. Исследование импульсивности в зрелом возрасте (6 мес) на новых группах животных показало отсутствие у них различий по полу. И самцы, и самки проявляли примерно одинаковую степень импульсивности в условиях выбора слабого немедленного или сильного задержанного подкреплений. Однако импульсивность в этом возрасте у животных разных групп проявилась по-разному. В большей степени она проявилась у ЛПС-группы, несколько слабее была у ФИЗ и еще слабее – у ИНТ-группы. В зависимости от возраста существенные различия в степени импульсивности выявились в пределах контрольных групп; у ЛПС-групп таких различий не было. Таким образом, у контрольных животных с возрастом происходило ослабление импульсивности, а у крыс, получавших ранний ЛПС-стресс, она существенно не изменялась (суммарно у самцов и самок) и была выше показателей контрольных животных. Интересно, что у самцов ЛПС-группы импульсивность по мере взросления оставалась практически на том же уровне, тогда как у самок она уменьшалась.
Мы уже упоминали об одной, единственной работе (Rico et al., 2010), в которой исследовали связь между ранним провоспалительным стрессом и импульсивностью. В ней, однако, импульсивность оценивали не с помощью классических методик delay discounting или 5-CSRT, а на основе анализа двигательной и исследовательской активности. Надо отметить, что попытки обнаружить связь между ранним стрессом и поздними проявлениями импульсивного поведения предпринимались и раньше. Например, в работе Р. Колорадо и соавт. (Colorado et al., 2006) для этой цели использовали отлучение от матери (по 6 ч в день, первые 10 дней). Импульсивность оценивали по скорости движения и выбору рискованного поведения в открытом поле (выходы в центр) или в светло-темной камере (время пребывания в светлом отсеке). Отлучение от матери усиливало импульсивное поведение по сравнению с нормальным материнским уходом. Хэндлинг (приручение) по 15 мин в день за то же время нивелировал эффект отлучения от матери. В других опытах (Lazzaretti et al., 2016) приручение по 10 мин в день в течение 10 дней в том же возрасте вызывало не ослабление, а усиление импульсивного поведения у взрослых крыс-самцов. В. Лович и соавт. (Lovic et al., 2011) не обнаружили влияния отлучения от матери на “когнитивную” импульсивность в модели delay discounting. При комбинации материнской депривации с 1-го по 14-й день жизни с умеренным предъявлением алкоголя (28–57-й дни) двигательная импульсивность в модели 5-CSRT усиливалась у самцов в базовом состоянии и в ответ на повторное острое предъявление алкоголя (challenge) (Boutros et al., 2017). Однако при больших интервалах между пробами она уменьшалась. Социальная изоляция с 21-го по 42-й день жизни вызывала ослабление двигательной импульсивности в модели 5-местной дифференцировки, но не влияла на “когнитивную” импульсивность, оцениваемую с помощью методики delay discounting (Baarendse et al., 2013). М. Санчис-Олле и соавт. (Sanchis-Olle et al., 2019) показали, что неконтролируемый стресс уменьшает импульсивное поведение в условиях 5-местной дифференцировки, но не влияет на импульсивность в модели delay discounting. Таким образом, из сказанного выше следует, что на проявление импульсивного поведения в зрелом возрасте влияют особенности стрессового воздействия в раннем возрасте, способы оценки импульсивности (delay discounting или 5-CSRT), длительность интервалов между пробами, возраст животного и некоторые другие факторы.
В настоящей работе мы первые в литературе показали наличие прямой связи между ранним бактериальным липополисахаридным стрессом и степенью проявления импульсивного поведения у крыс в молодом и зрелом возрасте. У крыс под влиянием ЛПС повышались уровни кортикостерона и провоспалительного цитокина IL-1β в сыворотке крови. Причем уровень цитокина IL-1β у взрослых (6 мес) самцов ЛПС-группы был намного выше, чем у других групп. В этом возрасте импульсивность у самцов оставалась высокой по сравнению с другими группами животных. То есть провоспалительный ЛПС-стресс каким-то образом сохранял у них высокий уровень импульсивного поведения, который в норме с возрастом уменьшается (Burton, Fletcher, 2012; Doremus-Fitzwater et al., 2012; Soares et al., 2012). Трудно сказать, почему у самцов провоспалительный стресс не вызывал ослабления импульсивности через полгода после его инициации. Этому, на наш взгляд, может быть ряд причин. Во-первых, потому что у самцов и самок ранний стресс вызывает разную сенситизацию иммунной системы, которая у самцов оказывается более чувствительной и реактивной на последующие стрессы с соответствующими экзальтированными реакциями (Fonken et al., 2018). В пользу такой возможности говорит высокий уровень цитокина IL-1β через 6 мес после ЛПС-стресса как раз у самцов, а не у самок. Во-вторых, импульсивность, возникающая при травмах мозга, сопровождается увеличением уровня транскрипционного фактора, регулирующего экспрессию генов иммунного ответа, NFκB, и активности индуцируемой синтазы оксида азота, iNOS (Logsdon et al., 2016). А модулятор клеточного стресса, салубринал, нормализует активность этих факторов и одновременно снижает уровень импульсивного поведения (Logsdon et al., 2016). Хотя мы специально не исследовали уровень и активность цитокина IL-12, сообщалось о его прямом вкладе в развитие импульсивного поведения у самцов (Vonder Haar et al., 2017).
В литературе имеются данные о том, что импульсивное поведение под влиянием раннего стресса проявляется у самцов в подростковом возрасте сильнее, чем у самок. Это происходит в случае отлучения от матери (Renard et al., 2007), ограничительного стресса (Conrad et al., 2004) или выученной беспомощности (Dalla et al., 2008). У людей мальчики также чаще подвержены СДВГ и импульсивному поведению, чем девочки (Carlson et al., 1997). Эти различия связывают с двусторонней недоразвитостью у крыс-самцов (Spivey et al., 2009) и подростков (Sowell et al., 2003) некоторых отделов префронтальной коры и влиянием половых гормонов, тестостерона и эстрогенов. В частности, гонадоэктомия у самцов ослабляла импульсивное поведение (5-CSRT), а овариоэктомия у самок усиливала его (Jentsch, Taylor, 2003). Однако эти изменения касались больше двигательной, а не “когнитивной” импульсивности, т.е. связанной с принятием решения. В наших опытах молодые самки были более импульсивными, чем самцы, что совпадает с данными других авторов (Weafer, Witt, 2014; Koot et al., 2009; van Haaren et al., 1988), которые показали, что у самок “когнитивная” импульсивность проявляется в большей степени, чем у самцов. Согласно одной из точек зрения, самки более пластичны в принятии решения, чем самцы (Koot et al., 2009). Последние в ходе исследовательской активности быстро выбирают наиболее выгодную опцию и дальше концентрируются только на этой опции, игнорируя другие варианты. Самки же непрерывно взвешивают разные опции, переходя от исследовательской активности к выбору конкретной опции, но затем снова возвращаются к исследованию других опций и выбору новой (Koot et al., 2009). У самок овариоэктомия снижала “когнитивную” импульсивность (Uban et al., 2012). Но под влиянием эстрадиола или комбинации агонистов ERα- и ERβ-рецепторов она возвращалась к исходному уровню. Предполагается, что влияние эстрогенов на импульсивное поведение реализуется через взаимодействие с дофаминергической системой. Подробно об этом см. в работе (Orsini, Setlow, 2017).
ВЫВОДЫ
1. “Когнитивная” импульсивность, оцениваемая с помощью модели delay discounting, проявлялась в молодом возрасте в большей степени у самок, чем у самцов. У взрослых животных межполовые различия в проявлениях импульсивности исчезали.
2. Провоспалительный стресс, созданный путем введения ЛПС на 3-й и 5-й дни жизни, не оказывал существенного влияния на проявление импульсивного поведения в молодом возрасте. Однако в зрелом возрасте импульсивность у крыс ЛПС-группы проявлялась в большей степени, чем у контрольных животных. У самцов импульсивность в зависимости от возраста практически не изменялась, в то время как у самок она с возрастом уменьшалась.
3. Устойчивость импульсивного поведения в зрелом возрасте у самцов, получавших ранний ЛПС-стресс, может быть обусловлена особенностями сенситизации их нейровоспалительной системы в ответ на этот стресс. Превалирование “когнитивной” импульсивности в молодом возрасте у самок по сравнению с самцами, вероятно, связано с их большой пластичностью в принятии решения.
Список литературы
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Груздева В.А., Григорьян Г.А. Влияние раннего провоспалительного стресса на тревожное и депрессивно-подобное поведение у крыс разного возраста. Физиологический журнал. 2020. 106 (7): 823–842.
Зайченко М.И., Ванециан Г.Л., Мержанова Г.Х. Различия в поведении импульсивных и самоконтролирующих крыс при исследовании их в тестах открытого поля и светло-темной камеры. Журнал высшей нервной деятельности им. И.П. Павлова. 2011. 61 (3): 340–350.
Acheson A., Vincent A.S., Cohoon A., Lovallo W.R. Early life adversity and increased delay discounting: Findings from the Family Health Patterns project. Exp. Clin. Psychopharmacol. 2019. 27 (2): 153–159.
Andersen S.L., Teicher M.H. Desperately driven and no brakes: Developmental stress exposure and subsequent risk for substance abuse. Neuroscience and Biobehavioral Reviews. 2009. 33: 516–524.
Baarendse P.J., Counotte D.S., O'Donnell P., Vanderschuren L.J. Early social experience is critical for the development of cognitive control and dopamine modulation of prefrontal cortex function. Neuropsychopharmacology. 2013 38 (8): 1485–1494.
Bale T.L., Baram T.Z., Brown A.S., Goldstein J.M., Insel T.R., McCarthy M.M., Nestler E.J. Early life programming and neurodevelopmental disorders. Biological Psychiatry. 2010. 68: 314–319.
Bock J., Breuer S., Poeggel G., Braun K. Early life stress induces attention-deficit hyperactivity disorder (ADHD)-like behavioral and brain metabolic dysfunctions: functional imaging of methylphenidate treatment in a novel rodent model. Brain Struct. Funct. 2017. 222 (2): 765–780.
Boutros N., Der-Avakian A., Markou A., Semenova S. Effects of early life stress and adolescent ethanol exposure on adult cognitive performance in the 5-choice serial reaction time task in Wistar male rats. Psychopharmacology (Berl). 2017. 234 (9–10): 1549–1556.
Brydges N.M., Holmes M.C., Harris A.P., Cardinal R.N., Hall J. Early life stress produces compulsive-like, but not impulsive, behavior in females. Behav. Neurosci. 2015. 129 (3): 300–308.
Burton C.L., Fletcher P.J. Age and sex differences in impulsive action in rats: the role of dopamine and glutamate. Behav. Brain Res. 2012. 230 (1): 21–33.
Carlson C., Tamm L., Gaub M. Gender differences in children with ADHD, ODD, and co-occurring ADHD/ODD identified in a school population. J Am Acad Child Adolesc. Psychiatry. 1997. 36: 1706–1714.
Colorado R.A., Shumake J., Conejo N.M., Gonzalez-Pardo H., Gonzalez-Lima F. Effects of maternal separation, early handling, and standard facility rearing on orienting and impulsive behavior of adolescent rats. Behav. Processes. 2006. 71 (1): 51–58.
Conrad C.D., Jackson J.L., Wieczorek L., Baran S.E., Harman J.S., Wright R.L., Korol D.L. Acute stress impairs spatial memory in male but not female rats: influence of estrous cycle. Pharmacol. Biochem. Behav. 2004; 78: 569–579.
Dalla C., Edgecomb C., Whetstone A.S., Shors T.J. Females do not express learned helplessness like males do. Neuropsychopharmacology. 2008. 33: 1559–1569.
Doremus-Fitzwater T.L., Barreto M., Spear L.P. Age-related differences in impulsivity among adolescent and adult Sprague-Dawley rats. Behav Neurosci. 2012. 126 (5): 735–41.
Dunn G.A., Nigg J.T., Sullivan E.L. Neuroinflammation as a risk factor for attention deficit hyperactivity disorder. Pharmacol. Biochem. Behav. 2019. 182: 22–34.
Fonken L.K., Frank M.G., Gaudet A.D., D’Angelo H.M., Daut R.A., Hampson E.C., Ayala M.T., Watkins L.R., Maier S.F. Neuroinflammatory priming to stress is differentially regulated in male and female rats. Brain Behav. Immun. V. 70. 2018. 257–267.
Fuentes S., Daviu N., Gagliano H., Garrido P., Zelena D., .Monasterio N., Armario A., Nadal R. Sex-dependent effects of an early life treatment in rats that increases maternal care: vulnerability or resilience? Front Behav. Neurosci. 2014. Feb 25; 8: 56.
Gondré-Lewis M.C., Warnock K.T., Wang H., June H.L. Jr, Bell K.A., Rabe H., Tiruveedhula V.V., Cook J., Lüddens H., Aurelian L., June H.L. Sr. Early life stress is a risk factor for excessive alcohol drinking and impulsivity in adults and is mediated via a CRF/GABA(A) mechanism. Stress. 2016. 19 (2): 235–247.
González-Martínez L.F., D’Aigle J., Lee S.M., Lee H.J., Delville Y. Social stress in early puberty has long-term impacts on impulsive action. Behav. Neurosci. 2017. 131 (3): 249–261.
Hallowell E.S., Oshri A., Liebel S.W., Liu S., Duda B., Clark U.S., Sweet L.H. The Mediating role of neural activity on the relationship between childhood maltreatment and impulsivity. Child Maltreat. 2019 24 (4): 389–399.
Hosking J., Winstanley C.A. Impulsivity as a mediating mechanism between early-life adversity and addiction: Theoretical comment on Lovic et al. (2011). Behavioral Neuroscience. 2011. 125 : 681–686.
Jentsch J.D., Taylor J.R. Sex-related differences in spatial divided attention and motor impulsivity in rats. Behavioral Neuroscience. 2003. 117: 76–83.
Lazzaretti C., Kincheski G.C., Pandolfo P., Krolow R., Toniazzo A.P., Arcego D.M., Couto-Pereira N. de S., Zeidán-Chuliá F., Galvalisi M., Costa G., Scorza C., Souza T.M., Dalmaz C. Neonatal handling causes impulsive behavior and decreased pharmacological response to methylphenidate in male adult wistar rats. J. Integr. Neurosci. 2016. 15 (1): 81–95.
Logsdon A.F., Lucke-Wold B.P., Nguyen L., Matsumoto R.R., Turner R.C., Rosen C.L., Huber J.D. Salubrinal reduces oxidative stress, neuroinflammation and impulsive-like behavior in a rodent model of traumatic brain injury. Brain Res. 2016. 1643: 140–151.
Lovallo W.R. Early life adversity reduces stress reactivity and enhances impulsive behavior: implications for health behaviors. Int. J. Psychophysiol. 2013. 90 (1): 8–16.
Kessler R.C., McLaughlin K.A., Green J.G., Gruber M.J., Sampson N.A., Zaslavsky A.M., Aguilar-Gaxiola S., Alhamzawi A.O., Alonso J., Angermeyer M., Benjet C., Bromet E., Chatterji S., de Girolamo G., Demyttenaere K., Fayyad J., Florescu S., Gal G., Gureje O., Haro J.M., Hu C.-y., Karam E.G., Kawakami N., Lee S., Lepine J.-P., Ormel J., Posada-Villa J., Sagar R., Tsang A., Ustun T.B., Vassilev S., Viana M.C., Williams D.R. Childhood adversities and adult psychopathology in the WHO World Mental Health Surveys. The British Journal of Psychiatry. 2010. 197: 378–385.
Koot S., van den Bos R., Adriani W., Laviola G. Gender differences in delay-discounting under mild food restriction. Behavioral Brain Research. 2009. 200: 134–143.
Lovic V., Keen D., Fletcher P.J., Fleming A.S. Early-life maternal separation and social isolation produce an increase in impulsive action but not impulsive choice. Behav. Neurosci. 2011. 125 (4): 481–491.
Makinson R., Lloyd K., Grissom N., Reyes T.M. Exposure to in utero inflammation increases locomotor activity, alters cognitive performance and drives vulnerability to cognitive performance deficits after acute immune activation. Brain Behav. Immun. 2019. 80: 56–65.
Orsini C.A., Setlow B. Sex differences in animal models of decision making. J Neurosci. Res. 2017. 95 (1–2): 260–269.
Renard G.M., Rivarola M.A., Suarez M.M. Sexual dimorphism in rats: effects of early maternal separation and variable chronic stress on pituitary-adrenal axis and behavior. International Journal of Developmental Neuroscience. 2007: 373–379.
Rico J.L., Ferraz D.B., Ramalho-Pinto F.J., Morato S. Neonatal exposure to LPS leads to heightened exploratory activity in adolescent rats. Behav. Brain Res. 2010. 215 (1): 102–109.
Shanks N., Larocque S., Meaney M.J. Neonatal endotoxin exposure alters the development of the hypothalamic-pituitary-adrenal axis: early illness and later responsivity to stress. J. Neurosci. 1995. 15: 376–384.
Sanchís-Ollé M., Fuentes S., Úbeda-Contreras J., Lalanza J.F., Ramos-Prats A., Armario A., Nadal R. Controllability affects endocrine response of adolescent male rats to stress as well as impulsivity and behavioral flexibility during adulthood. Sci Rep. 2019. 9 (1): 3180.
Soares A.R., Esteves M., Moreira P.S., Cunha A.M., Guimarães M.R., Carvalho M.M., Raposo-Lima C., Morgado P., Carvalho A.F., Coimbra B., Melo A., Rodrigues A.J., Salgado A.J., Pêgo J.M., Cerqueira J.J., Costa P., Sousa N., Almeida A., Leite-Almeida H. Trait determinants of impulsive behavior: a comprehensive analysis of 188 rats. Sci. Rep. 2018. 8 (1): 17666.
Sowell E.R., Thompson P.M., Welcome S.E., Henkenius A.L., Toga A.W., Peterson B.S. Cortical abnormalities in children and adolescents with attention-deficit hyperactivity disorder. Lancet. 2003. 362: 1699–1707.
Spivey J.M., Shumake J., Colorado R.A., Conejo-Jimenez N., Gonzalez-Pardo H., Gonzalez-Lima F. Adolescent female rats are more resistant than males to the effects of early stress on prefrontal cortex and impulsive behavior. Dev. Psychobiol. 2009. 51 (3): 277–288.
Sutin A.R., Milaneschi Y., Cannas A., Ferrucci L., Uda M., Schlessinger D., Zonderman A.B., Terracciano A. Impulsivity-related traits are associated with higher white blood cell counts. J. Behav. Med. 2012. 35 (6): 616–623.
Tishkina A., Stepanichev M., Kudryashova I., Freiman S., Onufriev M., Lazareva N., Gulyaeva N. Neonatal proinflammatory challenge in male Wistar rats: Effects on behavior, synaptic plasticity, and adrenocortical stress response. Behav Brain Res. 2016. 304 (5): 1–10.
Uban K.A., Rummel J., Floresco S.B., Galea L.A. Estradiol modulates effort-based decision making in female rats. Neuropsychopharmacology. 2012. 37 (2): 390–401.
Van Haaren F., van Hest A., van de Poll N.E. Self-control in male and female rats. Journal of the Exper. Anal. Behav. 1988. 201–211.
Vonder Haar C., Martens K.M., Riparip L.K., Rosi S., Wellington C.L., Winstanley C.A. Frontal traumatic brain injury increases impulsive decision making in rats: a potential role for the inflammatory cytokine interleukin-12. J. Neurotrauma. 2017. 34 (19): 2790–2800.
Weafer J., de Wit H. Sex differences in impulsive action and impulsive choice. Addict. Behav. 2014. 39 (11): 1573–1579.
Zhu H., Luo X., Cai T., He J., Lu Y., Wu S. Life event stress and binge eating among adolescents: the roles of early maladaptive schemas and impulsivity. Stress Health. 2016. 32 (4): 395–401.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


