Журнал высшей нервной деятельности им. И.П. Павлова, 2021, T. 71, № 1, стр. 104-113
Стресс иммобилизации и поведение мышей с разным весом мозга
О. В. Перепелкина 1, Н. А. Огиенко 1, А. Д. Сулейманова 1, И. И. Полетаева 1, *
1 Кафедра высшей нервной деятельности, Биологический факультет,
Московский государственный университет имени М.В. Ломоносова
Москва, Россия
* E-mail: ingapoletaeva@mail.ru
Поступила в редакцию 11.05.2020
После доработки 01.10.2020
Принята к публикации 05.10.2020
Аннотация
Мышей двух линий, селектированных на большой и малый относительный вес мозга (БМ и ММ), тестировали на гипонеофагию, реакцию в “неизбегаемой скользкой воронке” и на понимание правила “неисчезаемости” (по Ж. Пиаже), когда нужно найти вход в комфортное укрытие при его маскировке (когнитивный тест). Межлинейные различия оценивали у контрольных мышей и в группах после 2 ч иммобилизации, провоцирующей развитие стресс-реакции. В тесте на гипонеофагию реакция на новую пищу в новой обстановке у мышей ММ (но не у БМ) после иммобилизации была достоверно выше, чем в контроле. В тесте “неизбегаемой скользкой воронки” у мышей БМ после иммобилизации было достоверно больше время адаптивной реакции “избавления”, тогда как у ММ это изменение было недостоверным. Мыши БМ чаще, чем ММ, переходили от одного типа реакции к другому. У мышей ММ “рисунок” соотношения времени, занятого тремя типами реакции в тесте с воронкой, и в контроле, и после иммобилизации отличался от такового у БМ, что свидетельствует о наличии межлинейных различий. Мыши БМ (суммарно контрольные и опытные) лучше решали когнитивный тест, чем ММ. Достоверного влияния стресса на показатели его решения выявлено не было. Полученные данные показывают, что между линиями БМ и ММ продолжают выявляться различия в поведении (в том числе и в состоянии стресса), несмотря на прекращение селекции на относительный вес мозга.
ВВЕДЕНИЕ
Одной из важных проблем нейрофизиологии и нейробиологии в целом является оценка связи между особенностями генотипа, стресс-реактивностью и проявлениями нарушений поведения (O’Connor et al., 2010). Состояние стресса, т.е. физиологической реакции организма, мобилизующей его ресурсы при возникновении опасности, а также при большой нагрузке и др. (McEwen et al., 2015), анализируется на разных лабораторных моделях. В соответствии с современными представлениями состояние стресса – это активный процесс, реализующий изменения в организме через активацию оси “гипоталамус–гипофиз–надпочечники” c вовлечением иммунной и вегетативной нервной систем (Elenkov et al., 2000). Состояние стресса влияет на проявления тревожности и на общий уровень активности (Parker et al., 2008, Sulakhiya et al., 2016). Исследования роли генотипа в реакции на стресс проводятся либо на селектированных линиях грызунов, либо на животных с выключением ряда генетических элементов (Harris et al., 2001, Parker et al., 2008, Malisch et al., 2009, O’Mahony et al., 2010). Оценка изменений поведения проводится также в состоянии стресса, который развивается после иммобилизации (restraint stress (Miyamoto et al., 2017)).
Влияние стресса иммобилизации на когнитивные способности лабораторных грызунов (в тестах, не требующих предварительного научения) исследовано мало и преимущественно на крысах (например, Rygula et al., 2013). В настоящей работе был проведен анализ поведения в тесте на новизну (неофагия), в тесте “Неизбегаемая скользкая воронка” (реакция на новую неприятную ситуацию), а также в когнитивном тесте на поиск входа в укрытие (puzzle-box, (Ben Abdallah et al., 2011)) у мышей двух линий в норме и после двухчасовой иммобилизации. Использованные линии “Большой Мозг” и “Малый Мозг” (БМ и ММ) были получены в результате ранее проведенной селекции на большой и малый относительный вес мозга. В настоящее время они разводятся без поддерживающего отбора, причем у них сохраняются различия и в весе мозга, и в поведении (Perepelkina et al., 2013, Перепелкина и др., 2019). В статье приводятся данные по мышам 17-го поколения разведения мышей без отбора на вес мозга.
МЕТОДИКА
Экспериментальные животные. Самцы мышей линии БМ (n = 31) и линии ММ (n = 22) в возрасте 6 мес были разделены на группы “иммобилизация” и “контроль”, которые далее так и именуются.
Они содержались по 3–5 животных в стандартных клетках (разм. 33 × 22 × 8 см) в условиях естественного освещения, корм и вода ad lib (за исключением пищевой депривации в тестe на гипонеофобию). Эксперименты проводили в соответствии с Directive 2010/63 ЕС.
Иммобилизация. Для иммобилизации мышей (БМ, n = 16, ММ, n = 11) помещали в пластиковые пробирки 50 мл (диам. 2.8 см, длина 12 см), снабженные большим числом отверстий 1 мм. Контрольные группы (БМ, n = 15, ММ, n = 11) оставались в домашних клетках. Иммобилизацию, как и соответствующие тесты, проводили с интервалом в 14 дней, что позволяет не считать данное воздействие индукцией “хронического” стресса. Тестирование поведения проводили через 15–20 мин после высаживания сидевших в цилиндрах мышей в домашнюю клетку. Первым был предъявлен тест на поиск входа в укрытие, затем тест на неофагию, после чего – тест неизбегаемой скользкой воронки.
Тестирование поведения
Тест на неофагофобию. За 18–19 ч до теста животных лишали еды (но не воды). В центр цилиндрической камеры (диам. 40 см, высота стенок – 35 см) помещали пластиковую чашечку с новой для мышей пищей (мелкие кусочки сыра). За 5 мин теста регистрировали число подходов к пище, вес съеденного сыра и длительность времени, занятого едой.
Тест “Неизбегаемая скользкая воронка” (“щадящий” аналог теста Порсолта, (Salimov, 1999)). Использовалась большая стеклянная воронка, высотой 18 см, диам. верхней части – 40 см, с заполненной водой горловиной (диам. 10 см, высота 6 см) (Маркина и др., 1999). При помещении в воду у мыши могут быть реакции 3 типов: сохранение неподвижности в горловине воронки, активные попытки выпрыгнуть (избегание), либо распластанная поза “лапами враспор” над поверхностью воды (избавление). Оценивали число эпизодов каждой из реакций и время, занятое каждой из них, за 3 мин теста.
Тест на поиск входа в укрытие. Тест проводили в камере (74 × 30 × 28 см) из двух отсеков – светлого (куда помещали мышь) и темного (который служил укрытием). Эти отсеки разделены непрозрачной перегородкой, у основания которой в центре стенки находится углубленный в пол камеры (на 1.5 см) лаз (ширина – 4.5 см, длина – 11.5 см), через который мышь может перейти в темный отсек. Четыре пробы теста различались по степени “доступности” лаза: 1-я проба – открытый лаз, 2-я проба – лаз присыпан стружкой вровень с полом, в 3-й и 4-й пробах лаз заблокирован легкой пластиковой пробкой, которую мышь может извлечь зубами или отодвинуть. После перехода мыши в темную часть камеры ее оставляли в ней на 10–15 с, после чего высаживали в отдельную клетку. Через 30–40 с мышь снова помещали в камеру для следующей пробы. В этом тесте оценивали латентный период (ЛП) перехода в темный отсек, успешность (или неуспешность) выполнения теста, а также регистрировали число подходов к лазу до перехода в темный отсек, число стоек и эпизодов груминга. Тест считали успешно решенным, если мышь перешла в темный отсек в пределах 180 с для 1-й и 2-й проб и за 240 с – для 3-й и 4-й проб теста. Отметим, что 1-я проба этого теста – это аналог теста “светло-темной камеры” для оценки быстроты реакции избегания яркого освещения (Kulesskaya, Voikar, 2014).
Для статистической оценки результатов использовали непараметрический тест Манна–Уитни, различия считали достоверными при p < 0.05 (Statistica 10). Достоверность различий альтернативных долей оценивали по методу φ (по Фишеру).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Тест на гипонеофагию. У контрольных групп обеих линий вес съеденной новой пищи был одинаковым, и он почти не изменился в группе мышей БМ после иммобилизации. У мышей ММ после иммобилизации вес съеденного сыра был достоверно больше как по сравнению с контролем ММ, так и с группой после иммобилизации БМ (рис. 1). Число подходов к кормушке у группы ММ после иммобилизации было достоверно выше только по сравнению со своим контролем. Время, занятое едой, оказалось достоверно больше только у мышей ММ (по сравнению с их контролем).
Рис. 1.
Средние величины (±ош. средн.) показателей теста на гипонеофагию. (а) – вес новой пищи, съеденной мышами БМ и ММ 4 групп, (б) – число подходов к кормушке за 5 мин теста, (в) – время, занятое едой. Черные столбики – контрольные группы, серые – группы после иммобилизации. * – достоверно отличается от показателя соответствующей группы БМ, p < 0.05, критерий Манна–Уитни, #, ## – достоверно отличается от показателя контрольной группы линии ММ при p < 0.05 и p < 0.01 соответственно, критерий Манна–Уитни.
Fig. 1. Mean values (±se) of indices from hyponeophagia test. (а) –weight of the new food eaten by БМ and ММ mice of 4 groups, (б) – number of visits to the food cup during 5 test minutes. Black columns – control groups, grey columns – post-immobilization groups. * – significantly different from the respective БМ group, p < 0.05, Mann–Whitney criterion, #, ## – significantly different from ММ control group, p < 0.05 and p < 0.01, respectively, Mann–Whitney criterion.
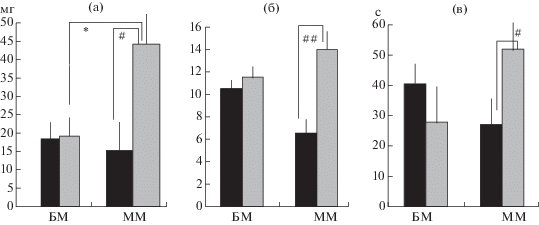
Таким образом, состояние стресса вызвало активацию поведения мышей линии ММ. Можно предположить, что эта активация была отражением повышенной тревожности, но она позволяла мышам чаще находить пищу. Кроме того, было показано, что у голодных крыс в состоянии стресса уровень кортикостерона был ниже, чем при стрессе в состоянии насыщения (De Boer al., 1989). Возможно, что подобный феномен проявился и у мышей ММ (но не у БМ).
Тест “Неизбегаемая скользкая воронка”. Различия были выявлены между группами мышей обеих линий (иммобилизация–контроль), результаты теста представлены в табл. 1.
Таблица 1.
Показатели поведения мышей БМ и ММ в тесте “Неизбегаемая скользкая воронка” после двухчасовой иммобилизации и в контроле (n – число животных) Table 1. Behavioral indices of БМ and ММ mice in “Unescapable slippery funnel” test after two-hours immobilization and in controls (n – number of subjects)
| Воздействие | Показатели поведения/линия | Неподвижность | Реакция избавления | Реакция избегания | |||
|---|---|---|---|---|---|---|---|
| время | Число эпизодов | время | Число эпизодов | время | Число эпизодов | ||
| стресс | БМ n = 31 |
112 ± 9.8 | 7.5 ± 0.7*## | 48.2 ± 6.4***### | 5.9 ± 0.8*## | 20.2 ± 9.8 | 2.0 ± 0.5 |
| контроль | 137.8 ± 10.1# | 4.1 ± 0.8 | 13.8 ± 6.6 | 2.1 ± 0.9# | 29.4 ± 10.1## | 2.7 ± 0.5# | |
| стресс | ММ n = 22 |
104.8 ± 19.7 | 3.5 ± 0.7 | 8.0 ± 3.1 | 1.3 ± 0.5 | 68.3 ± 20.7 | 2.4 ± 0.6* |
| контроль | 77.4 ± 19.7 | 4.8 ± 0.7 | 6.2 ± 3.1 | 0.7 ± 0.5 | 97.4 ± 20.7 | 4.5 ± 0.6 | |
Примечание. *, **, *** – достоверно отличается от показателя контрольной группы, p < 0.05, 0.01 и 0.001 соответственно, #, ##, ### – достоверно отличается от показателя в соответствующей группе линии ММ, p < 0.05, 0.01 и 0.001 соответственно (критерий Манна–Уитни). Note. *,**, *** – significantly different from indices of the control group, p < 0.05, 0.01 and 0.001, respectively (Mann–Whitney criterion).
Мыши БМ: иммобилизация–контроль. Время неподвижности в воронке у мышей БМ-контроль было (недостоверно) больше по сравнению с группой БМ-иммобилизация. Время, занятое реакцией избегания (активные движения и прыжки), – было у группы БМ-иммобилизация (также недостоверно) короче. Время, занятое реакцией избавления (пассивная, но оптимальная с точки зрения расхода сил, стратегия), было достоверно больше у мышей БМ-иммобилизация (p < 0.01).
Число эпизодов неподвижности у мышей БМ-иммобилизация было достоверно (p < 0.01, критерий Манна–Уитни) больше, чем в контроле, т.е. эти мыши чаще переходили от активного состояния к “отдыху”, т.е. к неподвижности. Число эпизодов с активными попытками выбраться было у двух групп мышей БМ почти одинаковым. Число эпизодов реакции избавления было достоверно больше (p < 0.05) после иммобилизации.
Мыши ММ. Иммобилизация–контроль. Время неподвижности в воронке мышей ММ-контроль было (недостоверно) меньше, чем у ММ-иммобилизация, т.е. “знак” различий был обратным тому, что наблюдалось у БМ. Время, занятое активными попытками выбраться (избегание), у ММ-контроль было (недостоверно) больше, чем у группы ММ-иммобилизация. По абсолютной величине это время было дольше у обеих групп ММ по сравнению с БМ. Время, занятое реакцией избавления, у двух групп мышей ММ было практически одинаковым и невысоким по величине. У обеих групп мышей ММ число эпизодов неподвижности было почти одинаковым. Число эпизодов, в которых проявлялась реакция избегания, было достоверно (p < 0.05) ниже у мышей ММ-иммобилизация, у них было также (недостоверно) больше число эпизодов с проявлением реакции избавления.
Сравнение контрольных мышей БМ и ММ. Показатели этого теста у контрольных мышей двух линий (рис. 2) выявили межлинейные различия. У мышей БМ время неподвижности в скользкой воронке было достоверно (p < 0.01) больше, чем у ММ. Время, занятое активными попытками выбраться, у группы ММ-контроль было достоверно (p < < 0.01) больше, чем у группы БМ-контроль. Время, занятое реакцией избавления, было недостоверно короче у ММ.
Рис. 2.
Диаграмма, показывающая соотношение среднего времени, занятого реакциями 3 типов в тесте скользкой воронки у мышей четырех групп (за 180 с теста). Черная часть столбика – время неподвижности, светло-серая – время реакции избавления, темно-серая – время реакции активного избегания. * – достоверно отличается от показателя контрольной группы той же линии, $\diamondsuit $ – достоверно отличается от показателя соответствующей группы ММ (см. также табл. 1).
Fig. 2. The ratios of mean time scores for 3 types of reactions in slippery funnel test for mice of 4 groups (for test 180 s). The black part of the column – time of immobility, light grey – time of escape reaction, dark-grey – time of active avoidance. * – significantly different from the control group of the same line, $\diamondsuit $ – significantly different from the SM index of SB mice of the respective group (see also table 1).
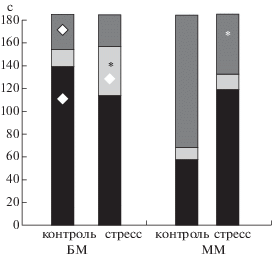
Сравнение групп БМ и ММ после иммобилизации. В группах после иммобилизации время неподвижности было почти одинаковым. Время, занятое активными попытками выбраться, было несколько дольше у мышей ММ (р = 0.08). Время, занятое реакцией избавления, было высокодостоверно (p < 0.001) больше у мышей БМ – у контрольных групп такие различия были недостоверными.
Эпизодов с проявлением реакции избавления было достоверно (p < 0.05) больше у мышей БМ.
Сравнение числа эпизодов реакций 3 типов у БМ и ММ после иммобилизации показало, что неподвижность достоверно чаще возникала у мышей БМ (p < 0.01), по сравнению с ММ. Число эпизодов активных попыток выбраться почти не различалось между линиями, но было лишь немного выше у мышей ММ, тогда как эпизодов реакции избавления было достоверно (p < 0.01) больше у БМ. На “качественной” интегральной схеме (рис. 2), показывающей сложный характер межлинейных различий в этом тесте, можно видеть, что соотношение времени, занятого реакциями трех типов, у контрольных мышей БМ и ММ различается сильнее, чем у мышей этих же линий в состоянии стресса, т.е. при стрессе “рисунок” времени этих реакций более сходен. Следует отметить, что время неподвижности в горловине воронки у мышей ММ-иммобилизация было больше, чем у ММ-контроль, но у них же было более четко выражено активное избегание. Отметим, что в тесте на гипонеофагию (где ситуация была хотя и новой, но не была неприятной) мыши ММ-иммобилизация были более активными.
Тест на поиск входа в укрытие. Мыши БМ-контроль (2-я проба, лаз засыпан стружкой) решали тест достоверно быстрее, чем ММ-контроль (p < 0.05). Достоверные различия такого же знака (p < 0.05) были у контрольных животных и в 3-й пробе (лаз закрыт пробкой). 1-ю и 4-ю пробы контрольные мыши ММ решали несколько (недостоверно) дольше, чем БМ (рис. 3 (а)). У мышей БМ-иммобилизация средние ЛП в 3-й и 4-й пробах были (недостоверно) длиннее, чем в контроле. Отметим, что переход мыши в темноту в первой пробе аналогичен решению теста светло-темной камеры (Kulesskaya, Voikar, 2014). Мыши ММ-иммобилизация переходили в темноту быстрее (недостоверно), чем в последующей пробе (со стружкой). Во 2-й и 3-й пробах, когда лаз был замаскирован и в темноту было попасть труднее, различия сохранились.
Рис. 3.
(а) – средние латентные периоды (± ош. средн.) решения четырех проб теста на поиск входа в укрытие. (б) – доли (в %) мышей 4 групп, успешно решивших последовательные пробы теста. * – достоверные различия между контрольными группами БМ и ММ, p < 0.05, критерий Манна–Уитни. # – достоверные отличия от контрольной группы ММ при p < 0.05 (оценка достоверности различия альтернативных долей, метод φ, по Фишеру). Прерывистыми линиями отмечены различия, обнаружившие “тенденцию” к достоверности (р = 0.07). Обозначения как на рис. 1.
Fig. 3. (а) – mean latencies (± se) of the 4 stages of puzzle-box test solutions. (б) – the proportions (%) of mice, which solved successfully the stages of puzzle-box test.* – significantly differences between LB and SB control groups, p < 0.05 (Mann–Whitney criterion), # – significant differences between control groups, p < 0.05, φ-test by Fisher. Dashed lines mark the marginal differences (tendencies, р = 0.07). Designations as in fig. 1.
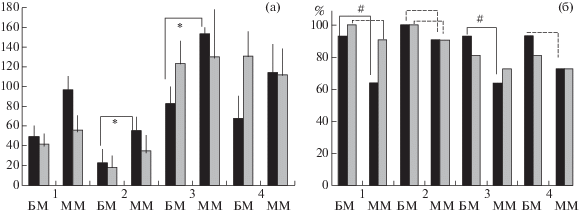
В успешности решения теста, т.е. в доле (в %) мышей каждой группы, решивших тест (в пределах условного интервала времени), также были выявлены различия (рис. 3 (б)). В первой и в третьей пробах теста доля решивших тест мышей в группе ММ-контроль была достоверно меньше, чем у БМ-контроль. Нельзя исключить, что в основе подобных различий, как уже упоминалось, может быть состояние тревоги мышей линии ММ. Такие различия выявлялись и ранее (Perepelkina et al., 2013).
Однако в целом следует заключить, что если в контрольных группах различия в успешности выполнения теста на поиск входа в укрытие обнаруживались, то в состоянии стресса они в определенной степени сгладились (как стало более сходным у БМ и ММ распределение времени между 3 типами реакции в тесте скользкой воронки).
В показателях исследовательского поведения – числе подходов к лазу до решения пробы и числе стоек в течение каждой из проб (рис. 4) – также обнаружились различия между группами. В 1-й пробе у мышей БМ (суммарно контроль + иммобилизация) число подходов было достоверно больше, чем у ММ. При этом у мышей ММ-иммобилизация подходов к открытому лазу (до захода в темноту) было достоверно (p < 0.05) больше, чем у ММ-контроль (как был длиннее ЛП ухода в темноту). Межлинейные различия по числу подходов к лазу в 3-й пробе, когда лаз был заблокирован пробкой, были недостоверными. В 4-й пробе у мышей всех групп “интерес” к лазу оказался сниженным, возможно, из-за привыкания к освещенной части камеры, в которой не было дополнительных источников для тревоги.
Рис. 4.
(а) – среднее число (±ош. средн.) подходов к лазу (до решения) у мышей 4 групп в тесте на поиск входа в укрытие. (б) – среднее число (±ош. средн.) стоек у мышей 4 групп в этом тесте. * – достоверно отличается от контрольной группы ММ при p < 0,05. # – достоверно отличается от БМ-иммобилизация при p < 0.05, & – достоверные межлинейные различия (БМ суммарно от ММ), критерий Манна–Уитни. Обозначения как на рис. 1.
Fig. 4. (а) – mean (± se) number of approaches to the underpass (before solution) in mice of 4 groups in the puzzle-box test. (б) – mean (±se) numbers of rearings in this test, performed by mice of 4 groups. * – significantly different from SB control group (p < 0.05). # – significantly different from LB stressed group, p < 0.05, & – significant (p < 0.05) interstrain difference (summed LB vs summed SB values). Designations as in fig. 1.
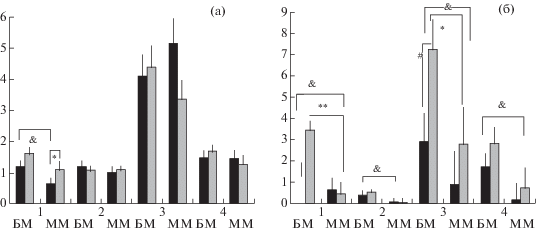
В 1-й, 3-й и 4-й пробах у мышей БМ-иммобилизация было больше стоек, чем в контроле (рис. 4). Кроме того, этот показатель обнаружил устойчивые в течение всех проб теста межлинейные различия с достоверно большим числом стоек суммарно у всех мышей БМ против всех мышей ММ (p < 0.05). Эти данные указывают и на более интенсивное исследовательское поведение мышей БМ в этих пробах, и на усиление этого состояния при стрессе.
У мышей всех 4 групп эпизодов груминга было очень мало и данные не представлены.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Данные, полученные в настоящей работе, свидетельствуют о сохранении описанных ранее различий в поведении мышей БМ и ММ (Perepelkina et al., 2013). Эти различия обнаружились и в контрольных группах, и после двухчасового пребывания в состоянии иммобилизации, которое вызывает у мышей стресс-реакцию (“restrain stress”).
Напомним, что ранее эти линии были селектированы на большой и малый относительный вес мозга (Перепелкина и др., 2019), а в настоящее время разводятся аутбредно без селекции. Межлинейные различия в весе мозга между ними сохраняются, как обнаруживались и продолжают обнаруживаться и различия в поведении. Ранее межлинейные различия (т.е. данные по сравнению мышей БМ и ММ) не отличались большой устойчивостью, но в целом их можно охарактеризовать как более высокую способность к решению когнитивных тестов у мышей БМ и большую подверженность тревожности мышей ММ.
В настоящей работе тест на новизну, точнее, реакция голодной мыши на новую пищу в новой (но не пугающей) обстановке, дал четкие результаты. Он показал, что в отсутствие значимых межлинейных различий в контроле, в состоянии стресса после иммобилизации поведение мышей ММ было более активным и в плане контактов с новой пищей, и по количеству съеденного сыра. Отметим, что у мышей С57BL/N стресс иммобилизации вызывал снижение потребления пищи (гипофагию), однако его оценивали в привычной (а не в новой) обстановке (Jiang, Eiden, 2016). В целом состояние стресса вызывает не только мощную активацию симпато-адреналовой системы, но и изменения в нейротрансмиттерных системах мозга (De Boer et al., 1989), которые могут сказываться на пищевой мотивации (и на тревожности) генотип-зависимым образом. Несколько более высокая активность мышей ММ в этом тесте после иммобилизации совпадает с признаками активации поведения животных этой группы в двух других тестах (см. Результаты исследований) и позволяет предположить, что это отражает повышение тревожности. При этом большая активность мышей ММ после иммобилизации, возможно, способствует более успешному обнаружению ими источника пищи в этом тесте.
В тесте “неизбегаемой скользкой воронки” помещенное в воронку животное может оставаться неподвижным, стоя на задних лапах в горловине воронки, но может и проявлять активность. Неподвижность в воронке сопоставляют с состоянием неподвижности в тесте Порсолта, в котором неподвижность трактуют как проявление склонности животного к депрессии. Тест скользкой воронки не связан с удельным весом животных из-за разницы в степени тучности (поскольку наличие подкожного жира облегчает пребывание в неподвижном состоянии), но по своей логике он частично сходен с тестом Порсолта (Salimov, 1999). Животное, находясь в воронке, может активно пытаться выпрыгнуть из нее, а может, забравшись на начало ската воронки, принять распластанную позу и быть тем самым избавленным от неприятного пребывания в воде. В тесте Порсолта такой (третьей) возможности у животного нет.
Различия в поведении мышей четырех групп в этом тесте имели достаточно сложный характер. У мышей БМ после иммобилизации отчетливо и достоверно увеличилось (по сравнению с контролем) время пребывания в распластанной позе. Этому изменению у них сопутствовало увеличение числа коротких эпизодов неподвижности. Можно сделать вывод, что в состоянии стресса мыши БМ чаще меняли “стратегию” от неподвижности к позе “реакции избавления”. Такое изменение “рисунка” соотношения реакций в скользкой воронке позволяет предположить, что в состоянии стресса мыши БМ выбирали более “выгодную” стратегию, чередуя отдых в состоянии неподвижности с избавлением от неприятного контакта с водой. У мышей ММ подобного феномена обнаружено не было – у группы ММ после иммобилизации время неподвижности было достоверно больше, чем в контроле, без значимых изменений в поведении избавления и избегания. Из этого можно сделать заключение, что состояние стресса у мышей БМ вызвало изменения поведения, позволившие им реагировать на неприятную обстановку более адекватно, тогда как у мышей ММ и проявилась склонность к неподвижности, и регистрировались менее “адекватные”, чем реакция избавления, попытки выпрыгнуть из воронки.
Успешное выполнение теста на поиск входа в укрытие предполагает, что животное оперирует эмпирическим законом “неисчезаемости” предмета по Ж. Пиаже – предмет продолжает существовать после исчезновения его из поля зрения субъекта, и его можно отыскать. Мышь может успешно решить этот тест, если у нее есть понимание, что лаз можно обнаружить, несмотря на то, что он перестал быть видимым. У контрольной группы ММ время решения этого теста (во 2-й и 3-й пробах) было достоверно длиннее, чем у БМ. Достаточно четко это было выражено и при решении 1-й пробы (т.е. в отсутствие “когнитивного” компонента теста). Выше упоминалось о том, что в тесте на гипонеофагию и в тесте с воронкой наблюдалась несколько более высокая активность мышей ММ при стрессе. Эта вызванная иммобилизацией активация могла препятствовать целенаправленному уходу в темноту, что можно трактовать как проявление повышенной тревожности мышей ММ (которая обнаруживалась и ранее (Perepelkina et al., 2013)).
У контрольных мышей БМ доля мышей, успешно решивших 1-ю пробу теста, была достоверно выше, чем у ММ-контроль, т.е. более высокая тревожность мешала мышам ММ быстро уйти в темноту. В группах после иммобилизации такое же межлинейное различие проявилось только в виде тенденции (р = 0.07). Достоверных различий в решении теста между мышами БМ и ММ (иммобилизация) в 3-й и 4-й пробах выявлено не было. Суммарные (по 2 группам) доли мышей БМ и ММ, не решивших тест в 3-й и 4-й пробах, были достоверно (p < 0.05) меньше в линии БМ. Несмотря на кажущуюся простоту теста на поиск входа в укрытие, интерпретация его результатов требует ряда допущений. Мы предполагаем, что у мышей БМ наличие препятствия в виде закрытого лаза сопровождается активной исследовательской реакцией (большее число стоек по сравнению с ММ), а в группе после иммобилизации это выражено наиболее четко (рис. 4 (б)). Очевидно, что анализ причин таких различий требует проведения специальных экспериментов.
Таким образом, судя по доле мышей, решивших “когнитивные” пробы этого теста, в работе не было обнаружено достоверных различий между экспериментальными и контрольными группами внутри каждой линии. Важный вопрос, на который настоящие данные не дают ответа, заключается в том, как одинаковая по длительности иммобилизация могла вызвать разные изменения, как минимум, в симпато-адреналовой системе мышей БМ и ММ.
Межлинейные различия в успешности решения теста (рис. 3 (б)) были достоверными только для 1-й пробы, в которой животное не встречало препятствий к уходу в темноту, а также для пробы 3. Можно предположить, что эти различия отражают, скорее, различия в уровне тревожности, которые несколько усиливаются в состоянии стресса, и это препятствует мышам ММ в отыскании лаза (исследовательских “стоек” у ММ также было меньше). Реакция крыс Вистар на новизну (которую также относят к показателям когнитивных способностей) нарушалась как при стрессе, так и при введении кортикостерона (Vargas-López et al., 2015), хотя данных о генотип-зависимых изменениях в литературе мы не нашли. Перед решением 3-й пробы теста на поиск входа в укрытие (с “пробкой”) у мышей БМ-иммобилизация было больше стоек, чем в контроле (p < 0.05) и чем у ММ-иммобилизация (рис. 4 б)), – “трудность” этой пробы для мышей БМ при стрессе проявилась в их поведении, тогда как у ММ такой эффект был недостоверным.
В целом полученные сравнительные данные свидетельствуют, что стресс не оказывает резкого влияния на выполнение когнитивного теста у мышей этих генотипов, хотя в поведении мышей линий БМ и ММ (17-е поколение разведения без селекции) выявлен целый ряд различий в поведении в состоянии стресса.
ВЫВОДЫ
1. У мышей линий, различающихся по относительному весу мозга (БМ, большой мозг, и ММ, малый мозг), в условиях разведения без отбора в 17 поколениях, выявлены межлинейные различия в выполнении тестов на гипонеофагию и неизбегаемой скользкой воронки.
2. В тесте неизбегаемой скользкой воронки межлинейные различия обнаруживались как между контрольными группами, так и между группами БМ и ММ в состоянии стресса после иммобилизации.
3. У мышей БМ в состоянии стресса была сильнее выражена реакция избавления, т.е. “стратегия”, при которой животное остается вне воды, т.е. испытывает меньший дискомфорт.
4. Достоверных эффектов влияния стресса иммобилизации на успешность решения когнитивного теста на неисчезаемость выявлено не было, хотя обнаружены межлинейные различия в виде более высокой способности к его решению у мышей линии БМ по сравнению с ММ.
5. Мыши ММ в состоянии стресса после иммобилизации обнаружили более высокое, чем в контроле, потребление незнакомой пищи в новой обстановке, тогда как у мышей БМ поведение в состоянии стресса не отличалось от контроля.
Работа выполнена при поддержке гранта РФФИ № 20-015-00287 и Госпрограммы N AAA-A16-11602166005-1.
Список литературы
Маркина Н.В., Попова Н.В., Салимов Р.М., Салимова Н.Б., Савчук О.В., Полетаева И.И. Уровни тревожности и стресс-реактивности у мышей, селектированных на большой и малый вес мозга. Журн. высш. нервн. деят. им. И.П. Павлова. 1999. 49 (5): 789–798.
Перепелкина О.В., Тарасова А.Ю., Огиенко Н.А., Лильп И.Г., Полетаева И.И. Вес мозга и когнитивные способности лабораторной мыши. Усп. совр. биол. 2019. 139 (5): 434–445.
Ben Abdallah N.M.-B., Fuss J., Trusel M., Galsworthy M.J., Bobsin K., Colacicco G., Deacon R.M.J., Riva M.A., Kellendonk C., Sprengel Rolf, Lipp H.-P., Gass P. The puzzle box as a simple and efficient behavioral test for exploring impairments of general cognition and executive functions in mouse models of schizophrenia. Exp. Neurol. 2011. 227 (1): 42–52.
De Boer S.F., Koopmans S.J., Slangen J.L. Van der Gugten J. Effects of fasting on plasma catecholamine, corticosterone and glucose concentrations under basal and stress conditions in individual rats. Physiol Behav. 1989. V. 45. № 5. P. 989–994.
Elenkov I.J., Wilder R.L., Chrousos G.P., Vizi E.S. The sympathetic nerve – an integrative interface between two supersystems: the brain and the immune system. Pharmacol. Rev. 2000. V. 52. № 4. P. 595–638.
Harris R.B., Zhou J., Shi M., Redmann S., Mynatt R.L., Ryan D.H. Overexpression of agouti protein and stress responsiveness in mice. Physiol. Behav. 2001. V. 73. № 4. P. 599–608. https://doi.org/10.1016/s0031-9384
Kulesskaya N., Voikar V. Assessment of mouse anxiety-like behavior in the light-dark box and open-field arena: role of equipment and procedure. Physiol Behav. 2014 Jun 22; 133: 30–8. https://doi.org/10.1016/j.physbeh.2014.05.006
Jiang S.Z., Eiden L.E. Activation of the HPA axis and depression of feeding behavior induced by restraint stress are separately regulated by PACAPergic neurotransmission in the mouse. Stress. 2016. V. 19. № 4. P. 374–382. https://doi.org/10.1080/10253890.2016.1174851
Malisch J.L., Breuner C.W., Kolb E.M., Wada H., Hannon R.M., Chappell M.A., Middleton K.M., Garland T.Jr. Behavioral despair and home-cage activity in mice with chronically elevated baseline corticosterone concentrations. Behav. Genet. 2009. V. 39. № 2. P. 192–201. https://doi.org/10.1007/s10519-008-9246-8
McEwen B.S., Bowles N.P., Gray J.D., Hill M.N., Hunter R.G., Karatsoreos I.N., Nasca C. Mechanisms of stress in the brain. Nat. Neurosci. 2015. V. 18. № 10. P. 1353–1363. https://doi.org/10.1038/nn.4086
Miyamoto T., Funakami Y., Kawashita E., Nomura A., Sugimoto N, Saeki H., Tsubota M., Ichida S., Kawabata A. Repeated cold stress enhances the acute restraint stress-induced hyperthermia in mice. Biol. Pharm. Bull. 2017. V. 40. № 1. P. 11–16. https://doi.org/10.1248/bpb.b16-00343
O’Connor R.M., Finger B.C., Flor P.J., Cryan J.F. Metabotropic glutamate receptor 7: At the interface of cognition and emotion. Eur. J. Pharmacol. 2010. V. 639. № 1–3, P. 123–31. https://doi.org/10.1016/j.ejphar.2010.02.059
O’Mahony C.M., Sweeney F.F., Daly E., Dinan T.G., Cryan J.F. Restraint stress-induced brain activation patterns in two strains of mice differing in their anxiety behaviour. Behav. Brain Res. 2010. V. 213. № 2. P. 148–54. https://doi.org/10.1016/j.bbr.2010.04.038
Parker C.C., Ponicsan H., Spencer R.L., Holmes A., Johnson T.E. Restraint stress and exogenous corticosterone differentially alter sensitivity to the sedative-hypnotic effects of ethanol in inbred long-sleep and inbred short-sleep mice. Alcohol. 2008. V. 42. № 6. P. 477–485. https://doi.org/10.1016/j.alcohol.2008.05.004
Perepelkina O.V., Golibrodo V.A., Lilp I.G., Poletaeva I.I. Mice selected for large and small brain weight: The preservation of trait differences after the selection was discontinued Adv. Biosci. Biotechn. 2013. V. 4. P. 1–8.
Rygula R., Papciak J., Popik P. Trait pessimism predicts vulnerability to stress-induced anhedonia in rats. Neuropsychopharmac. 2013. V. 38 № 11. P. 2188–2196. https://doi.org/10.1038/npp.2013.116
Salimov R.M. Different Behavioral Patterns Related to Alcohol Use in Rodents: A Factor Analysis Alcohol, 1999 Feb; 17 (2): 157–62. https://doi.org/10.1016/s0741-8329
Sulakhiya K., Patel V.K., Saxena R., Dashore J., mit Kumar Srivastava A.K., Rathore M. Effect of Beta vulgaris Linn. leaves extract on anxiety- and depressive-like behavior and oxidative stress in mice after acute restraint stress. Pharmacognosy Res. 2016. V. 8. № 1. P. 1–7. https://doi.org/10.4103/0974-8490.171100
Vargas-López V., Torres-Berrio A., González-Martínez L., Múnera A., Lamprea M.R. Acute restraint stress and corticosterone transiently disrupts novelty preference in an object recognition task. Behav Brain Res. 2015. V. 291. P. 60–66. https://doi.org/10.1016/j.bbr.2015.05.006
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


