Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 6, стр. 825-836
Роль глюкокортикоидных гормонов в стресс-протективных эффектах гипоксического посткондиционирования в моделях депрессии и посттравматического стрессового расстройства у крыс
М. Ю. Зенько 1, Е. А. Рыбникова 1, *
1 Федеральное государственное бюджетное учреждение науки
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: rybnikovaea@infran.ru
Поступила в редакцию 01.06.2020
После доработки 17.07.2020
Принята к публикации 20.07.2020
Аннотация
Исследовали эффекты применения нейропротективного способа гипоксического гипобарического посткондиционирования (ПостК) в двух экспериментальных моделях: посттравматического стрессового расстройства “стресс-рестресс” и депрессии “выученная беспомощность” у крыс. ПостК (360 мм рт. ст., 2 ч.) осуществляли трехкратно, с 24-часовым интервалом, первый сеанс начинали спустя 24 ч после патогенного психоэмоционального стресса. В поведенческих тестах “Открытое поле” и “Приподнятый крестообразный лабиринт” были выявлены антидепрессивный и анксиолитический эффекты ПостК. Наряду с поведенческими симптомами специфические для каждой патологии отклонения базального уровня кортикостерона в крови и модификации иммунореактивности к глюкокортикоидным рецепторам и кортиколиберину в гиппокампе также нивелировались после применения ПостК. Используя инъекции ингибитора синтеза глюкокортикоидных гормонов метирапона, показано, что антидепрессивное и анксиолитическое действие гипобарического ПостК в моделях постстрессорных тревожно-депрессивных расстройств реализуются с участием глюкокортикоидных гормонов.
Депрессивное (рекуррентное, дистимическое или депрессивно-тревожное, МКБ11 [WHO, ICD-11 alpha, 2011]) и посттравматическое стрессовое расстройства являются распространенными психическими заболеваниями [WHO, 2017], развитие которых у человека и в моделях на животных сопровождается характерными нарушениями регуляции гипоталамо-гипофизарно-адренокортикальной системы (ГГАС) [Raone, 2007]. Посттравматическое стрессовое расстройство (ПТСР) отсроченно развивается после сверхинтенсивных стрессорных воздействий [Shalev et al., 1996] и характеризуется сенситизацией глюкокортикоидной обратной связи и сниженным уровнем глюкокортикоидов в крови [Yehuda, 2005; De Kloet et al., 2006; Yehuda, LeDoux 2007; Zenko, 2018]. Напротив, ослабление торможения ГГАС и повышенный уровень глюкокортикоидных гормонов в крови наблюдаются при депрессивных патологиях [Pariante et al., 2008; Keller et al., 2017]. Эффективность существующих подходов к фармакотерапии депрессии и ПТСР довольна низка [Fiszman et al., 2008; Bauer et al., 2017], что представляет значительную проблему на фоне их нарастающей распространенности [Galea, 2005; Hidaka, 2012]. В связи с этим разработка новых, в том числе нефармакологических методов терапии постстрессорных расстройств [Holtzheimer et al., 2012; Lima et al., 2015], представляет собой актуальную тему для биомедицинских исследований.
Гипоксическое/ишемическое пре- и посткондиционирование – это предварительная (преК) или последующая (постК) экспозиция эпизодам умеренной гипоксии или ишемии, повышающая устойчивость организма к действию тяжелой гипоксии или ишемии. Впервые феномены ишемического ПреК и ПостК были описаны в 1986 и 2003 г. соответственно [Murry et al., 1986; Zhao et al., 2003]. В нашей лаборатории было разработано Пре- и ПостК с применением гипобарической гипоксии [Патент № 2593345, 2016], оказывающее выраженное нейропротективное действие при коррекции постгипоксических патологий. Нами также был выявлен и описан превентивный эффект ПреК в моделях депрессии [Rybnikova et al., 2007] и ПТСР [Рыбникова и др., 2008]. Что касается ПостК, то вопрос о его эффективности в отношении коррекции постстрессорных расстройств и возможные эндогенные механизмы этого феномена на данный момент изучены слабо. Недавно нами показано, что на молекулярном уровне ПостК стимулирует экспрессию нейротрофина BDNF в нейронах гиппокампа и неокортекса, что свидетельствует о важном вкладе процессов нейропластичности в этих отделах мозга в механизмы, активируемые ПостК [Зенько и др., 2014]. Однако, как уже отмечалось выше, в патогенезе тревожно-депрессивных расстройств наблюдаются характерные гормональные нарушения, что, очевидно, свидетельствует о возможной роли ГГАС в формировании этих патологий и, соответственно, их коррекции. С учетом этого, цель настоящей работы состояла в исследовании как возможного корректирующего действия ПостК на формирование тревожно-депрессивных расстройств, так и вклада ГГАС в изучаемые эффекты. С этой целью ставились две задачи: впервые оценить эффекты гипоксического ПостК в двух экспериментальных моделях – депрессии “выученная беспомощность” (ВБ) и ПТСР у крыс – и исследовать изменения уровня глюкокортикоидных гормонов, экспрессии кортиколиберина, глюкокортикоидных и кортиколибериновых рецепторов в гиппокампе после применяемых стрессорных воздействий и ПостК. Выбор гиппокампа обусловлен тем, что данная структура мозга играет ключевую роль в регуляции функции ГГАС [Jacobson, Sapolsky 1991; Harvey, 2006; Гуляева, 2015], нарушенной при данных патологиях [Morris, 2012; Sheynin, Liberzon, 2017].
МЕТОДИКА
Объект исследования. Работа была выполнена на 114 взрослых самцах крыс аутбредной линии Вистар массой 200–250 г из ЦКП “Биоколлекция ИФ РАН”. При проведении экспериментов были соблюдены принципы, изложенные в директивах Европейского Совета (2010/63/ЕU) и положениях ИФ РАН о работе с животными, используемыми в научных экспериментах.
Экспериментальная модель депрессии “выученная беспомощность”. В серии экспериментов модели депрессии были использованы 72 крысы. В качестве экспериментальной модели депрессии была использована наиболее распространенная классическая парадигма “выученной беспомощности” (ВБ), в которой воздействие неизбегаемого аверсивного стрессора приводит к развитию у животных состояния, при котором они после неудачных попыток прекращают пытаться избежать стрессорного воздействия [Seligman, Beagley, 1975]. Неизбегаемый стресс создавался путем импульсной электрокожной стимуляции (1 мА, 1 Гц) в установке с токопроводящим полом с временным интервалом случайной длительности от 1 до 15 сек., 60 стимуляций (1 ч). Воздействие неконтролируемого, аверсивного стрессора приводит к последующему развитию стойкого депрессивно-подобного состояния, что отмечается по результатам поведенческого тестирования и повышению базального уровня кортикостерона относительно контрольных животных. Крысы модели ВБ проявляют ангедонию, что выражается в снижении потребления растворов сахарозы [Forbes et al., 1996], а также характеризуются повышенным временем иммобилизации в тесте вынужденного плавания Порсолта [López-Rubalcava, Lucki, 2000], замираниями и снижением горизонтальной активности в тесте “Открытое поле” [Katz et al., 1981].
Экспериментальная модель посттравматического стрессового расстройства. Для индукции экспериментального аналога другой патологии, ПТСР, у крыс (42 шт.) была использована модель “патогенный стресс-умеренный рестресс” [Liberzon et al., 1997], где в качестве патогенного стресса используется 2-часовая иммобилизация крыс в пеналах, затем 20-минутное вынужденное плавание и, после 15-минутного перерыва, ингаляция диэтилового эфира до наркозного состояния. Рестресс, т.е. повторный стрессор, являющийся триггером развития ПТСР (30-минутная иммобилизация животных в пеналах), проводился на 7-й день после травматического стресса. Наличие патологии отмечается по результатам поведенческого тестирования и снижению базального уровня кортикостерона.
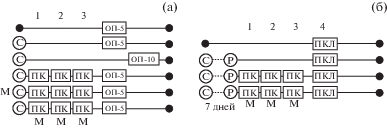
Гипоксическое посткондиционирование. С целью коррекции постстрессорных расстройств двух исследуемых экспериментальных расстройств было использовано гипоксическое ПостК путем трехкратной экспозиции умеренной гипобарической гипоксии (360 мм рт. ст., 2 ч) в барокамере проточного типа с 24-часовым интервалом. Первый сеанс проводился через 24 ч после патогенного стресса модели ВБ либо рестресса в модели ПТСР (рис. 1).
Рис. 1.
Схема экспериментов. (а) – экспериментальная модель депрессии ВБ. (б) – экспериментальная модель посттравматического стрессового расстройства. С – патогенный стресс, Р – рестресс, ПК – посткондиционирование, ОП – тест “Открытое поле”, ПКЛ – тест “Приподнятый крестообразный лабиринт”, М – введение метирапона (30 мг/кг, в.б.) за 30 мин до стрессирования или ПостК.
Fig. 1. Scheme of experiments. (а) – an experimental model of depression. (б) – an experimental model of post-traumatic stress disorder. С – pathogenic stress, Р – restress, ПК – post-conditioning, ОП – open field test, ПКЛ – elevated plus maze test, М – metyrapone injection (30 mg/kg, i.p.) 30 min before stress or ПК.
Тестирование на депрессивно-подобное и тревожное поведение. Развитие поведенческих отклонений и эффекты ПостК оценивали методами “приподнятый крестообразный лабиринт” (в модели ПТСР) на 4-й день после рестресса и “открытое поле” (в модели депрессии) на 5-е или 10-е сутки после патогенного стресса соответственно (рис. 1). Тест “Приподнятый крестообразный лабиринт” (ПКЛ, TS0502-R3, ООО “НПК Открытая Наука”) выполняли в течение 5 мин по общепринятой методике [Pellow et al., 1985]. Тревожное поведение животного характеризуется предпочтением закрытых рукавов открытым [Pellow et al., 1985; Walf, Frye, 2007]. Тестирование депрессивно-подобного поведения в тесте “Открытое поле” (ОП) [Hall, 1936] проводили в течение 5 мин в установке квадратной формы площадью 1 м2, разбитой на 36 одинаковых квадратов. Фиксировали латентный период, количество пересеченных квадратов различных зон установки (4 центральных, 12 средних, 20 крайних) при перемещении, время замирания, груминга, вертикальных стоек. Крысы модели ВБ характеризуются эпизодами замирания и снижением горизонтальной активности при тестировании в ОП [Katz et al., 1981], что может считаться аналогом психомоторной заторможенности, наблюдаемой у пациентов с депрессивными расстройствами [Caligiuri, Ellwanger, 2000]. В наших предыдущих исследованиях было показано соответствие результатов теста “Открытое поле” с данными специфических тестов на депрессию (ангедонией, дексаметазоновым тестом, тестом с антидепрессантами и пр.) [Рыбникова и др., 2007].
Иммуноферментный анализ. Через сутки после поведенческих тестов крыс декапитировали и собирали периферическую (туловищную) кровь, которую центрифугировали 15 мин при 4°С и 1500 g для получения сыворотки. Пробы хранили при –40°С до проведения иммуноферментного анализа. Для определения уровня кортикостерона в сыворотке крови использовали наборы для иммуноферментного анализа (K210R, “Кортикостерон крыса/мышь ИФА”, Xeмa, РФ).
Фармакологический анализ. Ингибитор синтеза глюкокортикоидных гормонов – метирапон (Santa Cruz Biotechnology Inc., USA), блокирующий работу 11-β-гидроксилазы [Hays et al., 1984], был использован для изучения возможного глюкокортикоид-зависимого пути развития постстрессорной патологии модели ВБ и вклада глюкокортикоидных гормонов в стресс-протективное действие гипобарического ПостК. Метирапон (30 мг/кг, в.б.) вводился за 30 мин до каждого сеанса посткондиционирования или патогенного стресса. Последующее развитие (или отсутствие) поведенческих отклонений оценивали методами ПКЛ (в модели ПТСР) на 4-й день после рестресса и ОП (в модели депрессии) на 5-е сутки после патогенного стресса (рис. 1).
Иммуногистохимический анализ. Для получения гистологических препаратов крыс декапитировали, мозг извлекали, выделяли сегменты, включающие области гиппокампа с прилежащим фронто-париетальным неокортексом. Выделенные образцы ткани мозга крыс были проведены через процедуры фиксации, обезвоживания и заливки в соответствии с рутинным протоколом, опубликованным ранее [Зенько и др., 2014]. При помощи микротома (Reichert, Austria) изготавливали серии чередующихся срезов мозга во фронтальной плоскости толщиной 7 мкм на уровне –2.80 мм от брегмы [Paxinos, Watson, 2005]. Для иммуногистохимического анализа были использованы поликлональные кроличьи антитела к ГР (Santa Cruz Biotechnology, USA 1:170) и к КЛ и КЛ-Р1/2 (Merck, USA, 1:400). После инкубации на срезы наносили вторичные биотинилированные антитела и раствор авидин-биотинового комплекса, из набора для детекции фирмы Vector Laboratories Inc. (UK, PK-4001). Для визуализации реакции связывания антитела с антигеном использовался диаминобензидиновый набор (Peroxidase Substrate Kit DAB: SK-4100, Vector Laboratories, UK). Полученные препараты заключали под покровную среду ImmunoHistoMount (Santa Cruz Biotechnology, USA).
Количественный анализ иммунореактивности нейронов проводили с использованием системы анализа микроизображений: световой микроскоп Olympus CX31RBSF (Optical systems, Germany), цифровая камера ProgResCT1 (Jenoptik, Germany) и компьютер с программным обеспечением “ВидеоТест Морфология 5.2” (ВидеоТест, РФ). С учетом величины интегральной оптической плотности был произведен подсчет числа иммунореактивных клеток на участке размером 350×400 мкм, 5% наиболее иммунореактивных клеток выделены в класс интенсивных.
Статистическая обработка результатов. Был использован программный пакет STATISTICA 10.0. Распределение параметров, проанализированных в статье, было проверено на нормальность по критерию Колмогорова–Смирнова, после чего был использован непараметрический U-критерий Манна–Уитни. Различия между выборками считали статистически значимыми при р ≤ 0.05. Данные на рисунках представлены в виде среднего ± ошибка среднего или в процентах от средних значений в контрольной группе.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
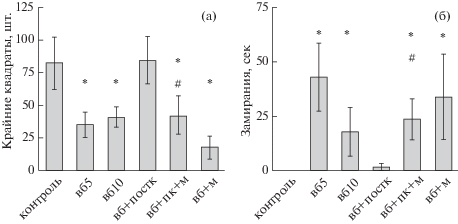
Поведенческие и гормональные нарушения в группах экспериментальных патологий, эффекты применения ПостК. Неизбегаемый стресс в модели ВБ приводил к развитию у крыс отсроченного стойкого депрессивно-подобного состояния, симптомы которого были выявлены в тесте ОП на 5-е или 10-е сутки после аверсивного стресса: наблюдалось достоверное снижение двигательной активности животных и на 5-е, и на 10-е сутки, что проявлялось в уменьшении количества пересеченных крайних квадратов (рис. 2 (а)), вместе с появлением замираний (рис. 2 (б)). Животные, прошедшие ПостК после стрессорного воздействия модели ВБ, по показателям горизонтальной и вертикальной двигательной активности, латентным периодам и отсутствию замираний не отличались от контрольных животных, что свидетельствует о стресс-протективном эффекте гипоксического ПостК в модели депрессии ВБ. Помимо моторной заторможенности, развитие выученной беспомощности сопровождалось достоверным повышением базального уровня кортикостерона плазмы крови (рис. 2 (а)).
Рис. 2.
Результаты теста “Открытое поле”. (а) – количество пройденных крайних квадратов крысами разных экспериментальных групп (n = 6). (б) – общее время замирания крыс за 5 мин теста. Обозначения групп: контроль – интактные животные; вб5 – “выученная беспомощность”, 5-е сутки после патогенного стресса; вб10 – модель ВБ, 10-е сутки; вб + постк – ВБ + ПостК; вб + пк + м – ВБ + ПостК с предварительным введением метирапона; вб + м – модель ВБ с введением метирапона перед патогенным стрессом. * – достоверное отличие от контрольной группы; # – достоверное отличие группы ПостК. р ≤ 0.05, критерий Манна–Уитни.
Fig. 2. Results of the “Open Field” test. (а) – number of passed squares by rats of different experimental groups (n = 6). (б) – total time of rats freezing in 5 minutes of the test. Group symbols: контроль – intact animals; вб5 – learned helplessness (LH), the 5th day after pathogenic stress; вб10 – learned helplessness model, the 10th day; вб + постк – LH + PostC; вб + пк + м – LH + PostC with preliminary injection of metyrapone; вб + м – LH model with injection of methyrapone before pathogenic stress. * – significant difference from the control group; # – significant difference from the PostC group. р ≤ 0.05, Mann–Whitney U test.
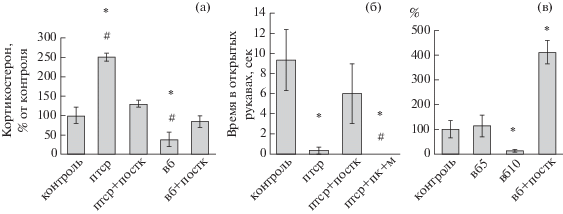
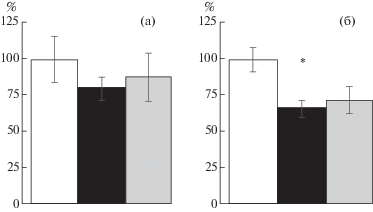
В поведенческом тесте ПКЛ, проводимом на 4-й день после рестресса для верификации развития тревожного состояния в модели пост-травматического стрессового расстройства, был выявлен достоверный анксиогенный эффект в группе ПТСР: животные данной группы проводили достоверно меньше времени в открытых рукавах установки, по сравнению с контрольными животными (рис. 3 (б)). При этом в группе гипоксического ПостК, примененного после рестресса модели ПТСР, крысы проводили в открытых рукавах установки ПКЛ время, сопоставимое с показателями контрольной группы, что свидетельствует об анксиолитическом действии гипобарического ПостК. Развитие экспериментального ПТСР также сопровождалось достоверным снижением базального уровня кортикостерона в плазме крови крыс (рис. 3 (а)), что также корректировалось ПостК.
Рис. 3.
(а) – уровень базального кортикостерона крови крыс разных групп (n = 6), в % от значений в контрольной группе. (б) – результаты теста ПКЛ, время в открытых рукавах установки. (в) – количество интенсивно-иммунореактивных к ГР клеток зоны СА1 гиппокампа, в % от значений в контрольной группе. Обозначения групп: контроль – интактные животные; вб, вб5/10 – модель “выученной беспомощности”, 5-е и 10-е дни соответственно; вб + постк – ВБ + ПостК; птср – модель ПТСР; птср + постк – ПТСР + + ПостК; птср + пк + м – ПТСР + ПостК с предварительным введением метирапона. * – достоверное отличие от контрольной группы; # – достоверное отличие группы ПостК. р ≤ 0.05, критерий Манна–Уитни.
Fig. 3. (а) – level of basal corticosterone in blood of rats of different groups (n = 6), % of values in the control group. (б) – EPM test results, time in the open sleeves of the unit. (в) – number of intensively GR-immunoreactive cells of hippocampal CA1 region, % of values in the control group. Groups: контроль – intact animals; вб, вб5/10 – learned helplessness model, the 5th and the 10th day respectively; вб + постк – LH + PostC; птср – PTSD model; птср + постк – PTSD + PostC; птср + постк + м – PTSD + PostC with preliminary metyrapone injection. * – significant difference from the control group; # – significant difference from the PostC group. р ≤ 0.05, Mann–Whitney U test.
Роль глюкокортикоидных гормонов в развитии выученной беспомощности: эффекты метирапона. Ранее нами показано, что стрессорный выброс глюкокортикоидных гормонов играет ключевую патогенетическую роль в формировании экспериментального ПТСР [Zenko et al., 2018]. В настоящей работе исследовали данный вопрос в модели депрессии ВБ, с этой целью был использован метирапон, вводимый за 30 мин перед патогенным стрессом модели ВБ. Показано, что в отличие от модели ПТСР, в модели депрессии введение метирапона перед стрессорным воздействием не оказывало значимого эффекта на проявление депрессивно-подобной поведенческой симптоматики (рис. 2 (а), (б)): животные этой модели по-прежнему имели достоверно выраженные замирания и сниженную горизонтальную активность относительно контроля. Таким образом, обнаружено еще одно существенное различие между патогенетическими механизмами двух исследуемых патологий.
Роль глюкокортикоидных гормонов в стресс-протективном эффекте ПостК: эффекты метирапона. Исследование роли глюкокортикоидных гормонов в стресс-протективном эффекте ПостК было проведено в обеих изучаемых моделях постстрессорных патологий. Было установлено, что на фоне блокады синтеза кортикостероидов метирапоном, вводимым перед каждым сеансом ПостК, его стресс-протективный эффект не проявлялся. В экспериментальной модели ПТСР это выражалось в достоверном снижении времени, которое крысы проводили в открытых рукавах в тесте ПКЛ (рис. 3 (б)), что свидетельствует о проявлении тревожного поведения, характерного для ПТСР. В тесте ОП крысы группы ВБ-ПостК-метирапон показали достоверно более низкую горизонтальную двигательную активность вместе с замираниями (рис. 2 (а), (б)) относительно контроля и группы ПостК, что соответствует депрессивно-подобному поведению модели ВБ. Эти данные указывают на то, что глюкокортикоидные гормоны играют ключевую роль не только в патогенезе ПТСР (как было установлено ранее), но и в механизмах его коррекции, задействуемых ПостК.
Иммуногистохимический анализ. Глюкокортикоидные рецепторы. В модели ПТСР на 4-е сутки уровень иммунореактивности к ГР в гиппокампе и неокортексе крыс достоверно не изменялся. У крыс модели ВБ в дорсальном гиппокампе (область СА1) количество интенсивно-иммунореактивных клеток к ГР на 10-е сутки достоверно снижается, после применения ПостК этот показатель, наоборот, возрастал (рис. 4 (в)).
Рис. 4.
Количество клеток, иммунореактивных к КЛ (а), (б) и его рецепторам (в), (г) в зоне СА1 (а), (в) и зубчатой извилине (б), (г) гиппокампа крыс разных экспериментальных групп (n = 6) модели ПТСР, в % от значений в контрольной группе. Белые столбцы – контрольная группа, 100%; черные – группа ПТСР; серые – группа ПТСР + ПостК. * – достоверное отличие от контрольной группы; # – достоверное отличие группы ПТСР + ПостК от ПТСР, р ≤ 0.05, критерий Манна–Уитни.
Fig. 4. Number of CRH- (а), (б) and CRHR-immunoreactive cells (в), (г) in hippocampal CA1 field (а), (в) and dentate gyrus (б), (г) in rats of different experimental groups (n = 6) of PTSD model, % of values in the control group. White columns – control group, 100%; black – PTSD group; grey – PTSD + PostC group. * – significant difference from the control group; # – significant difference PTSD + PostC group from the PostC group. р ≤ 0.05, Mann–Whitney U test.
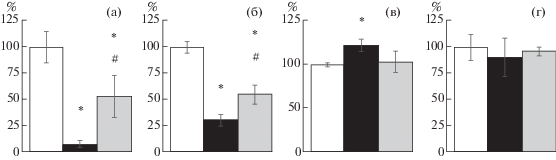
Кортиколиберин и кортиколибериновые рецепторы (КЛ и КЛ-Р). При развитии ПТСР на 4-й день после рестресса было отмечено достоверное снижение иммунореактивности к КЛ в зоне СА1 и зубчатой извилине гиппокампа. ПостК частично, но всегда достоверно корректировало изменения уровня иммунореактивного КЛ (рис. 4 (а), (б)). Данное изменение сопровождалось повышением иммунореактивности к КЛ-Р1/2 при развитии ПТСР в зоне СА1 (рис. 4 (в)), но не зубчатой извилине гиппокампа (рис. 4 (г)).
В модели депрессии на 5-е сутки иммунореактивность к КЛ в зубчатой извилине гиппокампа животных группы ВБ была достоверно сниженной (рис. 5 (б)), а в группе ПостК это изменение было на уровне тенденции (рис. 5 (б), р = 0.06). В зоне CА1 гиппокампа достоверных изменений иммунореактивности к КЛ в модели ВБ отмечено не было (рис. 5 (а)).
Рис. 5.
Количество клеток, иммунореактивных к КЛ в зоне СА1 (а) и зубчатой извилине (б) гиппокампа крыс разных экспериментальных групп (n = 6) модели ВБ, в % от значений в контрольной группе. Белые столбцы – контрольная группа, 100%; черные – группа ВБ, 5-е сутки; серые – группа ВБ + ПостК. * – достоверное отличие от контрольной группы, р ≤ 0.05, критерий Манна–Уитни.
Fig. 5. Number CRH-immunoreactive cells in hippocampal CA1 field (а) and dentate gyrus (б) in rats of different experimental groups (n = 6) of the LH model, % of values in the control group. White columns – control group, 100%; black – LH group, the 5th day; grey – LH + PostC group. * – significant difference from the control group, р ≤ 0.05, Mann–Whitney U test.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В основе Пре- и ПостК лежит феномен перекрестной адаптации к гомо- и гетеротипическим стрессорам. Клинические и экспериментальные данные свидетельствуют о наличии большого числа вариантов перекрестной адаптации как с системными, так и эмоциональными стрессорами: существует положительная перекрестная адаптация между гипоксией [Meerson et al., 1994; Зенько, Рыбникова, 2019], тепловым [Mefferd, Hale et al., 1958; Gibson et al., 2017], холодовым [Lunt et al., 2010], психосоциальным стрессами [Klaperski et al., 2013], вынужденным плаванием [Price et al., 2002], иммобилизацией и большим количеством других стрессоров [Armario et al., 1984; Lee et al., 2019].
Изучение ишемического и гипоксического Пре/ПостК показало их высокую эффективность для кардио- [Vinten-Johansen et al., 2007], нефро- [Ali et al., 2007], нейро- [Gidday et al., 1997; Рыбникова и др., 2008] и геропротекции [Arumugam et al., 2006]. Гипобарическое Пре- и ПостК, разработанное в нашей лаборатории [Патент № 2593345, 2016], имеет преимущество в меньшей инвазивности по сравнению с ишемическими воздействиями, так же как и дистантные модификации ишемического кондиционирования [Баранова, Зенько, 2018].
В наших предыдущих исследованиях в моделях ПТСР и ВБ у крыс было показано, что гипоксическая толерантность организма, индуцируемая гипобарическим гипоксическим ПреК, обеспечивает повышение резистентности не только к факторам гипоксической природы, но и к психоэмоциональным стрессорам [Рыбникова и др., 2008; Zenko et al., 2019]. По-видимому, это может быть связано со сложными перестройками функции ГГАС на всех уровнях ее регуляции [Рыбникова и др., 2008] одновременно со стимуляцией экспрессии нейротрофического фактора мозга [Зенько и др., 2014]. Изучение потенциального терапевтического (ПостК), а не превентивного (ПреК) метода коррекции этих расстройств является предметом нынешнего исследования.
Полученные данные поведенческого тестирования показали достоверный анксиолитический и антидепрессивный эффекты гипобарического ПостК (рис. 1, 2), а также нормализацию иммунореактивности к КЛ и BDNF в модели ПТСР [Зенько и др., 2014], и КЛ и ГР в гиппокампе в модели депрессии (рис. 2, 3), и, по-видимому, могут свидетельствовать о терапевтическом потенциале его применения для лечения ПТСР и депрессии.
Развитие патологических состояний в моделях ПТСР и ВБ сопровождалось модификацией работы ГГАС [Рыбникова и др., 2008; Zenko et al., 2018] и экспрессии ее экстрагипоталамических регуляторов – КЛ и его рецепторов, ГР в гиппокампе. Снижение уровня BDNF характерно для модели ПТСР [Vollmayr et al., 2001; Зенько и др., 2014].
На поведенческом уровне крысы модели ВБ характеризуются сниженной горизонтальной активностью и замираниями в тесте ОП [Katz et al., 1981]. Моторная заторможенность наряду с гипотимией и ангедонией является частью т.н. депрессивной триады, т.е. тремя ключевыми симптомами у пациентов с депрессией [Caligiuri, Ellwanger, 2000]. В экспериментальных моделях депрессии у животных психомоторная заторможенность и преобладание пассивной стратегии поведения выявляются по активности крыс в тестах принудительного подвешивания, ОП и вынужденного плавания Порсолта [López-Rubalcava, Lucki, 2000]. Ангедония – по изменению уровня потребления подслащенных растворов [Forbes et al., 1996].
Также развитие ВБ у крыс сопровождалось повышением базального уровня кортикостерона плазмы крови крыс (рис. 3 (а)). Подобный феномен в виде гиперкортизолемии является характерным для пациентов с депрессией [Axelson et al., 1993; Gillespie, Nemeroff, 2005]. Это совместно с данными по пониженному уровню кортикостерона в модели ПТСР (рис. 3 (а)) [Yehuda et al., 1995; Yehuda et al., 2000; Meewisse et al., 2007] дополнительно подтверждает валидность использованных экспериментальных моделей и воспроизведение патологии не только на поведенческом, но и на гормональном уровнях [Willner, 1986].
Исследование иммунореактивности к ГР в мозге крыс модели ВБ показало достоверное снижение количества интенсивных ГР-иммунореактивных клеток в зоне СА1 гиппокампа на 10-е сутки, применение ПостК, в свою очередь, достоверно повышало экспрессию ГР в данной зоне (рис. 3 (в)). В модели ПТСР на 4-е сутки уровень иммунореактивности к ГР в гиппокампе и неокортексе крыс достоверно не изменялся.
Полученные данные по иммунореактивности к КЛ (рис. 4) свидетельствуют также о вовлечении экстрагипоталамической КЛ-ергической системы в патогенез ПТСР и депрессии и в реализацию терапевтического эффекта гипоксического ПостК. Данные изменения, по-видимому, могут составлять важный механизм ПостК, способствуя компенсации ослабленной, в случае депрессии, отрицательной обратной связи в гипоталамо-гипофизарно-адренокортикальной оси, наблюдаемой и у пациентов [Lopez-Duran et al., 2009; Keller et al., 2017], и у животных в моделях депрессии [Greenberg et al., 1989].
Увеличение иммунореактивности к КЛ-Р в зоне CА1 гиппокампа при развитии ПТСР (рис. 4 (в)), вероятно, может отражать попытку компенсации снижения тонуса экстрагипоталамической КЛ-ергической системы через up-регуляцию его рецепторов. Однако в вентральном гиппокампе, структуре, которая преимущественно участвует в регуляции эмоций и форм поведения, связанных с тревожностью, подобных изменений отмечено не было (рис. 4 (г)) [Гуляева, 2015]. Это дополняется повышенной тревожностью животных группы ПТСР в тесте ПКЛ и, по-видимому, свидетельствует о ее недостаточности и важности роли вентрального гиппокампа в патогенезе ПТСР. Вовлечение гиппокампа как структуры, играющей ключевую роль в механизмах работы памяти, особенно значимо в контексте того, что развитие экспериментального ПТСР в модели, содержащей одновременно патогенный стресс и рестресс, по-видимому, обусловлено одновременным формированием ассоциативной памяти о стрессоре и неассоциативной сенситизации систем стрессорного ответа [Торопова, Анохин, 2018].
Как было показано ранее, введение метирапона за 30 минут перед травматическим стрессом модели ПТСР нивелировало развитие последующей патологии, что, по-видимому, может свидетельствовать о патогенетической роли глюкокортикоид-зависимых механизмов в ее развитии [Zenko et al., 2018]. Однако данные, полученные в настоящей работе в экспериментальной модели другого изучаемого расстройства, депрессии, показывают, что блокада выброса глюкокортикоидов в ответ на стресс в модели ВБ не влияла на развитие депрессивно-подобного состояния (рис. 2), что подчеркивает различие патогенетической природы этих расстройств.
Гипоксическое ПостК эффективно предотвращало развитие экспериментальных ПТСР и ВБ по результатам поведенческих тестов, в то время как сочетанное применение метирапона и ПостК таким эффектом не обладало (рис. 2, 3). Вызываемая гипобарическим ПостК коррекция поведенческих и нейроэндокринных нарушений в этих моделях, по-видимому, требует вовлечения глюкокортикоидных гормонов и, вероятно, реализации их стресс-протективного действия. Таким образом, глюкокортикоидные гормоны играют важную и двойственную роль как в реализации стресс-протективного эффекта гипоксического ПостК, так и в индукции экспериментального ПТСР, но не “выученной беспомощности” у крыс, несмотря на то, что последняя сопровождается гиперфункцией ГГАС [Mehta, Binder, 2012].
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют об эффективности применения гипоксического ПостК в моделях ПТСР и депрессии, а также о двойственной роли глюкокортикоидов в развитии и коррекции постстрессорных патологий и необходимости дальнейших исследований по данному вопросу.
Работа поддержана грантом Российского фонда фундаментальных исследований № 19-015-00336.
Список литературы
Баранова К.А., Зенько М.Ю. Анксиолитический эффект дистантного ишемического пре-и посткондиционирования в модели посттравматического стрессового расстройства. Журнал высш. нервн. деят. им. И.П. Павлова. 2018. 68 (5): 663–672.
Гуляева Н.В. Фундаментальные и трансляционные аспекты стресс-реактивности вентрального гиппокампа: функционально-биохимические механизмы измененной нейропластичности. Нейрохимия. 2015. 32 (2): 101–101.
Зенько М.Ю., Рыбникова Е.А. Перекрестная адаптация: от Ф.З. Меерсона до наших дней. Часть 1. Адаптация, перекрестная адаптация и перекрестная сенсибилизация. Усп. физиологических наук. 2019. 50 (4): 3–13.
Зенько М.Ю., Рыбникова Е.А., Глущенко Т.С. Экспрессия нейротрофина BDNF в гиппокампе и неокортексе у крыс при формировании постстрессового тревожного состояния и его коррекции гипоксическим посткондиционированием. Морфология. 2014. 146 (5): 14–18.
Рыбникова Е.А., Самойлов М.О., Миронова В.И., Тюлькова Е.И., Пивина С.Г., Ватаева Л.А., Колчев А.И. Возможности использования гипоксического прекондиционирования для профилактики постстрессовых депрессивных эпизодов. Журн. неврологии и психиатрии им. С.С. Корсакова. 2007. 107 (7): 43–48.
Рыбникова Е.А., Миронова В.И., Пивина С.Г., Ордян Н.Э., Тюлькова Е.И., Самойлов М.О. Гормональные механизмы гипоксического прекондиционирования у крыс. Докл. РАН. 2008. 421 (5): 713–715.
Способ улучшения когнитивных функций: Пат. 2593345 Рос. Федерация. МПК: A61M16/12. Беляков А.В., Дудкин К.Н., Рыбникова Е.А., Самойлов М.О.; заявл. 21.10.2014; опубл. 10.08.2016.
Торопова К.А., Анохин К.В. Моделирование посттравматического стрессового расстройства у мышей: нелинейная зависимость от силы травматического воздействия. Журн. высш. нервн. деят. им. И.П. Павлова. 2018. 68 (3): 378–394.
Ali Z.A., Callaghan C.J., Lim E., Ali A.A., Reza Nou-raei S.A., Akthar A.M., Gaunt M.E. Remote ischemic preconditioning reduces myocardial and renal injury after elective abdominal aortic aneurysm repair: a randomized controlled trial. Circulation. 2007. 116 (11): 1–98.
Armario A., Castellanos J.M., Balasch J. Effect of chronic noise on corticotropin function and on emotional reactivity in adult rats. Neuroendocrinol. Lett. 1984. 6 (2): 121–127.
Arumugam T.V., Gleichmann M., Tang S.C., Mattson M.P. Hormesis/preconditioning mechanisms, the nervous system and aging. Ageing Res. Rev. 2006. 5 (2): 165–178.
Axelson D.A., Doraiswamy P.M., McDonald W.M., Boyko O.B., Tupler L.A., Patterson L.J., Krishnan K.R. Hypercortisolemia and hippocampal changes in depression. Psychiatry Res. 1993. 47 (2): 163–173.
Bauer M., Severus E., Möller H.J., Young A.H. Task Force on Unipolar Depressive Disorders. Pharmacological treatment of unipolar depressive disorders: summary of WFSBP guidelines. Int. J. Psychiatr. Clin. Pract. 2017. 21 (3): 166–176.
Caligiuri M.P., Ellwanger J. Motor and cognitive aspects of motor retardation in depression. J. Affect. Disord. 2000. 57 (1–3). 83–93.
De Kloet C., Vermetten E., Geuze E., Kavelaars A., Heijnen, C., Westenberg, H. Assessment of HPA-axis function in posttraumatic stress disorder: pharmacological and non-pharmacological challenge tests, a review. J. Psychiatr. Res. 2006. 40 (6): 550–567.
Fiszman A., Mendlowicz M.V., Marques-Portella C., Volchan E., Coutinho E.S., Souza W.F., Figueira I. Peritraumatic tonic immobility predicts a poor response to pharmacological treatment in victims of urban violence with PTSD. J. Affect. Disord. 2008. 107 (1–3): 193–197.
Forbes N.F., Stewart C.A., Matthews K., Reid I.C. Chronic mild stress and sucrose consumption: validity as a model of depression. Physiol. Behav. 1996. 60 (6): 1481–1484.
Galea S., Nandi A., Vlahov D. The epidemiology of post-traumatic stress disorder after disasters. Epidemiol. Rev. 2005. 27 (1): 78–91.
Gibson O.R., Taylor L., Watt P.W., Maxwell N.S. Cross-adaptation: heat and cold adaptation to improve physiological and cellular responses to hypoxia. Sport Med. 2017. 47 (9): 1751–1768.
Gidday J.M., Fitzgibbons J.C., Shah A.R., Park T.S. Neuroprotection from ischemic brain injury by hypoxic preconditioning in the neonatal rat. Neurosci. Lett. 1994. 168 (1–2): 221–224.
Gillespie C.F., Nemeroff C.B. Hypercortisolemia and depression. Psychosom. Med. 2005. 67: S26–S28.
Greenberg L., Edwards E., Henn F.A. Dexamethasone suppression test in helpless rats. Biol. Psychiatry. 1989. 26 (5): 530–532.
Hall C.S. Emotional behavior in the rat. III. The relationship between emotionality and ambulatory activity. J. Comp. Psychol.1936. 22 (3): 345.
Harvey B.H., Brand L., Jeeva Z., Stein D.J. Cortical/hippocampal monoamines, HPA-axis changes and aversive behavior following stress and restress in an animal model of post-traumatic stress disorder. Physiol. Behav. 2006. 87 (5): 881–890.
Hays S.J., Tobes M.C., Gildersleeve D.L., Wieland D.M., Beierwaltes W.H. Structure-activity relationship study of the inhibition of adrenal cortical 11-beta-hydroxylase by new metyrapone analogs. J. Med. Chem. 1984. 27 (1): 15–19.
Hidaka B.H. Depression as a disease of modernity: explanations for increasing prevalence. J. Affect. Disord. 2012. 140 (3): 205–214.
Holtzheimer P.E., Kelley M.E., Gross R.E., Filkowski M.M., Garlow S.J., Barrocas A., Moreines J.L. Subcallosal cingulate deep brain stimulation for treatment-resistant unipolar and bipolar depression. JAMA Psychiatry. 2012. 69 (2): 150–158.
Jacobson L., Sapolsky R. The role of the hippocampus in feedback regulation of the hypothalamic-pituitary-adrenocortical axis. Endocr. Rev. 1991. 12 (2): 118–134.
Katz R.J., Roth K.A., Carroll B.J. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression. Neurosci. Biobehav. Rev. 1981. 5 (2): 247.
Keller J., Gomez R., Williams G., Lembke A., Lazzeroni L., Murphy G.M., Schatzberg A.F. HPA axis in major depression: cortisol, clinical symptomatology and genetic variation predict cognition. Mol. Psychiatry. 2017. 22 (4): 527–536.
Klaperski S., von Dawans B., Heinrichs M., Fuchs R. Does the level of physical exercise affect physiological and psychological responses to psychosocial stress in women? Psychol. Sport. Exerc. 2013. 14 (2): 266–274.
Lee B.J., Gibson O.R., Thake C.D., Tipton M., Hawley J.A., Cotter J.D. Cross Adaptation and Cross Tolerance in Human Health and Disease. Front. Physiol. 2019. 9: 1827.
Liberzon I., Krstov M., Young E.A. Stress-restress: effects on ACTH and fast feedback. Psychoneuroendocrinology. 1997. 22 (6): 443–453.
Lima B.F.R., Alencar A.A., Carneiro D.M., Sousa I.G.D., Moura J.A., Andrade Viana R.C., Carval S.N. The efficiency of electroconvulsive therapy in the treatment of depression in the elderly. Int. Arch. Med. 2015. 8.
Lopez-Duran N.L., Kovacs M., George C.J. Hypothalamic–pituitary–adrenal axis dysregulation in depressed children and adolescents: A meta-analysis. Psychoneuroendocrinology. 2009. 34 (9): 1272–1283.
López-Rubalcava C., Lucki I. Strain differences in the behavioral effects of antidepressant drugs in the rat forced swimming test. Neuropsychopharmacology. 2000. 22 (2): 191–199.
Lunt H.C., Barwood M.J., Corbett J., Tipton M.J. ‘Cross-adaptation’: habituation to short repeated cold-water immersions affects the response to acute hypoxia in humans. J. Physiol. 2010. 588 (18): 3605–3613.
Meerson F., Pozharov V., Minyailenko T. Superresistance against hypoxia after preliminary adaptation to repeated stress. Appl. Physiol. 1994. 76 (5): 1856–1861.
Meewisse M.L., Reitsma J.B., De Vries G.J., Gersons B.P., Olff M. Cortisol and post-traumatic stress disorder in adults: systematic review and meta-analysis. Br. J. Psychiatr. 2007. 191 (5): 387–392.
Mefferd J.R.R.B., Hale H.B. Effects of abrupt temperature changes on excretion characteristics of rats acclimated to cold, neutral or hot environments. Am. J. Physiol. 1958. 195 (3): 726–734.
Mehta D., Binder E.B. Gene×environment vulnerability factors for PTSD: the HPA-axis. Neuropharmacology. 2012. 62 (2): 654–662.
Morris M.C., Compas B.E., Garber J. Relations among posttraumatic stress disorder, comorbid major depression, and HPA function: a systematic review and meta-analysis. Clin. Psychol. Rev. 2012. 32 (4): 301–315.
Murry C.E., Jennings R.B., Reimer K.A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 1986. 74 (5): 1124–1136.
Pariante C.M., Lightman S.L. The HPA axis in major depression: classical theories and new developments. Trends Neurosci. 2008. 31 (9): 464–468.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates: hard cover edition. 2006. Elsevier.
Pellow S., Chopin P., File S.E., Briley M. Validation of open: closed arm entries in an elevated plus-maze as a measure of anxiety in the rat. J. Neurosci. Methods. 1985. 14 (3): 149–167.
Price M.L., Kirby L.G., Valentino R.J., Lucki I. Evidence for corticotropin-releasing factor regulation of serotonin in the lateral septum during acute swim stress: adaptation produced by repeated swimming. Psychopharmacology. 2002. 162 (4): 406–414.
Raone A., Cassanelli A., Scheggi S., Rauggi R., Danielli B., De Montis M. G. Hypothalamus–pituitary–adrenal modifications consequent to chronic stress exposure in an experimental model of depression in rats. Neuroscience. 2007. 146 (4): 1734–1742.
Rybnikova E., Mironova V., Pivina S., Tulkova E., Ordyan N., Vataeva L., Turner A. J. Antidepressant-like effects of mild hypoxia preconditioning in the learned helplessness model in rats. Neurosci. Lett. 2007. 417 (3): 234–239.
Seligman M.E., Beagley G. Learned helplessness in the rat. J. Comp. Physiol. Psychol. 1975. 88 (2): 534.
Shalev A.Y., Peri T., Canetti L., Schreiber S. Predictors of PTSD in injured trauma survivors: a prospective study. Am. J. Psychiatry. 2006. 153 (2): 219–225.
Sheynin J., Liberzon I. Circuit dysregulation and circuit-based treatments in posttraumatic stress disorder. Neurosci. Lett. 2017. 649: 133–138.
Vinten-Johansen J., Zhao Z.Q., Jiang R., Zatta A.J., Dobson G.P. Preconditioning and postconditioning: innate cardioprotection from ischemia-reperfusion injury. J. Appl. Physiol. 2007. 103 (4): 1441–1448.
Vollmayr B., Faust H., Lewicka S., Henn F. A. Brain-derived-neurotrophic-factor (BDNF) stress response in rats bred for learned helplessness. Mol. Psychiatry. 2001. 6 (4): 471–474.
Walf A.A., Frye C.A. The use of the elevated plus maze as an assay of anxiety-related behavior in rodents. Nat. Protoc. 2007. 2 (2): 322–328.
Willner P. Validation criteria for animal models of human mental disorders: learned helplessness as a paradigm case. Prog. Neuro-Psychopharmacol. Biol. Psychiatry. 1986. 10 (6): 677–690.
World Health Organization. Depression and other common mental disorders: global health estimates. World Health Organization, Geneva: WHO. 2017
World Health Organization. ICD-11 alpha. Content model reference guide. Geneva: WHO. 2011.
Yehuda R. Neuroendocrine aspects of PTSD. Anxiety Anxiolytic Drugs. 2005. 371–403.
Yehuda R., Bierer L.M., Schmeidler J., Aferiat D.H., Breslau I., Dolan S. Low cortisol and risk for PTSD in adult offspring of holocaust survivors. Am. J. Psychiatry. 2000. 157 (8): 1252–1259.
Yehuda R., Kahana B., Binder-Brynes K., Southwick S.M., Mason J.W., Giller E.L. Low urinary Cortisol excretion in holocaust survivors with posttraumatic stress disorder. Am. J. Psychiatry. 1995. 152 (7): 982–986.
Yehuda R., Le Doux J. Response variation following trauma: a translational neuroscience approach to understanding PTSD. Neuron. 2007. 56 (1): 19–32.
Zenko M.Y., Baranova K.A., Rybnikova E.A. Pathogenetic role of the stress-induced release of glucocorticoid hormones in the development of post-traumatic stress disorder: an experimental study. Dokl. Biol. Sci. 2018. 479 (1): 51–53.
Zenko M.Y., Rybnikova E.A. Antidepressant-like action of hypoxic postconditioning is accompanied by the up-regulation of hippocampal HIF-1α and erythropoietin. Med. Ac. J. 2019. 19 (4): 41–46.
Zhao Z.Q., Corvera J.S., Halkos M.E., Kerendi F., Wang N.P., Guyton R.A., Vinten-Johansen J. Inhibition of myocardial injury by ischemic postconditioning during reperfusion: comparison with ischemic preconditioning. Am. J. Physiol. 2003. 285 (2): H579–H588.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


