Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 6, стр. 807-824
Влияние рациона питания крыс во время беременности на поведение потомства после раннего провоспалительного стресса
И. В. Павлова 1, *, Н. Д. Брошевицкая 1, М. И. Зайченко 1, Г. А. Григорьян 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: pavlovfml@mail.ru
Поступила в редакцию 23.04.2020
После доработки 22.06.2020
Принята к публикации 20.07.2020
Аннотация
Исследовали влияние стандартного и высококалорийного питания беременных самок на поведение их потомства, подвергнутого раннему провоспалительному стрессу. Провоспалительный стресс создавали путем введения крысятам на третий и пятый дни жизни бактериального липополисахарида (ЛПС) в дозе 50 мкг/кг. При стандартном режиме питания беременных самок введение ЛПС вызывало у их потомства в подростковом возрасте снижение двигательной и исследовательской активности, а также усиление тревожного поведения в открытом поле и приподнятом крестообразном лабиринте. Высококалорийное ценное питание в период беременности предохраняло потомство крыс с ранним стрессом от данных изменений в поведении. Вместе с тем высококалорийное питание не устраняло признаки депрессивно-подобного поведения, которые наблюдались у самцов и самок в тесте предпочтения сахарозы, а также у самцов в тесте вынужденного плавания. Высококалорийное питание беременных самок приводило к снижению прироста уровня кортикостерона в крови в ответ на стрессирующее воздействие у самок после раннего провоспалительного стресса. Полученные результаты свидетельствуют, что высококалорийное питание беременных самок влияет на тревожное поведение и гормональную стресс-реактивность их потомства.
Известно, что стресс в раннем возрасте приводит к серьезным нарушениям нормального развития гипоталамо-гипофизарно- надпочечниковой, иммунной, нейрогормональной и других систем организма [Custódio et al., 2018; Danese, Lewis, 2017; Hohmann et al., 2017; van Bodegom et al., 2017; Tishkina et al., 2016; Григорьян и др., 2014; Григорьян, 2020]. В результате субъекты, перенесшие такой стресс, при повторных негативных воздействиях во взрослой жизни могут проявлять не только неадекватные поведенческие реакции, но и целый ряд психоневрологических заболеваний, таких как шизофрения, болезнь Альцгеймера, наркомания, синдром дефицита внимания и гиперактивности и др. Особенно часто под влиянием раннего стресса в зрелом возрасте проявляются тревожные расстройства и депрессии. Для выявления причинно-следственных отношений между ранним стрессом и поздними тревожно-депрессивными расстройствами и исследования патофизиологических механизмов этих отношений сегодня используются разные модели раннего стресса (материнское отлучение, социальная изоляция, умеренный хронический поведенческий стресс, липополисахаридная интоксикация и др.). Для анализа тревожно-депрессивного поведения животных тестируют в открытом поле, приподнятом крестообразном лабиринте, в тестах на предпочтение сахарозы, вынужденного плавания и др. В большинстве работ выраженный стресс в раннем возрасте вызывал у взрослых животных отчетливые признаки тревожного и депрессивно-подобного поведения. Однако при определенных условиях и под влиянием ряда факторов организм проявляет устойчивость (resilience) и не демонстрирует такого поведения [Ignácio et al., 2019; Lorsch et al., 2018; Mul et al., 2018; Wang et al., 2018; Anacker et al., 2016; do Prado et al., 2016; Holz et al., 2016; Rincel et al., 2016; Григорьян, Гуляева, 2015]. Выявление этих условий и факторов является важнейшей задачей современных исследований. Одним из центральных механизмов, через которые стресс влияет на развитие тревожно-депрессивных расстройств, является процесс нейровоспаления [Culmsee et al., 2019; Milenkovic et al., 2019; Stepanichev et al., 2014]. Вмешательства в этот процесс на разных уровнях (от молекулярно-клеточных до системных) с целью его ослабления и торможения препятствуют развитию тревожно-депрессивных расстройств [Culmsee et al., 2019; Ignácio et al., 2019; Taniguti et al., 2018; Wang et al., 2018; Tang et al., 2016; Jiang et al., 2016; Lucchina et al., 2010; Francis et al., 2002].
В литературе накоплено большое число данных, согласно которым чрезмерно богатая жирами диета (более 60% энергии из жира) и излишний вес матери во время беременности и лактации ведут к нарушению нормального развития потомства и нейровоспалительным процессам [см. обзоры De Capo et al., 2019; Edlow, 2017; Bilbo, Tsang, 2010; Rivera et al., 2015; Sullivan et al., 2015; 2012, Kang et al., 2014]. Этому сопутствуют усиленный окислительный стресс, дисрегуляция активности дофаминергической и серотонинергической систем мозга, нарушения инсулинового, глюкозного и лептинового сигналинга и синаптической пластичности. Кормление матерей богатой жирами диетой приводило на поведенческом уровне к проявлениям тревожного и депрессивно-подобного поведения у их потомства в тестах вынужденного плавания [Giriko et al., 2013], а также к нарушениям в распознавании нового объекта [Sullivan et al., 2010] и пространственного обучения в водном бассейне Морриса [Bilbo, Tsang, 2010]. Риск появления тревожных расстройств и депрессии у потомства был связан с длительностью высокожирной диеты у матери и с появлением у нее излишнего веса (ожирением) [Rincel et al., 2016]. При отсутствии ожирения усиленное кормление матери не приводило к поведенческим нарушениям у потомства. В ряде работ было показано, что диета с высоким содержанием жира как у матери во время беременности и лактации [Rincel et al., 2016], так и у крысят после отъема от матери [Maniam, Morris, 2010] имела защитное действие и была способна уменьшить негативные последствия раннего стресса на тревожно-депрессивное поведение потомства. При этом использовалась модель раннего стресса с материнской изоляцией [Rincel et al., 2016; Maniam, Morris, 2010] и с недостатками строительного материала для гнезда (limited nesting) [Maniam et al., 2016]. Диета матери с высоким содержанием жира во время беременности и лактации оказывала защитное действие на потомство, которое испытало пренатальный провоспалительный стресс [Huang et al., 2015] или хронический социальный стресс [Finger et al., 2011].
С учетом всего сказанного, целью настоящей работы было исследование на крысах линии Вистар влияния рациона питания самок во время беременности на тревожно-депрессивное поведение в подростковом возрасте их потомства, которое в раннем онтогенезе испытало провоспалительный стресс, создаваемый с помощью введения бактериального липополисахарида крысятам на 3-й и 5-й дни жизни. Выбор подросткового возраста объясняется тем, что, согласно нашим предыдущим исследованиям [Брошевицкая и др., 2020], именно в этом возрасте наблюдались наибольшие изменения в тревожно-депрессивном поведении крыс после раннего провоспалительного стресса, у взрослых крыс эффекты могли исчезать. В задачи работы входило изучение поведения крыс в открытом поле, приподнятом крестообразном лабиринте, в тесте на предпочтение сахарозы и тесте вынужденного плавания. Кроме того, с целью оценки активности гипоталамо-гипофизарно-надпочечниковой (ГГН) системы необходимо было проанализировать уровень кортикостерона в плазме крови до и после стрессирующего воздействия с помощью иммуноферментного анализа.
МЕТОДИКА
Объект исследования. В опытах было использовано 136 крыс линии Вистар в возрасте от 25 дней до 3 мес (69 самцов и 67 самок). Крысята (18 пометов) были выведены в виварии ИВНД и НФ от родителей, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА, Россия. Опыты проводили на животных, матери которых, начиная с первого дня ссаживания самцов и самок и на протяжении всей беременности вплоть до родов, получали два разных рациона питания. Самцы в течение 10 дней, пока находились в клетке с самкой, также получали разное питание. Первая серия экспериментов была выполнена на животных (8 пометов, 51 крыса), родители которых получали стандартный сухой корм для крыс (ПК-120, ГОСТ Р 50258-92, ОАО Мелькомбинат, Россия) с содержанием сырого протеина 19%, сырого жира 5% и раз в неделю – овощи и хлеб. Вторая серия экспериментов была выполнена на животных (10 пометов, 85 крыс), родители которых кроме стандартного сухого корма (ПК-120) через день получали в виде добавки высококалорийное питание (5–10 г на крысу), состоящее либо из вареных куриных крылышек и творога, либо из сухого корма (Pronature, Канада) с содержанием 27% белка, 17% жира. Необходимо отметить, что во второй серии опытов, в отличие от первой серии, пометы были более многочисленные, все крысята выживали, случаев поедания матерью своего потомства не наблюдалось.
Как в первой, так и во второй серии опытов на 3-й и 5-й дни жизни у одной группы крыс вызывали провоспалительный стресс путем введения бактериального липополисахарида (ЛПС) в дозе 50 мкг/кг в объеме 10 мкл/г (группа ЛПС, 47 крысят, 8 пометов). Во время этой процедуры крысят отлучали от матери на 15–20 мин, взвешивали на электронных весах с точностью до 0.01 г и делали им подкожную инъекцию ЛПС в холку с помощью инсулинового шприца. Другой группе крыс в этом же возрасте подкожно вводили физиологический раствор в объеме 10 мкл/г (группа ФИЗ, контроль I, 49 крысят, 5 пометов). Третья группа оставалась интактной, но на 3-й и 5-й дни жизни их также забирали от матери на 15–20 мин и взвешивали (группа ИНТ, контроль II, 40 крысят, 5 пометов). Точное число самцов и самок в каждой группе, участвующих в каждом тесте, приведено на рисунках. В возрасте 25 дней крысят отлучали от матери и разделяли на подгруппы в зависимости от пола. В дальнейшем животных содержали в виварии при обычном 12-часовом световом режиме в свободном доступе к воде и стандартному корму (ПК-120) в клетках по 3–5 крыс; в одной клетке находились крысы, как правило, из одного помета. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU), и положения ИВНД и НФ РАН о работе с экспериментальными животными.
Тестирование уровня тревожности. В работе изучали поведение крыс в двух тестах на тревожность: в “Открытом поле” (ОП) и в “Приподнятом крестообразном лабиринте” (ПКЛ). Перед первым тестированием для снижения стрессирующей нагрузки на животных проводили 10–15-минутное приручение (хендлинг) в течение 3–4 дней, при этом животных брали в руки, пересаживали из домашней клетки в переноску и обратно. Крыс тестировали в возрасте 30–40 дней (подростковый возраст). Использовали общепринятые размеры и конфигурации лабиринта и ОП, которые были подробно описаны ранее [Брошевицкая и др., 2020]. Время наблюдения в каждом тесте – 5 мин. Для фиксирования траектории движения крыс и элементов поведения использовали программу Etho Vision, а также видеорегистрацию. Анализировали показатели, отражающие тревожность/смелость крыс (время нахождения на периферии ОП, число и длительность выходов в центр ОП, в открытые рукава ПКЛ), двигательную активность крыс (пройденную дистанцию, скорость движения, время движения, число переходов между рукавами в ПКЛ), исследовательское поведение (стойки, выглядывания в открытые рукава в ПКЛ), поведение по оценке риска (свешивания в ПКЛ, вытягивания), элементы замещающего поведения (число и длительность груминга), а также ряд показателей, отражающих вегетативные реакции (число дефекаций и уринаций). При дальнейшей обработке поведения крыс в ПКЛ подсчитывали процент времени пребывания в открытых рукавах от общего времени нахождения в открытых и закрытых рукавах, а также процент времени движения от общего времени пребывания в лабиринте. Всегда вначале тестировали крысу в ОП, а через 2–3 дня в ПКЛ. Перед помещением в камеру животного другого пола, кроме обычной влажной и сухой уборки, лабиринт протирали 20%-м раствором этилового спирта. Для переноски самцов и самок из вивария в экспериментальную комнату и для ожидания своей очереди использовали разные клетки.
Тест на предпочтение сахарозы. Для оценки депрессивно-подобного поведения проводили тест на ангедонию у крыс в возрасте 40–45 дней. Тест проводили в течение одних или двух суток. В клетку помещали 2 бутылки, одну с 1–5%-м раствором сахарозы, другую с водой. Два раза в сутки (утром и вечером) бутылки взвешивали и меняли местами. Определяли объем выпитых раствора сахарозы и воды за сутки каждой крысой, а также процент выпитой сахарозы от общего объема потребленной жидкости.
Тест вынужденного плавания проводили в возрасте 45–50 и 90 дней, для этих целей использовали цилиндры из оргстекла диаметром 20 см и высотой 50 см, которые заполняли водой температурой 25–26°С до уровня 30 см. Крыс помещали в воду на 5 мин. При зависании (неподвижности) в ходе плавания крысы осуществляли лишь слабые движения лапами и хвостом для коррекции положения тела около поверхности воды. Во время опыта проводили видеорегистрацию. При обработке данных подсчитывали время зависания крыс поминутно и суммарно за весь опыт, число эпизодов зависания и среднюю длительность таких эпизодов за опыт.
Иммуноферментный анализ крови. Забор крови проводили у взрослых крыс в 3 мес за один день до и через 30–40 мин после теста вынужденного плавания. Для этого крыс наркотизировали с помощью изофлуранового ингаляционного наркоза (Аэрран), на кончике хвоста делали косые надрезы скальпелем и собирали периферическую кровь в объеме 0.5 мл. Затем кровь центрифугировали 15 мин при 4°С и 1500 g для получения сыворотки. Аликвоты сыворотки хранили при –80°С до проведения иммуноферментного анализа.
Для определения уровня кортикостерона в сыворотке крови использовали наборы для иммуноферментного анализа (DRG, Германия), с помощью которых детектировали как свободный, так и связанный с транспортными белками кортикостерон методом конкурентного иммуноферментного анализа.
Статистическая обработка результатов. Для вторичной обработки результатов использовали стандартную программу STATISTICA 8.0. Распределение данных было проверено на нормальность по критерию Колмогорова–Смирнова (Basic Statistics, раздел Descriptive Statistics). Если данные по анализируемому показателю удовлетворяли данному критерию, то при сравнении групп крыс использовали дисперсионный анализ ANOVA, раздел factorial ANOVA. При post-hoc анализе применяли Newman-Keuls test. Различия считали статистически значимыми при р < < 0.05, отмечали наличие тенденции при 0.05 ≤ р < 0.1. Во всех экспериментах анализировали влияние факторов ПОЛ и ГРУППА, в тесте вынужденного плавания также анализировали влияние факторов ВОЗДЕЙСТВИЕ и ВРЕМЯ. При отсутствии нормальности распределения данных использовали Kruskal-Wallis test, с последующим сравнением групп с помощью Multiple Comparisons (Nonparametric Statistics), а также Mann Whitney U test. Данные на рисунках представлены в виде средних значений ± ошибки средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Влияние раннего провоспалительного стресса на вес крыс. Вес крыс разных групп в возрасте 30 дней представлен в табл. 1. Видно, что только в первой серии экспериментов у самок ЛПС-группы вес был меньше, чем в группе ИНТ и ФИЗ (р < 0.05, Kruskal-Wallis test: H (2, N = 28) = 10.48, p = 0.005, Multiple Comparisons). Во второй серии экспериментов у самок ЛПС-группы вес не отличался от других групп и был больше, чем в 1-й серии (p < 0.05, Mann–Whitney U test). Других различий по весу между группами крыс в каждой серии, а также между первой и второй сериями не наблюдалось. Таким образом, ранний провоспалительный стресс привел к снижению веса у самок только в первой серии опытов. Усиленный рацион кормления матерей во время беременности нормализовал вес самок ЛПС-группы и не сказался на весе потомства других групп в возрасте 1 мес.
Таблица 1.
Влияние введения ЛПС в раннем онтогенезе на вес крысят в возрасте 30 дней Table 1. The influence of LPS administration in early ontogenesis on the weight of pups in the 30 days age
| Серия экспериментов | Группа | Вес самцов, г | Все самок, г |
|---|---|---|---|
| 1 серия | ИНТ | 85.9 ± 7.5 | 80.8 ± 7.5 |
| ФИЗ | 70.7 ± 8.5 | 76.0 ± 7.1 | |
| ЛПС | 74.0 ± 8.5 | 65.9 ± 7.5*+х | |
| 2 серия | ИНТ | 71.3 ± 5.9 | 72.9 ± 4.9 |
| ФИЗ | 72.6 ± 3.4 | 68.5 ± 4.7 | |
| ЛПС | 82.7 ± 3.9 | 77.9 ± 4.0 |
Примечание: * – статистически значимые различия между группами ЛПС и ФИЗ, + – между группами ИНТ, ЛПС (p < < 0.05, Kruskal–Wallis test, Multiple Comparisons), х – между крысами в 1-й и 2-й сериях (p < 0.05, Mann–Whitney U Test). Notes: * – the significant differences between groups ЛПС and ФИЗ, + – between ЛПС and ИНТ (p < 0.05, Kruskal–Wallis test, Multiple Comparisons), х – between rats in the first and second series (p < 0.05, Mann–Whitney U Test).
Влияние раннего провоспалительного стресса на поведение крыс в приподнятом крестообразном лабиринте. Необходимо отметить, что только некоторые из анализируемых показателей поведения имели нормальное распределение, результаты их анализа с помощью Factorial ANOVA представлены в табл. 2. В первой и второй сериях экспериментов результаты существенно различались. Видно (табл. 2), что в первой серии экспериментов фактор ГРУППА оказывал влияние на показатели, отражающие уровень тревожности крыс (число выходов в открытые рукава, процент времени пребывания в открытых рукавах), двигательной активности (дистанцию, скорость и время движения, число переходов через центр), исследовательской активности (стойки, выглядывания в открытые рукава). На другие регистрируемые показатели поведения исследуемые факторы не оказывали влияния, поэтому в дальнейшем они в результатах работы не упоминаются. Post hoc анализ показал, что в первой серии опытов у животных ЛПС-группы по сравнению с одной или двумя контрольными группами (ФИЗ и ИНТ) были меньше (р < 0.05) число выходов и время нахождения в открытых рукавах (рис. 1 (а), (б)), пройденная дистанция (рис. 1 (в)), скорость, время движения, число переходов через центр. Кроме того, у самцов и самок ЛПС-группы в первой серии было меньше стоек и выглядываний в открытые рукава по сравнению с контрольными группами (рис. 1 (г), (д)). Фактор ПОЛ не оказывал существенного влияния на анализируемые показатели. Таким образом, судя по результатам первой серии опытов, в возрасте 1 мес ранний провоспалительный стресс привел к снижению показателей двигательной и исследовательской активности, а также к увеличению уровня тревожности.
Таблица 2.
Значения F и р при анализе с помощью Factorial ANOVA некоторых показателей поведения в ПКЛ у крыс в 1-й и 2-й сериях опытов Table 2. F and р values of some parameters of behavior in the elevated plus maze in the first and second series of experiments in rats (Factorial ANOVA)
| Серия опытов | Показатель поведения | Фактор | |
|---|---|---|---|
| ГРУППА | ПОЛ | ||
| 1 серия | Выходы в ОР | F2,45 = 3.39, р = 0.042 | – |
| % Времени выхода в ОР | F2,45 = 3.46, р = 0.040 | – | |
| Дистанция | F2,45 = 9.54, р = 0.000 | – | |
| Время движения (%) | F2,45 = 9.12, р = 0.000 | – | |
| Скорость | F2,45 = 9.49, р = 0.000 | – | |
| Переходы через центр | F2,45 = 11.53, р = 0.000 | – | |
| Стойки | F2,45 = 4.51, р = 0.016 | – | |
| Свешивания | – | – | |
| Выглядывания в ОР | F2,45 = 8.53, р = 0.001 | – | |
| Груминг (с) | F2,45 = 2.91, р = 0.065 | – | |
| 2 серия | Выходы в ОР | –* | – |
| % Времени выхода в ОР | – | – | |
| Дистанция | – | – | |
| Время движения (%) | F2,79 = 2.41, р = 0.096 | – | |
| Скорость | – | – | |
| Переходы через центр | – | – | |
| Стойки | – | – | |
| Свешивания | – | – | |
| Выглядывания в ОР | – | F2,79 = 4.97, р = 0.029 | |
| Груминг (с) | – | – | |
Рис. 1.
Влияние раннего провоспалительного стресса на поведение крыс в приподнятом крестообразном лабиринте в 1-й и 2-й серии экспериментов. По вертикали – значения различных показателей поведения. ИНТ – интактная группа крыс, ФИЗ – группа, получившая инъекцию физиологического раствора, ЛПС – группа, получившая инъекцию ЛПС. n – число крыс в группе (самцы/самки). ОР – открытые рукава лабиринта, Т – время. * – статистически значимые различия между группой ЛПС и группой ФИЗ, + – между группой ЛПС и ИНТ (p < 0.05, post hoc анализ Factorial ANOVA).
Fig. 1. The influence of an early proinflammatory stress on behavior of rats in an elevated plus maze at the first and second series of experiments. On vertical axis – the values of different parameters of behavior. ИНТ – the intact group, ФИЗ – the saline group, ЛПС – the LPS group. N – a number of rats in group (makes/females), T – time. * – the significant differences between ЛПС and ФИЗ groups, + – between ЛПС and ИНТ groups (p < 0.05, post hoc анализ Factorial ANOVA).
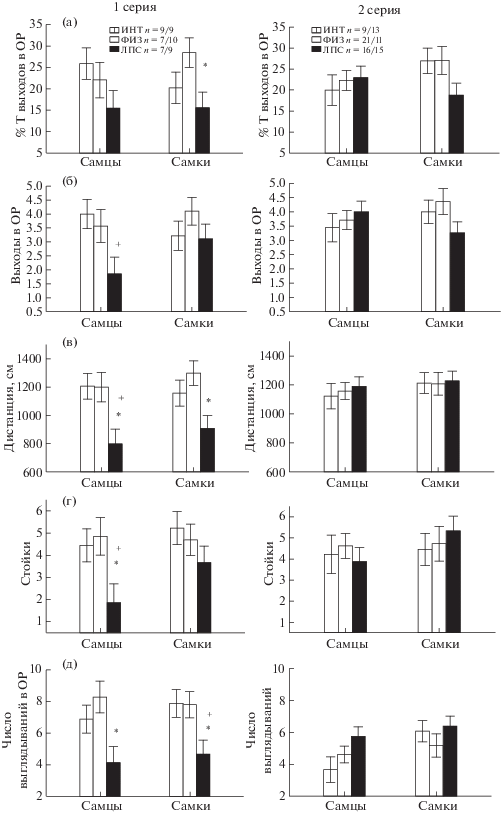
Во второй серии экспериментов фактор ГРУППА не оказывал влияния ни на один из проанализированных с помощью Factorial ANOVA показателей поведения (табл. 2), только для процента времени движения его влияние проявлялось на уровне тенденции (р = 0.096). Фактор ПОЛ оказывал влияние только на число выглядываний, у самок выглядываний было больше, чем у самцов (р < < 0.05). Таким образом, во второй серии опытов, при усиленном питании беременных самок, влияния раннего провоспалительного стресса на показатели двигательной активности и тревожности не было выявлено у крыс в подростковом возрасте.
Влияние раннего провоспалительного стресса на поведение крыс в открытом поле. При анализе с помощью Factorial ANOVA показателей поведения, имеющих нормальное распределение (табл. 3), в первой серии экспериментов было выявлено влияние фактора ГРУППА на показатели двигательной активности крыс (дистанция, скорость и время движения). Post hoc анализ показал, что у животных ЛПС-группы была меньше пройденная дистанция (рис. 2 (б)), скорость (рис. 2 (в)), время движения (рис. 2 (г)), чем у животных группы ИНТ. Анализ остальных показателей поведения, не имеющих нормального распределения, показал, что у самок ЛПС-группы было меньше выходов в центр (рис. 2 (а), р < 0.05 Multiple Comparisons, Kruskal–Wallis test: Н (2N = 28) = 6.92, p = 0.031), а также время, проведенное центре ОП (р < 0.05, Multiple Comparisons, Kruskal–Wallis test: H (2, N = 28) = = 8.65, p = 0.013), чем у группы ФИЗ. По числу стоек, длительности груминга, числу дефекаций, уринаций, латентности ухода из центра межгрупповые различия не были обнаружены. Таким образом, в первой серии экспериментов ранний провоспалительный стресс привел к снижению двигательной активности у самцов и самок и увеличению тревожности у самок.
Таблица 3.
Значения F и р при анализе с помощью Factorial ANOVA некоторых показателей поведения в ОП у крыс в 1-й и 2-й сериях опытов Table 3. F and р values of some parameters of behavior in the open field in the first and second series of experiments in rats (Factorial ANOVA)
| Серия опытов | Показатели поведения | Фактор | |
|---|---|---|---|
| ГРУППА | ПОЛ | ||
| 1 серия | Дистанция | F2,45 = 5.81, р = 0.006 | –* |
| Время движения (%) | F2,45= 4.54, р = 0.016 | – | |
| Скорость | F2,45 = 5.49, р = 0.007 | ||
| Стойки | – | – | |
| Груминг (с) | – | – | |
| 2 серия | Дистанция | – | F1,79 = 3.57, p = 0.063 |
| Время движения (%) | – | – | |
| Скорость | – | – | |
| Стойки | – | – | |
| Груминг (с) | F2,79 = 3.31, р = 0.042 | ||
Рис. 2.
Влияние раннего провоспалительного стресса на поведение крыс в открытом поле в подростковом возрасте в 1-й и 2-й серии экспериментов. По вертикали – значения различных показателей поведения. * – статистически значимые различия между группами ЛПС и ФИЗ, + – между группами ЛПС и ИНТ (p < 0.05, на (а) – Kruskal–Wallis test, Multiple Comparisons, на (б) – (г) – post hoc анализ Factorial ANOVA. Остальные обозначения как на рис. 1.
Fig. 2. The influence of an early proinflammatory stress on behavior of rats in an open field at the first and second series of experiments. On vertical axis – the values of different parameters of behavior. * – the significant differences between ЛПС and ФИЗ, + – between ЛПС and ИНТ p < 0.05, on (а) – Kruskal–Wallis test, Multiple Comparisons, on (б) – (г) – post hoc analysis Factorial ANOVA. The rest designations are the same as in Fig. 1.
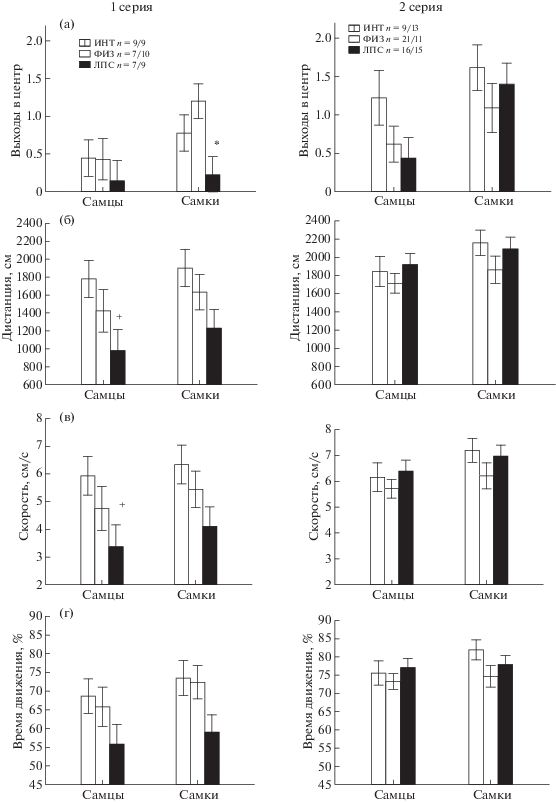
Во второй серии экспериментов влияние фактора ГРУППА не было обнаружено при анализе большинства показателей, за исключением длительности груминга (табл. 3). Анализ с помощью Kruskal–Wallis test не обнаружил различий между ЛПС-группой и контрольными группами по числу и длительности выходов в центр, времени, проведенном на периферии, числе болюсов и уринаций. Таким образом, во второй серии экспериментов у крыс, чьи матери получали во время беременности усиленное питание, влияние раннего провоспалительного стресса не проявлялось.
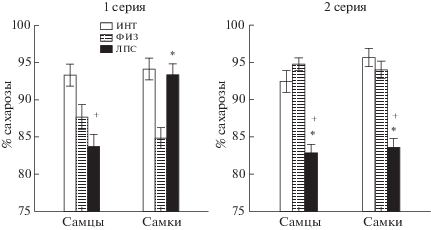
Влияние раннего провоспалительного стресса на предпочтение сахарозы. Результаты теста на предпочтение раствора сахарозы у крыс в первой и второй сериях опытов представлены на рис. 3. Сопоставление групп крыс в первой серии опытов с помощью критерия Kruskal–Wallis test обнаружило статистически значимые различия между группами как для самцов (Н (2, N = 23) = 17.16, p = 0.000), так и для самок (H (2, N = 28) = 19.46, p = 0.000). При этом самцы в группе ЛПС и ФИЗ меньше предпочитали сахарозу, чем в группе ИНТ (Multiple Comparisons, р < 0.05). Самки в группе ЛПС потребляли столько же сахарозы, сколько в группе ИНТ, но в то же время больше, чем в группе ФИЗ. Во второй серии опытов статистически значимые различия между группами были обнаружены как у самцов (Н (2, N = 39) = 20.12, p = 0.000), так и у самок (H (2, N = 31) = 20.66, p = 0.000). При этом как самцы, так и самки группы ЛПС меньше предпочитали сахарозу, чем в группах ИНТ и ФИЗ (Multiple Comparisons, р < < 0.05). Таким образом, судя по результатам теста на сахарозу, крысы ЛПС-группы во второй серии опытов демонстрировали признаки депрессивно-подобного поведения, в первой серии эти признаки наблюдались в меньшей степени и только у самцов.
Рис. 3.
Влияние раннего провоспалительного стресса на предпочтение раствора сахарозы в 1-й и 2-й сериях опытов. По вертикали – процент выпитого раствора сахарозы от общего объема потребленной жидкости в сутки. * – статистически значимые различия между группами ЛПС и ФИЗ, + – между группами ЛПС и ИНТ (post hoc анализ Factorial ANOVA). Остальные обозначения как на рис. 1.
Fig. 3. The influence of an early proinflammatory stress on sucrose preference at the first and second series of experiments. On vertical axis – the percentage of daily consumption of sucrose solution. * – the significant differences between ЛПС and ФИЗ, + – between ЛПС and ИНТ (post hoc analysis Factorial ANOVA). The rest designations are the same as in Fig. 1.
Влияние раннего провоспалительного стресса на время зависания в тесте вынужденного плавания. На рис. 4 (а) и (в) представлены данные по пяти минутам плавания у подростков в первой и второй сериях опытов соответственно. В первой серии опытов при поминутном анализе времени зависания в тесте вынужденного плавания было обнаружено влияние фактора ВРЕМЯ (F4,271 = 144.8, p = = 0.000) и взаимодействие факторов ПОЛ × × ГРУППА (F2,271 = 9.9, p = 0.000). Видно (рис. 4 (а)), что самцы ЛПС группы “зависали” на большее время, чем самцы группы ФИЗ на 2-й, 3-й и 4-й минутах, различие с ИНТ-группой проявлялось на уровне тенденции. Самки ЛПС-группы зависали, наоборот, на меньшее время, чем самки группы ИНТ на 2-й и 4-й минутах. Более четко межгрупповые различия проявлялись при анализе взаимодействия факторов ГРУППА × ПОЛ (рис. 4 (б)). На другие анализируемые показатели в тесте вынужденного плавания (число эпизодов зависания и средняя их длительность) исследуемые факторы не оказывали влияние как в первой, так и во второй серии опытов.
Рис. 4.
Влияние раннего провоспалительного стресса на время зависания в тесте вынужденного плавания в 1-й (а), (б) и 2-й (в), (г) сериях опытов. (а), (в) – время зависания по минутам в тесте, с. (б) – (г) – усредненные данные по времени зависания у самцов и самок, с. n – число крыс в группе (самцы/самки). * – статистически значимые различия между группами ЛПС и ФИЗ, + – между группами ЛПС и ИНТ (p < 0.05, post-hoc анализ, Factorial ANOVA). $ – различия между самцами и самками. # – тенденция (0.05 < р < 0.1). Остальные обозначения как на рис. 1.
Fig. 4. The influence of an early proinflammatory stress on immobility time in forced swimming test at the first (а), (б) and second (в), (г) series of experiments. (а), (в) – the immobility time by minutes, s. (б) – (г) – the averaged immobility time in males and females by time, s. n – a number of rats in group (males/females). * – the significant differences between groups ЛПС and ФИЗ, + - between ЛПС и ИНТ (p < 0.05, post-hoc analysis, Factorial ANOVA). $ – the differences between males and females. # – tendency (0.05 < р < 0.1). The rest designations are the same as in Fig. 1.
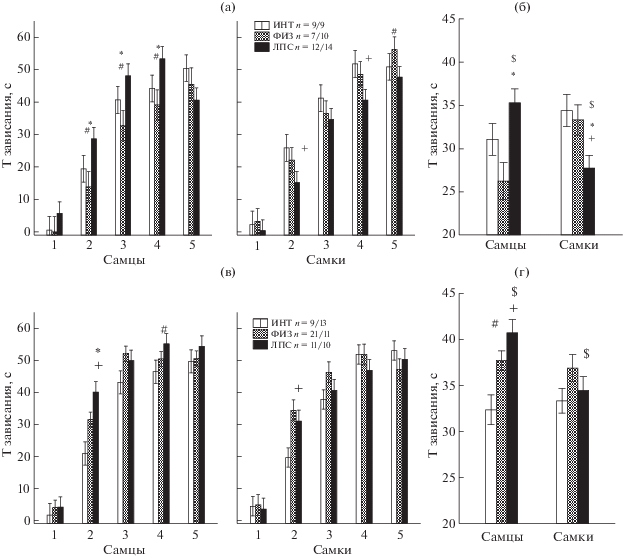
Во второй серии экспериментов было обнаружено влияние факторов ГРУППА (F2,345 = = 6.6, р = 0.001), ВРЕМЯ (F4,345 = 235.2, р = = 0.000) и взаимодействие факторов ГРУППА × ПОЛ (F2,345 = 3.2, р = 0.040), ГРУППА × × ВРЕМЯ (F8,345 = 2.7, р = 0.007). Самцы ЛПС-группы зависали на большее время, чем самцы группы ИНТ и ФИЗ на 2-й минуте теста, на 4-й минуте различие проявлялось на уровне тенденции. Более четко межгрупповые различия среди самцов проявлялись при анализе взаимодействия факторов ГРУППА × × ПОЛ (рис. 4 (г)). У самок во второй серии опытов межгрупповые различия проявлялись в меньшей степени, чем в первой серии опытов (рис. 4 (б), (г)). По времени зависания самцы ЛПС-группы существенно отличались от самок в 1-й и 2-й сериях опытов, время зависания самок было меньше, чем у самцов.
Таким образом, у самцов ЛПС-группы наблюдалось большее время зависания в начале вынужденного плавания, чем у одной или двух контрольных групп как в первой, так и во второй серии опытов, что свидетельствует о признаках депрессивно-подобного состояния. Высококалорийная диета беременных самок не препятствовала развитию депрессивно-подобного состояния у их потомства после раннего провоспалительного стресса.
Влияние ЛПС на уровень кортикостерона. Проведенный иммуноферментный анализ сыворотки крови, взятой за один день до и через 30–40 мин после теста вынужденного плавания у крыс в возрасте трех месяцев показал (рис. 5), что на уровень кортикостерона как в первой, так и во второй сериях опытов существенное влияние оказывал фактор ПОЛ (F1,76 = 88.1, p < 0.001 и F1,75 = 61.3, p < < 0.001 соответственно), у самок в среднем до и после воздействия уровень кортикостерона был выше, чем у самцов (р < 0.05, post hoc анализ) (рис. 5 (а), (б)). Значительное влияние оказывал фактор ВОЗДЕЙСТВИЕ в первой и второй сериях (F1,76 = 167.9, p < 0.000 и F1,75 = 113.9, p < 0.001 соответственно), также наблюдалось взаимодействие факторов ВОЗДЕЙСТВИЕ × ГРУППА (F2,76= 4.0, p = 0.023 и F2,75 = 4.1, p = 0.021) и ВОЗДЕЙСТВИЕ × × ПОЛ (F1,76 = 41.8, p < 0.001 и F1,75 = 12.5, p < < 0.001). Как у самцов, так и у самок уровень кортикостерона увеличивался после теста вынужденного плавания, однако у самок прирост был больше (в среднем 150% к уровню до теста), чем у самцов (в среднем 85%). Статистически значимые межгрупповые различия наблюдались только у самок, у самцов они проявлялись на уровне тенденции. В первой серии опытов до воздействия у самок ЛПС-группы уровень кортикостерона был ниже, чем в группах ИНТ и ФИЗ (p < 0.05, post hoc анализ) (рис. 5 (а)). После вынужденного плавания у самок в группе ЛПС уровень кортикостерона был выше, чем в группе ИНТ. Прирост уровня кортикостерона после воздействия у самок в группе ЛПС был значительно выше (326%), чем в группе ИНТ (96%) и ФИЗ (100%). У самцов ЛПС-группы уровень кортикостерона до воздействия был несколько выше (тенденция), чем в группе ИНТ. Во второй серии опытов (рис. 5 (б)) у самок и самцов до воздействия межгрупповых различий не наблюдалось, после воздействия у самок в группе ЛПС уровень кортикостерона был ниже, чем в группах ИНТ и ФИЗ (р < 0.05). Прирост уровня кортикостерона после воздействия у самок ЛПС группы был меньше (72%), чем в группе ИНТ (132%) и ФИЗ (171%). У самцов ЛПС-группы во второй серии до воздействия уровень кортикостерона не отличался от группы ИНТ и ФИЗ, а его прирост после воздействия, так же как у самок, был ниже (56%), чем в группе ИНТ (128%) и ФИЗ (115%), хотя межгрупповые различия после воздействия и не возникали.
Рис. 5.
Влияние раннего провоспалительного стресса на уровни кортикостерона (нмоль/л) в сыворотке крови у самцов и самок до и после теста вынужденного плавания в 1-й (а) и 2-й сериях (б) опытов. По горизонтали – интервалы до и после теста, пол крыс. * – статистически значимые различия между группами ЛПС и ФИЗ, + – между группами ЛПС и ИНТ (р < 0.05, post hoc анализ Factorial ANOVA). # – тенденция (0.05 < р < 0.1). ↑ – увеличение после теста по сравнению с данными до воздействия. Остальные обозначения как на рис. 1.
Fig. 5. The influence of an early proinflammatory stress on corticosterone levels (nmol/l) in a blood serum in males and females before and after the forced swimming test in the fist (a) and second series (б) of experiments. On horizontal axis – intervals before and after test, the sex of rats. * – the significant differences between groups ЛПС and ФИЗ, + – between ЛПС и ИНТ (p < 0.05, post-hoc analysis, Factorial ANOVA). # – tendency (0.05 < р < 0.1). ↑ – an increase after test in comparison with the data before it. The rest designations are the same as in Fig. 1.
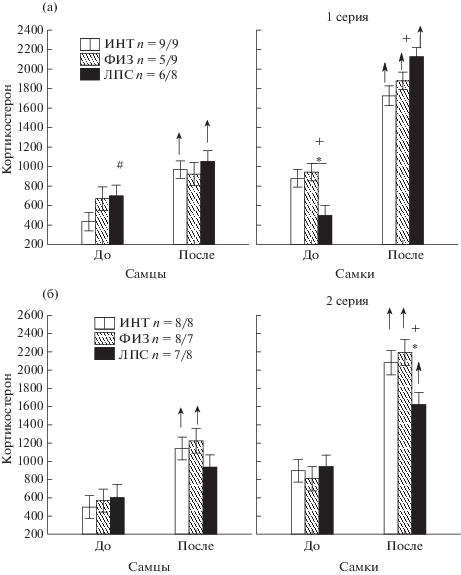
Таким образом, ранний провоспалительный стресс оказывал разное влияние на уровень кортикостерона в сыворотке крови у самцов и самок в первой и второй серии опытов. В первой серии, судя по уровню кортикостерона, самки после раннего провоспалительного стресса демонстрировали повышенную реактивность на стрессирующее воздействие, во второй серии самки ЛПС-группы отличались, наоборот, пониженной реактивностью.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенное исследование показало, что высококалорийное питание матерей во время беременности препятствовало проявлению у потомства в подростковом возрасте некоторых последствий раннего провоспалительного стресса – усиления тревожного поведения, снижения двигательной и исследовательской активности, а также значительному приросту у самок уровня кортикостерона в ответ на дополнительное стрессирующее воздействие. Вместе с тем высококалорийное питание матерей во время беременности не препятствовало появлению признаков депрессивно-подобного поведения, возникающих после провоспалительного стресса.
Важно отметить, что, несмотря на высококалорийную и богатую жирами/протеинами диету беременных самок, какой-то особой прибавки веса у их потомства в наших опытах не наблюдалось. Исключение составляют самки ЛПС-группы, у которых при высококалорийной диете матерей вес увеличивался до значений контрольных групп. Похожие результаты были получены в работе [Rincel et al., 2016], которые использовали обогащенный жирами рацион питания самок во время беременности и лактации (40% энергии из жира), который не приводил к их ожирению. В их опытах ранним стрессом для новорожденных крысят служило материнское отлучение со 2-го по 14-й день жизни на 180 мин. Как и в нашей работе, потомство беременных самок, содержавшихся на высококалорийной диете, было более устойчивым к проявлениям тревожного поведения под влиянием раннего стресса, чем потомство самок, содержавшихся на обычном рационе питания [Rincel et al., 2016]. Потомство самок, получавших диету с высоким содержанием жира, не имело также нарушений пространственного обучения, социальных взаимодействий, характерных для крыс после материнской изоляции. Положительные эффекты такой диеты могли быть связаны с предотвращением гибели синаптических шипиков в раннем подростковом периоде и атрофии дендритов нейронов префронтальной коры в зрелом возрасте под влиянием стресса, вызываемого материнским отлучением [Rincel et al., 2018]. Кроме того, одним из молекулярно-клеточных механизмов, ведущим к уменьшению тревожности под влиянием богатой жирами диеты в период беременности, было устранение нарушений уровня экспрессии генов Rest4, 5-HT1A, BDNF, кортикостероидных и других рецепторов в префронтальной коре, которые возникали после раннего стресса [Rincel et al., 2016]. Известно, что оверэкспрессия гена Rest4 (neuron-restrictive silencer element) в медиальной префронтальной коре во время онтогенетического развития ведет к усилению тревожности во взрослой жизни и увеличению чувствительности к стрессу [Uchida et al., 2010]. На поведенческом уровне положительные эффекты богатой жирами диеты матерей могли быть также связаны с усилением ухода (nursing) за детенышами в период лактации [Purcell et al., 2011] и снижением отрицательных эмоций у матерей под влиянием вкусной еды [Dallman et al., 2003].
Другой пример защитного влияния диеты с высоким содержанием жира представлен в работе [Huang et al., 2015]. Показано, что диета матерей с высоким содержанием жира, комбинированная с ЛПС-стрессом во время беременности, оказывала защитное действие от воспалительных и морфологических изменений в клетках гиппокампа у потомства крыс.
Таким образом, принципиальным фактором во влияниях диеты в период беременности является отсутствие прибавки веса и ожирения у самок, т.е. способность к быстрой энергетической утилизации пищи. Это подтверждается в специально проведенных опытах на мышах, получавших во время беременности так называемую кетогенную диету, богатую жирами и бедную углеводами (67.4% жира, 0.6% углеводов, 15.3% белка), которая не приводила к ожирению за счет расщепления в печени жиров на жирные кислоты и кетоновые тела [Sussman et al., 2015]. У потомства матерей, получавших такую диету, в зрелом возрасте не происходило увеличения веса тела, наблюдались ослабление тревожного и депрессивно-подобного поведения и усиление двигательной активности по сравнению с контрольными животными.
Наоборот, в случае ожирения матери происходит перепрограммирование нормального развития потомства, которое ведет к излишнему их весу из-за ослабленного метаболизма и недостаточной физической активности [Johnson et al., 2017]. Диета с высоким содержанием жира (более 60%) во время беременности вызывала у взрослого потомства склонность к увеличению веса, усиление тревожного поведения, уменьшение исследовательского поведения [Johnson et al., 2017; Sasaki et al., 2014], увеличение депрессивно-подобного поведения и агрессивности [Giriko et al., 2013], нарушения пространственного обучения [Bilbo, Tsang, 2010]. Авторы объясняют эти результаты эффектами нейровоспаления, нарушениями реактивности гипоталамо-гипофизарно-надпочечниковой системы и другими влияниями ожирения. В работе [Bruce-Keller et al., 2017] была продемонстрирована роль микробиоты кишечника животных, находящихся на разных диетах. Здоровым самкам до спаривания вводили микрофлору из кишечника мышей, находившихся на богатой жирами и обычной (контрольной) диете. Самцы из потомства матерей с “жирной” микробиотой имели значительные нарушения в исследовательском, когнитивном и стереотипном поведении. Они были более тревожными в ОП, показали больше стереотипных движений, больше предпочитали сахарозу, меньше замирали на звук при условнорефлекторном страхе. У самок от этих матерей не было таких поведенческих нарушений, но имелось увеличение веса тела и ожирение.
Половые различия в поведении крыс отчетливо проявились при тестировании крыс в тесте вынужденного плавания. Независимо от диеты матерей в период беременности, самцы, получавшие ранний ЛПС-стресс, проявляли депрессивно-подобное поведение в большей, а самки в меньшей степени, либо не отличались от контрольных животных. Подобные различия, скорее всего, были связаны с особенностями нейровоспалительного процесса у самцов и самок. По существу, в тесте вынужденного плавания, в отличие от других использованных тестов, крысы испытывали сильный повторный стресс (challenge) на фоне сенситизации (priming) к нейровоспалению в результате первичного ЛПС-стресса [Брошевицкая и др., 2020]. В результате разной сенситизации процессов нейровоспаления [Fonken et al., 2018] в ответ на повторный стресс у самцов и самок по-разному проявилось депрессивно-подобное поведение. А поскольку двойной стресс оказывает более сильное влияние на поведенческие и биохимические показатели, нежели одиночный стресс, то, по-видимому, положительных эффектов от усиленного ценного питания для воспрепятствования проявлениям депрессивно-подобного поведения в этом случае оказалось недостаточно.
Половые различия крыс проявлялись также как в базовом, так и в вызванном стрессом уровне кортикостерона, при этом у самок уровень кортикостерона был выше, чем у самцов. При стандартном питании беременных самок ранний провоспалительный стресс оказывал влияние на уровень кортикостерона в наших опытах только у самок, понижая базовый уровень и увеличивая его после теста вынужденного плавания, что приводило к большему приросту уровня кортикостерона после острого стресса у ЛПС-группы. Ранее в наших опытах было показано, что высокий уровень кортикостерона после введения ЛПС был характерен для самок после стресса, в то время как у самцов наблюдался высокий уровень провоспалительного цитокина IL-1beta [Брошевицкая и др., 2020]. Другие авторы также наблюдали более высокий прирост уровня кортикостерона у самок по сравнению с самцами после различных стрессирующих воздействий [Azogu et al., 2018; Daviu et al., 2014; Verma et al., 2010]. В литературе представлены многочисленные данные о программирующем влиянии раннего провоспалительного стресса на функционирование ГГН-оси у взрослых животных [Shanks et al., 1995;Walker et al., 2009; Tishkina et al., 2016 и др.], при этом эффекты могли отличаться. В ряде работ у взрослых самцов и самок было обнаружено увеличение базового уровня кортикостерона после введения ЛПС в раннем онтогенезе, ответ на дополнительное стрессирующее воздействие мог быть как уменьшен, так и увеличен [Walker et al., 2008; 2009; Tishkina et al., 2016; Nilsson et al., 2002]. Увеличение реактивности ГГН-оси на стресс у взрослых наблюдали ранее и после введения эндотоксина (Salmonella enteritidis) в раннем онтогенезе, что связывали с уменьшением отрицательной обратной связи, тормозящей синтез АКТГ [Shanks et al., 1995].
Высококалорийное питание беременных самок, судя по нашим результатам, приводило к изменению реактивности ГГН-оси на стресс у взрослого потомства, снижая прирост уровня кортикостерона в ответ на тест вынужденного плавания. У самок ЛПС-группы в наших опытах прирост уровня кортикостерона был даже ниже, чем у контрольных групп. Эти данные позволяют говорить о проявлении некоторого защитного действия раннего провоспалительного стресса под влиянием обогащенной диеты беременных самок. Защитное действие раннего провоспалительного стресса отмечалось ранее в работе [Bilbo et al., 2008], в которой крысы после инфекции в раннем онтогенезе (Escherichia coli) по сравнению с контрольными животными демонстрировали меньше депрессивно-подобного поведения и уменьшенный ответ по кортикостерону после стрессирующих ударов током по хвосту.
Таким образом, все сказанное свидетельствует о том, что усиленное ценное питание во время беременности, которое не приводит к ожирению матери и детенышей, может играть положительную защитную роль по отношению к развитию будущих тревожных расстройств и повышенной стресс-реактивности ГГН-оси у потомства, испытавшего отрицательные воздействия в виде провоспалительного стресса в раннем возрасте.
ВЫВОДЫ
1. В подростковом возрасте у потомства самок со стандартным рационом питания во время беременности ранний провоспалительный стресс вызывал снижение двигательной и исследовательской активности, а также усиление тревожного поведения в открытом поле и приподнятом крестообразном лабиринте.
2. Высококалорийное питание беременных самок предохраняло потомство крыс, получавших ранний провоспалительный ЛПС-стресс, от усиления тревожного поведения и ослабления двигательной и исследовательской активности.
3. Высококалорийное питание беременных самок не устраняло признаки депрессивно-подобного поведения у потомства после раннего провоспалительного стресса, которые наблюдались у самцов и самок в тесте предпочтения сахарозы, а также у самцов в тесте вынужденного плавания.
4. После раннего провоспалительного стресса у самок, чьи матери получали стандартное питание во время беременности, наблюдалась повышенная реактивность ГГН-оси на стрессирующее воздействие, судя по уровню кортикостерона в плазме крови. У самок, чьи матери получали высококалорийное питание во время беременности, наблюдалась, наоборот, пониженная реактивность.
5. Высококалорийное питание самок во время беременности было способно ослабить негативные влияния раннего провоспалительного стресса на потомство, снижая уровень тревожности как у самцов, так и у самок, а также уменьшая реактивность ГГН-оси на стрессирующее воздействие (только у самок).
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проекты № 19-015-00129A и №19-34-90022).
Авторы выражают благодарность сотрудникам лаборатории функциональной биохимии нервной системы ИВНД и НФ РАН М.В. Онуфриеву и Ю.В. Моисеевой за помощь в проведении иммуноферментного анализа.
Список литературы
Брошевицкая Н.Д., Павлова И.В., Зайченко М.И., Груздева В.А., Григорьян Г.А. Влияние раннего провоспалительного стресса на тревожное и депрессивно-подобное поведение у крыс разного возраста. Рос. физиол. журн. 2020. 106 (7): 823–842.
Григорьян Г.А. Половые различия в поведении и биохимических маркерах у животных в ответ на нейровоспалительный стресс. Успехи физиол. Наук. 2020. 51 (1): 18–32.
Григорьян Г.А., Гуляева Н.В. Стресс-реактивность и стресс-устойчивость в патогенезе депрессивно-подобных расстройств. Роль эпигенетических механизмов Журн. высш. нервн. деят. им. И.П. Павлова. 2015. 65 (1): 19–32.
Григорьян Г.А., Дыгало Н.Н., Гехт А.Б., Степаничев М.Ю., Гуляева Н.В. Молекулярно-клеточные механизмы депрессии. Роль глюкокортикоидов, цитокинов и нейротрофических факторов в генезе депрессивных расстройств. Успехи физиол. наук. 2014. 44 (2): 3–20.
Anacker C., Luna V.M., Stevens G.S., Millette A., Shores R., Jimenez J.C., Chen B., Hen R. Hippocampal neurogenesis confers stress resilience by inhibiting the ventral dentate gyrus. Soc. Cogn. Affect. Neurosci. 2016. 11 (5): 813–820.
Azogu I., Liang J., Plamondon H. Sex-specific differences in corticosterone secretion, behavioral phenotypes and expression of TrkB.T1 and TrkB.FL receptor isoforms: Impact of systemic TrkB inhibition and combinatory stress exposure in adolescence. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2018. 86: 10–23.
Bilbo S.D., Tsang V. Enduring consequences of maternal obesity for brain inflammation and behavior of offspring. FASEB journal: official publication of the Federation of American Societies for Experimental Biology. 2010. 24 (6): 2104–2115.
Bilbo S.D., Yirmiya R., Amat J., Paul E.D., Watkins L.R., Maier S.F. Bacterial infection early in life protects against stressor-induced depressive-like symptoms in adult rats. Psychoneuroendocrinology. 2008. 33 (3): 261–269.
Bruce-Keller A.J., Fernandez-Kim S.O., Townsend R.L., Kruger C., Carmouche R., Newman S., Salbaum J.M., Berthoud H.R. Maternal obese-type gut microbiota differentially impact cognition, anxiety and compulsive behavior in male and female offspring in mice. PLoS One. 2017. 12 (4): e0175577.
Culmsee C., Michels S., Scheu S., Arolt V., Dannlowski U., Alferink J. Mitochondria, microglia, and the immune system- how are they linked in affective disorders? Front. Psychiatry. 2019. 9: 739.
Custódio C.S., Mello B.S.F., Filho A.J.M.C., de Carvalho Lima C.N., Cordeiro R.C., Miyajima F., Réus G.Z., Vasconcelos S.M.M., Barichello T., Quevedo J., de Oliveira A.C., de Lucena D.F., Macedo D.S. Neonatal immune challenge with lipopolysaccharide triggers long-lasting sex- and age-related behavioral and immune/neurotrophic alterations in mice: relevance to autism spectrum disorders. Mol. Neurobiol. 2018. 55 (5): 3775–3788.
Dallman M.F., Pecoraro N., Akana S.F., La Fleur S.E., Gomez F., Houshyar H. et al. Chronic stress and obesity: a new view of ‘comfort food'. Proc. Natl. Acad. Sci. USA. 2003. 100: 11696–11701.
Danese A., Lewis S.J. Psychoneuroimmunology of early-life stress: The hidden wounds of childhood trauma? Neuropsychopharmacology. 2017. 42 (1): 99–114.
Daviu N., Andero R., Armario A., Nadal R. Sex differences in the behavioural and hypothalamic-pituitary-adrenal response to contextual fear conditioning in rats. Horm Behav. 2014. 66 (5): 713–723.
De Capo M., Thompson J.R., Dunn G., Sullivan E.L. Perinatal nutrition and programmed risk for neuropsychiatric disorders: a focus on animal models. Biol. Psychiatry.2019. 85 (2): 122–134.
do Prado C.H., Narahari T., Holland F.H., Lee H.N., Murthy S.K., Brenhouse H.C. Effects of early adolescent environmental enrichment on cognitive dysfunction, prefrontal cortex development, and inflammatory cytokines after early life stress. Dev. Psychobiol. 2016. 58 (4): 482–491.
Edlow A.G. Maternal obesity and neurodevelopmental and psychiatric disorders in offspring. Prenat. Diagn. 2017. 37 (1): 95–110.
Finger B.C., Dinan T.G., Cryan J.F. High-fat diet selectively protects against the effects of chronic social stress in the mouse. Neuroscience. 2011. 192: 351–360.
Francis D.D., Diorio J., Plotsky P.M., Meaney M.J. Environmental enrichment reverses the effects of maternal separation on stress reactivity. J. Neurosci. 2002. 22 (18): 7840–7843.
Fonken L.K., Frank M.G., Gaudet A.D., D’Angelo H.M., Daut R.A., Hampson E.C., Ayala M.T., Watkins L.R., Maier S.F. Neuroinflammatory priming to stress is differentially regulated in male and female rats. Brain Behav. Immun. 2018. 70: 257–267.
Giriko C.A., Andreoli C.A., Mennitti L.V., Hosoume L.F., Souto T.D.S., da Silva A.V., Mendes-da-Silva C. Delayed physical and neurobehavioral development and increased aggressive and depression-like behaviors in the rat offspring of dams fed a high-fat diet. Int. J. Dev. Neurosci. 2013. 31 (8): 731–739.
Hohmann C.F., Odebode G., Naidu L., Koban M. Early life stress alters adult Inflammatory responses in a mouse model for depression. Ann. Psychiatry Ment. Health. 2017. 5 (2). pii: 1095.
Holz N.E., Boecker R., Jennen-Steinmetz C., Buchmann A.F., Blomeyer D., Baumeister S., Plichta M.M., Esser G., Schmidt M., Meyer-Lindenberg A., Banaschewski T., Brandeis D., Laucht M. Positive coping styles and perigenual ACC volume: two related mechanisms for conferring resilience? Soc. Cogn. Affect. Neurosci. 2016. 11 (5): 813–820.
Huang C.F., Du J.X., Deng W., Cheng X.C., Zhang S.Y., Zhao S.J., Tao M.J., Chen G.Z., Hao X.Q. Effect of prenatal exposure to LPS combined with pre- and post-natal high-fat diet on hippocampus in rat offspring. Neuroscience. 2015. 286: 364–370.
Jiang X., Chen L., Shen L., Chen Z., Xu L., Zhang J., Yu X. Trans-astaxanthin attenuates lipopolysaccharide induced neuroinflammation and depressive-like behavior in mice. Brain Res. 2016. 1649 (Pt A): 30–37.
Johnson S.A., Javurek A.B., Painter M.S., Murphy C.R., Conard C.M., Gant K.L., Howald E.C., Ellersieck M.R., Wiedmeyer C.E., Vieira-Potter V.J., Rosenfeld C.S. Effects of a maternal high-fat diet on offspring behavioral and metabolic parameters in a rodent model. J. Dev. Orig. Health Dis. 2017. 8 (1): 75–88.
Ignácio Z.M., da Silva R.S., Plissari M.E., Quevedo J., Réus G.Z. Physical exercise and neuroinflammation in major depressive disorder. Mol. Neurobiol. 2019. 56(12): 8323–8335.
Kang S.S., Kurti A., Fair D.A., Fryer J.D. Dietary intervention rescues maternal obesity induced behavior deficits and neuroinflammation in offspring. J. Neuroinflammation. 2014. 11: 156.
Lorsch Z.S., Loh Y.E., Purushothaman I., Walker D.M., Parise E.M., Salery M., Cahill M.E., Hodes G.E., Pfau M.L., Kronman H., Hamilton P.J., Issler O., Labonté B., Symonds A.E., Zucker M., Zhang T.Y., Meaney M.J., Russo S.J., Shen L., Bagot R.C., Nestler E.J. Estrogen receptor α drives pro-resilient transcription in mouse models of depression. Nat. Commun. 2018. 9 (1): 1116.
Lucchina L., Carola V., Pitossi F., Depino A.M. Evaluating the interaction between early postnatal inflammation and maternal care in the programming of adult anxiety and depression-related behaviors. Behav. Brain Res. 2010. 213 (1): 56–65.
Maniam J., Morris M.J. Palatable cafeteria diet ameliorates anxiety and depression-like symptoms following an adverse early environment. Psychoneuroendocrinology. 2010. 35 (5): 717–728.
Maniam J., Antoniadis C.P., Le V., Morris M.J. A diet high in fat and sugar reverses anxiety-like behaviour induced by limited nesting in male rats: Impacts on hippocampal markers. Psychoneuroendocrinology. 2016. 68: 202–209.
Milenkovic V.M., Stanton E.H., Nothdurfter C., Rupprecht R., Wetzel C.H. The role of chemokines in the pathophysiology of major depressive disorder. Int. J. Mol. Sci. 2019. 20 (9). pii: E2283.
Mul J.D., Soto M., Cahill M.E., Ryan R.E., Takahashi H., So K., Zheng J., Croote D.E., Hirshman M.F., la Fleur S.E., Nestler E.J., Goodyear L.J. Voluntary wheel running promotes resilience to chronic social defeat stress in mice: a role for nucleus accumbens ΔFosB. Neuropsychopharmacology. 2018. 43 (9): 1934–1942.
Nilsson C., Jennische E., Ho H.P., Eriksson E., Bjorntorp P., Holmang A. Postnatal endotoxin exposure results in increased insulin sensitivity and altered activity of neuroendocrine axes in adult female rats. Eur. J. Endocrinol. 2002. 146 (2): 251–260.
Purcell R.H., Sun B., Pass L.L., Power M.L., Moran T.H., Tamashiro K.L.K. Maternal stress and high-fat diet effect on maternal behavior, milk composition, and pup ingestive behavior. Physiol. Behav. 2011.104: 474–479.
Rincel M., Lépinay A.L., Janthakhin Y., Soudain G., Yvon S., Da Silva S., Joffre C., Aubert A., Séré A., Layé S., Theodorou V., Ferreira G., Darnaudéry M. Maternal high-fat diet and early life stress differentially modulate spine density and dendritic morphology in the medial prefrontal cortex of juvenile and adult rats. Brain Struct. Funct. 2018. 223 (2): 883–895.
Rincel M., Lépinay A.L., Delage P., Fioramonti J., Théodorou V.S., Layé S., Darnaudéry M. Maternal high-fat diet prevents developmental programming by early-life stress. Transl. Psychiatry. 2016. 6 (11):e966.
Rivera H.M., Christiansen K.J., Sullivan E.L. The role of maternal obesity in the risk of neuropsychiatric disorders. Front. Neurosci. 2015. 9: 194.
Sasaki A., de Vega W.C., St-Cyr S., Pan P., McGowan P.O. Perinatal high fat diet alters glucocorticoid signaling and anxiety behavior in adulthood. Neuroscience. 2013. 240: 1–12.
Shanks N., Larocque S., Meaney M.J. Neonatal endotoxin exposure alters the development of the hypothalamic-pituitary-adrenal axis: early illness and later responsivity to stress. J. Neurosci. 1995. 15: 376–384.
Stepanichev M.Yu., Dygalo N.N., Grigoryan G.A., Tishkina G., Gulyaeva N.V. Rodents model of depression: neurotrophic and neuroinflammatory biomarkers. BioMed. Research International. 2014. 1–20 (ID932757).
Sullivan E.L., Riper K.M., Lockard R., Valleau J.C. Maternal high-fat diet programming of the neuroendocrine system and behavior. Horm. Behav. 2015. 76: 153–161.
Sullivan E.L., Nousen E.K., Chamlou K.A., Grove K.L. The impact of maternal high-fat diet consumption on neural development and behavior of offspring. Int. J. Obes. Suppl. 2012. 2: S7–S13.
Sullivan E.L., Grayson B., Takahashi D., et al. Chronic consumption of a high-fat diet during pregnancy causes perturbations in the serotonergic system and increased anxiety-like behavior in nonhuman primate offspring. J. Neurosci. 2010. 30 (10): 3826–3830.
Sussman D., Germann J., Henkelman M. Gestational ketogenic diet programs brain structure and susceptibility to depression and anxiety in the adult mouse offspring. Brain Behav. 2015. 5 (2): e00300.
Taniguti E.H., Ferreira Y.S., Stupp I.J.V., Fraga-Junior E.B., Mendonça C.B., Rossi F.L., Ynoue H.N., Doneda D.L., Lopes L., Lima E., Buss Z.S., Vandresen-Filho S. Neuroprotective effect of melatonin against lipopolysaccharide-induced depressive-like behavior in mice. Physiol. Behav. 2018. 188: 270–275.
Tang M.M., Lin W.J., Pan Y.Q., Guan X.T., Li Y.C. Hippocampal neurogenesis dysfunction linked to depressive-like behaviors in a neuroinflammation induced model of depression. Physiol. Behav. 2016. 161: 166–173.
Tishkina A., Stepanichev M., Kudryashova I., Freiman S., Onufriev M., Lazareva N., Gulyaeva N. Neonatal proinflammatory challenge in male Wistar rats: Effects on behavior, synaptic plasticity, and adrenocortical stress response. Behav Brain Res. 2016. 304: 1–10.
Uchida S., Hara K., Kobayashi A., Funato H., Hobara T., Otsuki K. et al. Early life stress enhances behavioral vulnerability to stress through the activation of REST4-mediated gene transcription in the medial prefrontal cortex of rodents. J. Neurosci. 2010. 30: 15007–15018.
van Bodegom M., Homberg J.R., Henckens M.J.A.G. Modulation of the hypothalamic-pituitary-adrenal axis by early life stress exposure. Front. Cell Neurosci. 2017. 11: 87.
Verma P., Hellemans K.G., Choi F.Y., Yu W., Weinberg J. Circadian phase and sex effects on depressive/anxiety-like behaviors and HPA axis responses to acute stress. Physiol Behav. 2010. 99 (3): 276–285.
Walker F.R., Knott B., Hodgson D.M. Neonatal endotoxin exposure modifies the acoustic startle response and circulating levels of corticosterone in the adult rat but only following acute stress. J. Psychiatr. Res. 2008. 42 (13): 1094–1103.
Walker A.K., Nakamura T., Byrne R.J., Naicker S., Tynan R.J., Hunter M., Hodgson D.M. Neonatal lipopolysaccharide and adult stress exposure predisposes rats to anxiety-like behavior and blunted corticosterone responses: implications for the double-hit hypothesis. Psychoneuroendocrinology. 2009. 34 (10): 1515–1525.
Wang J., Hodes G.E., Zhang H., Zhang S., Zhao W., Golden S.A., Bi W., Menard C., Kana V., Leboeuf M., Xie M., Bregman D., Pfau M.L., Flanigan M.E., Esteban-Fernández A.,Yemul S., Sharma A., Ho L., Dixon R., Merad M., Han M.H., Russo S.J., Pasinetti G.M. Epigenetic modulation of inflammation and synaptic plasticity promotes resilience against stress in mice. Nat. Commun. 2018. 9 (1): 477.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


