Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 6, стр. 770-782
МК-801 нарушает реконсолидацию “новой” памяти и влияет на “старую” память при инструментальном пищевом поведении в 8-рукавном радиальном лабиринте у крыс
М. И. Зайченко 1, *, Ф. Х. Закиров 1, В. А. Маркевич 1, Г. А. Григорьян 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии Российской академии наук
Москва, Россия
* E-mail: mariya-zajchenko@yandex.ru
Поступила в редакцию 13.03.2020
После доработки 29.06.2020
Принята к публикации 20.07.2020
Аннотация
Пространственная память в пищевом инструментальном поведении в 8-рукавном радиальном лабиринте у крыс в результате реактивации с помощью одной пробы без подкрепления и последующего краткого реверсивного обучения (смены ранее подкрепляемых рукавов на неподкрепляемые) существенно ухудшалась. Ухудшение первично выработанного инструментального навыка (“старой” памяти) у контрольной реактивированной группы происходило по двум причинам: 1) из-за применения в фазу реактивации пробы без подкрепления, которая была связана с неполучением пищи в четырех ранее подкрепляемых рукавах лабиринта (эффект угашения) и 2) за счет формирования “новой” памяти в процессе выработки реверсивного обучения. В результате конфликт между старым и новым обучением смещался в пользу нового навыка. Блокада NMDA-рецепторов с помощью антагониста МК-801 частично восстанавливала “старую” память у реактивированной группы крыс за счет смещения конфликта между старым (торможение эффекта угашения под влиянием МК-801) и новым обучением в пользу старого навыка. Наряду с ухудшением “старой” памяти в ходе реверсивного обучения формировалась также “новая” память. Блокада NMDA-рецепторов ухудшала формирование “новой” памяти: крысы совершали достоверно больше ошибок и тратили больше времени на обход подкрепляемых рукавов, чем контрольные животные. Таким образом, использованный подход позволил выделить и оценить проявления “старой” памяти, сформированной при первичном обучении, и проявления “новой” памяти, образовавшейся при реверсивном обучении.
Известно, что формирование памяти проходит две стадии. Первая – фаза краткосрочной памяти (до нескольких часов), которая является лабильной и подвержена разным воздействиям. Затем наступает фаза долгосрочной памяти (через 24 ч и более), во время которой память стабилизируется и не меняется при воздействиях на нее [Dudai, 2004; McGaugh, 2000]. Однако точка зрения о том, что консолидированная память не изменяется, подверглась существенным сомнениям благодаря опытам лаборатории Льюиса [Lewis, 1979; Lewis et al., 1972]. В этих опытах было показано, что консолидированная память может снова дестабилизироваться (т.е. принимать лабильную форму), если спустя некоторое время после ее формирования и стабилизации применить условный раздражитель или поместить субъект в ту же обстановку (контекст). Вслед за лабильной фазой память снова консолидируется. Этот факт впоследствии получил название “реконсолидация” памяти, а действие условного раздражителя (или контекста) на фоне хорошо консолидированной памяти – реактивацией или извлечением следов сохраненной памяти, а сам условный раздражитель (или контекст) – напоминанием (reminder). Реконсолидация памяти хорошо проявляется при обучении, основанном на отрицательных эмоциях, например, в случае выработки условно-рефлекторной реакции страха [Зюзина, Балабан, 2015; Nader et al., 2000], условной вкусовой аверсии [Garcia-Delatorre et al., 2010] или реакции пассивного избегания (inhibitory avoidance) [Boccia et al., 2005]. Во всех этих случаях для выработки условной связи достаточно всего лишь одного сочетания. В отличие от этого, в литературе до сих пор идут споры о возможности реактивации и реконсолидации памяти в инструментальных пищевых условных рефлексах, которые требуют для своей выработки большого числа сочетаний. Согласно одним данным, память в таких рефлексах способна подвергаться дестабилизации и реконсолидации [Piva et al., 2019; Зайченко и др., 2018; Exton-McGuinness, Lee, 2015; Exton-McGuinness et al., 2014; Tedesco et al., 2014; Przybyslawski et al., 1999], а по другим данным [Mierzejewski et al., 2009; Brown et al., 2008; Hernandez, Kelley, 2004] этого не происходит. Важно отметить, что реконсолидацию памяти в этих последних работах [Mierzejewski et al., 2009; Hernandez, Kelley, 2004] пытались получить при упроченных пищевых инструментальных условных рефлексах, которые, как известно, с трудом поддаются дестабилизации [Suzuki et al., 2004]. Для проявления реконсолидации существенное значение имеют также характер и условия реактивации памяти. Например, в классических условных рефлексах реконсолидация вызывается довольно просто, путем одного или нескольких предъявлений условного раздражителя или контекста без подкрепления [Nader et al., 2000; Зюзина, Балабан, 2015]. В инструментальном поведении все сложнее. Неслучайно для дестабилизации памяти в инструментальном поведении применяют разные сложные схемы. Например, Дж. Ли и др. [Exton-McGuinness, Lee, 2015; Exton-McGuinness et al., 2014; Reichelt, Lee, 2013; 2012] для реактивации памяти в пищевых инструментальных рефлексах, выработанных в режиме подкрепления каждого нажатия с переменным интервалом, использовали три разных способа: 1) короткие эпизоды неподкрепляемых реакций по 5 мин, 2) смену режима подкрепления, VR20 (variable ratio 20), при котором подкрепление предъявлялось после 12–28 нажатий на педаль (в среднем 20 нажатий), 3) смену режима подкрепления, FR20 (fixed ratio 20), при котором только каждое 20-е нажатие приводило к получению подкрепления. Реконсолидацию памяти удалось получить только в случае реактивации инструментального навыка с помощью смены режима подкрепления VR 20. Введение антагониста NMDA-рецепторов (N-methyl-D-aspartate), MK-801 [(+)-5-methyl-10,11-dihydro-5H-dibenzo[a,d]cyclohepten-5,10-imine maleate] непосредственно перед реактивацией подавляло реконсолидацию памяти [Exton-McGuinness, Lee, 2015; Exton-McGuinness et al., 2014]. Недавно мы [Зайченко и др., 2020; 2018] показали, что пространственная память при выработке пищевого инструментального поведения в 8-канальном радиальном лабиринте также может подвергаться дестабилизации и реконсолидации, но только при определенных условиях ее реактивации. В частности, реконсолидация проявлялась при использовании в качестве реактивации только одной единственной пробы (посещение 4 рукавов лабиринта без подкрепления) и не проявлялась при использовании для этой цели подряд трех проб без подкрепления или трех проб с усиленным подкреплением. Как и в опытах М. Экстон-МакГиннесса и др. [Exton-McGuinness, Lee, 2015; Exton-McGuinness et al., 2014], антагонист NMDA-рецепторов, МК-801, препятствовал реконсолидации памяти после одной пробы без подкрепления в четырех рукавах лабиринта [Зайченко и др., 2020; 2018].
В последние годы возможность реконсолидации памяти связывают с довольно популярной гипотезой, высказанной много лет назад В. Шульцем [Schultz et al., 1997], – на основе оценки “ошибки прогноза подкрепления” (reward prediction error). Согласно этой гипотезе, для вызова дестабилизации и последующей реконсолидации памяти обязательным условием является оценка мозгом ошибки прогноза подкрепления, т.е. расхождения между параметрами ожидаемого и реально получаемого подкрепления [Gotthard et al., 2018; Fernández et al., 2016; Exton-McGuinness, Lee, 2015; Exton-McGuinness et al., 2014]. Считается, что чем больше ошибка прогноза подкрепления, тем лучше условия для дестабилизации и последующей реконсолидации памяти. Вероятно, такая точка зрения имеет больше теоретический, чем практический интерес, поскольку не очень полезна при выборе конкретных действий, приводящих к дестабилизации памяти. Предполагается, что дестабилизация и реконсолидация памяти обычно связаны с какими-то новыми условиями, которые обновляют (update) и видоизменяют старую память [Jones et al., 2012; Hupbach et al., 2007]. Это могут быть самые разнообразные факторы, влияния которых интегрируются в исходную память, образуя новую модифицированную память. В этой связи возникает вопрос, как в ходе дестабилизации и реконсолидации памяти в инструментальном пищевом поведении соотносятся и взаимодействуют между собой обновляемая “старая” и обновленная “новая” память. Попытки понять особенности такого взаимодействия предпринимались в ряде работ [Jones et al., 2012; Hupbach et al., 2007], но, к сожалению, прямого ответа на поставленный вопрос получено не было. Но справедливости ради надо отметить, что в процессе реактивации (в период лабильной фазы) использовались такие вмешательства [Lee et al., 2017; Haubrich et al., 2015; Jones et al., 2012], которые влияли на структуру обновляемой (updating) памяти. К этим вмешательствам относятся процедуры угашения и нового обучения в лабильной фазе памяти [Lee et al., 2017].
В настоящей работе мы использовали такую процедуру реактивации инструментального пищевого поведения, которая позволила нам оценить состояние как “новой” обновленной памяти, сформированной в результате включения в фазу реактивации реверсивного обучения, так и “старой”, или прошлой памяти, сформированной в результате первичного обучения. Первичное обучение заключалось в выработке инструментального пищевого поведения в 8-рукавном радиальном лабиринте (поиск и поедание пищевых гранул в четырех рукавах). Реверсивное обучение представляло собой выработку инструментального поведения со сменой всех ранее подкреплявшихся рукавов лабиринта на неподкрепляемые, а ранее не подкреплявшихся на подкрепляемые (переделка первичного навыка). В задачи работы входило исследование возможности дестабилизации и реконсолидации пространственной памяти в инструментальном пищевом поведении при выбранных условиях реактивации, а также возможности блокады подобной реконсолидации с помощью антагониста NMDA-рецепторов, вещества МК-801. Важно было также выяснить, как использование реверсивного обучения в фазе реактивации отразится на проявлениях обновляемой “старой” и обновленной “новой” памяти в фазе тестирования.
МЕТОДИКА
Опыты проведены на 23 крысах-самцах линии Вистар массой 300–350 гр. Крыс содержали в клетках группами по 4–5 животных при обычном 12-часовом искусственном световом режиме и свободном доступе к воде. Количество подаваемой пищи регулировалось так, чтобы поддерживать массу крысы на уровне приблизительно 80% от массы животного при свободном доступе к пище. Эксперименты осуществляли с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (2010/63/ЕU), и Положением Института ВНД и НФ РАН о работе с экспериментальными животными.
8-рукавный радиальный лабиринт состоял из центральной платформы (диаметр 32 см) и 8 отходящих от нее в виде лучей рукавов (длина 45 см, ширина 10 см) со слегка приподнятыми бортиками (высота 7 см). В дистальных частях рукавов лабиринта располагались кормушки, в которых помещали подкрепление (пищевые гранулы по 45 мг производства фирмы “Bio-Serv”, dustless precision pellets, США). Лабиринт был приподнят от пола на 50 см, 4 рукава лабиринта всегда подкрепляли, 4 других не подкрепляли, причем подкрепляемые и неподкрепляемые рукава выбирали так, что максимально примыкать друг к другу могли только два рукава (например, 1, 2, 5 и 8). Опыты проводили в небольшой комнате, где вокруг лабиринта располагались разные предметы, которые служили зрительными стимулами при ориентации в пространстве. Животные должны были обучиться связывать эти стимулы с положением подкрепляемых рукавов, находить в них пищу и поедать ее.
Адаптация к лабиринту. В первый день крыс парами помещали на 5 мин на центральную платформу для знакомства и обследования лабиринта. Такое парное размещение способствовало лучшей адаптации животных к новой среде. Пищевые гранулы были равномерно разбросаны по всему лабиринту. На второй день эту процедуру повторяли, но на этот раз пищевые гранулы находились только в дистальных отделах всех рукавов. На третий день крысы обследовали лабиринт индивидуально, пищевые гранулы (4 шт.) находились только в кормушках четырех рукавов, которые были выбраны подкрепляемыми. За эти три дня все крысы привыкали к лабиринту, активно обследовали его, находили пищу и поедали ее.
Обучение по основной схеме А в 8-рукавном радиальном лабиринте начинали на четвертый день. Крысы должны были научиться находить подкрепляемые рукава, заходить в них и поедать из кормушек пищевые гранулы. Они также должны были обучиться не входить в неподкрепляемые рукава. После того, как крысы обходили все 4 подкрепляемые рукава и поедали корм, пробу прекращали. Максимальное время каждой пробы составляло 5 мин. В день применяли одну пробу, опыты продолжали в течение 30 дней, без перерывов, в одно и то же время дня с 11.00 до 14.00. Оценивали время, за которое животные обходили подкрепляемые рукава лабиринта, и число заходов в неподкрепляемые рукава, которые рассматривали как ошибки долгосрочной памяти. После того, как крысы обучались в течение 5 мин находить пищу в подкрепляемых рукавах лабиринта и поедать ее, совершая при этом за дневную сессию в среднем для всех крыс одну или менее ошибки за пробу, приступали к основным опытам – исследованию возможности реконсолидации памяти в инструментальном пищевом поведении и влияния на нее антагониста NMDA-рецепторов, МК-801. Схема опытов приведена на рис. 1.
Рис. 1.
(а) – План проведения опытов; (б) – Расположение подкрепляемых рукавов по оригинальной (серые круги) и реверсивной (белые квадраты) схеме обучения в 8-рукавном радиальном лабиринте.
Fig. 1. (а) – a plan of the experiments; (б) – locations of the reinforced arms of a radial arm maze by the original (grey circles) and reverse (white squares) scheme of learning.
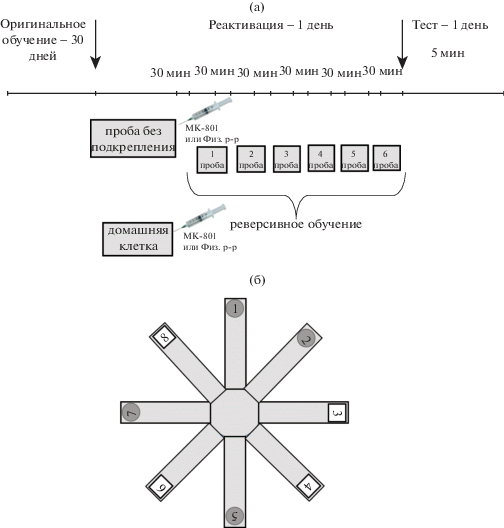
Процедура реактивации памяти. Все животные были разделены на 4 группы: 1) MK-801 + R+-группа, (n = 6), 2) Sal + R+-группа, (n = 6), 3) MK-801 + R–группа, (n = 5), 4) Sal + R–-группа, (n = 6). После выработки устойчивого пищедобывательного навыка в 8-канальном радиальном лабиринте две группы животных (MK-801 + R+ и Sal + R+) помещали в лабиринт на 5 мин без подкрепления. Сразу после окончания пробы животным обеих групп вводили внутрибрюшинно MK-801 (1.0 мг/кг) или физиологический раствор (1.0 мл/кг) соответственно. Двум другим группам животных (MK-801 + R– и Sal + R–), не проходивших процедуру реактивации памяти, в домашней клетке также вводили внутрибрюшинно MK-801 (1.0 мг/кг) или физиологический раствор (1.0 мл/кг) соответственно.
Реверсивное обучение (переделка навыка). Через 30 мин после введения препаратов приступали к реверсивному обучению. Условия опыта были такими же, как и при первоначальном обучении, с той лишь разницей, что подкрепляемыми рукавами лабиринта становились теперь ранее не подкреплявшиеся, и, наоборот, ранее не подкреплявшиеся рукава становились подкрепляемыми (ситуация Б). В ходе реверсивного обучения применяли 6 проб (максимально по 5 мин каждая) с интервалами между пробами в 30 мин. Крыс разных групп чередовали, чтобы избежать влияния суточных колебаний активности на какую-либо из групп.
Тестирование “новой” и “старой” памяти. Через 24 ч после процедуры реактивации и реверсивного обучения в специальном тесте исследовали память о пищевом поведении у крыс разных групп путем помещения их в 8-канальный радиальный лабиринт на 5 мин без подкрепления. Регистрировали время, которое требовалось крысе для обхода всех подкреплявшихся рукавов лабиринта и число ошибочных заходов в неподкреплявшиеся рукава. При обработке данных анализ проводился по двум схемам: реверсивного и оригинального обучения. По схеме реверсивного обучения (ситуация Б) подсчитывали общее число заходов в неподкреплявшиеся рукава лабиринта (бывшие подкрепляемыми при первичном обучении) (ситуация А) до тех пор, пока крысы не обходили все четыре подкрепляемые рукава (ранее не подкреплявшиеся в ситуации А). По схеме первичного обучения (ситуация А) подсчитывали общее число заходов в неподкреплявшиеся рукава (ставшие подкрепляемыми в ситуации Б) до тех пор, пока крысы не обходили все четыре подкреплявшиеся рукава (ставшие неподкрепляемыми в ситуации Б). Таким образом, проведенный подсчет и анализ ошибок памяти по двум разным схемам обучения позволяли оценить: 1) в какой степени у крыс разных групп проявляется обновленная “новая” (оцениваемая по числу ошибок в ситуации Б) и прошлая “старая” память (оцениваемая по числу ошибок в ситуации А), и 2) каково влияние МК-801 на проявления этих двух форм памяти.
Статистическая обработка. Результаты обрабатывали с использованием программы Statistica 10.0 (StatSoft, USA). Проверку распределения в выборках на соответствие закону нормального распределения проводили с использованием критерия Колмогорова–Смирнова. Для оценки межгрупповых различий (фактор ГРУППА) использовали однофакторный анализ ANOVA. В дальнейшем использовали два действующих фактора – РЕАКТИВАЦИЯ (R– и R+) и МК-801 (Sal и МК-801). Для оценки динамических показателей использовали фактор ПРОБА. Для того чтобы выявить влияние всех изучаемых факторов и оценить взаимодействие между ними, применяли дисперсионный многофакторный анализ (3-way Repeated Measures ANOVA). В качестве теста для post hoc использовали тест Fisher. Если распределение не было нормальным, использовали тесты: Mann–Whitney U test для независимых и Вилкоксона (Wilcoxon Matched Pairs Test W test) для зависимых переменных.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
При анализе усредненных данных за три дня, предшествующие началу основного эксперимента, не было обнаружено различий между группами крыс ни по времени обхода подкрепляемых рукавов лабиринта (Sаl + R+ – – 93.8c ± 18.6; MK-801 + R+ – 109.22c ± 22.4; Sal + R– – 101.8c ± 29.1; MK-801 + R– – 125.6c ± ± 32.6) [F(3,19) = 0.267, p = 0.85], ни по числу ошибок долгосрочной памяти (Sаl + R+– 0.3 ± ± 0.1; MK-801 + R+ – 0.7 ± 0.3; Sal + R– – 0.3 ± ± 0.1; MK-801 + R– – 0.8 ± 0.4) [F(3,19) = = 1.008, p = 0.41].
Поведение крыс во время реактивации. Реактивацию памяти (напоминание) у крыс двух групп (Sаl + R+ и MK-801 + R+) проводили путем помещения их в тот же лабиринт, в котором проходило первичное обучение, на 5 мин, но без подкрепления. В течение первых полутора минут животные обходили все ранее подкрепляемые рукава. Не найдя в них пищевых гранул, часть животных (8 крыс) 1–2 раза заходила в неподкрепляемые рукава, но затем теряла интерес к поиску пищи, оставаясь неподвижными до конца пробы. Четыре другие крысы (по две из каждой группы) продолжали поиск до окончания пробы, повторно обходя подкрепляемые и неподкрепляемые рукава. Однако различий между группами крыс в числе заходов в ранее подкрепляемые (Sаl + R+ – 7.67 ± 1.76; MK-801 + R+ – – 6.00 ± 0.93) и неподкрепляемые рукава (Sаl + R+ – 3.83 ± 1.92; MK-801 + R+ – 3.17 ± 1.42) не наблюдалось (p > 0.05, Mann–Whitney U test).
Реверсивное обучение. Сразу после окончания одиночной пробы без подкрепления вводили МК-801 или физиологический раствор и через 30 мин после инъекции у всех крыс начинали выработку реверсивного обучения (переделку исходного навыка). Как и ожидалось, в первую пробу время обхода подкрепляемых рукавов лабиринта и число совершаемых ошибок (рис. 2) достоверно увеличились по сравнению с усредненными значениями за последние три дня оригинального обучения как для времени обхода у Sаl + R+, MK-801 + R+ , MK-801 + R– (p < 0.0001) и у Sal + R– (p < < 0.05), так и для числа ошибок у всех групп крыс, p < 0.0001(W test).
Рис. 2.
Реверсивное обучение. (а) – время обхода подкрепляемых рукавов, (б) – число ошибочных заходов в неподкрепляемые рукава. По оси ординат: (а) – время в с., (б) – число ошибок. По оси абсцисс – номер пробы. Серые линии – данные по группам Sal, черные – по группам МК-801. Сплошные линии – реактивированные группы, пунктирные линии – группы без реактивации. * – статистически значимые различия между группами Sаl + R+ и МК-801 на (а), и между Sаl + R+ и остальными группами на (б), # – статистически значимые различия между группами Sаl и МК-801 (p < 0.05).
Fig. 2. Reverse learning. (а) – Time spent to visit all reinforced arms, (б) – a number of erroneous entries into the non-reinforced arms. On vertical axis: (а) – time in s., (б) – a number of errors. On horizontal axis – a number of trials. The grey lines show the data for Sal groups, the black lines for MK-801 groups. The solid lines represent the reactivated groups, the dashed lines – non-reactivated groups. * – the significant differences between Sаl + R+ and MK-801 groups on (а), and between Sаl + R+ and other groups on (б), # – the significant differences between Sаl and MK-801 groups (p < 0.05).
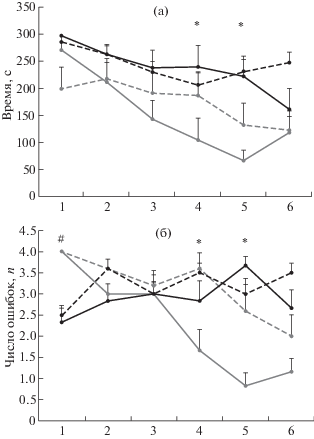
В последующих пробах время обхода подкрепляемых рукавов и число ошибок существенно уменьшались. О том, что происходило обучение, свидетельствовало значимое влияние фактора ПРОБА [F(5, 114) = 5.919, p = 0.0007] для времени обхода и [F(5,114) = = 4.370, p = 0.0012] для числа ошибок. Статистически значимым для времени обхода подкрепляемых рукавов было влияние фактора MK-801 [F(6,14) = 4.153, p = 0.013]. Влияние фактора РЕАКТИВАЦИЯ в данном случае было не значимым [F(6,14) = 1.417, p = 0.276]. Различия между Sal + R+ и МК-801 + R+ и между Sal + R+ и МК-801 + R– группами проявились с высокой степенью достоверности (p < 0.0001). Высокодостоверными были также различия между группами Sal + R– и МК-801 + R+, и между Sal + R– и МК-801 + R– (p < 0.005). В пределах однородных групп статистически значимых различий (Sаl + R+ vs Sal + R–, p = 0.27) и (МК-801 + R+ vs MK-801 + + R–, p = 0.73) обнаружено не было. Причем меньше всего времени на обход подкрепляемых рукавов лабиринта в 3–5-е пробы затратила Sаl + R+ группа, в 4-ю и 5-ю пробы разница между крысами Sаl + R+ и крысами, получавшими МК-801, была статистически значимой (p < 0.005), а разница между Sаl + R+ и Sal + R– проявилась на уровне тенденции (p < 0.1). Но к 6-й пробе эти различия исчезали (рис. 2 (а)).
При анализе числа ошибочных заходов в неподкрепляемые рукава было выявлено значимое влияние как фактора MK-801 [F(6,14) = = 3.5932, p = 0.032], так и фактора РЕАКТИВАЦИЯ [F(6,14) = 7.7128, p = 0.002]. При этом крысы группы Sаl + R+ во время реверсивного обучения совершали меньше ошибок по сравнению с крысами MK-801 + R+, (p < < 0.0005), Sаl + R–, (p < 0.0005) и MK-801 + R–, (p < 0.00005). Между крысами групп MK-801 + R+, Sаl + R– и MK-801 + R– статистически значимых различий выявлено не было (рис. 2 (б)). Исследование взаимодействия факторов ПРОБА + МК-801 + РЕАКТИВАЦИЯ обнаружило значимые влияния [F(15,114) = 4.626, p = 0.0001]. Интересно, что в первую пробу крысы, получавшие МК-801, совершали достоверно меньше ошибок по сравнению с крысами, получавшими физиологический раствор (p < 0.01). Но если крысы, получавшие физиологический раствор, демонстрировали очевидное обучение: число ошибок в первой и последней пробах было соответственно 4.0 ± 0.0 и 1.17 ± 0.3 (p < 0.00001) у Sаl + R+-группы, 4.0 ± 0.0 и 2.05 ± 0.5 (p < 0.0005) у Sal + R–группы, то у крыс, получавших МК-801, обучения практически не происходило. Крысы Sаl + R+-группы имели лучшие показатели при обучении, начиная с 4-й пробы число ошибок у них было существенно меньше (p < 0.001), чем у крыс других групп в соответствующих пробах (рис. 2 (б)).
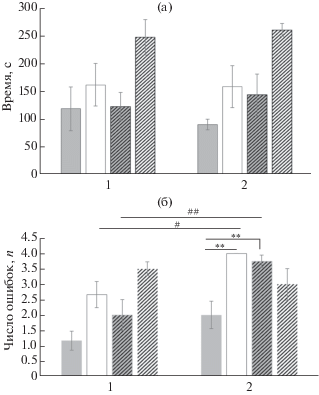
Состояние “новой” памяти в тесте через 24 часа после реактивации и реверсивного обучения. При тестировании “новой” памяти подсчитывали время, затрачиваемое крысами на обход всех подкрепляемых рукавов, и число ошибочных заходов в неподкрепляемые рукава в ситуации Б. Среднее время обхода подкрепляемых рукавов в ситуации Б для всех групп крыс было близким к значениям этого показателя в 6-й пробе реверсивного обучения. При анализе взаимодействия факторов ПРОБА + МК801 + РЕАКТИВАЦИЯ [F(1,19) = 0.1717, p = 0.683] и парном сравнении каждой из исследованных групп крыс (рис. 3 (а)) статистически значимых различий обнаружено не было. Количество ошибочных заходов в неподкрепляемые рукава в ситуации Б во время теста было больше, чем в 6-й пробе, но статистической значимости эти различия достигали только у групп МК-801 + R+ (p < 0.05) и Sal + R– (p < 0.01). Примечательно, что структура межгрупповых отношений по этому показателю (рис. 3 (б)) спустя сутки мало изменилась – меньше всего ошибок опять совершала группа, получавшая реактивацию и инъекцию физиологического раствора (Sаl + R+); крысы других групп практически забывали расположение подкрепляемых рукавов, совершая при их поиске либо максимальное число ошибок (4 ошибки), либо близкие к нему значения. Статистически значимые различия были выявлены при анализе взаимодействия факторов ПРОБА + МК-801 + РЕАКТИВАЦИЯ [F(1,19) = = 6.735, p = 0.018]. Они вызывались за счет различий в числе ошибок у групп Sаl + R+ и MK-801 + R+ (p < 0.001), и групп Sаl + R+ и Sаl + R– (p < 0.001). На уровне тенденции различия проявились между группами Sаl + R+ и МK-801 + R– (p = 0.09).
Рис. 3.
Тестирование крыс по схеме в ситуации Б через 24 ч после реверсивного обучения в сравнении с 6-й пробой предшествующего дня. (а) – время обхода кормушек, (б) – число ошибочных заходов в неподкрепляемые рукава лабиринта. По оси ординат: на (а) – время в с., на (б) – число ошибок. По оси абсцисс: 1 – результаты 6-й пробы реверсивного обучения, 2 – результаты тестирования крыс через 24 ч по схеме в ситуации Б. Серые столбцы – данные по группам Sal, белые – по МК-801. Сплошные линии – реактивированные группы, заштрихованные линии – группы без реактивации. * – статистически значимые различия между группами (p < < 0.05), ** – p < 0.01, # – различия между показателями в 6-й пробе и в тесте (p < 0.05), ## – p < 0.01.
Fig. 3. The testing of rats according to a plan in situation Б 24 hours after the reverse learning in comparison with the 6th trial of the previous day. (а) – time spent to visit all reinforced arms, (б) – a number of erroneous entries into the non-reinforced arms. On vertical axis on (а) – time in s., on (б) – a number of errors. On horizontal axis: 1 – the results for 6th trial of reverse learning, 2 – the results for test 24 hours after reverse learning by a plan in situation Б. The grey columns represent the results for Sal groups, the white columns – for MK-801 groups. The solid lines show the reactivated groups, the dashed lines – non-reactivated groups. * – the significant differences between groups (p < 0.05), ** – p < 0.01, # –differences between data in the 6th trial and in the test (p < 0.05), ## – p < 0.01.
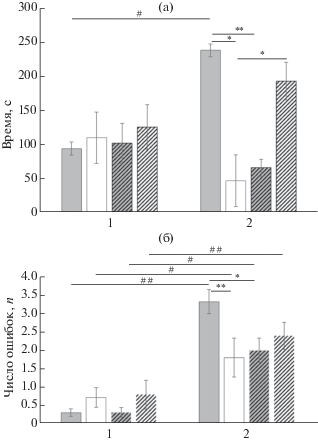
Состояние “старой” памяти в тесте через 24 часа после реактивации и реверсивного обучения. При тестировании “старой” памяти подсчитывали время, которое крысы затрачивали на обход всех подкрепляемых рукавов лабиринта, и число ошибочных заходов в ситуации А, т.е. как при первоначальном обучении. В этой ситуации, как и в ситуации Б, не было обнаружено статистически значимых различий (p > 0.05) между временем обхода подкрепляемых рукавов в тесте и фоне (среднее значение за 3 последних дня перед реверсивным обучением) у групп MK-801 + R+, Sаl + R– и МK-801 + R–. У крыс же группы Sаl + R+ наблюдалось статистически значимое увеличение времени обхода рукавов (p < 0.001). Анализ взаимодействия факторов МК-801 + РЕАКТИВАЦИЯ [F(1,19) = 76.114, p = 0.000] показал зависимость между этими факторами. Различия между отдельными группами крыс были статистически значимыми (рис. 4 (а)). Быстрее других обходили подкрепляемые рукава крысы MK-801 + R+ и Sаl + R– групп. Хуже других это делали крысы Sаl + R+ группы. Post hoc анализ выявил статистически значимые различия между группами крыс Sаl + R+ и группами MK-801 + R+ и Sаl + R– (p < 0.001); и MK-801 + R+ и MK-801 + R– (p < 0.001). Различия между группами Sаl + R+ и MK-801 + R– проявились на уровне тенденции (p = 0.08). Среднее число ошибок при тестировании крыс в ситуации А было существенно больше, чем в фоне у Sаl + R+ (p < 0.001), у МK-801 + R+ (p < 0.05), у Sаl + R– (p < 0.001) и у МK-801 + R– (p < 0.001), фактор ПРОБА [F(1,19) = 76.352, p = 0.000]. Анализ взаимодействия факторов МК-801 + РЕАКТИВАЦИЯ [F(1,19) = 4.092, p = 0.047] также выявил зависимость между этими факторами. Статистически значимые различия между группами проявились за счет различий в числе ошибок между Sаl + R+ и MK-801 + R+ (p < 0.005) и Sаl + R+ и Sаl + R– (p < 0.05) (рис. 4 (б)). Различия между Sаl + R+ и MK-801 + R– были на уровне тенденции (p = 0.06). Статистически значимых различий между группами MK-801 + R+, Sаl + R– и MK-801 + R– по числу ошибочных заходов обнаружено не было (p > 0.05).
Рис. 4.
Тестирование крыс по схеме в ситуации А через 24 ч после реверсивного обучения в сравнении с фоном оригинального обучения. (а) – время обхода кормушек, (б) – число ошибочных заходов в неподкрепляемые рукава лабиринта. По оси ординат: на (а) – время в с., на (б) – число ошибок. По оси абсцисс: 1 – данные для фона оригинального обучения, 2 – данные теста через 24 ч по схеме в ситуации А. Серые столбцы – данные по группам Sal, белые – по МК-801. Сплошные линии – реактивированные группы, заштрихованные линии – группы без реактивации. * – статистически значимые различия между группами (p < 0.05), ** – p < 0.01, # – различия между показателями в фоне и тесте (p < 0.05), ## – p < 0.01.
Fig. 4. The testing of rats according to a plan in situation А 24 hours after the reverse learning in comparison with the baseline of original learning. (а) – time spent to visit all reinforced arms, (б) – a number of erroneous entries into the non-reinforced arms. On vertical axis on (а) – time in s., on (б) – a number of errors. On horizontal axis: 1 – the results for baseline of original learning, 2 – the results for test 24 hours after reverse learning by a plan in situation A. The grey columns represent the results for Sal groups, the white columns – for MK-801 groups. The solid lines show the reactivated groups, the dashed lines – non-reactivated groups. * – the significant differences between groups (p < 0.05), ** – p < 0.01, differences between data in the baseline and in the test (p < 0.05), ## – p < 0.01.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе мы показали, что реактивация памяти в инструментальном пищевом поведении с помощью одной единственной неподкрепляемой пробы и последующего реверсивного обучения оказывает двойственное влияние на память. С одной стороны, происходит ослабление “старой” памяти, сформированной в ходе выработки оригинального обучения, с другой, наступает облегчение “новой” памяти, формируемой в ходе выработки реверсивного обучения (переделки). У контрольных крыс, хорошо обучившихся в 8-рукавном радиальном лабиринте, находить пищу в 4 подкрепляемых рукавах, в результате помещения их в тот же лабиринт на 5 мин без подкрепления (напоминание) и последующего непродолжительного реверсивного обучения существенно ухудшалось проявление первично выработанного пищевого инструментального навыка. В большинстве работ воздействие с целью влияния на процесс реконсолидации (в нашем случае МК-801) применяется сразу после процедуры реактивации на фоне лабильного состояния памяти. Результат проверяется через 24 ч. В наших опытах у группы крыс, получавших инъекцию физиологического раствора, под влиянием реактивации происходило серьезное ухудшение первично выработанного навыка, о чем свидетельствует резкое увеличение числа совершенных ошибок у этой группы крыс при тестировании через сутки после реактивации. Под влиянием МК-801 память о том, что во время реактивации животные обходили лабиринт и не получали пищу в четырех ранее подкреплявшихся рукавах, утрачивалась; крысы как будто “забывали” об этом. Такое “забывание” приводило при тестировании через 24 ч к тому, что первично выработанный инструментальный навык у них проявлялся в лучшей степени, чем у реактивированной группы, получавшей инъекцию физиологического раствора. Ранее мы [Зайченко и др., 2018] показали, что одна единственная неподкрепляемая проба в фазу реактивации (без реверсивного обучения) способна дестабилизировать оригинальную память и вызвать ее ослабление при реконсолидации, что проявляется в существенном увеличении числа ошибок долгосрочной памяти у реактивированных крыс по сравнению с нереактивированными животными. Согласно теоретическим представлениям, существующим на этот счет в литературе [Fernandez et al., 2016; Schultz et al., 1997], реконсолидация могла быть результатом рассогласования (mismatch) между ожидаемым пищевым подкреплением и его отсутствием в реальности. Причем в одной единственной пробе без подкрепления крыса сталкивалась сразу с 4 случаями рассогласования, поскольку обходила 4 ранее подкрепляемые рукава и ни в одном из них не получала подкрепления. Отсутствие подкрепления в фазу реактивации запоминалось во время реконсолидации, и по этой причине при тестировании через 24 ч у реактивированных крыс наблюдалось ослабление исходно выработанного навыка по сравнению с нереактивированными животными. По мнению Д. Севенстера и соавт. [Sevenster et al., 2014], только первое применение условного раздражителя без подкрепления приводит к дестабилизации оригинальной памяти. Каждое последующее неподкрепляемое применение условного раздражителя минимизирует рассогласование между прогнозом и реальностью, в результате вместо модифицированного запоминания прежнего навыка формируется новое обучение (угашение исходно выработанного навыка). В настоящих опытах дополнительный фактор (реверсивное обучение) в фазу реактивации еще больше дестабилизировал первичный пищевой инструментальный навык. Причем в отличие от дестабилизации оригинальной памяти с помощью только одной единственной пробы без подкрепления, реверсивное обучение способствовало не только ухудшению исходно выработанного навыка (“старой” памяти), но и приводило к формированию нового инструментального навыка (“новой” памяти), противоположного ранее выработанному. Этот новый навык лучше вырабатывался у реактивированной контрольной группы по сравнению с нереактивированными животными, поскольку выработка реверсивного обучения у них уже начиналась на фоне частично ослабленного оригинального обучения из-за неполучения 4 порций пищи в пробе, предшествующей реверсивному обучению. Нереактивированные крысы сложнее обучались также новому навыку (переделке), так как реверсивное обучение у них начиналось без предварительного угасания исходного навыка, и в силу этого им было труднее преодолеть конфликт между оригинальным и реверсивным обучением. В результате процедуры реактивации у крыс существенно ухудшалась “старая” (оригинальная) память, причем в большей степени у реактивированных контрольных животных. Эта группа крыс совершала максимально возможное число ошибок в ситуации А, поскольку хорошо обучалась новому инструментальному навыку в ситуации Б. У крыс других групп число ошибок в ситуации А было существенно меньше, чем у реактивированной группы, но существенно больше, чем у животных соответствующих групп в фоне. Другими словами, нереактивированные крысы в ситуации А занимали среднее положение между реактивированными крысами, получавшими инъекции физиологического раствора и МК-801, т.е. переделка инструментального навыка у них без предварительной неподкрепленной пробы вызывала более серьезный конфликт между оригинальным и реверсивным обучением, что ухудшало проявления как новой, так и старой памяти.
В литературе для дестабилизации памяти используют разные приемы, причем как ослабляющие, так и усиливающие оригинальную память. Например, Хоубрик и др. [Haubrich et al., 2015] показали, что если в процессе реактивации негативной памяти применять эмоциональные позитивные стимулы, то благодаря инкорпорации в нее позитивной информации память о страхе ослабевает. Аналогичные данные были получены Ф. Монти и др. [Monti et al., 2016], которые обнаружили, что потребление раствора сахарозы в стадии реактивации приводит к ослаблению памяти страха, и это ослабление реализуется через NMDA GluN2B-рецепторы в базолатеральной миндалине, поскольку блокада этих рецепторов снимает облегчающий эффект сахарозы. Показано, что даже простое применение нового раздражителя во время дестабилизации позитивной памяти облегчает процесс ее реконсолидации [Wang, 2018]. То же наблюдалось при инкорпорации пробы с сильным подкреплением в Т-образном лабиринте в процесс реконсолидации пространственной памяти в ситуации обучения с более слабым подкреплением [Salvetti et al., 2014]. Обнаружено, что у людей новое обучение в том же контексте в условиях реактивации интегрируется в старую память, вызывая ее обновление и модификацию [Hupbach et al., 2007]. Новое обучение в период реактивации вызывает двоякое действие [Zhu et al., 2018]. Во-первых, оно ослабляет первоначальную память, а во-вторых, интегрирует новую информацию в старую память. Б. Джонс и др. [Jones et al., 2012] обучали две группы крыс в контексте (А) находить и поедать пищу в 3 строго расположенных кормушках. На следующий день одну группу крыс тестировали в том же контексте (реактивация), но пищу располагали в 3 других кормушках, а вторую группу обучали находить пищу в аналогично расположенных кормушках, но в другом контексте (без реактивации) (контекст Б). На третий день обе группы крыс снова тестировали в контексте А при расположении пищи в тех же кормушках, что и в первый день. Оказалось, что крысы с реактивацией существенно чаще подходили к кормушкам 2-го дня, чем крысы без реактивации. Эти данные свидетельствуют о том, что реактивация способствует интеграции нового опыта, приобретенного во второй день, в старую память, которая была приобретена в первый день обучения [Jones et al., 2012]. Несмотря на существенные различия в процедуре реактивации и обучении крыс (степень прочности навыков, использования однотипной и комбинированной реактивации, одного или разных контекстов при реактивации и тестировании и др.) в работе [Jones et al., 2012] и в наших опытах, результаты оказались очень похожими.
Помимо поведенческих вмешательств (нейтральный раздражитель, угашение ранее сформированного навыка, новое обучение и т.д.), существуют и нейрофармакологические способы воздействия на процесс реконсолидации. В частности, мы уже отмечали блокаду реконсолидации памяти в пищевом инструментальном поведении антагонистом NMDA-рецепторов, веществом МК-801 в ряде работ [Exton-McGuinness, Lee, 2015; Exton-McGuinness et al., 2014; Lee, Everitt, 2008] и в наших предшествующих опытах [Зайченко и др., 2018]. Такой же результат был получен в настоящей работе при реактивации инструментального пищевого навыка с помощью одноразовой пробы без подкрепления и реверсивного обучения. У животных, получавших МК-801 в фазе реактивации, происходило ухудшение старой памяти и нарушение формирования новой памяти. Никитин и др. [2017] показали, что антагонисты NMDA-рецепторов могут вызывать и обратный эффект – не ухудшать, а восстанавливать утраченную память. В их опытах введение на ранней стадии амнезии (третьи сутки) антагонистов NMDA- и АMPА-рецепторов и напоминание условным пищевым стимулом приводили к восстановлению памяти. Изолированное действие напоминания или введение антагонистов без напоминания либо после него не оказывали эффекта. Приведенные данные хотя и не раскрывают механизмы участия глутаматных рецепторов в процессах реконсолидации памяти, но свидетельствуют об их важной роли в этих процессах, и не только в случае инструментальных пищевых рефлексов, но и при иных формах позитивного поведения. Более подробно это описано в диссертационной работе М. Экcтон-МакГиннесса [Exton-McGuinness, 2014].
ВЫВОДЫ
1. Пространственная память о пищевом инструментальном навыке в 8-рукавном радиальном лабиринте у крыс подвергалась реконсолидации при реактивации с помощью одноразовой пробы без подкрепления и последующего краткого реверсивного обучения. В результате реактивации у контрольной группы животных, получавшей инъекцию физ. раствора, существенно ухудшалась память об исходно выработанном инструментальном навыке. Одновременно под влиянием реверсивного обучения формировалась “новая” память о вновь вырабатываемом инструментальном поведении (переделка) с поиском пищи в тех рукавах лабиринта, которые при первичном обучении были неподкрепляемыми.
2. Блокада NMDA-рецепторов с помощью МК-801 сразу после одиночной пробы без подкрепления и за 30 мин до начала реверсивного обучения вызывала частичное восстановление памяти об исходно выработанном инструментальном пищевом навыке. Она ухудшала формирование нового навыка (переделку оригинального обучения). Крысы, получавшие МК-801, совершали достоверно больше ошибок и затратили достоверно больше времени на обход подкрепляемых рукавов при переделке, чем контрольные животные.
3. Использование в фазе реактивации наряду с одноразовой пробой без подкрепления также краткосрочного реверсивного обучения позволило выделить и оценить проявления “старой” памяти, присущей оригинальному обучению, и “новой” памяти, присущей переделанному инструментальному навыку. В результате реактивации происходило ухудшение старой и формирование новой памяти.
Работа выполнена с использованием средств государственного бюджета по госзаданию на 2019–2021 гг. (№ г.р. АААА-А17-117092040002-6 (руководитель темы П.М. Балабан).
Список литературы
Зайченко М.И., Маркевич В.А., Григорьян Г.А. Реактивация и реконсолидация памяти в оборонительном и пищевом инструментальном поведении. Успехи физиол. наук. 2020. 51 (1): 87–102.
Зайченко М.И., Григорьян Г.А., Маркевич В.А. Влияние МК-801 на пространственную память в 8-канальном радиальном лабиринте у крыс зависит от условий ее реактивации. Журн. высш. нервн. деят. им. И.П. Павлова. 2018. 68 (2): 216–222.
Зюзина А.Б., Балабан П.М. Угашение и реконсолидация памяти. Журн. высш. нервн. деят. им. И.П. Павлова. 2015. 65 (5): 564–576.
Никитин В.П., Козырев С.А., Солнцева С.В. Реконсолидация процессов амнезии, индуцируемая напоминанием: участие NMDA- и АМПА рецепторов глутамата. Бюллетень экспериментальной биологии и медицины. 2015. 160 (7): 4–9.
Boccia M.M., Blake M.G., Acosta G.B., Baratti C.M. Memory consolidation and reconsolidation of an inhibitory avoidance task in mice: effects of a new different learning task. Neuroscience. 2005. 135: 19–29.
Brown T.E., Lee B.R., Sorg B.A. The NMDA antagonist MK-801 disrupts reconsolidation of a cocaine-associated memory for conditioned place preference but not for self-administration in rats. Learn Mem. 2008. 15 (12): 857–865.
Dudai Y. The neurobiology of consolidations, or, how stable is the engram? Annu Rev Psychol. 2004. 55: 51–86.
Exton-McGuinnesss M.T., Lee J.L. Reduction in responding for sucrose and cocaine reinforcement by disruption of memory reconsolidation (1,2,3). eNeuro. 2015. 2 (2): 9–15.
Exton-McGuinnesss M.T., Patton R.C., Sacco L.B., Lee J.L. Reconsolidation of a well-learned instrumental memory. Learn. Mem. 2014. 21 (9): 468–477.
Exton-McGuinnesss, Marc Thomas James. Neural mechanisms of memory reconsolidation. 2014. Birmingham University. Ph.D. https://etheses.bham.ac.uk/id/eprint/4858/
Fernández R.S., Boccia M.M., Pedreira M.E. The fate of memory: reconsolidation and the case of prediction error. Neurosci. Biobehav. Rev. 2016. 68: 423–441.
Garcia-Delatorre P., Rodríguez-Ortiz C.J., Balderas I., Bermúdez-Rattoni F. Differential participation of temporal structures in the consolidation and reconsolidation of taste aversion extinction. Eur J Neurosci. 2010. 32 (6): 1018–1023.
Gotthard G.H., Kenney L., Zucker A. Reconsolidation of appetitive odor discrimination requires protein synthesis only when reactivation includes prediction error. Behav Neurosci. 2018. 132 (3): 131–137.
Haubrich J., Crestani A.P., Cassini L.F., Santana F., Sierra R.O., Alvares L.de O., Quillfeldt J.A. Reconsolidation allows fear memory to be updated to a less aversive level through the incorporation of appetitive information. Neuropsychopharmacology. 2015. 40 (2): 315–326.
Hernandez P.J., Kelley A.E. Long-term memory for instrumental responses does not undergo protein synthesis_dependent reconsolidation upon retrieval. Learn. Mem. 2004. 11: 748–754.
Hupbach A., Gomez R., Hardt O., Nadel L. Reconsolidation of episodic memories: A subtle reminder triggers integration of new information. Learn. Mem. 2007. 14: 47–53.
Jones B., Bukoski E., Nadel L., Fellous J.M. Remaking memories: reconsolidation updates positively motivated spatial memory in rats. Learn Mem. 2012. 19 (3): 91–98.
Lee J.L.C., Nader K., Schiller D. An update on memory reconsolidation updating. Trends Cogn. Sci. 2017. 21 (7): 531–545.
Lee J.L., Everitt B.J. Appetitive memory reconsolidation depends upon NMDA receptor-mediated neurotransmission. Neurobiol. Learn. Mem. 2008. 90 (1): 147–154.
Lewis D.J. Psychobiology of active and inactive memory. Psychol. Bull. 1979. 86: 1054–1083.
Lewis D.J., Bregman N.J., Mahan J.J. Jr. Cue-dependent amnesia in rats. J. Comp. Physiol. Psychol. 1972. 81 (2): 243–247.
McGaugh J.L. Memory – a century of consolidation. Science. 2000. 287 (5451): 248–251.
Mierzejewski P., Korkosz A., Rogowski A., Korkosz I., Kostowski W., Scinska A. Post-session injections of a protein synthesis inhibitor, cycloheximide do not alter saccharin self-administration. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2009. 33: 286–289.
Monti R.I., Giachero M., Alfei J.M., Bueno A.M., Cuadra G., Molina V.A. An appetitive experience after fear memory destabilization attenuates fear retention: involvement GluN2B-NMDA receptors in the basolateral. amygdala complex. Learn Mem. 2016. 23 (9): 465–478.
Nader K., Schafe G.E., LeDoux J.E. The labile nature of consolidation theory. Nat. Rev. Neurosci. 2000. 1 (3): 216–219.
Piva A., Gerace E., Di Chio M., Padovani L., Paolone G., Pellegrini-Giampietro D.E., Chiamulera C. Reconsolidation of sucrose instrumental memory in rats: The role of retrieval context. Brain Res. 2019. 1714: 193–201.
Przybyslawski J., Roullet P., Sara S.J. Attenuation of emotional and nonemotional memories after their reactivation: role of beta adrenergic receptors. J. Neurosci. 1999. 19 (15): 6623–6628.
Reichelt A.C., Lee J.L.C. Memory reconsolidation in aversive and appetitive settings. Front. Behav. Neurosci. 2013. 7: 118–119.
Reichelt A.C., Lee J.L.C. Appetitive pavlovian goal-tracking memories reconsolidate only under specific conditions. Learn. Mem. 2012. 20: 51–60.
Salvetti B., Morris R.G., Wang S.H. The role of rewarding and novel events in facilitating memory persistence in a separate spatial memory task. Learn. Mem. 2014. 21 (2): 61–72.
Schultz W., Dayan P., Montague R. A. Neural Substrate of Prediction and Reward. Science 1997. 5306: 1593–1599.
Sevenster D., Beckers T., Kindt M. Prediction error demarcates the transition from retrieval, to reconsolidation, to new learning. Learn. Memory. 2014. 21: 580–584.
Suzuki A., Josselyn S.A., Frankland P.W., Masushige S., Silva A.J., Kida S. Memory reconsolidation and extinction have distinct temporal and biochemical signatures. J. Neurosci. 2004. 24: 4787–4795.
Tedesco V., Mutti A., Auber A., Chiamulera C. Nicotine-seeking reinstatement is reduced by inhibition of instrumental memory reconsolidation. Behav. Pharmacol. 2014. 25 (8): 725–731.
Wang S.H. Novelty enhances memory persistence and remediates propranolol-induced deficit via reconsolidation. Neuropharmacology. 2018. 141: 42–54.
Zhu Z., Wang Y., Jia J., Huang L., Rao Yi., Wu Y. Post-reactivation new learning impairs and updates human episodic memory through dissociable processes. bioRxiv. 2018. bioRxiv preprint first posted online May 11, 2018. https://doi.org/10.1101/320101
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


