Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 6, стр. 763-769
Размер исследуемого пространства по-разному отражается в активности различных субрегионов гиппокампа вдоль его септотемпоральной оси
П. А. Купцов 1, М. Г. Плескачева 1, *, К. В. Анохин 2, 3
1 Кафедра высшей нервной деятельности, Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт перспективных исследований мозга, Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Федеральное государственное бюджетное научное учреждение Научно-исследовательский институт нормальной физиологии им. П.К. Анохина
Москва, Россия
* E-mail: mpleskacheva@yandex.ru
Поступила в редакцию 20.05.2020
После доработки 30.05.2020
Принята к публикации 01.06.2020
Аннотация
Функциональная дифференциация гиппокампа вдоль его продольной септотемпоральной оси не вызывает сомнений, однако факторы, определяющие эту субрегиональную специфичность, остаются предметом дискуссий. Известно, что градиент пространственной специфичности клеток места гиппокампа уменьшается вдоль его продольной оси от септального полюса к темпоральной области. Такое различие в шкале пространственной репрезентации предполагает возможность разного вовлечения нейронов этих субрегионов в процессы исследования и картирования территорий разного размера. Используя экспрессию c-Fos в качестве маркера активации нейронов гиппокампа в новой среде, мы изучили влияние исследования арен различного размера на активацию нейронов в септальных и темпоральных субрегионах полей CA1, CA3 и зубчатой фасции (ЗФ) у мышей C57BL/6. Результаты показали, что на интенсивность экспрессии влиял размер арены, при этом выявлено взаимодействие факторов активации субрегиона и размера арены. Повышенная экспрессия c-Fos обнаружена только в темпоральной части гиппокампа, при этом значительное изменение активации отмечалось в поле CA3 и ЗФ у мышей, исследовавших арену наибольшего размера. Экспрессия c-Fos в септальных субрегионах не различалась в аренах разного размера. Однако при повторном тестировании животного в арене другого размера дополнительно активировалась экспрессия в темпоральной части CA3 и в септальной части ЗФ. Высокая активность нейронов темпорального субрегиона гиппокампа может определяться не только размером исследуемой арены, но и повышенной неоднородностью большого пространства по биологической значимости разных его областей.
ВВЕДЕНИЕ
В настоящее время имеется множество нейрофизиологических, морфологических, молекулярно-генетических данных, свидетельствующих о функциональной неоднородности субрегионов гиппокампа вдоль его длинной оси от септального до темпорального полюса [Nadel, 1968; Moser, Moser, 1998; Bannerman et al., 2004; Fanselow, Dong, 2010; Strange et al., 2014; Kesner, 2018; Chawla et al., 2018 и др.]. Хотя сам факт наличия такой дифференциации уже не вызывает сомнений, факторы, определяющие функциональную специфичность субрегионов, особенно менее изученной темпоральной части гиппокампа, остаются предметом дискуссий. Не ясна и специфическая роль этой области в процессах исследовательской активности и пространственного картирования [O’Keefe, Nadel, 1978]. В настоящее время получены важные сведения о субрегиональных различиях в характеристиках пространственно-специфичных клеток места гиппокампа крыс. От септального к темпоральным субрегионам гиппокампа увеличиваются размеры рецептивных полей клеток места, пространство кодируется с разной степенью разрешения от высокой в септальном субрегионе (дорзальном гиппокампе) к низкой в темпоральной области (вентральном гиппокампе) [Jung et al., 1994; Kjelstrup et al., 2008; Royer et al., 2010]. Полученные факты позволяют предположить, что разные субрегионы гиппокампа могут быть по-разному вовлечены в процессы исследования среды разного размера, ее когнитивного картирования и контроля. В частности, предполагается, что крупномасштабная карта может быть важна для навигации в природных условиях при передвижении животных на больших индивидуальных участках контролируемой территории [Kjelstrup et al., 2008].
При этом увеличение размера доступного пространства может изменить его биологически значимые характеристики. В частности, при этом увеличивается открытое пространство, удаленное от безопасных мест, что может провоцировать тревожность. Контекстная неоднородность, очевидно, потребует усложнения и исследовательского поведения, его соответствия особенностям среды. Ранее подобные различия в исследовательском поведении у мышей C57BL/6 были показаны нами в экспериментах с использованием арен открытого поля различного диаметра (35, 75, 150 и 220 см в диаметре). Размер арены повлиял на характер передвижения животных в разных ее зонах, частоту посещений и характеристики участков пути (сегментов), в больших аренах проявлялась повышенная тревожность [Лебедев и др., 2012].
Известно, что темпоральный субрегион гиппокампа (вентральный у грызунов) участвует в процессах, связанных с тревожным поведением и страхом [Bannerman et al., 2004; Fanselow, Dong, 2010]. Существует мнение, что более крупные поля активности клеток места в вентральной части гиппокампа могут быть эволюционно выгодными, позволяя заранее, с большого расстояния, обнаружить приближающуюся опасность [Strange et al., 2014]. Можно предположить, что степень вовлечения темпоральных субрегионов будет увеличиваться с увеличением размера исследуемого пространства, однако как это увеличение пространства влияет на активность нейронов септального субрегиона гиппокампа? Показано, что в аренах и на линейных треках большого размера характеристики активности клеток места дорзального гиппокампа изменяются, появляются множественные поля разрядов [Fenton et al., 2008; Rich et al., 2014]. Недавно с использованием оценки экспрессии раннего гена Arc в качестве маркера клеточной активности было показано, что исследование небольшой арены (61 × 61 см) вызывало более выраженную активацию нейронов в септальном, по сравнению темпоральным, субрегионом гиппокампа [Chawla et al., 2018]. Однако никто не проводил прямого сравнения активации различных субрегионов гиппокампа у крыс или мышей, когда они исследовали экспериментальные пространства разного размера.
Ранее, используя экспрессию c-Fos в качестве маркера активации нейронов, мы показали, что исследование незнакомого радиального лабиринта вызывает неоднородную активацию полей гиппокампа вдоль септотемпоральной оси у обыкновенных полевок [Купцов и др., 2005] и мышей C57BL/6 [Купцов и др., 2012]. Наибольшее увеличение экспрессии по сравнению с ее интенсивностью у контрольных животных (они передвигались в рукавах, отделенных от лабиринта) наблюдали в более темпоральных частях гиппокампа, промежуточном и вентральном субрегионах. Повышенная активация этой части СА1, по сравнению с септальным ее субрегионом, была обнаружена у мышей, исследовавших крупную арену открытого поля (150 см в диаметре).
Целью настоящего исследования явилась оценка влияния размера арены, которую обследовали мыши C57BL/6, на активацию септального и темпорального субрегионов гиппокампа. У разных групп мышей сравнивали экспрессию c-Fos в двух субрегиональных частях полей CA1, CA3 и зубчатой фасции (ЗФ) как после обследования незнакомых арен разных размеров, так и после повторного тестирования в той же арене, или в другой, размер которой отличался. В последнем случае оценивали эффект изменения размера арены на активность нейронов септального и темпорального субрегионов.
МЕТОДИКА
В первом эксперименте мышей C57BL/6 (взрослые самцы), которые были случайным образом разделены на 4 группы, тестировали в течение 20 мин в одной из круглых арен открытого поля разного диаметра (35, 75, 150 или 220 см; n = 7, n = 9, n = 9 и n = 9 соответственно). Пол арен был одинаковым, они различались только диаметром и высотой стенок, подробности см. [Лебедев и др., 2012]. Арену помещали под черный купол, чтобы уменьшить влияние дистальных ориентиров, которые животные могут видеть по-разному из больших и маленьких арен. Пол арены освещался лампой (40 Вт), закрепленной на высоте 2 м, уровень освещенности составлял 5 лк. Траекторию движения мыши регистрировали с помощью системы видеотрекинга, дополнительно информация о поведении животного вводилась с клавиатуры (EthoVision, Noldus). Для детального анализа поведения использовали дополнительные боковые видеокамеры. Отмечали и вычисляли суммарные значения вертикальной активности (исследовательские стойки) мышей, а также продолжительность и частоту груминга. Мышь выпускали из центра арены из небольшой непрозрачной коробки, закрепленной на длинной ручке. Между испытаниями пол арены протирали водой и 50% раствором этанола. После эксперимента мышь возвращали в домашнюю клетку и через 60 мин декапитировали. Мозг замораживали в парах жидкого азота. Контрольные интактные мыши (n = 10) были взяты из домашней клетки.
Иммуногистохимический анализ проводили в соответствии с протоколом, примененным ранее [Купцов и др., 2005; Купцов и др., 2012]. Анализ экспрессии проводили на фронтальных срезах (20 мкм) замороженного мозга. Экспрессию гена c-Fos определяли иммуногистохимически, авидин-биотин-пероксидазным методом. После окрашивания и обработки срезов мозга изображения были оцифрованы. Для анализа были выбраны два уровня гиппокампа: септальный (в диапазоне от –1.58 до –1.7 мм от брегмы) и темпоральный (от –3.16 до –3.4 мм). Площадь полей CA1, CA3 и ЗФ, количество c-Fos-экспрессирующих клеток и индекс плотности (отношение числа c-Fos-позитивных нейронов к площади структуры) были рассчитаны с использованием программного пакета Image Pro v. 3. Границы полей (срезы, окрашенные по Нисслю) определяли по атласу [Paxinos, Franklin, 2004].
Во втором эксперименте с двумя новыми группами мышей (n = 10 в каждой группе) использовали арены диаметром 75 и 220 см. Тест проводили дважды с интервалом 24 ч. Во второй раз мышей выпускали либо в ту же арену, либо в незнакомую, которая была больше или меньше, чем исходная. Остальные детали процедуры не отличались от эксперимента 1.
Различия групп оценивали стандартными методами двухфакторного дисперсионного анализа и с помощью критерия Стьюдента (Statistica 8.0). Для оценки корреляций был применен ранговый критерий Спирмена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Эксперимент 1
Передвижение и обследование мышами незнакомых арен привело к значительному увеличению, по сравнению с контрольной группой, экспрессии c-Fos во всех полях гиппокампа и ЗФ на обоих уровнях септотемпоральной оси (рис. 1). Однако размер арены значительно повлиял только на активацию темпорального субрегиона гиппокампа мышей.
Рис. 1.
Плотность экспрессии с-Fos (средн.±ош. ср.) в отделах гиппокампа мышей разных групп в Эксперименте 1. 0 – контроль, домашняя клетка. 1–4 – группы мышей после тестирования в аренах разного размера: 1 – диаметр арены 35 см, 2 – 75 см, 3 – 150 см, 4 – 220 см. Различия групп достоверны при * р < 0.05 и ** р < 0.01.
Fig. 1. The density of c-Fos-expressing cells (mean ± S.E.M.) in the hippocampal subregions of mice of different groups. Experiment 1. 0 – control, home cage. 1–4 – groups of mice after testing in arenas of different sizes: 1 – arena diameter 35 cm, 2 – 75 cm, 3 – 150 cm, 4 – 220 cm. The differences between the groups were significant: * p < 0.05 and ** p < 0.01.
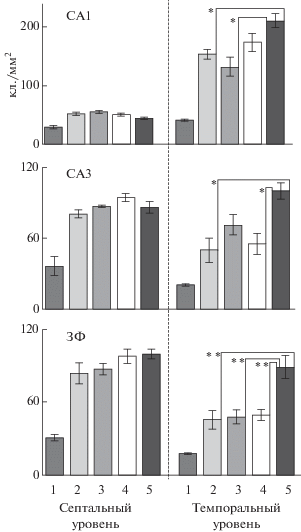
Двухфакторный дисперсионный анализ (факторы “размер арены” и “уровень среза гиппокампа”) выявил значительный эффект размера арены в CA1 (F (3,70) = 7.5, p < 0.01), CA3 (F (3,70) = 6.6, р < 0.01) и в ЗФ (F (3,70) = = 17.3, р < 0.001). Влияние фактора “уровень среза” также было обнаружено во всех трех полях (CA1: F (1,70) = 188.0, p < 0.001; CA3: F (1,70) = 16.4, p < 0.01; ЗФ: F (1,70) = 11.6), р < < 0.01). Наибольшая активация CA1 отмечена в темпоральном субрегионе, а CA3 и ЗФ – в септальной части. Значимое взаимодействие факторов (размер х уровень) было выявлено для СА1 (F (3,1,10) = 9.5, р < 0.01) и СА3 (F (3,1,10) = 7.4, р < 0.05). В темпоральных субрегионах CA1, CA3 и ЗФ самая высокая интенсивность экспрессии обнаружена у мышей, которые исследовали большую арену (рис. 1). Длина пути и число вертикальных стоек у них превышали показатели других групп. Это увеличение, как и в случае наших предыдущих экспериментов [Лебедев и др., 2012], было непропорционально “росту” диаметра и площади арены. Выявлена значительная корреляция между плотностью c-Fos в темпоральной части ЗФ и скоростью передвижения мышей, однако она была положительной для группы, исследовавшей самую большую арену (диаметр 220 см, r = 0.7, p < < 0.05), и отрицательной в группах арен среднего размера (150 см: r = –0.93, р < 0.05 и 75 см: r = –0.85, р < 0.05). Те же тенденции отмечены и для длины пути. Число стоек и плотность c-Fos-позитивных клеток в септальном СА3 были положительно скоррелированы только у группы мышей из наибольшей арены (0.93, р < 0.05). Корреляций между значениями экспрессии c-Fos и показателями груминга или дефекации не обнаружено.
Эксперимент 2
Повторное исследование мышами арены вызвало активацию гиппокампа, в значительной степени похожую на ту, что наблюдали в 1-м эксперименте (рис. 2). Влияние размера арены обнаружено во всех трех полях (CA1: F (1,28) = 44; CA3: F (1,28) = 26.6; ЗФ: F (1,28) = 56.4, p < 0.001 для всех). Влияние фактора “уровень” было значительным для CA1 (F (1,28) = 721.6, р < 0.001) и ЗФ (F (1,28) = = 26.8, р < 0.001). Взаимодействие факторов уровня гиппокампа и размера арены было значимым для всех полей (CA1: F (1,1,28) = = 25.8, p < 0.001; CA3: F (1,1,28) = 50.6, p < < 0.001; ЗФ: F (1) 1,28) = 11.0, р < 0.01). Влияние размера арены было выявлено только для темпоральной области гиппокампа, а именно – исследование большей арены сопровождалось более интенсивной экспрессией c-Fos.
Рис. 2.
Плотность экспрессии с-Fos в отделах гиппокампа мышей разных групп после повторного тестирования в арене того же или другого размера (Эксперимент 2). 1 – контрольная группа, 2 – повторный тест в арене диаметром 75 см, 3 – тест в арене 75 см после арены 220 см, 4 – повторное тестирование в арене 220 см, 5 – тест в арене 220 см после арены 75 см. # – различия групп с повторным тестированием в той же арене и со сменой арены, р < 0.05.
Fig. 2. The density of c-Fos-expressing cells (mean.±S.E.M) in the hippocampal subregions of mice of different groups after repeated testing in the arena of the same or different size. Experiment 2. 1 – control group, 2 – retesting in the arena of 75 cm diameter, 3 – testing in arena 75 cm after the arena 220 cm, 4 – retesting in the arena 220 cm, 5 – testing in arena 220 cm after the arena 75 cm. # – differences between groups with retesting in the same arena and with arena change, p < 0.05.
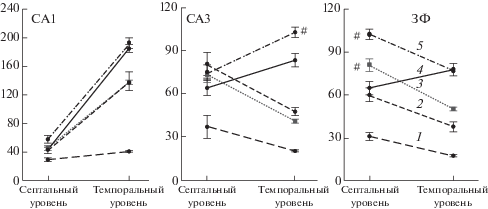
Повторное обследование мышами арены вызвало изменение экспрессии в CA1 в соответствии с размером исследуемой во втором тесте арены, независимо от того, была ли она такая же, что и раньше, или отличалась по размеру. Эффект предыдущего опыта был обнаружен в темпоральной части CA3. Экспрессия была ниже (р < 0.05) в группе, которую повторно тестировали в большой арене, чем в той, для которой большая арена была новой. Кроме того, значительный эффект изменения арены был обнаружен для ЗФ (F (1,28) = 31.9, р < 0.001). Повышенная плотность c-Fos-позитивных клеток была отмечена в септальном субрегионе ЗФ у групп мышей, которым изменяли размер арены, причем как в случае обследования больших арен после малых, так и малых после больших. Показано значительное взаимодействие факторов “уровень” и “изменение арены” (F (1, 1, 28) = 13.8, р < 0.001). Повторное тестирование в той же арене сопровождалось более низкой экспрессией в септальной части ЗФ (p < 0.05) по сравнению с интенсивностью экспрессии c-Fos в гиппокампе групп мышей, которым заменяли арену.
Влияние предыдущего опыта на поведение мышей во втором тесте обнаружено только по числу стоек. Их было меньше на большой арене, если она заменяла малую арену, по сравнению с повторным тестированием на той же большой арене (р < 0.05). При использовании одной и той же малой арены наблюдали меньшее число стоек по сравнению с группой, где первый тест проводили на большой арене.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Таким образом, показано, что исследование даже самой маленькой арены вызывает значительное увеличение, по сравнению с контрольными мышами из домашней клетки, экспрессии с-Fos как в септальных, так и в темпоральных субрегионах гиппокампа. Причем не было обнаружено влияния размера арены в диапазоне диаметров от 35 до 150 см на активацию нейронов в разных субрегионах. В этих случаях активность нейронов в темпоральных частях CA3 и ЗФ была меньше, чем в их септальных отделах, что совпадает с данными других авторов ([Chawla et al., 2018], но не для CA1). Однако обследование мышами самой большой (220 см) арены значительно увеличило активацию нейронов во всех темпоральных частях полей, особенно в поле CA3 и ЗФ. Эффект проявился и после второго обследования мышью той же арены. Необходимо отметить, что ее площадь более чем в два раза превышала площадь другой арены диаметром 150 см (3.8 м2 и 1.77 м2), где такой высокой экспрессии с-Fos не наблюдали. Возможно, существует критический размерный порог, после которого изменяются механизмы картирования и управления движением животных. Можно предположить, что расширение открытого пространства, увеличение размера потенциально опасной зоны требует более высокой скорости движения, большего контроля мозга за передвижением животных, модуляции сегментов пути по скорости, длине, ускорению в соответствии с особенностями среды. Положительная корреляция скорости и активации нейронов темпорального субрегиона отмечена в группе мышей, тестированных в самой большой арене. К сожалению, существует недостаточно данных о функциональных различиях активности субрегионов септотемпоральной оси гиппокампа в экспериментах, когда грызуны передвигаются с разными скоростями, и эти исследования были выполнены с использованием небольшого аппарата [Maurer et al., 2005; Hinman et al., 2011].
Причины значительной активации темпоральных субрегионов после исследования мышами самой большой арены остаются неясны. Это может быть связано и со специфическим крупномасштабным картированием [Kjelstrup et al., 2008; Royer et al., 2010], и с усилением контроля поведения через связи темпорального субрегиона гиппокампа с префронтальной корой и подкорковыми структурами, вовлеченными в процессы, связанные с тревожностью и страхом [Bast, 2007; Adhikari et al., 2010].
ЗАКЛЮЧЕНИЕ
В проведенном нами исследовании были обнаружены субрегионы, которые реагируют на изменение размера арены независимо от направления этих изменений, т.е. на новизну ситуации (септальная часть ЗФ и темпоральная часть CA3). Эти данные совпадают с наблюдениями об экспрессии c-Fos в нейронах мозга в связи с новизной [Анохин, Судаков, 1993] и о повышенной чувствительности нейронов ЗФ на новизну [Bernstein et al., 2019]. Кроме того, они подтверждают важную роль поля СА3 как компаратора [Виноградова, 1975; Vinogradova, 2001] в процессах сравнения размеров доступного пространства и детекции новизны пространственных характеристик. В целом эта специфика реагирования ЗФ и поля СА3 согласуется с представлениями об их роли в поддержке механизмов разделения паттернов (“pattern separation”) [Knierim, Neunuebel, 2016; Kesner, 2018; GoodSmith et al., 2019].
Полученные результаты дают новую информацию о функциональной специфичности малоизученной темпоральной части гиппокампа. Важность исследований в этом субрегионе подтверждается клиническими данными, показывающими его высокую уязвимость при таких заболеваниях человека, как височная эпилепсия, шизофрения и другие заболевания [Strange et al., 2014].
Авторы благодарны И.В. Лебедеву за помощь в проведении экспериментов.
Работа поддержана грантами РНФ 20-15-00283 и РФФИ 20-04-00287а.
Список литературы
Анохин К.В., Судаков К.В. Системная организация поведения: новизна как ведущий фактор экспрессии ранних генов в мозге при обучении. Усп. физиол. наук. 1993. 24: 53–70.
Виноградова О.С. Гиппокамп и память. М.: Наука, 1975. 333 с.
Купцов П.А., Плескачева М.Г., Воронков Д.Н., Липп Х.П., Анохин К.В. Особенности экспрессии гена с-Fos по ростро-каудальной оси гиппокампа обыкновенных полевок после быстрого обучения решению пространственной задачи. Журн. высш. нерв. деят. им. И.П. Павлова. 2005. 55 (2): 231–240.
Купцов П.А., Плескачева М.Г., Анохин К. В. Неравномерная ростро-каудальная активация гиппокампа после исследований мышами нового пространства Журн. высш. нерв. деят. им. И.П. Павлова. 2012. 62 (1): 43–55.
Лебедев И.В., Плескачева М.Г., Анохин К.В. Анализ поведения мышей линии C57BL/6 в аренах “открытого поля” разного размера. Журн. высш. нерв. деят. им. И.П. Павлова. 2012. 62 (4): 485–496.
Adhikari A., Topiwala M.A., Gordon J.A. Synchronized activity between the ventral hippocampus and the medial prefrontal cortex during anxiety. Neuron. 2010. 65: 257–269.
Bannerman D.M., Rawlins J.N., McHugh S.B., Deacon R.M., Yee B.K., Bast T., Zhang W.N., Pothuizen H.H., Feldon J. Regional dissociations within the hippocampus – memory and anxiety. Neurosci. Biobehav. Rev. 2004. 28 (3): 273–283.
Bast T. Toward an integrative perspective on hippocampal function: from the rapid encoding of experience to adaptive behavior. Rev. Neurosci. 2007. 18: 253–281.
Bernstein H.L., Lu Y.L., Botterill J.J., Scharfman H.E. Novelty and novel objects increase c-Fos immunoreactivity in mossy cells in the mouse dentate gyrus. Neural Plast. 2019. 2019:1815371. https://doi.org/10.1155/2019/1815371
Chawla M.K., Sutherland V.L., Olson K., McNaughton B.L., Barnes C.A. Behavior-driven arc expression is reduced in all ventral hippocampal subfields compared to CA1, CA3, and dentate gyrus in rat dorsal hippocampus. Hippocampus. 2018. 28 (2): 178–185.
Fanselow M.S., Dong H.W. Are the dorsal and ventral hippocampus functionally distinct structures? Neuron. 2010. 65 (1): 7–19.
Fenton A.A, Kao H.Y., Neymotin S.A., Olypher A., Vayntrub Y., Lytton W.W., Ludvig N. Unmasking the CA1 ensemble place code by exposures to small and large environments: more place cells and multiple, irregularly arranged, and expanded place fields in the larger space. J. Neurosci. 2008. 28 (44): 11250–11262.
GoodSmith D., Lee H., Neunuebel J.P., Song H., Knierim J.J. Dentate gyrus mossy cells share a role in pattern separation with dentate granule cells and proximal CA3 pyramidal cells. J. Neurosci. 2019. Oct 21. pii: 0940-19. [Epub ahead of print].https://doi.org/10.1523/JNEUROSCI.0940-19.2019
Hinman J.R., Penley S.C., Long L.L., Escabí M.A., Chrobak J.J. Septotemporal variation in dynamics of theta: speed and habituation. J. Neurophysiol. 2011. 105 (6): 2675–2686.
Jung M.W., Wiener S.I., McNaughton B.L. Comparison of spatial firing characteristics of units in dorsal and ventral hippocampus of the rat. J. Neurosci. 1994. 14: 7347–7356.
Kesner R.P. An analysis of dentate gyrus function (an update). Behav Brain Res. 2018. 354: 84–91.
Kjelstrup K.B., Solstad T., Brun V.H., Hafting T., Leutgeb S., Witter M.P., Moser E.I., Moser M.B. Finite scale of spatial representation in the hippocampus. Science. 2008. 321 (5885): 140–143.
Knierim J.J., Neunuebel J.P. Tracking the flow of hippocampal computation: Pattern separation, pattern completion, and attractor dynamics. Neurobiol. Learn. Mem. 2016. 129: 38–49.
Maurer A.P., Vanrhoads S.R., Sutherland G.R., Lipa P., McNaughton B.L. Self-motion and the origin of differential spatial scaling along the septo-temporal axis of the hippocampus. Hippocampus. 2005. 15: 841–852.
Moser M.B., Moser E.I. Functional differentiation in the hippocampus. Hippocampus 1998. 8: 608–619.
Nadel L. Dorsal and ventral hippocampal lesions and behavior. Physiol. Behav. 1968. 3: 891–900.
O’Keefe J., Nadel L. The hippocampus as a cognitive map. Oxford: Oxford University Press. 1978. 570 p.
Paxinos G., Franklin K.B.J. The mouse brain in stereotaxic coordinates. Compact second edition. San Diego. Academic Press. 2004.
Rich P.D., Liaw H.P., Lee A.K. Large environments reveal the statistical structure governing hippocampal representations. Science. 2014. 345 (6198): 814–817.
Royer S., Sirota A., Patel J., Buzsaki G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. J. Neurosci. 2010. 30: 1777–1787.
Strange B.A., Witter M.P., Lein E.S., Moser E.I. Functional organization of the hippocampal longitudinal axis. Nat. Rev. Neurosci. 2014. 15 (10): 655–669.
Vinogradova O.S. Hippocampus as comparator: role of the two input and two output systems of the hippocampus in selection and registration of information. Hippocampus. 2001. 11: 578–598.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


