Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 6, стр. 783-793
Зависимость поведенческих эффектов иммунотоксина 192-IgG-сапорина от способа введения
Ю. В. Добрякова 1, *, М. И. Зайченко 1, А. П. Большаков 1, М. Ю. Степаничев 1, Н. В. Гуляева 1, В. А. Маркевич 1
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: julkadobr@gmail.com
Поступила в редакцию 18.02.2020
После доработки 26.05.2020
Принята к публикации 01.06.2020
Аннотация
Известно, что дегенерация холинергических нейронов является одним из ключевых событий при развитии болезни Альцгеймера. В нашем исследовании для индукции холинергического дефицита в гиппокампе использовали иммунотоксин 192IgG-сапорин (192-SAP), антитела к рецептору p75/NFGR, конъюгированные с сапорином. Полученные результаты позволили провести сравнительный анализ влияния внутрижелудочкового и внутрисептального введений иммунотоксина на обучение животных. Иммуногистохимический анализ срезов при окрашивании области медиального септума на холинацетилтрансферазу (ХАТ) показал, что оба типа инъекции 192-SAP приводили к потере ХАТ-позитивных нейронов в области медиального септума по сравнению с контрольными животными. Поведенческое тестирование осуществлялось через 3 нед после инъекции. Показано, что в водном лабиринте Морриса со скрытой платформой оба способа инъекции иммунотоксина не оказывали значимого влияния на обучение. В то же время независимо от способа введения иммунотоксина в обеих группах была нарушена сенсомоторная координация в тесте “Сужающаяся дорожка”, подопытные животные совершали значимо большее количество ошибок по сравнению с контролем. В тесте “Открытое поле” 192-SAP вызвал снижение количества стоек лишь в случае внутрисептального введения. Внутрижелудочковое введение токсина вызывало нарушение кратковременной памяти в тесте “Y-образный лабиринт”. Кроме того, как внутрижелудочковое, так и септальное введение 192-SAP способствовало увеличению времени нахождения на свету в ходе предварительного ознакомления с камерой в тесте “Пассивное избегание”. Таким образом, анализ полученных результатов свидетельствует о том, что схожее снижение числа холинергических клеток при разных типах введения иммунотоксина приводит к различным нарушениям в поведении животных.
Дегенерация холинергической системы является одной из ключевых стадий при развитии болезни Альцгеймера. Холинергические нейроны расположены в области медиального септума, базального ядра, а также вертикальной и горизонтальной полосок Брока [Mesulum, 1983]. Холинергические нейроны проецируются в гиппокамп, миндалину и обонятельные луковицы. Предыдущие данные [см. обзор Hasselmo, 1995] свидетельствуют о том, что активность холинергических нейронов тесно связана с процессами обучения и памяти. Холинергический дефицит, возникающий в результате разрушения холинергических нейронов базального переднего мозга, приводит к нарушениям обучения и памяти.
Холинергическая дисфункция в базальном переднем мозге может быть вызвана различными агентами, такими как AF64A и иботеновая кислота [Waite et al., 1994; Van Dam, De Deyn, 2011]. Было показано, что эти фармакологические агенты могут привести к потере холинергических нейронов и в ряде случаев к биохимическим изменениям, которые приводят к более глобальным повреждениям [Gulyaeva et al., 2017]. Кроме того, большинство использованных ранее агентов обладало относительно низкой избирательностью воздействия. В отличие от них изобретенный в начале 1990-х годов иммунотоксин 192IgG-сапорин (192-SAP), представляющий собой конъюгат моноклонального антитела к рецептору p75/NGF, который экспрессируется преимущественно на холинергических нейронах, и рибосомального токсина сапорина, демонстрирует более высокий уровень избирательности в отношении холинергических нейронов [Wiley et al., 1991].
На данный момент существует большое количество исследований, которые показывают, что внутрижелудочковые инъекции 192-SAP вызывают нарушение обучения. Lehmann и соавт. [Lehmann et al., 2000, 2002] показали, что введение этого иммунотоксина вызывает моторный дефицит, гиперактивность и нарушает обучение в Т-образном лабиринте. Из других работ видно, что 192-SAP ухудшает обучение в водном лабиринте Морриса и тесте “Пассивное избегание” [Leanza et al., 1995, 1996; Dobryakova et al., 2018]. Во всех этих исследованиях использовали широкий диапазон доз 192-SAP и различные способы введения токсина. Некоторые авторы отмечают, что даже низкие дозы вводимого в желудочки мозга сапорина (<2 мкг) индуцировали снижение активности холинацетилтрансферазы (ХАТ) в гиппокампе и вызывали нарушение поведения в некоторых когнитивных задачах [Lehmann et al., 2002]. Прямые внутрисептальные инъекции иммунотоксина 192-SAP требуют более низких доз [Lee et al., 2013], однако вызывают сходную холинергическую дегенерацию.
В настоящем исследовании мы проанализировали поведение животных и структурно-функциональные изменения в мозге после введения 192-SAP в боковые желудочки и медиальную септальную область мозга.
МЕТОДИКА
Эксперименты проводили на половозрелых самцах крыс Sprague-Dawley (250–350 г, возраст 3–4 мес), полученных из питомника “Пущино” Филиала Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН. Общее число использованных животных – 41 особь (n = 7–14/группу). Животных содержали в стандартных условиях вивария при 21 ± 1°C с 12-часовым циклом свет/темнота, корм и воду давали ad libitum. Световая фаза в виварии 8.30–20.30. Поведение оценивали ежедневно с 9.00 до 13.00. Все эксперименты проводили в соответствии с этическими принципами, изложенными в европейской директиве (2010/63/EU), и были одобрены Этическим комитетом Института высшей нервной деятельности и нейрофизиологии Российской академии наук.
Иммунотоксин 192-SAP (Merck, США) вводили стереотаксически под хлоралгидратной анестезией (400 мг/кг, внутрибрюшинно). Эффективную дозу 192-SAP для каждого способа введения подбирали в предварительном эксперименте. Наибольшая гибель клеток наблюдалась при введении 192-SAP в дозе 8 мкг/животное в случае внутрижелудочкового введения и в дозе 1.5 мкг/животное при введении непосредственно в область медиального септума.
Для анализа влияния 192-SAP на поведенческие характеристики при двух разных типах введения были протестированы четыре группы животных. Двум группам животных иммунотоксин или эквивалентный объем растворителя вводили билатерально в боковые желудочки мозга (доза 8 мкг/животное). Животным двух других групп препарат или растворитель инъецировали непосредственно в область медиального септума (доза 1.5 мкг/животное). Введение в желудочки мозга проводили по следующим координатам: AP – 0.8 мм, L – 1.5 мм [Paxinos, Watson, 1998]. Введение препарата в медиальную септальную область проводили под углом по следующим координатам: AP + 0.4 мм, L – 1.5 мм, 14–15° [Paxinos, Watson, 1998]. Препарат вводили с помощью микроинфузионного насоса (Stoelting Co., США) со скоростью 0.2 мкл/мин. Животных начинали тестировать через 21 день после операции.
Исследование поведения
Начиная с 21-го дня после инъекции токсина были проведены следующие тесты: “Водный лабиринт Морриса” (21–31-й день), “Открытое поле” (32-й день), “Сужающаяся дорожка” (33–37-й дни), “Y-образный лабиринт” (38-й день) и “Пассивное избегание” (39–40-й дни).
Тест “Водный лабиринт Морриса”
Оценку пространственной памяти проводили в тесте “Водный лабиринт Морриса”. Лабиринт представляет собой круглый пластиковый бассейн черного цвета диаметром 1.5 м и высотой 60 см (Noldus, Ltd., Нидерланды), наполненный водой до уровня 30 см. Вода в бассейне была не забелена. На стенах комнаты, где расположен бассейн, прикреплены знаки (квадрат, крест, треугольник), которые служат в качестве внешних ориентиров для животных и фиксации положения в бассейне скрытой под водой платформы. Бассейн условно, с помощью двух проходящих через центр прямых, разделяли на 4 квадранта. Точки пересечения прямых со стенками бассейна служат в качестве мест погружения животных в воду (условно – север, юг, запад, восток). В середину одного из квадрантов помещали платформу из прозрачного плексигласа (10 × 10 см), верхний край которой располагался на 1.5–2.0 см ниже уровня воды. Во время тестирования комната была тускло освещена, температуру воды поддерживали на уровне 22–24°С. После каждой пробы крыс вынимали из бассейна и протирали сухим полотенцем.
Обучение проводили в течение 10 дней в соответствии с ранее опубликованным протоколом [Grigoryan et al., 1996; Зайченко и др., 2020]. Первые 9 дней животным предоставляли по 2 попытки с интервалом в 30 мин. Продолжительность попытки 60 с. Если крыса не находила платформу в течение этого времени, ее сажали на платформу и оставляли на ней в течение 10–15 с. Если животное обнаруживало платформу ранее, чем через 60 с, то попытку завершали, но оставляли животное на платформе на 5 с. В течение 60 с регистрировали следующие показатели: латентный период нахождения платформы, суммарное расстояние, скорость передвижения по бассейну. На 10-й день платформу убирали и в течение 60 с регистрировали время нахождения и дистанцию, проплываемую крысой в каждом квадранте. Регистрацию и анализ данных осуществляли с помощью программы Noldus EthoVision 3.1.
Тест “Открытое поле”
Двигательную и исследовательскую активность животных изучали в тесте “Открытое поле”. “Открытое поле” представляло собой круглую арену диаметром 1 м, расчерченную на 3 концентрические зоны и окруженную стенкой высотой 50 см. Первая зона радиусом 15 см располагалась в центре арены (центральная зона). Вторая зона (радиусом 17.5 см) находилась в средней части арены, 3-я зона (периферическая) также представляла собой кольцо с радиусом 17.5 см. При тестировании в течение 5 мин регистрировали следующие показатели: пройденное расстояние, скорость передвижения, вертикальную активность (число стоек), число и общее время реакций груминга и длительность и число замираний. Регистрацию и анализ данных осуществляли с помощью программы Noldus EthoVision 3.1.
Тест “Сужающаяся дорожка”
Сенсомоторную координацию оценивали в тесте “Сужающаяся дорожка”, как описано ранее [Lehmann et al., 2000, 2002]. Экспериментальная установка представляла собой пластиковую дорожку длиной 200 см, приподнятую над полом на высоту 80 см, разделенную на четыре сегмента по 50 см и соединенную с пластиковой камерой. Ширина дорожки варьировала от 6 см в начале до 1.5 см в конце около камеры. В течение первых четырех дней животных обучали доходить по дорожке до целевой камеры. На пятый день проводили тестирование. В первый день крысу 5 раз помещали на дорожку на расстоянии 50 см от камеры. На следующий день крысу последовательно помещали на расстоянии 50, 100, 150, 200 см от камеры, причем проводилось только одно испытание для каждой дистанции. На третий день проводили две попытки, с дистанциями 100 и 200 см. В течение четвертого дня были сделаны три последовательных испытания на расстоянии 200 см. На пятый день крыс тестировали так же, как и на четвертый день, при этом оценивали координацию животных. Для оценки применяли балльную систему подсчета. Итоговая оценка включала в себя сумму трех испытаний, причем баллы присваивали отдельно за каждый из четырех 50-сантиметровых сегментов дорожки (максимальная оценка 12 баллов за 3 испытания). 0 баллов присваивали, если животное соскальзывало лапой с поверхности дорожки, оценку 1 балл давали, если крыса прошла сегмент без ошибок.
Тест спонтанного чередования рукавов в Y-образном лабиринте
Кратковременную память оценивали, исследуя поведение чередования в Y-образном лабиринте [Kraeuter et al., 2019]. Экспериментальная камера состояла из трех рукавов (42.5 см × 14.5 см × 22.5 см), расходящихся из центра под углом 120°. Подопытное животное помещали в центр, место пересечения рукавов. Оценивали поведение спонтанного чередования, основанное на способности животных запоминать рукав, который оно только что исследовало, и не входить в те рукава, которые оно посещало до этого. Длительность тестирования составляла 8 мин. В течение всего теста крысы свободно перемещались по лабиринту. Регистрировали последовательность входов в каждый рукав. Чередование определяли как последовательные входы в рукава лабиринта без возврата в ранее посещенный рукав или рукав, из которого животное вышло в данный момент времени. Таким образом, процент чередований оценивали как ((число чередований/число входов в рукава – 2) × 100).
Выработка и тестирование условной реакции пассивного избегания (УРПИ)
Выработку реакции пассивного избегания проводили в камере, разделенной на два отсека (OpenScience, Россия), размером 30 × 30 × × 30 см. Один отсек имел крышку и непрозрачные стенки, а второй отсек был освещен. В ходе предварительной попытки животное помещали в светлый отсек установки на 5 мин для ознакомления, в ходе которого крыса свободно перемещалась по всей камере. В течение этого времени оценивали такие показатели, как латентный период входа животного в темный отсек и общее время, проведенное животным в светлом отсеке камеры. Спустя 1 ч после ознакомительной попытки крысу повторно помещали в светлый отсек установки. После того, как крыса входила в темный отсек, она получала электроболевую стимуляцию (100 В, 100 Гц) в течение 5 с. После окончания стимуляции крысу извлекали из темного отсека и возвращали в домашнюю клетку. Проверку сохранности УРПИ проводили через 24 ч после процедуры обучения.
Оценка экспрессии ХАТ и анализ структурных изменений в гиппокампе
После проведения поведенческих экспериментов (примерно через 1.5 мес после инъекции) крыс повторно анестезировали (хлоралгидрат в дозе 400 мг/кг) и интракардиально перфузировали охлажденным 0.9%-ным NaCl. Мозг извлекали и помещали в 4%-ный раствор параформальдегида (Sigma-Aldrich, USA) на PBS минимум на два дня. Через два дня делали фронтальные срезы септальной области и гиппокампа толщиной 50 мкм с помощью вибротома Leica VT 1200S (Leica Biosystems, ФРГ). Срезы собирали в криопротектор и хранили при –18°С до окрашивания. Для оценки степени гибели холинергических нейронов в септальной области проводили окрашивание срезов на ХАТ. После отмывки в растворе PBS, содержащем 0.3% Triton X-100 (PBS-T; Serva, ФРГ), срезы инкубировали в растворе поликлональных антител кролика к ХАТ (Santa Cruz Biotechnology, США) в разведении 1:500 в течение ночи при 4°C. На следующий день срезы отмывали в PBS-T и инкубировали с антителами козы к IgG кролика, конъюгированными с биотином (Sigma-Aldrich, США) в разведении 1:800 при комнатной температуре в течение 1 ч. Все антитела разводили в блокирующем растворе, состоявшем из 5% неиммунной сыворотки козы в PBS-T. После дополнительной промывки в PBS срезы инкубировали с комплексом авидин-биотин-пероксидаза хрена (ABC Elite kit, Vector Labs, США) в течение 1 ч. В качестве хромогена применяли 3,3’-диаминобензидин (SIGMA-Fast Kit, Sigma-Aldrich, США). Все изображения были получены с помощью микроскопа Leica DM6000B (Leica Biosystems, Германия). Параметры изображения были установлены таким образом, чтобы избежать насыщения сигнала. Подсчет клеток проводили на 6 срезах, содержавших медиальное септальное ядро.
Для анализа структурных изменений в гиппокампе по три среза от каждого животного монтировали на предметные стекла, покрытые желатином, и окрашивали по Нисслю с использованием 0.1%-го крезилвиолета (Merck, США). Срезы обезвоживали и заключали под покровное стекло, используя среду Histofluid (Marienfeld, Германия). Во избежание подсчета избыточного числа клеток, нейроны в отделах гиппокампа считали в одном оптическом срезе с использованием микроскопа Olympus CX-41 (Olympus, Япония), оснащенного окулярной сеткой, при увеличении ×40. Учитывали только клетки с четко видимыми ядрами и ядрышками. Размер оптического поля 500 × 500 мкм.
Статистическая обработка данных
Для оценки статистической значимости эффектов, вызванных введением иммунотоксина, использовали параметрический (t-тест Стьюдента) критерий, а также двухфакторный дисперсионный анализ (ANOVA) с одним межгрупповым (“введение иммунотоксина”) и одним внутригрупповым (повторные измерения в ходе тестирования) факторами.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Животные, получившие инъекции 192-SAP или растворителя в боковые желудочки мозга, демонстрировали сходный характер обучения в водном лабиринте Морриса (рис. 1 (а)). У крыс обеих групп наблюдалось постепенное уменьшение времени поиска скрытой платформы (F(8,96) = 17.25, p < 0.001). Животные, получавшие внутрисептальные инъекции сапорина, по динамике обучения также не отличались от контрольной группы (рис. 1 (б)), и время поиска платформы снижалось сходным образом в обеих группах крыс (F(8,192) = = 31.4, p < 0.001).
Рис. 1.
Изменение латентного периода нахождения платформы в дни тестирования (а), (б) и величина проплываемой дистанции на 10-й день проверки выработанного навыка (в), (г) в водном лабиринте Морриса у крыс, получавших внутрижелудочковые (а), (в) (n = 7) и внутрисептальные (n = 14) (б), (г) инъекции 192-SAP. По оси абсцисс – дни тестирования. Данные представлены в виде среднего ± ошибка среднего. Значимые отличия (p < 0.05 по критерию Стьюдента) от соответствующего контроля отмечены *.
Fig. 1. Changes in the latencies to reach the platform during testing (а), (б) and distance swam on the 10th day of testing (в), (г) in the Morris water maze in rats that received intracerebroventricular (а), (в) (n = 7) and intraseptal (n = 14) (б), (г) 192-SAP injections. X-axis, days of testing. The data represent mean ± SEM. Significant differences (p < 0.05 according to the student’s criteria) from the corresponding control are marked by asterisk.
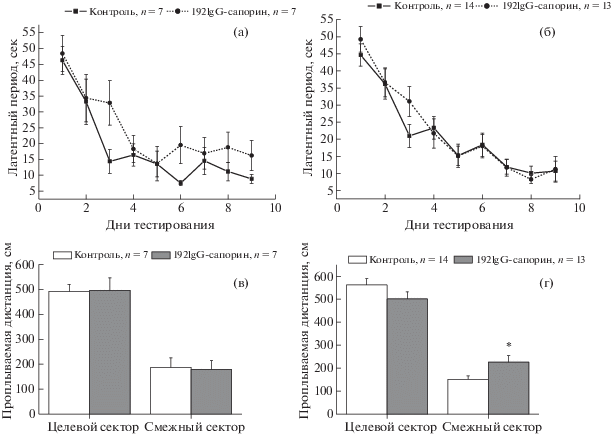
Через сутки после последнего сеанса обучения проводили проверку сохранности пространственной памяти. Показателем этого служила длина дистанции, которую животное проплывало в том секторе лабиринта, где ранее располагалась платформа. Представленные на рис. 1 (в) данные показывают, что и контрольные, и подопытные крысы, получившие внутрижелудочковое введение препаратов, демонстрировали сходные показатели пребывания в целевом секторе. Дистанция, проплываемая в целевом секторе, существенно превышала таковую в смежном секторе, подтверждая способность животных правильно идентифицировать сектор, в котором располагалась платформа. Введение 192-SAP в септум также не оказывало значительного влияния на сохранность пространственной памяти у крыс (рис. 1 (г)), но эти животные проплывали значимо большую часть пути в смежном секторе по сравнению с соответствующим контролем. Это указывает на то, что крысы, получившие внутрисептальную инъекцию 192-SAP, хуже различали и/или помнили о местоположении платформы во время обучения.
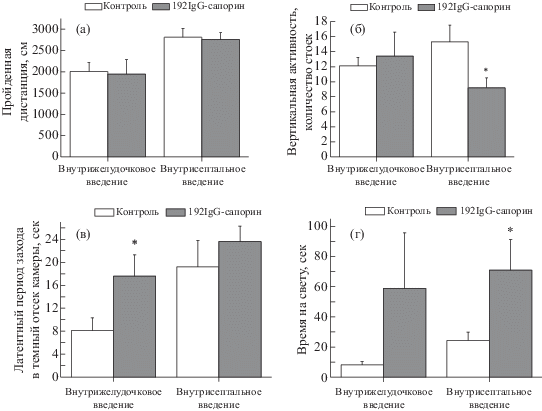
Ни горизонтальная, ни вертикальная двигательная активность крыс, получавших внутрижелудочковые инъекции, не различались значимо в новой обстановке теста “Открытое поле” (рис. 2 (а), (б)). При септальном введении 192-SAP крысы также проходили сходную с контролем дистанцию (рис. 2 (а)), но при этом наблюдалось статистически значимое снижение числа стоек по сравнению с контролем (рис. 2 (б)). Эти данные указывают на снижение исследовательского поведения, измеренного по числу стоек, только у крыс, получавших внутрисептальное введение 192-SAP. Анализ остальных исследованных показателей поведения в тесте “Открытое поле” достоверных различий между группами не выявил (данные не представлены).
Рис. 2.
Горизонтальная (а) и вертикальная (число стоек) (б) активность крыс в тесте “Открытое поле”. Изменение латентных периодов входа в темный отсек камеры (в) и времени пребывания на свету (г) у крыс, получавших внутрижелудочковые (n = 7/группе) и внутрисептальные инъекции 192-SAP (n = 14/группе) до обучения, во время предварительного этапа ознакомления с установкой. Данные представлены в виде среднего ± ошибка среднего. Значимые отличия (p < 0.05 по критерию Стьюдента) от соответствующего контроля отмечены *.
Fig. 2. Horizontal (а) and vertical (number of rears) (б) activity of rats in the “open field” test. Changes in the latencies to enter the dark chamber (в) and the time spent in the light (г) in rats that received intracerebroventricular (n = 7/group) and intraseptal injections of 192-SAP (n = 14/group) before training, during the preliminary stage of habituation with the apparatus. The data represent mean ± SEM. Significant differences (p < 0.05 according to the student’s criteria) from the corresponding control are marked by asterisk.
В отличие от параметров двигательной активности, показатели тонкой координации движения в тесте “Сужающаяся дорожка” существенно изменялись у крыс, получавших инъекции 192-SAP, независимо от места его введения. Так, внутрижелудочковые инъекции 192-SAP приводили к значимому снижению координации, измеренному по балльной шкале (8.6 ± 0.9 балла в опыте (n = 7) против 11.3 ± 0.5 балла в контроле (n = 7); p < 0.05). Аналогичные изменения были обнаружены и при интрасептальном введении 192-SAP. У животных подопытной группы наблюдалось сходное c указанным выше снижение по количеству баллов при сравнении с контрольными животными (8.9 ± 0.1 балла в опыте (n = 14) против 10.6 ± 0.1 балла в контроле (n = 14); p < 0.05).
Поведение спонтанного чередования рукавов в Y-образном лабиринте позволяет, хотя и в достаточно примитивной форме, оценить состояние кратковременной (рабочей) памяти. Введение 192-SAP в боковые желудочки приводило к выраженному нарушению чередования. Установлено, что чередования в контроле наблюдались на уровне 77.5 ± 7.14%, а в подопытной группе 44.2 ± 3.35% (р < 0.05). В то же время при септальном введении значимых изменений такого поведения после введения 192-SAP выявлено не было (53.0 ± 1.1% в опыте и 59.5 ± 1.4% в контроле). Возможно, это было связано с относительно низкими показателями чередования в контрольной группе животных.
Выработку УРПИ проводили в камере, состоявшей из светлого и темного отсеков. В ходе предварительного знакомства с установкой у крыс, которым внутрь желудочков вводили 192-SAP, латентный период был больше по сравнению с контролем (p < 0.05). Латентный период был больше по сравнению с контрольными животными и в случае внутрисептального введения, и эти различия были статистически значимы (p < 0.05; рис. 2 (в), (г)). Если рассматривать предварительное ознакомление с установкой как аналог теста “Темно-светлая камера”, который используется для оценки тревожности, то можно сделать предположение о снижении тревожности у крыс с холинергическим дефицитом, вызванным введением 192-SAP.
При исследовании сохранности УРПИ рост латентного периода входа в темный отсек камеры через 24 ч после предъявления в этом отсеке однократного болевого раздражителя наблюдался у животных всех групп. Нам не удалось выявить значимых межгрупповых различий по изменению времени входа в темный отсек камеры.
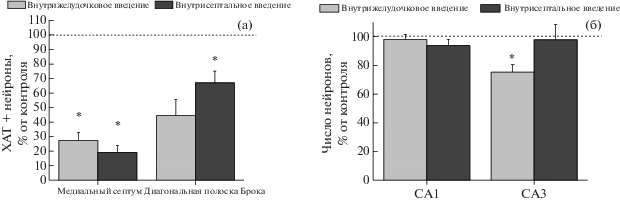
Иммуногистохимический анализ срезов мозга, проведенный после окончания поведенческих экспериментов, показал, что оба типа введения 192-SAP вызывают значимое снижение числа ХАТ-позитивных нейронов в области медиального ядра септума и ядер диагональной полоски Брока. В случае внутрижелудочкового введения число септальных нейронов снижалось на 60–70% и примерно на 50% в диагональной полоске Брока по сравнению с контролем (рис. 3 (а), (б), 4 (а)). При введении непосредственно в область медиального септума нейродегенерация достигает 80–90%, однако гибель ХАТ-позитивных нейронов в диагональной полоске Брока составляет лишь 30–40% от контрольного уровня (рис. 3 (в), (г), 4 (а)). Внутрижелудочковое введение 192-SAP приводит к частичной гибели нейронов области CA3 гиппокампа, в то время как анализ числа гиппокампальных нейронов, проведенный после септального введения, не выявил значимых изменений в количестве и состоянии клеток разных областей гиппокампа при покраске по Нисслю (рис. 4 (б)).
Рис. 3.
На верхних панелях представлены фотографии срезов области медиального септума при внутрижелудочковом введении 192-SAP. (а) число ХАТ-позитивных нейронов у контрольных животных, (б) число ХАТ-позитивных нейронов после введения 192-SAP. На нижних панелях показано уменьшение числа ХАТ-позитивных нейронов в области медиального септума после внутрисептального введения 192-SAP; контроль (в) и 192-SAP (г). Увеличение 200.
Fig. 3. The upper panels show photos of sections of the medial septum area after intracerebroventricular administration of 192-SAP. (а) – the number of ChAT-positive neurons in control animals; (б) – the number of ChAT-positive neurons after administration of 192-SAP. The lower panels show a decrease in the number of ChAT-positive neurons in the medial septum area after intraseptal administration of 192-SAP; control (в) and 192-SAP (г). Magnification 200.
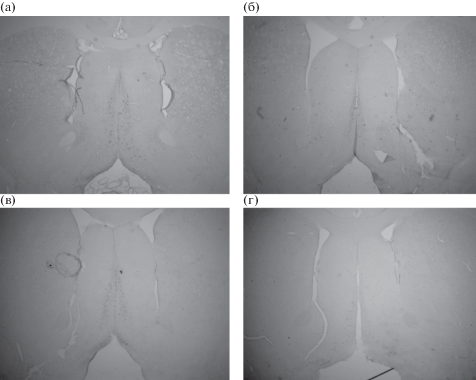
Рис. 4.
Влияние внутрижелудочкового и внутрисептального введения 192-SAP на число ХАТ-позитивных нейронов в области медиального септума и диагональной полоски Брока (а) (% от числа нейронов у контрольных животных). Влияние 192-SAP на морфологию и число клеток в CA1 и CA3 зонах гиппокампа при разных способах введения иммунотоксина (б). Данные представлены в виде среднего ± ошибка среднего. Значимые отличия (p < 0.05 по критерию Стьюдента) от соответствующего контроля отмечены *.
Fig. 4. Effect of intracerebroventricular and intraseptal administration of 192-SAP on the number of ChAT-positive neurons in the medial septum and diagonal band of Broca (а) (% of the number of neurons in control animals). The effect of 192-SAP on the morphology and number of cells in the CA1 and CA3 zones of the hippocampus after administration of immunotoxin via different routes (б). The data represent mean ± SEM. Significant differences (p < 0.05 according to the student’s criteria) from the corresponding control are marked by asterisk.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные эксперименты и детальный анализ поведения при двух способах введения иммунотоксина 192-SAP показали, что при сравнительно схожем уровне гибели ХАТ-позитивных нейронов в медиальной септальной области наблюдается разная картина поведенческих изменений. В случае с билатеральными внутрижелудочковыми инъекциями мы не наблюдаем значимых изменений при обучении в водном лабиринте Морриса со скрытой платформой и каких-либо изменений локомоторной активности, однако видим ярко выраженный дефицит моторики, нарушение поведения чередования и увеличение времени пребывания на свету во время ознакомления подопытного животного с камерой для теста УРПИ. Так же как и крысы, получавшие 192-SAP в боковые желудочки, крысы с внутрисептальной инъекцией обучаются поиску скрытой платформы в водном лабиринте, демонстрируют нарушение тонкой координации движения, предпочитают светлый отсек во время ознакомления с установкой теста УРПИ, вырабатывают и воспроизводят УРПИ. В то же время крысы с этим типом введения 192-SAP хуже различают целевой и смежный сектора при тестировании пространственной памяти в водном лабиринте, демонстрируют снижение исследовательского поведения в тесте “Открытое поле”. Поведение чередования в Y-образном лабиринте у животных, получавших инъекции в медиальную септальную область, не нарушается.
В нашей предыдущей работе введение 192-SAP в боковые желудочки мозга приводило к умеренному нарушению обучения в водном лабиринте Морриса [Dobryakova et al., 2018]. Вероятно, такое расхождение результатов настоящей работы с ранее опубликованными данными связано с уровнем гибели ХАТ-позитивных нейронов в области медиального септума. Ранее было показано, что эффект воздействия иммунотоксина 192-SAP на поведение возрастает с уровнем гибели клеток [Leanza et al., 1995; Wrenn et al., 1999]. Известно, что изменения поведения в большинстве случаев наблюдаются, когда уровень гибели септальных нейронов достигает 90–100%. В нашем случае при обоих типах введения гибель клеток не достигает максимального уровня, необходимого для развития эффекта, и составляет около 70%. Это может быть также обусловлено разной токсичностью препарата 192-SAP, использованного в разных экспериментах. Другое возможное объяснение отсутствия видимых изменений в обучении – это восстановление холинергической иннервации гиппокампа за счет спраутинга волокон вегетативной нервной системы [Scheiderer et al., 2006]. С большой долей вероятности по тем же причинам не наблюдается эффект 192-SAP на выработку и воспроизведение УРПИ.
В настоящей работе получены достаточно противоречивые данные о тревожности крыс, получавших иммунотоксин. С одной стороны, наблюдается слабое влияние на показатели поведения в тесте “Открытое поле” при септальном введении (снижение исследовательской активности при отсутствии эффекта на двигательную активность), что может в определенной степени отражать повышение тревожности при встрече с новым контекстом. С другой стороны, происходит снижение тревожности в тесте “Темно-светлая камера”, и крысы с холинергическим дефицитом предпочитают находиться в светлом отсеке установки. Такое “противоречие” может быть связано с неоднозначностью эффектов ацетилхолина, которые зависят не только от конкретного выброса нейромедиатора, но и от состояния нейронных ансамблей, вовлеченных в реализацию определенных форм поведения. Дефицит ацетилхолина может по-разному сказываться на функционировании сетей, отвечающих за разные, иногда конфликтующие формы поведения. Поэтому необходимо больше исследований для выяснения таких сложных и противоречивых последствий интегративного взаимодействия этих сетей [Picciotto et al., 2012].
Нарушение моторной координации наблюдается при обоих типах введения иммунотоксина и подтверждается стабильно более низким числом баллов по сравнению с контролем в тесте “Сужающаяся дорожка”. Сходные изменения были показаны ранее [Lehmanm et al., 2000, 2002]. Эти изменения, по всей вероятности, могут быть связаны с нарушением функционирования клеток Пуркинье в мозжечке, которые, по данным литературы, также экспрессируют рецептор p75 [Pioro, Cuello, 1988]. Такие эффекты более вероятны при введении 192-SAP в желудочки мозга. Подобные нарушения координации также могут быть обусловлены снижением холинергической иннервации фронто-париетальной коры [Heckers et al., 1994].
Следует отметить, что нарушение поведения чередования в Y-образном лабиринте наблюдалось лишь при внутрижелудочковом введении иммунотоксина. Поведение чередования отражает, хотя и в примитивной форме, состояние кратковременной памяти [Lalonde 2002; Bak et al., 2017; Kraeuter et al., 2019]. Формирование памяти – это комплексный процесс, затрагивающий разные отделы мозга. Память, задействованная при тестировании животного в Y-образном лабиринте, в первую очередь затрагивает гиппокамп [Eichenbaum, 2001]. Таким образом, гибель пирамидных нейронов области CA3 гиппокампа, описанная нами здесь и ранее при внутрижелудочковом введении [Dobryakova et al., 2019], может приводить к более сильным изменениям в тех формах поведения, для которых необходима структурно-функциональная целостность гиппокампа. Следует отметить, что оба типа введения вызывают сравнительно одинаковую гибель ХАТ-позитивных нейронов в медиальном септальном ядре и ядрах диагональной полоски.
ВЫВОДЫ
1. Введение 192-SAP в боковые желудочки или в медиальную септальную область вызывало сходное снижение числа ХАТ-позитивных клеток в медиальном септальном ядре. Повреждение гиппокампа наблюдалось только при внутрижелудочковом введении токсина.
2. Введение 192-SAP в боковые желудочки не вызывало нарушений формирования долговременной памяти, но приводило к ухудшению рабочей памяти и моторной координации.
3. Внутрисептальное введение 192-SAP не вызывало нарушений формирования долговременной памяти, не нарушало рабочую память, но вызывало снижение исследовательской активности и ухудшало моторную координацию.
Работа поддержана грантом РНФ № 16-15-10403П.
Список литературы
Зайченко М.И., Мержанова Г.Х., Григорьян Г.А. Способности к различению видимых сигналов в водном лабиринте Морриса у высоко- и низкоимпульсивных крыс. Журн. высш. нервн. деят. им. И.П. Павлова. 2020. 70 (2): 231–242.
Bak J., Pyeon H.I., Seok J.I., Choi Y.S. Effect of rotation preference on spontaneous alternation behavior on Y maze and introduction of a new analytical method, entropy of spontaneous alternation. Behav. Brain. Res. 2017. 320: 219–224.
Dobryakova Y.V., Kasianov A., Zaichenko M.I., Stepanichev M.Y., Chesnokova E.A., Kolosov P.M., Markevich V.A., Bolshakov A.P. Intracerebroventricular Administration of 192IgG-Saporin Alters Expression of Microglia-Associated Genes in the Dorsal But Not Ventral Hippocampus. Front. Mol. Neurosci. 2018. 10: 429. https://doi.org/10.3389/fnmol.2017.00429
Dobryakova Y.V., Volobueva M.N., Manolova A.O., Medvedeva T.M., Kvichansky A.A., Gulyaeva N.V., Stepanichev M.Y., Markevich V.A., Bolshakov A.P. Cholinergic Deficit Induced by Central Administration of 192IgG-Saporin Is Associated With Activation of Microglia and Cell Loss in the Dorsal Hippocampus of Rats. Front. Neurosci. 2019. 13: 146. https://doi.org/10.3389/fnins.2019.00146
Eichenbaum H. The hippocampus and declarative memory: cognitive mechanisms and neural codes. Behav. Brain. Res. 2001. 127: 199–207.
Grigoryan G., Hodges H., Mitchell S., Sinden J.D., Gray J.A. 6OHDA lesions of the nucleus accumbens accentuate memory deficits in animals with lesions to the forebrain cholinergic projection system: effects of nicotine administration on learning and memory in the water maze. Neurobiol. Learn. Mem. 1996. 65 (2): 135–153.
Gulyaeva N.V., Bobkova N.V., Kolosova N.G., Samokhin A.N., Stepanichev M.Y., Stefanova N.A. Molecular and Cellular Mechanisms of Sporadic Alzheimer’s Disease: Studies on Rodent Models in vivo. Biochemistry. (Mosc). 2017. 82 (10): 1088–1102.
Hasselmo M.E. Neuromodulation and cortical function: modeling the physiological basis of behavior. Behav. Brain. Res. 1995. 67 (1): 1–27.
Heckers S., Ohtake T., Wiley R.G., Lappi D.A., Geula C., Mesulam M.M. Complete and selective cholinergic denervation of rat neocortex and hippocampus but not amygdala by an immunotoxin against the p75 NGF receptor. J. Neurosci. 1994. 14 (3 Pt 1): 1271–1289.
Kraeuter A.K., Guest P.C., Sarnyai Z. The Y-Maze for Assessment of Spatial Working and Reference Memory in Mice. Methods. Mol. Biol. 2019. 1916: 105–111.
Lalonde R. The neurobiological basis of spontaneous alternation. Neurosci Biobehav Rev. 2002. 26 (1): 91–104.
Leanza G., Muir J., Nilsson O.G., Wiley R.G., Dunnett S.B., Bjorklund A. Selective immunolesioning of the basal forebrain cholinergic system disrupts short-term memory in rats. Eur. J. Neurosci. 1996. 8 (7): 1535–1544.
Leanza G., Nilsson O.G., Wiley R.G., Björklund A. Selective lesioning of the basal forebrain cholinergic system by intraventricular 192 IgG-saporin: behavioural,biochemical and stereological studies in the rat. Eur. J. Neurosci. 1995. 7 (2): 329–343.
Lee Y.S., Danandeh A., Baratta J., Lin C.Y., Yu J., Robertson R.T. Neurotrophic factors rescue basal forebrain cholinergic neurons and improve performance on a spatial learning test. Exp. Neurol. 2013. 249: 178–186.
Lehmann O., Jeltsch H., Lazarus C., Tritschler L., Bertrand F., Cassel J.C. Combined 192 IgG-saporin and 5,7-dihydroxytryptamine lesions in the male rat brain: A neurochemical and behavioral study. Pharmacol. Biochem. Behav. 2002. 72: 899–912.
Lehmann O., Jeltsch H., Lehnardt O., Pain L., Lazarus C., Cassel J.C. Combined lesions of cholinergic and serotonergic neurons in the rat brain using 192 IgG-saporin and 5,7-dihydroxytryptamine: Neurochemical and behavioural characterization. Eur. J. Neurosci. 2000. 12: 67–79.
Mesulam M.M., Mufson E.J., Wainer B.H., Levey A.I. Central cholinergic pathways in the rat: an overview based on an alternative nomenclature (Ch1-Ch6). Neuroscience. 1983. 10: 1185–1201.
Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinate. 1998. Academic Press, New York.
Picciotto M.R., Higley M.J., Mineur Y.S. Acetylcholine as a neuromodulator: cholinergic signaling shapes nervous system function and behavior. Neuron. 2012. 76 (1): 116–129.
Pioro E.P., Cuello A.C. Purkinje cells of adult rat cerebellum express nerve growth factor receptor immunoreactivity: light microscopic observations. Brain. Res. 1988. 455 (1):182–186.
Scheiderer C.L., McCutchen E., Thacker E.E., Kolasa K., Ward M.K., Parsons D. Sympathetic sprouting drives hippocampal cholinergic reinnervation that prevents loss of a muscarinic receptor-dependent long-term depression at CA3-CA1 synapses. J. Neurosci. 2006. 26: 3745–3756.
Van Dam D., De Deyn P.P. Animal models in the drug discovery pipeline for Alzheimer’s disease. Br. J. Pharmacol. 2011. 164 (4): 1285–1300.
Waite J.J., Chen A.D., Wardlow M.L., Thal L.J. Behavioral and biochemical consequences of combined lesions of the medial septum/diagonal band and nucleus basalis in the rat when ibotenic acid, quisqualic acid, and AMPA are used. Exp. Neurol. 1994. 130 (2): 214–229.
Wiley R.G., Oeltmann T.N., Lappi D.A. Immunolesioning: selective destruction of neurons using immunotoxin to rat NGF receptor. Brain. Res. 1991. 562 (1): 149–153.
Wrenn C.C., Lappi D.A., Wiley R.G. Threshold relationship between lesion extent of the cholinergic basal forebrain in the rat and working memory impairment in the radial maze. Brain. Res. 1999. 847 (2): 284–298.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


