Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 6, стр. 794-806
Нарушения формирования памяти и развитие временного холинергического дефицита у мышей после удаления обонятельных луковиц
О. А. Недогреева 1, *, Н. А. Лазарева 1, М. Ю. Степаничев 1, Н. В. Гуляева 1
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: nedogreewaolga@gmail.com
Поступила в редакцию 23.04.2020
После доработки 23.05.2020
Принята к публикации 01.06.2020
Аннотация
Удаление обонятельных луковиц у грызунов широко используется как модель симптомов клинической депрессии и нейродегенерации, в том числе холинергической. В работе проводили удаление обонятельных луковиц самцам мышей линии С57BL/6. Через 2 или 4 нед после операции исследовали формирование долговременной неассоциативной памяти (габитуации) и пространственной памяти. Эффект влияния бульбэктомии на состояние нейронов медиальной септальной области изучали с помощью иммуногистохимической окраски на холинацетилтрансферазу и NeuN по окончании исследования поведения, т.е. через 4 и 7 нед после операции. Бульбэктомия приводила к нарушению габитуации по показателям двигательной активности в тесте “открытое поле” и нарушению пространственного обучения, но не памяти в водном лабиринте на обоих исследованных сроках. Снижение доли холинергических клеток в медиальной септальной области наблюдалось через 4, но не через 7 нед после операции. При этом не наблюдалось значимого изменения общего числа нейронов в этом отделе мозга. Таким образом, возникновение когнитивных нарушений после удаления обонятельных луковиц может быть связано с проявлениями временного холинергического дефицита на ранних этапах развития патологии.
ВВЕДЕНИЕ
Холинергические структуры медиального септального комплекса – медиальное септальное ядро (MS) и ядра диагональной полоски Брока (DBB) – имеют обширные проекции в кору больших полушарий и гиппокамп, где ацетилхолин (АХ) регулирует возбудимость нейронов, влияет на синаптическую трансмиссию, индуцирует синаптическую пластичность, координирует активность нейронов в сетях. Таким образом, АХ участвует в процессах фильтрации сенсомоторной информации и формирования памяти [Deiana et al., 2011; Jin et al., 2019; Papouin et al., 2017]. Клетки медиального септума являются ритмоводителями гиппокампального тета-ритма, связанного с исследовательской активностью [Müller, Remy, 2018; Solari, Hangya, 2018]. Поскольку нейроны медиальной перегородки и ядер полоски Брока формируют основной холинергический вход в гиппокамп, дегенерация нейронов в этих отделах мозга приводит к нарушению функции всех зависимых от АХ нейронных сетей гиппокампа. Повреждение базальных ядер, сопровождающееся снижением холинергической трансмиссии, рассматривается как причина возникновения когнитивных нарушений при некоторых нейродегенеративных патологиях, включая болезнь Альцгеймера [Hampel et al., 2019], болезнь Паркинсона, ассоциированную с деменцией, и деменцию с тельцами Леви [Liu et al., 2018]. Также эта связь наблюдается при моделировании нейродегенеративных процессов на грызунах и приматах [Irle, Markowitsch, 1987; Leanza et al., 1996; Stepanichev et al., 2014]. В ряде работ было показано, что нарушение некоторых форм обучения и памяти может совпадать только с возникновением холинергического дефицита [Stepanichev et al., 2014] и отсутствовать на фоне выраженного снижения числа холинергических клеток в медиальной септальной области [Dobryakova et al., 2019]. Это указывает на необходимость дальнейших исследований вклада холинергической системы базальных ядер в процессы обучения и памяти в норме и при развитии патологических процессов в мозге.
Удаление обонятельных луковиц у грызунов (ольфакторная бульбэктомия, ОБ) является широко известной моделью некоторых симптомов клинической депрессии и нейродегенеративных заболеваний. ОБ вызывает у крыс и мышей множественные эмоциональные и когнитивные нарушения, сопровождающиеся структурно-функциональными изменениями в мозге. Животные после ОБ демонстрируют признаки депрессивноподобного состояния: снижение массы тела, ангедонию. У них наблюдаются повышение двигательной активности в тесте “Открытое поле”, увеличение времени иммобильности в тесте вынужденного плавания, а также снижение длительности актов груминга. Показано ухудшение обучения животных после ОБ по сравнению с контрольными в тестах на пространственное обучение, таких как Т-образный лабиринт и водный лабиринт Морриса, а также в задании на поиск пищи в условиях holeboard test [Hellweg et al., 2007]. Исследования говорят о драматических изменениях работы медиаторных систем головного мозга, спровоцированных ОБ: снижении метаболизма серотонина в гипоталамусе, гиппокампе и фронтальной коре и повышении содержания дофамина в гипоталамусе мышей [Flores et al., 2014]. Неонатальная двусторонняя ОБ в препубертатный период развития у крыс приводит к усилению экспрессии NMDA-рецепторов и повышению их сродства к лигандам в ряде областей мозга, в том числе в гиппокампе [Yoshimura et al., 1974]. При ОБ страдает холинергическая система головного мозга, что приводит к снижению содержания АХ в коре и миндалевидном комплексе крыс [Hozumi et al., 2003], а также содержания фермента синтеза АХ холинацетил-трансферазы (ХАТ) в коре, миндалевидном комплексе и гиппокампе мышей через 14 дней после ОБ [Capurso et al., 1997; Koliatsos et al., 2004]. В пириформной и энторинальной областях коры, связанных проекциями с обонятельными луковицами, наблюдается ретроградная дегенерация нейронов [Bobkova et al., 2001; Hu et al., 2012; Kang et al., 2010]. В некоторых работах показано снижение плотности ХАТ-иммунореактивных клеток в медиальной септальной области у мышей через 2 и 4 нед после ОБ, что также трактуется авторами как признак гибели этих нейронов, и в совокупности с вышеперечисленными эффектами позволяет некоторым исследователям считать ОБ моделью нейродегенерации [Gulyaeva et al., 2018]. В то же время было показано, что развитие холинергического дефицита является характерной чертой ОБ-ассоциированной патологии у мышей, но не у крыс [Hendriksen et al., 2015; Stepanichev et al., 2016].
В настоящей работе мы исследовали развитие нарушений неассоциативного и ассоциативного пространственного обучения и состояние холинергических клеток медиальной септальной области у мышей линии C57BL/6 после ОБ.
МЕТОДИКА
Самцы мышей линии C57BL/6 в возрасте 3 мес массой 25–30 г были получены из Филиала “Столбовая” Федерального государственного бюджетного учреждения науки “Научного центра биомедицинских технологий Федерального медико-биологического агентства” (Московская обл., РФ). Мышей содержали в конвенциональном виварии по 5 особей в клетке в условиях 12-часового светового дня при свободном доступе к воде и корму. Эксперименты с животными выполнены в соответствии с требованиями Директивы 2010/63/EU Европейского Парламента, Совета от 22 сентября 2010 г. и Приказа № 267 МЗ РФ от 19 июня 2003 г. в области защиты и использования животных в экспериментальных исследованиях. Протокол эксперимента утвержден Этической комиссией ИВНД и НФ РАН. Животных случайным образом делили на две группы: ложнооперированные (ЛО, n = 19) и бульбэктомированные (ОБ, n = = 22). Удаление обонятельных луковиц осуществляли согласно общепринятому протоколу [Bobkova et al., 2014; Stepanichev et al., 2016]. Для этого мышей анестезировали введением хлоралгидрата (400 мг/кг), после чего помещали в стереотаксический аппарат (“Kopf Instruments”, США) и под местным обезболиванием (2%-й лидокаин подкожно) подготавливали операционное поле. Дополнительное обезболивание было обусловлено чрезвычайной болезненностью манипуляций с надкостницей и костями крыши черепа. В черепе сверлили отверстие диаметром 2 мм, на 5 мм ростральнее брегмы. Обонятельные луковицы удаляли путем аспирации. Образовавшуюся полость заполняли гемостатической губкой, а отверстие закрывали акриловым цементом (Акродент, Украина). Ложнооперированные мыши, перенесшие все манипуляции, кроме удаления обонятельных луковиц, служили контрольной группой. Масса тела контрольных и бульбэктомированных животных в период восстановления значимо не различалась. Исследование поведения и морфологии проводили в двух сериях экспериментов. Для серии 1 (ЛО = 10, ОБ = = 14) восстановительный период составлял 14 сут; для серии 2 (ЛО = 9, ОБ = 8) – 30 сут.
Исследование поведения в тесте “Открытое поле” (ОП) проводили согласно ранее описанному протоколу [Platel et al., 1984; Platel, Porsolt, 1982] в малом экспериментальном комплексе (НПК “Открытая Наука”, Россия), представляющем собой бокс из панелей серого цвета (внутренние размеры: длина – 1.19 м, ширина – 1.23 м, высота – 1.9 м) с ровной матовой поверхностью, оснащенный потолочной плоской регулируемой светодиодной панелью и цифровой видеокамерой DMK 23GV024 GigE (“The Imaging Source Europe GmbH”, ФРГ). Установку помещали внутрь бокса таким образом, что животные и наблюдатель были разделены стенками во время теста. Поведение животных записывали с помощью персонального компьютера для последующего анализа, используя программу IC-Capture Ver. 2.2.248.1000 (“The Imaging Source Europe GmbH”, ФРГ). Установка представляла собой круглую арену белого цвета диаметром 63 см со стенками высотой 32 см (НПК “Открытая Наука”, Россия). В полу имелось 13 отверстий диаметром 1 см, расположенных в центре и по двум окружностям, на периферии и в промежуточной зоне. Животных тестировали в течение четырех последовательных дней (14–18 или 33–36 сут после ОБ соответственно) для оценки угашения двигательной активности. Каждое животное помещали на освещенную арену (350 люкс) и в течение 5 мин регистрировали поведение при помощи видеокамеры. В ходе обработки для каждого дня тестирования регистрировали длину пройденной дистанции и число стоек с опорой как показатель двигательной активности, а также число стоек без опоры на стенку установки и число заглядываний в отверстия в полу установки как показатели исследовательской активности [Ennaceur, 2014].
Способность к пространственному обучению тестировали в водном лабиринте Морриса (ВЛМ) [Vorhees, Williams, 2006]. Круглый бассейн диаметром 120 см со стенками высотой 50 см на 20 см заполняли водой температурой 27°С. В качестве дистантных визуальных стимулов использовали контрастные геометрические фигуры на стенах экспериментальной комнаты. Квадранты бассейна условно обозначали через стороны света – NW, SW, NE, SE. В центр юго-восточного сектора помещали платформу, погруженную в воду на 0.5–1.5 см. Воду в бассейне подкрашивали обезжиренным молоком для исключения визуального поиска платформы. Тестирование проводили на 21–26-й или 45–51-й дни после ОБ. В течение пяти дней каждому животному предоставляли ежедневно по четыре попытки продолжительностью 2 мин для поиска платформы. В том случае, если мышь не справлялась с задачей в течение этого времени, ее мягко направляли к платформе. И в случае успешной, и в случае неуспешной попытки мышь оставляли на платформе на 15–20 с. Интервал между попытками составлял 30 мин. Точки запуска животных в бассейн чередовали в псевдослучайном порядке. На 6-й день проводили тестовую попытку длительностью 1 мин, в ходе которой платформу изымали из бассейна, и сигнальную попытку для контроля мотивации, в ходе которой платформа, размещенная в северо-западном квадранте бассейна, была помечена флажком. В ходе обучения фиксировали латентный период (ЛП) нахождения платформы, в течение тестовой попытки – время, проведенное в целевом квадранте, и частоту пересечения его границ. В сигнальной попытке регистрировали факт нахождения видимой платформы. Поведение животных фиксировали при помощи видеокамеры и анализировали с использованием программного пакета Ethovision XT11 (Noldus, Нидерланды).
Подготовка тканей к иммуногистохимическому исследованию
По окончании экспериментов по исследованию поведения, через 30 либо 52 дня после ОБ, животных повторно анестезировали хлоралгидратом, после чего транскардиально перфузировали равными объемами (200 мл на животное) 0.9%-го раствора хлорида натрия и 4%-го раствора формальдегида на 0.1 М фосфатном буфере (рН 7.4). Головной мозг извлекали и дофиксировали в том же фиксаторе в течение 48 ч. Затем при помощи вибрационного микротома VT1200S (Leica Biosystems GmbH, ФРГ) изготавливали серийные фронтальные срезы толщиной 40 мкм. Положение первого среза выбирали случайным образом. Срезы хранили в криопротекторе (0.01 М фосфатный буфер, этиленгликоль, глицерин) при температуре –18°С.
Иммуногистохимическое исследование
Для выявления ХАТ-иммунореактивных клеток срезы после отмывки от криопротектора фосфатным буфером и блокировки 5%-й нормальной козьей сывороткой инкубировали с первичными антителами Rabbit anti-ChAT (Santa Cruz Biotechnology, США) в разведении 1:400 в блокирующем буфере в течение 18–20 ч при 4°С, затем, после промывки – с вторичными антителами Goat anti-Rabbit IgG-DyLight-488 (JIR, США) в разведении 1:500 2 ч при комнатной температуре. Определение нейронов проводили путем окрашивания на ядерный нейрональный белок NeuN. Порядок окрашивания был аналогичным, используемые первичные антитела – Rabbit anti-NeuN (Millipore, США) в разведении 1:500, вторичные антитела – Goat anti-Rabbit IgG-DyLight-546 (JIR, США). Срезы заключали в среду Fluoroshield c DAPI (Sigma Aldrich, ФРГ). После окрашивания срезы фотографировали на увеличении ×200 при помощи флуоресцентного микроскопа Leica DM6000B, оснащенного CCD камерой (Leica Biosystems Gmbh., ФРГ), и персонального компьютера с программным пакетом Leica Application Suit. Подсчет клеток и определение площади окрашивания осуществляли с помощью программного пакета Fiji (NIH, США). Для подсчета от каждого животного брали два последовательных среза, число клеток определяли в одном оптическом срезе, далее измеряли площадь и пересчитывали на 1 мм2.
Статистическую обработку и визуализацию данных проводили при помощи программных пакетов STATISTICA 8.0 (StatSoft, США) и GraphPad Prism (GraphPad Software, США). После оценки распределения в выборках для проверки различий между группами использовали дисперсионный анализ для связанных переменных (RM-ANOVA) с апостериорным множественным сравнением средних по критерию Тьюки. Для анализа выделяли два фактора с соответствующими градациями: “группа” (1 – ОБ, 2 – ЛО), и “день тестирования” (4 градации для ОП и 5 градаций для ВЛМ). Для обработки результатов тестовой попытки ВЛМ использовали t-критерий Стьюдента. Если распределение исследуемого признака отличалось от нормального, например, при сравнении данных иммуногистохимического исследования, применяли непараметрический тест Манна–Уитни. Данные представлены в виде средних значений ± SEM либо в виде медиан, индивидуальных значений и интерквартильных размахов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Влияние ОБ на неассоциативную память
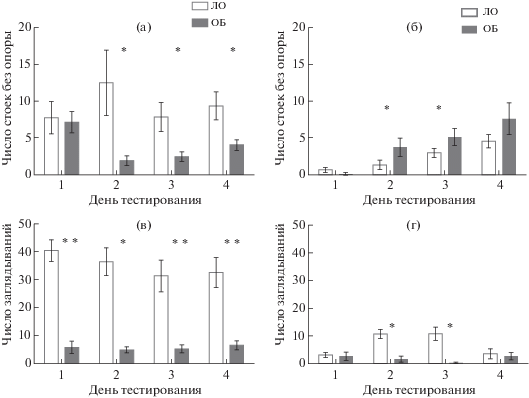
Для изучения состояния неассоциативной памяти использовали четырехкратное исследование поведения в тесте “Открытое поле”. У контрольных мышей (группа ЛО) ежедневное тестирование приводило к снижению и горизонтальной, и вертикальной локомоторной активности (рис. 1), указывая на формирование габитуации к контексту. В тесте “Открытое поле” животные ОБ на обоих сроках после операции демонстрировали признаки гиперлокомоции (рис. 1, 2). Для серии 1 ANOVA выявил эффект фактора “группа” по признакам длины пройденной дистанции (F(1,20) = 16.13; p = 0.0007), числа стоек с опорой (F(1,20) = 43.44; р = 0.000), числа стоек без опоры (F(1,20) = 12.27; р = 0.002) и числа заглядываний в отверстия в полу установки (F(1,20) = 88.57; р = 0.000). Статистически значимого эффекта фактора “день тестирования”, а также взаимодействия факторов выявлено не было. Для серии 2 в отношении длины пройденной дистанции было выявлено статистически значимое влияние фактора “группа” (F(1,15) = 5.16, p < 0.04) и взаимодействие факторов “группа” × “день тестирования” (F(1,45) = 15.27, p < 0.0001). Значимого эффекта фактора “день тестирования” в отдельности выделено не было. По признаку числа стоек с опорой ANOVA выявил в серии 2 эффект фактора “группа” (F(1,15) = 9.05, p < < 0.01), но не фактора “день тестирования”, и значимое взаимодействие факторов “группа” × × “день тестирования” (F(1,45) = 7.58, p < < 0.001). Таким образом, мыши ОБ демонстрировали более высокий уровень локомоторной активности как через 2, так и через 4 нед после воздействия, и повторное тестирование не приводило к ее снижению, что свидетельствует о нарушении габитуации у мышей после ОБ. Животные серии 2 после ОБ реже заглядывали в норки в полу установки: ANOVA выявил эффект фактора “группа” (F(1,15) = 15.09, p < 0.01), фактора “день тестирования” (F(1,15) = 3.01, p < 0.04) и значимое взаимодействие факторов “группа” × × “день тестирования” (F(1,45) = 7.54, p < < 0.001). В отношении стоек без опоры ANOVA не показал ни значимых эффектов отдельных факторов, ни их взаимодействия, однако попарное сравнение контрольной и опытной групп с помощью критерия Стьюдента показало статистически значимое повышение числа стоек без опоры у ОБ животных во 2-й и 3-й дни. Таким образом, для мышей ОБ был характерен более низкий уровень исследовательской активности, проявлявшийся максимально через 2 нед после воздействия. ОБ нарушала формирование неассоциативной памяти у мышей на обоих сроках после операции.
Рис. 1.
Показатели двигательной активности в тесте “Открытое поле”. (а), (в) – серия 1 – 14 сут после ОБ, (б), (г) – серия 2 – 30 сут после ОБ. ЛО – ложная операция; ОБ – обонятельная бульбэктомия. * – р < 0.05, ** – р < 0.01, *** – р < 0.001. Данные представлены в виде средних и стандартных ошибок средних.
Fig. 1. Indices of locomotor activity in the “open field” test. (а), (в), Series 1, 14 days after OB; (б), (г), Series 2, 30 days after OB. ЛО – sham-operated; ОБ – olfactory bulbectomy. Data are presented as mean ± S.E.M. The differences are significant at * – р < 0.05, ** – р < 0.01, *** – р < 0.001.
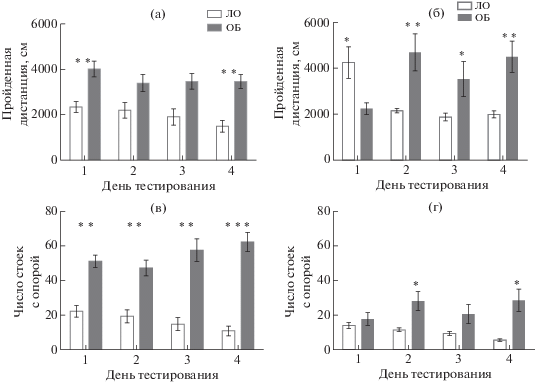
Рис. 2.
Показатели исследовательской активности в тесте “Открытое поле”. (а), (в) – серия 1 – 14 сут после ОБ, (б), (г) – серия 2 – 30 сут после ОБ. ЛО – ложная операция; ОБ – обонятельная бульбэктомия. * – р < 0.05, ** – р < 0.01. Данные представлены в виде средних значений и стандартных ошибок средних.
Fig. 2. Indices of exploratory activity in the “open field” test. (а), (в), Series 1, 14 days after OB; (б), (г), Series 2, 30 days after OB. ЛО – sham-operated; ОБ – olfactory bulbectomy. Data are presented as mean ± S.E.M. The differences are significant at * – р < 0.05, ** – р < 0.01.
Влияние ОБ на пространственную память
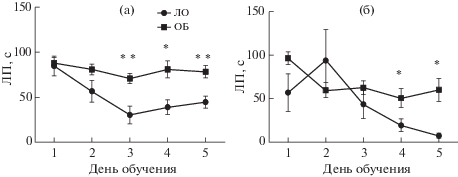
ОБ также негативно влияла на формирование ассоциативной памяти при обучении мышей выполнению пространственной задачи в ВЛМ. Анализ кривых обучения показал, что контрольные животные постепенно снижали время поиска скрытой платформы как в серии 1, так и в серии 2 (рис. 3). Мыши ОБ также сокращали ЛП нахождения платформы, но этот процесс происходил медленнее, чем в контрольной группе. Для группы 1 выявлено взаимодействие факторов “группа” × × “день обучения” (F(1,19) = 2.72; р = 0.04), причем действие каждого фактора по отдельности не было статистически значимым. Апостериорное сравнение средних выявило статистически значимые различия ЛП, начиная с третьего дня обучения (рис. 3 (а)). Для серии 2 ANOVA выявил эффект фактора “группа” (F(1,12) = 8.36, p < 0.02) и фактора “день обучения” (F(4,48) = 8.51, p < 0.0001), при этом взаимодействие факторов не было статистически значимым (F(4,48) = 2.55, p = = 0.051). Данные, приведенные на рис. 3 (б), показывают, что в отличие от мышей, которых начинали тестировать через 2 нед после ОБ, эти животные обучались быстрее. Снижение ЛП в подгруппе ЛО в конце обучения было более выражено, тогда как мыши ОБ также демонстрировали худшие показатели ЛП в четвертый и пятый дни тренировки.
Рис. 3.
Кривые обучения в тесте “Водный лабиринт Морриса”. (а) – серия 1, начало обучения 21 сут после ОБ, (б) – серия 2, начало обучения 45 сут после ОБ. Данные о времени нахождения платформы усреднены для четырех попыток каждого дня обучения и представлены в виде средних по группе и стандартных ошибок средних. * – р < 0.05, ** – р < 0.01.
Fig. 3. Learning curves in the Morris water maze. (а) – series 1, start of training 21 day after OB; (б) – series 2, start of training 45 days after OB. Data from 4 trials of each training day are averaged and presented as group mean ± ± S.E.M. The differences are significant at * – р < 0.05, ** – р < 0.01.
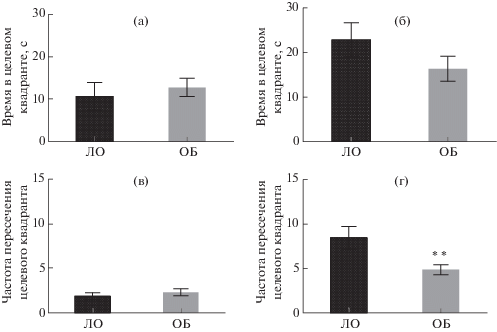
Через 24 ч после последнего сеанса обучения проводили тестовую попытку, в ходе которой платформа была убрана из целевого сектора, а мышь запускали в ВЛМ с незнакомой стартовой позиции (S). Во время тестовой попытки ни в одной из групп не выявлено значимых различий времени нахождения в целевом квадранте бассейна (рис. 4 (а), (б)). Частота пересечений целевого квадранта в подгруппах мышей ЛО и ОБ серии 1 была сходной (рис. 4 (в)), в то время как животные ОБ серии 2 реже заплывали в целевой сектор по сравнению с мышами ЛО (p < 0.01) (рис. 4 (г)). Мыши всех подгрупп демонстрировали сходное время достижения видимой платформы (данные не представлены). В целом можно заключить, что, несмотря на имевшие место различия в характере обучения, наиболее заметные в последних сеансах, ярких нарушений сохранности ассоциативной памяти у животных после ОБ не было выявлено.
Рис. 4.
Показатели тестовой попытки в тесте “Водный лабиринт Морриса”. Время, проведенное в целевом квадранте, и частота посещения целевого квадранта. (а), (в) – серия 1, начало обучения 21 сут после ОБ, (б), (г) – серия 2, начало обучения 45 сут после ОБ. ** – р < 0.01. Данные представлены в виде средних и стандартных ошибок средних.
Fig. 4. Indices of the test trial in the Morris water maze. The test trial was performed 24 h after the least training trial. (а), (в) – series 1, start of training 21 day after OB; (б), (г) – series 2, start of training 45 days after OB. (а), (б) – time spent in the target quadrant; (в), (г) – frequency of entries in the target quadrant. Data are presented as mean ± ± S.E.M. The differences are significant at ** – р < 0.01.
Влияние ОБ на экспрессию ХАТ в медиальной септальной области
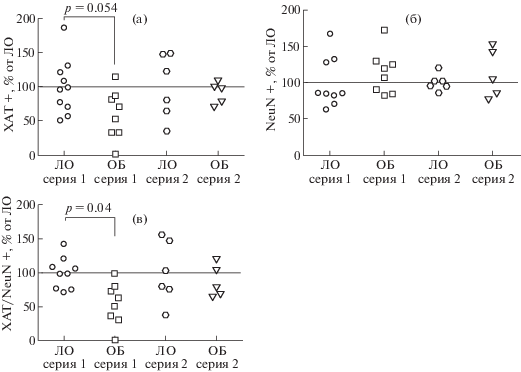
Оценку эффектов ОБ на экспрессию ХАТ проводили с помощью иммуногистохимического окрашивания, после завершения экспериментов по изучению поведения. Для этого исследования объемы выборок составляли для серии 1 (4 нед): ЛО, n = 10, ОБ, n = = 8; для серии 2 (7 нед): ЛО, n = 7, ОБ, n = 5. В серии 1 не было выявлено существенного влияния ОБ на плотность NeuN-позитивных нейронов (рис. 5 (а) и (б), рис. 6 (б)), в то время как наблюдалась выраженная тенденция (p = 0.054) к снижению плотности клеток, экспрессирующих ХАТ (рис. 5 (а) и (б), рис. 6 (а)). При этом доля ХАТ-иммунореактивных клеток была статистически значимо ниже в мозге мышей подгруппы ОБ серии 1 в сравнении с соответствующим контролем (рис. 5 (а) и (б), рис. 6 (в)). В серии 2 ни по одному из исследованных параметров значимых различий не обнаружено (рис. 5 (в) и (г), рис. 6)). Таким образом, ОБ не вызывала выраженной гибели NeuN-позитивных нейронов медиальной септальной области ни на одном исследованном сроке после воздействия. При этом наблюдалось временное снижение экспрессии ХАТ в нейронах этого отдела мозга через 4 нед после операции, которое исчезало через 7 нед.
Рис. 5.
Иммунофлюоресцентная окраска срезов медиального септального ядра антителами к ХАТ и NeuN. (а) и (б) – серия 1 (группы ЛО и ОБ соответственно); (в) и (г) – серия 2 (группы ЛО и ОБ соответственно). Масштабный отрезок соответствует 50 мкм.
Fig. 5. Choline acetyltransferase (ChAT, ХАТ) and NeuN immunofluorescent staining in medial septal nucleus sections. (а) and (б) – series 1 (Sham operated (ЛО) and OB (ОБ) mice, respectively); (в) and (г) – series 2 (Sham operated (ЛО) and OB (ОБ) mice, respectively). Scale bars represent 50 µm.
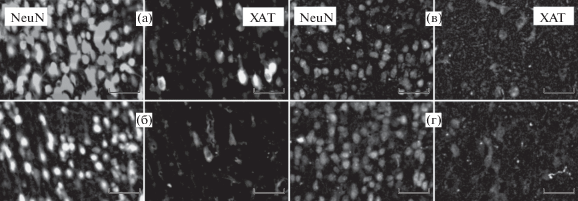
Рис. 6.
Влияние ОБ на общее число нейронов и число ХАТ-позитивных нейронов в медиальном септальном ядре мозга мышей в разные сроки после операции. (а) – ХАТ-иммунопозитивные клетки; (б) – NeuN-иммунопозитивные клетки; (в) – доля ХАТ-позитивных клеток от общего числа нейронов. Данные представлены в виде медиан и интерквартильных размахов, а также индивидуальных значений, выраженных в процентах от среднего значения для соответствующей контрольной группы.
Fig. 6. Density of ChAT+ (a) and NeuN+ (б) cells; ChAT+/NeuN+ (в) ratio. Data are presented as median and individual values which are normalized to the Sham mean value. The differences are significant at р < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе проанализированы эффекты удаления обонятельных луковиц на поведение самцов мышей линии C57BL/6 в тестах, позволяющих оценить состояние неассоциативной и ассоциативной памяти. Динамику развития изменений, вызванных ОБ, изучали на двух независимых выборках животных, для которых восстановительный послеоперационный период составлял 2 и 4 нед. (серии 1 и 2 соответственно). По окончании поведенческих тестов (через 4 и 7 нед соответственно) определяли изменения числа ХАТ-экспрессирующих клеток и общего числа нейронов в медиальном септальном комплексе.
Снижение двигательной активности в тесте “Открытое поле” при повторных испытаниях служит моделью габитуации [Platel, Porsolt, 1982]. Габитуация (привыкание) – это простейшая форма неассоциативного обучения и неассоциативной долговременной памяти, проявляющаяся в виде снижения величины ответа на повторяющийся стимул и не связанная с сенсорной адаптацией или мышечной усталостью [McDiarmid et al., 2017]. Другими словами, габитуация позволяет игнорировать знакомые, предсказуемые или несущественные стимулы, что крайне важно для познавательных функций. В нашей работе после операции животные с ОБ, в отличие от мышей ЛО, демонстрировали повышенную двигательную активность, не сокращая пройденной дистанции с течением времени как через 2, так и через 4 нед после операции, а также совершая больше стоек с опорой. В то же время исследовательская активность изменялась по-разному в разные сроки после ОБ. Так, через 2 нед после ОБ животные совершали значимо меньше стоек без опоры, чем мыши ЛО, во второй и последующие дни тестирования. Это позволяет нам говорить о конкуренции между повышенной двигательной и исследовательской активностью. Однако через 4 нед после ОБ число стоек без опоры, совершенных подопытными животными, оказалось выше по сравнению с контрольными мышами. Другой параметр, выбранный для характеристики исследовательской активности, – число заглядываний в отверстия пола – в серии 1 был стабильно ниже у животных ОБ, чем у мышей ЛО, на протяжении всего тестирования. В серии 2 значимые отличия от контроля были обнаружены только в дни 2 и 3, в те же дни, когда животные ОБ совершали значимо больше стоек без опоры. Это может быть связано с несовместимостью двух этих разновидностей поведенческих актов.
Несмотря на то что клеточные и молекулярные механизмы привыкания до конца не ясны, было показано, что оно зависит от состояния холинергической системы медиальной септальной области. В частности, стимуляция холинергической трансмиссии комбинацией холина и пирацетама приводила к улучшению привыкания [Platel et al., 1984]. Это согласуется с полученными в представленной работе данными о нарушении габитуации и снижении доли ХАТ-иммунореактивных нейронов в медиальной перегородке через 4 нед после ОБ. Исследование состояния холинергических нейронов у животных серии 2 не выявило значимых изменений доли ХАТ-позитивных нейронов в медиальной перегородке. Таким образом, нарушение габитуации может объясняться не только нарушением формирования памяти вследствие холинергической гипофункции, но и напрямую гиперлокомоцией, которая, как известно, является наиболее воспроизводимым последствием ОБ [Kelly et al., 1997; Song, Leonard, 2005], способным оказывать значительное влияние на разнообразные формы поведения [Недогреева и др., 2020].
Нарушения формирования и сохранности пространственной памяти у мышей были продемонстрированы как при использовании стандартной [Bobkova et al., 2001; Bobkova et al., 2014], так и модифицированной процедуры тестирования в ВЛМ [Mucignat-Caretta et al., 2006]. В нашем эксперименте через 3 нед после ОБ мыши медленнее обучались находить скрытую платформу в ВЛМ. Максимально различия проявлялись в завершающей стадии обучения, когда контрольные мыши находили платформу за относительно небольшое время. Еще больше эти различия в приобретении умения искать платформу были заметны в группе 2. Однако в тестовой попытке животные ОБ и ЛО и в серии 1, и в серии 2 значимо не различались по времени, проведенному в целевом квадранте. В серии 2 число посещений целевого квадранта, характеризующее поисковую активность животных, было значимо ниже в группе ОБ по сравнению с контрольными мышами. Это позволяет нам говорить об ухудшении обучения на обоих сроках после ОБ, но о нарушении сформированной памяти мы можем говорить только на более позднем сроке, когда наблюдали ухудшение исследовательской активности животных. Следует заметить, что аналогичные выводы были сделаны и в некоторых работах других авторов [Machado et al., 2012]. Таким образом, возникновение холинергического дефицита, обусловленное снижением доли ХАТ-позитивных нейронов медиальной перегородки, совпадало по срокам с проявлением трудностей в формировании пространственной памяти, хотя не влияло на ее сохранность. Похожие данные были получены при исследовании роли временной холинергической дисфункции в выработке и сохранности условно-рефлекторного замирания после введения β-амилоидного пептида крысам [Stepanichev et al., 2014]. Исчезновение же дефицита ХАТ-иммунореактивных клеток не приводило к существенному улучшению обучения в ВЛМ, а на сохранность пространственной памяти влияло незначительно. Вероятно, нарушения обучения в пространственных задачах связаны не только, а может и не столько с нарушением холинергической трансмиссии, сколько с комплексом структурных и молекулярных изменений, индуцируемых ОБ в отделах мозга.
Важным представляется тот факт, что статистически значимое снижение доли ХАТ-иммунореактивных клеток в общей популяции нейронов (NeuN-позитивных клеток) наблюдали в группе 1, соответствующей 4 нед после ОБ (начало поведенческих тестов – 2 нед после операции). На более позднем сроке доля ХАТ-позитивных клеток не отличалась от таковой у мышей ЛО. Таким образом, наблюдается временная утрата способности нейронов медиальной септальной области экспрессировать белок ХАТ. Ранее эту особенность холинергических нейронов утрачивать специфический фенотип в ходе развития экспериментальных патологий или нейродегенерации при болезни Альцгеймера отмечали и другие авторы [Blusztajn et al., 2000; Lazo et al., 2010; Lopez-Coviella et al., 2011; Meola et al., 2013; Stepanichev et al., 2014; 2017]. Хотя причины этого до настоящего времени не ясны, предполагается, что такое уменьшение экспрессии ХАТ может быть вызвано снижением нейротрофической поддержки холинергических нейронов [Schliebs, Arendt, 2006; Schliebs, Arendt, 2011] и/или усилением окислительного стресса [Cenini et al., 2019; Gulyaeva et al., 2017]. ОБ сопровождается усилением генерации активных форм кислорода, снижением антиоксидантной защиты, накоплением продуктов перекисного окисления липидов, нарушением функции митохондрий [Avetisyan et al., 2016; Tasset et al., 2010]. В нашей предыдущей работе было показано, что максимально выраженное окислительное повреждение нуклеиновых кислот в медиальном септальном ядре и белков в гиппокампе наблюдается в течение 30 дней после ОБ [Недогреева и др., 2018]. Указанные изменения могут приводить к снижению экспрессии белка, которое, по-видимому, является обратимым.
ВЫВОДЫ
1. Удаление обонятельных луковиц у мышей приводит к нарушению неассоциативного обучения и памяти.
2. Удаление обонятельных луковиц у мышей нарушает обучение в водном лабиринте Морриса в течение по крайней мере двух месяцев после операции и вызывает умеренное ухудшение пространственной памяти через 45, но не через 26 дней после операции.
3. Через 30 дней после удаления обонятельных луковиц в медиальном септальном ядре и ядрах диагональной полоски Брока происходит снижение доли холинергических клеток, которое не наблюдается через 52 дня после операции.
Список литературы
Недогреева О.А., Евтушенко Н.А., Манолова А.О., Лазарева Н.А., Гуляева Н.В., Степаничев М.Ю. Окислительная модификация белков и нуклеиновых кислот в мозге мыши после удаления обонятельных луковиц. Асимметрия. 2018. 12: 346–350.
Недогреева О.А., Степаничев М.Ю., Гуляева Н.В. Удаление обонятельных луковиц у мышей приводит к изменениям эмоционального поведения. Журн. высш. нерв. деят. им. И.П. Павлова. 2020. 70 (1): 104–114.
Avetisyan A.V., Samokhin A.N., Alexandrova I.Y., Zinovkin R.A., Simonyan R.A., Bobkova N.V. Mitochondrial dysfunction in neocortex and hippocampus of olfactory bulbectomized mice, a model of Alzheimer’s disease. Biochemistry (Mosc). 2016. 81: 615–623.
Bobkova N.V., Nesterova I.V., Nesterov V.V. The state of cholinergic structures in forebrain of bulbectomized mice. Biull. Exp. Biol. Med. 2001. 131 (5): 427–431.
Bobkova N., Garbuz D.G., Nesterova I.V., Medvinskaya N., Samokhin A., Alexandrova I., Yashin V., Karpov V., Kukharsky M.S., Ninkina N.N., Smirnov A.A., Nudler E., Evgen’ev M. Therapeutic effect of exogenous hsp70 in mouse models of Alzheimer’s disease. J. Alzheimers Dis. 2014. 38 (2): 425–435.
Blusztajn J.K., Berse B. The cholinergic neuronal phenotype in Alzheimer’s disease. Metab. Brain Dis. 2000. 15: 45–64.
Capurso S., Calhoun M., Sukhov R., Mouton P., Pice D., Koliatsos V. Deafferentation causes apoptosis in cortical sensory neurons in the adult rat. J. Neurosci. 1997. 17(19): 7372–7384.
Cenini G., Lloret A., Cascella R. Oxidative Stress in Neurodegenerative Diseases: From a Mitochondrial Point of View. Oxid. Med. Cell Longev. 2019. 2019: 2105607.
Deiana S., Platt B., Riedel G. The cholinergic system and spatial learning. Behav. Brain Res. 2011. 221(2): 389–411.
Dobryakova Y., Volobueva M., Manolova A., Medvedeva T., Kvichansky A., Gulyaeva N., Markevich V., Stepanichev M., Bolshakov A. Cholinergic deficit induced by central administration of 192IgG-Saporin is associated with activation of microglia and cell loss in the dorsal hippocampus of rats. Front. Neurosci. 2019. 13: 146.
Ennaceur A. Tests of unconditioned anxiety – pitfalls and disappoitments. Physiol. Behav. 2014. 135: 55–71.
Flores G., Ibañez-Sandoval O., Silva-Gómez A.B., Camacho-Abrego I., Rodriguez-Moreno A., Morales-Medina J.C. Neonatal olfactory bulbectomy enhances locomotor activity, exploratory behavior and binding of NMDA receptors in pre-pubertal rats. Neuroscience. 2014. 259: 84–93.
Gulyaeva N.V., Bobkova N.V., Kolosova N.G., Samokhin A.N., Stepanichev M.Y., Stefanova N.A. Molecular and Cellular Mechanisms of Sporadic Alzheimer’s Disease: Studies on Rodent Models in vivo. Biochemistry (Mosc). 2017. 82 (10): 1088–1102.
Hampel H., Mesulam M., Cuello A., Khachaturian A., Vergallo A., Farlow M., Snyder P., Giacobini E., Khachaturian Z. Revisiting the cholinergic hypothesis in Alzheimer’s disease: emerging evidence from translational and clinical research. The journal of prevention of Alzheimer’s disease. 2019. 6 (1): 2–15.
Hellweg R., Zueger M., Fink K., Hörtnagl H., Gass P. Olfactory bulbectomy in mice leads to increased BDNF levels and decreased serotonin turnover in depression-related brain areas. Neurobiol. Dis. 2007. 25 (1): 1–7.
Hendriksen H., Korte S.M., Olivier B., Oosting R.S. The olfactory bulbectomy model in mice and rat: one story or two tails? Eur. J. Pharmacol. 2015. 753: 105–113.
Hozumi S., Nakagawasai O., Tan-no K., Niijima F. Characteristics of changes in cholinergic function and impairment of learning and memory-related behavior induced by olfactory bulbectomy. Behav. Brain Res. 2003. 138: 9–15.
Hu J., Wang X., Liu D., Wang Q., Zhu L. Olfactory deficits induce neurofilament hyperphosphorylation. Neurosci. Lett. 2012. 506 (2): 180–183.
Irle E., Markowitsch H.J. Basal forebrain-lesioned monkeys are severely impaired in tasks of association and recognition memory. Ann. Neurol. 1987. 22 (6): 735–743.
Jin J., Cheng J., Lee K., Amreen B., McCabe K., Pitcher C., Liebmann T., Geengard P., Flajolet M. Cholinergic neurons of the medial septum are crucial for sensorimotor gating // J. Neurosci. 2019. 39 (26): 5234–5242.
Kang H.-M., Jin J., Lee S., Ryu J., Park C. A novel method for olfactory bulbectomy using photochemically induced lesion. // Neuroreport. 2010. 21 (3): 179–184.
Koliatsos V., Dawson T., Kesojevic A., Zhou Y., Wang Y., Huang K. Cortical interneurons become activated by deafferentation and instruct the apoptosis of pyramidal neurons. P. Natl. Acad. Sci USA. 2004. 101 (39): 14264–14269.
Lazo O.M., Mauna J.C., Pissani C.A., Inestrosa N.C., Bronfman F.C. Axotomy-induced neurotrophic withdrawal causes the loss of phenotypic differentiation and downregulation of NGF signalling, but not death of septal cholinergic neurons. Mol. Neurodegener. 2010. 5: 5.
Leanza G., Mu J., Nissonl G., Wilef R., Dunnett S., Bjorklund A. Selective lmmunolesioning of the basal forebrain cholinergic system disrupts short-term memory in rats. Eur. J. Neurosci. 1996. 8: 1535–1544.
Liu A., Lim E., Ahmed I., Chang R., Pearce R., Gentleman S. Review: Revisiting the human cholinergic nucleus of the diagonal band of Broca. Neuropath. Appl. Neuro. 2018. 44 (7): 647–662.
Lopez-Coviella I., Mellott T.J., Schnitzler A.C., Blusztajn J.K. BMP9 protects septal neurons from axotomy-evoked loss of cholinergic phenotype. PLoS One. 2011. 6 (6): e21166.
Kelly J.P., Wrynn A.S., Leonard B.E. The olfactory bulbectomized rat as a model of depression: an update. Pharmacol. Ther. 1997. 74 (3): 299–316.
Machado D.G., Cunha M.P., Neis V.B., Balen G.O., Colla A.R., Grando J., Brocardo P.S., Bettio L.E., Dalmarco J.B., Rial D., Prediger R.D., Pizzolatti M.G., Rodrigues A.L. Rosmarinus officinalis L. hydroalcoholic extract, similar to fluoxetine, reverses depressive-like behavior without altering learning deficit in olfactory bulbectomized mice. J. Ethnopharmacol. 2012. 143 (1): 158–169.
McDiarmid T.A., Bernardos A.C., Rankin C.H. Habituation is altered in neuropsychiatric disorders – a comprehensive review with recommendations for experimental design and analysis. Neurosci. Biobehav. Rev. 2017. 80: 286–305.
Meola D.M., Huang Z., King M., Petitto J.M. Loss of cholinergic phenotype in septohippocampal projection neurons: relation to brain versus peripheral IL-2 deficiency. Neurosci. Lett. 2013. 539: 60–64.
Mucignat-Caretta C., Bondí M., Caretta A. Time course of alterations after olfactory bulbectomy in mice. Physiol. Behav. 2006. 89 (5): 637–643.
Müller C., Remy S. Septo-hippocampal interaction. Cell Tissue Res. 2018. 373 (3): 565–575.
Papouin T., Dunphy J., Tolman M., Dineley K., Haydon P. Septal cholinergic neuromodulation tunes the astrocyte-dependent gating of hippocampal NMDA receptors to wakefulness. Neuron. 2017. 94 (4): 840–854.
Platel A., Porsolt R.D. Habituation of exploratory activity in mice: a screening test for memory enhancing drugs. Psychopharmacology. 1982. 78: 346–352.
Platel A., Jalfre M., Pawelec C., Roux S., Porsolt R. Habituation of exploratory activity in mice: effects of combinations of piracetam and choline on memory processes. Pharmacol. Biochem. Behav. 1984. 21: 209–212.
Schliebs R., Arendt T. The significance of the cholinergic system in the brain during aging and in Alzheimer’s disease. J. Neural Transm. 2006. 113 (11): 1625–1644.
Schliebs R., Arendt T. The cholinergic system in aging and neuronal degeneration. Behav. Brain Res. 2011. 221 (2): 555–563.
Solari N., Hangya B. Cholinergic modulation of spatial learning, memory and navigation. Eur. J. Neurosci. 2018. 48 (5): 2199–2230.
Song C., Leonard B.E. The olfactory bulbectomised rat as a model of depression. Neurosci. Biobehav. Rev. 2005. 29 (4–5): 627–647.
Stepanichev M., Lazareva N., Tukhbatova G., Salizhin S., Gulyaeva N. Transient disturbances in contextual fear memory induced by Aβ(25–35) in rats are accompanied by cholinergic dysfunction. Behav. Brain Res. 2014. 259: 152–157.
Stepanichev M., Nedogreeva O., Gulyaeva N. Cholinergic degeneration in early stages of Alzheimer’s disease: Loss of cholinergic phenotype or loss of cells? Alzheimer’s, Dementia & Cognitive Neurology. 2017. 1 (2): 1–7.
Tasset I., Medina F.J., Peña J., Jimena I., Muñoz M.D.E.L.C. Olfactory bulbectomy induced oxidative and cell damage in rat: protective effect of melatonin. Physiol. Res. 2010. 8408: 105–112.
Vorhees C.V., Williams M.T. Morris water maze: procedures for assessing spatial and related forms of learning and memory. Nat. Protocols. 2006. 1 (Mic 7044): 848–858.
Yoshimura H., Gomita Y., Ueki S. Changes in acetylcholine content in rat brain after bilateral olfactory bulbectomy in relation to mouse-killing behavior. Pharmacol. Biochem. Behav. 1974. 2 (5): 703–705.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


