Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 5, стр. 668-681
Долговременные изменения спонтанного поведения и экспрессии c-Fos в мозге мышей в состоянии покоя в модели посттравматического стрессового расстройства
К. А. Торопова 1, 2, 3, 4, *, О. И. Ивашкина 1, 2, 4, А. А. Иванова 1, Е. В. Коновалова 4, О. Н. Долгов 1, К. В. Анохин 2, 3, 4
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт перспективных исследований мозга,
Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
4 Федеральное государственное бюджетное научное учреждение
Научно-исследовательский институт нормальной физиологии им. П.К. Анохина
Москва, Россия
* E-mail: xen.alexander@gmail.com
Поступила в редакцию 02.12.2019
После доработки 16.12.2019
Принята к публикации 16.12.2019
Аннотация
У людей развитие посттравматического стрессового расстройства (ПТСР) включает в себя ряд симптомов, основными из которых являются навязчивые воспоминания о травме, психологическая и физиологическая гиперреактивность при напоминании о травме, а также повышение тревожности и специфические нарушения памяти. Существующие на сегодняшний день модели ПТСР у животных адресуются к трем последним симптомам, но при этом не позволяют изучать возникающие спонтанно навязчивые воспоминания и их нейрональные основы. В данной работе, используя современные методы непрерывного мониторинга поведения, мы обнаружили, что развитие ПТСР у мышей сопровождается специфическим изменением спонтанного поведения в домашних клетках. Данные изменения являются долговременными и включают сниженную исследовательскую активность и повышенную тревожность. Таким образом, мы показали, что у мышей присутствуют поведенческие проявления характерных для человека спонтанно возникающих симптомов ПТСР, связанных у людей с навязчивыми воспоминаниями о травме. Кроме того, с помощью изучения зависимой от нейронной активности экспрессии транскрипционного фактора c-Fos, мы установили, что при ПТСР в мозге мышей, даже когда животные находятся в покое, не получая внешних напоминаний о пережитой травме, наблюдается увеличенная спонтанная активность цингулярной и ретросплениальной коры, миндалины, таламуса и околоводопроводного серого вещества. Таким образом, нами было показано наличие спонтанных проявлений ПТСР в модели у мышей как на поведенческом, так и на нейрональном уровне.
ВВЕДЕНИЕ
Посттравматическое стрессовое расстройство (ПТСР) – это хроническое психиатрическое состояние, которое развивается у некоторых людей после серьезного травматического события. Согласно Международной классификации болезней (ICD-11) и Руководству по диагностике и статистике психических расстройств, пятое издание (DSM-5), ПТСР – это расстройство, которое может развиться после травмирующего события или серии таких событий, как наблюдение смерти или угроза смерти, фактическое увечье или угроза увечья, фактическое насилие или угроза насилия [Молчанова, 2014]. Известно, что 60% мужчин и 50% женщин из развитых благополучных стран хотя бы раз в своей жизни сталкивались с ситуацией, имеющей психотравматический характер и потенциально способной привести к развитию посттравматического расстройства [Kessler et al., 2000]. Таким образом, распространенность данного заболевания, а также существенные экономические затраты из-за высокой стоимости лечения и длительной потери работоспособности у пациентов делают особенно актуальными исследования фундаментальных физиологических, мозговых и клеточных механизмов данной патологии.
ПТСР включает в себя ряд симптомов, как психологических, так и физиологических. К симптомам, указывающим на развитие ПТСР относятся: (1) мысленное возвращение к стрессорной ситуации (навязчивые воспоминания о травме, кошмары, флэшбэки, интрузии); (2) психологическая и физиологическая гиперреактивность в случае предъявления стимулов, напоминающих о травме; (3) нарушения памяти, такие как гипермнезия относительно одних аспектов травмирующего события и амнезия относительно других, а также усиление способности формировать отрицательные воспоминания при общем ухудшении памяти; (4) повышение тревожности, проявляющееся в бессоннице, приступах неконтролируемой агрессии и повышенной бдительности [Кекелидзе, Портнова, 2009; Fenster et al., 2018].
Данные симптомы сопровождаются также нарушениями нормальной активности мозга. Одними из ключевых симптомов являются интрузии и флэшбеки, при которых травматическое событие постоянно переживается, при этом – часто спонтанно, без дополнительно внешнего напоминания [Brewin, 2018]. Было высказано предположение о том, что эти навязчивые воспоминания являются продуктом недостатка эмоциональной модуляции, т.е. неспособности неокортекса подавлять лимбическую систему [Lanius et al., 2010]. В поддержку этой теории говорит то, что у людей с ПТСР повышена активность миндалины и снижена активность медиальной префронтальной коры во время провокации симптомов по сравнению со здоровыми испытуемыми [Osuch et al., 2001; Pissiota et al., 2002]. Кроме того, отчеты о повторных переживаниях у пациентов с ПТСР показали связь со снижением активности в ростральной передней поясной извилине и нижней лобной коры [Hopper et al., 2007; Jeong et al., 2019]. В многочисленных исследованиях также показаны нарушения в задачах на когнитивный контроль у людей с ПТСР, сопровождающиеся изменениями в активности префронтальной коры [Polak et al., 2012; Falconer et al., 2013]. Таким образом, на данный момент показано, что спонтанные и вызванные проявления симптомов ПТСР у пациентов сопровождаются значительными нарушениями активности мозга на уровне различных структур, в том числе, префронтальной и цингулярной коры, а также миндалины. Однако клеточные и сетевые механизмы таких проявлений до сих пор остаются малоизученными.
В связи с этим разными исследователями были предложены многочисленные модели ПТСР на животных [Adamec, Shallow, 1993; Liberzon et al., 2005; Siegmund, Wotjak, 2007a; Cohen et al., 2012; Berardi et al., 2014; Schöner et al., 2017]. Для моделирования ПТСР критическим является сходство свойств стрессорного стимула, который должен приводить к развитию симптомов, описанных выше, а также сходство самого заболевания у животных и у человека [Yehuda, Antelman, 1993; Belzung, Griebel, 2001; Siegmund, Wotjak, 2006]; возможность купирования симптомов у животных препаратами, уже применяемыми для пациентов [Рыбникова и др., 2008, 2012; Schöner et al., 2017]; а также контролируемость модели [Siegmund, Wotjak, 2007a]. Ранее Siegmund и Wotjak была предложена модель ПТСР, основанная на нанесении мышам электрокожного раздражения лап в качестве эпизода травматического опыта и соответствующая поставленным критериям [Siegmund, Wotjak, 2007a]. В дальнейшем эта модель была использована для исследования зависимости выраженности симптомов ПТСР от интенсивности травмирующего воздействия [Торопова, Анохин, 2018]. При этом ни одна из используемых сегодня моделей ПТСР у животных не адресуется к симптомам данного расстройства, возникающим спонтанно. Тем не менее возможность исследования симптомов, проявляющихся спонтанно, а не в результате навязанных экспериментатором внешних воздействий, является критически важным требованием к модели ПТСР на животных, поскольку у людей, страдающих ПТСР, такие симптомы, как интрузии или флэшбеки, являются ключевыми для постановки диагноза (см. выше, например [Кекелидзе, Портнова, 2009; Fenster et al., 2018]) и в значительной степени определяют тяжелое протекание ПТСР и его инвалидизирующий потенциал.
В связи с этим задачей данной работы являются исследования изменения спонтанного поведения животных после травмирующего воздействия, а также сопровождающих его изменений в активности мозга в состоянии покоя, т.е. без внешней провокации симптомов ПТСР.
МЕТОДИКА
Животные
В экспериментах использовали 77 самцов мышей линии C57BL/6 в возрасте 12–16 нед (питомники “Пущино”, “Столбовая”). Эксперименты проводили в соответствии с требованиями приказа № 267 МЗ РФ (19.06.2003 г.), а также с постановлением локального этического комитета по вопросам биомедицинских исследований НИЦ “Курчатовский институт” (Протокол № 1 от 09.07.2015).
Моделирование посттравматического стрессового расстройства
Моделирование ПТСР проводили по протоколу, разработанному нами ранее [Торопова и др., 2018]. Травмирующей ситуацией, приводящей к развитию ПТСР в данной модели, является нанесение мышам электрокожного раздражения лап (ЭКР). Для оценки развития ПТСР применяются следующие критерии: (1) выраженность обусловленного страха, проявляющегося при попадании животных в ту же обстановку, в которой их подвергали ЭКР; (2) выраженность сенситизации, проявляющейся в новой для мышей обстановке, одним из компонентов которой является незнакомый звук; (3) изменение уровня тревожности, выявляемое в классических поведенческих тестах.
Животных подвергали ЭКР, а также проводили тестирование обусловленного страха и сенситизации, при помощи установки Video fear conditioning system (MED Associates Inc.) и компьютерной программы Video Freeze (MED Associates Inc.). При нанесении ЭКР и в ходе тестов проводили видеорегистрацию поведения мышей и автоматически определяли число и продолжительность актов замирания.
При нанесении ЭКР животных помещали в камеру размером 30 × 23 × 21 см с тремя металлическими и одной плексигласовой стенками и электродным полом; над камерой находился источник диффузного белого света (средний уровень освещенности в камере 87 люкс); также в камере находился источник постоянного шума (средний уровень громкости 25 дБ). Для очистки камеру протирали 55% раствором этилового спирта. Далее обстановка, объединяющая все описанные контекстуальные компоненты, будет называться обстановкой А. Животных помещали в обстановку А и давали свободно обследовать ее в течение 170 сек. Затем три раза наносили ЭКР (1.5 мА, 10 сек) через электродный пол, межстимульный интервал составлял 50 сек. После последнего ЭКР животные оставались в камере еще на 60 сек, а затем были возвращены в домашние клетки.
Через 7 дней после индукции ПТСР проводили тестирование мышей на обусловленный страх. Для этого животных помещали в обстановку А на 3 мин.
Через 24 ч после теста на обусловленный страх проводили тестирование поведенческой сенситизации. Мышей помещали в тестовую камеру (обстановка Б), представлявшую собой модифицированную камеру для нанесения ЭКР. Модификация заключалась в том, что электродный пол был закрыт пластиковой вставкой (20.5 × 23 см), а внутри камеры был установлен Л-образный домик из черного плексигласа (высота верхней точки 15.5 см). Камеру протирали 3% раствором уксусной кислоты. Тестирование проводили при инфракрасном освещении. В течение первой минуты мыши могли свободно обследовать обстановку Б, а затем в течение 180 сек через установленный в камере динамик подавали нейтральный (незнакомый для животных и сам по себе не вызывающий реакции замирания) звуковой тон (80 дБ, 9 кГц).
Через 24 ч после тестирования сенситизации мышей тестировали в приподнятом крестообразном лабиринте (ПКЛ). В тесте использовали лабиринт с рукавами размером 62 × 5 см, приподнятый над полом на 70 см. Закрытые рукава лабиринта были окружены прозрачными плексигласовыми стенками высотой 16 см, по краям открытых рукавов был установлен бортик высотой 0.5 см. Центральная платформа ПКЛ имела размер 5 × 5 см. Освещенность закрытых рукавов составляла 60 люкс, открытых – 77 люкс, центральной платформы – 70 люкс. Для очистки лабиринт протирали раствором настойки мяты перечной в 50% этиловом спирте. Мышей высаживали на центральную платформу мордой к одному из открытых рукавов и давали свободно исследовать лабиринт в течение 5 мин. Проводили видеорегистрацию поведения животных при помощи видеокамеры и компьютерной программы EthoVision XT 8.5 (Noldus Information Technology). Анализировали долю времени на открытых рукавах лабиринта как основной показатель тревожности в данном тесте [Lister, 1987; Walf, Frye, 2007].
Оценка спонтанного поведения мышей
Для того чтобы оценить влияние индукции ПТСР на поведение мышей в привычных для них комфортных условиях домашних клеток, животных по одному рассаживали в установки круглосуточного мониторинга поведения PhenoMaster (TSE Systems Inc.). Система PhenoMaster (PM) представляет из себя домашнюю камеру 36 × 46 × 20 см, оснащенную сеткой инфракрасных датчиков с шагом 15 мм для автоматической фиксации положения животного на плоскости и регистрации вертикальной активности (подъемов на полку); а также поилкой, кормушкой и домиком, имеющими функции весов; беговым колесом с возможностью регистрации количества и направления оборотов; приподнятой над полом полкой и блоком для оперантного обучения (рис. 1, (б)). Данная система позволяет в круглосуточном режиме оценивать двигательную активность животных (пройденный путь), вертикальную исследовательскую активность (количество подъемов на полку), время, проведенное в беговом колесе и количество оборотов бегового колеса, а также вес животного и консуматорное поведение. Каждый из параметров поведения измерялся поминутно в течение всего эксперимента.
Рис. 1.
Общая схема эксперимента по оценке спонтанного поведения мышей в установке PhenoMaster (а) и общий вид установки PhenoMaster (б). PM – PhenoMaster; ЭКР – нанесение электрокожного раздражения (индукция ПТСР); обусл. – тест на обусловленный страх; сенсит. – тест на сенситизацию; ПКЛ – тестирование в приподнятом крестообразном лабиринте.
Fig. 1. Experimental design to assess the spontaneous behavior of mice in the PhenoMaster (а) and the general view of the PhenoMaster (б). PM – PhenoMaster; ЭКР – footshock (PTSD induction); обусл. – conditioned fear test; сенсит. – sensitized fear test; ПКЛ – elevated plus maze test.
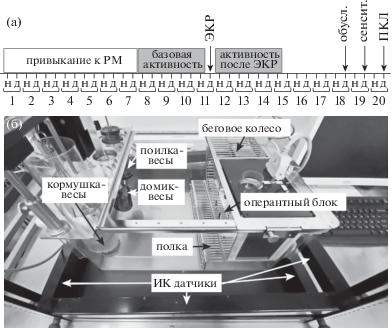
До начала эксперимента мышей содержали в индивидуально вентилируемых клетках по 5 животных со свободным доступом к воде и пище при неинвертированном световом цикле 12/12 ч. Так же содержали контрольных животных групп “домашняя клетка” (ДК) на протяжении всего эксперимента.
Животных рассаживали в установки PhenoMaster и давали 7 дней на привыкание. Затем в течение 3.5 сут (3 дней и 4 ночей) регистрировали базовую поведенческую активность мышей, и на основании двигательной активности в беговом колесе животных делили на две группы: “наивные PM” (n = 8) и “ПТСР PM” (n = 8) так, чтобы средние групповые количества оборотов колеса были равны. На 11-й день эксперимента одной группе мышей проводили индукцию ПТСР так, как описано выше. Для того чтобы сбалансировать между группами эффект стресса, связанного с отловом животного в установке, мышей группы “наивные PM” вынимали из установки PhenoMaster, помещали в транспортировочные боксы и относили в экспериментальную комнату, но не проводили никаких поведенческих процедур и немедленно возвращали обратно в установку. Затем в течение еще 3.5 сут (3 дней и 4 ночей) регистрировали поведенческую активность животных обеих групп. Поведение мышей в установке PhenoMaster анализировали отдельно для светлой фазы цикла (с 8:00 до 20:00) и для темной фазы цикла (с 20:00 до 8:00). Для того чтобы избежать эффектов смены освещенности, за “день” брали промежуток с 8:30 до 19:30, а за “ночь” – с 20:30 до 7:30. Данные о каждой форме поведения животного суммировали за 11 ч соответствующей фазы (день или ночь). День индукции ПТСР полностью исключали из анализа.
Тестирование обусловленного страха, поведенческой сенситизации и тревожности в ПКЛ проводили так, как описано выше, для групп мышей “ПТСР PM” и “наивные PM” на 18-й, 19-й и 20-й день эксперимента соответственно. Так же тестировали контрольных мышей групп “ПТСР ДК” (n = 12) и “наивные ДК” (n = 13). В день индукции ПТСР мышей “наивные ДК” вынимали из домашних клеток, помещали в транспортировочные боксы и относили в экспериментальную комнату, но не проводили никаких поведенческих процедур и немедленно возвращали обратно в клетку. Общая схема эксперимента по оценке спонтанной активности мышей представлена на рис. 1(а).
Оценка с-Fos активности мозга мышей в покое
Для оценки активности мозга в покое мышей в течение 14 дней до индукции ПТСР содержали по 1 особи для минимизации когнитивной нагрузки, связанной с социальными взаимодействиями. Животных содержали в индивидуально вентилируемых клетках со свободным доступом к воде и пище при неинвертированном световом цикле 12/12 ч. Экспериментальные процедуры проводили в светлую фазу цикла.
Использовали две группы мышей: “ПТСР” (n = 13) и “наивные” (n = 11). Группе “ПТСР” индукцию ПТСР проводили так, как описано выше. Мышей группы “наивные” оставляли в домашних клетках без каких-либо поведенческих воздействий.
После индукции ПТСР мышей оставляли в клетках на 7 дней, в течение которых не подвергали никаким воздействиям: не осуществляли уборку домашних клеток, не перемещали клетки и не открывали их. Через 7 дней после индукции ПТСР у животных обеих групп брали образцы мозга в состоянии покоя. В течение 4 ч перед взятием образцов мозга проводили видеорегистрацию поведения животных при помощи системы EthoVision XT 8.5 (Noldus Information Technology), и в дальнейший анализ брали только мышей, которые в течение этого времени пребывали в покое, т.е. не показывали явных признаков глубокого сна, не питались и не проявляли высокой двигательной активности. Так как мыши наиболее активны в темное время суток, а также изменяют свое поведение в связи со сменой освещенности [Jud et al., 2005], для обеспечения состояния спокойного бодрствования все животные были умерщвлены через 5 ч после начала светлой фазы цикла.
Оценку транскрипционной активности структур мозга мышей проводили с помощью анализа экспрессии немедленного раннего гена с-fos, являющегося маркером геномной активации нейронов [Barth et al., 2004].
Внутрибрюшинно вводили летальную дозу 15% раствора хлоралгидрата, а затем проводили интракардиальную перфузию тканей 4% раствором параформальдегида в фосфатном буфере. На микротоме с вибрирующим лезвием (Leica VT1200S) изготавливали плавающие срезы мозга толщиной 50 мкм, на которых далее проводили иммуногистохимическое выявление белка с-Fos. Для этого использовали первичные поликлональные антитела кролика против белка c-Fos (Synaptic Systems, разведение 1:5000) и вторичные антитела осла к белкам кролика (AlexaFluor 488, Invitrogen, разведение 1:500).
Срезы оцифровывали с помощью конфокального микроскопа Fluoview 1000 (Olympus) при десятикратном увеличении. Подсчет с-Fos-положительных (c-Fos+) клеток осуществляли автоматически в программе Image-Pro Plus 3.0 (Media Cybernetics) на основании размера ядер и порогового уровня интенсивности окраски ядер по шкале зеленого цвета. Плотность положительных клеток рассчитывали как отношение числа позитивных клеток к площади (в мм2), занимаемой данной структурой на срезе. Для каждой из выбранных структур в анализ брали по три среза с каждого мозга. Координаты структур определяли с помощью стереотаксического атласа мозга мыши [Franklin, Paxinos, 2007]. Анализировали следующие структуры мозга: прелимбическую кору (PrL) и инфралимбическую кору (IL) на уровне +1.70 мм от брегмы; цингулярную кору (Cg) на уровне +0.98 мм от брегмы; ретросплениальную кору (RS), а также латеральное (LA), базолатеральное (BLA) и центральное (CeA) ядра миндалины и паравентрикулярное ядро таламуса (PV) на уровне –1.46 мм от брегмы; околоводопроводное серое вещество (PAG) на уровне –3.16 мм от брегмы.
Статистическая обработка данных
Статистическую обработку данных проводили с помощью статистического пакета Prism 7 (GraphPad Software Inc.). Использовали однофакторный или двухфакторный дисперсный анализ ANOVA и апостериорный критерий Тьюки для несвязанных выборок и t-тест Сидака для связанных выборок, а также t-критерий Стьюдента для несвязанных выборок. Критический уровень значимости принимали равным р < 0.05. Данные на графиках представлены как среднее и 95% доверительный интервал.
В работе было использовано оборудование ресурсного центра нейрокогнитивных исследований (РЦ НКИ) Курчатовского комплекса НБИКС-технологий.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
ПТСР развивается одинаково у мышей с разным типом содержания
Содержание мышей в установке PhenoMaster существенно отличается от содержания в конвенциональных индивидуально вентилируемых клетках: PhenoMaster богаче с точки зрения доступного животному для обследования пространства и наличия в нем различных объектов, но в то же время беднее с точки зрения социального окружения. Поэтому вначале мы проверили, не оказывает ли влияния содержание в PhenoMaster на индукцию и развитие ПТСР у мышей. Для этого было проведено сравнение поведения мышей с ПТСР и наивных животных, содержащихся в PhenoMaster (группы “РМ”) и в обычных домашних клетках (группы “ДК”).
На рис. 2 представлены данные о поведении мышей при индукции ПТСР (рис. 2 (а)), а также тестировании обусловленного страха (рис. 2 (б)), сенситизации (рис. 2 (в)) и тревожности в ПКЛ (рис. 2 (г)). При индукции ПТСР мыши групп “ПТСР РМ” и “ПТСР ДК” демонстрировали низкий уровень замирания до нанесения ЭКР (в среднем 2.16%), который значимо повышался после каждого нанесения ЭКР (фактор “время”: F (2.017, 36.30) = 368.7, p < 0.0001, попарные сравнения временных интервалов между собой: p < < 0.0001, апостериорный критерий Сидака). При этом данные группы не различались между собой ни в одном из временных интервалов (фактор “группа”: F (1, 18) = 1.846, p = = 0.1911; взаимодействие факторов: F (5, 90) = = 0.9326, p = 0.4638).
Рис. 2.
Моделирование ПТСР у мышей, содержащихся в установке PhenoMaster (“РМ”) и домашних клетках (“ДК”). (а) – Поведение животных групп “ПТСР” при нанесении ЭКР; (б) – поведение животных четырех групп при тестировании обусловленного страха; (в) – результаты тестирования поведенческой сенситизации; (г) – результаты тестирования в ПКЛ. * – p < 0.02, ** – p < 0.0001 при сравнении групп “ПТСР” и “наивные”, апостериорный критерий Тьюки.
Fig. 2. PTSD modeling in mice housed in the PhenoMaster (“РМ”) and conventional home cages (“ДК”). (а) – Behavior of “PTSD” groups during footshock; (б) – behavior of four groups during conditioned fear test; (в) – results of behavioral sensitization test; (г) – results of EPM test. * – p < 0.02, ** – p < 0.0001 comparing “PTSD” and “naïve” mice, Tukey’s multiple comparisons test.
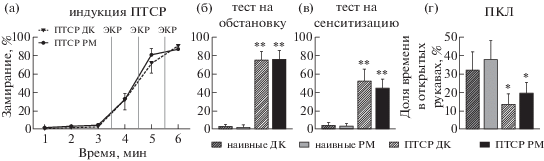
При тестировании обусловленного страха мыши групп “ПТСР РМ” и “ПТСР ДК” демонстрировали значимо более высокий уровень замирания, чем животные групп “наивные РМ” и “наивные ДК” (F (3, 37) = 205.7, p < 0.0001, сравнение “ПТСР РМ” и “наивные РМ”: p < 0.0001, сравнение “ПТСР ДК” и “наивные ДК”: p < 0.0001, апостериорный критерий Тьюки) и не различались между собой (p = 0.9983). Наивные мыши двух групп также между собой не различались (p = 0.9980).
Во время предъявления звука при тестировании сенситизации животные групп “ПТСР РМ” и “ПТСР ДК” также замирали значимо больше, чем наивные мыши обеих групп (F (3, 37) = 47.38, p < 0.0001, сравнение “ПТСР РМ” и “наивные РМ”: p < 0.0001, сравнение “ПТСР ДК” и “наивные ДК”: p < < 0.0001, апостериорный критерий Тьюки) и не различались между собой (p = 0.5377). Также не было найдено отличий между наивными мышами, содержавшимися по-разному (p = 0.9981).
При тестировании в ПКЛ животные, подвергшиеся индукции ПТСР, проявляли повышенный уровень тревожности, что выражалось в значимо меньшем времени на открытых рукавах лабиринта, чем у наивных мышей (F (3, 37) = 8.874, p = 0.0001, сравнение “ПТСР РМ” и “наивные РМ”: p = 0.0184, сравнение “ПТСР ДК” и “наивные ДК”: p = = 0.0024, апостериорный критерий Тьюки). При этом мыши с разным типом содержания между собой не различались (сравнение “ПТСР РМ” и “ПТСР ДК”: p = 0.7078; сравнение “наивные РМ” и “наивные ДК”: p = = 0.6910).
Таким образом, мы показали, что содержание в установке PhenoMaster не влияет на индукцию и развитие ПТСР у мышей, и данная установка может быть использована для анализа изменений спонтанного поведения у животных после травматического опыта.
Развитие ПТСР приводит к долговременным изменениям спонтанного поведения животных
Для анализа влияния ПТСР на спонтанное поведение животных было оценено три параметра поведения мышей в условиях покоя в установке PhenoMaster: количество оборотов колеса как показатель двигательной активности мышей, общий пройденный путь как показатель исследовательской активности и подъемы на полку как показатель тревожности (полка приподнята над полом камеры и является более открытой – в таких условиях грызуны проявляют поведение избегания, отражающее уровень тревожности [Hölter et al., 2015]).
Мы обнаружили, что развитие ПТСР сопровождается значительными изменениями спонтанного поведения мышей. Так, у мышей группы “ПТСР” в течение 12 ч после нанесения ЭКР наблюдалось понижение двигательной активности, выражавшееся в уменьшении количества проделанных оборотов в беговом колесе по сравнению с группой “наивные” (p = 0.0089, двухвыборочный t-критерий) – рис. 3 (а). При этом в дальнейшем двигательная активность мышей с ПТСР возвращалась к норме и более не отличалась от таковой у наивных мышей ни в дневное, ни в ночное время (день: фактор “группа”: F (1, 14) = 0.01391, p = 0.9078, фактор “время”: F (1, 14) = 0.05902, p = 0.8116, взаимодействие факторов: F (1, 14) = 0.4138, p = 0.5304; ночь: фактор “группа”: F (1, 14) = 0.007154, p = = 0.9338, фактор “время”: F (1, 14) = 5.292, p = 0.1246, взаимодействие факторов: F (1, 14) = = 0.1192, p = 0.7350) – рис. 3 (б).
Рис. 3.
Исследование эффектов травматического воздействия, приводящего к развитию ПТСР, на спонтанное поведение животных в условиях покоя. (а), (б) – Двигательная активность (количество проделанных оборотов в беговом колесе). (в), (г) – Исследовательское поведение (пройденная дистанция в домашней клетке). (д), (е) – Тревожность (количество запрыгиваний на полку). На графиках (а), (в) и (д) показана динамика поведения животных до и после нанесения ЭКР; “Н” – ночь, “Д” – день. На графиках (б), (г) и (е) показаны результаты, усредненные по 3 дневным интервалам до нанесения ЭКР и 3 дневным интервалам после нанесения ЭКР (“день”), а также отдельно показаны результаты, усредненные по 4 ночным интервалам до нанесения ЭКР и 4 ночным интервалам после нанесения ЭКР (“ночь”). + – p = 0.0134, при сравнении групп “ПТСР” и “наивные” в первом интервале после нанесения ЭКР, двухвыборочный t-критерий Стьюдента; * – p < 0.05, ** – p < 0.005 при сравнении с группой “наивные”, # – p < 0.02, ## – p < 0.005 при сравнении с интервалом до ЭКР у той же группы, апостериорный критерий Сидака.
Fig. 3. The effects of PTSD-inducing trauma on spontaneous behavior of animals at rest. (а), (б) – Locomotor activity (the number of rotations in the running wheel). (в), (г) – Exploratory behavior (distance traveled in the home cage). (д), (е) – Anxiety (number of jumps on the shelf). The graphs (а), (в) and (д) show the dynamics of animal behavior before and after the application of footshock; “Н” – night, “Д” – day. Graphs (б), (г) and (е) show results averaged over 3 day intervals before footshock and 3 day intervals after footshock (“day”), and separately show results averaged over 4 night intervals before footshock and 4 night intervals after footshock (“night”). + – p = 0.0134, comparing “PTSD” and “naïve” in the first interval after footshock, two-sample t-test; * – p < 0.05, ** – p < 0.005 compared to “naïve” group, # – p < 0.02, ## – p < 0.005 compared with the interval before footshock for the same group, Sidak’s multiple comparisons test.
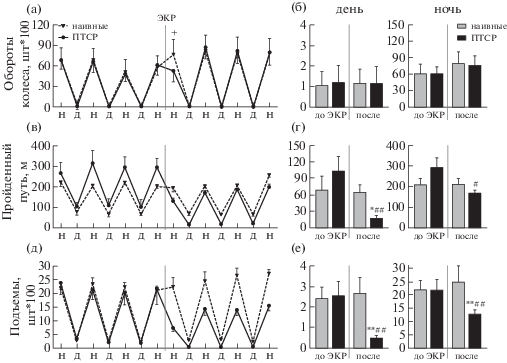
Деление мышей на группы “ПТСР” и “наивные” было произведено на основании их двигательной активности без учета других параметров поведения, поэтому по параметру исследовательской активности мыши этих двух групп оказались несбалансированными еще до нанесения ЭКР: пройденный мышами группы “ПТСР” путь был в среднем на 30% больше, чем у наивных мышей (рис. 3 (в)), однако эти различия не были значимыми (фактор “группа”: F (1, 14) = 0.1807, p = 0.6772; фактор “время”: F (2.337, 32.71) = 33.88, p < < 0.0001; взаимодействие факторов: F (13, 182) = = 3.940, p < 0.0001). После нанесения ЭКР, однако, картина поведения животных менялась на противоположную: исследовательская активность значимо снизилась у мышей группы “ПТСР” в дневное время как по сравнению с собственным значением до ЭКР, так и по сравнению с активностью наивных мышей (день: фактор “группа”: F (1, 14) = 18.67, p = 0.0002; фактор “время”: F (1, 14) = 12.82, p = 0.0030; взаимодействие факторов: F (1, 14) = = 10.29, p = 0.0063; сравнение интервалов до и после ЭКР у группы “ПТСР”: p = 0.0006, сравнение групп “ПТСР” и “наивные” после ЭКР: p = 0.0454, апостериорный критерий Сидака), а в ночное время – только по сравнению с периодом до ЭКР (день: фактор “группа”: F (1, 14) = 0.6840, p = 0.4221; фактор “время”: F (1, 14) = 6.511, p = 0.0420; взаимодействие факторов: F (1, 14) = 4.782, p = 0.0462; сравнение интервалов до и после ЭКР у группы “ПТСР”: p = 0.0173) – рис. 3 (г). Эти изменения имели долговременный характер и сохранялись на протяжении не менее 3 суток после ЭКР, тогда как у наивных мышей никаких изменений исследовательского поведения не происходило (сравнение интервалов до и после ЭКР: день – p = 0.9583, ночь – p = 0.9988).
Самые значительные изменения в поведении животных после индукции ПТСР наблюдались по параметру подъемов на полку, отражающему тревожность мышей (рис. 3(д),(е)). Мыши групп “наивные” и “ПТСР” не различались по данному параметру до нанесения ЭКР, однако после него животные с ПТСР поднимались на полку значимо меньше как днем, так и ночью, по сравнению с наивными животными и с периодом до ЭКР (день: фактор “группа”: F (1, 14) = 5.549, p = 0.0336, фактор “время”: F (1, 14) = 5.235, p = 0.0382, взаимодействие факторов: F (1, 14) = 8.802, p = = 0.0102, сравнение групп “ПТСР” и “наивные” после ЭКР: p = 0.0017, сравнение интервалов до и после ЭКР у группы “ПТСР”: p = = 0.0046, апостериорный критерий Сидака; ночь: фактор “группа”: F (1, 14) = 5.314, p = = 0.0436, фактор “время”: F (1, 14) = 4.037, p = 0.0458, взаимодействие факторов: F (1, 14) = = 7.884, p = 0.0140, сравнение групп “ПТСР” и “наивные” после ЭКР: p = 0.0051, сравнение интервалов до и после ЭКР у группы “ПТСР”: p = 0.0048, апостериорный критерий Сидака). При этом изменение в поведении мышей группы “ПТСР” было более выраженным днем, чем ночью: количество подъемов на полку снизилось в 5.5 раз днем и менее чем в два раза ночью, в более комфортное для грызунов время суток. При этом не наблюдалось тенденции к возврату активности мышей с ПТСР к уровню наивных животных по крайней мере в 3.5 дней после нанесения ЭКР (рис. 3 (д)).
Все эти данные говорят о том, что индукция ПТСР приводит к долговременным изменениям в спонтанном поведении мышей даже в знакомых условиях домашней клетки, и эти изменения заключаются в снижении исследовательской активности и повышении тревожности. При этом происходит также острое снижение двигательной активности мышей в течение первых часов после травматического опыта, которое, однако, затем нивелируется.
Развитие ПТСР сопровождается повышением спонтанной активности различных структур мозга
После того, как мы установили, что спонтанное поведение мышей изменяется после индукции ПТСР, нами был исследован вопрос о влиянии ПТСР на спонтанную активность мозга животных. Для этого мы проанализировали экспрессию с-fos в различных областях ассоциативной коры, миндалине, таламусе и околоводопроводном сером веществе у мышей в спокойном состоянии через 7 дней после индукции ПТСР, а также у наивных животных.
Результаты анализа количества с-Fos-положительных клеток в различных областях мозга показаны на рис. 4. Двухфакторный дисперсионный анализ по данным всех проанализированных нами областей показал, что развитие ПТСР приводило к значимому повышению активности мозга животных по сравнению с наивными мышами (фактор “группа”: F (1, 22) = 19.47, p = 0.0002), и данное повышение транскрипционной активности в покое было специфическим, поскольку затрагивало лишь некоторые области мозга (фактор “структура”: F (8, 176) = 87.86, p < < 0.0001, взаимодействие факторов: F (8, 176) = = 6.631, p < 0.0001). Значимое повышение плотности с-Fos-положительных клеток у группы “ПТСР” по сравнению с группой “наивные” было обнаружено в цингулярной коре (p = 0.0100, здесь и далее – двухвыброчный t-критерий), ретросплениальной коре (p < 0.0001), латеральном ядре миндалины (p = 0.0388), базолатеральном ядре миндалины (p = 0.0162), паравентрикулярном ядре таламуса (p = 0.0104) и околоводопроводном сером веществе (p = 0.0002); но не в прелимбической коре (p = 0.3385), инфралимбической коре (p = 0.8544) и центральном ядре миндалины (p = 0.6108).
Рис. 4.
Влияние развития ПТСР на активность мозга мышей в состоянии покоя. (а) – Ассоциативные области неокортекса; (б) – миндалина; (в) – таламус; (г) – средний мозг. PrL – прелимбическая кора, IL – инфралимбическая кора, Cg – цингулярная кора, RS – ретросплениальная кора, LA – латеральное ядро миндалины, BLA – базолатеральное ядро миндалины, CeA – центральное ядро миндалины, PV – паравентрикулярное ядро таламуса, PAG – околоводопроводное серое вещество. * – p < 0.05, ** – p < 0.005 при сравнении с группой “наивные”, двухвыборочный t-критерий Стьюдента.
Fig. 4. The effect of PTSD on the brain activity of mice at rest. (а) – Associative regions of the neocortex; (б) – amygdala; (в) – thalamus; (г) – midbrain. PrL – prelimbic cortex, IL – infralimbic cortex, Cg – cingulate cortex, RS – retrosplenial cortex, LA – lateral amygdaloid nucleus, BLA – basolateral amygdaloid nucleus, CeA – сentral amygdaloid nucleus, PV – paraventricular thalamic nucleus, PAG – periaqueductal gray. * – p < 0.05, ** – p < 0.005 compared to “naïve” group, two-sample t-test.
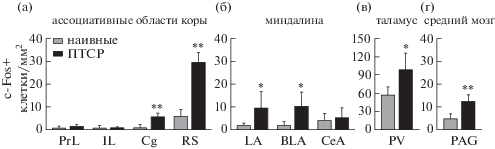
Таким образом, нами было показано, что развитие ПТСР сопровождается повышением спонтанной активности различных областей мозга мышей в то время, когда животное находится в спокойном состоянии в домашней клетке, не получая никаких внешних напоминаний о пережитой травме. При этом в процесс вовлекались только некоторые из исследованных структур, что говорит о его специфичности.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе мы исследовали вопрос о том, сопровождается ли развитие ПТСР в модели у животных изменениями спонтанного поведения и активности мозга в состоянии покоя, т.е. без внешней провокации симптомов ПТСР. При этом для индукции и тестирования проявлений ПТСР у животных нами была использована одна из предложенных ранее моделей, основанная на нанесении ЭКР в качестве травматического воздействия и оценке основных проявлений данного расстройства, таких как обусловленный страх, поведенческая сенситизация и тревожность в ПКЛ [Siegmund, Wotjak, 2007a; Торопова, Анохин, 2018].
Для того чтобы оценить спонтанное поведение животных и выявить его изменения в связи с развитием ПТСР, нами был применен современный метод мониторинга поведения с использованием установки PhenoMaster (TSE Systems Inc.). Данная установка позволяет проводить круглосуточную регистрацию перемещений животного, его двигательной и исследовательской активности, консуматорного поведения, а также проводить оперантное обучение мышей. Ранее установку PhenoMaster использовали для оценки исследовательского поведения у мышей в генетической модели синдрома Ретта, для фенотипирования различных линий грызунов, в том числе крыс с генетической моделью болезни Хантингтона, и оценки эффектов скополамина и фенциклидина на поведение в домашней клетке [Robinson et al., 2013; 2014; Urbach et al., 2014]. В одной работе изучали влияние стресса, вызванного ограничением подвижности, на спонтанное поведение мышей, и показали снижение локомоторной активности животных как в темное, так и в светлое время цикла (причем в темное время снижение активности было больше), которое было долговременным и сохранялось в течение 4 дней после стресса [Spiers et al., 2017]. Эти данные согласуются с тем, что было показано нами для животных после стресса, вызванного индукцией ПТСР. Тем не менее спонтанное поведение в PhenoMaster у мышей в модели посттравматического стрессового расстройства было изучено нами впервые в мире. В связи с этим вначале мы оценили, влияет ли содержание в PhenoMaster, существенно отличающееся от конвенционального, на развитие ПТСР, и показали отсутствие такого влияния во всех основных тестах на ПТСР у мышей.
Далее нами было показано, что развитие ПТСР действительно приводит к долговременным (как минимум в течение 3 сут после нанесения ЭКР) изменениям спонтанного поведения, даже в знакомых условиях домашней клетки, и эти изменения заключаются в снижении исследовательской активности и повышении тревожности. Ранее при исследованиях поведения животных в моделях ПТСР изучали исключительно симптомы данного расстройства, проявляющиеся в ответ на какую-либо внешнюю ситуацию: чаще всего это проявление животными тревожности в тестах ПКЛ, темно-светлая камера или стартл [Adamec, Shallow, 1993; Liberzon et al., 2005; Cohen et al., 2012; Berardi et al., 2014; Schöner et al., 2017], и реже – проявление об-условленного страха при повторном попадании в обстановку травмы и поведенческая сенситизация при предъявлении нового звука [Siegmund, Wotjak, 2007a,b; Dahlhoff et al., 2010]. Спонтанное поведение животных в моделях ПТСР до сих пор никем не изучалось. При этом известно, что у людей с ПТСР проявление только части симптомов опосредовано внешней ситуацией, тогда как ключевой симптом навязчивых воспоминаний проявляется спонтанно, без внешнего напоминания о травме [Кекелидзе, Портнова, 2009; Lanius et al., 2010; Fenster et al., 2018; Brewin, 2018]. Таким образом, мы впервые показали, что используемая нами модель ПТСР воспроизводит и эту особенность ПТСР у людей.
Далее нами была изучена спонтанная активность мозга мышей в покое после развития ПТСР. Известно, что у людей развитие ПТСР сопровождается уменьшением активации медиальной префронтальной и цингулярной областей коры, также изменением их функциональных связей с другими регионами при когнитивной нагрузке [Clausen et al., 2017]. Сходные изменения наблюдаются и в состоянии покоя: крупный мета-анализ на основании 15 исследований с применением фМРТ показал, что у пациентов с ПТСР наблюдаются пониженная активность дорсальной части медиальной префронтальной коры и повышенная активность вентральной части медиальной префронтальной коры, а также аномальная активация областей лимбической системы [Wang et al., 2016]. При этом в состоянии покоя у людей с ПТСР наблюдаются повышенная локальная связанность миндалины и таламуса и пониженная локальная связанность в медиальной и дорсолательной префронтальной коре [Zhong et al., 2015]. Также меняется и глобальная связанность корковых лимбических структур: у пациентов с ПТСР была обнаружена повышенная функциональная связанность в покое между базолатеральной миндалиной и передней и дорсальной цингулярной корой, а также дорсомедиальной префронтальной корой [Brown et al., 2013]. Таким образом, при развитии ПТСР состояние покоя у людей характеризуется повышенной активностью и функциональной связанностью миндалины, цингулярной и префронтальной коры – т.е. областей мозга, связанных с контролем страха и стресса у людей и животных [Shin et al., 2001; Zhang et al., 2011; Rabellino et al., 2016; Gvozdanovic et al., 2017]. Нами также было обнаружено, что у мышей с ПТСР в состоянии покоя наблюдается повышенная экспрессия с-Fos именно в базолатеральной миндалине и цингулярной коре. При этом, однако, нами не было обнаружено такой активации в покое у мышей в прелимбической и инфралимбической областях коры, относящихся к медиальной префронтальной коре и участвующих в формах поведения, связанных со страхом, в том числе в ПТСР [Zhang et al., 2011; Lguensat et al., 2019]. Возможно, это соотносится с данными на человеке, говорящими о том, что в покое активность различных отделов медиальной префронтальной коры при ПТСР может быть как специфически повышенной, так и специфически пониженной [Wang et al., 2016]. Интересно, что у людей именно симптомы интрузии и флэшбэков при ПТСР соотносят с измененной активностью миндалины и передних отделов коры [Lanius et al., 2010]. В доказательство этого говорит то, что у людей с ПТСР повышена активность миндалины и снижена активность медиальной префронтальной коры во время провокации симптомов по сравнению со здоровыми испытуемыми [Osuch et al., 2001; Pissiota et al., 2002]. Кроме того, мы исследовали активность по с-Fos в областях мозга, критически важных для формирования аверсивной памяти, контроля страха и развития ПТСР: ретросплениальной коре, паравентрикулярном ядре таламуса и околоводопроводном сером веществе [Kwapis et al., 2015; Penzo et al., 2015; Harricharan et al., 2016; Della Valle et al., 2019], и для данных областей нами тоже была показана повышенная активация экспрессии с-fos в покое у мышей с ПТСР. В совокупности полученные нами данные дают основание полагать, что животные, получившие травматический опыт и развившие ПТСР в использованной нами модели, переживают состояния, сходные с интрузиями и флэшбэками, наблюдающимися у пациентов с ПТСР.
ВЫВОДЫ
1. Развитие ПТСР у мышей сопровождается специфическим изменением спонтанного поведения в домашних клетках.
2. Данные изменения в спонтанном поведении являются долговременными и включают снижение исследовательской активности и повышение уровня тревожности – типичный комплекс поведенческих проявлений ПТСР в моделях на животных, обычно выявляемый с помощью специальных тестов.
3. Таким образом, мы показали, что при моделировании ПТСР у мышей возникают изменения спонтанного поведения, подобные проявлениям спонтанных симптомов ПТСР у человека.
4. Развитие ПТСР сопровождается выявляемым по экспрессии c-Fos повышением спонтанной активности различных областей мозга мышей в то время, когда животное находится в спокойном состоянии в домашней клетке, не получая никаких внешних напоминаний о пережитой травме.
5. Данная спонтанная активация нейронов является специфической и вовлекает такие области мозга, как цингулярная и ретросплениальная кора, миндалина, паравентрикулярное ядро таламуса и околоводопроводное серое вещество.
6. На основании полученных результатов об изменении спонтанного поведения и спонтанной активности мозга мы считаем, что мыши в использованной нами модели ПТСР переживают состояния, сходные с интрузиями и флэшбэками, наблюдающимися у пациентов с ПТСР.
Исследование выполнено при поддержке Российского научного фонда в рамках научного проекта № 16-15-00300 (эксперименты по анализу спонтанного поведения и спонтанной активности мозга мышей) и Российского фонда фундаментальных исследований в рамках научного проекта № 19-015-00534 (эксперименты по анализу влияния типа содержания животных на развитие ПТСР).
Список литературы
Кекелидзе Ж.И., Портнова A.A. Диагностические критерии посттравматического стрессового расстройства. Журн. неврол. психиатр. 2009. 109: 4–7.
Молчанова Е.С. Посттравматическое стрессовое и острое стрессовое расстройство в формате DSM-V: внесенные изменения и прежние проблемы. Мед. псих. Росс. 2014. 6(1): 2.
Рыбникова E.A., Воробьев М.Г., Самойлов М.О. Гипоксическое посткондиционирование корректирует нарушения поведения крыс в модели посттравматического стрессового расстройства. Журн. высш. нерв. деят. им. И.П. Павлова. 2012. 62 (3): 364.
Рыбникова E.A., Миронова В.И., Тюлькова E.И., Самойлов M.O. Анксиолитический эффект легкой гипобарической гипоксии в модели посттравматического стрессового расстройства у крыс. Журн. высш. нерв. деят. им. И.П. Павлова. 2008. 58 (4): 486–492.
Торопова К.А., Анохин К.В. Моделирование посттравматического стрессового расстройства у мышей: нелинейная зависимость от силы травматического воздействия. Журн. высш. нерв. деят. им. И.П. Павлова. 2018. 68 (3): 378–394.
Adamec R.E., Shallow T. Lasting effects on rodent anxiety of a single exposure to a cat. Physiol. Behav. 1993. 54: 101–109.
Barth A.L., Gerkin R.C., Dean K.L. Alteration of neuronal firing properties after in vivo experience in a FosGFP transgenic mouse. J. Neurosci. 2004. 24 (29): 6466–6475.
Belzung C., Griebel G. Measuring normal and pathological anxiety-like behaviour in mice: a review. Behav. Brain Res. 2001. 125: 141–149.
Berardi A., Trezza V., Palmery M., Trabace L., Cuomo V., Campolongo P. An updated animal model capturing both the cognitive and emotional features of post-traumatic stress disorder (PTSD). Front. Behav. Neurosci. 2014. 8:142. eCollection.
Brewin C.R. Memory and Forgetting. Curr. Psychiatry Rep. 2018. 20 (10): 87.
Brown V.M., LaBar K.S., Haswell C.C., Gold A.L.; Mid-Atlantic MIRECC Workgroup, McCarthy G., Morey R.A. Altered resting-state functional connectivity of basolateral and centromedial amygdala complexes in posttraumatic stress disorder. Neuropsychopharmacology. 2014. 39 (2): 351–359.
Clausen A.N., Francisco A.J., Thelen J., Bruce J., Martin L.E., McDowd J., Simmons W.K., Aupperle R.L. PTSD and cognitive symptoms relate to inhibition-related prefrontal activation and functional connectivity. Depress. Anxiety. 2017. 34 (5): 427–436.
Cohen H., Kozlovsky N., Alona C., Matar M.A., Joseph Z. Animal model for PTSD: from clinical concept to translational research. Neuropharmacology. 2012. 62: 715–724.
Dahlhoff M., Siegmund A., Golub Y., Wolf E., Holsboer F., Wotjak C.T. AKT/GSK-3beta/beta-catenin signalling within hippocampus and amygdala reflects genetically determined differences in posttraumatic stress disorder like symptoms. Neuroscience. 2010. 169: 1216–1226.
Della Valle R., Mohammadmirzaei N., Knox D. Single prolonged stress alters neural activation in the periacqueductal gray and midline thalamic nuclei during emotional learning and memory. Learn Mem. 2019. 26 (10): 403–411.
Falconer E., Allen A., Felmingham K.L., Williams L.M., Bryant R.A. Inhibitory neural activity predicts response to cognitive-behavioral therapy for posttraumatic stress disorder. J. Clin. Psychiatry. 2013. 74 (9): 895–901.
Fenster R.J., Lebois L.A.M., Ressler K.J., Suh J. Brain circuit dysfunction in post-traumatic stress disorder: from mouse to man. Nat. Rev. Neurosci. 2018. 19 (9): 535–551.
Franklin K.B.J., Paxinos G. The mouse brain in stereotaxic coordinates. 3rd ed. New York: Academic Press. 2007.
Gvozdanovic G.A., Stämpfli P., Seifritz E., Rasch B. Neural correlates of experimental trauma memory retrieval. Hum. Brain Mapp. 2017. 38 (7): 3592–3602.
Harricharan S., Rabellino D., Frewen P.A., Densmore M., Théberge J., McKinnon M.C., Schore A.N., Lanius R.A. fMRI functional connectivity of the periaqueductal gray in PTSD and its dissociative subtype. Brain Behav. 2016. 6 (12): e00579.
Hölter S.M., Einicke J., Sperling B., Zimprich A., Garrett L., Fuchs H., Gailus-Durner V., Hrabé de Angelis M., Wurst W. Tests for Anxiety-Related Behavior in Mice. Curr. Protoc. Mouse Biol. 2015. 5 (4): 291–309.
Hopper J.W., Frewen P.A., van der Kolk B.A., Lanius R.A. Neural correlates of reexperiencing, avoidance, and dissociation in PTSD: symptom dimensions and emotion dysregulation in responses to script-driven trauma imagery. J. Trauma Stress. 2007. 20 (5): 713–725.
Jeong H., Chung Y.A., Ma J., Kim J., Hong G., Oh J.K., Kim M., Ha E., Hong H., Yoon S., Lyoo I.K. Diverging roles of the anterior insula in trauma-exposed individuals vulnerable or resilient to posttraumatic stress disorder. Sci. Rep. 2019. 9 (1): 15539.
Jud C., Schmutz I., Hampp G., Oster H., Albrecht U. A guideline for analyzing circadian wheel-running behavior in rodents under different lighting conditions. Biol. Proced. Online. 2005. 7: 101–116.
Kessler R.C. Posttraumatic stress disorder: the burden to the individual and to society. J. Clin. Psychiatry. 2000. 61 (5): 4–14.
Kwapis J.L., Jarome T.J., Lee J.L., Helmstetter F.J. The retrosplenial cortex is involved in the formation of memory for context and trace fear conditioning. Neurobiol. Learn. Mem. 2015. 123: 110–116.
Lanius R.A., Vermetten E., Loewenstein R.J., Brand B., Schmahl C., Bremner J.D., Spiegel D. Emotion modulation in PTSD: Clinical and neurobiological evidence for a dissociative subtype. Am. J Psychiatry. 2010. 167 (6): 640–647.
Lguensat A., Bentefour Y., Bennis M., Ba-M’hamed S., Garcia R. Susceptibility and Resilience to PTSD-Like Symptoms in Mice Are Associated with Opposite Dendritic Changes in the Prelimbic and Infralimbic Cortices Following Trauma. Neuroscience. 2019. 418: 166–176.
Liberzon I., Khan S., Young E. Animal models of posttraumatic stress disorder. Handbook of stress and the brain. Eds. Steckler T., Kalin N., Reul J. Amsterdam: Elsevier, 2005. Vol. 15. Part 2. 231–250 pp.
Lister R.G. The use of a plus-maze to measure anxiety in the mouse. Psychopharmacology (Berl). 1987. 92: 180–185.
Osuch E.A., Benson B., Geraci M., Podell D., Herscovitch P., McCann U.D., Post R.M. Regional cerebral blood flow correlated with flashback intensity in patients with posttraumatic stress disorder. Biol. Psychiatry. 2001. 50 (4): 246–253.
Penzo M.A., Robert V., Tucciarone J., De Bundel D., Wang M., Van Aelst L., Darvas M., Parada L.F., Palmiter R.D., He M., Huang Z.J., Li B. The paraventricular thalamus controls a central amygdala fear circuit. Nature. 2015. 519 (7544): 455–459.
Pissiota A., Frans O., Fernandez M., von Knorring L., Fischer H., Fredrikson M. Neurofunctional correlates of posttraumatic stress disorder: a PET symptom provocation study. Eur. Arch. Psychiatry Clin. Neurosci. 2002. 252 (2): 68–75.
Polak A.R., Witteveen A.B., Reitsma J.B., Olff M. The role of executive function in posttraumatic stress disorder: a systematic review. J. Affect Disord. 2012. 141: 11–21.
Rabellino D., Densmore M., Frewen P.A., Théberge J., McKinnon M.C., Lanius R.A. Aberrant Functional Connectivity of the Amygdala Complexes in PTSD during Conscious and Subconscious Processing of Trauma-Related Stimuli. PLoS One. 2016. 11 (9): e0163097.
Robinson L., Plano A., Cobb S., Riedel G. Long-term home cage activity scans reveal lowered exploratory behaviour in symptomatic female Rett mice. Behav. Brain Res. 2013. 250: 148–156.
Robinson L., Riedel G. Comparison of automated home-cage monitoring systems: emphasis on feeding behaviour, activity and spatial learning following pharmacological interventions. J. Neurosci. Methods. 2014. 234: 13–25.
Schöner J., Heinz A., Endres M., Gertz K., Kronenberg G. Post-traumatic stress disorder and beyond: an overview of rodent stress models. J. Cell Mol. Med. 2017. 21 (10): 2248–2256.
Shin L.M., Whalen P.J., Pitman R.K., Bush G., Macklin M.L., Lasko N.B., Orr S.P., McInerney S.C., Rauch S.L. An fMRI study of anterior cingulate function in posttraumatic stress disorder. Biol. Psychiatry. 2001. 50 (12): 932–942.
Siegmund A., Wotjak C.T. A mouse model of posttraumatic stress disorder that distinguishes between conditioned and sensitised fear. J. Psychiatr. Res. 2007a. 41: 848–860.
Siegmund A., Wotjak C.T. Hyperarousal does not depend on trauma-related contextual memory in an animal model of posttraumatic stress disorder. Physiol. Behav. 2007b. 90: 103–107.
Siegmund A., Wotjak C.T. Toward an animal model of posttraumatic stress disorder. Ann. N. Y. Acad. Sci. 2006. 1071: 324–334.
Spiers J.G., Chen H.C., Steyn F.J., Lavidis N.A., Woodruff T.M., Lee J.D. Noninvasive assessment of altered activity following restraint in mice using an automated physiological monitoring system. Stress. 2017. 20 (1): 59–67.
Urbach Y.K., Raber K.A., Canneva F., Plank A.C., Andreasson T., Ponten H., Kullingsjö J., Nguyen H.P., Riess O., von Hörsten S. Automated phenotyping and advanced data mining exemplified in rats transgenic for Huntington’s disease. J. Neurosci. Methods. 2014. 234: 38–53.
Walf A.A., Frye C.A. The use of the elevated plus maze as an assay of anxiety-related behavior in rodents. Nat. Protoc. 2007. 2: 322–328.
Wang T., Liu J., Zhang J., Zhan W., Li L., Wu M., Huang H., Zhu H., Kemp G.J., Gong Q. Altered resting-state functional activity in posttraumatic stress disorder: A quantitative meta-analysis. Sci. Rep. 2016. 6: 27131.
Yehuda R., Antelman S.M. Criteria for rationally evaluating animal models of posttraumatic stress disorder. Biol. Psychiatry.1993. 33: 479–486.
Zhang Y., Fukushima H., Kida S. Induction and requirement of gene expression in the anterior cingulate cortex and medial prefrontal cortex for the consolidation of inhibitory avoidance memory. Mol. Brain. 2011. 4: 4.
Zhong Y., Zhang R., Li K., Qi R., Zhang Z., Huang Q., Lu G. Altered cortical and subcortical local coherence in PTSD: evidence from resting-state fMRI. Acta Radiol. 2015. 56 (6): 746–753.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


