Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 5, стр. 655-667
Импульсная активность и нестабильность генома нейронов миндалевидного комплекса у крыс селектированных линий с контрастной возбудимостью нервной системы в нормальных и стрессовых условиях
И. Б. Сиваченко 1, М. Б. Павлова 2, А. И. Вайдо 2, Н. В. Ширяева 2, С. С. Пантелеев 1, Н. А. Дюжикова 2, *, О. А. Любашина 1
1 Лаборатория кортико-висцеральной физиологии Федеральное государственное бюджетное учреждение науки Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Лаборатория генетики высшей нервной деятельности, Федеральное государственное бюджетное учреждение науки Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: dyuzhikova@infran.ru
Поступила в редакцию 13.03.2020
После доработки 13.04.2020
Принята к публикации 01.06.2020
Аннотация
У интактных и подвергнутых длительному эмоционально-болевому стрессорному воздействию (ДЭБС) крыс селектированных линий с высоким (ВП) и низким (НП) порогом возбудимости нервной системы исследовали фоновую и вызванную электрическим раздражением префронтальной коры нейрональную активность миндалевидного комплекса, а также уровень нестабильности генома в его клетках с использованием белкового маркера двойных разрывов ДНК – фосфорилированного по серину 139 гистона Н2АХ (γ-H2AX phospho Ser139). Впервые выявлена прямая связь базальной (фоновой) импульсной активности нейронов миндалевидного комплекса и уровня нестабильности их генома, а также зависимость ответной реакции нейронов базолатеральной миндалины на возбуждающее раздражение инфралимбической коры от врожденного генетически детерминированного уровня возбудимости нервной системы. Под действием ДЭБС продемонстрировано усиление функциональной активности миндалевидного комплекса у крыс линии ВП по показателям частоты фоновой импульсации нейронов, среднего количества и латентности импульсов в их реакции на кортикальное раздражение. У линии НП в тех же условиях выявлено более значительное увеличение частоты фоновой нейрональной активности, сопровождаемой ростом иммунореактивности клеток к γ-H2AX phospho Ser139, а также значительное уменьшение латентности реакции амигдалярных нейронов на кортикальную стимуляцию при неизменном количестве в ней импульсов.
Исследование системных механизмов стресс-индуцированных патологических состояний является актуальной задачей современной нейробиологии.
Важная роль в формировании нейропатологии принадлежит функциональному состоянию нервной системы (ФСНС), ключевым параметром которого является возбудимость, на что впервые указывал еще И.П. Павлов. Наши многолетние исследования, выполненные с использованием моделей на беспозвоночных и позвоночных животных, свидетельствуют о связи между генетически-детерминированным уровнем возбудимости нервной системы и особенностями реализации нормального и стресс-индуцированного патологического поведения, формированием долговременных нервно-психических расстройств со специфическим характером патологии [Лопатина, Пономаренко, 1986; Вайдо и др., 2018]. У селектированных по высокому и низкому порогу возбудимости нервной системы линий крыс была выявлена склонность к формированию вызванных стрессорными воздействиями нервно-психических расстройств и особенности их долгосрочного проявления, что позволило отнести их к генетическим моделям нейропатологий тревожного спектра – посттравматического стрессового расстройства (ПТСР) и компульсивного расстройства (КР) человека [Вайдо и др., 2018; Дюжикова и др., 2015].
Специфика нейропатологии может быть связана с вовлечением в инициацию и поддержанием патологических состояний разных отделов ЦНС, нейрофизиологическими особенностями их взаимодействия у животных с различным ФСНС [Лопатина, Пономаренко, 1986].
Известно, что в основе патогенеза долговременных нервно-психических расстройств лежит устойчивое раcсогласование в работе разных отделов нервной системы – синдром дезинтеграции [Айрапетянц, Вейн, 1982; Бехтерева, 2010]. Нарушаются связи между отдельными структурами мозга и координация их активности [Айрапетянц, Вейн, 1982]. При заболеваниях тревожного спектра страдают функции и связи между эмоциогенными структурами мозга, прежде всего, префронтальной корой и миндалиной [Jalbrzikowski et al., 2017; Delli Pizzi et al., 2017]. Кроме того, известно о дестабилизирующем влиянии стресса на геном нейронов [Дюжикова, Даев, 2018], однако характер взаимосвязи между импульсной активностью нейронов и нестабильностью их генома в структурах мозга, связанных с патогенезом постстрессорных расстройств, в частности, в миндалине, не изучен.
Представляемое исследование – первая часть комплексного проекта, направленного на выяснение нейрофизиологических нарушений взаимосвязи между структурами мозга патологического контура тревожно-депрессивных расстройств в зависимости от генетически детерминированного порога возбудимости нервной системы. Целями данной работы являлись: 1) изучение фоновой импульсной активности миндалевидного комплекса и реакций его нейронов на электрическое раздражение медиальной префронтальной коры (а именно ее инфралимбической области, участвующей в подавлении реакций тревожности и страха); 2) оценка нестабильности генома в клетках миндалины (с использованием белкового маркера двойных разрывов ДНК – фосфорилированного по серину 139 гистона Н2АХ [Kuo, Yang, 2008]) у интактных и подвергнутых длительному эмоционально-болевому стрессорному воздействию крыс селектированных линий с высоким (ВП) и низким (НП) порогом возбудимости нервной системы.
МЕТОДИКА
Объектом исследования служили самцы крыс (возраст – 5 мес), являющихся 74-м поколением высокопороговой (ВП) и низкопороговой (НП) линий, селектированных в лаборатории генетики высшей нервной деятельности по порогу возбудимости большеберцового нерва (n. tibialis) – с высоким (низковозбудимые) и низким (высоковозбудимые) порогом возбудимости [Вайдо и др., 2018]. Линии входят в биоколлекцию ФГБУН Института физиологии им. И.П. Павлова РАН (№ ГЗ 0134-2018-0003, патенты на селекционное достижение № 10769 и 10768, выданные ФГБУ “Государственная комиссия РФ по испытанию и охране селекционных достижений”, зарегистрировано в государственном реестре охраняемых селекционных достижений 15.01.2020). Животных содержали в виварии при стандартном световом режиме (12 ч день, 12 ч ночь), в условиях свободного доступа к воде и пище. При работе с животными соблюдались международные требования Директивы Европейского парламента и Совета Европейского Союза 2010/63/ЕС о защите животных, использующихся для научных целей, и принципы Хельсинкской декларации о гуманном отношении к животным. Протоколы экспериментов утверждены комиссией по биоэтике ФГБУН Института физиологии им. И.П. Павлова РАН.
Эксперименты выполнены на самцах крыс линии ВП (n = 24) и линии НП (n = 24). Крысы обеих линий были разделены на две равные группы (n = 12): 1) подвергнутые длительному эмоционально-болевому стрессу и 2) нестрессированные (контрольные). Половина животных из каждой группы (n = 6) использовалась в нейрофизиологических экспериментах, остальные (n = 6) – для иммуногистохимического исследования γ-H2AX phospho Ser139.
Метод стрессорного воздействия
Длительное эмоционально-болевое стрессирование (ДЭБС) осуществляли ежедневно (по 13 мин) в течение 15 дней по стохастической схеме К. Гехта [Hecht et al., 1972, цит. по: Вайдо и др., 2018]. На решетчатый электрифицированный пол прозрачной камеры подавалось 12 сигналов длительностью 10 с каждый, которые состояли из шести неподкрепляемых и шести подкрепляемых током (2.5 мА, 4 с) световых сигналов. Межсигнальный интервал равнялся 1 мин. Согласно схеме сочетания условных и безусловных стимулов не повторялись, а чередовались с вероятностью 0,5, что не позволяло выработать у животных условный рефлекс. Как показали наши предыдущие исследования, используемое воздействие способствует возникновению у животных устойчивого патологического состояния – нарушений поведения, сохраняющихся до шести месяцев после воздействия [Вайдо и др., 2018].
Методика нейрофизиологических экспериментов
Нейрофизиологические эксперименты проводили через 24 ч после окончания стрессорного воздействия. Для проведения исследования крыс анестезировали внутрибрюшинным введением смеси уретана (“ICN”, США, 800 мг/кг) и альфа-хлоралозы (“ICN”, США, 60 мг/кг). После катетеризации бедренных артерии и вены с последующей трахеостомией (для облегчения дыхания в условиях анестезии), животное помещали в стереотаксический аппарат (“Медикор”, Венгрия). Для установки стимулирующего и регистрирующего электродов в левых лобной и теменной костях черепа проделывали отверстия в зонах проекций медиальной префронтальной коры и базолатеральной части миндалевидного комплекса согласно их стереотаксическим координатам по стандартному атласу мозга крысы [Paxinos, Watson, 2007].
Глубину анестезии в ходе эксперимента оценивали по уровню системного артериального давления, которое регистрировали через канюлю, введенную в бедренную артерию и соединенную с полупроводниковым датчиком (ПДП-300, Россия). В случае дестабилизации этого показателя или его отклонения за пределы диапазона 70–100 мм рт. ст. осуществляли дополнительное введение анестезирующей смеси через внутривенный катетер. Температуру тела животного контролировали ректально и поддерживали в пределах 37–38°С с помощью пластины, подогреваемой водяным термостатом (U-10, Германия).
Электрическую стимуляцию левой медиальной префронтальной коры в инфралимбической области (2.5–3.0 мм ростральнее брегмы, 0.7–1.0 мм латеральнее средней линии, глубина 4.5 мм от дорсальной поверхности мозга) выполняли монополярными вольфрамовыми электродами в лаковой изоляции с диаметром кончика 5 мкм и сопротивлением 50 кОм (“Science Products GMBH”, Германия). Индифферентный электрод закрепляли в контралатеральной височной мышце. Раздражение коры осуществляли одиночными прямоугольными импульсами тока амплитудой 300–700 мкА и длительностью 150–350 мкс посредством электростимулятора Isostim A320 (“World Precision Instruments”, США), управляемого компьютером с помощью авторской программы Spikes 1202 [Пантелеев и др., 2004]. В опыте на каждой крысе параметры стимуляции префронтальной коры подбирали таким образом, чтобы вызвать наиболее стабильную (появляющуюся в ответ на каждый из предъявляемых стимулов) реакцию регистрируемого нейрона миндалевидного комплекса.
Регистрацию фоновой активности нейронов левого миндалевидного комплекса и их ответов на электрическое раздражение ипсилатеральной медиальной префронтальной коры производили вольфрамовыми микроэлектродами в лаковой изоляции с диаметром кончика 1 мкм и сопротивлением 12 Мом (“Science Products GMBH”, Германия). Микроэлектроды размещали в базолатеральной части структуры, в зоне от 3.2 до 3.6 мм каудальнее брегмы и от 4.5 до 5.5 мм латеральнее средней линии на глубине от 6.5 до 7.5 мм от поверхности мозга – области, которая является основным реципиентом проекций от медиальной префронтальной коры [Любашина и др., 2009]. Вертикальное перемещение микроэлектрода в ткани мозга осуществляли шагами по 4 мкм с использованием электронного погружающего устройства (МП-2, Россия). Сигнал от регистрирующего электрода после необходимого усиления (усилитель DAM 80, “World Precision Instruments”, США) подавали на вход аналого-цифрового преобразователя PCI-1202H (ICPDAS, Тайвань) для ввода в компьютер.
Визуализацию нейрональной активности на экране монитора, построение перистимульных гистограмм и сохранение данных в памяти компьютера для последующей обработки производили в реальном времени с помощью программы Spikes1202, которая позволяла производить дифференциальную амплитудную дискриминацию из суммарной записи до трех импульсных последовательностей с раздельным построением гистограмм для каждой из них [Пантелеев и др., 2004]. Оценку нейрональных реакций на стимуляцию медиальной префронтальной коры производили по перистимульным гистограммам с бином в 1 мс и пре- и постстимульной эпохами анализа длительностью 250 мс каждая, накапливаемым в результате 50 последовательных реализаций одиночного электрического раздражения с частотой следования стимулов 0.3 Гц. Для оценки фоновой активности использовали аналогичные гистограммы, накопленные по 50 реализациям без предъявления электрического стимула. Для фоновой активности определяли частоту (имп/с), для вызванных кортикальной стимуляцией нейрональных реакций – число импульсов, генерируемых в ответ на стимул (имп/стимул) в интервале от 5 до 75 мс после его предъявления.
По окончании каждого эксперимента осуществляли эвтаназию животного внутривенным введением уретана в дозе не менее 3 г/кг, после чего выполняли электролитическое разрушение ткани мозга пропусканием через стимулирующий и регистрирующий электроды постоянного тока силой 0.75–1.5 мА в течение 60 с. Локализацию мест расположения электродов производили по обработанным стандартными гистологическими методами (метод Ниссля) срезам мозга толщиной 40 мкм с использованием атласа мозга крысы [Paxinos, Watson, 2007].
Графическое оформление и статистическую обработку результатов производили с помощью программы Origin 2015 (“OriginLab Corp”, США). Поскольку критерий Шапиро–Уилка выявил отклонение полученных данных от нормального распределения, их статистический анализ осуществляли с применением непараметрических методов для парных (парный тест Вилкоксона) и непарных (тест Манна–Уитни–Вилкоксона) измерений. Данные представлены как среднее значение ± стандартная ошибка среднего. Различия между контрольными и экспериментальными группами считали статистически значимыми при p < 0.05.
Методика иммуногистохимического исследования
С использованием иммуногистохимического метода исследовали иммунореактивность клеток изучаемой области миндалины к гамма-H2AX, фосфорилированному по серину 139 (γ-H2AX phospho Ser139) у крыс линий ВП и НП в норме и через 24 часа после ДЭБС (в каждой группе n = 6). Выделенный мозг крыс фиксировали в 4% растворе параформальдегида и подвергали стандартной гистологической обработке. Иммуногистохимическое исследование проводили на фронтальных срезах мозга (7 мкм) на уровне от –2.76 мм до –3.24 мм от брегмы. Исследовали переднюю часть базолатерального ядра миндалевидного комплекса (BLA – basolateral amygdaloid nucleus, anterior part) и вентромедиальную часть латерального ядра миндалевидного комплекса (LaVM – lateral amygdaloid nucleus, ventromedial part) в соответствии со стереотаксическим атласом мозга крысы [Paxinos, Watson, 2007].
Использовали первичные антитела Anti-Нistone-H2AX (phospho Ser139) antibody (RabMAb, Abcam) в разведении 1:200 и вторичные антитела Goat Anti-Rabbit IgG Н&L (HRP polymer) (Abcam). Визуализацию реакции проводили с помощью окрашивания диаминобензидином (3,3′-Diaminobenzidine tetrahydrochloride, DAB) (Peroxidase substratе Kit DAB, Vector Laboratories, США). Учитывали общее количество иммуноположительных клеток двух классов – с высокой и средней оптической плотностью – по отношению к общему количеству клеток на определенной площади микрообъекта. Для каждого животного в каждой экспериментальной группе анализировали не менее 15–20 срезов. Препараты анализировали с помощью светового микроскопа Микромед-3 (увеличение 40–1000 раз), совмещенного с ССD-камерой и программным обеспечением ВидеоТест- МОРФОЛОГИЯ и -FISH (Санкт-Петербург, Россия) и ImageBase. Оценка достоверности различий между группами проводилась с помощью U-критерия Манна–Уитни–Вилкоксона и критерия one-way ANOVA; использовали пакет программ Statgraphics Сenturion 18.1.01.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В ходе опыта у каждого экспериментального животного была зарегистрирована активность 6–12 нейронов миндалевидного комплекса, локализованных преимущественно в вентромедиальной части латерального ядра и передней части базолатерального ядра (рис. 1 (а)–(г)).
Рис. 1.
(а)–(г) – Локализация зарегистрированных нейронов в базолатеральной части миндалевидного комплекса контрольных (темные символы) и стрессированных (светлые символы) крыс линий ВП ((а), (б)) и НП ((в), (г)). Каждый символ соответствует локализации 1–3 зарегистрированных нейронов. Схема адаптирована из стандартного атласа мозга крысы (Paxinos, Watson, 2007). Обозначения: ASt – амигдалостриарная переходная область, BLA – передняя часть базолатерального ядра миндалевидного комплекса, BLP – задняя часть базолатерального ядра миндалевидного комплекса, BLV – вентральная часть базолатерального ядра миндалевидного комплекса, BMP – задняя часть базомедиального ядра миндалевидного комплекса, CeA – центральное ядро миндалевидного комплекса, CoA – кортикальное ядро миндалевидного комплекса, DEn – дорсальное эндопириформное ядро, I – вставочные ядра миндалевидного комплекса, LaDL – дорсолатеральная часть латерального ядра миндалевидного комплекса, LaVL – вентролатеральная часть латерального ядра миндалевидного комплекса, LaVM – вентромедиальная часть латерального ядра миндалевидного комплекса, MeA – медиальное ядро миндалевидного комплекса, opt – оптический тракт, Pir – пириформная кора, st – конечная полоска. (д) и (е) – примеры фоновой активности нейрона миндалевидного комплекса (д) и его реакции на электрическую стимуляцию передней лимбической коры (е) у крысы линии ВП. В верхней части каждого фрагмента – нативные осциллограммы одной реализации, ниже – соответствующие гистограммы, накопленные в результате 50 аналогичных реализаций. На гистограммах: по оси абсцисс – время, по оси ординат – число импульсов в бине, равном 1 мс.
Fig. 1. (а) – (г) – Localization of recorded neurons in the basolateral part of the amygdaloid complex in control (dark symbols) and stressed (light symbols) rats of the HT ((а), (б)) and LH ((в), (г)) bred strains. Each symbol covers 1–3 recording neurons. Adapted from the standard rat brain atlas (Paxinos, Watson, 2007). Designations: ASt – amygdalostriatal transition area, BLA – anterior part of basolateral amygdaloid nucleus, BLP – posterior part of basolateral amygdaloid nucleus, BLV – ventral part of basolateral amygdaloid nucleus, BMP – posterior part of basomedial amygdaloid nucleus, CeA – central amygdaloid nucleus, CoA – cortical amygdaloid nucleus, DEn – dorsal endopiriform nucleus, I – intercalated nuclei of amygdala, LaDL – dorsolateral part of the lateral nucleus of the amygdala, LaVL – ventrolateral part of the lateral nucleus of the amygdala, LaVM – ventromedial part of the lateral amygdaloud nucleus, MeA – medial amygdaloid nucleus, opt – optic tract, Pir – piriform cortex, st – stria terminalis. (д), (е) – Examples of background activity of an amygdala neuron (д) and its reaction to electrical stimulation of the infralimbic cortex (е) in a rat of the HT bred strain. In the upper part of each fragment – native oscillogram of a single recording, below – respective histogram accumulated from 50 similar recordings. In histograms: abscissa – time, ordinate – number of impulses in 1 ms bin.
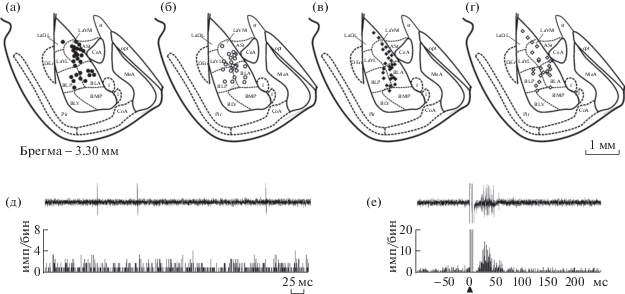
Все зарегистрированные нейроны демонстрировали фоновую активность в виде нерегулярно генерируемых одиночных импульсов (рис. 1 (д)). В контрольной группе крыс линии ВП средняя частота фоновой нейрональной активности составляла 0.4 ± 0.07 имп/с (n = 48) и была существенно ниже, чем частота импульсации у контрольных животных линии НП (1.5 ± 0.22 имп/с, n = 46, p < 0.0001, U = 1987.5, тест Манна–Уитни–Вилкоксона; рис. 2 (а)).
Рис. 2.
Диаграммы, демонстрирующие средние частоту фоновой импульсации нейронов миндалевидного комплекса (а) и величину их реакции на электрическую стимуляцию передней лимбической коры (б) у контрольных и стрессированных крыс линий ВП и НП. По оси ординат – средняя частота импульсов (а) или среднее число разрядов в ответ на предъявляемый стимул (б). Вертикальные отрезки отражают величину стандартной ошибки среднего. Различия значимы по сравнению с контрольными для каждой линии данными (# р < 0.05, ## р < 0.01 и ### p < 0.001) и между линиями ВП и НП в контроле или после стресса (* p < 0.05, *** p < 0.001).
Fig. 2. Diagrams demonstrate mean frequency of background firing of amygdala neurons (а) and value of their reaction to electrical stimulation of the anterior limbic cortex (б) in control and stressed rats of the HT and LT strains. Ordinate – mean rate of impulses (а) or mean number of discharges in response to presented stimulus (б). Vertical bars represent standard error of mean. Differences are significant versus control values in each rat strain (# р < 0.05, ## р < 0.01, ### p < 0.001) and between strains HT and LT in control or after stress (* p < 0.05, *** p < 0.001).
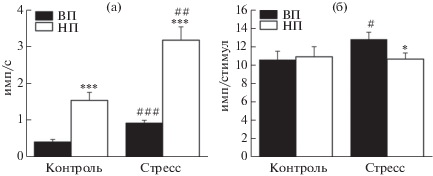
После эмоционально-болевого стрессорного воздействия у крыс линии ВП было отмечено статистически значимое по сравнению с контролем (p < 0.0001, U = 2881.0, тест Манна–Уитни–Вилкоксона) усиление фоновой нейрональной активности в миндалевидном комплексе до 0.9 ± 0.08 имп/с (n = 66; рис. 2 (а)). У стрессированных животных линии НП средняя частота фоновой импульсации нейронов также была существенно выше, чем у контрольных животных (p = 0.003, U = = 3907.0, тест Манна–Уитни–Вилкоксона; табл. 1), достигая уровня в 3.2 ± 0.36 имп/с (n = 56) и по-прежнему превосходя аналогичный показатель у крыс линии ВП (p < 0.0001, U = 4789.0, тест Манна–Уитни–Вилкоксона).
Таблица 1.
Изменения показателей фоновой и вызванной активностей нейронов миндалевидного комплекса крыс исследованных линий после стрессорного воздействия Table 1. Changes in background and evoked neuronal activities of the amygdaloid complex in rats of the studied bred strains following stress exposure
| Линия (Bred strain) |
Фоновая активность (Background activity) |
Ответ на кортикальное раздражение (Response to cortical stimulation) |
|
|---|---|---|---|
| Величина (value) |
Латентный период (latency) |
||
| ВП | ↑ | ↑ | ↓ |
| НП | ↑ | = | ↓ |
Обозначения: ВП – высокопороговая линия, НП – низкопороговая линия, ↑ – увеличение, ↓ – уменьшение, = – без изменений. Величина и толщина стрелок отражают степень изменений. Designation: ВП – high threshold strain, НП – low threshold strain, ↑ – an increase, ↓ – a decrease, = – no changes. The size and thickness of the arrows reflect the degree of the change.
По данным гистологического контроля, стимулирующие электроды во всех экспериментах были локализованы в пределах V–VI слоев инфралимбической области медиальной префронтальной коры. В обеих линиях электрическое раздражение инфралимбической коры вызывало реакцию нейронов миндалевидного комплекса в виде разряда, состоящего из нескольких импульсов (рис. 1 (е)). Среднее количество импульсов в ответе у контрольных крыс линий ВП и НП существенно не различалось (p = 0.9, U = 1091.0, тест Манна–Уитни–Вилкоксона) и составляло 10.6 ± ± 0.92 (n = 48) и 10.9 ± 1.08 имп/стимул (n = 46) соответственно (рис. 2 (б)). У крыс линии ВП вызванная нейрональная реакция была выше по отношению к фону (при нормализации к среднему уровню фоновой активности, 26.4 ± 2.31 у ВП против 7.3 ± 0.72 у НП, p < 0.0001, U = 220.0) и появлялась со средним латентным периодом в 30.7 ± 2.13 мс (n = 48), который был меньше такового у НП животных (45.8 ± 4.99 мс, n = 46, p = 0.03, U = 728.0, тест Манна–Уитни–Вилкоксона; рис. 3).
Рис. 3.
Диаграммы, демонстрирующие величину латентного периода ответов нейронов миндалевидного комплекса на электрическое раздражение передней лимбической коры у контрольных и стрессированных крыс линий ВП и НП. По оси ординат – среднее значение латентного периода. Вертикальные отрезки отражают величину стандартной ошибки среднего. Различия значимы по сравнению с контрольными для каждой линии данными (# р < 0.05 и ### p < < 0.001) и между линиями ВП и НП в контроле (* р < 0.05).
Fig. 3. Diagrams demonstrate latency of amygdala neuron responses to electrical stimulation of the anterior limbic cortex in control and stressed rats of the HT and LT strains. Ordinate – mean value of latency. Vertical bars represent standard error of mean. Differences are significant versus control values in each rat strain (# р < 0.05, ### p < 0.001) and between strains HT and LH in control (* p < 0.05).
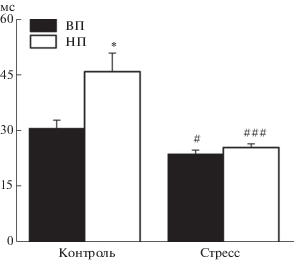
После стрессорного воздействия у животных линии ВП среднее число импульсов в реакциях нейронов миндалевидного комплекса на раздражение инфралимбической коры составляло 12.8 ± 0.77 имп/стимул (n = 66) и было существенно большим, чем в контроле (p = 0.04, U = 1242.0, тест Манна–Уитни–Вилкоксона; рис. 2 (б), табл. 1). При этом нейрональный ответ появлялся с несколько меньшим, чем у нестрессированных животных (p = 0.015, U = 1078.5, тест Манна–Уитни–Вилкоксона), средним латентным периодом 23.8 ± 1.04 мс (n = 66; рис. 3). У крыс линии НП стресс не оказал значимого влияния на интенсивность вызванной кортикальной стимуляцией нейрональной активности в миндалине, которая сохранялась на сопоставимом с контрольным уровне в 10.7 ± 0.65 имп/стимул (n = 56, p = 0.57, U = 1202.0, тест Манна–Уитни–Вилкоксона). Этот уровень был ниже, чем аналогичный показатель у стрессированных животных линии ВП (p = 0.04, U = 1396.0, тест Манна–Уитни–Вилкоксона; рис. 2 (б)). Средний латентный период нейронального ответа у животных линии НП после стрессорного воздействия был существенно меньшим, чем в контроле (p < 0.0001, U = 629.0, тест Манна–Уитни–Вилкоксона; табл. 1), и составлял 25.5 ± 0.99 мс (n = 56). Это значение было сопоставимо со средним латентным периодом вызванных реакций нейронов миндалевидного комплекса у стрессированных крыс линии ВП (p = 0.22, U = 1607.0, тест Манна–Уитни–Вилкоксона; рис. 3).
Результаты иммуногистохимического исследования
Базовый уровень иммунореактивности к γ-H2AX phospho Ser139 клеток исследуемой области миндалевидного комплекса у крыс линии НП более чем в 2 раза снижен по сравнению с линией ВП (U = 0, p = 0.01, тест Манна–Уитни-Вилкоксона; F = 22.91, p = 0.002, тест ANOVA, рис. 4).
Рис. 4.
Иммунореактивность к γ-H2AX phospho Ser139 клеток миндалевидного комплекса крыс линий ВП и НП в норме и через 24 ч после действия длительного эмоционально-болевого стрессорного воздействия. На графиках показаны среднее, медиана, максимальные и минимальные значения, межквартильные интервалы. Различия значимы по сравнению с контрольной группой той же линии (* p < 0.05) и альтернативной линии ВП (# p < 0.05).
Fig. 4. Immunoreactivity of amygdala cells to γ-H2AX phospho Ser139 in control and stressed (24 hours after long-term emotional painful stress) rats of the НТ and LT strains. The graphs show the average, median, maximum and minimum values, interquartile intervals. Differences are significant versus control values of the same strain (* p < 0.05) and of the alternative HT strain (# p < 0.05).
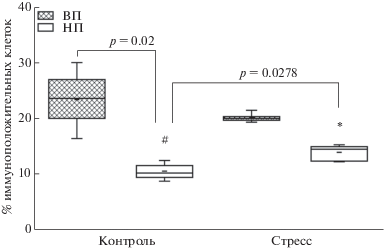
Через 24 ч после действия ДЭБС происходит достоверное повышение иммунореактивности к γ-H2AX phospho Ser139 клеток миндалевидного комплекса только у крыс линии НП (U = 1.5, p = 0.0278, U-критерий Манна–Уитни–Вилкоксона; F = 13.41, p = 0.0064, тест ANOVA, рис. 4). У крыс линии ВП стресс не оказал значимого влияния на исследуемый показатель.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты проведенного исследования показали, что частота фоновой нейрональной активности миндалевидного комплекса высоковозбудимых крыс линии НП в 3.7 раза превосходит значения этого показателя у крыс низковозбудимой линии ВП. Выявленный уровень межлинейных различий в частоте импульсной активности нейронов миндалины соответствует их различиям по основному признаку, по которому ведется селекция, – возбудимости нервной системы, проявляющейся не только в исходно разных для крыс НП и ВП линий порогах активации большеберцового нерва (n. tibialis) [Вайдо и др., 2018], но и в их различиях по порогу возбудимости каудального нерва (n. caudalis) [Вайдо и др., 1985], а также порогу реакции активации электроэнцефалограммы (ЭЭГ) в ретикулярной формации среднего мозга (отведение от сенсомоторной зоны коры) при электрическом раздражении прямоугольными импульсами тока в течение 3 с, частотой 200 Гц [Александрова и др., 1981]. Ранее были обнаружены также межлинейные различия по амплитуде длительной посттетанической потенциации гиппокампа, более выраженной у крыс линии НП [Вайдо и др., 1992]. В своей совокупности эти данные свидетельствуют об отличающих линии НП и ВП уровнях возбудимости не только периферической, но и центральной нервной системы, включая переднемозговые структуры. Последнее подтверждают и дополняют продемонстрированные нами в данной работе различия указанных линий крыс по фоновым показателям нейрональной активности в миндалевидном комплексе.
Как показали наши исследования, в норме среднее число импульсов в ответах нейронов миндалины на электрическое раздражение инфралимбической области медиальной префронтальной коры у животных обеих линий не различалось. Однако у крыс линии ВП вызванная нейрональная активность была выше по отношению к фоновой импульсации, что указывает на большую реактивность клеток этой структуры к возбуждающим кортикальным влияниям у этих животных. При этом латентный период нейрональных реакций, вызванных стимуляцией инфралимбической коры, у контрольных крыс линии ВП был значительно меньше аналогичного показателя у линии НП, что наряду с дополнительным свидетельством в пользу большей реактивности нейронов миндалины может также указывать на большую скорость проведения возбуждения в соответствующих кортико-амигдалярных проекциях у низковозбудимых животных по сравнению с высоковозбудимыми. Последнее может быть связано с возможными различиями в структурно-функциональной организации этих проекций у крыс линий ВП и НП. В пользу такого предположения косвенно свидетельствуют ранее полученные данные, которые продемонстрировали более высокую скорость проведения нервных импульсов (потенциала действия) в периферических отделах нервной системы и больший диаметр нервных волокон в каудальном и большеберцовом нервах у крыс линии ВП [Вайдо и др., 1985].
Таким образом, впервые выявлена связь уровня базальной (фоновой) импульсной активности нейронов миндалевидного комплекса и их ответной реакции на возбуждающее влияние инфралимбической коры с врожденным генетически детерминированным уровнем возбудимости нервной системы.
Как известно, миндалина играет ключевую роль в формировании эмоций, проявлении эмоциональных реакций, вовлечена в регуляцию уровня тревожности [Stein et al., 2002; Phan et al., 2006]. При этом уровень функциональной активности миндалины при реализации негативных эмоциональных реакций и, в частности, реакции страха определяется ее двусторонними структурно-функциональными связями с медиальной префронтальной корой [Любашина, Ноздрачев, 2008; Arruda-Carvalho, Clem, 2015; Lyubashina, Panteleev, 2009; Peters et al., 2009; Sierra-Mercado et al., 2011]. Очевидно, что связанные с наследственно обусловленной возбудимостью нервной системы особенности нейрональной активности миндалины должны сказываться и на проявлении поведенческих признаков. Действительно, высокопороговые линии крыс, которые в нашем исследовании при более низкой фоновой активности нейронов базолатеральной миндалины характеризовались более выраженной и быстрой активацией ее клеток кортикальными входами, имеют и более высокий уровень тревожности по сравнению с крысами линии НП, что было показано в приподнятом крестообразном лабиринте и тесте экстраполяционного избавления [Левина и др., 2020, в печати]. Причина парадоксального проявления более сильных реакций у низковозбудимых животных может быть связана с тем, что разделение крыс на низко- и высоковозбудимых осуществлялось по порогам возбудимости периферического соматического нерва, а здесь речь идет о функциональных отношениях между переднемозговыми лимбическими структурами, т.е. более связанными с висцеральными и эндокринными функциями.
Межлинейные различия, выявленные по уровню врожденной возбудимости нервной системы и ее нейрофизиологическим коррелятам, проявляются и при исследовании в клетках миндалины белка гамма H2AX, что показано в настоящей работе. Ранее у крыс линий ВП и НП была продемонстрирована разница по уровню метилирования ДНК и метилирования гистона Н3К9 [Павлова, 2019] – эпигенетическим маркерам “молчащего”, сайленсированного, транскрипционно неактивного хроматина [Du et al., 2015]. У низковозбудимых крыс линии ВП иммунореактивность клеток миндалины к перечисленным маркерам была выше, чем у крыс линии НП, что дает основания предполагать существование генетической детерминации обусловленного функциональным состоянием нервной системы базового уровня нестабильности генома в клетках мозга. Тем более, что в настоящее время возникновение двойных разрывов ДНК и их репарация рассматриваются не только в связи с патологическими процессами, но и как отражение нормальных явлений пластичности генома нейронов, лежащих в основе их активности и связанных с обеспечением динамических взаимодействий генома с влиянием среды, необходимых для формирования адаптивных реакций, процессов обучения и памяти [Suberbielle et al., 2013]. Для установления определенного характера наследственно обусловленных связей между нервной возбудимостью, нейрональной активностью и целостностью генома требуются дальнейшие исследования.
Под влиянием длительного эмоционально-болевого стрессорного воздействия изменение отдельных показателей нейрональной активности базолатеральной миндалины у крыс линий ВП и НП происходило по-разному. Увеличение частоты фоновой импульсации нейронов проявлялось у обеих линий в одинаковой степени, что, по-видимому, является универсальной реакцией на психоэмоциональный стресс, не зависит от базового уровня возбудимости крыс, отражая фазу активации при невротизации [Айрапетьянц, Вейн, 1982]. Это также согласуется с ранее полученными данными о вызываемых хроническим стрессом структурно-функциональных перестройках в базолатеральной миндалине, способствующих повышению общего уровня ее возбудимости, таких как индукция пролиферации дендритов и увеличение плотности шипиков на нейронах [Mitra et al., 2005; Roozendaal et al., 2009; Vyas et al., 2006].
При этом индуцированное стрессом увеличение среднего числа разрядов в ответах нейронов базолатеральной миндалины на стимуляцию инфралимбической коры происходило только у низковозбудимых крыс линии ВП. У высоковозбудимых животных линии НП, напротив, при сопоставимой с нормой величине этой реакции наблюдалось значительное уменьшение ее латентного периода, вероятно, отражая адаптивную реакцию мозга на стресс именно у этих животных. Известно, что глутаматергические проекции от инфралимбической коры в базолатеральную миндалину способны активировать как возбуждающие, так и тормозные внутриамигдалярные механизмы [Cho et al., 2013; Maroun, 2006; Quirk, Mueller, 2008; Reznikov et al., 2018]. Ранее было показано, что стресс от неизбегаемых воздействий вызывает нарушение нормального баланса активируемых корой возбуждающих и тормозных процессов в базолатеральной миндалине в сторону усиления возбуждающих механизмов, способствующих упрочению реакции страха и нарушению процессов его подавления [Maroun, 2006]. После стрессорного воздействия в миндалине крыс линии ВП нами было отмечено значительное усиление вызываемого кортикальной стимуляцией нейронального возбуждения, тогда как у животных линии НП этот показатель не отличался от нормы. Последнее может являться одной из причин формирования такими животными характерных для них постстрессорных поведенческих нарушений с высокими уровнями тревожности и страха, которые сходны с симптомами посттравматического стрессового расстройства. В свою очередь предположительно обладающие более консервативными кортико-амигдалярными входами стрессированные крысы линии НП также демонстрировали более выраженное, чем у линии ВП, уменьшение латентного периода реакции нейронов миндалины на стимуляцию инфралимбической коры по сравнению с нормой. Последнее может быть связано с вызванным стрессом повышением уровня возбудимости проецирующихся на миндалину кортикальных нейронов, которое, как установлено [Bloodgood et al., 2018], способствует процессу подавления реакции страха. Полученные нами данные в совокупности с изложенными выше сведениями из литературы позволяют предположить, что крысы линии НП обладают большей способностью подавлять реакцию страха в постстрессовый период, чем животные линии ВП. В определенной мере эти различия могут определяться характерными для линий ВП и НП спектрами вызванных стрессом эпигенетических изменений в клетках миндалины, запускающих формирование зависимых от нервной возбудимости патологических постстрессорных состояний [Дюжикова и др., 2015; Павлова, 2019]. В то же время получены результаты, демонстрирующие, что длительное эмоционально-болевое стрессорное воздействие через 24 ч после его окончания приводит к возрастанию уровня белка Н2AX – маркера двойных разрывов ДНК в клетках миндалины у высоковозбудимых животных линии НП и не вызывает изменений у низковозбудимых крыс линии ВП. В исследованиях Брэндона Д. Харе на мышах также показано, что длительный вариабельный стресс повышает уровень гамма-Н2AX в ядре ложа конечной полоски [Hare et al., 2018] – области мозга, которая структурно и функционально связана с миндалиной и принимает участие в реакции мозга на стрессорное воздействие [Walker et al., 2003].
Следует отметить, что степень дестабилизации ДНК обусловлена соотношением активности повреждающих и репарационных процессов [Wang, Lindahl, 2016]. Гормоны стресса индуцируют структурные повреждения ДНК за счет торможения процессов репарации, что было показано в исследованиях in vitro [Flint et al., 2007]. Ранее было обнаружено, что для высоковозбудимых крыс по сравнению с низковозбудимыми характерны повышенная стресс-реактивность ГАС и ускоренное развитие гормонального ответа [Ордян и др., 1998], что согласуется с упомянутыми выше данными. Возможно, у крыс линии НП механизм постстрессорного повышения уровня двойных разрывов ДНК обусловлен специфическим гормон-зависимым снижением репарационной активности по сравнению с линией ВП.
Ранее с использованием методов иммуногистохимии было показано, что у высоковозбудимых крыс в те же сроки после ДЭБС в клетках миндалины возрастает уровень общего метилирования ДНК и метилирования гистона Н3К9 [Павлова, 2019]. Известно, что формирование двойных разрывов ДНК сопряжено с повышением именно этих маркеров репрессивного хроматина, что может играть важную роль для его стабилизации и ремоделирования в целях создания эффективной матрицы для запуска механизма репарации ДНК [Ayrapetov et al., 2014; Gong, Miller, 2019].
Таким образом, продемонстрированное в работе усиление под действием стресса активности миндалевидного комплекса у крыс линии ВП по показателям частоты фоновой импульсной активности, среднему количеству импульсов и скорости реакции на кортикальное раздражение является, возможно, частью нейрофизиологического механизма формирования устойчивых постстрессорных поведенческих нарушений, связанных с низкой возбудимостью нервной системы, и напоминающих симптомы посттравматического стрессового расстройства, характерных для данной линии, что рассмотрено более подробно в обзоре А.И. Вайдо [Вайдо и др., 2018]. В то же время обнаруженное после ДЭБС в миндалине крыс линии НП более значительное по сравнению с линией ВП увеличение частоты фоновой нейрональной активности, сопровождаемой ростом иммунореактивности клеток к γ-H2AX phospho Ser139, а также значительное увеличение скорости вызванной кортикальной стимуляцией нейрональной реакции при неизменном количестве импульсов может отражать связанные с высокой возбудимостью нервной системы механизмы развития специфического постстрессорного патологического состояния (компульсивное расстройство).
ВЫВОДЫ
1. Выявлена связь базальной (фоновой) импульсной активности нейронов миндалевидного комплекса мозга крыс и уровня нестабильности их генома в норме, а также ответной реакции на возбуждающее влияние инфралимбической коры, с врожденным генетически детерминированным уровнем возбудимости нервной системы.
2. У низковозбудимых крыс линии ВП под влиянием длительного эмоционально-болевого стрессорного воздействия продемонстрировано усиление функциональной активности миндалевидного комплекса по показателям частоты фоновой импульсации нейронов, среднего количества и латентности импульсов в их реакции на кортикальное раздражение.
3. У высоковозбудимых крыс линии НП под влиянием стресса выявлено значительное усиление частоты фоновой нейрональной активности миндалины, сопровождаемой увеличением иммунореактивности клеток к маркеру двойных разрывов ДНК-γ-H2AX phospho Ser139, а также значительное уменьшение латентности, вызванной кортикальной стимуляцией нейрональной реакции, при неизменном количестве импульсов.
4. Выявленные особенности линий подтверждают их наследственно обусловленные различия по возбудимости ЦНС, могут определять предрасположенность к развитию постстрессорных патологических состояний тревожного спектра и лежать в основе механизмов их формирования.
Работа выполнена по Программе фундаментальных научных исследований государственных академий (ГП-14, разделы 64, 65) и частично по Программе фундаментальных исследований президиума РАН № 18 “Биомедицинские технологии: инновационные разработки”.
Список литературы
Айрапетянц М.Г., Вейн А.М. Неврозы в эксперименте и в клинике. М.: Наука. 1982. 272 с.
Александрова Н.П., Ширяева Н.В., Кратин Ю.Г., Лопатина Н.Г. Порог активации мозга у крыс, селектированных по возбудимости нервно-мышечного аппарата. Докл. АН СССР. 1981. 259: 1233–1235.
Бехтерева Н.П. Здоровый и больной мозг человека / Н.П. Бехтерева; под ред. С.В. Медведева. М.: АСТ; СПб : Сова; Владимир: ВКТ. 2010. 399 с.
Вайдо А.И., Енин Л.Д., Ширяева Н.В. Скорость проведения потенциалов действия по хвостовому и большеберцовому нервам у линий крыс, селектированных по возбудимости нервно-мышечного аппарата. Генетика. 1985. ХХI (2): 262–264.
Вайдо А.И., Ширяева Н.В., Хиченко В.И., Любославская П.Н., Старостина М.В. Развитие длительной посттетанической потенциации и изменение содержания белка S-100 в срезах гиппокампа крыс с различным функциональным состоянием нервной системы. Бюлл. эксперим. биологии и медицины. 1992. 113 (6): 645–648.
Вайдо А.И., Ширяева Н.В., Павлова М.Б., Левина А.С., Хлебаева Д.А.-А., Любашина О.А., Дюжикова Н.А. Селектированные линии крыс с высоким и низким порогом возбудимости: модель для изучения дезадаптивных состояний, зависимых от уровня возбудимости нервной системы. Лабораторные животные для научных исследований. 2018. 3:12–22.
Дюжикова Н.А., Даев Е.В. Геном и стресс-реакция у животных и человека. Экологическая генетика, 2018. 16 (1): 4–26.
Дюжикова Н.А., Скоморохова Е.Б., Вайдо А.И. Эпигенетические механизмы формирования постстрессорных состояний. Успехи физиологических наук. 2015. 45 (1): 47–74.
Левина А.С., Бондаренко Н.А., Ширяева Н.В., Вайдо А.И., Дюжикова Н.А. Наследственно обусловленное поведение ныряния у крыс как фактор приспособленности. Экологическая генетика. 2020. В печати.
Лопатина Н.Г., Пономаренко В.В. Исследование генетических основ высшей нервной деятельности. В кн.: Физиология поведения. Нейробиологические закономерности. Ред. А.С. Батуев. Л.: Наука. 1987. 9–59 с.
Любашина О.А., Ноздрачев А.Д. NO-зависимые механизмы амигдалокортикальных влияний. Доклады Академии наук. 2008. 421 (2): 282–285.
Любашина О.А., Пантелеев С.С., Ноздрачев А.Д. Амигдалофугальная модуляция вегетативных центров мозга. СПб: Наука. 2009. 211 с.
Ордян Н.Э., Вайдо А.И., Ракицкая В.В., Ширяева Н.В., Проймина Ф.И., Лопатина Н.Г., Шаляпина В.Г. Функционирование гипофизарно-адренокортикальной системы у крыс, селектированных по порогу чувствительности к электрическому току. Бюлл. эксперимент. биол. и мед. 1998. 125 (4): 443–445.
Павлова М.Б. Эпигенетические изменения в амигдале у крыс с различной возбудимостью нервной системы под влиянием эмоционально-болевого стресса. Журнал “Здоровье – основа человеческого потенциала: проблемы и пути их решения”. 2019. 14 (2): 713–723.
Пантелеев С.С., Багаев В.А., Ноздрачев А.Д. Кортикальная модуляция висцеральных рефлексов. СПб.: Изд-во С.-Петерб. ун-та, 2004. 207 с.
Arruda-Carvalho M., Clem R. L. Prefrontal-amygdala fear networks come into focus. Front. Syst. Neurosci. 2015. 9:145.
Ayrapetov M.K., Gursoy-Yuzugullu O., Xu C., Xu Y., Price B.D. DNA double-strand breaks promote methylation of histone H3 on lysine 9 and transient formation of repressive chromatin. Proc Natl Acad Sci U S A. 2014. 111 (25): 9169–9174.
Bloodgood D.W., Sugam J.A., Holmes A., Kash T.L. Fear extinction requires infralimbic cortex projections to the basolateral amygdala. Transl. Psychiatry. 2018. 8 (1): article number 60.
Cho J.H., Deisseroth K., Bolshakov V.Y. Synaptic encoding of fear extinction in mPFC-amygdala circuits. Neuron. 2013. 80 (6): 1491–1507.
Delli Pizzi S., Chiacchiaretta P., Mantini D., Bubbico G., Ferretti A., Edden R.A., Di Giulio C., Onofrj M., Bonanni L. Functional and neurochemical interactions within the amygdalamedial prefrontal cortex circuit and their relevance to emotional processing. Brain Struct. Funct. 2017. 222 (3): 1267–1279.
Du J., Johnson L.M., Jacobsen S.E., Patel D.J. DNA methylation pathways and their crosstalk with histone methylation. Nat. Rev. Mol. Cell Biol. 2015. 16 (9): 519–532.
Flint M.S., Baum A., Chambers W.H., Jenkins F.J. Induction of DNA damage, alteration of DNA repair and transcriptional activation by stress hormones. Psychoneuroendocrinology. 2007. 32 (5): 470–479.
Gong F., Miller K.M. Histone methylation and the DNA damage response. Mutat Res. 2019.780: 37–47.
Hare B.D., Thornton T.M., Rincon M., Golijanin B., King S.B., Jaworski D.M., Falls W.A. Two Weeks of Variable Stress Increases Gamma-H2AX Levels in the Mouse Bed Nucleus of the Stria Terminalis. Neuroscience. 2018. 373: 137–144.
Jalbrzikowski M., Larsen B., Hallquist M.N., Foran W., Calabro F., Luna B. Development of white matter microstructure and intrinsic functional connectivity between the amygdala and ventromedial prefrontal cortex: associations with anxiety and depression. Biol. Psychiatry. 2017. 82 (7): 511–521.
Kuo L.J., Yang L.X. Gamma-H2AX – a novel biomarker for DNA double-strand breaks. In Vivo. 2008. 22 (3): 305–9.
Lyubashina O., Panteleev S. Effects of cervical vagus nerve stimulation on amygdala-evoked responses of the medial prefrontal cortex neurons in rat. Neurosci. Res. 2009. 65 (1): 122–125.
Maroun M. Stress reverses plasticity in the pathway projecting from the ventromedial prefrontal cortex to the basolateral amygdala. Eur. J. Neurosci. 2006. 24(10): 2917–2922.
Mitra R., Jadhav S., McEwen B.S., Vyas A., Chattarji S. Stress duration modulates the spatiotemporal patterns of spine formation in the basolateral amygdala. Proc. Natl. Acad. Sci. U. S. A. 2005. 102 (26): 9371–9376.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates – 6th edition. – Ac.Press, 2007.
Peters J., Kalivas P.W., Quirk G.J. Extinction circuits for fear and addiction overlap in prefrontal cortex. Learn Mem. 2009. 16 (5): 279–288.
Phan K.L., Fitzgerald D.A., Nathan P.J., Tancer M.E. Association between amygdala hyperactivity to harsh faces and severity of social anxiety in generalized social phobia. Biol Psychiatry. 2006. 59 (5): 424–9.
Quirk G.J., Mueller D. Neural mechanisms of extinction learning and retrieval. Neuropsychopharmacology. 2008. 33 (1): 56–72.
Reznikov R., Bambico F.R., Diwan M., Raymond R.J., Nashed M.G., Nobrega J.N., Hamani C. Prefrontal Cortex Deep Brain Stimulation Improves Fear and Anxiety-Like Behavior and Reduces Basolateral Amygdala Activity in a Preclinical Model of Posttraumatic Stress Disorder. Neuropsychopharmacology. 2018. 43 (5): 1099–1106.
Roozendaal B., McEwen B.S., Chattarji S. Stress, memory and the amygdala. Nat. Rev. Neurosci. 2009. 10(6): 423–433.
Sierra-Mercado D., Padilla-Coreano N., Quirk G.J. Dissociable roles of prelimbic and infralimbic cortices, ventral hippocampus, and basolateral amygdala in the expression and extinction of conditioned fear. Neuropsychopharmacology. 2011. 36 (2): 529–538.
Stein M.B., Goldin P.R., Sareen J., Zorrilla L.T., Brown G.G. Increased amygdala activation to angry and contemptuous faces in generalized social phobia. Arch Gen Psychiatry. 2002. 59 (11):1027–1034.
Suberbielle E., Sanchez P.E., Kravitz A.V., Wang X., Ho K., Eilertson K., Devidze N., Kreitzer A.C., Mucke L. Physiologic brain activity causes DNA double-strand breaks in neurons, with exacerbation by amyloid-β. Nat.Neurosci. 2013. 16 (5): 613–621.
Vyas A., Jadhav S., Chattarji S. Prolonged behavioral stress enhances synaptic connectivity in the basolateral amygdala. Neuroscience. 2006. 143 (2): 387–393.
Walker D.L., Toufexis D.J., Davis M. Role of the bed nucleus of the stria terminalis versus the amygdala in fear, stress, and anxiety. Eur J Pharmacol. 2003. 463 (1–3): 199–216.
Wang J., Lindahl T. Maintenance of Genome Stability. Genomics, Proteomics & Bioinformatics. 2016. 14 (3): 119–121.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


