Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 5, стр. 682-695
Влияние пренатального и раннего постнатального введения вальпроата на поведение и цитологические характеристики крыс линии Wistar
В. Р. Гедзун 1, *, М. М. Свинов 2, Н. Ю. Сарычева 1, П. С. Шлапакова 3, К. О. Довбнюк 1, В. А. Дубынин 1
1 Московский государственный университет им. М.В. Ломоносова, Биологический факультет
Москва, Россия
2 Институт высшей нервной деятельности и нейрофизиологии РАН, Лаборатория функциональной нейроцитологии
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова, Факультет фундаментальной медицины
Москва, Россия
* E-mail: vrgedzun@gmail.com
Поступила в редакцию 23.03.2020
После доработки 14.05.2020
Принята к публикации 01.06.2020
Аннотация
Пренатальное введение вальпроевой кислоты (ВПК) и ее солей является распространенным способом моделирования нарушений развития нервной системы; последствия постнатального введения ВПК исследованы значительно меньше. В работе сопоставляются поведенческие характеристики двух групп детенышей крыс, подвергшихся пре- и постнатальному воздействию вальпроата натрия; использованы также нейроцитологические методы. Поведенческие исследования начинались с раннего постнатального периода и заканчивались в возрасте 36 дней. Сравнение моделей показало задержку раннего моторного развития и гиперактивность в обоих случаях, однако снижение интереса к новым социальным контактам (взаимодействие с крысятами своего возраста) наблюдалось лишь у животных, получавших инъекции ВПК постнатально. Кроме того, показано достоверное увеличение числа перинейрональных сателлитных олигодендроцитов в передней цингулярной коре животных как в серии с пренатальным, так и в серии с постнатальным введением ВПК. Изучение цингулярной коры, как компонента лимбической системы, важно при рассмотрении социальных взаимодействий, процессов формирования и регуляции эмоционального поведения, а также патологических реакций при различных нарушениях высших функций мозга.
ВВЕДЕНИЕ
Вальпроевая кислота (ВПК) и ее соли, в частности, вальпроат натрия, применяются для моделирования патологий развития нервной системы с конца XX века [Binkerd et al., 1988; Haberer, Pollack, 1994]. На сегодняшний день о механизмах, опосредующих широкий спектр действия ВПК на онтогенез ЦНС, известно многое. Главные среди этих механизмов – избыточная возбудимость молодых нервных клеток из-за инвертированного хлорного тока, опосредованного ГАМК-А рецепторами, и блокада гистоновых деацетилаз, которая приводит к нарушению экспрессии генов, ответственных за нормальное развитие систем органов, включая ЦНС. Также известно, что ВПК селективно ингибирует формирование тормозных ГАМКергических терминалей и повышает активность глутаматергических синапсов [Ingram et al., 2000; Kim et al., 2016].
Впервые побочные эффекты пренатального воздействия ВПК были выявлены в клинике: прием вальпроатов (в качестве антиконвульсантов) беременными женщинами с эпилептическим статусом существенно повышал вероятность развития значительного числа патологических изменений у детей, в совокупности названных фетальным вальпроатным синдромом. Среди них как серьезные тератогенные нарушения, так и психоэмоциональныe дисфункции, среди которых были отмечены симптомы расстройств аутистического спектра (РАС) [Williams et al., 2001].
Инъекция высокой дозы ВПК на ранних сроках эмбрионального развития крыс, а именно на 12–13-й день беременности, затрагивает органогенез, нарушает смыкание нервной трубки, формирование крупных структур мозга, оказывает эксайтотоксическое воздействие [Ingram et al., 2000]. В ряде работ показано, что даже однократное пренатальное введение ВПК приводит к тератогенным изменениям, нарушениям социального поведения, росту тревожности, гиперактивности, появлению стереотипий и депрессивно-подобных реакций; отмечены нарушения глутаматергической, ГАМКергической и окситоциновой систем мозга грызунов, а также проапоптотических процессов и синаптогенеза [Schneider, Przewłocki, 2005; Kim et al., 2016]. Существует множество данных о патологических изменениях гистологической структуры миндалины, гиппокампа, коры больших полушарий, а также отдельных глиальных клеток на фоне активации нейровоспалительных процессов [Kazlauskas et al., 2016; Nicolini, Fahnestock, 2018].
Так как крысы являются незрелорождающимися животными [Bayer et al., 1993], формирование нервной системы их детенышей завершается примерно на 10–14-й постнатальный день (ПНД). Таким образом, ранний постнатальный период детенышей крыс может рассматриваться как модель позднего эмбрионального развития человека. При постнатальном введении на 6–12-й день жизни, когда формирование макроструктур и органогенез в целом завершаются, ВПК воздействует преимущественно на тонкие процессы синаптогенеза, не вызывая ярко выраженных морфологических нарушений; при этом обнаруживаются патологии сенсорных процессов и моторных реакций [Reynolds et al., 2012]. В других моделях с постнатальным введением ВПК на более ранних сроках (2–4-й день) показаны нарушения социальных взаимодействий, повышение тревожности, количественное увеличение астроглии [Mony et al., 2014].
Анализируя имеющиеся литературные данные, можно сделать вывод, что вальпроатные модели вполне валидны в отношении исследования различных видов патологии социальных взаимодействий и раннего развития. Чаще всего введение вальпроата рассматривается именно как модель аутистических расстройств [Kim et al., 2016], поскольку помимо социальных нарушений обнаруживаются и другие ключевые особенности РАС, например, стереотипия и тревожность.
В последнее время в силу особенностей механизма действия данного фармакологического агента, а также гетерогенности проявлений РАС и сходства этой группы заболеваний с другими расстройствами психики, нередко квалифицируют последствия введения ВПК как генерализованную патологию развития ЦНС, в которой проявляется сходство как с аутизмом (социальные нарушения, отставание в раннем моторном развитии, избыточная локомоция в более позднем возрасте), так и, например, с синдромом дефицита внимания и гиперактивности (СДВГ) [Kim et al., 2016].
Сопоставление последствий введения ВПК на разных сроках развития поможет лучше понять механизм формирования задержки раннего моторного развития (которая также характерна для многих генетически предопределенных заболеваний) и патологии социального поведения (поиск “социальной новизны”), а также определить, какой этап развития ЦНС играет наиболее критическую роль при формировании социальных и моторных нарушений у экспериментальных животных.
Изучение цингулярной коры в рамках рассмотрения вальпроатных моделей представляется важным и актуальным, поскольку функции данной структуры связаны с координированием мотивационной и эмоциональной сфер [Allman et al., 2001], а нарушения деятельности цингулярной коры выявляются при таких патологиях, как биполярное расстройство, шизофрения, депрессия, аутизм [Bouras et al., 2001; Drevets et al., 2008].
МЕТОДИКА
Животные
Работа проводилась на белых крысах линии Wistar, которые содержались в стандартных условиях вивария со световым режимом 12/12 с доступом к пище и воде ad libitum. В работе было использовано потомство 9 самок (масса тела 250–300 г). Для получения потомства самок подсаживали к самцам (1 самец на 2 самки) на 7 дней, в течение которых для определения беременности у самок отбирали влагалищный мазок в период с 8.00 до 9.00.
Формирование экспериментальных групп
Для исследования пренатальных эффектов воздействия ВПК самки на сроке 12.5 дней беременности получали инъекцию натриевой соли вальпроевой кислоты (ВПК) в дозе 600 мг/кг. Впервые эта методика была предложена Rodier и соавт. [Rodier et al., 1997] и используется до настоящего времени. Самки, из потомства которых была сформирована контрольная группа, получали эквивалентный объем растворителя – физиологического раствора (ФР). После рождения детеныши самок, получавших ВПК, обозначались как группа “ВПК-пренат.”, а соответствующий контроль – “ФР-пренат.”.
Для исследования постнатальных эффектов ВПК самки в ходе беременности оставались интактными, затем новорожденных детенышей внутри каждого выводка делили на 2 группы – часть получала внутрибрюшинные инъекции ВПК в дозе 150 мг/кг, оставшиеся – эквивалентный объем физраствора. Инъекции проводились с 6-го по 12-й ПНД. Детеныши, получавшие ВПК, обозначались как группа “ВПК-постнат.”, а соответствующий контроль – “ФР-постнат.”. Данная модель разработана относительно недавно и охарактеризована в статье Reynolds и соавт. [Reynolds et al., 2012].
Количество животных по группам: (ФР.-пренат.) n = 14, (ВПК-пренат.) n = 15, (ФР-постнат.) n = 27, (ВПК-постнат.) n = 30. Соотношение самцов и самок ≈1:1, статистически значимых различий между детенышами по признаку пола выявлено не было. Количество животных, использованных в гистологическом эксперименте: первая серия с пренатальным введением ВПК, (ФР-пренат.) n = 6, (ВПК-пренат.) n = 6; вторая серия с постнатальным введением ВПК, (ФР-постнат.) n = 6, (ВПК-постнат.) n = 6.
Вещества
Вальпроат натрия (Sigma, Aldrich) растворяли в физиологическом растворе (стерильный 0.9% водный раствор NaCl для инъекций, Гротекс, Россия). Для пренатального внутрибрюшинного введения взрослым самкам крыс использовался раствор вальпроата с концентрацией 60 мг/мл, для детенышей в постнатальной модели был использован раствор с концентрацией 15 мг/мл.
Тесты на раннее двигательное развитие
Данная группа тестов была выбрана в связи с тем, что раннее моторное развитие человека является одним из ключевых показателей диагностики заболеваний, ассоциированных с нарушениями онтогенеза нервной системы. В частности, у детей с РАС моторные нарушения выявляются раньше, чем недостаточность коммуникативных и когнитивных навыков, и, возможно, являются одной из причин этой недостаточности [Bhat et al., 2012]. Описанные ниже тесты позволяют комплексно оценить нормальное поддержание позы, вестибулярные рефлексы и формирование нейронных связей, ответственных за локомоторные реакции. Следует отметить, что детеныши групп “ВПК-постнат.” и “ФР-постнат.” проходили тесты до инъекции ВПК в соответствующий день наблюдений тестирования с целью минимизировать острые эффекты препарата.
Отрицательный геотаксис. Детеныш помещается на наклонную поверхность головой вниз (сначала 15°, потом 30° градусов по отношению к поверхности земли), регистрируется время переворота головой вверх [Altman, Sudarshan, 1975].
Выход из круга. Детеныш помещается в центр круга диаметром 10 см, регистрируется время выхода за линию круга всеми четырьмя конечностями. Данный тест позволяет оценить развитие рефлекса ходьбы: до определенного момента детеныш совершает круговые движения на месте или медленно ползает и, только освоив ходьбу, быстро покидает круг (до 10 с) [Altman, Sudarshan, 1975].
Открытое поле. Тест проводился в стандартной малой арене (диаметр 63 см), предоставленной НПК “Открытая наука” [Open Field test (OpenScience, Russia, НПК Открытая Наука, Россия)]. Животное помещали в центр арены и в течение 3 мин регистрировали латентный период выхода из центра, подхода к стенке арены, двигательную активность в центре и на периферии арены, время, проведенное в центре и на периферии, а также количество стоек и умываний (эпизодов груминга).
Социальное поведение
Тест проводился в Т-образном лабиринте, сконструированном в лаборатории “Общей физиологии и регуляторных пептидов” биологического факультета МГУ. Данная методика основана на стремлении животных к новым социальным контактам. Как правило, крысы демонстрируют повышенный интерес к ранее незнакомым особям и проводят с ними больше времени. Однако при повышении тревожности или снижении социальной активности тестируемое животное может проявлять меньший интерес к ранее незнакомой особи или избегать социальных контактов, проводя большую часть времени независимо [Малышев, 2016]. Тестирование проводилось в течение 3 мин, производилась оценка времени, проведенного в стартовом отсеке (рис. 1, 1), рядом с детенышем из своего выводка, “сибсом” (рис. 1, 2, черный квадрат) и “чужаком” (рис. 1, 3, серый квадрат). Также измерялось количество актов груминга и обнюхиваний, совершавшихся рядом с сибсом и чужаком.
Рис. 1.
Схема установки “Т-образный лабиринт”, вид сверху: 1. Стартовый отсек установки без перегородки, отделяющей его от основного лабиринта. 2. Отсек с сибсом. 3. Отсек с детенышем из другого выводка. Пунктиром обозначены решетки, отделяющие отсеки 2 и 3 от других частей установки.
Fig. 1. Scheme of T-maze setup, top view: 1. Starting compartment of the setup, without a partition from the rest of the setup. 2. Compartment with sibling. 3. Compartment with a pup from another brood. Dotted lines represent metallic grids between compartments 2 and 3 and the rest of the setup.

Рис. 2.
Динамика становления рефлекса переворота в тесте “отрицательный геотаксис” под углом 15° (a) и (б) и 30° (в) и (г) в группах крысят с пренатальным введением ВПК (а), (в) и постнатальным введением ВПК (б), (г). По оси абсцисс – день жизни, по оси ординат – процент детенышей, выполнивших переворот за время тестирования. Здесь и далее ПНД – постнатальный день развития. Обозначения: * – p < 0.05, *** – p < 0.001 – по сравнению с группой с введением физраствора, по критерию Мантела–Кокса.
Fig. 2. Rotation reflex dynamics in “negative geotaxis test” on 15° (а), (б) and 30° (в), (г) in groups with prenatal (а), (в) and postnatal (б), (г) sodium valproate exposure. Horizontal axis represents postnatal development day (PND), vertical axes represents percentage of animals in each group, successfully performed the rotation on the angled surface. * – p < 0.05, *** – p < 0.001 – in comparison with saline group according to Mantel–Cox longrank test.
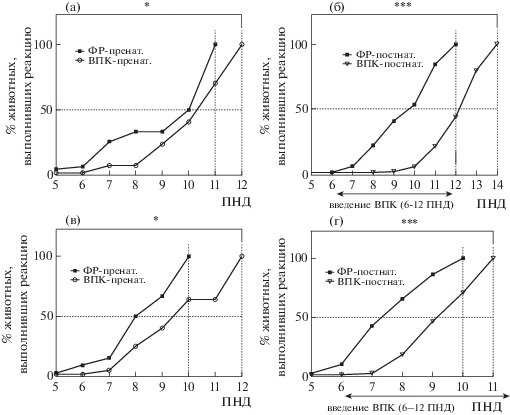
Рис. 3.
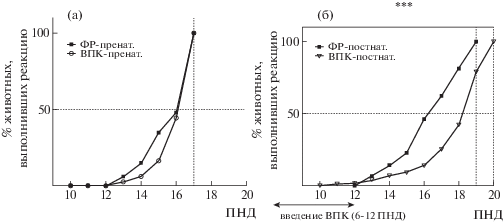
Динамика становления реакции выхода из круга в группах крысят с пренатальным введением ВПК (а) и постнатальным введением ВПК (б). По оси абсцисс – день жизни, по оси ординат – процент детенышей, выполнивших рефлекторную реакцию выхода из круга за 10 с. *** – p < 0.001 – по сравнению с группой с введением физраствора по критерию Мантела–Кокса.
Fig. 3. Dynamics of circle exit reaction development in groups with prenatal sodium valproate exposure (а); in groups with postnatal sodium valproate exposure (б). Horizontal axis represents postnatal development day (PND), vertical axes represents percentage of animals in each group, successfully performed the circle exit in 10 seconds. *** – p < 0.001 – in comparison with saline group according to Mantel–Cox longrank test.
Гистологические методы
На 60-й день жизни самцов крыс из групп “ФР-пренат.”, “ВПК-пренат.”, “ФР-постнат.” и “ВПК-постнат.” подвергали эвтаназии. Крыс вводили в глубокий невозвратный наркоз хлоралгидратом (внутрибрюшинно, 250 мг/кг). Проводили перфузию мозга промывочным изотоническим раствором NaCl (0.32 мл гепарина на 95 мл раствора), затем фиксирующим раствором (4% параформальдегид на 0.1 M фосфатном буфере).
После завершения перфузии животных декапитировали, голову на сутки помещали в фиксирующий раствор в холодильник (‒4°С…–8°С), после чего проводилось извлечение головного мозга из черепной коробки.
Затем на правое полушарие наносили метку для определения правильной ориентации при изготовлении препаратов, удаляли с помощью хирургического скальпеля все стволовые структуры, а также обонятельные луковицы.
После этого с помощью бинокуляра с оптической шкалой, ориентируясь по координатам из анатомического атласа [Paxinos, Watson, 2007], вырезали фрагмент, содержащий целевую область коры – переднюю цингулярную кору.
Затем полученные фрагменты отмывали холодным фосфатным буфером и погружали в новый фиксатор – 1% р–р ОsО4 на фосфатном буфере (в отношении 1:1) на 2 ч. После повторной отмывки фосфатным буфером препараты проводили по батарее спиртов: 50%, 70%, 96% С2Н5ОН (по 15 мин в каждом), абсолютный этанол (3 смены по 15–20 мин), абсолютный ацетон (3 смены по 15–20 мин). Затем препараты пропитывали в аралдите с абсолютным ацетоном (в соотношении 1:1) в течение 1 ч. Затем – в аралдите в течение суток. После этого следовала разливка по капсулам в свежий аралдит. Полимеризация алардита в термостате: 37° С – сутки, 60° С – 2 сут.
После затвердевания алардита проводили резку на ультратоме: толщина среза 0.5 микрон, окраска “в капле” в смеси 1% туллоидинового синего и 1% бурой (Na2B4O7) на предметных стеклах для последующего анализа состояния нейронов в световом микроскопе.
Подсчет осуществлялся в программе ImageJ на фотографиях гистологических срезов, изготовленных и окрашенных по методу Ниссля. Считали количество заметных на срезе тел нейронов (n-нейронов), а также количество ассоциированных с ними перинуклеарных олигодендроцитов (n-олигодендроцитов). Затем считали отношение: (n-нейронов)/(n-олигодендроцитов). Данный коэффициент показывает относительное количество перинуклеарных олигодендроцитов. Чем ниже коэффициент, тем больше количество перинуклеарных олигодендроцитов.
Статистический анализ
Полученные результаты обрабатывали на компьютере с помощью пакета статистических программ “Statistica V8.0” (Statsoft, США), “MS Office Excel 2013” (Microsoft, США) и “GraphPad Prism 6”. Вычисляли средние арифметические (AM), стандартные ошибки средних (SEM) и стандартные отклонения (SD) массивов данных. Для определения нормальности применялись критерии Шапиро–Уилка и Колмогорова–Смирнова, а также проводилась проверка равенства дисперсий. Статистическая обработка проводилась с использованием параметрических методов анализа (t-критерий Стьюдента для независимых выборок), а также однофакторного и двухфакторного дисперсионного анализа (one-way ANOVA, two-way ANOVA). Для выборок, не соответствующих нормальному распределению, использовали непараметрический статистический метод, критерий Манна–Уитни (для парных сравнений). Для сравнения динамики становления моторных рефлексов детенышей крыс был использован критерий Мантела–Кокса.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Раннее моторное развитие
Все тесты, направленные на оценку раннего развития животных, производили в течение нескольких дней (начиная с 5 ПНД) с целью проследить динамику становления моторных рефлексов.
Рефлекс “отрицательный геотаксис” заключается в стремлении детеныша, находящегося на наклонной плоскости головой вниз, перевернуться головой вверх. Проверка данного рефлекса проводилась в двух модификациях теста: под углом 15° и 30°. За момент “полуформирования” рефлекса принимался день жизни, в который он регистрировался у 50% детенышей группы; за момент полного формирования – день, в который у 100% детенышей группы наблюдалось выполнение исследуемой реакции.
Показано, что в группе крысят “ВПК-пренат.” наблюдается статистически значимое отставание в формировании рефлекса в тесте “отрицательный геотаксис” по сравнению с контролем. При наклоне в 15° стопроцентное формирование рефлекса в контрольной группе происходило на 11-й ПНД, в опытной – на сутки позже (рис. 2 (а)). При наклоне в 30° в контрольной группе момент “полуформирования” приходится на 8-й ПНД, полное формирование – на 10-й ПНД, в опытной группе – соответственно на 10-й ПНД и 12-й ПНД (отставание на 2 дня) (рис. 2 (в)).
В серии с постнатальным введением ВПК также обнаружено статистически значимое отставание опытной группы от контрольной по формированию этого рефлекса. При наклоне 15° к 10-му ПНД у 50% детенышей контрольной группы уже сформирован рефлекс переворота в тесте “отрицательный геотаксис”, в то время как в группе “ВПК-постнат.” – только у 4.5% детенышей. Момент “полуформирования” в опытной группе приходится на 12–13-й ПНД (отставание от контроля более чем на 2 дня). В контрольной группе 100% формирование рефлекса наблюдается на 12-й ПНД, в то время как в группе ВПК-постнат. – на 14-й ПНД (отставание на 2 дня) (рис. 2 (б)).
При наклоне в 30° “полуформирование” рефлекса в контрольной группе приходится примерно на 7–8-й ПНД, 100% формирование рефлекса в контроле приходится на 10-й ПНД, в опытной группе – соответственно на 9-й и 11-й ПНД (отставание на 1–2 и 1 день) (рис. 2 (г)).
В тесте “выход из круга” в серии с пренатальным введением ВПК статистически значимых различий между контрольной и опытной группой выявлено не было: “полуформирование” реакции приходится на 16-й ПНД, а 100% формирование – на 17-й ПНД (рис. 3 (а)). При этом в серии с постнатальным введением ВПК у детенышей контрольной группы момент “полуформирования” реакции выхода из круга пришелся на 16–17-й ПНД; все детеныши формируют данный рефлекс к 19-му дню жизни. У детенышей группы “ВПК-постнат.” процесс идет значимо медленнее: момент “полуформирования” реакции наступил на 1–2 дня позже – 18–19-й ПНД; 100%-ое формирование также отстает на сутки и приходится на 20-й ПНД (рис. 3 (б)).
Тест “открытое поле” (21 ПНД)
Мы не выявили различий между опытными и контрольными группами по суммарной локомоторной активности в данном тесте, однако были показаны отличия в динамике изменений пробега. Обнаружено, что в обеих сериях экспериментов у контрольных животных наблюдается снижение локомоторной активности на третьей минуте тестирования, по сравнению с первой (рис. 4 (а) и 4 (б)). У животных групп “ВПК-пренат.” и “ВПК-постнат.” не происходит подобного угасания локомоторной активности: количество пройденных секторов с первой по третью минуту значимо не различается (рис. 4 (а)). Более того, у животных группы “ВПК-постнат.” выявлено статистически значимое увеличение числа пройденных секторов на второй минуте тестирования по сравнению с первой (рис. 4 (б)).
Рис. 4.
Динамика изменений локомоторной активности животных, подвергшихся однократному пренатальному (а) и хроническому постнатальному (б) воздействию ВПК в тесте “открытое поле” (21 ПНД). α –p < 0.05 по сравнению с первой минутой для контрольной и опытной группы (two-way ANOVA, множественные сравнения по критерию Даннета). Данные представлены в виде среднего, планки погрешностей – в виде стандартной ошибки среднего. Вертикальная двигательная активность животных (“стойки”), подвергшихся однократному пренатальному (в) и хроническому постнатальному (г) воздействию ВПК в том же тесте. * – p < 0.05 по сравнению с группой с введением физраствора по критерию Манна–Уитни. Данные представлены в виде медиан, разброс в группах – в виде интерквартильного размаха. Латентный период первого подхода от центра арены животных, подвергшихся однократному пренатальному (д) и хроническому постнатальному (е) воздействию ВПК в том же тесте. * – p < 0.05 по сравнению с группой с введением физраствора, по t-тесту Стьюдента. Данные представлены в виде среднего, разброс в группах – в виде стандартной ошибки среднего.
Fig. 4. Locomotor activity of experimental animals for 3 minutes time bin in groups with single prenatal (а) and chronic postnatal (б) VPA administration in open field test (21 PND). α – p < 0.05 – differences shown in comparison with 1st min of testing two-way ANOVA Dunnett’s multiple comparison test in all experimental groups. Vertical locomotor activity (“rearings”) in groups with single prenatal (в) and chronic postnatal (г) VPA administration in open field test (21 PND). * – p < 0.05 in comparison with saline group according to Mann–Whitney test. Data shown as median, error bars represent interquartile range. Latency of first transition from the center of arena to the border in groups with single prenatal (д) and chronic postnatal (е) VPA administration in the same test. * – p < 0.05 in comparison with saline group according to Student’s t-test. Data shown as mean, error bars represent SEM.
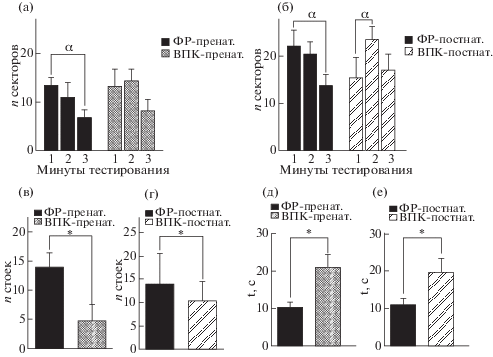
Кроме того, в группе “ВПК-пренат.” суммарная вертикальная двигательная активность (количество стоек) значимо снижена по сравнению с контролем (рис. 4 (в)). Группа “ВПК-постнат.” также значимо отличается по этому показателю от контрольных животных (рис. 4 (г)). Латентный период подхода к стенке арены открытого поля статистически значимо увеличен по сравнению с контролем как у крыс группы “ВПК-пренат.”, так и у крыс группы “ВПК-постнат.” (рис. 4 (д) и 4 (е)). Заметных различий в динамике вертикальной двигательной активности в ходе эксперимента как в модели с пренатальным, так и в модели с постнатальным введением вальпроевой кислоты обнаружено не было.
Социальное поведение (36 ПНД)
В группах контроля “ФР-пренат.” и “ФР-постнат.” наблюдалось ярко выраженное стремление крысят к новым социальным контактам: время, проведенное рядом с ранее незнакомым животным, в 1.37 и 1.69 (для пре- и постнатального введения соответственно) раза превысило время нахождения рядом с сибсом (рис. 5 (а) и 5 (б)); то же справедливо и для группы “ВПК-пренат.” (рис. 5 (а)). В сравнении с этим у детенышей, подвергшихся хроническому постнатальному воздействию вальпроата (группа “ВПК-постнат.”), время, проведенное в контакте с сибсом и чужаком, значимо не различается (рис. 5 (б); р = 0.7746 по one-way ANOVA, множественные сравнения по критерию Даннета).
Рис. 5.
Тест “социальное поведение с сибсом” (36 ПНД). Время, проведенное в лабиринте рядом с сибсом или чужим крысенком, в группе с однократным пренатальным введением ВПК (а) и хроническим постнатальным введением ВПК (б). Суммарное количество эпизодов груминга и обнюхиваний, совершенных рядом с сибсом и чужим крысенком, в группе с пренатальным введением ВПК (в) и постнатальным введением ВПК (г). Данные представлены в виде среднего, планки погрешностей – в виде стандартной ошибки среднего. α – p < 0.05, αα – p < 0.01, ααα – p < 0.001 (в контроле), α – p < 0.05, ββ – p < 0.01 (в группах с введением ВПК) – отличие от времени, проведенного в отсеке рядом с сибсом по сравнению с реакцией на сибса, по one-way ANOVA, множественные сравнения по тесту Даннета.
Fig. 5. Test for social interaction with sibling, 36 PND. Time spend near the sibling or unfamiliar pup in rats with single prenatal (а) or chronic postnatal (б) VPA administration. Total number of sniffing and grooming near the sibling or unfamiliar animal in the group with single prenatal (в) or chronic postnatal (г) VPA administration. Data shown as mean, error bars represents SEM. α – p < 0,05, αα – p < 0.01, ααα – p < 0.001 (vehicle groups), β – p < 0.05, ββ – p < 0.01 (groups with VPA administration) – in comparison with reaction on sibling differences between groups according to one-way ANOVA, multiple comparisons Dunnet’s multiple comparisons test.
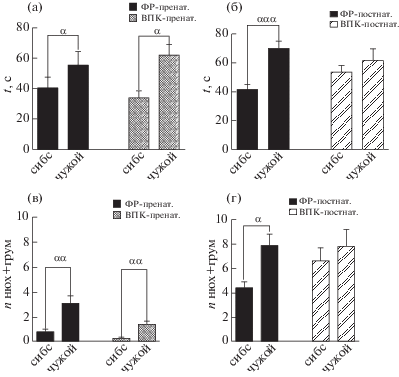
Животные контрольных групп в обеих сериях экспериментов совершают значимо больше обнюхиваний чужого крысенка, а также чаще умываются рядом с ним, чем рядом с сибсом. Такое же поведение демонстрируют и крысята группы с пренатальным введением ВПК (рис. 5 (в)). В группе “ВПК-постнат.” количество обнюхиваний и умываний рядом с чужаком значимо не отличается (рис. 5 (г)) от количества обнюхиваний и умываний рядом с сибсом. Суммарное количество умываний и обнюхиваний используется в качестве интегрального показателя и, как демонстрируют результаты наших предыдущих исследований, отражает общий уровень поведенческого взаимодействия и эмоциональности тестируемых детенышей крыс.
Гистологическое исследование (60 ПНД)
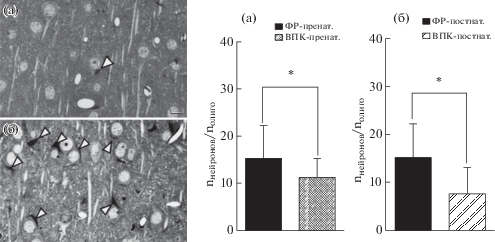
Важным аспектом работы стало гистологическое исследование передней цингулярной коры “вальпроатных” и контрольных крыс. Методом световой микроскопии было выявлено снижение отношения количества тел нейронов к количеству перинуклеарных сателлитных олигодендроцитов (рис. 6), т.е. увеличение доли данного типа глиальных клеток. Такое снижение наблюдалось как в группе с пренатальным введением ВПК (рис. 6 (а)), так и в группе с постнатальным введением ВПК (рис. 6 (б)), по сравнению с соответствующими контрольными группами.
Рис. 6.
Перинейрональные сателлитные олигодендроциты в образцах цингулярной коры в группе “ФР-пренат.” (а) и в группе “ВПК-пренат.” (б). Стрелками указаны олигодендроциты, располагающиеся рядом с телами нейронов. Фронтальный срез через цингулярную кору, окраска по Нисслю. Калибровка – 10 мкм. Отношение количества нейронов к количеству перинуклеарных олигодендроцитов в передней цингулярной коре в серии с пренатальным введением ВПК (в) и в серии с постнатальным хроническим введением ВПК (г) (60 ПНД). * – p < 0.05 по сравнению с группой с введением физраствора, по критерию Манна–Уитни. По оси ординат – количество нейронов/количество перинуклеарных олигодендроцитов. Данные представлены в виде медианы, разброс данных – в виде интерквартильного размаха.
Fig. 6. Perineuronal satellite oligodendrocytes in samples of cingulate cortex in groups “VEH-prenat.” (а) and “VPA-prenat.” (б). Red arrows show the oligodendrocytes near bodies of neurons. Frontal section through cingulate cortex, Nissl staining. Сalibration 10 µm. Neurons to oligodendrocytes ratio in the cingulate cortex of animals in series with prenatal VPA administration (в) and postnatal VPA administration (г) (60 PND). * – p < 0.05 in comparison with saline group difference from vehicle group according to Mann–Whitney test. Vertical axes represent ratio number of neurons to number of oligodendrocytes. Graphs represents median, error bars – interquartile range.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изменения моторных реакций
Полученные результаты указывают, что введение ВПК в обеих моделях приводит к нарушению становления ранних вестибуло-моторных рефлексов, в частности, рефлекса отрицательного геотаксиса при наклоне 15° и 30°. Выраженность данного отставания в модели с постнатальным введением ВПК была в среднем выше, чем в пренатальной модели. Только в модели постнатального введения ВПК проявилось негативное влияние препарата на реакцию “выхода из круга”. Формирование данной реакции (до уровня 50% и 100%) значимо замедляется в группе “ВПК-постнат.” в сравнении с показателями контрольной группы. Реакция “выхода из круга” позволяет оценить развитие ходьбы: пока у детеныша не сформирована локомоция, хоть в какой-то степени соответствующая возможностям взрослых животных, он совершает множество хаотичных движений конечностями, часто перемещается по кругу; когда двигательный комплекс ходьбы созрел, детеныш за несколько секунд (порой – за 1–2 с) покидает круг небольшого диаметра по прямой траектории [Altman, Bayer, 1980].
Известно, что ВПК в ходе эмбрионального развития ЦНС вызывает дисбаланс возбуждающих и тормозных процессов, снижая количество ингибирующих терминалей и повышая активность возбуждающих [Kim et al., 2016]. При этом многие моторные программы (в том числе ходьба) предполагают четко скоординированную схему взаимного возбуждения и торможения как в головном, так и в спинном мозге [McCrea, Rybak, 2008]. Можно предположить, что дисбаланс глутамат- и ГАМКергической трансмиссии приводит к замедлению созревания базовых нейронных контуров, более выраженному в постнатальной модели введения ВПК за счет непосредственного воздействия на процессы синаптогенеза. Нельзя полностью исключить и острые эффекты ВПК, нарушающие функционирование ГАМК-трансаминазы. В результате повышаются концентрация и время нахождения ГАМК в синаптической щели в значительном числе отделов ЦНС, что способно приводить к генерализованному торможению, в числе прочего, моторных реакций (но только в период введения ВПК – до 12-го ПНД включительно, еще до момента формирования ходьбы у основной части группы “ВПК-постнат.”).
Тест “открытое поле” с красным освещением направлен на изучение локомоторной и ориентировочно-исследовательской активности животных в новых условиях без дополнительных стрессогенных стимулов. Снижение количества пройденных секторов на вторую и третью минуты тестирования в контрольных группах “ФР-пренат.” и “ФР-постнат.” свидетельствует об угасании локомоторной активности, вызванной привыканием крысят (21 ПНД) к условиям экспериментальной установки. Отсутствие сходной динамики в группах “ВПК-пренат.” и “ВПК-постнат.” может быть следствием гиперактивности, индуцированной соответственно пре- и постнатальным введением ВПК. Гипер-активность является, в числе прочего, одним из самых распространенных симптомов детского аутизма. Наряду с описанными выше моторными реакциями, она может быть следствием долгосрочных нарушений деятельности ГАМКергической системы мозга [Blatt, Fatemi, 2011], существенного дисбаланса тормозных и возбуждающих терминалей в сторону усиления последних, как и в случае пациентов с РАС [Переверзева, Горбачевская, 2016].
Социальное поведение
Как уже указано в разделе “Введение”, вальпроатные модели валидны при изучении многих патологий раннего развития, однако чаще всего введение вальпроата рассматривается через призму моделирования аутистических расстройств [Kim et al., 2016]. В свою очередь характернейшим симптомом РАС являются нарушения социального поведения, что побудило нас к анализу соответствующих реакций экспериментальных животных.
По данным литературы, у потомства крыс, пренатально подвергшихся действию высокой дозы ВПК, нарушается один из ключевых аспектов зоосоциального поведения – “игровые” реакции сибсов [Schneider, Przewłocki, 2005]. Наша методика, помимо различных внутрисемейных поведенческих характеристик (параметров взаимодействия крысят одного выводка), позволяет изучать и другой компонент данной сферы – стремление к “социальной новизне”. Этот показатель дает оценку стремления детеныша к расширению внутривидовой активности, к новым контактам, выходящим за рамки родного выводка. Наиболее информативными параметрами, характеризующими поведение молодых крыс (36 ПНД) в использованном нами Т-образном лабиринте, оказались время, проведенное в непосредственной близости от сибса или незнакомого животного, и количество эмоционально окрашенных поведенческих актов, совершаемых в отсеках рядом с сибсом либо чужаком.
Согласно полученным данным, в серии с хроническим постнатальным введением у животных группы “ВПК-постнат.” какое-либо предпочтение “знакомой” или “незнакомой” особи действительно отсутствовало. Вместе с тем в группе “ВПК-пренат.” не наблюдалось заметного снижения стремления к “социальной новизне” в сравнении с контролем (как и в контрольных группах, контакты с чужаком реализовались значимо интенсивнее), что противоречит результатам, полученным ранее на пренатальных вальпроатных моделях многими исследователями [Bambini-Junior et al., 2014; Baronio et al., 2015; Dai et al., 2018]. Впрочем, единодушие в данной сфере все же отсутствует, и Štefánik и соавт. [2015] опубликовали работу, согласно которой стремление к контакту с незнакомым животным, напротив, повышается в результате пренатального введения вальпроевой кислоты.
Наиболее вероятным вариантом представляется ситуация, когда, несмотря на валидность пренатального использования ВПК для воспроизведения ключевых проявлений аутизма (социальные нарушения, стереотипии, гиперактивность), индуцированная вальпроатом симптоматика может быть снижена за счет обогащения среды – условий содержания животных и их участия в экспериментальных процедурах [Campolongo et al., 2018]. В нашем случае корректирующее влияние на выраженность реакций “социальной новизны” могло оказать проведение тестов на раннее моторное развитие. То, что такая коррекция распространилась только на группу “ВПК-пренат.”, видимо, свидетельствует о большей эффективности постнатальных инъекций, по времени частично совпавших с периодом изучения двигательного развития крысят. Ежедневное участие животных в экспериментальных процедурах в 5–18-й ПНД (см. рис. 2 и рис. 3) могло сыграть роль, аналогичную дополнительному внутривидовому (прежде всего, материнскому) грумингу, который за счет активации окситоцинергических механизмов способен в значительной степени нивелировать эффекты пренатального действия вальпроата [Dai et al., 2018]. Более высокая выраженность эффектов постнатально вводимого вальпроата зафиксирована нами и в тесте “открытое поле” (сравнение рис. 4 (а) и 4 (б), статистически значимое увеличение локомоторной активности на второй минуте в группе “ВПК-постнат.”, 21 ПНД).
Чтобы подтвердить или опровергнуть высказанное выше предположение, необходимо расширить набор используемых методов (к примеру, исследовать игровые реакции и степень агрессивности подопытных животных), а также в новых сериях экспериментов исключить тесты, предшествующие оценке социального поведения.
Гистологические изменения в передней цингулярной коре
Нарушение количества, состояния, проявлений активности различных типов глиальных клеток вовлечено в генез многих психиатрических и неврологических заболеваний.
Неоднократно показаны патологические изменения олигодендроглии, астроглии и микроглии как по данным клиники, так и в моделях in vivo [Bronzuoli et al., 2018; Tanti et al., 2018; Verkhratsky et al., 2019]. Исследования вклада олигодендроцитов в развитие дисфункций нервной системы преимущественно связаны с нарушениями миелинизации [Haroutunian et al., 2014; Bernhardi et al., 2016]. Однако известно, что олигодендроциты имеют несколько подгрупп, различающихся функционально и морфологически [Verkhratsky, Butt, 2013]. Перинуклеарные сателлитные олигодендроциты, увеличение числа которых зарегистрировано нами в передней цингулярной коре, окружают тела крупных, преимущественно глутаматергических нейронов. Роль этого типа глии не до конца изучена, однако по некоторым данным они участвуют в формировании внеклеточной среды; при патологиях отмечена их протекторная функция: предотвращение нейродегенеративных процессов, развивающихся вследствие повреждающих воздействий на ЦНС, например, ишемии или ремиелинизации после химического повреждения миелина [Ludwin, 1987; Dewar et al., 2003; Verkhratsky, Butt, 2013]. Согласно Vostrikov и соавт. [Vostrikov et al., 2007], снижение числа данного подтипа олигодендроцитов обнаружено при шизофрении, биполярном расстройстве, а также большом депрессивном расстройстве, что позволяет предположить их вовлеченность в патофизиологию указанных психических расстройств. В целом можно предположить, что наблюдаемое нами увеличение числа перинуклеарных олигодендроцитов связано с генерализованным ростом возбудимости ЦНС, индуцированным ВПК, и носит компенсаторный характер. Выраженность эффектов в моделях с пренатальным и постнатальным введением вальпроата в этом случае не различалась.
ЗАКЛЮЧЕНИЕ
Полученные в работе данные указывают на то, что задержка раннего моторного развития, а также гиперактивность, соответствующие важнейшим характеристикам детских психоэмоциональных расстройств, развиваются независимо от использованной модели введения вальпроевой кислоты. Нарушение социального взаимодействия (падение стремления к социальной новизне в ходе контактов с незнакомым детенышем того же возраста) выявлено у детенышей белых крыс только в случае серии с повторным постнатальным введением ВПК. Отсутствие в результате пренатальной инъекции вальпроата выраженных нарушений социального поведения может свидетельствовать о компенсаторной роли проводимых в первые две декады жизни животных экспериментальных процедур; для проверки данной гипотезы требуются дополнительные исследования. Важным и обладающим высоким уровнем новизны результатом стало описание увеличения числа перинуклеарных олигодендроцитов в передней цингулярной коре как в пренатальной, так и в постнатальной моделях введения ВПК. Этот факт не только еще раз подчеркивает валидность введения высоких доз вальпроевой кислоты в отношении моделирования психоэмоциональных патологий, но и позволяет подчеркнуть значимость перинуклеарных олигодендроцитов как маркера выраженности компенсаторных реакций нервной системы.
Работа поддержана Российским фондом фундаментальных исследований; номера проектов 18-315-00362 и 19-015-00345.
Список литературы
Малышев А.В. Экспериментальное моделирование расстройств аутистического спектра и депрессии; поиск путей пептидергической коррекции. Диссертация на соискание ученой степени кандидата биологических наук. Москва. 2014.
Переверзева Д.С., Горбачевская Н.Л. Нейробиологические маркеры ранних стадий расстройств аутистического спектра. Журнал высшей нервной деятельности им. И.П. Павлова. 2016. 66 (3): 289–301.
Электронный ресурс. Open Field test (OpenScience, Russia, НПК Открытая Наука, Россия). http://www.openscience.ru/index.php?page=ts&item=001&lang=en&lang=ru Дата обращения: 11.04.2019.
Altman J., Bayer S.A. Development of the brain stem in the rat. Thymidine-radiographic study of the time of origin of neurons of the lower medulla. J. Comp. Neurol. 1980. 194 (1): 1–35.
Allman J.M., Hakeem A., Erwin J. M., Nimchinsky E., Hof P. The Anterior Cingulate Cortex. Annals of the New York Academy of Sciences. 2006. 935 (1): 107–117. https://doi.org/10.1111/j.1749-6632.2001.tb03476.x
Bayer S.A., Altman J., Russo R.J., Zhang X. Timetables of neurogenesis in the human brain based on experimentally determined patterns in the rat. Neurotoxicology. 1993. 14: 83–144.
Bambini-Junior V., Zanatta G., Della Flora Nunes G., Mueller de Melo G., Michels M., Fontes-Dutra M., Nogueira V., Riesgobc F.R., Gottfried C. Resveratrol prevents social deficts in animal model of autism induced by valproic acid. 2014. Neuroscience Letters. 583: 176–181.
Baronio D., Castro K., Gonchoroski T., Mueller De Melo G., Nunes G.D.F., Bambini-Junior V., Gottfried C., Riesgo R. 2015. Effects of an H3R antagonist on the animal model of autism induced by prenatal exposure to valproic acid. PLoS ONE, 10 (1). https://doi.org/10.1371/journal.pone.0116363
Bernhardi von R. Glial cells in health and disease of the CNS. Cham, Switzerland: Springer Nature, 2016. 345.
Bhat A.N., Galloway J.C., Landa R.J. Relation between early motor delay and later communication delay in infants at risk for autism. 2012. Infant Behavior and Development. 35: 838–846.
Binkerd P.E., Rowland JM., Nau H., Hendrickx A.G. Evaluation of Valproic Acid, VPA Developmental Toxicity and Pharmacokinetics in Sprague-Dawley Rats. Fundamental and applied toxicology. 1988. 11:485–23.
Blatt G.J., Fatemi S.H. Alterations in GABAergic Biomarkers in the Autism Brain: Research Findings and Clinical Implications. 2011. Integr. Anat. Evol. Biol. 294: 1646–1652.
Bouras C., Kövari E., Hof P.R., Riederer B.M., Giannakopoulos P. Anterior cingulate cortex pathology in schizophrenia and bipolar disorder. 2001. Acta Neuropathologica, 102 (4): 373–379.
Bronzuoli M.R., Facchinetti R., Ingrassia D., Sarvadio M., Schiavi S., Steardo L., Verkhratsky A., Trezza V., Scuderi C. Neuroglia in the autistic brain: evidence from a preclinical model. Molecular Autism. 2018. I.9 (66).
Campolongo M., Kazlauskas N., Falasco G., Urrutia L., Salgueiro N., Höcht C., Depino A.M. Sociability deficits after prenatal exposure to valproic acid are rescued by early social enrichment. 2018. Molecular Autism. 9 (1). 36.
Dai Y.C., Zhang H.F., Schön M., Böckers T.M., Han S.P., Han J.S., Zhang R. Neonatal oxytocin treatment ameliorates autistic-like behaviors and oxytocin deficiency in valproic acid-induced rat model of autism. Frontiers in Cellular Neuroscience. 2018. 12. 355.
Dewar D., Underhill S.M., Goldberg M.P. Oligodendrocytes and ischemic brain injury. 2003. Journal of Cerebral Blood Flow & Metabolism. 23: 263– 274.
Drevets W.C., Savitz J., Trimble M. The subgenual anterior cingulate cortex in mood disorders. 2008. CNS Spectrums, 13 (8): 663–681.
Haberer L.J., Pollack G.M. Disposition and protein binding of valproic acid in the developing rat. 1994. Drug Metab Dispos. 22: 113–119.
Haroutunian V., Katsel P., Roussos P., Davis K.L., Altshuler L.L., Bartzokis G. Myelination, oligodendrocytes, and serious mental illness. 2014. Glia. 62 (11): 1856–1877.
Ingram J.L., Peckham S.M., Tisdale B., Rodier P.M. Prenatal exposure of rats to valproic acid reproduces the cerebellar anomalies associated with autism. 2000. Neurotoxicol. Teratol. 22: 319–24.
Kazlauskas N., Campolongo M., Lucchina L., Zappala C., Depino A.M. Postnatal behavioral and inflammatory alterations in female pups prenatally exposed to valproic acid. 2016. Psychoneuroendocrinology. 72: 11–21.
Kim K.C., Gonzales E.L., Lázaro M.T., Choi C.S., Bahn G.H., Yoo H.J., Shin C.Y. Clinical and neurobiological relevance of current animal models of autism spectrum disorders. 2016. Biomol. Ther. (Seoul). 24: 207–243.
Ludwin S.K. The function of perineuronal satellite oligodendrocytes: an immunohistochemical study. 1984. Neuropathology and Applied Neurobiology. 10 (2): 143–149.
McCrea D.A., Rybak I.A. Organization of mammalian locomotor rhythm and pattern generation. 2008. Brain Res. Rev. 57: 134–146.
Mony T.J., Lee J.W., Dreyfus C., DiCicco-Bloom E., Lee H.J. Valproic Acid Exposure during Early Postnatal Gliogenesis Leads to Autistic-like Behaviors in Rats. 2016.Clin. Psychopharmacol. Neurosci. 14: 338–344.
Nicolini C., Fahnestock M. The valproic acid-induced rodent model of autism. 2018. Experimental Neurology. 299(A): 217–227.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. 2007. Academic Press. 456.
Reynolds S., Millette A., Devine D.P. Sensory and motor characterization in the postnatal valproate rat model of autism. 2012. Dev. Neurosci. 34: 258–267.
Rodier P.M., Ingram J.L., Tisdale B., Croog V.J. Linking etiologies in humans and animal models: Studies of autism. 1997. Reproductive Toxicology. 11: 417–422.
Schneider T., Przewłocki R. Behavioral alterations in rats prenatally exposed to valproic acid: animal model of autism. 2005. Neuropsychopharmacology. 30: 80 – 89.
Štefánik P., Olexová L., Kršková L. Increased sociability and gene expression of oxytocin and its receptor in the brains of rats affected prenatally by valproic acid. 2015. Pharmacol. Biochem. Behav. 131: 42–50.
Tanti A., Kim J.J., Wakid M., Davoli M.A., Turecki G., Mechawar N. Child abuse associates with an imbalance of oligodendrocyte-lineage cells in ventromedial prefrontal white matter. 2018. Mol Psychiatry. 23 (10): 2018–2028.
Verkhratsky A., Butt A. Oligodendrocytes. In Glial Physiology and Pathophysiology. 2013. John Wiley & Sons, Ltd. pp. 245–319.
Verkhratsky A., Ho M.S., Vardjan N., Zorec R., Parpura V. General Pathophysiology of Astroglia. 2019. Adv. Exp. Med. Biol. 1175: 149–179.
Vostrikov V.M., Uranova N.A., Orlovskaya D.D. Deficit of perineuronal oligodendrocytes in the prefrontal cortex in schizophrenia and mood disorders. 2007. Schizophr. Res. 94: 273–280.
Williams G., King J., Cunningham M., Stephan M., Kerr B., Hersh J.H. Fetal valproate syndrome and autism: additional evidence of an association. 2001. Developmental Medicine & Child Neurology, 43 (3): 202–206.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


