Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 5, стр. 650-654
Влияние монодиет с разным содержанием триптофана на окрас раковины, поведение и нейронную активность виноградной улитки
Т. А. Палихова *
Кафедра психофизиологии, факультет психологии, Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: palikhova@mail.ru
Поступила в редакцию 30.01.2020
После доработки 17.02.2020
Принята к публикации 26.02.2020
Аннотация
Незаменимая аминокислота триптофан является предшественником серотонина, одного из наиболее значимых нейромодуляторов в мозге позвоночных и в нервной системе беспозвоночных животных. Известны многочисленные данные о влиянии экзогенного серотонина и его предшественников на поведение и нейронную активность. Менее изучено влияние триптофана, содержащегося в пищевых продуктах. В данной статье представлены результаты исследования влияния длительных монодиет, содержащих разные количества триптофана, на визуальные и поведенческие характеристики моллюска виноградной улитки Helix pomatia и Helix lucorum и на электрическую активность ее идентифицированных нейронов.
ВВЕДЕНИЕ
В статье представлены результаты исследования влияния длительных монодиет на визуальные и поведенческие характеристики моллюска виноградной улитки и на электрическую активность ее идентифицированных нейронов. Выбор монодиет для исследования основан на содержании в пище незаменимой аминокислоты триптофана. Триптофан является предшественником 5-гидрокситриптофана (5-HTP), непосредственного прекурсора серотонина (5-гидроокситриптамина, 5-HT). В диетологии рекомендуются диеты и биологически активные добавки (БАД), содержащие продукты с большим количеством триптофана и 5-HTP, повышающие тонус, улучшающие состояние при депрессиях, нарушениях памяти и сна. Биохимиками получены данные о содержании разных аминокислот в пищевых продуктах [Скурихин, Волгарев, 1987]. Приводятся исторические сведения о нарушениях здоровья при недостатке триптофана [https://lahtaclinic.ru/article/pellagra/]. Однако не все медики уверены в эффективности триптофана, поступающего с пищей [http://dietolog.org/components/tryptophan/], для коррекции поведения, и поэтому рекомендуется использование триптофана и 5-HTP в качестве биологически активных добавок (БАД). Использование диет и БАД основано на данных о механизмах действия серотонина и его предшественников, в том числе на нейронном уровне.
В нейробиологии серотонин рассматривается как один из важнейших нейромодуляторов, участвующий в когнитивных процессах, включая функциональные состояния, внимание, эмоции и память. Однако одновременное изучение влияния экзогенных предшественников серотонина на поведенческом и нейронном уровнях у высших животных затруднительно. В качестве модельных объектов для таких исследований используются беспозвоночные. Так, Нобелевская премия по физиологии и медицине в 2000 г. присуждена Э. Кэнделу за достижения в исследованиях процессов обучения на нейронном уровне и серотонина как необходимого элемента обучающейся системы [Kandel, 2000]. Подробный обзор литературы о влиянии экзогенного серотонина и его предшественников на поведение и нейронную активность беспозвоночных животных опубликован в сборнике [Дьяконова, Сахаров, 2019] и в статьях [Сахаров, 1990; Цыганов, Сахаров, 2002]. Д.А. Сахаров использует экспериментальные данные для обоснования концептуального “гетерона” [Сахаров, 1990]. На аплизии и виноградной улитке получены данные о роли серотонина в обучении [Кэндел, 1980; Балабан, 2017; Kandel, 2009; Kandel, 2000; Balaban, 2002]. В большинстве работ изучение функций серотонина и его предшественников проводилось при их экзогенном введении. Задачей нашего исследования было сравнение поведенческих показателей и результатов внутриклеточной регистрации при естественном поступлении триптофана с пищей у виноградных улиток, находившихся длительное время на монодиетах.
МЕТОДИКА
Получение данных о нейронных механизмах действия пищевого триптофана на высших позвоночных животных затруднительно, поэтому мы использовали в качестве модельного объекта наземного легочного моллюска, виноградную улитку. Виноградная улитка Helix pomatia и Helix lucorum – хорошо изученный объект нейробиологических исследований [Балабан, 1987; Сахаров, 1992]. Основным среди прочих преимуществ улитки является наличие идентифицируемых нейронов, позволяющее сравнивать электрическую активность одних и тех же нейронов в разных опытах [Иерусалимский и др., 1992].
Основанием для выбора монодиет, на которых виноградные улитки находились длительное время (до 2 лет), из общих для человека и улиток продуктов являлось содержание в них триптофана [Скурихин, Волгарев, 1987]. Таким образом, были выбраны три широко распространенных растительных продукта: морковь, бананы и яблоки. По данным таблицы из сборника Нестерина и Скурихина [1979], бананы и морковь содержат 45 и 42 мг триптофана на 100 г продукта, а яблоки – 12 мг. Содержание триптофана в моркови и яблоках различается в 3–4 раза. Бананы для третьей экспериментальной группы улиток были выбраны для проверки возможного влияния других, кроме триптофана, веществ на исследуемые параметры. Кроме того, для бананов существуют значительные расхождения в литературных данных. Другой пищи улитки не получали все время исследования.
Исследование поведения. На разных беспозвоночных доказана зависимость активности от уровня эндогенного серотонина [Балабан, 1987; Сахаров, 1990]. В наших экспериментах для сравнения уровня активности (5 уровней — от нахождения в раковине до максимально активного с вытянутыми щупальцами) за улитками трех групп велось систематическое наблюдение, результаты которого фиксировали в таблицах данных. Об активности улиток судили также по порогу пробуждения улиток в ответ на электростимуляцию через парные серебряные электроды, фиксированные на раковине. Группы улиток, находившихся на монодиетах, были обозначены: М (морковная), Б (банановая) и Я (яблочная). Кроме того, сравнивалось положение в террариумах “спящих” улиток (уровень 0) по отношению к источнику света (внизу – вверху). Статистическая обработка полученных данных (расчет средних значений, отклонений от среднего, ошибки среднего и достоверность полученных данных по критерию Стьюдента) проводилась в программе Microsoft Excel 97-2003.
Активность нейронов. Улиток, прошедших поведенческую проверку, препарировали для электрофизиологического исследования. Использовали два вида полуинтактных препаратов: “расщепленная нога” и “ЦНС – висцера”. Электрическую активность нейронов регистрировали внутриклеточно стеклянными микроэлектродами, заполненными хлоридом или цитратом калия. Электрическая стимуляция мантийного валика осуществлялась парными электродами импульсами (50 мс) стимулятора. Внутриклеточная стимуляция проводилась через регистрирующий микроэлектрод с помощью мостовой схемы усилителя (MES – 8201, Nihon Kohden). Регистрируемые сигналы после усиления и оцифровки фиксировали в программе Axon и анализировали в Mini Analysis Program (Synaptosoft 6.0.7, by Justin Lee 1997-99).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Визуальные параметры. Цвет раковины и выраженность ее рисунка достоверно различались у улиток, длительное время находившихся на морковной (М), банановой (Б) и яблочной (Я) монодиетах. По слепому тесту на визуальные различия случайных наблюдателей (около 20) просили разделить на две группы улиток (2 по 7 улиток), который они безошибочно выполняли для групп, состоящих из спящих улиток, содержащихся на М- и Б-диетах. Раковины банановых улиток были значительно светлее, а видовые различия в их окраске улиток H. pomatia (Подмосковье) и H. lucorum (Крым) практически полностью отсутствовали [Палихова, 2016]. Еще одной особенностью улиток группы Б было наличие в их выделениях нерастворимого в воде окрашенного вещества. Можно предполагать, что это связано с различием ферментов, утилизирующих каротин, однако биохимических задач мы перед собой не ставили. Различия в окраске раковин для улиток М и Я групп не выявлялись.
Поведение, активность. Однозначной зависимости между содержанием улиток на М-, Б- и Я-диетах и их активностью не выявлено. По положению в террариуме обнаружено незначительное предпочтение улитками группы Б более освещенного верхнего положения. Зависимости между уровнем активности улиток, содержащихся на морковной и банановой монодиетах, не обнаружено (Т-тест 0.6, p ≤ 0.05) . Различий активности по порогу пробуждения также не выявлено (8.1 В и 7.6 В, n = 20).
Внутриклеточная активность нейронов. Зарегистрирована активность нейронов париетальных ганглиев 56 улиток, находившихся более полугода на М (28), Б (17) и Я (27) диетах. Активность нейронов сравнивалась по стандартным показателям: значение мембранного потенциала (МП, мВ), наличие фоновой спайковой активности и ее тип (синаптические и\или пейсмекерные ПД, А-спайки), порог генерации потенциала действия ПД и пейсмекерной спайковой активности (нА). Проверялось наличие реакции на механо- и/или электросенсорные стимулы. Определялись: МП (мВ), порог ПД (нА), порог пейсмекерной спайковой активности (нА), максимальная амплитуда суммарного синаптического ответа на электрокожное раздражение (сВПСП, мВ) (рис. 1).
Рис. 1.
Электрическая активность нейронов улиток 3 групп (М – морковная диета, n = 29, Б – банановая диета, n = 12, Я – яблочная диета, n = 27). Сравнение нейронов трех групп по мембранному потенциалу (а) и по значению порогового внутриклеточного тока (нА) для генерации ПД и спайковой пейсмекерной активности (б). (в) – суммарные кривые привыкания амплитуды сВПСП в сериях ритмической (0,1 Гц) электросенсорной стимуляции мантийного валика. Эффект гетеросинаптической потенциации зарегистрирован в 23 нейронах М-группы и в 8 нейронах Я-группы. Экстрастимул (стрелка) – укол ноги в серии ритмического раздражения мантии, разброс данных — ошибки среднего. Восстановление ответа нейрона тестировалось (тест) через 2 мин (2 мин) после серии ритмической стимуляции.
Fig. 1. Electrical activity of snails’ neurons from carrot (М, n = 29), bananas (Б, n = 12) and apples (Я, n = 27) diets. (а) – membrane potential (mV), (б) – meanings of the threshold of intracellular current (нА, nA) for AP generation and for spike pacemaker activity. (в) – habituation curves for synaptic responses evoked by rhythmical (0.1 Hz) electro-sensory stimulation of mantle. Heterosynaptic potentiation has been observed in 23 neurons of M-group of snails and in 8 neurons of Я-group. An extra-stimulus (arrow) was a shot to the foot; deviations are the errors of mean. Recovery of responses were tested (тест) after 2 min (2 мин) from rhythmic stimulation series.
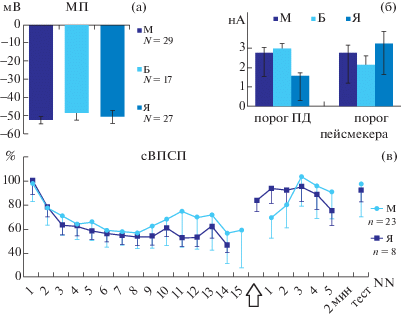
Достоверных различий между активностью нейронов улиток М-, Б- и Я-групп обнаружено не было. Так, средние значения МП нейронов всех групп составляли около 50 мВ (рис.1 (а)). Нейроны, известные как командные для оборонительного поведения [Балабан, 1987], были типично молчащими с порогом ПД 1–4 нА и при больших значениях внутриклеточного тока генерировали спайковую пейсмекерную активность. Разброс пороговых средних значений для нейронов трех групп улиток объясняется различиями между идентифицированными нейронами подглоточного комплекса ганглиев и не выходит за пределы отклонений от среднего (рис. 1 (б)). Синаптические потенциалы возникали как в фоне, так и в ответ на механо- и электросенсорную стимуляцию разных участков тела на полуинтактных препаратах улитки (суммарные возбуждающие постсинаптические потенциалы, сВПСП, cEPSPs). Параметры вызванных ответов не отличались от известных [Иерусалимский и др., 1992]. Крупные нейроны в вентральной области париетальных ганглиев проявляли типичную для этих идентифицированных нейронов фоновую активность пейсмекерного, синаптического и смешанного типа. В ППа6, ППа7 и в ЛПа6-нейронах регистрировались типичные для этих нейронов аксонные спайки (А-спайки).
Так как влияние серотонина рассматривается в связи с его участием в процессах обучения [Балабан, 2017; Kandel, 2009], мы провели проверку хорошо изученных феноменов пластичности синаптических ответов париетальных нейронов [Палихова и др., 2019; Sokolov, Palikhova, 1999]. Первоначальные данные показали типичную динамику привыкания суммарных синаптических ответов. Не столь однозначны данные о влиянии надпороговой гетеросинаптической стимуляции на амплитуду сВПСП в серии ритмической электростимуляции мантийного валика. Эффект гетеросинаптической потенциации [Абрамова и др., 2007; Палихова, Пивоваров, 2016] наблюдался в 23 нейронах М-улиток из 29 нейронов в группе и в 8 нейронах Я-улиток из 27 нейронов в группе. Показано, что гетеросинаптическая потенциация возникает чаще в нейронах М-группы (около 80%), чем в нейронах Я-группы около (30%). Однако это предварительные данные, требующие проверки, так как использованный в качестве экстрастимула укол ноги трудно стандартизировать. С уверенностью можно говорить о том, что гетеросинаптическая потенциация регистрируется в нейронах обеих групп улиток, хотя и с разной частотой и динамикой (рис. 1 (в)).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ И ЗАКЛЮЧЕНИЕ
Таким образом, значимых различий как по поведенческим критериям, так и по нейронной активности у улиток, содержащихся длительное время на разных монодиетах, мы не нашли. В яблоках содержится в 3–4 раза меньше триптофана, чем в моркови и бананах, тем не менее явные внешние различия (окраска раковины) наблюдались только у улиток на банановой монодиете [Palikhova, 2016]. Это может быть связано с процессами метаболизма каротина, однако биохимических задач мы в наших экспериментах не ставили. Результаты внутриклеточного исследования идентифицированных нейронов улитки достоверно не отличались для улиток из 3 групп монодиет, а также от известных ранее данных [Иерусалимский и др., 1992]. Полученные данные поддерживают представление некоторых медиков о малом значении пищевого триптофана для обеспечения нормального метаболизма серотонина [https://healthylife.nsp.com/], однако вывод этих авторов о необходимости употреблять БАД мы не разделяем. В качестве перспективы предполагается продолжение исследований нейрональной пластичности для объяснения данных о роли экзогенного триптофана в индивидуальных различиях процессов кратковременной памяти и внимания.
Итак, значительных различий между улитками, содержащимися длительное время на монодиетах, содержащих разное количество триптофана, мы не обнаружили как по поведенческим критериям, так и по параметрам активности идентифицированных нейронов.
Список литературы
Абрамова М.С., Палихова Т.А., Пивоваров А.С. Гетеросинаптическая потенциация холинергических возбуждающих постсинаптических ответов командных нейронов виноградной улитки. Журн. высш. нерв. деят. им. И.П. Павлова. 2007. 57 (5): 588–596.
Балабан П.М. Механизмы оборонительного поведения: исследование простой нейробиологической модели. Журн. общ. биол. 1987. 48 (3): 340–349.
Балабан П.М. Молекулярные механизмы модификации памяти. Журн. высш. нерв. деят. им. И.П. Павлова. 2017. 67. (2): 131–140.
Дьяконова В.Е., Сахаров Д.А. Пострефлекторная нейробиология поведения. М: Изд. дом ЯСК. 2019. 592 с.
Иерусалимский В.Н., Захаров И.С., Палихова Т.А., Балабан П.М. Нервная система и картирование нейронов брюхоногого моллюска Helix lucorum L. Журн. высш. нерв. деят. им. И.П. Павлова. 1992. 42 (6): 1075–1089.
Кэндел Э.Р. Клеточные основы поведения. М.: Мир. 1980. 598 с.
Нестерин М.Ф., Скурихин И.М. Химический состав пищевых продуктов. Справочные таблицы содержания аминокислот, жирных кислот, макро- и микроэлементов, органических кислот и углеводов. М.: Пищевая промышленность, 1979. табл. 246 с.
Палихова Т.А. Влияние монодиеты на крымских и подмосковных виноградных улиток. XII Междисциплинарный конгресс. Россия, Крым, 1–11 июня 2016, 314–315.
Палихова Т.А., Пивоваров А.С. Спонтанные ВПСП командных нейронов виноградной улитки при гетеросинаптической потенциации. Журн. высш. нервн. деят. им. И.П. Павлова. 2016, 66 (3): 361–366. https://doi.org/10.7868/S0044467716030096
Палихова Т.А., Соколов Е.Н., Черноризов А.М. Пластичность синапсов улитки в субсекундном временном интервале. Междунар. научно-исслед. журн. 2019. 3 (81): 151–154. https://doi.org/10.23670/IRJ.2019.81.3.030
Пeллaгpa. 2018. https://lahtaclinic.ru/article/pellagra/
Сахаров Д.А. Долгий путь улитки. Журн. высш. нервн. деят. им. И.П. Павлова. 1992. 42 (6): 1059–1063.
Сахаров Д.А. Интегративная функция серотонина у примитивных Metazoa. Журн. общ. биол. 1990. 51 (4): 447–449.
Симптомы дефицита триптофана. http://dietolog.org/components/tryptohan/
Скурихин И.М., Волгарев М.Н. (ред.) Химический состав пищевых продуктов: Кн. 2. 2 изд., М: Агропромиздат. 1987. 360 с.
Триптофан, действие. https://healthylife.nsp.com/2019/10/31/
Цыганов В.В., Сахаров Д.А. Серотонин-зависимое переподчинение респираторного ритма центральному генератору локомоции у легочного моллюска Limnaea. Докл. Акад. наук. 2002. Т. 382. № 4. С. 554.
Balaban P.M. Cellular mechanisms of behavioral plasticity in terrestrial snail. Neurosci. Biohev. Rev. Pergamon Press Ltd. (United Kingdom). 2002. V. 26. № 5. P. 597–630.
Kandel E.R. The Nobel Prize in Physiology or Medicine 2000. http://nobelprize.org/prizes/medicine/2000/kandel/lecture/
Kandel E.R. The biology of memory: forty-year perspective. J. Neurosci. 2009. V. 29. № 41. 12748–12756 pp.
Palikhova T.A. Influence of the carrot and banana monodiets to background neuronal activity of the edible snail. In: Simpler Nervous Systems. XI East European Conf. of the International Society for Invertebrate Neurobiology. Russia. Zvenigorod. 2016. P. 64.
Sokolov E.N., Palikhova T.A. Immediate plasticity of identifiable synapses in the land snails Helix lucorum. Acta Neurobiol. Exp. 1999. V. l. № 59. P. 161–169.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


