Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 5, стр. 616-634
Ритмическая активность мозга человека, связанная с движением звуковых стимулов
Л. Б. Шестопалова 1, *, Е. А. Петропавловская 1, В. В. Семенова 1, Н. И. Никитин 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: shestopalovalb@infran.ru
Поступила в редакцию 23.03.2020
После доработки 19.05.2020
Принята к публикации 01.06.2020
Аннотация
Исследовалась вызванная ритмическая активность мозга, лежащая в основе реакции на движение звукового стимула (motion-onset response, MOR). Запись ЭЭГ проводилась в условиях либо активной, либо пассивной локализации движущихся стимулов здоровыми испытуемыми. Анализировалось влияние направленности внимания слушателя и скорости движения стимула на суммарный ответ (MOR), а также на вызванное спектральное возмущение (event-related spectral perturbation, ERSP) и фазовую когерентность (inter-trial phase coherence, ITC). Пассивная локализация движущихся стимулов вызывала фазовую реорганизацию активности в дельта-альфа-диапазоне. При максимальной скорости движения наблюдались индуцированные слабо когерентные колебания. Привлечение внимания к движению звука сильнее отражалось на ритмической активности, чем на суммарной реакции. Активная локализация сопровождалась фазовой подстройкой и усилением дельта-тета-колебаний после начала движения, а также появлением колебаний, не синхронизированных по фазе с началом движения стимула.
Электрическая активность мозга человека, обеспечивающая локализацию источника звука, традиционно исследовалась путем усреднения отдельных эпох ЭЭГ, связанных с определенными слуховыми событиями, для получения вызванных потенциалов (event-related potentials, ERPs). Вызванные потенциалы (ВП) в реакциях на пространственное смещение в пределах непрерывного звукового сигнала были описаны при регистрации ЭЭГ/МЭГ [напр., Mäkelä, McEvoy, 1996; Magezi, Krumbholz, 2010; Briley et al., 2012]. Современный подход к изучению нейрональных механизмов слуховой обработки движения звука предполагает использование сигналов с разнесением во времени момента включения звука и начала его движения. Это позволяет раздельно исследовать вызванный ответ на движение (motion-onset response, MOR) и неспецифический ответ на включение звука. Ответ на начало движения состоит из раннего негативного компонента (“change”-N1, cN1) и позднего позитивного колебания (“change”-P2, cP2) [Варфоломеев, Старостина, 2006; Krumbholz et al., 2007]. Он отличается структурно и топографически от ответа на включение звука и рассматривается в качестве электрофизиологического коррелята процесса локализации движущегося стимула [Getzmann, 2009]. Ответ на начало движения имеет большую латентность относительно вызвавшего его события, чем ответ на включение, и сильнее выражен в отведениях от полушария, контралатерального направлению движения звука [Getzmann, 2011]. Параметры MOR зависят от различных свойств стимула, таких как скорость и направление движения, а также от вида локализационных признаков [Getzmann, 2009; Getzmann, Lewald, 2010a,b], и тесно коррелируют с уровнем субъективного различения движущихся стимулов [Getzmann, 2009; Getzmann, Lewald, 2010a]. Однако существующих данных недостаточно для ответа на вопрос о том, в какой мере обработка движения звука зависит от нисходящего (top-down) когнитивного контроля. Единственное исследование влияния направленности внимания показало увеличение поздней части MOR, без каких-либо изменений волны cN1 [Kreitwolf et al., 2011]. Поскольку усредненные по эпохам ВП в принципе отражают большей частью синхронизированную с событиями активность мозга [Herrmann et al., 2005], можно предположить, что проявление нисходящих процессов следует искать в колебательной активности отдельных эпох.
Относительно ритмической активности мозга, лежащей в основе локализационных процессов, имеется достаточно ограниченный объем сведений. Формирование компонентов вызванного суммарного ответа на любое слуховое событие происходит при сочетании трех процессов: 1) фазовой подстройки действующих мозговых ритмов; 2) генерации вызванной активности; 3) фазовой подстройки вызванных колебаний [Klimesh et al., 2007]. Связанную со стимулом колебательную активность принято подразделять на индуцированную (induced) и вызванную (evoked). Индуцированная активность коррелирует со стимуляцией, но не имеет четкой фазовой привязки к началу стимула, в то время как вызванная активность строго синхронизирована по фазе с моментами начала слуховых событий в каждой эпохе [Herrmann et al., 2005]. Колебательная модель мозговой активности основана на базовом предположении, что исходно равномерное фазовое распределение на множестве эпох ЭЭГ может смениться распределением с преобладающим значением фазы в течение короткого времени после стимуляции [Makeig et al., 2002]. Синхронизированная с событием подстройка фазы (phase resetting, phase alignment) оценивается по величине фазовой когерентности отдельных эпох (inter-trial phase coherence, ITC) [Makeig et al., 2004]. ITC представляет собой независимый от амплитуды колебаний показатель, способный выявить фазовое согласование даже очень слабых колебаний.
Данный подход неоднократно применялся в различных экспериментальных условиях, особенно при изучении избирательного внимания [напр., Costa-Faidella et al., 2017; обзоры Engel et al., 2001; Womelsdorf, Fries, 2007; Haegens et al.,2018; Zoefel et al., 2018]. В целом фаза медленных колебаний может отражать механизмы сенсорной обработки более точно, чем амплитуда тех же колебаний [VanRullen et al., 2011; Arnal, Giraud, 2012; Ng et al., 2012; Wöstmann et al., 2016]. Существует предположение, что медленные ритмы обеспечивают базовую колебательную основу обработки периодической стимуляции [Schroeder, Lakatos, 2009; Stefanics et al., 2010]. В слуховой модальности частотно-временные представления вызванной активности обычно характеризуются выраженной фазовой синхронизацией в тета-альфа-диапазоне [Weisz, Obleser, 2014]. С другой стороны, альфа-колебания часто рассматривают как активность без фазовой подстройки, связанную надмодальными механизмами высокого порядка, контролирующими направленность внимания [Klatt et al., 2018].
Другой показатель динамики ЭЭГ отражает модуляции спектральной мощности, связанные с экспериментальными событиями, и носит название “вызванное спектральное возмущение” (event-related spectral perturbation, ERSP) [Makeig et al., 2004]. В исследованиях слуха анализ ERSP успешно применялся в различных экспериментальных парадигмах [напр., Fuentemilla et al., 2006; Hsiao et al., 2009; Fuentemilla et al., 2008; Bishop, Hardiman, 2010].
Настоящее исследование представляет первую попытку выяснить, какие изменения колебательной активности мозга могут быть вызваны движением звукового стимула. Колебания, лежащие в основе реакции на движение звука (MOR), до сих пор не были описаны, а функциональная взаимосвязь между дельта-, тета- и альфа-ритмами при восприятии движения остается невыясненной. Опираясь на имеющиеся сведения о свойствах MOR, мы предположили, что рост его величины с увеличением скорости определяется не только параметрами стимула, но и направленностью внимания слушателя. Наши предыдущие исследования показали, что динамические пространственные свойства могут учитываться в процессе обработки движущегося стимула наряду с информацией о положении концов траектории [Shestopalova et al., 2012]. Парадигма отсроченного движения, в которой все стимулы имеют одинаковое положение начальных и конечных точек траекторий, позволяет свести к минимуму различия между активируемыми движением стимула нейрональными популяциями, настроенными на разные величины межушной задержки либо чувствительными к ее изменению. Поэтому можно предположить, что в этой парадигме фазовая когерентность будет сильнее зависеть от скорости стимула, чем спектральная мощность. Эксперимент был направлен на решение следующих вопросов: 1) вызывает ли движение звукового стимула фазовую подстройку медленных ритмов; 2) индуцируют ли движущиеся стимулы слабо когерентную активность; 3) сопровождается ли активная локализация движущихся стимулов простым сенсорным усилением (sensory gain) или дополнительной генерацией нейрональной активности, связанной с фокусировкой внимания на движение стимулов. Сравнивались спектральная мощность и фазовая подстройка колебаний, составляющих основу MOR, в условиях активного и пассивного прослушивания.
МЕТОДИКА
Условия эксперимента и испытуемые. В экспериментах приняли участие 13 испытуемых с нормальным слухом в возрасте от 22 до 42 лет (2 мужчин и 11 женщин, все праворукие). Все исследования проведены в соответствии с принципами Хельсинкской декларации 1964 г. и ее последующих обновлений, и одобрены Этическим комитетом Санкт-Петербургского государственного университета. Каждый участник представил письменное информированное согласие, подписанное им после разъяснения ему характера предстоящего исследования.
До начала экспериментов все испытуемые прошли стандартную процедуру аудиометрии. Звуковые сигналы предъявлялись испытуемым дихотическим способом. Исследование проведено в двух экспериментальных условиях: пассивное прослушивание (без привлечения внимания к звуковым стимулам) и активное прослушивание (с привлечением внимания). Испытуемые располагались в кресле внутри экранированной звукоизолированной камеры. При пассивном прослушивании стимулов испытуемые читали книгу по своему выбору. В активных условиях слушатели должны были сосредоточить внимание на пространственном положении звуковых сигналов и отмечать их траектории на графическом планшете.
Стимулы. Детальное описание звуковой стимуляции опубликовано в нашей предыдущей работе [Шестопалова и др., 2016]. Дихотические звуковые сигналы предъявлялись с помощью звукоизлучателей Etymotic ER-2 (Etymotic Research Inc., США). Сигналами служили отрезки белого шума полосой 100 – 1300 Гц. Длительность всех звуковых посылок составляла 2000 мс, не считая фронтов нарастания и спада длительностью по 10 мс, сглаженных косинусоидальной функцией. Пространственное положение сигналов задавалось величиной межушной задержки ΔT между бинаурально предъявляемыми сигналами. В экспериментах использовались четыре типа звуковых стимулов, условно обозначенных как “неподвижный”, “медленный”, “быстрый” и “скачок” (подробная схема дана в [Шестопалова и др., 2016]). Неподвижным стимулом служил сигнал с ΔT = 0, вызывающий ощущение неподвижного звукового образа по средней линии головы. Стимулы “быстрый” и “медленный” состояли из трех последовательных участков: начального участка с ΔT = 0 длительностью 1000 мс, последующего участка линейного нарастания ΔT от 0 до ±800 мкс длительностью 200 мс или 400 мс, и конечного участка с постоянной ΔT = ±800 мкс длительностью 800 или 600 мс соответственно. Данные сигналы вызывали сначала ощущение неподвижного звукового образа по средней линии головы, а затем его плавного движения влево или вправо от средней линии головы. Расчетные скорости движения быстрого и медленного стимулов составляли 450 град/с и 225град/с соответственно.
Стимул “скачок” вызывал ощущение неподвижного звукового образа по средней линии головы в начале действия сигнала, а затем его мгновенного перемещения влево или вправо от средней линии за счет скачкообразного изменения ΔT от 0 до ± 800 мкс. Изменение задержки происходило в середине сигнала через 1000 мс после его включения. Стимулы такого вида рассматриваются как движение с максимально возможной скоростью [Shestopalova et al., 2012].
Процедура эксперимента. На предварительном этапе каждого эксперимента у всех испытуемых измеряли пороги слышимости обоих ушей. Интенсивность сигналов устанавливалась на уровне 50 дБ над порогом слышимости каждого уха испытуемого. Все серии состояли из 120 стимулов, из которых 40 были неподвижными, а 40 левосторонних и 40 правосторонних перемещались влево или вправо от средней линии головы. Движущиеся стимулы в пределах каждой серии принадлежали к одному из описанных выше типов: медленный, быстрый или скачок. Серии, содержащие разные типы стимулов, чередовались в квазислучайном порядке. Каждому стимулу предшествовал интервал тишины длительностью 1000 мс. В условиях пассивного прослушивания после окончания стимула также следовала пауза 1000 мс, так что межстимульный интервал от начала звуковой посылки до начала следующей составлял 4000 мс, и длительность каждой серии была равна 8 мин. В условиях активного прослушивания испытуемые получали инструкцию выждать приблизительно 1 с после окончания звучания стимула, для исключения влияния моторной реакции на поздние компоненты ВП. После этого испытуемый должен был соотнести траекторию движения интернализованного звукового образа со схемой, изображенной на графическом планшете Genius G-pen 450, чтобы отметить положение конца траектории движения либо положение неподвижного стимула. Тем самым достигалась фиксация внимания на звуковом стимуле на всем протяжении его звучания.
Следующий стимул подавался через 2500 мс после ответа испытуемого, так что одна серия длилась 12–15 мин. Через каждые 25–30 мин слушателю предоставлялся перерыв. Серии с активным и пассивным прослушиванием чередовались во время эксперимента. Для каждого испытуемого было записано по три-четыре серии каждого вида, так что для каждого из экспериментальных условий накапливалось 120–160 предъявлений.
Регистрация ЭЭГ. Регистрация ЭЭГ осуществлялась с помощью цифрового энцефалографа (ActiveTwo, BIOSEMI, Голландия) в 32 точках по международной системе 10-20, с заменой точек отведения PO3/PO4 на C5/C6 и дополнительными электродами на мочках ушей. Детальное описание регистрации ЭЭГ опубликовано в нашей предыдущей работе [Шестопалова и др., 2016].
Анализ данных. Непрерывную запись ЭЭГ разбивали на эпохи длительностью 4000 мс. Эпохи, содержащие нестереотипные артефакты, удаляли вручную на основе визуального поиска избыточных изменений потенциала на нескольких каналах (в среднем около 2% эпох). После этого вычисляли потенциал на каждом канале относительно усредненного потенциала всех электродов и фильтровали в диапазоне 0.5–45 Гц. Затем проводили коррекцию ЭЭГ относительно базовой линии по предстимульному участку длительностью 1000 мс. Оставшиеся артефакты удаляли при помощи метода анализа независимых компонент (ICA), основанного на алгоритме infomax и реализованного в модуле EEGLab среды MATLAB [Delorme et al., 2007]. Алгоритм оптимизирован для выявления движений глаз, морганий и нарушений контакта кожи с электродами. После устранения артефактов ЭЭГ восстанавливали и принимали в качестве референса усредненный потенциал электродов на мочках ушей. Затем проводили коррекцию ЭЭГ относительно базовой линии по участку длительностью 200 мс перед началом движения. В среднем для каждого испытуемого в каждом из условий было отобрано приблизительно одинаковое количество эпох (153 ± 3), пригодных к последующему анализу.
Вызванные потенциалы. Для получения ВП ЭЭГ дополнительно фильтровали в полосе 2–30 Гц. Записи ЭЭГ в каждом из 32 каналов усредняли отдельно по всем типам стимулов для каждого испытуемого и по группе в целом.
Частотно-временной анализ. Средние величины вызванных изменений спектральной мощности (ERSP) вычисляли отдельно для каждого отведения и для каждой эпохи при помощи частотно-временного вейвлет-преобразования (функция EEGlab ‘pop_newtimef’ [Delorme et al., 2007]). В качестве спектральной базовой линии принимали среднюю мощность на предстимульном участке длительностью 1000 мс. Двести отсчетов ERSP получали в интервале от –441 мс до 2441 мс (относительно начала стимула) для 87 лога-рифмических частот в диапазоне от 2 до 45 Гц, используя 2 цикла вейвлета Морли на нижней частоте и 11.25 цикла на верхней. Ширина окна вейвлета составила 1118 мс. Спектральные преобразования включали нормировку относительно усредненной спектральной мощности на участке базовой линии с получением показателя ERSP в шкале децибел (дБ).
Чтобы оценить когерентную вызванную активность, содержащуюся в суммарном ВП, такую же процедуру вычисления ERSP применяли к ВП, усредненным по эпохам анализа. Для ясности дальнейшего изложения, спектральное возмущение отдельных эпох, содержащее как вызванную, так и индуцированную активность, будет обозначаться “полное ERSP” (total ERSP), а спектральное возмущение суммарного ответа – “вызванное ERSP” (evoked ERSP).
Степень фазовой когерентности колебаний одиночных эпох для 87 логарифмических частот (от 2 до 45 Гц) также вычисляли при помощи функции ‘pop_newtimef’. Для каждой эпохи отсчет фазы колебания производился от момента начала стимула. Показатель когерентности (ITC) выражен в относительных безразмерных единицах в пределах от 0 до 1.
Частотно-временные представления величин ERSP и ITC получены по индивидуальным данным для каждого типа стимулов и каждого условия и затем усреднены по всей группе. Индивидуальные величины ERSP и ITC усредняли в шести частотных полосах (дельта: 2–4 Hz, тета: 4–7 Hz, нижняя альфа-полоса: 7–10 Hz, верхняя альфа-полоса: 10–13 Hz, бета: 13–30 Гц, гамма: 30–45 Гц) для получения индивидуальных кривых ERSP и ITC в каждой полосе. Затем индивидуальные кривые усредняли по всей группе для получения гранд-усредненных кривых в каждой полосе.
Статистический анализ. Психофизические данные, полученные с помощью графического планшета, не подвергали детальному статистическому анализу, так как основной целью этой части эксперимента была фиксация внимания испытуемых на звуковой стимуляции. Для проверки фиксации внимания слушателей в активных условиях на движении стимула вычисляли уровень правильных ответов для каждого типа сигналов. Для движущихся стимулов правильный ответ определялся как сдвиг воспринимаемого конца траектории более чем на 10 град от средней линии в правильном направлении. Для неподвижного сигнала правильный ответ определялся как воспринимаемое положение в пределах ±10 град от средней линии.
Поскольку предметом исследования была колебательная основа потенциала MOR, измеряемого обычно в отведении Cz, статистический анализ проводили только по вертексным данным. Для каждого испытуемого измеряли пиковые латентности и средние амплитуды MOR в отведении Cz в окне шириной 50 мс, центрированном на пике компонентов cN1 и cP2 гранд-усредненного потенциала. Аналогично, индивидуальные величины полного и вызванного ERSP, а также ITC, были получены путем усреднения данных частотно-временного разложения в окне шириной 52 мс, центрированном на позитивном пике соответствующей гранд-усредненной кривой. Для негативных отклонений ERSP средние амплитуды вычисляли во временных интервалах, в которых кривые ERSP достоверно отклонялись от базовой линии (метод скользящего окна с шагом 13 мс, односторонний парный t-тест, p < 0.05).
Измеренные таким образом величины подвергали предварительному дисперсионному анализу с целью исключить факторы, не оказывающие на них значимого влияния. Во-первых, чтобы удостовериться в отсутствии влияния направления движения, индивидуальные (n = 13) средние величины MOR, полного и вызванного ERSP, а также ITC в каждой из 6 частотных полос сравнивали при помощи 3-факторного дисперсионного анализа (repeated measures ANOVA, rmANOVA) с факторами: Условия (активные, пассивные), Скорость (медленный, быстрый, скачок) и Направление (влево, вправо). Фактор Направление не оказал значимого влияния ни на одну из исследуемых переменных, поэтому он был исключен из дальнейшего анализа путем усреднения соответствующих кривых для каждого испытуемого в каждом из оставшихся условий. Во-вторых, поскольку блоки стимулов различались по типу движущихся сигналов, но содержали один и тот же неподвижный сигнал, следовало проверить данные, относящиеся к реакциям на неподвижный стимул, на возможные различия между блоками. Для этого был проведен 2-факторный дисперсионный анализ (rmANOVA) с факторами Условия (активные, пассивные) и Скорость (медленный, быстрый, скачок). Анализ показал отсутствие влияния Скорости и взаимодействия, поэтому данные, относящиеся к неподвижным стимулам, были усреднены по всем сериям, отдельно для активных и пассивных условий, и включены как “нулевой” уровень фактора Скорость в окончательный анализ. Таким образом, окончательные сравнения были проведены с помощью 2-факторного дисперсионного анализа (rmANOVA) с факторами Условия (активные, пассивные) и Скорость (неподвижный, медленный, быстрый, скачок). При отклонении данных от сферичности применяли поправку к степеням свободы Гринхауза–Гайссера. При проведении множественных сравнений применяли поправку Бонферрони. Все сравнения проводили с уровнем значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Психофизические данные по активной локализации показали, что воспринимаемое угловое смещение стимулов составило 69 ± ± 2 град, при усреднении по левому и правому направлениям движения. При усреднении по всем типам стимулов уровень правильных ответов составил 97 ± 1%, что подтверждает высокую концентрацию внимания слушателей.
Движение стимулов вызывало выраженные суммарные ответы (MOR) в активных и пассивных условиях. Частотно-временное разложение показало, что эти реакции сопровождались вызванными изменениями спектральной мощности и фазовой когерентности. Влияние движения стимула было наибольшим в случае скачка, поэтому этот стимул был выбран для иллюстрации усредненных ВП и частотно-временных представлений на рис. 1.
Рис. 1.
Усредненные по всем испытуемым (n = 13) реакции мозга на мгновенное перемещение стимула (отведение Cz). Стрелки указывают моменты включения стимула (0 мс) и изменения ΔT (1000 мс). (а) вызванные потенциалы. (б) верхний ряд – частотно-временные представления спектрального возмущения вызванных потенциалов (градиентные шкалы показывают мощность ERSP (в дБ); средний ряд – частотно-временные представления полного спектрального возмущения (полное ERSP, также в дБ); нижний ряд – частотно-временные представления фазовой когерентности отдельных эпох (ITC) (в относительных единицах).
Fig. 1. Grand-averaged brain responses elicited by Step stimuli during active (АКТИВНО) and passive (ПАССИВНО) listening. The arrows at time 0 and 1000 ms indicate the sound onset and the onset time of ITD change. (а) Event-related potentials recorded at Cz site. (б) Upper panels: Cz time-frequency plots of ERP spectral perturbation. Gradient scales show the ERSP power expressed in dB. Middle panels: Cz time-frequency plots of the inter-trial ERSP power (in dB). Bottom panels: Cz time-frequency plots of the inter-trial phase coherence (ITC). Gradient scales show the ITC values expressed in relative units.
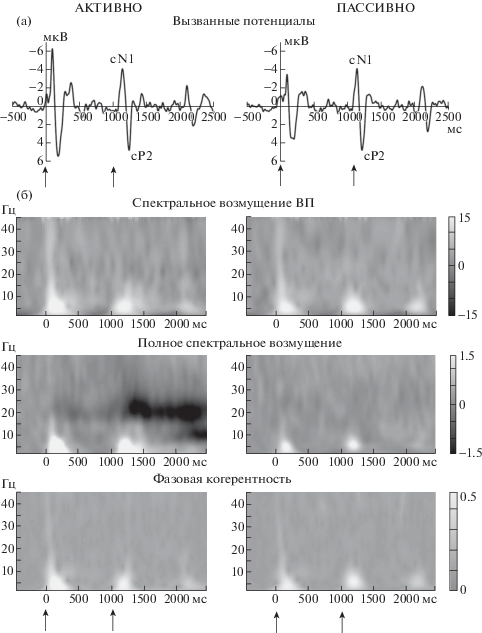
Суммарные и колебательные реакции на начало движения
Компоненты MOR. Начало движения стимула вызывало выраженный вертексный ответ, состоящий из негативного и позитивного отклонений cN1 и cP2 (рис. 1, 2, 3), что соответствует ранее описанному потенциалу MOR [Krumbholz et al., 2007, Getzmann, Lewald, 2010a, b]. MOR возвращался к уровню базовой линии в течение 500 мс после начала движения. Дисперсионный анализ амплитуд cN1 и cP2 (здесь и далее rmANOVA с факторами Условия (активные, пассивные) и Скорость (неподвижный, медленный, быстрый, скачок)) выявил единственный главный эффект Скорости (F(3, 36) = 36.34, p < 0.001, ε = = 0.50, η2 = 0.75 и F(3, 36) = 51.89, p < 0.001, ε = 0.57, η2 = 0.81). Оба компонента увеличивались с ростом скорости (рис. 4 (а)), и попарные сравнения подтвердили значимость различий между ответами на разные скорости (p < 0.05). Латентность пиков cN1и cP2 составила 144 ± 2 мс и 235 ± 3 мс после начала движения, независимо от направленности внимания.
Рис. 2.
Усредненные по всем испытуемым (n = 13, отведение Cz) вызванные потенциалы и вызванные колебательные ответы на стимулы разной скорости. Вертикальный пунктир указывает моменты начала движения и выключения стимула. Вверху – вызванные потенциалы. Средний ряд – полное ERSP (в дБ) дельта-, тета-, нижних и верхних альфа-частот. Внизу – фазовая когерентность (в относительных единицах).
Fig. 2. Grand-averaged waveforms (n = 13) of the evoked potentials and event-related oscillatory responses elicited by Stationary, Slow, Fast and Step sound stimuli at Cz site. Vertical dashed lines indicate the motion onset and the sound offset. Top panels: ERP waveforms. Middle panels: inter-trial ERSP power (in dB) of delta, theta, lower and upper alpha frequencies. Bottom panels: inter-trial phase coherence of delta, theta, lower and upper alpha frequencies (ITC, in relative units).
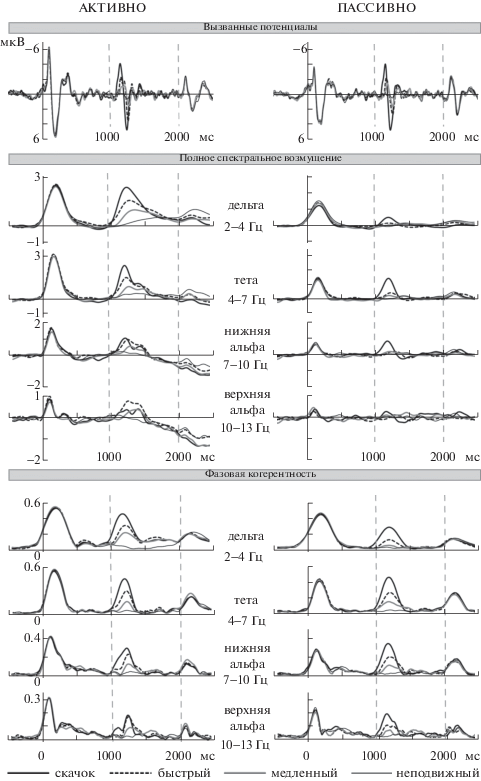
Рис. 3.
Влияние направленности внимания на потенциал MOR. Слева – потенциал MOR в отведении Cz, полученный в активных (сплошная линия) и пассивных (пунктир) условиях. Усреднение по всем испытуемым (n = 13). Справа – разница амплитуды MOR между активными и пассивными условиями (мкВ) как функция времени (абсцисса) для каждого отведения (ордината), отдельно для каждой из скоростей стимула. Электроды сгруппированы по отведениям от средней линии и от левого/правого полушарий и расположены в направлении от лобных к затылочным областям. Серый цвет – временные интервалы, в которых активная реакция была больше пассивной (t-тесты, p < 0.05); белый цвет – интервалы ниже уровня значимости (p > 0.05). Пунктиром показаны пиковые латентности компонентов MOR.
Fig. 3. Effect of attention on the MOR potential. Top row: Slow motion. Middle row: Fast motion. Bottom row: Step motion. Left column: MOR waveforms obtained at Cz site in the active (solid line) and passive (dashed line) conditions. Right column: MOR amplitude differences (μV) between active and passive conditions plotted across time for each electrode, separately for each stimulus velocity. Electrodes are grouped as midline, right and left recordings and arranged from the frontal to the occipital areas. Grayscale colors outline the time intervals where the active responses were larger than the passive ones (t-tests, p < 0.05); white color shows the regions below the significance level (p > 0.05). Dashed lines indicate the peak latencies of the MOR components.
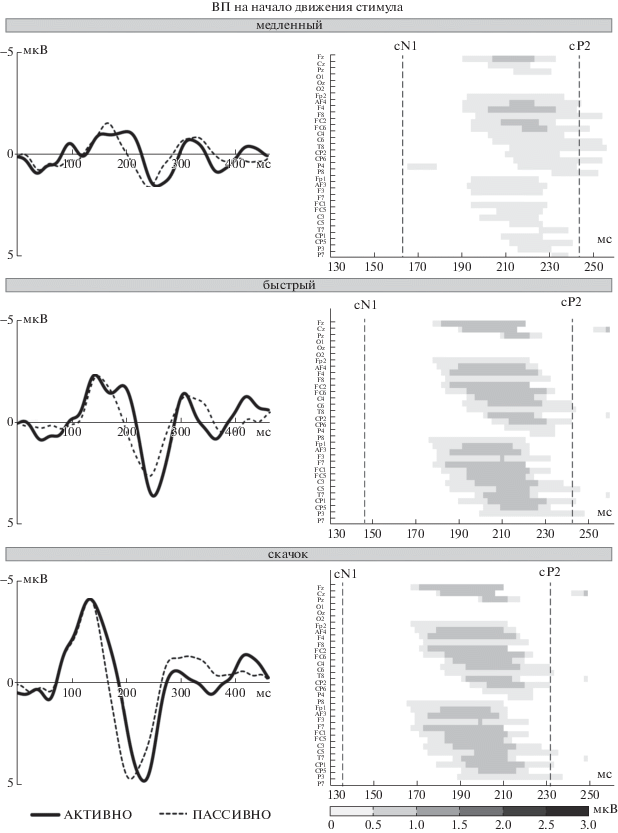
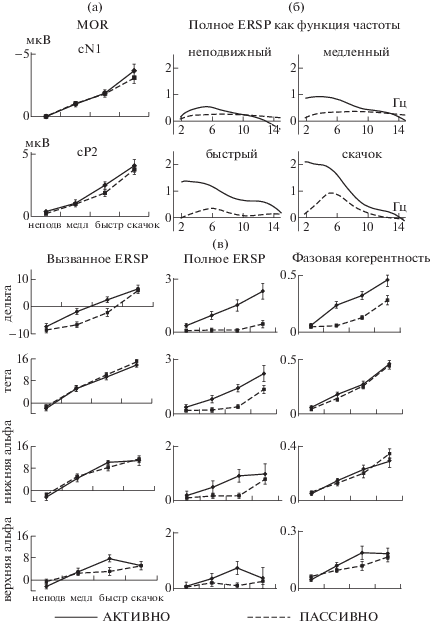
Рис. 4.
Влияние направленности внимания слушателя (n = 13) и скорости стимула на реакции на начало движения. Сплошные и пунктирные линии – активные и пассивные условия локализации. Вертикальные черточки – стандартная ошибка среднего. (а) средние амплитуды компонентов MOR, измеренные в окне шириной 50 мс, центрированном на пике каждого компонента. (б) полное спектральное возмущение (ERSP, в дБ), усредненное во временном интервале MOR (110–400 мс после начала движения), отдельно в активных и пассивных условиях. (в) вызванное ERSP (в дБ), полное ERSP (в дБ) и ITC (в отн. ед.) в каждой из частотных полос, усредненные в окнах шириной 52 мс, центрированных на пиках соответствующих кривых. Масштабы не совпадают.
Fig. 4. Effects of sound velocity and attention on the motion onset responses (n = 13). Solid and dashed lines represent active and passive conditions. The error bars show standard errors of means. (а) Mean amplitudes of the MOR components in the 50-ms peak-centered time windows. (б) Inter-trial ERSP power (in dB) averaged in the MOR time range (110–400 ms after motion onset), separately for each of the conditions. (в) The evoked ERSP (in dB), inter-trial ERSP (in dB) and ITC values (in relative units) averaged in the peak-centered 52-ms wide windows for each frequency band. Note the difference in scaling.
Направленность внимания не влияла на параметры cN1 и cP2, однако значимый эффект внимания мог быть сосредоточен в интервале между пиками. Поэтому мы исследовали временной ход амплитудных различий MOR в активных и пассивных условиях. Индивидуальные значения амплитуды MOR в обоих условиях в каждом из 32 отведений усреднялись методом скользящего временного окна шириной 10 мс и сравнивались при помощи парного t-теста (рис. 3). Согласно t-критерию (p < 0.05), значимый эффект внимания наблюдался между 160 и 250 мс после начала движения стимула.
Полное ERSP. Позитивные отклонения полного ERSP были больше в активных, чем в пассивных условиях в широком диапазоне от дельта- до верхних альфа-частот (рис. 4 (б)). Средние значения полного и вызванного ERSP, а также ITC, даны на рис. 4 (в). Эффект внимания достигал значимости только в дельта- и тета-полосах (rmANOVA, главный эффект Условий: F(1, 12) = 29.75, p < 0.001, ε = 1, η2 = 0.71 для дельта-полосы и F(1, 12) = = 19.81, p < 0.001, ε = 1, η2 = 0.62 для тета-полосы). Главный эффект Скорости был обнаружен в дельта-, тета- и нижней альфа-полосе (F(3, 36) = 10.02, p < 0.001, ε = 0.42, η2 = = 0.46; F(3, 36) = 17.89, p < 0.001, ε = 0.41, η2 = = 0.60; F(3, 36) = 6.77, p < 0.05, ε = 0.46, η2 = 0.36 соответственно). Значимое взаимодействие Условия*Скорость было выявлено в дельта- и тета-полосах (F(3, 36) = 13.76, p < 0.001, ε = = 0.65, η2 = 0.53 и F(3, 36) = 4.55, p < 0.01, ε = = 0.53, η2 = 0.28). Как показали последующие попарные сравнения, взаимодействие было связано с тем, что привлечение внимания к положению звуковых стимулов приводило к увеличению ERSP только в случае движущихся, но не неподвижных стимулов (p < 0.01 для медленного, p < 0.001 для быстрого стимула и скачка в обеих частотных полосах). В дельта-полосе увеличение полного ERSP с ростом скорости происходило только в активных условиях (p < 0.05 при сравнении реакций на быстрый стимул и на неподвижный или медленный, p < 0.01 при сравнении реакций на скачок и на неподвижный или медленный стимул). В тета-полосе эффект Скорости в активных условиях был аналогичным (p < 0.001 при сравнении реакций на быстрый и на неподвижный стимул, p < 0.01 при сравнении реакций на быстрый и медленный стимул, а также на скачок и неподвижный стимул, p < 0.05 при сравнении реакций на скачок и медленный стимул), но он проявлялся также и в пассивных условиях: тета-ERSP было больше в реакции на скачок по сравнению с остальными стимулами (p < 0.01). В нижней и верхней альфа-полосах значимый эффект Скорости был связан с большей величиной ERSP для быстрого стимула по сравнению с неподвижным (p < 0.05) (рис. 4 (в), средняя часть). В бета- и гамма-диапазоне отсутствовали позитивные отклонения ERSP, соответствующие реакции на начало движения (рис. 5).
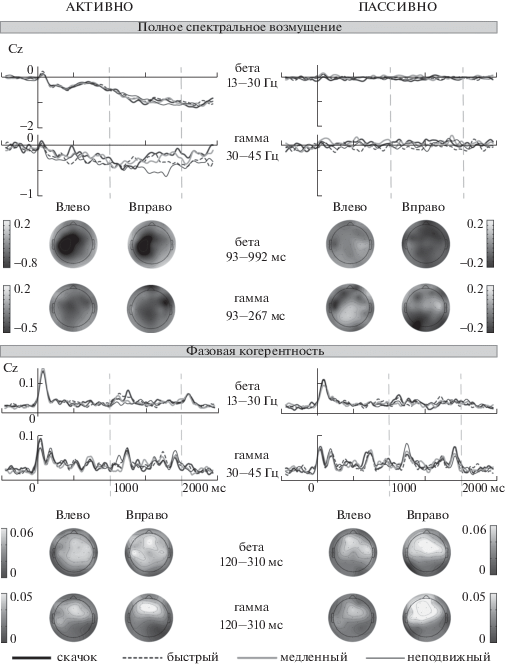
Рис. 5.
Усредненные по всем испытуемым (n = 13) вызванные колебательные ответы в бета- и гамма-полосах на стимулы разной скорости. Вверху: кривые и топограммы полного ERSP (отведение Cz). Внизу: кривые (отведение Cz) и топограммы ITC. Топограммы получены усреднением соответствующих кривых во временных интервалах после начала движения (указаны в каждом ряду), содержащих фокус активности для всех стимулов. На топограммах данные для лево- и правонаправленных стимулов представлены по отдельности (Влево, Вправо), а на кривых – в результате усреднения по направлениям. Вертикальным пунктиром обозначены моменты начала движения и выключения стимула. Градиентные шкалы показывают мощность ERSP в дБ и величины ITC в относительных единицах.
Fig. 5. Grand-averaged waveforms (n = 13) of the oscillatory responses elicited in the beta and gamma bands by Stationary, Slow, Fast and Step sound stimuli. Top panels: inter-trial ERSP waveforms at Cz site and topography maps of the inter-trial ERSP values. Bottom panels: ITC waveforms at Cz site and topography maps of the inter-trial ITC values. The waveforms represent data pooled over leftward and rightward direction of motion, while scalp distributions were calculated separately for leftward and rightward motion (Влево, Вправо). Topography maps were taken in the time intervals after motion onset which comprised the focuses of activity (shown in each row). Vertical dashed lines indicate the motion onset and the sound offset. Gradient scales show the ERSP power expressed in dB and the ITC values expressed in relative units.
Дисперсионный анализ латентностей полного ERSP выявил главный эффект Скорости в дельта-, тета-, нижней и верхней альфа-полосах (F(3, 36) = 6.95, p < 0.01, ε = 0.82, η2 = 0.37; F(3, 36) = 17.59, p < 0.001, ε = 0.77, η2 = 0.59; F(3, 36) = 8.21, p < 0.01, ε = 0.65, η2 = 0.41; F(3, 36) = 3.04, p < 0.05, ε = 0.89, η2 = 0.20) и главный эффект Условий в дельта-полосе (F(1, 12) = 11.17, p < 0.01, ε = 1, η2 = 0.48) . Значимых взаимодействий не обнаружено (p > 0.05). В целом чем быстрее перемещался стимул, тем раньше формировался пик полного ERSP. Следует отметить, что эффект Скорости в дельта-полосе имел место только в активных условиях. Кроме того, максимумы дельта-ERSP в реакциях на неподвижный и быстрый стимулы формировались в активных условиях позже, чем в пассивных (p < 0.01 и p < 0.05, соответственно).
Вызванное ERSP. Средние амплитуды и пиковые латентности вызванного ERSP (рис. 4 (в), слева) также подвергались дисперсионному анализу rmANOVA. Для амплитуды ERSP главный эффект Скорости обнаружен в диапазоне от дельта- до верхней альфа-полосы (p < 0.001 для всех частот; дельта: F(3, 36) = = 52.94, ε = 0.67, η2 = 0.82; тета: F(3, 36) = = 89.43, ε = 0.71, η2 = 0.88; нижняя альфа: F(3, 36) = 32.86, ε = 0.76, η2 = 0.73; верхняя альфа: F(3, 36) = 14.27, ε = 0.80, η2 = 0.54). Исключительно в дельта-полосе обнаружен главный эффект Условий (F(1, 12) = 17.97, p < 0.001, ε = 1, η2 = 0.60) и взаимодействие Условия*Скорость (F(3, 36) = 4.65, p < 0.05, ε = 0.75, η2 = = 0.28), связанное с увеличением вызванного ERSP при привлечении внимания к медленному и быстрому стимулу (p < 0.01 и p < 0.001 в попарных сравнениях). Для латентности вызванного ERSP также выявлен главный эффект Скорости в диапазоне от дельта- до верхней альфа-полосы (дельта: F(3, 36) = 6.93, p < 0.01, ε = 0.74, η2 = 0.37; тета: F(3, 36) = 14.68, p < 0.001, ε = 0.62, η2 = 0.55; нижняя альфа: F(3, 36) = 9.37, p < 0.001, ε = 0.78, η2 = 0.44; верхняя альфа: F(3, 36) = 8.59, p < 0.001, ε = = 0.84, η2 = 0.42). Эффекта внимания и взаимодействия не обнаружено. Аналогично влиянию скорости на полное ERSP, чем быстрее перемещался стимул, тем раньше формировалось позитивное отклонение ERSP.
Фазовая когерентность. Рост когерентности (ITC) с увеличением скорости стимула наблюдался в диапазоне от дельта- до верхней альфа-полосы как в активных, так и в пассивных условиях (рис. 2 и 4 (в)). Это подтвердил дисперсионный анализ, выявивший главный эффект Скорости (p < 0.001 для всех частот; дельта: F(3, 36) = 32.67, ε = 0.49, η2 = = 0.73; тета: F(3, 36) = 62.13, ε = 0.52, η2 = 0.84; нижняя альфа: F(3, 36) = 27.73, ε = 0.55, η2 = = 0.70; верхняя альфа: F(3, 36) = 12.37, ε = 0.76, η2 = 0.51). Кроме того, главный эффект Условий и взаимодействие Условия*Скорость обнаружены в дельта-полосе (F(3, 36) = 19.84, p < 0.001, ε = 0.83, η2 = 0.62). Другие эффекты или взаимодействия отсутствовали. Попарные сравнения величин дельта-ITC показали, что взаимодействие Условия*Скорость было вполне аналогично такому же взаимодействию для величины полного и вызванного ERSP: привлечение внимания к звуковой стимуляции приводило к росту дельта-ITC (по сравнению с пассивным прослушиванием) только для движущихся (p < 0.001 для медленного, быстрого и скачка), но не для неподвижных стимулов. Дельта-, тета- и нижние альфа-частоты демонстрировали достоверные различия величин ITC при сравнении между соседними скоростями (дельта: p < < 0.01; тета: p < 0.001; нижняя альфа: p < 0.05). В верхней альфа-полосе влияние скорости было слабее, и величина ITC для быстрого стимула не отличалась от таковых для медленного стимула и скачка (p > 0.05).
Латентность ITC демонстрировала тенденцию к уменьшению с ростом скорости стимула. Дисперсионный анализ показал главный эффект Скорости (дельта: F(3, 36) = = 4.61, p < 0.05, ε = 0.84, η2 = 0.28; тета: F(3, 36) = 24.86, p < 0.001, ε = 0.66, η2 = 0.67; нижняя альфа: F(3, 36) = 8.44, p < 0.01, ε = 0.64, η2 = 0.41; верхняя альфа: F(3, 36) = 5.88, p < 0.01, ε = 0.69, η2 = 0.33). Главный эффект Условий был обнаружен только в нижней альфа-полосе (F(1, 12) = 6.88, p < 0.05, ε = 1, η2 = 0.36), в отсутствие взаимодействия. Согласно попарным сравнениям, эффект Условий был об-условлен более ранним ростом когерентности в нижней альфа-полосе при пассивной локализации (по сравнению с активной) в реакции на неподвижный и быстрый стимулы, а также на скачок (p < 0.075, p < 0.075 и p < 0.05); при этом в реакции на медленное движение эффект отсутствовал (p > 0.05). Попарные сравнения по эффекту Скорости подтвердили значимость различий только в тета- и нижней альфа-полосе: тета-когерентность возникала раньше в реакциях на любое движение, чем на неподвижный стимул (p < 0.05), а в нижней альфа-полосе когерентность возникала раньше в реакции на скачок, чем на остальные стимулы (p < 0.05).
Чтобы сравнить влияние внимания и скорости стимула на разные спектральные показатели в дельта-альфа-диапазонах, были проведены дополнительные универсальные тесты (omnibus tests) при помощи дисперсионного анализа (rmANOVA), в который вызванное и полное ERSP, а также ITC, вводились как три уровня внутрисубъектного фактора: Спектральный показатель (вызванное ERSP, полное ERSP, ITC)*Условия (активные, пассивные)*Скорость (неподвижный, медленный, быстрый, скачок). Приведение спектральных показателей к соизмеримым единицам проводилось при помощи z-преобразования. Если влияние внимания и скорости стимула на разные показатели различается, это отразится в значимом взаимодействии соответствующих факторов. Действительно, в дельта- и тета-полосах было обнаружено значимое 3-факторное взаимодействие Спектральный показатель*Условия*Скорость(F(6, 72) = 7.90, p < 0.001, ε = 0.68, η2 = 0.40 и F(6, 72) = 4.10, p < 0.01, ε = 0.65, η2 = 0.26). В дельта-полосе оно связано с тем, что вызванное ERSP и ITC были функциями скорости в обоих условиях прослушивания (p < 0.05 при сравнении между соседними скоростями), а полное ERSP, в отличие от них, не зависело от скорости в пассивных условиях (p > 0.05 при сравнении между скоростями). В тета-полосе 3-факторное взаимодействие имело то же происхождение (p > 0.05 для полного ERSP при сравнении между неподвижным, медленным и быстрым стимулами), но в реакции на скачок полное ERSP было больше, чем при действии остальных стимулов (p < 0.01). В обеих альфа-полосах выявлено 2-факторное взаимодействие Спектральный показатель*Скорость, отражавшее аналогичное явление: полное ERSP слабо зависело от скорости (только неподвижный и быстрый стимулы вызывали его значимые различия (p < 0.05)).
Пространственные распределения амплитуд cN1 и cP2, а также полного ERSP и ITC, приведены на рис. 6. Для большей наглядности данные по левостороннему и правостороннему движению даны по отдельности. На топограммах представлены средние величины полного спектрального возмущения и фазовой когерентности во временном интервале от 120 мс до 310 мс после начала движения.
Рис. 6.
Топограммы реакций на начало движения. Реакции приведены отдельно для перемещения влево и вправо. Вверху – топограммы амплитуд компонентов MOR, измеренных на пиковых латентностях. Средний и нижний ряд – топограммы величин полного ERSP и ITC, усредненных во временных интервалах 120–310 мс относительно начала движения. Масштабы для разных частотных полос не совпадают. Градиентные шкалы показывают мощность ERSP в дБ и величины ITC в относительных единицах.
Fig. 6. Scalp distributions of the responses to the motion onset, separately for the leftward and rightward direction of sound motion (Влево, Вправо). Top panels: topography maps of cN1 and cP2 components taken at their peak latencies. Middle and bottom panels: topography maps of the inter-trial ERSP and ITC values averaged between 120 ms and 310 ms after motion onset. Different frequency bands are displayed vertically down from delta to upper alpha (note the differences in scaling). Gradient scales show the ERSP power expressed in dB and the ITC values expressed in relative units.

Негативные отклонения полного ERSP в альфа-, бета- и гамма-полосах
В активных условиях полное ERSP снижалось относительно базовой линии в широком диапазоне частот, от нижней альфа- до гамма-полосы. В альфа-диапазоне снижение начиналось через 1700 мс после включения сигнала (рис. 1, 2). Бета- и гамма-колебания демонстрировали снижение полного ERSP уже через 150 мс после включения, и оно продолжалось до конца эпохи (рис. 5). Измерение средних величин негативных отклонений ERSP и ITC в каждой полосе проводилось во временных интервалах 2295–2441 мс для альфа-полосы и 862–2441 мс для бета- и гамма-полосы. Данные интервалы были установлены на основе метода скользящего окна, применяемого к индивидуальным кривым в отведении Cz (усреднение в интервалах шириной 52 мс с шагом 13 мс; односторонний парный t-тест, n = 13).
Дисперсионный анализ (Условия (активные, пассивные)*Скорость (неподвижный, медленный, быстрый, скачок)) средних величин полного ERSP в альфа-гамма-диапазоне показал значимость единственного главного эффекта Условий, не сопровождавшегося взаимодействиями (нижняя альфа: F(1, 12) = = 11.48, p < 0.01, ε = 1, η2 = 0.49; верхняя альфа-полоса: F(1, 12) = 14.55, p < 0.01, ε = 1, η2 = = 0.55; бета: F(1, 12) = 24.24, p < 0.001, ε = 1, η2 = 0.67; гамма: F(1, 12) = 19.57, p < 0.01, ε = 1, η2 = 0.62). Эффект Условий состоял в развитии негативного отклонения полного ERSP при привлечении внимания к стимуляции, в то время как в пассивных условиях его отклонения от базовой линии были только позитивными.
В активных условиях полное гамма-ERSP в реакции на движущиеся стимулы возвращалось к уровню базовой линии приблизительно через 1400 мс после включения сигнала, в то время как реакция на неподвижный стимул продолжала снижение вплоть до 1800 мс. Чтобы выяснить, имеются ли значимые различия между полным гамма-ERSP в реакции на неподвижный стимул и движение, был проведен анализ методом скользящего временного окна (ширина 52 мс, шаг 13 мс) по индивидуальным кривым гамма-ERSP во всех отведениях. Значимые различия обнаружены в интервале между 1500 мс и 2000 мс после включения стимула (односторонний парный t-тест, p < 0.05). Тем самым подтверждено восстановление полного гамма-ERSP к базовому уровню только при действии движущихся стимулов, и только в активных условиях. Наибольшая выраженность данного эффекта наблюдалась в центральных и теменных отведениях (Cz, CP1, CP2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В работе исследовалась колебательная основа суммарной реакции на движение звукового стимула (MOR). Вычисленные с помощью частотно-временного разложения спектральные модуляции отдельных эпох характеризовались показателями фазовой когерентности (ITC) и спектрального возмущения (ERSP) [Makeig et al., 2002; Delorme et al., 2007]. Анализировалось влияние движения стимула и направленности внимания слушателей на компоненты MOR, а также на полное и вызванное ERSP и ITC. Проверялось предположение, что фазовая подстройка колебаний, составляющих основу MOR, является более точным коррелятом кортикального ответа на движение стимула, чем спектральная мощность.
Эффект движения стимула. В полном соответствии с классическими работами [Krumbholz et al., 2007; Getzmann, 2009] наше исследование показало явную зависимость ВП от скорости стимула: компоненты cN1 и cP2 увеличивались с ростом скорости, независимо от направленности внимания (рис.4 (а)). Эти результаты соответствуют представлениям о MOR как об общем электрофизиологическом корреляте слуховой обработки любых пространственных акустических изменений [Getzmann, Lewald, 2012]. Предыдущие исследования с использованием плавного и мгновенного перемещения стимулов показали, что они могут рассматриваться с точки зрения процессов бинауральной интеграции как качественно аналогичные стимулы, и скачок можно трактовать как движение с максимально возможной скоростью [Шестопалова, Василенко, 2010; Shestopalova et al., 2012; Getzmann, Lewald, 2012].
Потенциал MOR, как и большинство ВП, формируется в основном за счет тета- и альфа-колебаний, и в меньшей степени за счет дельта-активности. В пассивных условиях ITC и вызванное ERSP сильно зависели от скорости плавного движения, в отличие от полного ERSP (рис. 4 (в)). Вызванное ERSP по определению отражает только синхронизированную часть нейрональной активности. В пассивных условиях плавное движение стимула ведет к увеличению мощности и когерентности вызванной низкочастотной активности, но не индуцирует поддающегося измерению количества слабо когерентных колебаний. Индуцированные колебания обнаруживаются только в реакции на скачок: об этом свидетельствует значимый рост полного ERSP в тета-полосе. Топограммы полного ERSP в дельта- и тета-полосах (рис. 6) характеризовались правосторонней фронто-центральной активацией при движении стимулов влево и более симметричной активацией при движении вправо, что в целом соответствует топографии компонента cN1.
Влияние скорости стимула на характеристики альфа-активности было менее выраженным, чем для более низких частот, и значимого увеличения полного ERSP не обнаружено ни для одной из скоростей (рис.4 (в)). Как показывают топограммы полного ERSP (рис. 6), в активных условиях спектральные возмущения нижней альфа-полосы концентрировались во фронто-центральной области и демонстрировали более сильное подавление в левой теменной области, чем в тета-полосе. Колебания верхней альфа-полосы, напротив, характеризовались нарастанием мощности в центральной области справа (C4, C6) и сопутствующим снижением в центрально-теменной области слева (C3, CP1, CP5). Такой тип активации соответствует неоднократно описанному подавлению верхнего мю-ритма, которое начинается обычно приблизительно за 2 с до одностороннего произвольного движения руки [напр., Pfurtscheller, 2003; Кропотов, 2010]. Следует подчеркнуть, что в нашем эксперименте при выполнении задания по локализации испытуемые давали ответ при помощи планшета через 1 с после выключения сигнала (т.е. через 2 с после начала движения). Таким образом, топография и динамика нижних и верхних альфа-колебаний отражают как обработку движения стимула, так и процессы подготовки моторного ответа.
Состояние готовности к моторному ответу и подготовка движения правой руки явным образом отражались в активности среднего и верхнего частотного диапазона. Снижение мощности бета-колебаний отмечалось в левой сенсомоторной области (C3, FC1, CP1), независимо от направления движения стимула (рис. 5). Поскольку подавление бета-активности было одинаковым для всех скоростей стимула, а в пассивных условиях аналогичные явления отсутствовали, можно заключить, что снижение бета-активности в ходе активной локализации отражало в основном подавление роландического бета-ритма, связанного с моторной готовностью [Кропотов, 2010]. Следует отметить, что подавление бета- и гамма-колебаний в активных условиях начиналось уже через 150–200 мс после включения звукового стимула, то есть на 3 с предшествовало реализации моторного ответа. Бета-ритмы предположительно отражают функциональную координацию между слуховой и моторной системой и могут кооперироваться с дельта-тета-колебаниями в составе механизма временнóго предсказания (predictive timing). Эта кооперация модулируется предсказательными механизмами более высокого порядка, участвующими в обработке периодических слуховых событий [напр., Fujioka et al., 2012; см. также обзор Arnal et al., 2012].
В ходе выполнения слушателями активного задания мощность гамма-ритмов снижалась после включения сигнала, а затем восстанавливалась к уровню базовой линии приблизительно через 1400 мс (рис. 5, вверху), главным образом в центрально-теменной области. Эти изменения ERSP не сопровождались фазовой перестройкой. Восстановление мощности гамма-активности происходило только в случае движущихся (но не неподвижных) стимулов. Следовательно, оно не могло быть связано исключительно с моторным ответом, а отражало также процессы кодирования акустических признаков стимула. Таким образом, бета- и гамма-колебания демонстрировали различные свойства в ходе звуковой стимуляции. Это соответствует концепции различных ролей бета- и гамма-активности в синхронизации нейронных ансамблей, и в особенности – идее о противоположных направлениях информационного потока (прямом и встречном) по нейрональным каналам бета- и гамма-частот в ходе сенсорной обработки [Arnal et al., 2012].
Эффект направленности внимания. Фокусировка внимания на движении звука не влияла на амплитуды и латентности компонентов cN1 и cP2 (рис. 4 (а)). Этот результат оказался неожиданным, поскольку в упоминавшейся выше работе Kreitewolf et al. (2011) было обнаружено значимое увеличение поздних компонентов MOR (около 300 мс после начала движения, т.е. в области cP2 и позднее) при фокусировке внимания на движущихся стимулах. Тенденция к увеличению обоих компонентов MOR в активных условиях отмечена и в нашей предыдущей работе [Шестопалова и др., 2016]. Чтобы прояснить данное противоречие и установить временной интервал, в котором может проявиться эффект внимания, разность между суммарными ответами в активных и пассивных условиях в каждом отведении была представлена как функция времени (рис. 3). При всех скоростях движения активная локализация вызывала больший ответ на нисходящей ветви компонента cN1, причем интервал достоверности эффекта внимания сдвигался во времени с увеличением скорости: 190–240 мс для медленного движения, 175–235 мс для быстрого движения и 150–220 мс для скачка. Следовательно, наблюдался зависящий от скорости эффект внимания в средней части MOR, при отсутствии эффекта в области пиков. Интервал достоверности эффекта внимания оказался значительно более ранним, чем в работе [Kreitewolf et al., 2011]. Вероятно, это связано с тем, что Kreitewolf и соавт. использовали два активных условия, различавшихся только направленностью внимания (на движение либо на высоту сигнала), а в нашей работе активной локализации противопоставлялось пассивное прослушивание при чтении книги.
Взаимодействие факторов движения и внимания. Фокусировка внимания на положении стимулов сопровождалась значительным усилением полной мощности дельта-тета-частот (рис. 1, 2 и 4 (б)), длящимся с момента начала движения до конца эпохи. Альфа-частоты демонстрировали аналогичное усиление, но оно продолжалось не более 500 мс после начала движения, поскольку в активных условиях усиление компенсировалось за счет подавления мю-ритмов. Было обнаружено взаимодействие факторов движения и внимания для полного ERSP в дельта- и тета-полосе (рис. 4 (в)). В активных условиях зависимость дельта- и тета-колебаний от скорости была выражена сильнее, о чем свидетельствует наклон кривых полного ERSP. Привлечение внимания к стимуляции приводило к увеличению полной мощности дельта-тета-колебаний при всех скоростях, в отсутствие аналогичного эффекта для вызванной мощности. Рост фазовой когерентности обнаружен только в дельта-полосе. Эти результаты могут отражать генерацию индуцированной дельта-тета-активности при выполнении локализационного задания.
Как было сказано выше, влияние направленности внимания на параметры MOR сводилось к изменению его формы в интервале между пиками cN1 и cP2. Частотные характеристики потенциала MOR имеют максимальную мощность в диапазоне от тета- до нижних альфа-частот. В этом диапазоне привлечение внимания к стимуляции не приводило ни к изменению мощности вызванной активности, ни к дополнительной фазовой подстройке в момент начала движения. Следовательно, можно сделать вывод, что изменение формы MOR отражает главным образом дополнительную активность связанных с вниманием нейрональных сетей, не синхронизированную (или слабо синхронизированную) со слуховыми событиями.
По всей вероятности, потенциал MOR не является исчерпывающим комплексным показателем обработки движения, так как он отражает только часть ритмической активности мозга, сохраняющейся после усреднения по эпохам анализа. Усиление спектральной мощности и когерентности при активной локализации происходило в основном в диапазоне дельта-частот, которые не вносят значительного вклада в MOR. Концентрация эффекта внимания в дельта-полосе может отчасти объясняться синхронизацией слуховой системы с ритмами использованной звуковой стимуляции. Согласно многочисленным данным, именно дельта-колебания играют основную функциональную роль в механизмах временнóго предсказания в ходе слухового восприятия [см. обзоры Arnal et al., 2012; Haegens et al.,2018; Zoefel et al., 2018].
ЗАКЛЮЧЕНИЕ
Компоненты cN1 и cP2 и фазовая когерентность медленных колебаний увеличивались с ростом скорости стимула. Полное спектральное возмущение дельта-альфа-колебаний в активных условиях плавно возрастало при увеличении скорости, а в пассивных оставалось на одном уровне, и возрастало только при максимальной скорости движения стимула.
В пассивных условиях потенциал MOR формировался за счет усиления мощности и фазовой подстройки тета- и альфа-колебаний. Плавное движение стимула не индуцировало некогерентной активности в отсутствие привлеченного внимания. Мгновенное перемещение стимула индуцировало слабо когерентные тета-альфа-колебания, которые могли вносить некоторый вклад в потенциал MOR.
Фокусировка внимания на траектории стимулов не отражалась на пиковых величинах потенциала MOR: эффект внимания проявлялся в интервале между cN1 и cP2. При активной локализации MOR формировался за счет фазовой подстройки и амплитудных изменений как продолжающихся, так и вновь генерируемых дельта-альфа-колебаний. Эти изменения могли иметь в своей основе связанную с вниманием активность, не имеющую фазовой привязки к слуховым событиям. Вовлечение нисходящих процессов в обработку движения наиболее ясно проявилось в фазовой подстройке дельта-частот к началу движения стимула, которая была весьма отчетливой в активных условиях, но тем не менее не обнаружима в потенциале MOR.
Эти результаты находятся в соответствии с точкой зрения, что дельта-альфа-колебания следует рассматривать в более общем смысле как “медленные колебания”, без функционального разделения на ритмы, потому что они обладают во многом сходной нейрональной динамикой [Weisz, Obleser, 2014]. Пространственные акустические изменения могут отражаться также и в активности более высоких частот, о чем свидетельствует восстановление мощности гамма-колебаний в реакции на движение стимулов в активных условиях.
Список литературы
Варфоломеев А.Л., Старостина Л.В. Слуховые вызванные потенциалы человека при иллюзорном движении звукового образа. Рос. физиол. журн. им. Сеченова. 2006. 92 (9): 1046–1057.
Кропотов Ю.Д. Количественная ЭЭГ, когнитивные вызванные потенциалы мозга человека и нейротерапия. Перевод с англ. под ред. В.А. Пономарева. Донецк: Изд. Заславский А.Ю. 2010. 512 с.
Шестопалова Л.Б., Василенко Ю.А. Различение движущихся звуковых образов: негативность рассогласования и психофизическое тестирование. Физ. Чел. 2010. 36 (2): 23–31.
Шестопалова Л.Б., Петропавловская Е.А., Семенова В.В., Никитин Н.И. Вызванные потенциалы на звуковые стимулы с отсроченным началом движения в условиях активного и пассивного прослушивания. Журнал высш. нервн. деят. им. И.П. Павлова. 2016. 66 (5): 1–14.
Arnal L.H., Giraud A.L. Cortical oscillations and sensory predictions. Trends Cogn. Sci. 2012. 16 (7): 390–398. https://doi.org/10.1016/j.tics.2012.05.003
Bishop D.V.M., Hardiman M.J. Measurement of mismatch negativity in individuals: A study using single-trial analysis. Psychophysiol. 2010. 47: 697–705. https://doi.org/10.1111/j.1469-8986.2009.00970.x
Briley P.M., Kitterick P.T., Summerfield A.Q. Evidence for opponent process analysis of sound source location in humans. J. Assoc. Res. Otolaryngol. 2012. 14: 83–101. https://doi.org/10.1007/s10162-012-0356-x
Costa-Faidella J., Sussman E.S., Escera C. Selective entrainment of brain oscillations drives auditory perceptual organization. NeuroImage. 2017. 159: 195–206. https://doi.org/10.1016/j.neuroimage.2017.07.056
Delorme A., Sejnowski T., Makeig S. Enhanced detection of artifacts in EEG data using higher-order statistics and independent component analysis. Neuroimage. 2007. 34 (4): 1443–1449. https://doi.org/10.1016/j.neuroimage.2006.11.004
Engel A.K., Fries P., Singer W. Dynamic predictions: oscillations and synchrony in top-down processing. Nat. Rev. Neurosci. 2001. 2: 704–716.
Fuentemilla L., Marco-Pallarés J., Grau C. Modulation of spectral power and of phase resetting of EEG contributes differentially to the generation of auditory event-related potentials. NeuroImage. 2006. 30: 909–916.
Fuentemilla L., Marco-Pallarés J., Münte T.F., Grau C. Theta EEG oscillatory activity and auditory change detection. Brain Res. 2008. 1220: 93–101.
Fujioka T., Trainor L.J., Large E.W., Ross B. Internalized Timing of Isochronous Sounds Is Represented in Neuromagnetic Beta Oscillations. J. Neurosci. 2012. 32 (5): 1791–1802. https://doi.org/10.1523/JNEUROSCI.4107-11.2012
Getzmann S. Effect of auditory motion velocity on reaction time and cortical processes. Neuropsychologia. 2009. 47: 2625–2633. https://doi.org/10.1016/j.neuropsychologia.2009.05.012
Getzmann S. Auditory motion perception: onset position and motion direction are encoded in discrete processing stages. Eur. J. Neurosci. 2011. 33: 1339–1350. https://doi.org/10.1111/j.1460-9568.2011.07617.x
Getzmann S., Lewald J. Effects of natural versus artificial spatial cues on electrophysiological correlates of auditory motion. Hear Res. 2010a. 259: 44–54.
Getzmann S., Lewald J. Shared cortical systems for processing of horizontal and vertical sound motion. J. Neurophysiol. 2010b. 103: 1896–1904.
Getzmann S., Lewald J. Cortical processing of change in sound location: smooth motion versus discontinuous displacement. Brain Res. 2012. 1466: 119–127. https://doi.org/10.1016/j.brainres.2012.05.033
Haegens S., Golumbic E.Z. Rhythmic facilitation of sensory processing: A critical review. Neurosci. Biobehav. Rev. 2018. 86: 150–165. https://doi.org/10.1016/j.neubiorev.2017.12.002
Herrmann C.S., Grigutsch M., Busch N.A. EEG oscillations and wavelet analysis. In T.C. H and y (Ed.), Event-related potentials: A methods h and book. 2005. Cambridge, MA: MIT Press.
Hsiao F.J., Wu Z.A., Ho L.T., Lin Y.Y. Theta oscillation during auditory change detection: An MEG study. Biol. Psychol. 2009. 81: 58–66.
Klatt L.-I., Getzmann S., Wascher E., Schneider D. The contribution of selective spatial attention to sound detection and sound localization: Evidence from event-related potentials and lateralized alpha oscillations. Biol. Psychol. 2018. 138: 133–145.
Klimesch W., Sauseng P., Hanslmayr S., Gruber W., Freunberger R. Event-related phase reorganization may explain evoked neural dynamics. Neurosci. and Biobehav. Reviews. 2007. 31: 1003–1016. https://doi.org/10.1016/j.neubiorev.2007.03.005
Kreitewolf J., Lewald J., Getzmann S. Effect of attention on cortical processing of sound motion: An EEG study. NeuroImage. 2011. 54: 2340–2349.
Krumbholz K., Hewson-Stoate N., Schönwiesner M. Cortical response to auditory motion suggests an asymmetry in the reliance on inter-hemispheric connections between the left and right auditory cortices. J. Neurophysiol. 2007. 97: 1649–1655.
Magezi D.A., Krumbholz K. Evidence for opponent-channel coding of interaural time differences in human auditory cortex. J. Neurophysiol. 2010. 104: 1997–2007.
Makeig S., Debener S., Onton J., Delorme A. Mining event-related brain dynamics. Trends Cogn. Sci. 2004. 8(5): 204–210. https://doi.org/10.1016/j.tics.2004.03.008
Makeig S., Westerfield M., Jung T.-P., Enghoff S., Townsend J., Courchesne E., Sejnowski T.J. Dynamic brain sources of visual evoked responses. Science. 2002. 295: 690–694.
Mäkelä J.P., McEvoy L. Auditory evoked fields to illusory sound source movements. Exp. Brain Res. 1996. 110: 446–454.
Ng B.S.W., Schroeder T., Kayser C. A Precluding But Not Ensuring Role of Entrained Low-Frequency Oscillations for Auditory Perception. J. Neurosci. 2012. 32 (35): 12268–12276. https://doi.org/10.1523/JNEUROSCI.1877-12.2012
Pfurtscheller G. Induced oscillations in the alpha band: functional meaning. Epilepsia. 2003. 44 (Suppl 12): 2–8.
Schroeder C.E., Lakatos P. Low-frequency neuronal oscillations as instruments of sensory selection. Trends Neurosci. 2009. 32: 9–18.
Shestopalova L.B., Petropavlovskaia E.A., Vaitulevich S.Ph.,Vasilenko Yu.A., Nikitin N.I., Altman J.A. Discrimination of auditory motion patterns: The mismatch negativity study. Neuropsychologia. 2012. 50: 2720–2729.
Stefanics G., Hangya B., Hernádi I., Winkler I., Lakatos P., Ulbert I. Phase Entrainment of Human Delta Oscillations Can Mediate the Effects of Expectation on Reaction Speed. J. Neurosci. 2010. 30 (41): 13578–13585.
VanRullen R., Busch N.A., Drewes J., Dubois J. Ongoing EEG phase as a trial-by-trial predictor of perceptual and attentional variability. Front. Psychol. 2011. 2: 60.https://doi.org/10.3389/fpsyg.2011.00060
Weisz N., Obleser J. Synchronisation signatures in the listening brain: a perspective from non-invasive neuroelectrophysiology. Hear Res. 2014. 307: 16–28. https://doi.org/10.1016/j.heares.2013.07.009
Womelsdorf T., Fries P. The role of neuronal synchronization in selective attention. Curr. Opin. Neurobiol. 2007.17: 154–160. https://doi.org/10.1016/j.conb.2007.02.002
Wöstmann M., Herrmann B., Maess B., Obleser J. Spatiotemporal dynamics of auditory attention synchronize with speech. 2016. PNAS 113 (14): 3873–3878. www.pnas.org/cgi/doi/10.1073/pnas.1523357113.
Zoefel B., ten Oever S., Sack A.T. The Involvement of Endogenous Neural Oscillations in the Processing of Rhythmic Input: More Than a Regular Repetition of Evoked Neural Responses. Front. Neurosci. 2018. 12: 95. https://doi.org/10.3389/fnins.2018.00095
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


