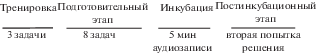Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 5, стр. 601-608
Эффект инкубации и активность сетей покоя
Г. Г. Князев 1, *, А. В. Бочаров 1, А. Н. Савостьянов 1, 2, Б. М. Величковский 3
1 Научно-исследовательский институт физиологии и фундаментальной медицины
Новосибирск, Россия
2 Институт цитологии и генетики СОРАН
Новосибирск, Россия
3 НИЦ “Курчатовский институт”
Москва, Россия
* E-mail: knyazev@physiol.ru
Поступила в редакцию 24.01.2020
После доработки 02.05.2020
Принята к публикации 01.06.2020
Аннотация
На протяжении десятилетий в психологии и истории науки известен, но до сих пор не получил должного объяснения феномен инкубации – подготовка решения в периоды относительного покоя. Нашей задачей в этом исследовании было выявление на основе ЭЭГ-данных паттернов коннективности сетей покоя в период инкубации, которые связаны с успешностью решения задач в постинкубационный период. Испытуемые выполняли тест отдаленных ассоциаций в три этапа – первая попытка, инкубация (прослушивание иррелевантной для решения задач теста аудиозаписи) и вторая попытка решения нерешенных задач. У испытуемых, которые после инкубации решили хотя бы одну дополнительную задачу, в инкубационный период выявлена более выраженная связь левой сенсомоторной коры с островком и сниженная – с левой дорсолатеральной лобной корой. Эти данные согласуются с представлением, согласно которому на этапе поиска решения оптимальным является сочетание сниженной активности сети исполнительного контроля, ведущее к дефокусировке внимания, и повышенной активности сети мотивационной значимости.
ВВЕДЕНИЕ
На протяжении десятилетий в психологии мышления и истории науки обсуждается, но до сих пор не получил должного объяснения феномен инкубации – подготовка решения в периоды относительного покоя, когда нет признаков целенаправленных усилий, направленных на решение задачи. Этот феномен многократно описан в воспоминаниях выдающихся представителей творческих профессий [Ghiselin, 1952] и довольно рано стал компонентом теоретических моделей креативности. Так, по теории Уоллеса, процесс возникновения креативной идеи проходит четыре стадии: подготовка (накопление необходимой информации), инкубация (процессы, происходящие в период, когда сознательное внимание не направлено на решение творческой задачи), инсайт (креативная идея “вспыхивает” в сознании) и верификация (креативная идея подвергается проверке) [Wallas, 1926]. В последующие годы эта и другие теоретические модели подверглись эмпирической проверке, однако ясность в понимании роли инкубации в креативном мышлении так и не была достигнута. Эмпирические данные в целом показывают, что период инкубации, действительно, способствует появлению креативной идеи [Dodds et al., 2003; Sio, Ormerod, 2009]. Непонятно, однако, почему и как это происходит. Один из возможных путей к пониманию этой проблемы – это изучение активности мозга в период инкубации и решения креативных задач.
В последние два десятилетия с помощью преимущественно метода функциональной магниторезонансной томографии (фМРТ) было показано, что спонтанное блуждание мыслей (mind-wandering) связано с активностью так называемой дефолтной сети (default mode network, DMN), включающей области лобной и теменной коры [Mason et al., 2007; Christoff et al., 2009]. Эта сеть особенно активна в периоды покоя [Buckner et al., 2008] и, вероятно, участвует в сложных, преимущественно подсознательных процессах обработки информации [Vincent et al., 2007; Yang et al., 2010]. В силу временной динамики активности эту сеть иногда называют негативно связанной с задачей и функционально противопоставляют сетям, участвующим в регуляции внимания. Их называют сетями, позитивно связанными с задачей, или “антидефолтными сетями” [Fox et al., 2005]. Наиболее важные из этих сетей – это сеть исполнительного контроля (central executive network, CEN), включающая дорсолатеральную лобную и заднюю теменную кору, и сеть мотивационной значимости (salience network, SN), включающая островок и переднюю часть поясной извилины [Cole, Schneider, 2007].
Исходя из идей о важности подсознательных процессов и “расфокусировки” внимания для генерации креативных решений, естественно ожидать, что DMN будет играть в этом важную роль, в то время как активность CEN и SN должна скорее препятствовать этому. В соответствии с представлением о роли DMN, данные структурной МРТ показывают, что психометрические оценки креативности коррелируют с объемом ткани коры, входящей в эту сеть [Jung et al., 2010; Kühn et al., 2013]. Функциональные исследования, однако, дают более противоречивую картину. Во-первых, показано, что в периоды блуждания мыслей наблюдается активация не только DMN, но и сетей, контролирующих внимание [Smallwood, Schooler, 2006; Smallwood et al., 2009], а инсайт является лишь кульминацией серии состояний и процессов мозга, оперирующих на различных временных шкалах [Kounios, Beeman, 2009]. В результате обзора 72 нейровизуализационных исследований креативности и инсайта авторы приходят к выводу, что существующие данные противоречивы, и креативность, судя по этим данным, не связана с каким-то одним ментальным процессом или областью мозга [Dietrich, Kanso, 2010]. Таким образом, DMN можно считать одной из, но не единственной сетью, связанной с креативностью [Величковский и соавт., 2019].
Необходимо отметить, что подавляющее большинство этих данных получено с помощью фМРТ. Этот метод имеет очевидные достоинства при изучении пространственной организации функциональной активности мозга, однако он обладает и рядом недостатков. Наиболее существенным из них является то, что до сих пор непонятно – в какой степени измеряемые этим методом изменения уровня оксигенации крови связаны с изменением информационных аспектов активности нейронов [Debener et al., 2006]. Это означает, что изучение функций мозга не должно ограничиваться только рамками фМРТ. Оно обязательно должно быть дополнено изучением регистрируемых с помощью ЭЭГ осцилляторных процессов, функциональные корреляты которых достаточно хорошо изучены [Basar, 1999; Knyazev, 2007]. Однако анализ ЭЭГ-коррелятов активности DMN и других сетей сопряжен с методическими трудностями, главная из которых – отсутствие прямой информации о пространственной локализации в мозгу выявляемых с помощью ЭЭГ процессов. В недавних работах эти трудности были в определенной степени преодолены, и были разработаны методы, позволяющие исследовать электрофизиологические корреляты активности сетей покоя [Brookes et al., 2011a, 2011b, 2012; De Pasquale et al., 2010; Hipp et al., 2012; Knyazev et al., 2016, 2018; Siems et al., 2016; Wens et al., 2014].
Задачей данной работы было выявление связи паттернов коннективности сетей покоя в период инкубации (по ЭЭГ-данным) с успешностью решения задач в постинкубационный период. В силу неопределенности существующих данных мы сформулировали две альтернативные гипотезы. Исходя из идей о важности подсознательных процессов и “расфокусировки” внимания для генерации креативных решений, можно было ожидать, что у испытуемых, решивших хотя бы одну задачу после инкубации, коннективность DMN в период инкубации будет преобладать над коннективностью CEN и SN. Вторая гипотеза основывалась на данных о роли сетей, контролирующих внимание в процессах возникновения спонтанных мыслей и генерации креативной идеи [Smallwood, Schooler, 2006; Smallwood et al., 2009]. По существующим данным, на разных этапах генерации креативной идеи оптимальными являются разные соотношения активности CEN и SN [Величковский и соавт., 2019]. Помимо основной роли SN, состоящей в выявлении в потоке информации наиболее значимых стимулов, эта сеть также участвует в переключении фокуса внимания с внешнего мира на внутренний [Cocchi et al., 2013]. На этапе поиска вариантов решения в период инкубации активность CEN, основная роль которой – поддержание внимания к текущей задаче (в данном случае это прослушивание отвлекающего текста), должна быть снижена, а SN – повышена. Соответственно, согласно второй нашей гипотезе, у испытуемых, решивших хотя бы одну задачу после инкубации, коннективность SN в период инкубации должна преобладать над коннективностью CEN. Поскольку, с одной стороны, поиск вариантов решения связан с извлечением следов памяти, а с другой стороны, инсайт сопровождается эмоциями, тестирование этих гипотез было решено провести в тета-диапазоне, так как, по существующим данным, тета-осцилляции связаны с памятью и эмоциональными процессами [Bekkedal et al., 2011; Knyazev, 2007].
МЕТОДИКА
Выборка включала 63 человека (32 мужчины, средний возраст 26.3, SD = 10.3) и состояла из студентов и преподавателей Новосибирского государственного университета. Протокол исследования был утвержден этическим комитетом Института физиологии и фундаментальной медицины. Информированное согласие было получено у всех испытуемых в соответствии с этическими нормами Хельсинкской декларации 2013 г. Сначала записывалась ЭЭГ в состоянии покоя в течение 6 мин. После этого испытуемые выполняли тест отдаленных ассоциаций [Mednick, Mednick, 1959, 1962]. В качестве стимулов использовали русскоязычные задания теста [Валуева, Белова, 2011]. Задача представляет собой тройку слов, к которой надо найти четвертое слово, образующее устойчивое словосочетание с каждым из трех слов. Задача считалась успешно решенной, если участник в заданное время набирал на клавиатуре правильный ответ, во всех остальных случаях считалось, что задача не была решена. Решение задач было разбито на 3 этапа – подготовительный (первая попытка решения), инкубационный и постинкубационный (вторая попытка решения). В качестве инкубационной задачи использовалась пятиминутная аудиозапись отрывка из русского перевода книги С. Лема “Магелланово облако”. В тексте были заменены отдельные слова, которые совпадали со словами заданий или ответов. Отредактированный текст был зачитан на диктофон мужским голосом. На первом этапе после инструкции была тренировочная серия с тремя задачами, после чего в случайном порядке предъявлялись 8 задач (30 с на задачу или до ответа). На третьем этапе предъявлялись задачи, на которые испытуемый не дал правильный ответ с первой попытки (30 с на задачу или до ответа). Схема эксперимента представлена на рис. 1.
Запись ЭЭГ производилась на установке Brain Products (Германия) с использованием стандартной шапочки с 127 электродами, расположенными по системе 10-5, при частоте оцифровки 1000 Гц. В качестве референта использовали Cz. Индивидуальная позиция каждого электрода определялась с помощью дигитайзера FASTRAK (Polhemus). Артефакты удалялись с помощью анализа независимых компонент в программе EEGlab [Delorme, Makeig, 2004] и данные пересчитывались на усредненный референт. Поскольку анализ коннективности требует непрерывной записи [Brookes et al., 2011], деление на эпохи не проводилось – анализировался весь массив данных, относящихся к периоду инкубации. Методы выявления сетей покоя на основе электрофизиологических данных в последние годы получают все большее распространение и подробно описаны во многих работах [Brookes et al., 2011a, 2011b, 2012; De Pasquale et al., 2010; Knyazev et al., 2016, 2018]. В этом исследовании мы использовали стандартный набор методов. Данные были отфильтрованы в двух стандартных диапазонах (тета – 4–8 Гц и альфа – 8–12 Гц) с использованием фильтра Butterworth и функции filtfilt программной среды Matlab, которая фильтрует данные в прямом и обратном направлении для минимизации фазовых искажений. Локализация источников осуществлялась методом формирователя пучка (linearly constrained minimum-variance beamformer, Van Veen et al., 1997) в пакете DAiSS (https://code.google.com/p/spm-beamforming-toolbox/). Этот метод наиболее часто применяется при выявлении сетей покоя на основе электрофизиологических данных. В многочисленных работах показано, что выявленные с его помощью сети покоя хорошо воспроизводят топографию этих сетей, описанную в фМРТ-исследованиях [Brookes et al., 2011a, 2011b, 2012; De Pasquale et al., 2010; Knyazev et al., 2016, 2018]. В качестве модели головы использовали модель граничных элементов, построенную на основе стандартной головы, но скорректированную в SPM12 в соответствии с индивидуальной формой головы, вычисляемой исходя из измеренных координат электродов. Далее проводилась коррекция утечки сигнала методом ортогонализации. После коррекции к временным рядам было применено преобразование Гилберта, позволяющее получить огибающую сигнала, которая после снижения временного разрешения до 1 с использовалась для расчета корреляций [Brookes et al., 2011].
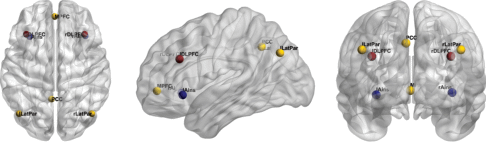
В качестве областей интереса (ОИ) при расчете коннективности брали точки, расположенные в центрах дефолтной системы, сети исполнительного контроля и сети мотивационной значимости (MNI-координаты) – медиальная префронтальная кора (–1, 49, –2), задняя часть поясной извилины (–5, –53, 41), левая (–45, –71, 35) и правая (45, –71, 35) латеральная париетальная кора, левая (–36, 27, 29) и правая (36, 27, 29) дорсолатеральная лобная кора и левая (–32, 24, –6) и правая (37, 25, –4) островковая кора. Расположение ОИ показано на рис. 2. Координаты точек были взяты нами из опубликованных ранее фМРТ-исследований [Corbetta, Shulman, 2002; Fox et al., 2005]. Для каждой ОИ данные усреднялись в пределах сферы диаметром 10 мм и центром в соответствующей точке, и рассчитывались корреляции Пирсона между временным ходом активности в ОИ и во всех остальных вокселях. К коэффициентам корреляции была применена трансформация Фишера. Полученные карты коннективности переводили в NIFTI-формат, и статистический анализ второго уровня проводили в пакете SPM-12. Всего было проведено два теста. Гипотеза о доминировании DMN тестировалась с использованием дисперсионного анализа с одним межсубъектным фактором с двумя уровнями (ни одной решенной задачи, гр 0, и хотя бы одна решенная задача, гр 1) и двумя внутрисубъектными факторами – сеть (DMN vs CEN + SN) и ОИ (4 уровня). Тестировался контраст, согласно которому коннективность DMN преобладала в гр 1, а коннективность CEN + SN – в гр 0. Вторая гипотеза также тестировалась с использованием дисперсионного анализа с одним межсубъектным фактором (то же, что и выше) и двумя внутрисубъектными факторами – сеть (CEN vs SN) и ОИ (2 уровня). Тестировался контраст, согласно которому коннективность SN преобладала в гр 1, а коннективность CEN – в гр 0. Достоверность эффектов оценивали с помощью двойного порога – на уровне вокселя (p < 0.001) и на уровне кластера (FWE-corrected p < 0.025). Последний порог рассчитан с поправкой Бонферрони на количество тестов (0.05/2).
Рис. 2.
Расположение областей интереса (ОИ), с которыми рассчитывались карты коннективности. Желтым показаны ОИ DMN, красным – CEN и синим – SN.
Fig. 2. The localization of seeds that were used to obtain connectivity maps. Yellow – DMN, red – CEN, and blue – SN.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Поведенческие данные
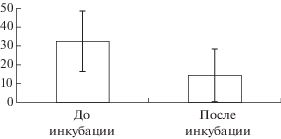
До инкубации из восьми предъявленных задач в среднем было решено 2.8 (разброс от 0 до 7). После инкубации среднее количество решенных задач из числа повторно предъявленных было 0.86 (разброс от 0 до 3) (рис. 3). После инкубации 24 испытуемых не решили ни одной задачи, остальные 39 решили от одной до трех задач.
Рис. 3.
Процент (стандартное отклонение) решенных задач от количества предъявленных до и после инкубации.
Fig. 3. The percent (standard deviation) of solved problems before and after the incubation.
Данные ЭЭГ
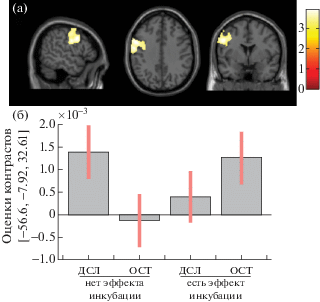
При анализе связи успешности/неуспешности решения задач в постинкубационный период с активностью сетей покоя в период инкубации гипотеза о доминировании DMN в группе испытуемых, успешно решивших хотя бы одну задачу, была отвергнута. Достоверный эффект был выявлен при тестировании второй гипотезы. Различие между группами выявилось по показателям коннективности сетей CEN и SN с областью моторной коры (precentral gyrus, PG). Этот эффект был выявлен в левом полушарии. У испытуемых из гр 1, по сравнению с испытуемыми из гр 0, PG была сильнее связана с левой островковой и слабее с левой дорсолатеральной лобной корой [x = –55, y = –8, z = 35, T(1, 244) = = 3.93, k = 1169, pvox < 0.001, FWE-corrected pclust = 0.013 (рис. 4).
Рис. 4.
Связь показателей коннективности в тета-диапазоне для сети исполнительного контроля (ДСЛ, CEN) и сети мотивационной значимости (ОСТ, SN) в период инкубации с успешностью решения задач в постинкубационный период (группы “нет эффекта инкубации” и “есть эффект инкубации”). (а) – локализация эффекта в левой моторной коре; (б) – величина эффекта для каждой сети в каждой группе.
Fig. 4. Association of connectivity of the central executive network (ДСЛ, CEN) and the salience network (ОСТ, SN) in the theta frequency band during the incubation period with the success of problem solving in the post-incubation period (groups “there is no incubation effect” – left, and “there is an incubation effect” – right).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нашей задачей в этом исследовании было выявление паттернов коннективности сетей покоя в период инкубации, которые связаны с успешностью решения задач в постинкубационный период. Достоверный эффект найден в тета-диапазоне для двух “антидефолтных сетей”, участвующих в регуляции внимания. У испытуемых, успешно решивших задачи в постинкубационный период, в инкубационном периоде были выявлены более выраженная связь левой сенсомоторной коры с островком и сниженная связь с левой лобной дорсолатеральной корой. Поскольку эффект выявлен в тета-диапазоне, можно думать, что эмоциональное напряжение и активный поиск в памяти вариантов решения нерешенных задач в период инкубации отличают испытуемых, нашедших решение в постинкубационный период, от тех, кто его не нашел.
Достоверный эффект выявлен в левом полушарии, что связано, вероятно, с вербальным характером теста отдаленных ассоциаций. Кроме того, левая PG – это область коры, которая активируется, когда испытуемый готовится нажать клавишу правой рукой. Что касается островка, то он участвует в большом спектре эмоциональных процессов и является центральной структурой SN [Menon, Uddin, 2010]. На этапе поиска вариантов решения активность CEN, которая выполняет роль как бы внутреннего критика, должна быть снижена, а SN повышена. Активность CEN становится важной на более поздних этапах – при отборе найденных вариантов [Jung et al., 2013]. Можно предположить, что в период инкубации у испытуемых, решивших впоследствии хотя бы одну задачу, происходил активный поиск вариантов решения. Соответственно PG находилась под меньшим контролем CEN, основная роль которой – поддержание внимания к текущей задаче (в данном случае это прослушивание отвлекающего текста) и критический разбор уже найденных вариантов, и под большим контролем SN, которая участвует в ориентации внимания на внутренние стимулы и поиске наиболее ярких вариантов решения основной задачи.
Одним из недостатков использованной экспериментальной схемы является то, что она, в силу длительности экспериментальной процедуры, не позволяет проводить повторные предъявления стимулов, сопровождающиеся инкубацией. Это исключает возможность внутрисубъектного анализа эффекта инкубации. Использованный в данной работе межсубъектный анализ обладает малой статистической мощностью, что, возможно, явилось причиной отсутствия некоторых ожидаемых эффектов.
ЗАКЛЮЧЕНИЕ
Нашей задачей в этом исследовании было выявление паттернов коннективности сетей покоя в период инкубации, которые связаны с успешностью решения задач в постинкубационный период. У испытуемых, которые после инкубации решили хотя бы одну дополнительную задачу, в инкубационный период выявлена более выраженная связь левой сенсомоторной коры с островком и сниженная – с левой лобной дорсолатеральной корой. Эти данные согласуются с представлением, согласно которому на этапе поиска решения творческой задачи оптимальным является сочетание сниженной активности сети исполнительного контроля и повышенной активности сети мотивационной значимости.
Работа выполнена при поддержке грантов Российского фонда фундаментальных исследований (РФФИ) (КОМФИ №18-00-00939, разработка экспериментальной парадигмы, сбор и анализ данных) и (№18-00-00569, подготовка статьи) и при частичной поддержке федерального бюджета на проведение фундаментальных научных исследований (тема № АААА-А16-116021010228-0, разработка методов анализа данных).
Список литературы
Валуева E.A., Белова C.C. Диагностика творческих способностей: методы, проблемы, перспективы. Творчество: от биологических предпосылок к культурным феноменам. Под ред. Д.B. Ушаков. Москва: Издательство “Институт психологии РАН”, 2011. 625–647 с.
Величковский Б.М., Князев Г.Г., Валуева E.A., Ушаков Д.В. Новые подходы в исследованиях творческого мышления: от феноменологии инсайта к объективным методам и нейросетевым моделям. Вопросы психологии. 2019. 64 (3): 3–16.
Basar E. Brain function and oscillations. II. Integrative brain function. Neurophysiology and cognitive processes. Berlin: Springer, 1999.
Bekkedal M.Y., Rossi III J., Panksepp J. Human brain EEG indices of emotions: delineating responses to affective vocalizations by measuring frontal theta event-related synchronization. 2011. Neurosci. Biobehav. Rev. 35 (9): 1959–1970.
Brookes M.J., Hale J.R., Zumer J.M., Stevenson C.M., Francis S.T., Barnes G.R., Owen J.P., Morris P.G., Nagarajan S.S. Measuring functional connectivity using MEG: methodology and comparison with fcMRI. Neuroimage. 2011a. 56: 1082–1104.
Brookes M.J., Woolric M., Luckhoo H., Price D., Hale J.R., Stephenson M.C., Barnes G.R., Smith S.M., Morris P.G. Investigating the electrophysiological basis of resting state networks using magnetoencephalography. PNAS. 2011b. 108 (40): 16783–16788.
Brookes M.J., Liddle E.B., Hale J.R., Woolrich M.W., Luckhoo H., Liddle P.F., Morris P.G. Task induced modulation of neural oscillations in electrophysiological brain networks. Neuroimage. 2012. 63 (4): 1918–1930.
Buckner R.L., Andrews-Hanna J.R., Schacter D.L. The brain default’s network: anatomy, function, and relevance to disease. Ann. N. Y. Acad. Sci. 2008. 1124: 1–38.
Christoff K., Gordon A., Smith R. Experience sampling during fMRI reveals default network and executive system contributions to mind wandering. Proc. Natl. Acad. Sci. U.S.A. 2009. 106: 8719–8724.
Cocchi L., Zalesky A., Fornito A., Mattingley J.B. Dynamic cooperation and competition between brain systems during cognitive control. Trends Cogn. Sci. 2013. 17: 494–501.
Cole M.W., Schneider W. The cognitive control network: integrated cortical regions with dissociable functions. Neuroimage. 2007. 37: 343–360.
Corbetta M., Shulman G.L. Control of goal-directed and stimulus-driven attention in the brain. Nature reviews neuroscience. 2002. 3: 201–215.
Debener S., Ullsperger M., Siegel M., Fiehler K., von Cramon D.Y., Engel A.K. Single-trial EEG/fMRI reveals the dynamics of cognitive function. Trends Cogn. Sci. 2006. 10: 558–563.
Delorme A., Makeig S. EEGLAB: an open source toolbox for analysis of single-trial EEG dynamics including independent component analysis. J. Neurosci. Methods. 2004. 134: 9–21.
De Pasquale F., Della Penna S., Snyder A.Z., Lewis C., Mantini D., Marzetti L., Belardinelli P., Ciancetta L., Pizzella V., Romani G.L., Corbetta M. Temporal dynamics of spontaneous MEG activity in brain networks. PNAS. 2010. 107(13): 6040–6045.
Dietrich A., Kanso R. A review of EEG, ERP and neuroimaging studies of creativity and insight. Psychol. Bull. 2010. 136: 822–848.
Dodds R.D., Ward T.B., Smith S.M. Incubation in problem solving and creativity. In The Creativity Research Handbook (Vol. 3). Ed. M.A. Runco, Cresskill, NJ: Hampton, 2003.
Fox M.D., Snyder A.Z., Vincent J.L., Corbetta M., Van Essen D.C., Raichle M.E. The human brain is intrinsically organized into dynamic, anticorrelated functional networks. PNAS. 2005. 102 (27): 9673–9678.
Ghiselin B. The Creative Process. NY: New American Library, 1952.
Hipp J.F., Hawellek D.J., Corbetta M., Siegel M., Engel A.K. Large-scale cortical correlation structure of spontaneous oscillatory activity. Nat. Neurosci. 2012. 15 (6): 884–890.
Jung R.E., Segall J.M., Bockholt H.J., Chavez R.S., Flores R., Haier R.J. Neuroanatomy of creativity. Hum. Brain Mapp. 2010. 31: 398–409.
Jung R.E., Mead B.S., Carrasco J., Flores R.A. The structure of creative cognition in the human brain. Front. Hum. Neurosci. 2013. 7: 1–13.
Knyazev G.G. Motivation, emotion, and their inhibitory control mirrored in brain oscillations. Neuroscience Biobehav. Rev. 2007. 31: 377–395.
Knyazev G.G. EEG correlates of self-referential processing. Front. Hum. Neurosci. 2013. 7: 264.
Knyazev G.G., Savostyanov A.N., Bocharov A.V., Tamozhnikov S.S., Saprigyn A.E. Task-positive and task-negative networks and their relation to depression: EEG beamformer analysis. Behav. Brain Res. 2016. 306: 160–169.
Knyazev G.G., Savostyanov A.N., Bocharov A.V., Brak I.V., Osipov E.A., Filimonova E.A., Saprigyn A.E., Aftanas L.I. Task-positive and task-negative networks in major depressive disorder: A combined fMRI and EEG study. J. Affect. Disord. 2018. 235: 211–219.
Kounios J., Beeman M. The Aha! Moment the cognitive neuroscience of insight. Curr. Dir. Psychol. Sci. 2009. 18: 210–216.
Kühn S., Ritter S.M., Müller B.C.N., van Baaren R.B., Brass M., Dijksterhuis A. The Importance of the Default Mode Network in Creativity – A Structural MRI Study. J. Creat. Behav. 2014. 48: 152–163.
Mason M.F., Norton M.I., Van Horn J.D., Wegner D.M., Grafton S.T., Macrae C.N. Wandering minds: the default network and stimulus-independent thought. Science. 2007. 315: 393–395.
Mednick S.A., Mednick M.T. Remote Associates Test, college and adult form. 1959, 1962.
Menon V., Uddin L.Q. Saliency, switching, attention and control: a network model of insula function. Brain Struct. Funct. 2010. 214: 655–667.
Siems M., Pape A.A., Hipp J.F., Siegel M. Measuring the cortical correlation structure of spontaneous oscillatory activity with EEG and MEG. Neuroimage. 2016. 129: 345–355.
Sio U.N., Ormerod T.C. Does incubation enhance problem solving? A meta-analytic review. Psychol. Bull. 2009. 135: 94–120.
Smallwood J., Nind L., O’Connor R.C. When is your head at? An exploration of the factors associated with the temporal focus of the wandering mind. Conscious. Cogn. 2009. 18: 118–125.
Smallwood J., Schooler J.W. The restless mind. Psychol. Bull. 2006. 132, 946–958.
Vincent J.L., Patel G.H., Fox M.D., Snyder A.Z., Baker J.T., Van Essen D.C., Zempel J.M., Snyder L.H., Corbetta M., Raichle M.E. Intrinsic functional architecture in the anaesthetized monkey brain. Nature. 2007. 447: 83–86.
Wallas G. The Art of Thought. NY: Harcourt Brace, 1926.
Wens V., Mary A., Bourguignon M., Goldman S., Marty B., Op D.B.M., Bogaert P.V., Peigneux P., De Tiege X. About the electrophysiological basis of resting state networks. Clin. Neurophysiol. 2014. 125 (8): 1709–1714.
Van Veen B.D., van Drongelen W., Yuchtman M., Suzuki A. Localization of brain electrical activity via linearly constrained minimum variance spatial filtering. IEEE Trans. Biomed. Eng. 1997. 44: 867–880.
Yang J., Weng X., Zang Y., Xu M., Xu X. Sustained activity within the default mode network during an implicit memory task. Cortex. 2010. 46: 354–366.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова