Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 4, стр. 528-542
ДОЛГОВРЕМЕННАЯ СТАБИЛЬНАЯ РЕГИСТРАЦИЯ ИМПУЛЬСНОЙ АКТИВНОСТИ ОДИНОЧНЫХ НЕЙРОНОВ В МИНДАЛИНЕ БОДРСТВУЮЩИХ КРОЛИКОВ
Л. Н. Васильева 1, И. В. Бондарь 1, *
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: bondar@ihna.ru
Поступила в редакцию 05.11.2019
После доработки 12.12.2019
Принята к публикации 16.12.2019
Аннотация
Развитие современных технологий нейрофизиологических исследований сделало возможным одновременное наблюдение за активностью большого количества нейронов, вовлеченных в работу распределенных нейронных сетей целого мозга. Важным аспектом таких исследований является стабильность регистрируемого сигнала, под которой подразумевается возможность отведения сигнала от одной и той же клетки длительное время. Целью нашей работы является оценка возможности использования хронически имплантированных множественных микропроволок для стабильной регистрации активности одиночных нейронов в мозге кролика. Исследования проводились на двух взрослых самцах европейского кролика (Orictolagus cuniculus), которым были имплантированы пучки микропроволок в миндалину. Накопление экспериментальных данных было возможно в течение 72 дней у кролика № 1 и в течение 964 дней – у кролика № 2. Проведенная оценка качества регистрации нейронного сигнала показала, что данная конструкция регистрирующего устройства обеспечивает запись активности одиночных нейронов хорошего качества в течение длительного времени. С использованием автоматизированного алгоритма выявлены стабильно регистрируемые одиночные нейроны, что в будущем позволит всесторонне изучать связь изменений в активности клеток мозга со сложным поведением.
ВВЕДЕНИЕ
Современные методы наблюдения за активностью нейронов позволяют одновременно оценивать активность больших популяций клеток. С помощью регистрации флуоресценции, зависимой от накопления внутриклеточного кальция, возможна одновременная регистрация тысяч клеток [Stosiek et al., 2003]. Особенности использования таких методик зачастую не позволяют осуществлять наблюдение длительное время, которое может быть необходимым для детального изучения свойств нейронов. Некоторые авторы высказывают мысль, что физиологические процессы, которые невозможно детектировать на коротких временных интервалах, могут обнаружиться при длительном времени наблюдения [Thompson, Best, 1990].
Классической методикой исследования мозга является внеклеточная регистрация активности одиночных клеток. Этот экспериментальный подход был предложен еще в 1926 г. [Adrian, 1926] и приобрел популярность в последующие годы [Renshaw и др., 1946].
Эффективность использования данной методики может быть оценена по числу исследованных нейронов в одном эксперименте на одном животном. Первые исследования с использованием данной методики проводили на наркотизированных и обездвиженных животных. При таком подходе число клеток, свойства которых было возможно охарактеризовать, было ограничено, поскольку смещения кончика регистрирующего микроэлектрода относительно нервной клетки могли привести к исчезновению ее активности в записи, тогда как для успешного тестирования физиологических свойств нейрона требовалось использование разнообразного стимульного материала [Hubel, Wiesel, 1959].
Очень скоро возникла необходимость проведения экспериментов и на бодрствующих животных, поскольку наибольшую ценность представляли собой данные по активности нейронов, которые можно было соотнести с поведением животного. В 50-х годах XX столетия были предприняты успешные попытки использования долговременных отведений клеточной активности множественными электродами [Verzeano, 1956; Strumwasser, 1958]. Эффективность экспериментов по регистрации клеточной активности с помощью микроэлектродов можно повысить, имплантируя одновременно несколько хронических микроэлектродов.
В последующие десятилетия были разработаны различные способы производства и имплантации электродов. Разнообразие подходов отражает те требования, которые предъявляются перманентным имплантациям: а) стабильная регистрация активности отдельных клеток; б) низкое травматическое воздействие на ткань мозга и хорошая биологическая совместимость; в) использование нескольких электродов одновременно; г) простота в изготовлении и обслуживании.
Важно отметить, что понятие стабильной регистрации разные авторы определяют по-разному. Чаще всего имеется в виду возможность в течение длительного времени регистрировать импульсную активность одиночных нервных клеток без проверки, действительно ли она принадлежит одному и тому же нейрону. Мы понимаем под стабильностью возможность наблюдения за активностью именно одного и того же нейрона, подтвержденную с помощью объективных методов [Bondar et al., 2009; Васильева и др., 2014].
Одним из способов повысить биосовместимость имплантата является увеличение гибкости имплантируемых микроэлектродов. Чем ближе механические свойства имплантата к свойствам нервной ткани, тем меньше во время имплантации происходит повреждений, провоцирующих тканевый ответ [Chavier et al., 2019]. Возможным выходом может быть использование ультратонких электродов, тогда как необходимая для успешного введения в нервную ткань жесткость конструкции может достигаться за счет заключения проводников в биорастворимый полимер [Guan et al., 2016]. Такая конструкция позволяла после успешного введения в мозг регистрировать активность одних и тех же нейронов в мозге мыши до шести недель при изучении рабочей памяти.
Тетроды и некоторые другие микроэлектроды подразумевают использование специальных методов анализа регистрируемых ими сигналов для оценки стабильности отведения активности от одного и того же нейрона. Классические тетроды использовали для долговременной регистрации активности в моторной коре крысы, которая во время исследования находилась в домашней клетке, при этом наблюдение за нейронной активностью велось непрерывно [Dhawale et al., 2017]. Для успешной реализации данного исследования было критически важно разработать специальное программное обеспечение, которое позволяет регистрировать активность отдельных нейронов. Были учтены все особенности изменений параметров, отражающих стабильность регистрации одиночной клетки, которые были выделены на основе импульсации клетки. В проведенном исследовании стабильная регистрация связанной с поведением активности была возможна в течение 20 дней.
Использование хронически имплантируемых микроэлектродов позволило изучить активность прилежащего ядра у крыс в модели с выработкой наркотической зависимости от кокаина [Coffey et al., 2015]. Действенность данного метода подтверждена также и в экспериментах на низших приматах. Но не всегда хронически имплантированные микроэлектроды могут быть использованы для регистрации активности одного и того же нейрона. Так, в работе М. Ланцилотто с коллегами были использованы хронически имплантированные конструкции с разным количеством микростержней, несущих сайты регистрации. Такие конструкции позволяли увеличить количество одновременно регистрируемых нейронов из области F6, которая у низших приматов связана с кодированием хватательных движений рук [Lanzilotto et al., 2016]. Данный подход позволяет накопить совокупно большой объем данных и снизить повреждающее воздействие, которое неизбежно оказывается при ежедневном погружении микроэлектрода. В других успешных экспериментах с приматами, в лаборатории д-ра Дэвида Леопольда, использование технологий стабильной регистрации отдельных клеток с одной стороны позволило связать активность нейронов с активацией глобальных сетей мозга [Park et al., 2018], а с другой – выявить особенности обработки зоосоциальных сигналов, которые могут быть важны для обеспечения взаимоотношений в группе обезьян [McMahon et al., 2015].
Рассмотренные примеры использования хронически имплантируемых электродов демонстрируют их преимущества при изучении вовлечения нейронов в сложные поведенческие задачи. Нам особенно интересно связать активность отдельных нейронов с зоосоциальными взаимодействиями. Ранее было показано, что клетки сенсомоторной области коры могут быть задействованы в организации взаимодействий между животными [Швыркова, Андрушко, 1990]. Животные даже с простыми социальными сообществами могут быть моделью для нейрофизиологических исследований внутривидовой коммуникации. Удобным объектом исследования могут быть кролики, нейроны которых задействованы в обработке коммуникационных сигналов от сородичей или потенциальных угроз.
Целью нашей работы является оценка возможности использования хронически имплантированных множественных микропроволок для стабильной регистрации активности одиночных нейронов в мозге кролика. Для достижения данной цели нам было необходимо решить следующие задачи:
– отладить методику стабильной регистрации активности одиночных нейронов в экспериментах на кроликах;
– провести оценку стабильности ответов одиночных нейронов в течение протяженных промежутков времени;
– оценить реакции нейронов на сенсорные стимулы, которые потенциально могут быть биологически значимыми для животных.
МЕТОДИКА
Исследования проводились на двух взрослых самцах европейского кролика (Orictolagus cuniculus). Все манипуляции с животными выполнялись в соответствии с требованиями Директивы Европейского Парламента и Совета Европейского Союза (2010/63/EU) об использовании животных для экспериментальных исследований и были одобрены Комиссией по биоэтике Института высшей нервной деятельности и нейрофизиологии РАН.
Используемая нами методика изготовления пучков микроэлектродов описана в работе Ю. Крюгера с коллегами [Krüger et al., 2010]. Версия этой методики, используемая в лаборатории физиологии сенсорных систем, описана в нашей предшествующей работе [Бондарь и др., 2014]. Для изготовления пучков микроэлектродов использовали нихромовую проволоку марки IsaOhm диаметром 18 мкм в полиимидной изоляции (Isabellenhuette, ФРГ). У отрезков проволоки длиной 10 см на одном из концов убирали полиимидную изоляцию на расстоянии 2–3 мм. Свободный от изоляции конец припаивали к контактам стандартных разъемов фирмы Omnetics (номер продукта: A79022-001). Места пайки изолировали эпоксидной смолой или акриловым цементом. Часть пучка, которую не предполагалось погружать в мозг, предохраняли от потенциального повреждения с помощью силиконовой трубки. Для обеспечения жесткости пучка во время имплантации погружаемые в мозг части микропроволок заключали в полиимидную трубку (диаметром 0.5 мм). После всех подготовительных манипуляций с помощью ножниц обрезали кончики микропроволок, оставляя 7–8 мм свободно выходящими из фиксирующей трубки. После формирования окончательной конфигурации пучка тестировали импеданс отдельных микроэлектродов, который составлял в среднем 1.07 ± 0.17 МОм при частоте 1 кГц и силе тока 100 нА. Непосредственно перед имплантацией пучок погружали в 70% раствор этилового спирта для стерилизации.
Хирургические операции на животных проводили под общей анестезией. В качестве анестезирующих препаратов использовали комбинацию тилетамина гидрохлорида и золазепама гидрохлорида или пропофол. Имплантацию технологических элементов на голове животных проводили в два этапа: сначала проводили закрепление держателя головы и после этого – пучков микроэлектродов.
Базолатеральная миндалина связана с фронтальной корой и анализом сенсорной информации. Сенсорная информация поступает в миндалину через латеральную группу ядер, обрабатывается локально, а затем переводится в центральное ядро, которое является основным выходом из миндалины. Участие нейронов миндалины в обработке зоосоциальных сигналов было исследовано в экспериментах на обезьянах. Нервные клетки данной области могут отслеживать направление взгляда другой обезьяны [Mosher et al., 2014]. Часть нейронов миндалины обнаруживают высокую чувствительность к зрительной и звуковой компонентам угрожающих или тревожных видео [Kuraoka, Nakamura, 2007; Kuraoka et al., 2015]. К сожалению, работы на других объектах исследования, в частности, грызунах, зачастую ограничиваются лишь изучением влияния удаления миндалины на социальное поведение, тогда как наблюдения за активностью одиночных нервных клеток пополнили бы знания о нормальном функционировании данной части мозга.
Координаты базолатерального ядра миндалины определяли по атласу мозга кролика [Блинков, 1973]. По восстановлении животных после операции начинали эксперименты по регистрации импульсной активности нейронов. Отведение нейронной активности проводили униполярно с помощью оборудования фирмы Intan Technologies (США). В качестве программного обеспечения использовали графический интерфейс некоммерческой организации OpenEphys (США). Оборудование позволяет записывать сигнал от мозга в частотном диапазоне 1–7500 Гц с частотой оцифровки 30 кГц. Во время опыта получаемый сигнал фильтровали в диапазоне 300–7500 Гц и выводили данные всех каналов на монитор для визуализации импульсной активности нейронов.
В эксперименте применялась методика внеклеточной регистрации активности отдельных нейронов. Установка состояла из аппаратного комплекса для многоканальной регистрации нейрофизиологических сигналов фирмы Intan (США) и компьютерного комплекса для предъявления сенсорных стимулов с программным обеспечением Psychtoolbox, работающим в среде программирования Matlab (США). Для синхронизации записи нейронного сигнала с моментами предъявления сенсорных стимулов использовали стандартный TTL-импульс, подаваемый от стимулирующего компьютера на цифровой вход регистрирующей платы Intan (США).
Экспериментальная установка. В опытах бодрствующего кролика мягко фиксировали в ящике таким образом, чтобы экран для проекции зрительных стимулов находился сбоку от животного на расстоянии 50 см от глаза кролика. Голову животного закрепляли в штативе с помощью фиксатора, имплантированного в череп. В 30 см от головы животного находилась колонка, на которую подавались звуки со стимулирующего компьютера.
Во время регистрации нейронных сигналов животным предъявляли изображения хищников, крупных животных, птиц, силуэты птиц и нейтральные пейзажи. Кроме того, были показаны изображения других кроликов в биологически значимых позах: стойка, принюхивание, замирание и бег. Такие изображения мы считали сложными. Всего было использовано 40 разных цветных изображений. Длительность экспозиции составляла 0.5 с с межстимульным интервалом, равным 3 с. В качестве контрольного изображения для сложных зрительных стимулов был использован вращающийся радиальный шахматный паттерн, который, по данным регистрации фМРТ, вызывает выраженную активацию зрительной системы [Logothetis et al., 2001]. В контрольной серии опытов кроликам предъявляли шахматный паттерн в течение 5 с, регистрируя при этом нейронный сигнал. Изображения проецировали на белый экран размером 50 × 70 см. Расстояние до изображения составляло 50 см. В качестве звуковых стимулов были использованы крики хищников и птиц. Длительность слухового стимула составляла в среднем 1.2 с. Во время эксперимента кролику предъявляли по 10–20 повторений каждого зрительного и слухового стимула за экспериментальную сессию, что составляло в общей сложности длительность записи примерно по 40–50 мин.
Регистрация активности одиночных нейронов проводилась одновременно с 64 микроэлектродов с частотой оцифровки 30 кГц на каждом канале. Для выделения потенциалов действия (ПД) одиночных нейронов устанавливали амплитудный порог 50 мкВ, после чего проводили сортировку ПД с помощью программы Offline Sorter (Plexon Inc., США). Оцифрованные ПД отображали в координатах первой и второй главных компонент, в которых каждый ПД был представлен в виде точки. Спайки, различающиеся по форме, занимали различные положения на плоскости первой и второй главных компонент. Группы точек, расположенные на расстоянии друг от друга, считали принадлежащими разным нейронам и выделяли вручную.
Стабильность регистрации оценивали с помощью алгоритма на языке Matlab, разработанном Дж. Фрейзером и Э. Шварцем [Fraser, Schwartz, 2012]. В качестве входных данных алгоритм требует для каждого нейрона средний спайк и последовательность из времен их появления в записи для каждого дня регистрации. Мы часто делали больше одной сессии регистрации в день; в таких случаях мы объединяли все данные за текущий день в единый массив. Алгоритм использует четыре параметра нейронной активности: попарные кросс-коррелограммы между последовательностями спайков, автокоррелограмму, форму ПД и среднюю частоту разряда. Классификация, базирующаяся на четырех параметрах, является более надежной, так как отдельные параметры могут подвергаться изменениям, однако решение о стабильности нейрона выносится на основе сравнения по всем выбранным параметрам.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Хроническая регистрация нейронной активности была проведена на двух кроликах: накопление экспериментальных данных было осуществлено в общей сложности во время 182 сессий записи нейронной активности, что было возможно в течение 72 дней у кролика № 1; а также в 115 сессиях регистрации в течение 964 дней у кролика № 2. В случае кролика № 1 из-за монотонного снижения числа нейронов, доступных для регистрации, было принято решение подвергнуть животное интракардиальной перфузии на 72-й день после имплантации микроэлектродов. У кролика № 2 регистрация активности одиночных нейронов была доступна до самой гибели животного в силу возраста.
Одним из показателей высокого качества регистрации может служить значение отношения амплитуды ПД к усредненной амплитуде шума, полученное в одной сессии по регистрации активности и усредненное по всем микроэлектродам . Как правило, этот показатель был больше 3 (медиана ± интерквартильный размах; кролик № 1: 3.8 ± 2.2; кролик №2: 3.1 ± 1.8). На всем периоде наблюдения как у кролика № 1 (рис. 1 (а)), так и у кролика № 2 (рис. 1 (б)) он оставался неизменным. В отличие от нашей предыдущей работы на обезьянах [Бондарь и др., 2014], мы не наблюдали резких колебаний этого показателя у кроликов.
Рис. 1.
Изменение качества регистрации нейрофизиологического сигнала на хронически имплантированных множественных микроэлектродах. (а, б) – динамика отношения сигнала к шуму: данные по кроликам № 1 и № 2 соответственно. (в, г) – изменения средней амплитуды регистрируемых спайков в течение одной сессии: животные № 1 (в) и № 2 (г). (д) – зависимость количества регистрируемых нейронов, нормированное относительно общего числа имплантированных микропроволок, от времени, прошедшего с момента имплантации: линия с точками в виде кругов соответствует данным по кролику № 1, а линия с точками в виде черных треугольников – кролику № 2. (е, ж) – изменения импеданса микропроволок, измеренного у кроликов № 1 и № 2 в разные дни регистрации. Горизонтальная ось для всех графиков – время, прошедшее с момента имплантации пучка.
Fig. 1. Changes in the quality of registration of a neurophysiological signal on chronically implanted multiple microelectrodes. (a, б) – dynamics of the signal-to-noise ratio: data for rabbits № 1 and № 2, respectively. (в, г) – changes of the average amplitude of spikes recorded during one session: animals № 1 (в) and № 2 (г). (д) – the dependence of the number of registered neurons during the time elapsed since implantation, values are normalized relative to the total number of implanted microwires: a line with markers in the form of circles corresponds to data for rabbit № 1, and a line with black triangles corresponds to rabbit № 2. (е, ж) – changes in the impedance of microwires measured in rabbits № 1 and № 2 on different days of registration. The horizontal axis for all graphs is the time elapsed since the implantation of the microwire bundle.
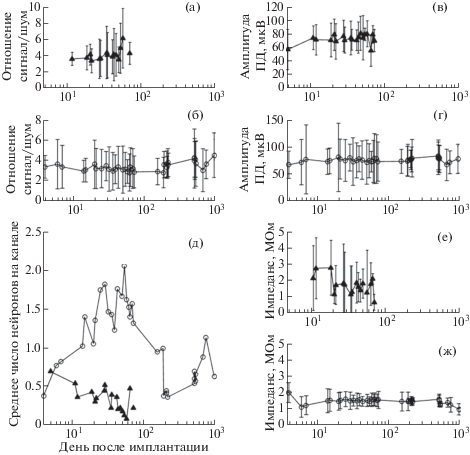
Дополнительным показателем качества сигнала при отведении нейронной активности могут служить амплитуды отдельных ПД. На рис. 1 (в) и (г) показано изменение средней амплитуды ПД, усредненной по всем микропроволокам, в зависимости от времени с момента имплантации. Медианы амплитуд спайков и интерквартильный размах у кроликов № 1 и № 2 составили 70.5 ± 21.3 и 74.3 ± ± 31.9 мкВ соответственно. Средний импеданс микропроволоки, измеренный in vivo после имплантации в мозг, составил 1.8 ± 1.8 и 1.5 ± 0.5 мОм для полученных на кроликах № 1 и № 2 данных соответственно. Некоторое снижение импеданса можно наблюдать у кролика № 1 (рис. 1 (е)) после 20-го дня регистрации, тогда как у кролика № 2 (рис. 1 (ж)) этот показатель в среднем оставался стабильным в течение всего периода регистрации, который в данном случае длился 964 дня.
График изменения числа отдельных нейронов, зарегистрированных в течение одного экспериментального дня на одной проволоке (нормировано к общему числу микропроволок в пучке; рис. 1 (д)), показывает, что в течение первых двух недель после имплантации пучка у кролика № 1 наблюдалось монотонное уменьшение их числа. Это может быть связано с ослаблением крепления имплантата к черепу, что вызывало микродвижения проволок относительно ткани, которые оказывали на нее травмирующее воздействие и ухудшали качество регистрации. У животного № 2, напротив, в течение трех месяцев количество регистрируемых нейронов увеличивалось. Позднее у этого кролика произошло значительное уменьшение количества успешно регистрируемых нейронов. Аналогичные результаты были получены и другими авторами при регистрации с помощью матриц микроэлектродов [Okun et al., 2016]. В этом исследовании также наблюдали снижение числа регистрируемых нейронов к третьему месяцу после имплантации.
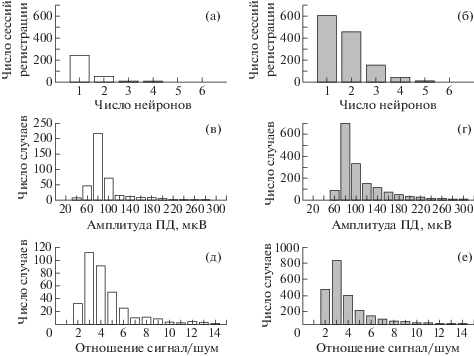
Обобщенные по всем сессиям регистрации данные показаны на рис. 2. Для кролика № 1 (рис. 2 (а, в, д)) и кролика № 2 (рис. 2 (б, г, е)) представлены распределения числа нейронов, одновременно регистрируемых на одном электроде, амплитуды ПД и отношения сигнала к шуму. Качество регистрации в целом было лучше у кролика № 2: у этого животного среднее число нейронов на один канал было выше, а также чаще наблюдались спайки большей амплитуды. Распределения соотношений сигнала к шуму на электродах у обоих кроликов были схожими. Более высокое качество регистрации может быть связано с общей механической стабильностью закрепленного на черепе имплантата и сниженной реакцией ткани на него.
Рис. 2.
Оценка качества регистрации активности одиночных нейронов. (а, б) – распределение количества нейронов, одновременно регистрируемых на одном электроде во время одной сессии. (в, г) – распределение амплитуд ПД, активность которых была зарегистрирована в течение всего периода регистрации активности. (д, е) – распределение отношений сигнала к шуму, рассчитанных за все время наблюдения за активностью. Распределения со столбцами белого цвета соответствуют данным, полученным в экспериментах на кролике № 1, а серого – на кролике № 2.
Fig. 2. Quality of single-unit recordings. (a, б) – distribution of the number of neurons simultaneously recorded on one electrode during one session. (в, г) – the distribution of the amplitudes of spikes, which activity was recorded during the entire period of recordings. (д, е) – distribution of signal-to-noise ratios calculated for the entire time of observation of activity. Distributions with white bars correspond to data obtained in experiments on rabbit № 1, and gray bars – on rabbit № 2.
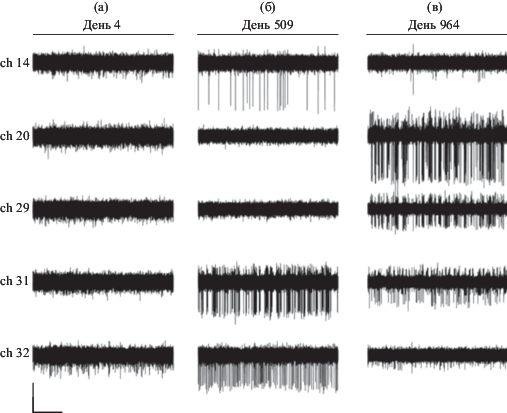
Как уже было отмечено ранее, качество регистрации нейронного сигнала у животного № 2 было выше, поэтому в общей сложности мы смогли регистрировать активность одиночных нейронов в течение 964 дней. Это уникальный результат, поскольку столь продолжительное время регистрации потенциально позволяет всесторонне изучить свойства нейронов в выбранной области мозга. На рис. 3 приведены примеры нативной нейронной активности на одних и тех же микроэлектродах в разные дни с момента имплантации: 4-й, 509-й и 964-й. Как ранее было показано в наших работах, после имплантации требуется некоторый промежуток времени для улучшения качества регистрации. Тем значительнее тот факт, что даже через длительное время после введения микроэлектродов в мозг возможно отведение активности одиночных нейронов. Даже на 964-й день после имплантации на каналах 20, 29 и 31 можно наблюдать ПД с амплитудой, которая, по крайней мере, в два раза превышает уровень шума. С использованием адекватных методов сортировки при таком качестве нейронного сигнала можно было разделять активность до 2–4 одиночных нейронов. Таким образом, возможность регистрации импульсной активности нейронов сохранялась в течение всего длительного срока наблюдения у кролика № 2. Данный факт доказывает действенность пучка микропроволок для хронической регистрации нейронной активности в течение длительного времени.
Рис. 3.
Фрагменты нативной записи нейронной активности в соответствующие дни регистрации. Представлены примеры данных с каналов 14, 20, 29, 31 и 32, которые были отфильтрованы для выделения импульсной активности одиночных нейронов. Масштабная линейка соответствует величине потенциала 100 мкВ и отрезку времени 1 с.
Fig. 3. Fragments of the native recording of neural activity on the different days of registration. Examples of data from channels 14, 20, 29, 31, and 32 are presented. Signals were filtered for the spike sorting. The scale bar corresponds to a potential value of 100 μV and a time span of 1 s.
После обработки базы данных по всем нейронам по методу Дж. Фрейзера и Э. Шварца [Fraser, Schwartz, 2012] нам удалось выявить нейроны, регистрируемые стабильно. Распределение длительностей интервалов показано на рис. 4 (а). Как правило, мы все-таки регистрировали активность от одного нейрона в течение одного дня, но стоит отметить, что встречается значительное число записей, когда стабильная регистрация одной и той же клетки была возможна более 10 дней. В одном случае регистрация была возможна около года.
Рис. 4.
Стабильная регистрация одиночных нейронов. (а) – распределение временных интервалов стабильной регистрации по данным, полученным в экспериментах на двух животных; (б, в) – примеры стабильности в течение 10 дней формы спайков и гистограмм межимпульсных интервалов для одного нейрона; (г) – изменения коэффициента корреляции между формами ПД во время стабильной регистрации; (д, е) – пример стабильности регистрации одиночного нейрона в течение трех месяцев.
Fig. 4. Stable recording of single-unit activity. (a) – the distribution of the time intervals for stable registration: data obtained in experiments with two animals; (б, в) – examples for the shape of spikes and histograms of interpulse intervals for stable recordings of one neuron lasting over 10 days; (г) – changes in the correlation coefficient between forms of action potetial during stable registration; (д, е) – an example of stability single neuron’s registration for three months.
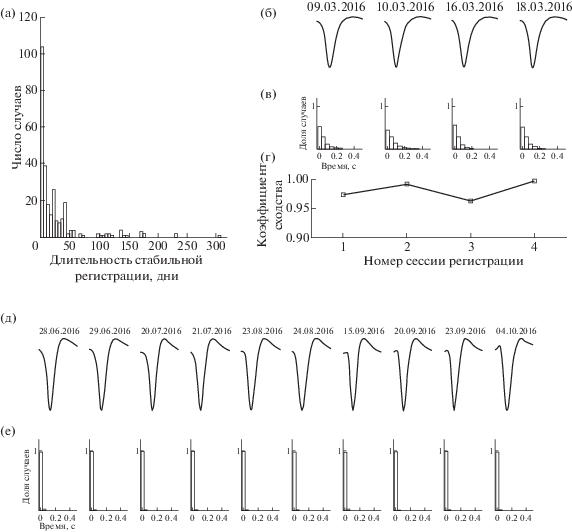
На рис. 4 (б, в, г) представлены изменения формы ПД и гистограмм межимпульсных интервалов (ГМИ) для стабильно регистрируемого нейрона на канале 15 у кролика № 1 в течение 10 дней. Наблюдения были сделаны на 35–51-й день с момента имплантации. Сравнение усредненного образца ПД с формами ПД, полученными в последующие временные интервалы, показывает высокую степень сходства (коэффициент корреляции > 0.95; рис. 4 (б, г)). Дополнительное сравнение форм ГМИ (рис. 4 (в)) позволяет нам утверждать, что активность данного одиночного нейрона наблюдалась в течение 10 дней. Более длительный интервал наблюдения можно отметить для нейрона № 1 с канала 32 у кролика № 2 (рис. 4 (д, е)). В данном случае можно говорить о стабильной регистрации в течение 98 дней: формы потенциалов действия и гистограмм межимпульсных интервалов демонстрируют высокую степень сходства.
Таким образом, полученные данные позволяют утверждать об успешном выделении активности одиночных нейронов, а высокие степени сходства и форм ПД, и форм ГМИ свидетельствуют о стабильной регистрации.
На данном этапе нам удалось провести несколько пилотных исследований по регистрации активности одиночных нейронов в условиях разной сенсорной стимуляции. Нами были обнаружены нейроны, которые реагировали увеличением ответа на предъявление как набора из естественных звуков, так и зрительных стимулов. В качестве иллюстрации обсуждаемого явления мы приводим ответы нейронов с каналов 22 и 32 кролика № 2 на рис. 5 и 6 соответственно. На рис. 5 изображены ответы нейрона 1 с канала 22. Этот нейрон нам удалось регистрировать в общей сложности в течение 150 дней с 58-го по 208-й день после имплантации микроэлектродов, что является одной из самых длительных регистраций одиночного нейрона в данной работе. Следует отметить, что данный нейрон отвечал на слуховые стимулы, а на зрительные ответ отсутствовал (рис. 5 (а, б)). В ответе нейрона наблюдаются два падения амплитуды после модуляций амплитуды звукового стимула (рис. 5 (а)), что можно наблюдать и на растровой диаграмме, и на функции плотности спайков.
Рис. 5.
Примеры ответов нейрона 1, регистрируемого на канале 22. (а) – ответ представленного нейрона на лай собаки на 187-й день после имплантации микроэлектродов. Все три графика построены в едином масштабе времени, по оси абсцисс – время после включения стимула. Верхняя панель графика отражает динамику звукового стимула: по оси ординат – амплитуда звукового сигнала. Средняя панель графика – растровая диаграмма ответов нейрона на звук лая собаки. Каждый вертикальный штрих обозначает время детекции спайка на записи. Более ранние предъявления стимула отражены в нижних строках. Серый прямоугольник обозначает временной интервал предъявления стимула. Нижняя панель графика – функция плотности спайков. (б) – ответ нейрона на изображение волка на 208-й день после имплантации микроэлектродов. Верхняя панель – зрительный стимул. Средняя и нижняя панели – растровая диаграмма и функция плотности спайков. Масштаб времени единый, условные обозначения идентичны графикам подграфика (а). (в-г) – профили селективности нейрона с 21.07.2016 по 26.08.2016. По оси абсцисс – номер стимула в наборе. По оси ординат – изменение частоты разряда нейрона в интервале 1 с после включения стимула по сравнению с фоновой активностью в течение 1 с до включения стимула. (в) – профиль селективности на стимулы набора с изображениями хищников и кроликов. (г) – профиль селективности на звуковые стимулы из набора с криками различных животных.
Fig. 5. Examples of responses of neuron 1 recorded on channel 22. (a) – response of the neuron to a dog’s bark on day 187 after implantation of microelectrodes. All three graphs are plotted using the same time scale; the X-axis shows the time relative to the stimulus onset. The upper panel of the graph reflects the dynamics of the sound stimulus: along the Y-axis the amplitude of the sound signal is shown. The middle panel of the graph represents a raster diagram of neuronal responses to the dog’s bark. Each vertical line indicates the time of spike detection in the record. Initial stimulus presentations are shown in the bottom lines. The gray box indicates the time interval during which stimulus was presented. On bottom panel of the graph a function of the density of spikes is demonstrated. (б) the response of a neuron to a wolf image on day 208 after implantation of microelectrodes. In the upper panel visual stimulus is shown. The middle and bottom panels showing raster diagram and spike density function respectively. The time scale is same, the legend is identical to the graphs of subgraph (a). (в-г) – neuron selectivity profiles obtained during the sessions from 21.07.2016 to 26.08.2016. X-axis indicates the number of stimulus in the set. The Y-axis shows the change in the frequency of the discharge of a neuron is shown. Average discharge calculated for the interval with duration 1 s after the stimulus turned on and compared with the background activity for 1 s before the stimulus onset. (в) – selectivity profile for stimulus set with images of predators and rabbits. (г) – selectivity profile for sound stimuli from a set with sounds of various animals.
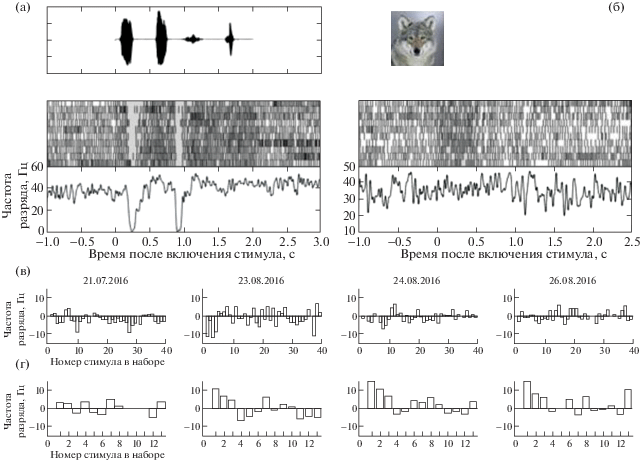
Рис. 6.
Примеры ответов нейрона 1, регистрируемого на канале 32. Все условные обозначения такие же, как на рис. 5. (а) – ответ представленного нейрона на лай собаки на 154-й день после имплантации микроэлектродов. (б) – ответ нейрона на изображение летящей совы на 188-й день после имплантации микроэлектродов. (в–г) – профили селективности нейрона с 21.07.2016 по 15.09.2016. (в) – профиль селективности на стимулы набора с изображениями хищников и кроликов. (г) – профиль селективности на звуковые стимулы из набора с криками различных животных.
Fig. 6. Examples of responses of neuron 1 recorded on channel 32. All symbols are the same as in Fig. 5. (a) – the response of the neuron to the dog's bark on day 154 after implantation of microelectrodes. (б) the response of a neuron to an image of a flying owl on day 188 after implantation of microelectrodes. (в–г)- neuron selectivity profiles from 21.07.2016 to 15.09.2016. (в) – profile of selectivity for stimulus set with images of predators and rabbits. (г) – selectivity profile for sound stimuli from a set with sounds of various animals.
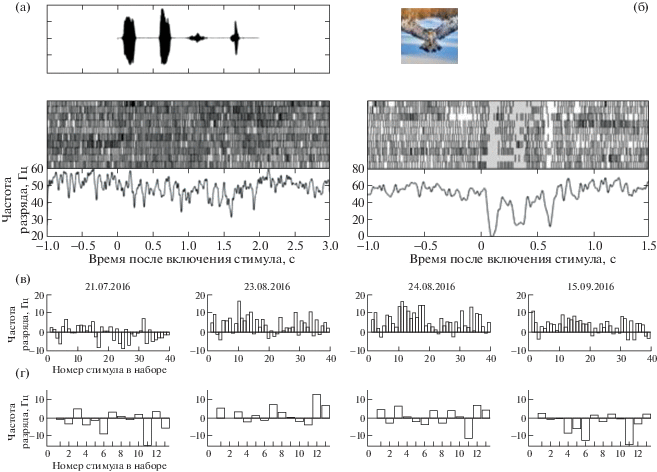
Нейрон 1 на канале 32 нам удалось регистрировать в течение 98 дней со 131-го по 229-й день после имплантации микроэлектродов (рис. 6). В его ответах мы видим обратную ситуацию: звуковой стимул не вызывает ответа у рассматриваемого нейрона, но присутствует ответ на зрительный стимул (рис. 6 (а, б)). В ответе на зрительный стимул можно выделить две фазы: в первую происходит падение частоты разряда нейрона приблизительно через 100 мс после включения стимула, во вторую – второе падение частоты фонового разряда через 350 мс после включения стимула. Также стоит отметить выраженный off-ответ обсуждаемого нейрона при выключении стимула (рис. 6 (б)).
Что касается профилей селективности, то для двух нейронов мы наблюдаем противоположную тенденцию. В случае нейрона 1 на канале 22 форма профилей селективности и на зрительные, и на слуховые стимулы в разные дни остается более или менее постоянной. Абсолютная величина ответа на отдельные стимулы меняется, однако общая форма профиля селективности между днями похожа (рис. 5 (в, г)).
У нейрона 1 с канала 32 мы не видим сходства между профилями селективности, полученными в разные дни стабильной регистрации (рис. 6 (в–г)). Исследование стабильности ответов, найденных на записях нейронов, не является целью настоящей работы, поэтому вопрос о сохранении профиля селективности во времени требует более детального внимания в будущем.
Благодаря использованию микропроволок, позволяющих регистрировать активность одиночных нейронов стабильно, мы смогли охарактеризовать свойства нейронов, обнаруженных на записях. Животным были предъявлены наборы разнообразных зрительных стимулов, а также слуховые стимулы (чистые тоны или крики различных животных). В качестве примеров мы приводили ответы двух нейронов, один из которых был селективен к зрительным стимулам, а другой – к слуховым. При этом ответы на стимулы непредпочитаемой модальности отсутствовали.
Целью имплантации микроэлектродов была базолатеральная миндалина. Из-за воспалительной реакции на имплантат нам не удалось осуществить морфологический контроль на должном уровне, поэтому окончательно прояснить вопрос локализации места регистрации затруднительно. Регистрируемые нами нейроны отличались низкой фоновой частотой разряда, что может свидетельствовать об отведении нейронной активности от миндалины [Kuraoka, Nakamura, 2003]. Мультимодальность части клеток также может служить подтверждением того, что регистрация велась из миндалевидного тела.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В распоряжении современных нейробиологов постоянно появляются новые методы, которые позволяют на самом базовом уровне адресно изменять свойства нейронов. Однако, как считает Джон Кракауер и соавт. [Krakauer et al., 2017], важным направлением должно оставаться детальное теоретическое и экспериментальное изучение поведения. В своем недавнем обзоре его группа делает акцент на невозможности объяснения функций мозга, которое базируется на традиционной редукционистской философии проведения исследований: одного лишь понимания механизмов работы отдельных частей сложной системы недостаточно для воссоздания функционала целого. В рамках такого подхода особенно важными становятся наблюдения за поведением животного и нейрофизиологическими коррелятами такого поведения в течение длительного времени.
Такую возможность предоставляет хроническая имплантация множественных микроэлектродов. Введенные в мозг микроэлектроды могут быть пригодны для длительной регистрации нейронной активности в экспериментах на крысах [Fyhn et al., 2007], мышах [Cohen et al., 2013], кошках [Legendy, 1984; Verzeano, 1956], кроликах [Porada, 2000] и обезьянах [Tolias, 2007]. В нашей работе был зарегистрирован нейрофизиологический сигнал, сопоставимый по качеству с полученными ранее результатами. Особенно следует отметить тот факт, что в одном случае нам удалось отводить активность одиночных нейронов в течение почти трех лет после имплантации. Из известных нам данных лишь Ю. Крюгер и соавт. [Krüger et al., 2010] в экспериментах на обезьянах регистрировал нейронную активность сопоставимого качества в течение 7 лет. Увеличение длительности успешной регистрации нейронной активности у одного и того же животного позволяет охарактеризовать разряд нейрона при разнообразных режимах стимуляции или различных формах поведения.
На первом этапе оценки стабильности представления информации необходимо выделить стабильно регистрируемые нейроны на основании их базовых свойств: формы потенциала действия, характера распределения межимпульсных интервалов, частоты спонтанного разряда и т.д. Ранее мы использовали критерии [Васильева и др., 2014], которые позволяли на основе кратковременной регистрации спонтанной активности и оценки форм ПД, а также ГМИ, говорить о регистрации одних и тех же нейронов. В данной работе мы использовали автоматизированный подход, предложенный в работе Дж. Фрейзера и Э. Шварца [Fraser, Schwartz, 2012]. В результате были выделены клетки, активность которых наблюдалась более чем в одной сессии регистрации. Максимальная длительность интервала стабильной регистрации составила 307 дней. Остается открытым вопрос об увеличении числа одновременно стабильно регистрируемых нейронов. Увеличение расстояния между отдельными микропроволоками позволит минимизировать повреждение ткани, что улучшит качество регистрации.
В наших предшествующих работах мы наблюдали за изменениями качества регистрации активности одиночных нейронов [Бондарь и др., 2014] и разрабатывали критерий стабильности регистрации [Васильева и др., 2014]. Результат настоящей работы – возможность регистрации активности одиночных нейронов в течение 2.5 лет у бодрствующих животных – является беспрецедентным для нашей лаборатории. В контексте мировой науки, исследования на крупных млекопитающих, где внимание уделялось бы и длительности регистрации одиночных нейронов, и регистрации их ответов на разнообразные зрительные и слуховые стимулы, на настоящий момент достаточно редки.
Используемая нами методика регистрации импульсной активности одиночных нейронов с помощью пучков микропроволоок позволяет регистрировать нейроны стабильно более 2.5 лет у кроликов. Срок службы микроэлектродов в случае нашей работы существенно выше, чем у большинства цитируемых в настоящей работе исследований. Ю. Крюгер с коллегами регистрировали импульсную активность нейронов у обезьян более 7 лет [Kruger et al., 2010], однако в этом исследовании не проводилось анализа, принадлежат ли регистрируемые в разные дни ПД одному или разным нейронам. В настоящей работе был проведен анализ стабильности регистрации с помощью автоматического алгоритма [Fraser, Schwartz, 2012].
В своих работах мы обсуждали вопрос выбора характеристик нейронного разряда, пригодных для определения стабильности регистрации одиночных нейронов [Васильева и др., 2014]. Потенциально все характеристики нейронного разряда могут меняться со временем, поэтому надежнее всего выбрать наиболее стабильные и опираться на них в своих суждениях. В работе И.В. Бондаря и соавт. [Bondar et al., 2009] обсуждается возможность поиска стабильных нейронов по форме ответа на предъявляемые стимулы. В данных, представленных в настоящей работе, мы наблюдали два противоположных случая: ответы нейронов были постоянны или они менялись изо дня в день. Полученные результаты можно интерпретировать как свидетельство в пользу изменения селективных свойств нейронов, так и как неудачный выбор параметров определения стабильно регистрируемых нейронов. Первое предположение подтверждают долговременные исследования свойств нейронов нижней височной коры [Koyano et al., 2016; Hong et al., 2017], в которых были продемонстрированы изменения амплитуды ответа при повторении зрительных стимулов, происходящие на протяжении нескольких дней. Вопросы вариабельности и стабильности ответов нейронов в экспериментах на бодрствующих животных становятся предметом обсуждения, поскольку современные технологии позволяют стабильно регистрировать активность одной и той же клетки длительное время [Clopath et al., 2018]. Представленная нами работа не только демонстрирует потенциальные возможности хронически имплантируемых микроэлектродов, но и расширяет спектр наблюдений за сложным поведением млекопитающих, поскольку кролики являются удобным традиционным объектом нейрофизиологических исследований [Рысакова, Павлова, 2013].
ЗАКЛЮЧЕНИЕ
По качеству регистрации нейронного сигнала с помощью хронически имплантированных пучков микроэлектродов можно утверждать, что данная конструкция регистрирующего устройства обеспечивает запись нейронной активности высокого качества.
По сравнению с коммерчески доступными устройствами пучок может быть изготовлен в условиях любой нейрофизиологической лаборатории, а стандартный набор материалов для его сборки (микропроволока, разъемы и расходные материалы для пайки) не требует значительных финансовых затрат.
При использовании автоматизированных подходов были обнаружены стабильно регистрируемые одиночные нейроны. Предложенная методика хронической имплантации в будущем позволит всесторонне изучать связь изменений активности клеток мозга со сложным поведением в течение длительного времени.
Нами были зарегистрированы ответы одиночных нейронов на сложные зрительные стимулы. Дальнейшие контрольные эксперименты позволят точнее ответить на вопрос о селективности таких нейронов к различным зрительным стимулам.
Работа поддержана грантом Российского фонда фундаментальных исследований № 19-015-00349-a.
Список литературы
Блинков С.М., Бразовская Ф.А., Пуцилло М.В. Атлас мозга кролика. Акад. мед. наук СССР. Москва: Медицина. 1973.
Бондарь И.В., Васильева Л.Н., Бадаква А.М., Миллер Н.В., Зобова Л.Н., Рощин В.Ю. Качество регистрации нейронного сигнала в моторной коре обезьян при использовании хронически имплантированных множественных микропроволок. Журнал высшей нервной деятельности им. И.П. Павлова. 2014. 64 (1): 101.
Васильева Л.Н., Бадаква А.М., Миллер Н.В., Зобова Л.Н., Рощин В.Ю., Бондарь И.В. Длительная регистрация одиночных нейронов и критерии ее оценки. Журнал высшей нервной деятельности им. И.П. Павлова. 2014. 64 (6): 693–701.
Павлова И.В., Рысакова М.П. Влияние введения агониста и антагониста гамка-рецепторов в миндалину кроликов на дыхательный и сердечный компоненты условнорефлекторного страха. Журнал высшей нервной деятельности им. И.П. Павлова. 2013. 63 (6): 730.
Швыркова Н.А., Андрушко С.В. Активность нейронов сенсомоторной области коры мозга кроликов в зоосоциальном поведении. Журнал высшей нервной деятельности им. И.П. Павлова. 1990. 40 (1): 52–58.
Adrian E.D. The impulses produced by sensory nerve endings: Part 4. Impulses from Pain Receptors. The Journal of Physiology. 1926. 62 (1): 33–51.
Bondar I.V., Leopold D.A., Richmond B.J., Victor J.D., Logothetis N.K. Long-term stability of visual pattern selective responses of monkey temporal lobe neurons. PLoS One. 2009. 4 (12): e8222.
Chauviere L., Pothof F., Gansel K.S., Klon-Lipok J., Aarts A.A.A., Holzhammer T., Singer W.J., Ruther P. In vivo recording quality of mechanically decoupled floating versus skull-fixed silicon-based neural probes. Frontiers in Neuroscience. 2019. 13: 464.
Coffey K.R., Barker D.J., Gayliard N., Kulik J.M., Pawlak A.P., Stamos J.P., West M.O. Electrophysiological evidence of alterations to the nucleus accumbens and dorsolateral striatum during chronic cocaine self-administration. European Journal of Neuroscience. 2015. 41: 1538–1552.
Cohen L., Koffman N., Meiri H., Yarom Y., Lampl I., Mizrahi A. Time-lapse electrical recordings of single neurons from the mouse neocortex. Proc. Natl Acad. Sci. USA. 2013. 110: 5665–5670. https://doi.org/10.1073/pnas.1214434110
Dhawale A.K., Poddar R., Wolff S.B.E., Normand V.A., Kopelowitz E., Ölveczky B.P. Automated long-Term recording and analysis of neural activity in behaving animals. ELife. 2017. 6.
Fraser G.W., Schwartz A.B. Recording from the same neurons chronically in motor cortex. J Neurophysiol. 2012. 107 (7): 1970-8. https://doi.org/10.1152/jn.01012.2010
Fyhn M.1., Hafting T., Treves A., Moser M.B., Moser E.I. Hippocampal remapping and grid realignment in entorhinal cortex. Nature. 2007. 446 (7132): 190-4.
Guan S., Wang J., Gu X., Zhao Y., Hou R., Fan H., Zou L., Gao L., Du M., Li C., Fang Y. Elastocapillary self-assembled neurotassels for stable neural activity recordings. Science Advances. 2019. 5 (3).
Hong J.H., Koyano K.W., Russ B.E., Leopold D.A. Comparing experience-dependent changes in stimulus response selectivity of macaque AM and AF face patch neurons. The Annual Meeting of Society for Neuroscience Abstract. 2017. Online.
Hubel D., Wiesel T. Receptive fields of single neurones in the cat ’ s striate cortex. In the: Central nervous system the visual pathway from retina to striate cortex. 1959. 574–591.
Koyano K.W., Russ B.E., Leopold D.A. Recording from face patch AM neurons of a macaque monkey using implanted microwire bundles. The Annual Meeting of the Japan Neuroscience Society Abstract. 2016. P1-142.
Krüger J., Caruana F., Volta R.D., Rizzolatti G. Seven years of recording from monkey cortex with a chronically implanted multiple microelectrode. Front Neuroeng. 2010. 3: 6.
Kuraoka K., Nakamura K. Responses of single neurons in monkey amygdala to facial and vocal emotions. J. Neurophysiol. 2007. 97 (2): 1379–1387.
Kuraoka K., Konoike N., Nakamura K. Functional differences in face processing between the amygdala and ventrolateral prefrontal cortex in monkeys. Neuroscience. 2015. 304: 71–80.
Lanzilotto M., Livi A., Maranesi M., Gerbella M., Barz F., Ruther P., Fogassi L., Rizzolatti G., Bonini L. Extending the cortical grasping network: Pre-supplementary motor neuron activity during vision and grasping of objects. Cerebral Cortex. 2016. 26: 4435–4449.
Lewicki M.S. A review of methods for spike sorting: the detection and classification of neural action potentials. Network. 1998. 9 (4): R53-78.
Logothetis N.K., Pauls J., Augath M., Trinath T., Oeltermann A. Neurophysiological investigation of the basis of the fMRI signal. Nature. 2001. 412 (6843): 150-7.
McMahon D.B.T., Russ B.E., Elnaiem H.D., Kurnikova A.I., Leopold D.A. Single-unit activity during natural vision: Diversity, consistency, and spatial sensitivity among AF face patch neurons. Journal of Neuroscience. 2015. 35 (14): 5537–5548.
Mosher C.P., Zimmerman P.E., Gothard K.M. Neurons in the monkey amygdala detect eye contact during naturalistic social interactions // Curr. Biol. 2014. 24 (20): 2459–2464.
Okun M., Lak A., Carandini M., Harris K.D. Long Term Recordings with Immobile Silicon Probes in the Mouse Cortex // PLoS ONE. 2016. 11 (3): e0151180.
Park S.H., Russ B.E., McMahon D.B.T., Koyano K.W., Berman R.A., Leopold D.A. Functional Subpopulations of Neurons in a Macaque Face Patch Revealed by Single-Unit fMRI Mapping. Neuron. 2017. 95 (4): 971–981.
Porada I., Bondar I., Spatz W.B., Krüger J. Rabbit and monkey visual cortex: more than a year of recording with up to 64 microelectrodes. J Neurosci Methods. 2000. 95 (1): 13–28.
Renshaw B. Central effects of centripetal impulses in axons of spinal ventral roots. Journal of Neurophysiology. 1946. 9: 191–204.
Stosiek C., Garaschuk O., Holthoff K., Konnerth A. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences of the United States of America. 2003. 100 (12): 7319–7324.
Strumwasser F. Long-term recording from single neurons in brain of unrestrained mammals. Science. 1958. 127 (3296): 469–470.
Thompson L.T., Best P.J. Long-term stability of the place-field activity of single units recorded from the dorsal hippocampus of freely behaving rats. Brain Research. 1990. 509 (2): 299–308.
Tinbergen N., Lorenz K. Taxis und Instinkthandlung in der Eirollbewegung der Graugans. Z. Tierpsychol. 1938. 2: 1–29.
Tolias A.S., Ecker A.S., Siapas A.G., Hoenselaar A., Keliris G.A., Logothetis N.K. Recording chronically from the same neurons in awake, behaving primates. J Neurophysiol. 2007. 98 (6): 3780-90.
Verzeano M. Activity of cerebral neurons in the transition from wakefulness to sleep. Science. 1956. 124 (3217): 366–367.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


