Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 4, стр. 515-527
ФИЗИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ОСТРОЙ НЕОНАТАЛЬНОЙ НОРМОБАРИЧЕСКОЙ ГИПОКСИИ У МЫШЕЙ ЛИНИИ C57BL/6
Д. Д. Хухарева 1, К. Д. Гусева 1, Ю. А. Суханова 1, Е. А. Себенцова 2, Н. Г. Левицкая 1, 2, *
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет
Москва, Россия
2 Институт молекулярной генетики РАН
Москва, Россия
* E-mail: nglevitskaya@gmail.com
Поступила в редакцию 11.09.2019
После доработки 06.12.2019
Принята к публикации 16.12.2019
Аннотация
Перинатальная гипоксия (ПГ) является одним из основных факторов, оказывающих негативное влияние на развитие центральной нервной системы. Последствия ПГ и механизмы ее развития исследуются в экспериментах на животных, главным образом на грызунах, что требует разработки адекватных экспериментальных моделей. Целью представленной работы явилось изучение эффектов однократной нормобарической гипоксии у детенышей мышей линии C57BL/6 обоего пола. Мышей в возрасте 2 дней подвергали гипоксическому воздействию длительностью 2 ч при содержании кислорода 8%. Контрольные мыши содержались в тех же условиях при нормальном содержании кислорода. Со 2-го по 31-й день жизни оценивали уровень физического и моторного развития, двигательную и исследовательскую активность, уровень тревожности. Было показано, что использованное воздействие приводит к высокому уровню летальности у мышей линии C57BL/6, а также вызывает у них нарушение становления сенсомоторных рефлексов, изменения поведения в тесте “Открытое поле” и незначительное увеличение тревожности в тесте “Приподнятый крестообразный лабиринт”. Можно заключить, что модель однократной нормобарической гипоксии у мышей может быть использована для изучения патофизиологии и нейрохимических механизмов, лежащих в основе неврологических нарушений при перинатальной гипоксии.
ВВЕДЕНИЕ
Перинатальная гипоксия (ПГ) является одной из основных причин повреждений ЦНС у детей и регистрируется у 1–6 на 1000 новорожденных [Takada et al., 2015]. ПГ может привести к возникновению функциональных расстройств, которые проявляются далее на протяжении всей жизни. К последствиям ПГ относят сенсомоторный дефицит, сниженную способность к обучению, невнимательность, гиперактивность, повышенный риск расстройств аутистического спектра и другие неврологические нарушения [Bolisetty et al., 2014; Salmaso et al., 2014]. Используемые в настоящее время фармакологические и терапевтические методы недостаточно эффективны в отношении предотвращения неврологических нарушений у детей, перенесших ПГ [Wang et al., 2013].
Клинические исследования последствий ПГ сталкиваются с большими трудностями и имеют множество ограничений. Поэтому эффекты ПГ активно исследуются в экспериментах на животных, однако при этом возникает вопрос о разработке адекватных моделей этого состояния для дальнейшего изучения патогенеза ПГ и поиска путей коррекции последствий данного воздействия [Millar et al., 2017].
Для исследования эффектов перинатальных воздействий в основном используются крысы и мыши. В отличие от человека, многие важнейшие этапы развития мозга у грызунов происходят в раннем постнатальном периоде. Развитие мозга у новорожденных грызунов в течение первых двух постнатальных недель сходно с развитием мозга у детей с высокой степенью недоношенности: кортикальный нейрогенез завершен, нейрогенез в гиппокампе и мозжечке продолжается, начинаются процессы синаптогенеза и миелинизации [Mayoral et al., 2009]. Исследования, в которых проводилось межвидовое сравнение созревания нервной системы, указывают на сходство последнего триместра беременности у человека с первыми неделями жизни крыс или мышей и обосновывают использование неонатальной гипоксии у грызунов в качестве модели перинатальной гипоксии человека [Wang et al., 2013; Суханова и др., 2016].
В настоящее время существует ряд моделей для изучения острых и отставленных эффектов ПГ. Наиболее широко используемая модель ПГ на крысах была разработана в начале 1980-х годов (модель Rice-Vannucci). В этой модели использовалась комбинация односторонней перевязки общей сонной артерии у 7-дневного детеныша крысы с последующим помещением животного в условия пониженного содержания кислорода (8%) [Rice et al., 1981]. Уровень зрелости ЦНС 7-дневного детеныша крысы сопоставим с 32–34-недельным эмбрионом или с недоношенным новорожденным. Для моделирования гипоксии новорожденных с высокой степенью недоношенности грызунов подвергали гипоксии на третий постнатальный день (ПНД) [Smith et al., 2014]. Патологические последствия такого комбинированного воздействия включали в себя повреждения как серого, так и белого вещества мозга [Vannucci et al., 1988]. Гипоксия/ишемия (Г/И) на 7 ПНД грызунов приводила в дальнейшем к замедлению физического и моторного развития, гиперактивности животных и нарушению обучения [Fan et al., 2005; Alexander et al., 2014; Smith et al., 2014; Суханова и др., 2016]. Недостатками модели Rice-Vannucci являются инвазивность (необходимость хирургического воздействия и наркоза) и фокальный характер повреждения мозга, отличный от клинической картины нарушений у человека [Millar et al., 2017; Jantzie, Robinson, 2015]. Кроме того, постоянная окклюзия сонной артерии затрудняет исследование отставленных эффектов ПГ.
В качестве модели ПГ также применяют гипоксическое воздействие в отсутствие ишемии. По данным некоторых авторов, гипоксия без ишемии не приводит к гистологическим и функциональным нарушениям [Rice et al., 1981; Towfighi et al., 1997]. Однако большое число исследований, выполненных за последние 20 лет, свидетельствуют о наличии гистологических [Отеллин и др., 2012], функциональных и поведенческих изменений, вызванных однократным неонатальным гипоксическим воздействием [Takada et al., 2016; Wang et al., 2013; Millar et al., 2017; Sukhanova et al., 2018; 2019].
Большинство исследований эффектов ПГ выполнено на крысах; работ, проведенных на мышах, значительно меньше. При этом разными авторами используются различные протоколы экспериментов, что приводит к противоречивости полученных результатов. Так, в модели Rice-Vannucci на мышах животные в возрасте 7 ПНД подвергались гипоксическому воздействию различной длительности – 30 мин [Sheldon et al., 2009], 45 мин [Chavez-Valdez et al., 2014] или 60 мин [Ten et al., 2003]. В моделях гипоксии без ишемии также применялось воздействие разной интенсивности – 8% О2, 35 мин [Rotstein et al., 2006], 5% О2, 120 мин [Wang et al., 2013].
Однако возможность выполнения трансгенных манипуляций делает мышей привлекательным объектом исследования в моделях различных патологий, в том числе ПГ [Sheldon et al., 1998; Salmaso et al., 2014]. При этом необходимо разработать методы оценки нейрофункциональных нарушений у мышей, так как использование генетически модифицированных животных будет способствовать выяснению тонких молекулярных механизмов повреждения головного мозга, вызванных гипоксией [Ten et al., 2003]. Это определяет необходимость разработки стандартизированных моделей ПГ на мышах, позволяющих долговременную оценку реакции на гипоксическое воздействие, а также важность сопоставления острых и отдаленных последствий одинакового воздействия у грызунов разных видов [Burnsed et al., 2015].
Ранее нами было проведено исследование эффектов однократной нормобарической гипоксии (ОНГ, 8% О2, 2 ч) на второй день жизни крыс как модели умеренного гипоксического повреждения мозга недоношенных новорожденных. Нами были выявлены зависимые от пола эффекты гипоксии на уровне транскрипционной активности генов, содержания нейротрофина и прооксидантного-антиоксидантного баланса, а также нарушения сенсомоторного развития, поведения и когнитивных функций у потомства крыс [Sukhanova et al., 2018; 2019]. Целью представленной работы явилось изучение физиологических эффектов однократной нормобарической гипоксии у детенышей мышей линии C57BL/6, а также сопоставление полученных данных с результатами, полученными ранее в нашей лаборатории с использованием аналогичной модели на крысах линии Wistar. Настоящее исследование было предпринято для разработки воспроизводимой модели краткосрочных и долговременных функциональных нарушений у грызунов, вызванных ОНГ.
МЕТОДИКА
Работа выполнена на мышах линии C57BL/6 обоего пола. Всего в работе была использована 61 мышь из 7 выводков. Животных содержали в стандартных условиях вивария с соблюдением 12-часового светового режима и со свободным доступом к воде и пище. Исследование проведено с соблюдением биоэтических норм обращения с экспериментальными животными в соответствии с “Правилами надлежащей лабораторной практики”, утвержденными приказом МЗ РФ № 199н от 01.04.2016 г.
День рождения мышат принимали за нулевой день жизни. На второй постнатальный день (2 ПНД) мышей взвешивали, маркировали (наносили метки на хвост маркером), затем каждый выводок делили на 2 группы так, чтобы в каждой группе было по 2–3 мыши разного пола из каждого выводка. Мышей одной группы (n = 33) на 2 ПНД изымали из гнезда и помещали в инкубатор с пониженным содержанием кислорода (8% О2) и температурой 37°С на 2 ч (группа “гипоксия”), остальных животных (n = 28) не подвергали воздействию гипоксии, в тот же день изымали из гнезда и помещали в аналогичные условия при нормоксии (21% О2) (группа “контроль”). Детеныши каждого выводка вместе с матерью содержались в отдельной клетке до достижения ими месячного возраста.
Для оценки уровня физического развития животных регистрировали массу тела, возраст открытия глаз и слуховых проходов. Массу тела измеряли ежедневно в течение первой недели жизни, затем – каждые 2–3 дня. Относительный прирост массы тела рассчитывали по формуле – (масса на 3 ПНД – масса на 2 ПНД / масса на 2 ПНД Х 100%).
Уровень психомоторного развития оценивали при помощи стандартных тестов [Altman, Sudarshan, 1975]. “Рефлекс переворота на плоскости” – мышонка помещали на спину и засекали время, за которое животное перевернется на все четыре лапы. Данный тест проводили дважды – в возрасте 3 и 5 дней. Максимальное время наблюдения 60 сек. “Рефлекс ползания” – мышонка в возрасте 10 дней помещали в центр окружности диаметром 13 см и регистрировали время, через которое животное всеми четырьмя лапами окажется вне круга. Максимальное время наблюдения 120 сек. “Рефлекс отрицательного геотаксиса” – животное в возрасте 12 дней помещали на наклонную поверхность длиной 30 см (45°) головой в направлении склона. Регистрировали латентный период (ЛП) поворота, т.е. время, за которое животное поворачивается на 180°, максимальное время наблюдения 60 сек. Если в течение максимального периода наблюдения мышь не выполняла задачу, то это время принимали за ЛП выполнения реакции.“Удержание на горизонтальном стержне” – животное в возрасте 12 дней помещали на горизонтальный тонкий стержень, закрепленный на высоте 15 см от пола, и регистрировали время удержания на стержне.
Оценку уровня двигательной и исследовательской активности проводили в тесте “Открытое поле” (ОП, возраст 24–26 ПНД) ежедневно в течение трех последовательных дней. Экспериментальная установка для мышей представляет собой круглую арену с диаметром 63 см и высотой стенок 32 см. Пол установки поделен на 19 секторов двумя окружностями и шестью диаметрами. Эксперимент проводится в тишине и при красном освещении. Животное помещали в центр поля и в течение 5 мин регистрировали следующие показатели: ЛП выхода из центра поля; количество пройденных секторов, стоек (подъемов на задние лапы) и выходов в центр поля.
Оценку уровня тревожности животных проводили в тесте “Приподнятый крестообразный лабиринт” (ПКЛ, возраст 30 ПНД). Экспериментальная камера лабиринта состоит из четырех расходящихся под прямым углом из центра рукавов (длина рукавов – 30 см, ширина – 5 см, высота стенок – 15 см). Два противоположных рукава затемнены (освещенность 10 лк) и закрыты стенками с торцов; два других – освещены (400 лк) и открыты. Лабиринт устанавливали на высоте 55 см от пола. Животное помещали в центр лабиринта и в течение 5 мин регистрировали следующие показатели: ЛП первого захода в темный отсек; общее время нахождения на открытых и закрытых рукавах; количество заходов в открытые рукава и закрытые рукава; количество свешиваний с открытых рукавов; количество стоек (подъемов на задние лапы).
При статистической обработке данных использовали пакет программ “Statistica 10”. Полученные экспериментальные данные были проверены на нормальность с использованием теста Колмогорова–Смирнова. Распределение всех выборок соответствовало нормальному (p > 0.20), что позволило применить факторный дисперсионный анализ (factorial ANOVA). Сравнение между группами проводили с использованием двухфакторного ANOVA (факторы “группа” и “пол”). При отсутствии значимого эффекта фактора “пол” и значимого взаимодействия между факторами сравнивали результаты, полученные на всей выборке мышей. Межгрупповые различия динамических показателей (изменение массы тела, рефлекс поворота на плоскости, изменение показателей поведения в ОП) оценивали с помощью трехфакторного ANOVA для повторных измерений для факторов “группа”, “пол” и “возраст”/“день тестирования”. В случае статистически значимого эффекта факторов или их взаимодействия для дальнейшей оценки различий между группами при post-hoc анализе использовали критерий Fisher LSD. Различия между группами считали статистически значимыми при p < 0.05. Данные на рисунках и в таблице представлены в виде среднее ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В ходе гипоксического воздействия умерло 6 мышат, таким образом, уровень летальности составил 18.2% по всей выборке животных, при этом статистически значимых отличий по этому показателю в подгруппах самцов и самок зарегистрировано не было.
Оценка уровня физического развития
Не было выявлено отличий между группами по таким показателям физического развития, как возраст открытия глаз и отлипания ушных раковин (табл. 1).
Таблица 1.
Показатели физического развития мышей в группах Контроль и Гипоксия Table 1. Parameters of physical development of Control and Hypoxic mice
| Показатели | Контроль (n = 28) | Гипоксия (n = 27) | Результаты двухфакторного ANOVA | ||
|---|---|---|---|---|---|
| Группа – F (p) | Пол – F (p) | Группа X Пол – F (p) | |||
| Масса тела до гипоксии (г) | 1.8 ± 0.05 | 1.9 ± 0.05 | F1,51 = 0.09 (0.77) | F1,51 = 0.73 (0.40) | F1,51 = 0.12 (0.74) |
| Относительный привес в первые сутки после гипоксии (%) | 28.5 ± 2.2 | 21.6 ± 2.1 | F1,51 = 6.62 (0.01) | F1,51 = 0.13 (0.72) | F1,51 = 0.04 (0.84) |
| День открытия слуховых проходов | 3.8 ± 0.10 | 3.9 ± 0.06 | F1,51 = 1.53 (0.23) | F1,51 = 0.06 (0.81) | F1,51 = 0.06 (0.81) |
| День открытия глаз | 14.8 ± 0.09 | 14.7 ± 0.09 | F1,51 = 1.83 (0.19) | F1,51 = 0.49 (0.48) | F1,51 = 0.24 (0.63) |
Результаты представлены в виде среднего ± стандартная ошибка среднего. Число самцов/самок в группе “контроль” – 11/17, в группе “гипоксия” – 11/16. Статистически значимые отличия (p < 0.05) выделены курсивом. The results are expressed as the mean ± standard error of the mean (SEM). The number of male/female rats in the “control” group – 11/17, in the “hypoxia” group – 11/16. Significant differences (p < 0.05) are marked by italic.
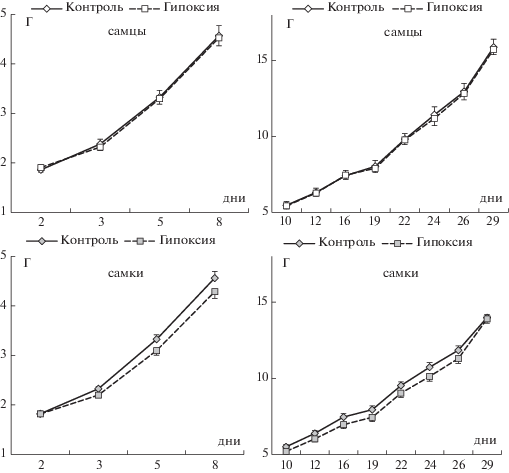
Измерение массы тела мышат на 2 ПНД (до сеанса гипоксии) не выявило исходных отличий между группами (табл. 1). В первые сутки после гипоксии относительный прирост массы тела у животных, перенесших воздействие, был статистически значимо меньше (p < 0.05), чем у контрольных, при этом не было зарегистрировано влияния фактора “пол” (табл. 1). Трехфакторный ANOVA для повторных измерений показал статистически значимое влияние фактора “возраст” (F11,561 = 2879.0; p < 0.001) на протяжении всего исследования (2–29 ПНД), т.е. во всех группах животные набирали вес. Кроме того, было зарегистрировано статистически значимое влияние фактора “пол” (F1,51 = 4.67; p = 0.035), а также взаимодействие факторов “возраст” × “пол” (F1,51 = 15.0; p < 0.001), поэтому дальнейший анализ изменения массы тела проводили раздельно для самцов и самок. Применение двухфакторного ANOVA для повторных измерений отдельно в подгруппах самцов и самок не выявило влияния фактора “группа” у самцов как в течение первой недели жизни (F1,19 = 0.12; p = 0.82), так и в ходе дальнейших измерений (F1,19 < 0.001; p = 0.99). Также в подгруппе самцов не наблюдалось взаимодействия факторов “группа” × “возраст” (F2,38 = 0.01; p = 0.99 и F7,126 = 0.07; p = 0.99 для первой недели жизни и последующих измерений соответственно) (рис. 1). В подгруппе самок, перенесших гипоксию, на уровне тенденции отмечалось отставание от контроля по массе тела в течение первой недели жизни (F1,32 = 3.30; p = 0.08), при дальнейших измерениях влияния фактора “группа” не наблюдалось (F1,32 = 1.55; p = 0.22). Взаимодействия факторов “группа” × “возраст” отмечено не было (F2,64 = 0.60; p = 0.55 и F7,224 = 1.47; p = = 0.18 для первой недели жизни и последующих измерений соответственно) (рис. 1).
Рис. 1.
Влияние неонатальной гипоксии на изменение массы тела самцов и самок мышей со 2-го по 8-й и с 10-го по 29-й дни жизни. По оси абсцисс – возраст животных (дни), по оси ординат – масса тела (г). Число самцов/самок в группе “контроль” – 11/17, в группе “гипоксия” – 11/16. В подгруппе самок отмечено на уровне тенденции влияние фактора “группа” на изменение массы тела в течение первой недели жизни (F1,32 = 3.30; p = 0.08; 2-way ANOVA).
Fig. 1. The effects of the neonatal hypoxia on the changes in body weight of male and female mice from 2 to 8 days and from 10 to 29 days of life. The X-axis – age of animals (days), the Y-axis – body weight (g). The number of male/female mice in the “control” grou p – 11/17, in the “hypoxia” group – 11/16. In the female subgroup, the influence of the factor “group” on the change in body weight during the first week of life was noted at the tendency level (F1,32 = 3.30; p = 0.08; 2-way ANOVA).
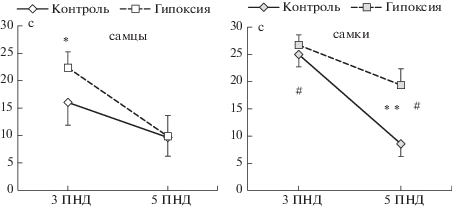
Рефлекс переворачивания на плоскости. Применение трехфакторного ANOVA для повторных измерений выявило статистически значимый эффект факторов “группа” (F1,45 = = 7.63; p = 0.008), “пол” (F1,45 = 6.89; p = 0.012), “возраст” (F1,45 = 23.1; p < 0.001) и значимое взаимодействие данных факторов (F1,45 = 5.18; p = 0.028). Последующий анализ выявил статистически значимое увеличение ЛП переворота на 3 ПНД у самцов группы гипоксия по сравнению с самцами группы контроль (p = = 0.048). В подгруппе самок отличий между контролем и опытом на 3 ПНД отмечено не было, при этом ЛП переворота у контрольных самок статистически значимо превышал величину этого показателя у контрольных самцов (p = 0.03). На 5 ПНД в подгруппе самцов отличий между опытом и контролем зарегистрировано не было, при этом самки, перенесшие гипоксию, выполняли рефлекс переворачивания на плоскости статистически значимо дольше, чем самки из контрольной группы (р = 0.007) (рис. 2).
Рис. 2.
Влияние неонатальной гипоксии на становление рефлекса переворота на плоскости. По оси абсцисс – возраст животных (дни), по оси ординат – латентный период переворота (с). Число самцов/самок в группе “контроль” – 10/15, в группе “гипоксия” – 10/14. Зарегистрированы статистически значимые эффекты факторов “группа” (F1,45 = 7.63; p = 0.008), “пол” (F1,45 = 6.89; p = 0.012), “день жизни” (F1,45 = 23.1; p < 0.001) и взаимодействие данных факторов (F1,45 = 5.18; p = 0.028) (3-way ANOVA). Статистически значимые отличия от соответствующего контроля отмечены * (p < 0.05) и ** (p < 0.01), отличия от подгруппы самцов – # (p < 0.05) (Fisher LSD критерий).
Fig. 2. The effects of the neonatal hypoxia on the maturation of the Righting reflex. The X-axis – the age of animals (days), the Y-axis – mean latency to turn (sec). The number of male/female mice in the “control” group – 10/15, in the “hypoxia” group – 10/14. Significant effects of factors “group” (F1,45 = 7.63; p = 0.008), “gender” (F1,45 = = 6.89; p = 0.012), “day of life” (F1,45 = 23.1; p < 0.001) and the factors interaction (F1,45 = 5.18; p = 0.028) was shown (3-way ANOVA). Significant differences vs corresponding control marked * (p < 0.05) and ** (p < 0.01), differences vs male subgroup – # (p < 0.05) (Fisher LSD test).
Рефлекс ползания. Методом двухфакторного ANOVA не было выявлено влияния фактора “группа” (F1,51 = 0.01; p = 0.996), а также взаимодействия факторов “группа” × “пол” (F1,51 = 0.11; p = 0.742). Однако было отмечено статистически значимое влияние фактора “пол” (F1,51 = 5.30; p = 0.025) на время выползания из круга. Дальнейший анализ показал, что самки вне зависимости от группы выполняют задачу быстрее, чем самцы (рис. 3 (а)).
Рис. 3.
Влияние неонатальной гипоксии на становление моторных рефлексов. По оси ординат – латентный период (с) выполнения следующих тестов: рефлекса ползания (а), негативного геотаксиса (б), удержания на горизонтальном стержне (в). Число самцов/самок в группе “контроль” – 11/17, в группе “гипоксия” – 11/16. 2-way ANOVA показал статистически значимое влияние фактора “пол” на время выползания из круга (F1,51 = 5.30; p = 0.025) и взаимодействие факторов “пол” и “группа” для времени удержания на стержне (F1,51 = 5.09; p = 0.028). Обозначения, как на рис. 2.
Fig. 3. The effects of the neonatal hypoxia on the maturation of the motor reflexes. The X-axis – mean latency times (sec) for performing the following tests: Gait reflex (a), Negative Geotaxis (б), Traction reflex test (в). The number of male/female mice in the “control” group – 11/17, in the “hypoxia” group – 11/16. 2-way ANOVA showed significant effect of factor “group” for latensy to exit from the circle (F1,51 = 5.30; p = 0.025) and interaction of factors “gender” and “group” for the holding time on the rod (F1,51 = 5.09; p = 0.028). Notation as in Fig. 2.
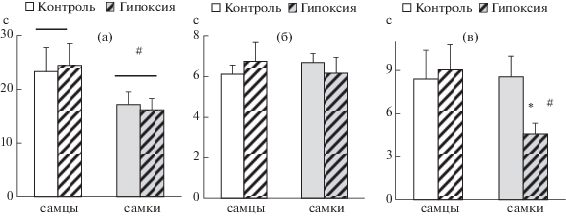
Рефлекс отрицательного геотаксиса. Анализ полученных результатов с помощью двухфакторного ANOVA показал отсутствие влияния факторов “группа” (F1,51 = 0.01; p = 0.93) и “пол” (F1,51 = 0; p = 0.93) на ЛП поворота на 180°, а также взаимодействия этих факторов (F1,51 = 0.65; p = 0.42) в данном тесте (рис. 3 (б)).
Удержание на горизонтальном стержне. Использование двухфакторного ANOVA не выявило эффекта фактора “группа” (F1,51 = 1.57; p = 0.22) на время удержания на стержне, при этом наблюдался на уровне тенденции эффект фактора “пол” (F1,51 = 3.47; p = 0.07) и статистически значимое взаимодействие факторов “группа” × “пол” (F1,51 = 5.09; p = 0.028). Post hoc анализ показал статистически значимое снижение времени удержания на горизонтальном стержне у самок, перенесших гипоксию, по сравнению с самками контрольной группы (p = 0.008), а также по сравнению с самцами, перенесшими гипоксическое воздействие (p = 0.006) (рис. 3 (в)).
Оценка ориентировочно-исследовательской активности и тревожности
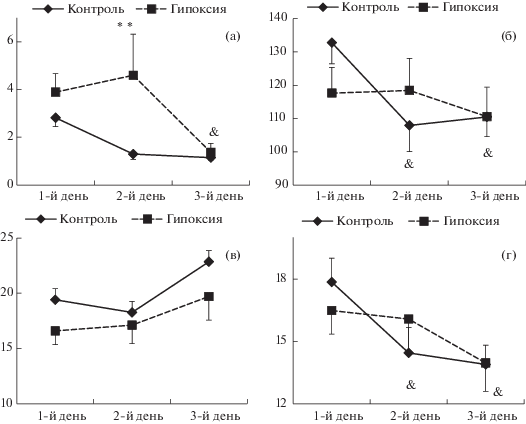
Тест “Открытое поле”. Оценка уровня двигательной активности и ориентировочно-исследовательской реакции проводилась в ОП в течение трех последовательных дней (24–26 ПНД). Трехфакторный ANOVA для повторных измерений не выявил влияния фактора “пол” на такие параметры поведения крыс в тесте ОП, как ЛП выхода из центра поля (F1,50 = 0.41, p = 0.53), количество пройденных секторов (F1,50 = 1.15, p = 0.29), число стоек (F1,50 = 0.35, p = 0.56) и выходов в центр ОП (F1,50 = 0.78, p = 0.38), а также взаимодействия факторов “пол” и “группа” (F1,50 < 2.00, p > > 0.16), что позволило представить данные, полученные по всей выборке животных (рис. 4). При этом было зарегистрировано статистически значимое влияние фактора “группа” на величину ЛП выхода из центра ОП (F1,50 = = 5.03; p = 0.029), а также влияние фактора “день тестирования” на все регистрируемые показатели (F2,100 > 3.50, p < 0.035). Кроме того, отмечалось взаимодействие указанных факторов на уровне тенденции для таких показателей, как ЛП и количество пройденных секторов (F2,100 = 3.07, p = 0.051 и F2,100 = 2.70, p = 0.07 соответственно). Последующий анализ показал, что у мышей, перенесших гипоксию, ЛП выхода из центра поля во второй день опыта статистически значимо больше, чем в контроле (p = 0.02), и этот показатель снижается к третьему дню опыта (p = 0.002). У контрольных животных величина ЛП оставалась на одном уровне на протяжении всех трех дней тестирования (рис. 4 (а)). В ходе эксперимента горизонтальная двигательная активность (длина пробега) и число выходов в центр ОП в контрольной группе мышей статистически значимо снижались относительно первого дня опыта (p < 0.02 и p < 0.001 для второго и третьего дня соответственно). В группе мышей, подвергавшихся гипоксии, эти показатели в ходе опыта сохранялись на постоянном уровне (рис. 4 (б) и (г)). Изменений вертикальной двигательной активности (числа стоек) в течение трех дней тестирования у животных обеих групп зарегистрировано не было (рис. 4 (в)).
Рис. 4.
Влияние неонатальной гипоксии на поведение мышей в тесте “Открытое поле”. По оси абсцисс – величина параметра: (а) – латентный период выхода из центра арены, (б) – число пересеченных секторов, (в) – число стоек, (г) – число выходов в центр арены. По оси ординат – дни тестирования в ОП. Число самцов/самок в группе “контроль” – 10/17, в группе “гипоксия” – 11/16. 3-way ANOVA выявил значимое влияние фактора “группа” на величину ЛП выхода из центра ОП (F1,50 = 5.03; p = 0.029) и взаимодействие факторов “группа” и “день тестирования” на уровне тенденции для ЛП выхода из центра ОП (F2,100 = 3.07, p = 0.051) и числа пройденных секторов (F2,100 = 2.70, p = 0.07). Статистически значимые отличия от контроля отмечены ** (p < 0.01), от соответствующего показателя в первый день тестирования – & (p < 0.05) (Fisher LSD критерий).
Fig. 4. The effects of the neonatal hypoxia on the mouse behavior in Open Field test. The X-axis – parameter value: (а) – the latency to exit from the center of the arena, (б) – the number of crossing, (в) – the number of rears, (г) – the number of visits to the center of arena. The Y axis – days of testing in the Open Field. The number of male/female mice in the “control” group – 10/17, in the “hypoxia” group – 11/16. 3-way ANOVA revealed significant effect of factor “group” on the latency to exit from the center of the arena (F1,50 = 5.03; p = 0.029) and interaction of factors “group” and “day of testing” for the latency to exit from the arena center (F2,100 = 3.07, p = 0.051) and the number of sectors crossing (F2,100 = 2.70, p = 0.07) at the tendency level. Significant differences vs control marked ** (p < 0.01), differences vs corresponding value on the 1st day of testing – & (p < 0.05) (Fisher LSD test).
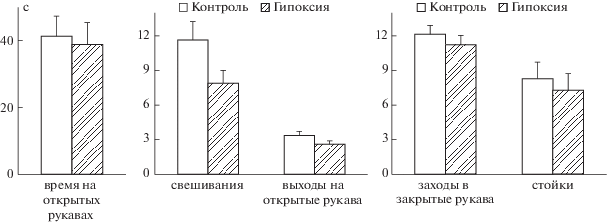
Тест “Приподнятый крестообразный лабиринт”. Анализ параметров поведения животных в ПКЛ методом ANOVA не выявил влияния фактора “пол” на показатели поведения мышей (F1,50 < 1.65, p > 0.20) и взаимодействия факторов “группа” × “пол” (F2,50 < 1.90, p > 0.18), что позволило представить данные, полученные по всей выборке животных (рис. 5). На уровне тенденции отмечалось влияние фактора “группа” на такие показатели, как число выходов на открытые рукава и число свешиваний с открытых рукавов лабиринта (F1,50 = 3.22; p = 0.079 и F1,50 = 3.03; p = 0.082 соответственно). Последующий анализ также выявил тенденцию к снижению числа выходов на открытые рукава и числа свешиваний с открытых рукавов в группе мышей, перенесших гипоксию, относительно контроля (p = 0.061 и p = 0.059 соответственно) (рис. 5).
Рис. 5.
Влияние неонатальной гипоксии на поведение мышей в тесте “Приподнятый крестообразный лабиринт”. Число самцов/самок в группе “контроль” – 11/17, в группе “гипоксия” – 11/16. 2-way ANOVA выявил влияние фактора “группа” на уровне тенденции на число выходов на открытые рукава (F1,50 = 3.22; p = 0.079) и число свешиваний с открытых рукавов лабиринта (F1,50 = 3.03; p = 0.082).
Fig. 5. The effects of the neonatal hypoxia on the mice behavior in Elevated Plus Maze. The number of male/female mice in the “control” group – 11/17, in the “hypoxia” group – 11/16. 2-way ANOVA revealed effect of factor “group” on the number of the open arms entries (F1,50 = 3.22; p = 0.079) and the number of head dipping (F1,50 = = 3.03; p = 0.082) at the tendency level.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для изучения патогенеза и поиска путей коррекции последствий перинатальной гипоксии необходима разработка адекватных экспериментальных моделей. В данной работе мы использовали модифицированную модель ОНГ (8% О2 в течение 2 ч на 2 ПНД) [Wang et al., 2013]. Ранее нами было показано, что такое воздействие оказывает негативное влияние на физическое развитие, поведение, уровень тревожности и способность к обучению крыс линии Wistar [Sukhanova et al., 2018; 2019]. В настоящей работе было показано, что аналогичное воздействие (ОНГ на второй день жизни) приводит к высокому уровню летальности у мышей линии C57BL/6, а также вызывает у них задержку физического и моторного развития, изменения поведения в тесте ОП и незначительное возрастание тревожности в тесте ПКЛ.
При исследовании острых эффектов неонатальной гипоксии у мышей наблюдался достаточно высокий уровень летальности (18.2% по общей группе животных). Величина этого показателя значительно превышает уровень летальности при аналогичном воздействии у крыс линии Wistar (от 4 до 10% в разных сериях экспериментов) [Sukhanova et al., 2018; 2019]. Согласно данным литературы, в моделях гипоксии-ишемии уровень смертности у мышей был значительно выше, чем у крыс аналогичного возраста, при этом длительность гипоксического воздействия после перевязки сонной артерии была меньше [Burnsed et al., 2015; Diaz et al., 2017]. Следовательно, мыши значительно хуже крыс переносят неонатальное гипоксическое воздействие. Работ, в которых бы проводили сравнение крыс и мышей немного, однако в имеющихся статьях отмечаются заметные различия физиологического ответа на гипоксию и профиля экспрессии генов у крыс и мышей [Hoshikawa et al., 2003; Jochmans-Lemoine et al., 2016]. Данные различия, вероятно, лежат в основе разной устойчивости крыс и мышей к одинаковому по степени тяжести гипоксическому воздействию.
При изучении влияния ПГ на параметры соматического развития большинство исследований не выявило изменения этих показателей у самцов и самок грызунов в моделях однократной гипоксии или Г/И [Kletkiewicz et al., 2016; Peterson et al., 2015]. В данной работе и проведенных нами ранее исследованиях не было зарегистрировано изменения таких показателей соматического развития, как возраст открытия глаз и возраст открытия слуховых проходов у мышей и крыс [Sukhanova et al., 2018].
Замедление набора веса было зарегистрировано многими исследователями у крыс, перенесших Г/И, пол которых не был указан [Lubics et al., 2005; Huang et al., 2016]. В тех случаях, когда самцы и самки анализировались отдельно, отмечалось снижение массы тела у самок, но не самцов крыс [Ashwal et al., 2014] и мышей [Diaz et al., 2017], перенесших Г/И. В наших экспериментах через сутки после гипоксии величина относительного прироста массы тела мышат, перенесших ОНГ, была ниже, чем в контроле. Такое отличие нельзя объяснить пищевой депривацией, которой подвергались мышата в период гипоксии, так как контрольные животные также на это время отлучались от матери. Следовательно, ОНГ приводит к замедлению прироста массы тела как самцов, так и самок мышей в течение первых суток после воздействия. В дальнейшем различий по массе между мышами группы контроль и мышами, перенесшими гипоксию, по общей выборке не наблюдалось. Однако на уровне тенденции в течение недели после гипоксии отмечалось отставание по массе у самок, перенесших ОНГ, относительно контроля. Проведенные нами ранее эксперименты также показали, что ОНГ вызывает замедление набора массы тела у самок, но не у самцов крыс [Sukhanova и др., 2018]. Следовательно, как в случае крыс, так и мышей влияние гипоксии на изменение массы тела носит зависимый от пола характер.
Показателем физического развития также является скорость созревания сенсомоторных рефлексов. Согласно клиническим данным, у новорожденных, перенесших ПГ, нарушения ранних рефлексов (таких как рефлекс Моро, подошвенный, хватательный, сосательный рефлексы) являются высокопредиктивными для дальнейшего развития церебрального паралича и задержки умственного развития [Ten et al., 2003]. В экспериментах увеличение времени выполнения переворота на плоскости и поворота в тесте отрицательного геотаксиса отмечалось у крыс [Fan et al., 2005; Lubics et al., 2005; Grojean et al., 2003] и мышей [Rostein et al., 2006; Wang et al., 2013; Xu et al., 2016], перенесших гипоксию или Г/И. Также было зарегистрировано снижение времени удержания на горизонтальном стержне (или струне) у подвергавшихся неонатальной гипоксии грызунов [Fan et al., 2005; Grojean et al., 2003; Xu et al., 2016]. В большинстве работ не было выявлено изменения времени выполнения рефлекса ползания у животных, перенесших ПГ [Peterson et al., 2015; Huang et al., 2016]. В данной работе нами было зарегистрировано замедление становления рефлекса переворота на плоскости у мышей, перенесших ОНГ. При этом у самцов ЛП выполнения задачи превышал контрольные значения на 3 ПНД, а у самок – на 5 ПНД. Следовательно, ОНГ приводила к нарушению становления рефлекса переворота как у самцов, так и у самок крыс, отмеченные отличия связаны с разным временем созревания данного рефлекса у животных разного пола. При изучении эффектов аналогичного воздействия на крысах было показано нарушение выполнения рефлекса переворота у самцов, но не у самок в возрасте 6 ПНД [Sukhanova et al., 2018]. Однако в этом возрасте время выполнения рефлекса в подгруппе контрольных самок было значимо больше, чем у самцов. Можно предположить, что дальнейшие наблюдения могли бы выявить нарушения этого рефлекса у самок крыс. В данной работе нами не было зарегистрировано влияние ОНГ на время выполнения рефлексов ползания и отрицательного геотаксиса у мышей, хотя самки в целом быстрее покидали пределы окружности. Однако следует отметить, что среднее время выполнения реакции в тесте отрицательного геотаксиса на 12 ПНД во всех группах мышей не превышало семи с, т.е. все мыши успешно выполняли задачу. Можно предположить, что проверка этого рефлекса у мышей более раннего возраста позволит зарегистрировать эффекты ОНГ [Ten et al., 2003]. У крыс, перенесших ОНГ, было зарегистрировано нарушение выполнения рефлекса отрицательного геотаксиса на 12 ПНД; при этом влияния на выполнение рефлекса ползания, как и у мышей, отмечено не было [Sukhanova и др., 2018]. В тесте удержания на горизонтальном стержне негативные эффекты ОНГ у мышей были зарегистрированы только в подгруппе самок. На крысах эффекты ОНГ на выполнение такого рефлекса исследованы ранее не были.
Известно, что ПГ у млекопитающих приводит к долговременному неврологическому дефициту, в том числе к изменению реакции на стресс и ухудшению способности к обучению [Millar et al., 2017]. Тест “Открытое поле” используется для оценки двигательной и исследовательской активности грызунов в незнакомых условиях и относительно большом пространстве [Altman, Sudarshan, 1975]. При этом многократные посадки животного в установку позволяют выявить ноотропную активность у изучаемых соединений или воздействий [Platel et al., 1984]. Ранее было показано, что изменение поведения в ОП у крыс, перенесших неонатальную аноксию, носит двухфазный характер: временная гиперактивность в подростковом возрасте сменяется гипоактивностью у взрослых крыс [Caputa et al., 2005]. Проведенное нами ранее изучение поведения в ОП крыс, подвергавшихся ОНГ, показало увеличение двигательной активности в возрасте 30 дней [Sukhanova и др., 2019]. Также было показано, что неонатальная гипоксия без ишемии у однодневных мышей (5% О2, 2 часа) приводит в дальнейшем к гиперактивности в возрасте 14–16 дней и нарушению пространственного обучения в возрасте 30 дней [Wang et al., 2013]. В данной работе у мышей, перенесших ОНГ, в ОП отмечались проявления гиперактивности и снижения способности к запоминанию, т.к. при повторном помещении в установку длина пробега и количество выходов в центр арены не изменялись по сравнению с первым днем. В контроле при повторном помещении в установку эти показатели снижались. О нарушении процессов запоминания у животных, перенесших гипоксию, может также свидетельствовать увеличение ЛП выхода из центра ОП на второй день тестирования, что может свидетельствовать о реакции затаивания. Следовательно, у мышей, как и у крыс, перенесших ОНГ, наблюдается гиперактивность в тесте ОП, однако у мышей для выявления этого эффекта необходимо использовать многократное предъявление экспериментальной обстановки [Wang et al., 2013].
При исследовании поведения мышей в тесте ПКЛ в возрасте 30 дней не было выявлено различий между контрольной и опытной группами. Однако отмеченные на уровне тенденции изменения параметров поведения (числа свешиваний и выходов на открытые рукава лабиринта) могут указывать на незначительное возрастание тревожности у мышей, перенесших гипоксию. Ранее влияние неонатальной гипоксии на поведение мышей в тесте ПКЛ не исследовалось. Результаты, полученные в экспериментах на крысах, противоречивы. Так, в модели Г/И на 7 ПНД не было зарегистрировано изменения уровня тревожности крыс в ПКЛ [Arteni et al., 2010]. В моделях неонатальной гипоксии без ишемии отмечалось как отсутствие влияния на уровень тревожности [Galeano et al., 2011], так и увеличение тревожности у крыс [Takada et al., 2016]. Для выяснения влияния неонатальной гипоксии на уровень тревожности грызунов необходимы дальнейшие исследования.
ЗАКЛЮЧЕНИЕ
Оценка физиологических показателей у мышей линии C57BL/6, подвергавшихся ОНГ на второй день постнатального развития, показала высокий уровень летальности, незначительное замедление физического развития, задержку психомоторного развития. Эти эффекты носили зависимый от пола характер. Кроме того, у мышей, перенесших ОНГ, наблюдались изменения поведения в тесте ОП и незначительное возрастание тревожности в тесте ПКЛ. На основании проведенных исследований можно заключить, что модель однократной неонатальной нормобарической гипоксии у мышей в возрасте двух дней может быть использована для дальнейшего изучения патофизиологии и нейрохимических механизмов, лежащих в основе неврологических нарушений при перинатальной гипоксии.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 19-04-00209).
Список литературы
Отеллин В.А., Хожай Л.И., Ватаева Л.А. Влияние гипоксии в раннем перинатальном онтогенезе на поведение и структурные характеристики головного мозга крыс. Журнал эволюционной биохимии и физиологии. 2012. 48 (5): 467–472.
Суханова Ю.А., Себенцова Е.А., Левицкая Н.Г. Острые и отставленные эффекты перинатального гипоксического повреждения мозга у детей и в модельных экспериментах на грызунах. Нейрохимия. 2016. 33 (4): 276–292.
Alexander M., Garbus H., Smith A.L., Rosenkrantz T.S., Fitch R.H. Behavioral and histological outcomes following neonatal HI injury in a preterm (P3) and term (P7) rodent model. Behav. Brain Res. 2014. 259: 85–96.
Altman J., Sudarshan K. Postnatal development of locomotion in the laboratory rat. Anim. Behav. 1975. 23: 896–920.
Arteni N., Pereira L., Rodrigues A., Lavinsky D., Achaval M., Netto C. Lateralized and sex-dependent behavioral and morphological effects of unilateral neonatal cerebral hypoxia-ischemia in the rat. Behav. Brain Res. 2010. 210 (1): 92–98.
Ashwal S., Ghosh N., Turenius C.I., Dulcich M., Christopher M. Denham B.T., Hartman R., Snyder E.Y., Obenaus A. Reparative effects of neural stem cells in neonatal hypoxic-schemic injury are not influenced by host sex. Pediatr Res. 2014. 75 (5): 603–611.
Bolisetty S., Dhawan A., Abdel-Latif M., Bajuk B., Stack J., Lui K. Intraventricular hemorrhage and neurodevelopmental outcomes in extreme preterm infants. Pediatrics, 2014. 133 (1): 55–62.
Burnsed J., Chavez-Valdez R., Hossain M., Kesavan K., Martin L., Zhang J3, Northington F. Hypoxia-ischemia and therapeutic hypothermia in the neonatal mouse brain – a longitudinal study. PLoS One. 2015. 10 (3): 0118889.
Caputa M., Rogalska J., Wentowska K., Nowakowska A. Perinatal asphyxia, hyperthermia and hyperferremia as factors inducing behavioural disturbances in adulthood: A rat model. Behav. Brain Res. 2005. 163 (2): 246–256.
Chavez-Valdez R., Martin L.J., Razdan S., Gauda E.B.B., Northington F.J.J. Sexual dimorphism in BDNF signaling after neonatal hypoxia-ischemia and treatment with necrostatin-1. Neuroscience. 2014. 260: 106–119.
Diaz J., Abiola S., Kim N., Avaritt O., Flock D., Yu J., Northington F.J., Chavez-Valdez R. Therapeutic hypothermia provides variable protection against behavioral deficits after neonatal hypoxia-ischemia: a potential role for brain-derived neurotrophic factor . Dev. Neurosci. 2017. 39 (1–4): 257–272.
Fan L., Lin S., Pang Y., Lei M., Zhang F., Rhodes P., Cai Z. Hypoxia-ischemia induced neurological dysfunction and brain injury in the neonatal rat. Behav. Brain Res. 2005. 165 (1): 80–90.
Galeano P., Blanco Calvo E., Madureira de Oliveira D., Cuenya L., Kamenetzky G.V., Mustaca A.E., Barreto G.E., Giraldez-Alvarez L.D., Milei J., Capani F. Long-lasting effects of perinatal asphyxia on exploration, memory and incentive downshift. Int. J. Dev. Neurosci. 2011. 29 (6): 609–619.
Hoshikawa Y., Nana-Sinkam P., Moore M., Sotto-Santiago S., Phang T., Keith R., Morris K., Kondo T., Tuder R., Voelkel N., Geraci M. Hypoxia induces different genes in the lungs of rats compared with mice. Physiol Genomics. 2003. 12 (3): 209–219.
Huang H., Wen X., Liu H. Sex differences in brain MRI abnormalities and neurodevelopmental outcomes in a rat model of neonatal hypoxia-ischemia. Int. J. Neurosci. 2016. 126 (7): 647–657.
Jantzie L., Robinson S. Preclinical models of encephalopathy of prematurity. Dev. Neurosci. 2015. 37 (4): 277–288.
Jochmans-Lemoine A., Shahare M., Soliz J., Joseph V. HIF1α and physiological responses to hypoxia are correlated in mice but not in rats. Exp Biol. 2016. 219 (24): 3952–3961.
Kletkiewicz H., Nowakowska A., Siejka A., Mila-Kierzenkowska C., Woźniak A., Caputa M., Rogalska J. Deferoxamine improves antioxidative protection in the brain of neonatal rats: The role of anoxia and body temperature. Neurosci. Lett. 2016. 628: 116–122.
Lubics A., Reglodi D., Tamas A., Kiss P., Szalai M., Szalontay L., Lengvári I. Neurological reflexes and early motor behavior in rats subjected to neonatal hypoxic-ischemic injury. Behav. Brain Res. 2005. 157 (1): 157–165.
Mayoral J., Nouzova M., Navare A., Noriega F. NADP+-dependent farnesol dehydrogenase, a corpora allata enzyme involved in juvenile hormone synthesis. Proc. Natl. Acad. Sci. 2009. 106 (50): 21091-6.
Millar L., Shi L., Hoerder-Suabedissen A., Molnar Z. Neonatal hypoxia ischaemia: mechanisms, models, and therapeutic challenges. Front. Cell. Neurosci. 2017. 11. P. 1–36.
Peterson B., Won S., Geddes R., Sayeed I., Stein D. Sex-related differences in effects of progesterone following neonatal hypoxic brain injury. Behav. Brain Res. 2015. 286: 152–165.
Platel A., Jalfre M., Pawelec C., Roux S., Porsolt R. Habituation of exploratory activity in mice: effects of combinations of piracetam and choline on memory processes. Pharmacol Biochem Behav. 1984. 21 (2): 209–212.
Rice J.E., Vannucci R.C., Brierley J.B. The influence of immaturity on hypoxic-ischemic brain damage in the rat. Ann. Neurol. 1981. 9 (2): 131–141.
Rotstein M., Bassan H., Kariv N., Speiser Z., Harel S., Gozes I. NAP enhances neurodevelopment of newborn apolipoprotein E-deficient mice subjected to hypoxia. J. Pharmacol. Exp. Ther. 2006. 319 (1): 332–339.
Salmaso N., Jablonska B., Scafidi J., Vaccarino F.M., Gallo V. Neurobiology of premature brain injury. Nat Neurosci. 2014. 17 (3): 341–346.
Sheldon R., Osredkar D., Lee C., Jiang X., Mu D., Ferriero D. HIF-1α-deficient mice have increased brain injury after neonatal hypoxia-ischemia. Dev. Neurosci. 2009. 31 (5): 452–458.
Sheldon R.A., Sedik C., Ferriero D.M. Strain-related brain injury in neonatal mice subjected to hypoxia-ischemia. Brain Res. 1998. 810 (1–2): 114–122.
Smith A., Alexander M., Rosenkrantz T., Sadek M., Fitch R. Sex differences in behavioral outcome following neonatal hypoxia ischemia: insights from a clinical meta-analysis and a rodent model of induced hypoxic ischemic brain injury. Exp. Neurol. 2014. 254: 54–67.
Sukhanova I.A., Sebentsova E.A., Khukhareva D.D., Vysokikh M.Y., Bezuglov V.V., Bobrov M.Y., Levitskaya N.G. Early-life N-arachidonoyl-dopamine exposure increases antioxidant capacity of the brain tissues and reduces functional deficits after neonatal hypoxia in rats. Int. J. Dev. Neurosci. 2019. 78: 7–18.
Sukhanova I.A., Sebentsova E.A., Khukhareva D.D., Manchenko D.M., Glazova N.Y., Vishnyakova P.A., Inozemtseva L.S., Dolotov O.V., Vysokikh M.Y., Levitskaya N.G. Gender-dependent changes in physical development, BDNF content and GSH redox system in a model of acute neonatal hypoxia in rats. Behav. Brain Res. 2018. v. 350. p. 87–98.
Takada S., dos Santos Haemmerle C., Motta-Teixeira L., Machado-Nils A., Lee V., Takase L., Cruz-Rizzolo R., Kihara A., Xavier G., Watanabe I., Nogueira M. Neonatal anoxia in rats: hippocampal cellular and subcellular changes related to cell death and spatial memory. Neuroscience, 2015. 284 (October): 247–259.
Takada S., Motta-Teixeira L., Machado-Nils A., Lee V., Sampaio C., Polli R., Malheiros J., Takase L., Kihara A., Covolan L., Xavier G., Nogueira M. Impact of neonatal anoxia on adult rat hippocampal volume, neurogenesis and behavior. Behav. Brain Res. 2016. 296: 331–338.
Ten V., Bradley-Moore M., Gingrich J., Stark R., Pinsky D. Brain injury and neurofunctional deficit in neonatal mice with hypoxic-ischemic encephalopathy. Behav. Brain Res. 2003. 145 (1–2): 209–219.
Towfighi J., Mauger D., Vannucci R.C., Vannucci S.J. Influence of age on the cerebral lesions in an immature rat model of cerebral hypoxia-ischemia: a light microscopic study. Dev. brain Res. 1997. 100 (2):149–160.
Vannucci R., Lyons D., Vasta F. Regional cerebral blood flow during hypoxia-ischemia in immature rats. Stroke. 1988. 19 (2): 245–250.
Wang Z., Zhan J., Wang X., Gu J., Xie K., Zhang Q., Liu D. Sodium hydrosulfide prevents hypoxia-induced behavioral impairment in neonatal mice. Brain Res. 2013. 1538: 126–134.
Xu B., Xiao A., Chen W., Turlova E., Liu R., Barszczyk A., Sun C., Liu L., Tymianski M., Feng Z., Sun H. Neuroprotective effects of a PSD-95 inhibitor in neonatal hypoxic-ischemic brain injury. Mol. Neurobiol. 2016. 53 (9): 5962–5970.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


