Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 4, стр. 460-472
АКТИВАЦИЯ ЗЕРКАЛЬНОЙ СИСТЕМЫ МОЗГА ЗАВИСИТ ОТ СПОСОБА ПРЕДЪЯВЛЕНИЯ СТИМУЛОВ: НЕПОСРЕДСТВЕННО ЭКСПЕРИМЕНТАТОРОМ ИЛИ КАК ВИДЕОРОЛИК
Н. Н. Лебедева 1, С. Е. Буркитбаев 1, Е. Д. Каримова 1, *
1 Федеральное государственное бюджетное научное учреждение
Институт высшей нервной деятельности и нейрофизиологии РАН
г. Москва, Россия
* E-mail: e.d.karimova@gmail.com
Поступила в редакцию 07.02.2020
После доработки 14.02.2020
Принята к публикации 26.02.2020
Аннотация
В данной статье проводится сравнительный анализ двух методик демонстрации стимульного материала при исследовании зеркальной системы мозга (ЗСМ) – лично экспериментатором и с помощью видеоролика на экране монитора. Зеркальная система мозга играет важнейшую роль при различных социальных взаимодействиях и обеспечивает понимание действий, мотиваций и эмоций других людей. Снижение мощности мю-ритма ЭЭГ в центральных областях мозга связано с активацией ЗСМ и используется в исследовательских работах как индикатор включения ЗСМ. В данной работе двум группам испытуемых сначала демонстрировали сжатие кисти руки, затем просили представить, а затем выполнить это же движение самостоятельно. Первой группе испытуемых демонстрацию сжатия кисти производил непосредственно экспериментатор, а второй группе это же моторное движение руки показывали на экране монитора. Наша работа показала, что снижение мощности мю-ритма наблюдалось во всех трех задачах, активирующих ЗСМ, только в верхнем частотном диапазоне 10.5–13 Гц и только в группе добровольцев, которым демонстрацию производили лично. Также у этой группы испытуемых наблюдалось повышение бета2-ритма ЭЭГ в моторных и сенсомоторных областях. Достоверных изменений мощности мю- или бета-ритма во второй группе при демонстрации на экране монитора не выявлено. Результаты работы позволяют выдвинуть гипотезу о том, что активация ЗСМ происходит значительнее в ситуации личного социального взаимодействия.
ВВЕДЕНИЕ
Первоначально зеркальные нейроны были обнаружены у макак в 1996 г. итальянскими учеными под руководством Ризолатти в экспериментах на моторной коре обезьян [Gallese et al., 1996]. В своей работе они показали, что некоторые нейроны из области F5 повышали свою активность не только в момент, когда макака сама совершала определенное моторное действие, например, брала кусочек пищи, но и тогда, когда экспериментатор показывал макаке, что ей нужно делать. Это свойство избирательной активации в условиях социального взаимодействия породило большой интерес к данной сети нейронов, в особенности в исследованиях, связанных с эмпатией и восприятием двигательных актов [Buccino et al., 2004; Calvo-Merino et al., 2005]. Функции зеркальных нейронов связывают в первую очередь с обучением через подражание в раннем возрасте [Kaida et al., 2019; Nishimura et al., 2018; Nyström, 2008]. Вторая важная функция зеркальных нейронов, которая проявляется в основном у взрослых – это способность воспринимать и понимать действия и эмоции других людей при социальном общении [Berntson, 2013; Calvo-Merino et al., 2005; Campbell et al., 2018; Hogeveen et al., 2015; Iacoboni, 2005].
Основные методы исследования зеркальных нейронов – это функциональная магнитно-резонансная томография (фМРТ), позитронно-эмисионная томография (ПЭТ), транскраниальная магнитная стимуляция (ТМС) и электроэнцефалограмма (ЭЭГ). При этом нужно понимать, что в данном случае речь идет не о прямой регистрации нейрональной активности, а об оценке повышения активности какой-либо области во время выполнения задач, стимулирующих работу зеркальных нейронов. Поэтому, на наш взгляд, когда речь идет о подобных методах, корректнее было бы использовать термин “зеркальная система мозга”. Кроме того, судя по тому, что активность зеркальных сетей обнаруживают в различных областях моторной, сенсомоторной коры, нижнелобной извилины, передней области теменной коры [Calvo-Merino et al., 2005; Grèzes, 2001], а не строго определенной анатомической области, скорее всего, речь идет действительно о функциональной системе зеркальных нейронов.
Одним из способов оценки активности зеркальной системы мозга (ЗСМ) является анализ мощности мю-ритма ЭЭГ при реализации моторных задач [Fox et al., 2016]. Известно, что мю-ритм, или сенсомоторный ритм ЭЭГ, связан с моторной функцией человека. Он имеет тот же диапазон, что и альфа-ритм (8–13 Гц), однако регистрируется в центральных отведениях в области моторной коры и снижается при наблюдении, представлении и выполнении моторных задач, т.е. как раз тогда, когда включаются в работу зеркальные нейроны. Таким образом, снижение мю-ритма может служить индикатором активации ЗСМ, а степень десинхронизации указывает на уровень активности ЗСМ.
Некоторые исследователи, тем не менее, в своих работах критикуют использование данного метода для определения активации ЗСМ, указывая на то, что диапазон мю-ритма пересекается с альфа-ритмом, и не всегда их можно хорошо дифференцировать, а снижение мю- или альфа-ритма может быть связано не только с активацией ЗСМ, но и повышением зрительного внимания и другими процессами, связанными с обработкой информации [Hobson, Bishop, 2016, 2017]. Действительно, при использовании десинхронизации мю-ритма в качестве главного показателя работы ЗСМ необходимо хорошо понимать функциональные особенности альфа- и мю-ритмов, учитывать их пространственную локализацию, внимательно подходить к выбору фона или baseline (состояния, относительно которого будут рассчитываться значения мощности ритма в задачах) и контролировать изменения мощности ритмов не только в центральных отведениях, но и в других областях скальпа, особенно в затылочных отведениях во всех задачах.
Одновременная регистрация ЭЭГ и фМРТ-сигнала в состоянии покоя показала важные результаты: амплитуда компонент мю-ритма отрицательно коррелировала с blood-oxygen-level-dependent (BOLD) ответом в сетях внимания, сенсомоторных областях, и сетях, предположительно являющихся сетями зеркальной системы [Yin et al., 2016].
Еще один безусловный довод для того, чтобы использовать десинхронизацию мю-ритма как меру активности ЗСМ, получили недавно в своей работе последователи первооткрывателя зеркальных нейронов Marco Bimbi и соавт. [Bimbi et al., 2018]. При одновременной регистрации Multi Unit Activity (MUA), local field potentials (LFP) и ЭЭГ с вентральной премоторной коры у обезьяны было обнаружено, что активность нейронов премоторной коры достоверно коррелирует с повышением мощности гамма-диапазона LFP, а также со снижением мощности в верхнем альфа- и нижнем бета-диапазонах ЭЭГ центральных отведений. Более того, они обнаружили, что повышение гамма-активности LFP предшествует десинхронизации мю-ритма примерно на 800 мс и 500 мс в задачах выполнения и наблюдения действия, а это значит, что активация нейронов премоторной коры модулирует генерацию мю-ритма.
Несмотря на убедительные доводы в пользу существования взаимосвязи между мю-ритмом и зеркальной системой мозга, в обзорных работах отмечают, что результаты ЭЭГ-исследований ЗСМ зачастую разрозненные и неубедительные, а дизайн экспериментов не всегда учитывает те свойства зеркальных нейронов, которые лежат в основе их изучения [Fox et al., 2016; Hobson, Bishop, 2016, 2017].
Основной идеей всех методик исследования зеркальной системы мозга является применение последовательности задач, стимулирующей работу ЗСМ, а именно: наблюдение, представление (в некоторых случаях) и выполнение одних и тех же моторных действий. В качестве моторных действий часто применяют сжатие кисти или пальцев, захват предмета, перемещение предмета, мимические движения лица при воспроизведении каких-либо эмоций. При этом, если изначально в экспериментах Ризолатти демонстрацию этих движений производил экспериментатор лично перед испытуемым [Gallese et al., 1996; Grafton et al., 1996], то затем, для того чтобы стандартизировать схему эксперимента, убрать субъективный момент восприятия, демонстрацию стали проводить с помощью видеоролика на экране монитора [Ensenberg et al., 2017; Fitzgibbon et al., 2016; Karakale et al., 2019; Varnum et al., 2016; Zhu, Sun, 2016].
И действительно, использование смонтированного видеоролика, где демонстрируются движения руки или мимика лица, делает эксперимент более стандартизированным, повторяемым, снижает субъективные реакции человека на увиденные жесты. Однако, если вспомнить основные свойства зеркальных нейронов и ситуации их включения в работу, а именно: социальные контакты, обучение через повторение, непосредственно общение с собеседником, эмпатия, станет понятно, что во всех этих ситуациях присутствуют субъективное восприятие собеседника и личный контакт.
Сравнительный анализ двух методик исследования ЗСМ (личная демонстрация и видеоролик) заставил нас задуматься об изначальных условиях включения в работу зеркальных нейронов и о степени их активации при социальных контактах в онлайн-формате. Можно предположить, что при социальных контактах через сеть онлайн, которые сопровождаются общением с помощью видеочатов, не происходит значительного включения зеркальных нейронов в работу. В связи с этим может значительно ухудшаться невербальный контакт, понимание эмоционального фона собеседника, хуже реализовываться процесс обучения.
МЕТОДИКА
В данной работе использовали две распространенные методики подачи стимульного материала, которые обычно применяют в исследованиях зеркальной системы мозга. Первая методика заключалась в личном непосредственном показе моторных движений и инструктаже экспериментатором. Вторая методика заключалась в использовании смонтированного видеоролика с визуализацией этого же моторного движения и письменных инструкций.
В качестве моторного движения было также выбрано одно из самых простых и распространенных движений, которые обычно используются в работах по изучению ЗСМ, – сжатие кисти руки. Причем визуальная демонстрация была “зеркальной”: испытуемый на ролике или вживую видел сжимание левой руки, при этом инструкция была представлять и выполнять сжимание собственной правой руки.
Схема эксперимента и в первом, и во втором случае была одинаковой (рис. 1). Экспериментатор предварительно объяснял испытуемому, какие задачи ему будет необходимо выполнять, не показывая при этом само движение, но объясняя, что сначала необходимо будет наблюдать сжимание кисти, затем нужно будет представить, как он сам сжимает правую руку, затем выполнить это же движение правой рукой. Затем, после подтверждения, что все условия понятны, включалась регистрация ЭЭГ и одновременно начинался ход эксперимента. Сначала записывали фон – 30 с в состоянии покоя с открытыми глазами. Затем следовала 10-секундная пауза, в которой экспериментатор или текст на экране напоминал, что последует демонстрация движения. После чего в течение 10 с испытуемый наблюдал на экране монитора или вживую сжатие кисти. Затем снова 10 с пауза, в которой напоминалась инструкция, и затем 10 с на задачу “представление” и т.д.
Рис. 1.
Схема эксперимента и методика демонстрации стимульного материала (сжимания кисти руки) – лично экспериментатором и с помощью видеоролика на экране монитора.
Fig. 1. Scheme of the experiment and demonstration of stimulus material (clenching the hand) – personally by the experimenter and using a video clip on the monitor screen.
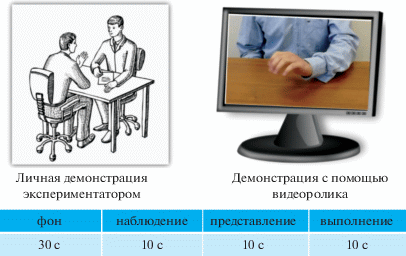
В начале и в конце каждой задачи в обеих методиках звучал звуковой сигнал, при этом испытуемый был проинформирован заранее, что каждую задачу следует выполнять от сигнала до сигнала.
В эксперименте участвовали 37 здоровых испытуемых возрастом от 20 до 37 лет, все правши без психо-неврологических нарушений: 17 испытуемым (11 женщин, 6 мужчин, средний возраст 27 лет) движение демонстрировал экспериментатор, 20 испытуемым (14 женщин, 6 мужчин, средний возраст 29 лет) – с помощью видеоролика. Все испытуемые имели выраженный затылочный и средний уровень альфа-ритма в центральных отведениях, критерием исключения из участия в исследовании был “плоский” тип ЭЭГ.
Эксперимент проходил в одном и том же помещении, экспериментатор был один и тот же, процедура подготовки к эксперименту была абсолютно одинаковой для обеих групп испытуемых (экспериментатор предварительно объяснял последовательность заданий, устанавливал электроды). После подготовки экспериментатор получал подтверждение у испытуемого, что задача понятна и он готов к записи. Далее, во время записи ЭЭГ и проведения эксперимента методика подачи стимульного материала и инструкций отличалась для двух групп испытуемых.
При личной демонстрации экспериментатор находился на расстоянии около 1.5 м от испытуемого лицом к нему, при демонстрации с помощью видеоролика испытуемый сидел лицом к монитору, который располагался на расстоянии около 70 см от испытуемого, а экспериментатор находился позади испытуемого в том же помещении и следил за ходом выполнения эксперимента.
Методики исследования одобрены этическими комитетами Института высшей нервной деятельности и нейрофизиологии РАН и ГБУЗ НПЦ психоневрологии Департамента здравоохранения г. Москвы.
Запись ЭЭГ осуществляли с помощью энцефалографа-анализатора ЭЭГА-21/26 “ЭНЦЕФАЛАН 131-03”, г. Таганрог (19 электродов по системе 10–20, монополярно относительно объединенных ушных электродов А1 и А2) в состоянии покоя с открытыми глазами (фон) и во время задач. Для всех отведений задавали частоту опроса 250 Гц, полосы фильтрации 0.5–60 Гц (12 дБ/октаву), импеданс менее 15 кОм. Записи ЭЭГ обрабатывались методом спектрально-корреляционного анализа на основе быстрого преобразования Фурье (БПФ) по 3 частотным диапазонам: тета (4–8 Гц), альфа (8–13 Гц), бета (13–35 Гц). При этом дополнительно альфа- и бета-диапазоны делили на 2 поддиапазона: альфа1 (8–10.5 Гц) и альфа2 (10.5–13 Гц), бета1 (13–24 Гц), бета2 (24–35 Гц). Отдельно рассматривали как все пространственные области регистрации ЭЭГ, так и изменения мощности в отдельных областях (F – фронтальных, C – центральных, P – теменных, O – затылочных, Т – височных).
Стоит обратить внимание на то, что, по данным многочисленных исследований [Andrews et al., 2016; Fox et al., 2016; Hogeveen et al., 2015; Kaida et al., 2019; Lübke et al., 2019; Nishimura et al., 2018; Лебедева et al., 2018], активацию ЗСМ связывают именно с мю-ритмом ЭЭГ человека, который регистрируется в центральных отведениях над моторной корой. Однако, поскольку по частотному диапазону мю-ритм совпадает с альфа-ритмом (отличаясь при этом формой), нередко возникает неоднозначность в его определении. По умолчанию все ритмы, регистрируемые в диапазоне 8–13 Гц, если мы не говорим о локализации и функциональном значении, называют альфа-активностью. При этом альфа-ритм, связанный со зрительным вниманием и регистрирующийся в затылочных отделах над зрительной корой, десинхронизируется при открытии глаз и восприятии зрительной афферентации. Если в качестве фона или baseline используется состояние с открытыми глазами с фиксацией внимания на точке или объекте, можно полагать, что альфа-ритм, связанный со зрительным вниманием, уже минимизировал свою активность. Далее, выполнение задачи, связанной с моторными функциями, вызовет снижение мощности или десинхронизацию преимущественно мю-ритма в центральных областях [Denis et al., 2017]. Поэтому, говоря о снижении мощности в центральных областях и в диапазоне 8–13 Гц при реализации моторных задач, мы имеем в виду снижение мощности мю-ритма, связанного с активацией ЗСМ. Однако, поскольку в данном исследовании проводится анализ изменения мощности в различных областях коры, а не только в моторных зонах, на графиках и в описании проводимого анализа диапазон 8–13 Гц и его поддиапазоны обозначаются более общим названием альфа-активность, или альфа-диапазон.
Статистический анализ осуществлялся с использованием дисперсионного анализа ANOVA для повторных измерений и факторного ANOVA, для определения попарных отличий использовали post-hoc анализ Бонферони.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Анализ всех изменений мощности ритмов ЭЭГ проводился между относительными величинами (мощность в выбранном диапазоне при реализации задачи, деленная на мощность в фоне – baseline). При этом на графиках относительные значения мощности фона равны единице. Также, когда будет идти речь о различных диапазонах частот ЭЭГ, диапазон от 8 до 13 Гц будет обозначаться как альфа, при этом стоит иметь в виду, что ритм ЭЭГ в данном диапазоне частот в центральных отведениях функционально является мю-ритмом, связанным с активацией ЗСМ.
Первым шагом в исследовании изменений мощности ЭЭГ ритмов при реализации задач, активирующих ЗСМ, был анализ трех частотных диапазонов (тета, альфа и бета) в центральных отведениях (С3, С4, Сz), поскольку в литературе упоминаются данные об изменениях не только альфа-диапазона [Bimbi et al., 2018]. Дисперсионный анализ, проведенный отдельно для каждой задачи с факторами “ритм” и “стимульный материал”, показал, что наибольшие различия по данным факторам наблюдались при реализации задачи “НАБЛЮДЕНИЕ” (р < 0.001) (см. рис. 2), в данной задаче снижалась мощность альфа- и бета-ритмов. Апостериорный тест Бонферрони показал, что по типу стимульного материала достоверны отличия между относительной мощностью альфа- и бета-ритмов в задаче “НАБЛЮДЕНИЕ” (р = 0.004 и р = 0.0003), альфа-активность в задаче “ПРЕДСТАВЛЕНИЕ” (р = 0.03) и тета-ритма в задаче “ВЫПОЛНЕНИЕ” (р < 0.0001).
Рис. 2.
Относительные изменения мощности тета-, альфа- и бета-ритмов в центральных отведениях при реализации трех задач (наблюдение, представление, выполнение) в двух группах испытуемых: при личной демонстрации (синие кружки) и при демонстрации с помощью видеоролика на экране монитора (красные квадратики). Значения в фоне равны единице. Вертикальные планки обозначают 95% доверительный интервал. * – достоверные отличия по указанному ритму между двумя группами испытуемых, post-hoc тест Бонферpони, р < 0.05.
Fig. 2. Relative changes in the power of theta, alpha, and beta rhythms in central regions during the implementation of three tasks (observation, imagination, and execution) in two groups of subjects: by a personal demonstration (blue circles) and using a video clip on the monitor screen (red squares). The baseline values are equal to one. Vertical bars denote 95% confidence interval. * – significant differences in the specified rhythm between the two groups of subjects, post-hoc Bonferroni test, р < 0.05.
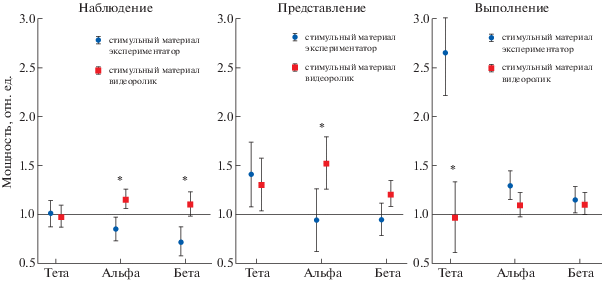
Стоит подробнее рассмотреть динамику альфа-ритма в центральных областях, поскольку активация ЗСМ ассоциируется с десинхронизацией мю-ритма, диапазон которого совпадает с альфа-ритмом, а пространственная локализация находится в области отведений С3, С4, Сz. В данном случае правомерно говорить о десинхронизации мю-ритма, поскольку выбраны соответствующие отведения и диапазон. Видно, что при наблюдении и представлении происходит снижение мю-ритма и соответственно активация ЗСМ только у тех испытуемых, которым стимульный материал демонстрировал экспериментатор.
Дисперсионный анализ относительной мощности альфа-ритма с повторными измерениями (задачи “НАБЛЮДЕНИЕ”, “ПРЕДСТАВЛЕНИЕ” И “ВЫПОЛНЕНИЕ”) и фактором “стимульный материал” показал достоверное влияние каждого фактора по отдельности и их взаимодействия (табл. 1).
Таблица 1.
Показатели дисперсионного анализа с повторными измерениями (наблюдение, представление, выполнение) относительных мощностей альфа-ритма в центральных областях в двух группах с различной демонстрацией стимульного материала Table 1. Indicators of ANOVA with repeated measurements (observation, imagination, execution) of relative alpha-rhythm power in the Central regions in two groups with different stimuli demonstration
| Эффект | Анализ повторных измерений “наблюдение–представление–выполнение” и фактора “стимульный материал” | ||||
|---|---|---|---|---|---|
| Сумма квадратов | Число степеней свободы | Средний квадрат отклонения | F | p | |
| Взаимодействие | 637.47 | 1 | 637.47 | 552.43 | 0.00 |
| Стимульный материал | 6.54 | 1 | 6.54 | 5.66 | 0.02 |
| Ошибка | 191.55 | 166 | 1.15 | ||
| R1 | 4.91 | 2 | 2.45 | 3.62 | 0.02 |
| R1*стимульный материал | 12.63 | 2 | 6.31 | 9.33 | 0.00 |
| Ошибка | 224.78 | 332 | 0.67 | ||
Однако данные результаты не демонстрируют значительной десинхронизации мю-ритма во всех задачах хотя бы в одной экспериментальной парадигме, в связи с чем было принято решение рассмотреть отдельно два поддиапазона. По некоторым данным, верхний и нижний диапазоны альфа- или мю-ритма могут иметь различную функциональную значимость [Базанова, 2009], кроме того, недавние данные подтвердили корреляцию активности нейронов премоторной коры с верхним альфа-диапазоном [Bimbi et al., 2018], в связи с этим стандартный диапазон альфа-активности 8–13 Гц был поделен на два поддиапазона – альфа1 и альфа2 (см. раздел “Методика”).
При этом было обнаружено, что снижение мощности мю-ритма в центральных отведениях во всех трех задачах наблюдается только в частотном диапазоне 10.5–13 Гц (что соответствует диапазону альфа2) и только у испытуемых, которым стимульный материал демонстрировал непосредственно экспериментатор (рис. 3). Относительная мощность альфа2-ритма у них снизилась на 31% в задаче “наблюдение” и на 11% и 16% в задачах “представление” и “выполнение” соответственно. Дисперсионный анализ относительной мощности в альфа2-диапазоне с повторными измерениями (различные задачи) и фактором “стимульный материал” показал достоверное влияние каждого фактора по отдельности и их взаимодействия (р = 0.03). Апостериорный тест Бонферрони показал, что относительная мощность в альфа2-поддиапазоне попарно достоверно отличается в экспериментах с различной методикой демонстрации стимульного материала в задачах “НАБЛЮДЕНИЕ” (р = 0.01) и “ПРЕДСТАВЛЕНИЕ” (р = 0.007) (см. рис. 4). Поскольку по степени снижения мю-ритма можно оценить степень активации ЗСМ, можно утверждать, что ЗСМ включалась в работу только у той группы испытуемых, которым движение руки демонстрировали лично. Также можно заключить, что ритм, функционально связанный с активацией ЗСМ, лежит в верхнем альфа2-диапазоне.
Рис. 3.
Относительные изменения мощности альфа1 (a) и альфа2 (б) поддиапазонов в центральных отведениях при реализации трех задач – наблюдение, представление, выполнение – в двух группах испытуемых: при личной демонстрации (синие кружки) и при демонстрации с помощью видеоролика на экране монитора (красные квадратики). Значения в фоне равны единице. Вертикальные планки обозначают 95% доверительный интервал. * – достоверные отличия по указанному ритму между двумя группами испытуемых, post-hoc тест Бонферpони, р < 0.05.
Fig. 3. Relative changes in the alpha1 (a) and alpha2 (б) power band in Central regions during the implementation of three tasks – observation, imagination, and execution – in two groups of subjects: by a personal demonstration (blue circles) and using a video clip on the monitor screen (red squares). The baseline values are equal to one. Vertical bars denote 95% confidence interval. * – significant differences in the specified rhythm between the two groups of subjects, post-hoc Bonferroni test, р < 0.05.
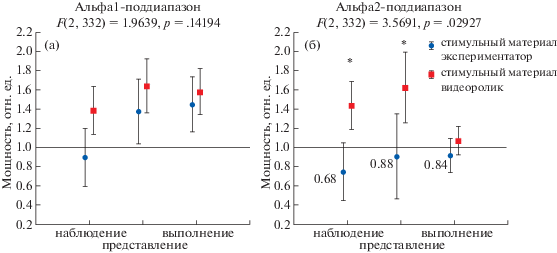
Рис. 4.
Относительные изменения мощности альфа2 поддиапазона в различных отведениях при реализации трех задач – наблюдение (а), представление (б), выполнение (в) – в двух группах испытуемых: при личной демонстрации (синие кружки) и при демонстрации с помощью видеоролика на экране монитора (красные квадратики). Значения в фоне равны единице. Вертикальные планки обозначают 95% доверительный интервал. O – средние значения отн. мощности в O1 и O2 отведениях, P – средние значения отн. мощности в Р3, Р4 и Рz отведениях, C – средние значения отн. мощности в С3, С4 и Сz отведениях, F – средние значения отн. мощности в F3, F4, F7, F8 и Fz отведениях, T – средние значения отн. мощности в Т3, Т4, Т5 и Т6 отведениях.
Fig. 4. Relative changes in the alpha2 power band in five different regions during the implementation of three tasks – observation (a), imagination (б), and execution (в) – in two groups of subjects: by a personal demonstration (blue circles) and using a video clip on the monitor screen (red squares). The baseline values are equal to one. Vertical bars denote 95% confidence interval. O – average values of the Ref. power in O1 and O2 electrodes, P – average values of the Ref. power in P3, P4 and PZ electrodes, C – average values of the Ref. capacities in C3, C4 and CZ electrodes, F – average values of the Ref. power in F3, F4, F7, F8 and Fz electrodes, T – average values of the Ref. capacities in T3, T4, T5 and T6 leads.
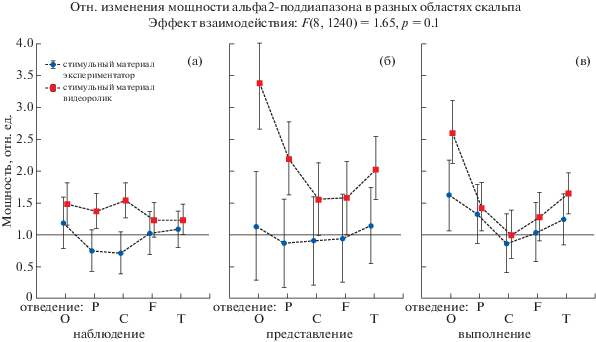
Чтобы выяснить, не связано ли снижение мощности альфа-диапазона при реализации задач с восприятием зрительной информации или повышением концентрации внимания, мы сравнили десинхронизацию мощности альфа2-диапазона в различных областях коры, в том числе в зрительной (затылочные отведения).
На рис. 4 видно, что у испытуемых, для которых демонстрация движения проводилась с помощью видеоролика, не было значимого снижения мощности в альфа2-диапазоне ни в одной задаче (по сравнению с фоновым значением, равным единице).
Если рассмотреть динамику у испытуемых, которым сжимание кисти показывали лично, видно, что в затылочных областях, связанных со зрительным вниманием, снижения мощности не происходило. В задаче “НАБЛЮДЕНИЕ” десинхронизация происходила в теменных и центральных областях, которые соответствуют сенсомоторной и моторной коре, т.е. областях, где была обнаружена зеркальная система мозга. В задаче “ПРЕДСТАВЛЕНИЕ” наблюдается большой внутригрупповой разброс значений, вообще говоря, задача “представить движение” является достаточно сложной для большинства людей. В задаче “ВЫПОЛНЕНИЕ” небольшая десинхронизация происходит в моторных областях коры, что вполне ожидаемо. Таким образом, снижение мощности мю-ритма происходит только в областях, связанных с ЗСМ.
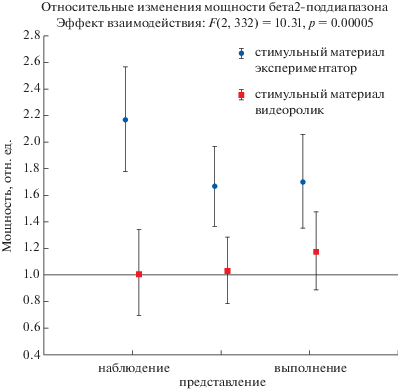
Также можно упомянуть динамику верхнего диапазона бета-ритма в разных группах испытуемых (рис. 5). Мощность бета2-диапазона в центральных областях повышалась только у испытуемых, которым сжимание кисти демонстрировали лично, что можно трактовать как повышение активации в моторной коре. Дисперсионный анализ с повторными измерениями показал достоверное влияние фактора “стимульный материал”, post-hoc тест Бонферрони выявил достоверные попарные отличия (р < 0.01) в каждой задаче между двумя группами испытуемых.
Рис. 5.
Относительные изменения мощности бета2-ритма в центральных отведениях при реализации трех задач – наблюдение, представление, выполнение – в двух группах испытуемых: при личной демонстрации (синие кружки) и при демонстрации с помощью видеоролика на экране монитора (красные квадратики). Значения в фоне равны единице. Вертикальные планки обозначают 95% доверительный интервал. Отличия достоверны между двумя группами испытуемых по каждому заданию, post-hoc тест Бонферpони, р < 0.05.
Fig. 5. Relative changes in the beta2 power in central regions during the implementation of three tasks – observation, imagination, and execution – in two groups of subjects: by a personal demonstration (blue circles) and using a video clip on the monitor screen (red squares). The baseline values are equal to one. Vertical bars denote 95% confidence interval. Differences are significant between the two groups of subjects for each task, post-hoc test Bonferroni, р < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В первую очередь стоит сказать, что авторы работы понимают, что данное исследование не является доказательством того, что зеркальная система мозга по-разному работает при взаимодействии вживую и в режиме с демонстрацией видеоролика. Данная работа послужила лишь поводом выдвинуть эту гипотезу и готовить проведение дальнейших исследований с максимально идентичными условиями демонстрации стимулов вживую и на экране монитора. Однако впервые был продемонстрирован сравнительный анализ двух методик предъявления стимульного материала в исследовании ЗСМ, и результаты говорят о том, что снижение мю-ритма и соответственно активация ЗСМ были значительно выше при личной демонстрации движения кисти.
Во-первых, хотелось бы обратить внимание на то, что достоверное снижение мю-ритма в центральных отведениях наблюдалось только в верхнем диапазоне частот (10.5–13 Гц). Эти результаты хорошо согласуются с недавней работой, в которой параллельно регистрировали активность нейронов премоторной коры MUA, LFP и ЭЭГ у обезьян при наблюдении и выполнении хватательного движения, причем демонстрацию производил непосредственно экспериментатор [Bimbi et al., 2018]. Bimbi и соавт. обнаружили, что активность нейронов премоторной коры достоверно коррелировала с повышением гамма-ритма LFP и со снижением мощности ЭЭГ в диапазоне 10–20 Гц, т.е. верхнем альфа- и нижнем бета- ритмах.
Интересно, что демонстрация сжимания кисти вживую влияла также на десинхронизацию мю-ритма и во время представления и выполнения движения. В эксперименте, когда добровольцам показывали движения на экране монитора и перед ними не было живого оппонента, это повлияло и на результаты в других двух задачах – представления и выполнения. В работе Zhu и Sun применяли интересную методику демонстрации стимульного материала – сначала испытуемым показывали только тень от движущейся руки, при этом не происходило активации ЗСМ. Затем, когда испытуемым показали, что это тень от руки, при повторной демонстрации движения тени активация ЗСМ повышалась [Zhu, Sun, 2016]. По-видимому, присутствие оппонента или наличие социального контекста оказывает пролонгированный эффект на ЗСМ, возможно, снижается порог активации зеркальных нейронов, или модуляция мю-ритма происходит в большем объеме, но эффект личного присутствия оппонента перед испытуемыми сказывается не только на задаче наблюдения, но и на последующих задачах, в которых он не проявляет активных действий.
Также стоит обратить внимание, что анализ снижения активности в верхнем альфа-диапазоне проводился не только в центральных отведениях, но и во всех основных областях коры. При этом ни в одной задаче не была выявлена десинхронизация в затылочных областях, связанных непосредственно со зрительным вниманием. При демонстрации сжимания кисти вживую наблюдалось достоверное снижение мощности альфа2-диапазона в центральных и теменных областях, что соответствует моторным и сенсомоторным областям коры, что функционально соответствует восприятию и проецированию движения. При выполнении движения наблюдается снижение мощности альфа2-диапазона только в центральных областях, т.е. в моторной коре. При этом некоторые исследователи отмечают, что в задачах “наблюдение” (демонстрация происходила с помощью экрана монитора) снижалась мощность не только мю-ритма в центральных областях, но и альфа-ритм в затылочных отведениях [Ensenberg et al., 2017; Hobson, Bishop, 2016; Karakale et al., 2019].
Хотелось бы также отметить, что в задаче представления наблюдается наибольший внутригрупповой разброс значений. Субъективно некоторые испытуемые после эксперимента отмечали, что им сложно было представить именно ощущение сжимание кисти, у некоторых при этом всплывал визуальный образ демонстрации движения, некоторым сложно было сосредоточиться на собственных ощущениях. Задача представления моторного действия без предварительной тренировки достаточно трудно реализуема и ее выполнение сложно контролировать [Мокиенко et al., 2013; Фролов et al., 2013], поэтому зачастую в исследованиях ЗСМ ее опускают [Cooper et al., 2012; Sestito et al., 2018; Varnum et al., 2016; Wehbe et al., 2013].
При анализе других частотных диапазонов в центральных отведениях мы отметили также значительное повышение мощности верхнего бета-ритма (25–35 Гц) во всех трех задачах, но в большей степени при наблюдении движений руки и только в группе добровольцев, которым демонстрировали движения лично. Это говорит о повышении активности области, ассоциированной с зеркальной системой мозга, в пробах с реализацией моторных задач. Интересно, что во второй группе испытуемых подобной активации совершенно не выявлено.
Связан ли обсуждаемый результат обнаружения десинхронизации мю-ритма только при личной демонстрации с эффектом присутствия экспериментатора и ощущением контроля? В экспериментах с обеими группами присутствовал и производил подготовку и предварительный инструктаж один и тот же экспериментатор. Во время демонстрации стимульного материала с помощью монитора экспериментатор также присутствовал в этот момент в помещении, однако не находился в поле зрения испытуемого, а следил за ходом эксперимента позади него. Испытуемые в этот момент ощущали его присутствие и понимали, что экспериментатор продолжает свою работу в непосредственной близости от них. Однако в этом случае исключался именно момент личного взаимодействия непосредственно во время записи ЭЭГ. Мы полагаем, что именно отсутствие социального контакта при восприятии движения (в первую очередь в задаче “наблюдение”) стало причиной возникновения различий в десинхронизации мю-ритма. Возможно, для испытуемых, перед которыми был монитор, а не сам экспериментатор, ощущение контроля за выполнением движений могло быть меньше, чем во второй группе. Это может объяснять тот факт, что в задаче “выполнение” в этой группе отсутствовала достоверная десинхронизация мю-ритма, однако с уверенностью это сложно утверждать. Результаты данной работы служат для нас предпосылкой для новых исследований, целью которых будет выявление эффекта “живого” социального взаимодействия по сравнению с онлайн-форматом при работе зеркальной системы мозга.
В заключение хотелось бы подчеркнуть, что в работе были получены различия в активации зеркальной системы мозга при использовании двух различных методик демонстрации стимульного материала – лично экспериментатором и с помощью видеоролика. Снижение мощности мю-ритма наблюдалось во всех трех задачах только в верхнем диапазоне частот (10.5–13 Гц), только в центральных областях и только в группе, которой демонстрация осуществлялась вживую. Причем наличие оппонента сказывалось на результатах не только в задаче наблюдения, но и в других двух задачах. Результаты данного сравнительного анализа позволяют выдвинуть гипотезу о том, что зеркальная система мозга в большей степени активируется при “живом” социальном контакте. Для проверки данной гипотезы планируются дополнительные исследования с максимально идентичными условиями демонстрации стимулов вживую и на экране монитора.
Список литературы
Базанова О.М. Современная интерпетация альфа – активности электроэнцефалограммы. Успехи физиологических наук. 2009. 40 (3): 32–53.
Лебедева Н.Н., Каримова Е.Д., Карпычев В.В., Мальцев В.Ю. Зеркальная система мозга при наблюдении, выполнении и представлении моторных задач – нейрофизиологическое отражение восприятия чужого сознания. Журнал высшей нервной деятельности им И.П. Павлова. 2018. (2): 204–215. https://doi.org/10.7868/S0044467718020065
Мокиенко О.А., Черникова Л.А., Фролов А.А., Бобров П.Д. Воображение движения и его практическое применение. Журнал высшей нервной деятельности им. И.П. Павлова. 2013. 63 (2): 195–204. https://doi.org/10.7868/s0044467713020056
Фролов А.А., Бирюкова Е.В., Бобров П.Д., Мокиенко О.А., Платонов А.К., Пряничников В.Е., Черникова Л.А. Принципы нейрореабилитации, основанные на использовании интерфейса “мозг–компьютер” и биологически адекватного управления экзоскелетоном. Физиология человека. 2013. 39 (2): 99–113. https://doi.org/10.7868/s0131164613020033
Andrews S.C., Enticott P.G., Hoy K.E., Thomson R.H., Fitzgerald P.B. Reduced mu suppression and altered motor resonance in euthymic bipolar disorder: Evidence for a dysfunctional mirror system? Social Neuroscience. 2016. 11 (1): 60–71. https://doi.org/10.1080/17470919.2015.1029140
Berntson G.G. Social Neuroscience. Psychology Press. Social Neuroscience. 2013. 53–62. https://doi.org/10.4324/9780203496190
Bimbi M., Festante F., Coudé G., Vanderwert R.E., Fox N.A., Ferrari P.F. Simultaneous scalp recorded EEG and local field potentials from monkey ventral premotor cortex during action observation and execution reveals the contribution of mirror and motor neurons to the mu-rhythm. NeuroImage. 2018. 175: 22–31. https://doi.org/10.1016/j.neuroimage.2018.03.037
Buccino G., Binkofski F., Riggio L. The mirror neuron system and action recognition. Brain and Language. 2004. 89 (2): 370–376. https://doi.org/10.1016/S0093-934X(03)00356-0
Calvo-Merino B., Glaser D.E., Grèzes J., Passingham R.E., Haggard P. Action Observation and Acquired Motor Skills: An fMRI Study with Expert Dancers. Cerebral Cortex. 2005b. 15 (8): 1243–1249. https://doi.org/10.1093/cercor/bhi007
Campbell M.E.J., Mehrkanoon S., Cunnington R. Intentionally not imitating: Insula cortex engaged for top-down control of action mirroring. Neuropsychologia. 2018. 111: 241–251. https://doi.org/10.1016/j.neuropsychologia.2018.01.037
Cooper N.R., Puzzo I., Pawley A.D., Bowes-Mulligan R.A., Kirkpatrick E.V., Antoniou P.A., Kennett S. Bridging a yawning chasm: EEG investigations into the debate concerning the role of the human mirror neuron system in contagious yawning. Cognitive, Affective, & Behavioral Neuroscience. 2012. 12 (2): 393–405. https://doi.org/10.3758/s13415-011-0081-7
Denis D., Rowe R., Williams A.M., Milne E. The role of cortical sensorimotor oscillations in action anticipation. NeuroImage. 2017. 146: 1102–1114. https://doi.org/10.1016/j.neuroimage.2016.10.022
Ensenberg N.S., Perry A., Aviezer H. Are you looking at me? Mu suppression modulation by facial expression direction. Cognitive, Affective, & Behavioral Neuroscience. 2017. 17 (1): 174–184. https://doi.org/10.3758/s13415-016-0470-z
Fitzgibbon B.M., Kirkovski M., Fornito A., Paton B., Fitzgerald P.B., Enticott P.G. Emotion processing fails to modulate putative mirror neuron response to trained visuomotor associations. Neuropsychologia. 2016. 84: 7–13. https://doi.org/10.1016/j.neuropsychologia.2016.01.033
Fox N.A., Bakermans-Kranenburg M.J., Yoo K.H., Bowman L.C., Cannon E.N., Vanderwert R.E., Ferrari P.F., van IJzendoorn M.H. Assessing human mirror activity with EEG mu rhythm: A meta-analysis. Psychological Bulletin. 2016. 142 (3): 291–313. https://doi.org/10.1037/bul0000031
Gallese V., Fadiga L., Fogassi L., Rizzolatti G. Action recognition in the premotor cortex. Brain. 1996. 119 (2): 593–609. https://doi.org/10.1093/brain/119.2.593
Grafton S., Arbib M., Fadiga L., Rizzolatti G. Localization of grasp representations in humans by positron emission tomography. Experimental Brain Research. 1996. 112 (1). https://doi.org/10.1007/BF00227183
Grèzes J. Functional anatomy of execution, mental simulation, observation, and verb generation of actions: a meta-analysis. Human Brain Mapping. 2001. 12:1. https://doi.org/10.1002/1097-0193(200101)12:1
Hobson H.M., Bishop D.V.M. Mu suppression – A good measure of the human mirror neuron system? Cortex. 2016. 82: 290–310. https://doi.org/10.1016/j.cortex.2016.03.019
Hobson H.M., Bishop D.V.M. The interpretation of mu suppression as an index of mirror neuron activity: past, present and future. Royal Society Open Science. 2017. 4 (3): 160662. https://doi.org/10.1098/rsos.160662
Hogeveen J., Chartrand T.L., Obhi S.S. Social Mimicry Enhances Mu-Suppression During Action Observation. Cerebral Cortex. 2015. 25 (8): 2076–2082. https://doi.org/10.1093/cercor/bhu016
Iacoboni M. Understanding others: imitation, language, empathy. Perspectives on Imitation: From Cognitive Neuroscience to Social Science. 2005.
Kaida A.I., Makhin S.A., Eismont E.V., Pavlenko V.B. Age dynamics and topography of an individual EEG mu rhythm reactivity in children aged 4–14 years. Vestnik Tomskogo gosudarstvennogo universiteta. Biologiya. 2019. (45): 106–127. https://doi.org/10.17223/19988591/45/6
Karakale O., Moore M.R., Kirk I.J. Mental Simulation of Facial Expressions: Mu Suppression to the Viewing of Dynamic Neutral Face Videos. Frontiers in Human Neuroscience. 2019. 13. https://doi.org/10.3389/fnhum.2019.00034
Lübke K.T., Sachse C., Hoenen M., Pause B.M. Mu-Suppression as an Indicator of Empathic Processes in Lesbian, Gay, and Heterosexual Adults. Archives of Sexual Behavior. 2019. https://doi.org/10.1007/s10508-019-01491-2
Nishimura Y., Ikeda Y., Suematsu A., Higuchi S. Effect of visual orientation on mu suppression in children: a comparative EEG study with adults. Journal of Physiological Anthropology. 2018. 37 (1): 16. https://doi.org/10.1186/s40101-018-0175-9
Nyström P. The infant mirror neuron system studied with high density EEG. Social Neuroscience. 2008. 3 (3–4): 334–347. https://doi.org/10.1080/17470910701563665
Sestito M., Harel A., Nador J., Flach J. Investigating Neural Sensorimotor Mechanisms Underlying Flight Expertise in Pilots: Preliminary Data From an EEG Study. Frontiers in Human Neuroscience. 2018. 12. https://doi.org/10.3389/fnhum.2018.00489
Varnum M.E.W., Blais C., Brewer G.A. Social class affects Mu-suppression during action observation. Social Neuroscience. 2016. 11 (4): 449–454. https://doi.org/10.1080/17470919.2015.1105865
Wehbe R.R., Kappen D.L., Rojas D., Klauser M., Kapralos B., Nacke L.E. EEG-based assessment of video and in-game learning. New York, New York, USA: ACM Press. In CHI ’13 Extended Abstracts on Human Factors in Computing Systems on – CHI EA ’13. p. 667. 2013. https://doi.org/10.1145/2468356.2468474.
Yin S., Liu Y., Ding M. Amplitude of sensorimotor mu rhythm is correlated with BOLD from multiple brain regions: A simultaneous EEG-fMRI study. Frontiers in Human Neuroscience. 2016. 10 (364). https://doi.org/10.3389/fncel.2016.00364
Zhu H., Sun Y. EEG evidence for human mirror activity during observation of ambiguous shadow actions: Toward an analysis of humanoid robotic system. IEEE. In 2016 2nd IEEE International Conference on Computer and Communications (ICCC). pp. 708–712. October 2016. https://doi.org/10.1109/CompComm.2016.7924794.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


