Журнал высшей нервной деятельности им. И.П. Павлова, 2020, T. 70, № 4, стр. 500-514
ОТДАЛЕННЫЕ ПОСЛЕДСТВИЯ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ У КРЫС: МОРФОЛОГИЧЕСКОЕ, ПОВЕДЕНЧЕСКОЕ И ЭЛЕКТРОФИЗИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
И. Г. Комольцев 1, 2, *, А. А. Волкова 1, 3, И. П. Левшина 1, М. Р. Новикова 1, Н. В. Гуляева 1, 2
1 Лаборатория функциональной биохимии нервной системы,
Институт высшей нервной деятельности и нейрофизиологии РАН
г. Москва, Россия
2 ГБУЗ Научно-практический психоневрологический центр им. З.П. Соловьева ДЗМ
г. Москва, Россия
3 ФГАОУ ВО Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Минздрава России
г. Москва, Россия
* E-mail: komoltsev.ilia@gmail.com
Поступила в редакцию 06.09.2019
После доработки 02.12.2019
Принята к публикации 16.12.2019
Аннотация
Отдаленные последствия черепно-мозговой травмы (ЧМТ) у человека ассоциированы с развитием судорог, когнитивных и эмоциональных нарушений, а также связаны с ускоренными процессами старения мозга и формированием склероза гиппокампа (СГ). Механизмы этих осложнений остаются до конца не выясненными, а лечение крайне затруднено. Имеющиеся на настоящий момент данные, полученные с использованием экспериментальных моделей на животных, не позволяют однозначно судить об этих механизмах. В представленной работе уточняли отдаленные гистологические, поведенческие и электрофизиологические последствия ЧМТ у крыс. Через 6 мес после латерального гидродинамического удара у животных выявили наличие выраженного асимметричного глиоза в поле СА3 и зубчатой извилине гиппокампа в виде фибриллярного астроглиоза, увеличение числа клеток глии и истончение пирамидного слоя СА3 ипсилатерального полушария (что соответствует СГ 3-го типа у человека); у ложнооперированных животных наблюдали только симметричный глиоз (изолированный глиоз по классификации СГ у человека). Поведение крыс через полгода после ЧМТ и ложной операции характеризовалось уменьшением двигательной активности, на фоне которого выявляли некоторые признаки повышения тревожности. Поведенческие нарушения усугублялись у крыс после перенесенной ЧМТ – в основном, за счет снижения исследовательской активности. Отдаленный период ЧМТ на ЭКоГ характеризовался появлением длительных спайк-волновых разрядов в коре и асимметрией эпилептиформных спайков в гиппокампе. У двух крыс в позднем периоде обнаружены эпилептические приступы. Интенсивное течение процессов старения мозга у крыс с перенесенной ЧМТ и развитие нейродегенеративных изменений в гиппокампе могут быть связаны с хроническим дистантным нейровоспалением, играющим важную роль в развитии посттравматической эпилепсии и деменции.
ВВЕДЕНИЕ
Черепно-мозговая травма является серьезным фактором риска неврологических и психиатрических нарушений в отдаленном периоде травмы: более чем у половины пациентов развиваются эмоциональные, когнитивные нарушения и нарушения сна, у 10–20% – посттравматическая эпилепсия (ПТЭ) [Jorge, David, 2012; Christensen, 2015]. Наличие ЧМТ в анамнезе является важным фактором риска развития деменции у пожилых людей [Wood, 2017; Fann et al., 2018]. Дегенеративные изменения на МРТ у пациентов с ЧМТ выявляют в более раннем возрасте, чем у контрольных испытуемых без ЧМТ [Cole et al., 2015]. Это говорит о более быстром “старении мозга” (атрофии различных отделов) у пациентов с перенесенной травмой, выраженность которого коррелирует с когнитивными нарушениями. Механизмы этих изменений остаются до конца не изученными. Процессы острого повреждения в результате ЧМТ характеризуются нарушением ГЭБ, привлечением иммунных клеток, активацией резидентной микроглии, реактивным астроглиозом, продукцией про- и противовоспалительных цитокинов в ответ на появление молекулярных фрагментов, ассоциированных с повреждением, которые запускают процессы воспаления [Thompson et al., 2005; Simon et al., 2017]. В отдаленном периоде ЧМТ (более 1 нед после травмы) острое нейровоспаление переходит в хроническую фазу. Активация микроглии и продукция провоспалительных медиаторов сопровождаются дальнейшей гибелью нейронов и прогрессирующей атрофией [Puntambekar et al., 2018]. Развитие процессов дистантного хронического нейровоспаления в гиппокампе может приводить к формированию когнитивного дефицита и эмоциональных нарушений в отдаленном периоде ЧМТ [Vezzani et al., 2012]. Параллельно с хроническим нейровоспалением протекают процессы нейрогенеза и нейропластичности, которые призваны восстанавливать утраченные в результате гибели нейронов функции мозга, но, в отдельных случаях, способствуют развитию аберрантных нейронных сетей, обусловливающих поздние эпилептические приступы [Gulyaeva, 2010]. Несмотря на активные исследования, механизмы и ранние предикторы развития ПТЭ до сих пор не обнаружены. В предыдущей работе нами было показано как наличие эпилептиформной активности в коре и гиппокампе, так и дистантное повреждение гиппокампа (возникающее на удалении от очага в коре) при отсутствии эпилептических приступов в остром периоде ЧМТ у крыс [Комольцев и соавт., 2018]. Кроме того, в остром периоде ЧМТ нами были выявлены элементы тревожного поведения, ассоциированные с уменьшением доли REM-сна [Комольцев и соавт., 2017]. Целью данной работы являлась комплексная характеристика изменений в позднем периоде ЧМТ у крыс в сопоставлении с результатами предыдущих исследований. Задачами исследования были: оценка морфологических изменений в гиппокампе и соотнесение гистологической картины с действующей классификацией склероза гиппокампа у человека; характеристика поведенческих изменений в отдаленном периоде ЧМТ; выявление эпилептических приступов и эпилептиформной активности у животных через 6 мес после травмы.
МЕТОДИКА
Эксперименты с животными выполнены в соответствии с требованиями Директивы 2010/63/EU Европейского Парламента и Совета от 22 сентября 2010 г. и Приказа № 267 МЗ РФ от 19 июня 2003 г. в области защиты и использования животных в экспериментальных исследованиях. Протокол эксперимента утвержден Этической комиссией ИВНД и НФ РАН (протокол № 10 от 10.12.2012 г). Были предприняты все меры для уменьшения числа используемых животных и минимизации их страданий. Работа выполнена на 20 крысах-самцах линии Wistar из питомника лабораторных животных “Пущино” в возрасте около 6 мес (масса 400–500 г) на момент начала эксперимента, разделенных на две группы – крысы с ЧМТ (n = 13, исключены: 3) и ложнооперированные животные (ЛО, n = 7, исключены: 1). Из эксперимента исключены животные с повреждением целостности твердой мозговой оболочки (1 ЧМТ, 1 ЛО). Летальность за 6 мес составила 16% (2 крысы группы ЧМТ). Все дальнейшие расчеты проведены на 10 крысах группы ЧМТ и 6 крысах группы ЛО. За время эксперимента крысы потеряли не более 10% массы.
Хирургическая подготовка, моделирование ЧМТ. Для нанесения ЧМТ использовали модель латерального гидродинамического удара [McIntosh et al., 1989; Kabadi et al., 2010]. Операции проводили под 1–3% изофлурановым наркозом. После скальпирования всем животным проводили трепанацию черепа (AP = 3; L = 3, проекция правой сенсомоторной коры, диаметр отверстия 3 мм). Непосредственно область повреждения при таком протоколе нанесения ЧМТ описана нами ранее [Комольцев и соавт., 2019] и включает сенсорные (представительство туловища и вибрисс), теменные, слуховые и зрительные отделы нео-кортекса. По краю трепанационного отверстия приклеивали головку инъекционной иглы типа Люэр. После полного выхода крыс из наркоза головку иглы посредством жесткой пластиковой трубки соединяли с прибором Fluid Percussion Device with the PC-Based Pressure Measurement Unit, Model FP302, США. Крысам группы ЧМТ в свободном поведении наносили удар силой 2.4–3.6 атм. Всем животным удаляли с черепа головку иглы, отверстие укрывали костным лоскутом, скрепляли края раны.
Тестирование поведения. Тестирование исходной поведенческой активности проводили за 1 мес до краниотомии (в возрасте 5 мес). Двигательную, исследовательскую активность и элементы тревожного поведения оценивали в тесте “Открытое поле” (ОП), приподнятом крестообразном лабиринте (ПКЛ) и в тесте Порсолта в три последовательных дня в соответствующем порядке. Повторное тестирование в ОП и ПКЛ осуществляли за 3 и 2 дня до вживления электродов соответственно, в возрасте 12 мес (через 6 мес после ЧМТ). Повторный тест Порсолта проводили после 7-дневной регистрации ЭЭГ перед выводом животных из эксперимента.
ПКЛ позволяет оценить уровень тревожности животных [Bailey, Crawley, 2009]. Длина рукавов лабиринта составляла 50 см, пол поделен на отрезки по 10 см для оценки пройденного пути. Ширина рукавов составляла 10 см, центральная площадка 10 × 10 см, высота стенок закрытых рукавов – 10 см. Освещенность составляла 6–8 лк в закрытых рукавах и 12–15 лк в открытых рукавах. Крысу помещали на центральную площадку ПКЛ в направлении открытого рукава. Определяли длительность первого пребывания крысы на центральной площадке (латентный период, ЛП), время выбора рукава при пересечении центральной площадки (т.е. суммарное время, проведенное на центральной площадке, без учета ЛП) и число таких пересечений. Оценивали число пересеченных квадратов, исходя из которого высчитывали пройденный путь в рукавах лабиринта. Исследовательскую активность крыс оценивали по сумме числа стоек и свешиваний, также определяли число выглядываний/заглядываний в рукава. Рукав или площадку считали покинутыми, когда все четыре лапы находились вне соответствующего квадрата. Определяли время, проведенное в открытых и закрытых рукавах лабиринта, а также число вхождений в открытые и закрытые рукава. Общее время нахождения в лабиринте – 300 с. Тест ОП позволяет оценить активность и тревожность животных. В эксперименте использовали круглое открытое поле, диаметр площадки составляет 100 см, пол поделен на квадраты 10 × 10 см для оценки пройденного пути. Высота стенок 30 см. Определяли время, проведенное в центральной части ОП и на периферии, а также число пересечений центра ОП. Оценивали горизонтальную активность (пройденный путь), вертикальную активность (стойки), вегетативную реакцию (дефекации и уринации). Общее время теста – 300 с. Анализ экспериментов проводили по видеозаписи в программе автоматической обработки Noldus. Тест вынужденного плавания (тест Порсолта) проводили в высоком прозрачном цилиндрическом стакане (высотой 65 см, диаметром 30 см), заполненном на 55 см водой (температура около 23–24°С). Крыс помещали в стакан, поведение регистрировали на видеокамеру. Общее время теста – 300 с. По видеозаписи определяли суммарное время активного и пассивного плавания (иммобилизации), число замираний, число нырков, а также их продолжительность.
Регистрация и обработка ЭЭГ. Через 6 мес после первой операции и через день после окончания повторных поведенческих тестов крыс скальпировали и пяти животным (ЧМТ n = 3; ЛО n = 2) имплантировали электроды (под 1–3% изофлурановым наркозом) в область фронтальной и затылочной коры, зубчатой извилины дорсального и вентрального гиппокампа по схеме (координаты даны в мм: по рострокаудальной оси от брегмы, латерально от срединной линии, глубина от поверхности кости): левый ростральный (ЛР 1, -3); правый ростральный (ПР 1, 3); левый каудальный (ЛК -7, -3); правый каудальный (ПК -7, 3); левый вентральный гиппокамп (ЛВГп -6, -4, 4.3); левый дорсальный гиппокамп (ЛДГп 0, -2, 5.3); правый вентральный гиппокамп (ПВГп -6, 4, 4.3); правый дорсальный гиппокамп (ПДГп 0, 2, 5.3). Референтный электрод вживляли над мозжечком по срединной линии, электрод заземления – ростральнее обонятельных луковиц слева от срединной линии. Запись ЭЭГ и регистрацию видео проводили в отдельных камерах со свободным доступом к воде и пище при естественном освещении в течение 7 сут эксперимента после проведения поведенческих тестов. Использовали беспроводные 8-канальные усилители биопотенциалов “BR8V1” (BioRecorder), разрешение АЦП 24 бита, входной диапазон до 1200 мВ, частота оцифровки до 1 кГц, используемая частота дискретизации 250 Гц. При просмотре записи в программе EDF browser 1.57 обрабатывали фильтром Баттерворта с нижней границей 1 Гц и с верхней границей 30 Гц и разбивали на 20-секундные эпохи. Для анализа структуры сна оценивали по 15 циклов сон-бодрствование для каждой крысы: каждой эпохе присваивали фазы цикла сон-бодрствование: NREM-сон (фаза медленного сна), REM-сон (фаза быстрого сна) или фаза бодрствования. Сравнение амплитуды эпилептиформной активности в гиппокампе проводили путем вычисления отношения амплитуды спайков в левом и правом гиппокампе и сравнения полученного отношения для каждого спайка со средним отношением, полученным для всех спайков. Такой подход позволяет уменьшить вариабельность амплитуды активности, связанной с конкретным животным, сравнивая соотношение амплитуд. Для дорсального гиппокампа отношение составило 1.5, для вентрального – 1.1. Также измеряли длительность разрядов спайк-медленная волна в коре.
Морфологический анализ. Через 6 мес после ЧМТ и после 1 нед регистрации ЭЭГ всех крыс наркотизировали хлоралгидратом (450 мг/кг) и выводили из эксперимента интракардиальной перфузией 4% раствора параформальдегида в 0.1 М фосфатном буфере (pH 7.4) с помощью насоса Heidolph Pumpdrive 5001. Вибротомные фронтальные срезы толщиной 50 мкм готовили на микротоме Campden Instruments MA752 Vibroslice. Для анализа выбирали срезы из области от 2.8 мм до 5.6 мм каудальнее брегмы (расстояние между срезами не менее 600 мкм) и окрашивали крезилвиолетом по методу Ниссля. Иммуногистохимическим методом окрашивали на маркер микроглии GFAP (разведение 1:500, DAKO, Дания). Для морфометрии с помощью программы ImageJ использовали снимки на увеличении 20 × (микроскоп Keyence Fluorescence Microscope BZ-X700). Для количественного анализа использовали по 4 среза, окрашенных на GFAP, и по 4 среза, окрашенных по методу Ниссля, с каждого животного. Все подсчеты проводились как в ипсилатеральном, так и в контралатеральном полушариях. На срезах, окрашенных по методу Ниссля, измеряли толщину гранулярного слоя зубчатой извилины (DG) и пирамидного слоя полей СА1 и СА3 обоих полушарий. Для каждого поля на каждом срезе проводили 3 измерения, показатели усредняли. На этих же срезах число глиальных клеток подсчитывали во всем полиморфном слое зубчатой извилины, лучистом слое (слое радиальных дендритов) поля СА1 и поля СА3. Нервные клетки на срезе определяли по наличию окрашенных тел нейронов и наличию в цитоплазме субстанции Ниссля, глиальные клетки при этом отличали по интенсивно окрашенным ядрам и отсутствию окрашенной цитоплазмы. На срезах, окрашенных на GFAP (специфичный маркер астроцитов), в трех полях зрения 150 × 150 мкм в каждой области (DG, СА1 и СА3) на каждом срезе определяли число астроцитов. Усредняли показатели, полученные с трех измерений в одной области. Степень глиоза гиппокампа определяли по балльной системе (от 0 до 3 баллов) на срезах, окрашенных на GFAP.
Статистические методы. Расчеты проводили в программе Statistica 12 (StatSoft, Inc.) Сравнение между группами ЧМТ и ЛО проводили по критерию Манна–Уитни, между временными точками внутри группы – по критерию Вилкоксона. Соотношения длительности разрядов и асимметрии спайков в электрофизиологической части работы считали при помощи двунаправленного точного теста Фишера. Результаты представлены в виде: среднее ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Морфологические изменения в гиппокампе у крыс через 6 мес после ЧМТ. У крыс в отдаленном периоде ЧМТ и у ложнооперированных животных морфологические изменения были сопоставлены с классификацией склероза гиппокампа (СГ) человека. СГ при гистологическом исследовании у человека и в экспериментальных работах подтверждается (1) наличием астроцитарного глиоза и (2) истончением клеточных слоев в гиппокампе (за счет гибели нейронов).
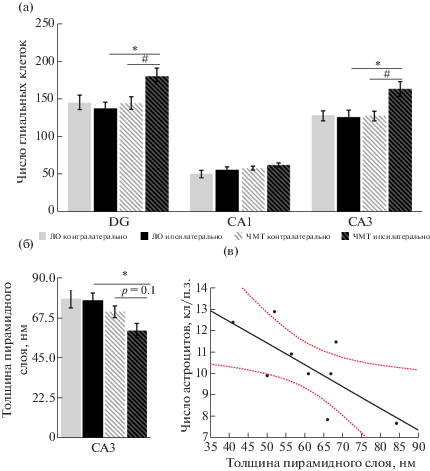
Глиоз в гиппокампе. При окраске по Нисслю у крыс с ЧМТ обнаружили увеличение числа глиальных клеток (без дифференцировки на астроциты и микроглию и другие не нейрональные клетки) в областях DG и CA3 в ипсилатеральном полушарии по сравнению с контралатеральным, а также в ипсилатеральном гиппокампе крыс с ЧМТ по сравнению с крысами группы ЛО (рис. 1 (а)).
Рис. 1.
Глиоз и истончение нейрональных слоев в гиппокампе через 6 мес после ЧМТ. (а) – Число глиальных клеток в гиппокампе крыс после ЧМТ, окрашивание по методу Ниссля. (б) – Толщина слоя пирамидных нейронов в гиппокампе крыс после ЧМТ. (в) – корреляция между истончением пирамидного слоя в области СА3 и числом клеток астроглии у крыс после ЧМТ (при окрашивании на GFAP) – у крыс с выраженным глиозом толщина пирамидного слоя была меньше (р < 0.05). * – p < 0.05 при сравнении групп ЧМТ и ЛО, тест Манна–Уитни. # – p < 0.05 при сравнении полушарий у крыс группы ЧМТ, тест Вилкоксона (зависимые переменные).
Fig. 1. Gliosis and thinning of neuronal layers in the hippocampus 6 months after TBI. (а) – Number of glial cells in the hippocampus after TBI, Nissl staining. (б) – Thickness of pyramidal layer in the hippocampus after TBI. (в) – Correlation between thinning of pyramidal layer in the CA3 region and the number of astroglial cells in rats after TBI (GFAP staining); the thickness of the pyramid layer was less in rats with pronounced gliosis (p < 0.05). * – p < 0.05 TBI vs. Sham groups, Mann–Whitney test. # – p < 0.05 ipsi- vs. contralateral hemispheres in TBI rats, Wilcoxon test (dependent variables).
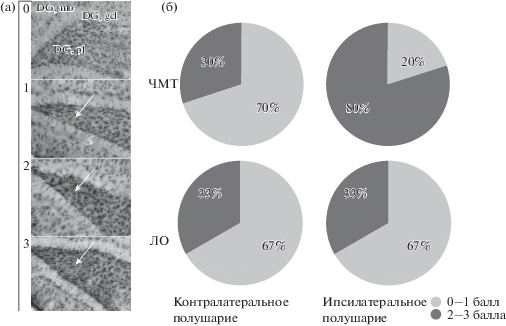
Астроцитарный глиоз в гиппокампе. Астроцитарный глиоз подразумевает как увеличение числа клеток, так и изменение их морфологии – увеличение числа и длины отростков, утолщение тела астроцитов. При анализе срезов отмечали наличие умеренно выраженного астроцитарного глиоза в гиппокампе у крыс обеих групп (ЛО и ЧМТ), отчетливее видимое в поле СА3 и зубчатой извилине гиппокампа (рис. 2 (а)). У пяти крыс (1 ЛО и 4 ЧМТ) отмечали значительный фибриллярный астроглиоз в DG (3 балла); глиоз в 2 и 3 балла обнаружили у 10 крыс (2 ЛО и 8 ЧМТ). При этом сами астроциты имели морфологию, характерную для активированного состояния, – крупные, амебоидной формы, с малым числом отростков, иногда с перифокальным отеком. У молодых животных в предыдущих работах нами таких изменений астроцитарной глии не было зафиксировано [Комольцев и соавт., 2018]. Достоверных различий по плотности астроцитов в полях гиппокампа между группами ЛО и ЧМТ обнаружено не было, но при этом у группы ЧМТ изменения в гиппокампе носили выраженный асимметричный характер (рис 2 (б)). В группе ЛО различий между полушариями не наблюдали. Астроциты в ипсилатеральном гиппокампе крыс с ЧМТ имели более выраженную активированную морфологию: средняя степень глиоза в ипсилатеральном полушарии была выше в сравнении с контралатеральным (1 ± 0.2 балла в контралатеральном и 2.1 ± 0.3 в ипсилатеральном полушарии, p < 0.05; рис 2 (б)); в поле CA3 число астроцитов на срезе у крыс группы ЧМТ было выше в ипсилатеральном полушарии (10.5 ± 0.6 клеток против 8.9 ± 0.4 клеток, p < 0.05). В группе ЛО межполушарных отличий не отмечали (8.9 ± 0.5 и 8.7 ± 0.7 в ипсилатеральном и контралатеральном полушариях соответственно, р > 0.1). Таким образом, гипертрофия астроцитов происходила у всех животных вне зависимости от наличия ЧМТ и связана, вероятно, с их возрастом. У крыс с ЧМТ изменения носили выраженный асимметричный характер – число астроцитов в поле СА3 и степень астроцитарного глиоза были выше в ипсилатеральном гиппокампе.
Рис. 2.
Астроцитарный глиоз в гиппокампе у крыс через 6 мес после ЧМТ. (а) – Шкала степени астроцитарного глиоза в зубчатой извилине гиппокампа (0–3 балла, изменения показаны стрелками); 3 балла соответствуют фибриллярному астроцитарному глиозу. (б) – Представленность глиального рубца разной степени у крыс групп ЛО и ЧМТ в ипсилатеральном и контралатеральном полушарии. Отмечается асимметрия астроцитарного глиоза у крыс группы ЧМТ (у 80% крыс в ипсилатеральном полушарии выявляли глиоз, оцененный в 2 и 3 балла). DG, mo – молекулярный слой зубчатой извилины, DG gcl – слой гранулярных клеток, DG pl – полиморфный слой зубчатой извилины.
Fig. 2. Astrogliosis in the rat hippocampus 6 months after TBI. (а) – Astrogliosis score in the dentate gyrus of the hippocampus (0–3 points, changes shown with arrows); 3 points correspond to fibrillary astrogliosis. (б) – Glial scar of different degrees in rats of the Sham and TBI groups in the ipsi- and contralateral hemispheres. The asymmetry of astrogliosis in TBI group rats is remarkable (in 80% of rats, 2–3 points of gliosis score were detected in the ipsilateral hemisphere). DG mo – molecular layer of dentate gyrus, DG gcl – granular cell layer, DG pl – polymorph layer of dentate gyrus.
Истончение и дисперсия нейрональных слоев в гиппокампе. Отмечали истончение пирамидного слоя в поле СА3 ипсилатерального гиппокампа у крыс группы ЧМТ при сравнении с животными группы ЛО (рис. 1 (б)). В контралатеральном гиппокампе таких отличий не было. Отличия между ипсилатеральным и контралатеральным полушариями у крыс группы ЧМТ выявляли на уровне статистической тенденции (p = 0.1). Истончение пирамидного слоя в поле CA3 в ипсилатеральном гиппокампе крыс с ЧМТ коррелировало с числом астроцитов в этой области (r = = 0.51, p = 0.03; рис. 1 (в)), что не наблюдали в группе ЛО (r = 0.47, p = 0.35). В полях CA1 и DG толщина слоев нейронов в обоих полушариях у крыс групп ЧМТ и ЛО не отличалась. Таким образом, описанные выше возрастные изменения астроцитов у крыс с ЧМТ имели межполушарную асимметрию и сопровождались истончением пирамидного слоя СА3 ипсилатерального полушария. Кроме того, у 11 крыс (4 ЛО и 7 ЧМТ) выявляли дисперсию пирамидного слоя в области СА3 гиппокампа (нарушение компактного строения клеточного слоя, характерное для пациентов с височной эпилепсией [Houser et al., 1990]).
Таким образом, астроцитарный глиоз гиппокампа у крыс после ЧМТ, выявленный при окрашивании на GFAP, качественно неотличим от астроцитарного глиоза, связанного с возрастом животного. ЧМТ в отдаленном периоде приводит к истончению пирамидного слоя СА3, наличию выраженного асимметричного астроцитарного глиоза в ипсилатеральном гиппокампе и увеличению числа глиальных клеток. Паттерн астроцитарного глиоза и истончения слоев гиппокампа позволяет классифицировать СГ у крыс группы ЛО как изолированный глиоз, а у крыс с ЧМТ – как СГ 3 типа [Blümcke et al., 2013], хотя изменения и имеют меньшую выраженность и выявляются преимущественно при количественном анализе патоморфологических изменений у крыс групп ЧМТ и ЛО, приведенном выше.
Поведенческие изменения через 6 мес после ЧМТ. Морфологические изменения у человека, связанные с возрастом и/или перенесенной ЧМТ, коррелируют с когнитивными нарушениями [Cole et al., 2015]. В поведенческой части нашей работы мы оценили возрастные изменения в поведении всех крыс (при сравнении показателей до травмы и через 6 мес после ЧМТ), а также выявили те изменения, которые у крыс с перенесенной ЧМТ имеют более выраженный характер (при сравнении групп ЧМТ и ЛО через 6 мес после травмы).
Поведенческие изменения в отдаленном периоде ЧМТ, связанные с травмой. Через 6 мес после травмы в ПКЛ у крыс группы ЧМТ при сравнении с крысами группы ЛО отмечали меньшее число выглядываний и заглядываний в рукава лабиринта (3.6 ± 0.7 в группе ЧМТ против 6.3 ± 0.3 в группе ЛО, p < 0.05), исходные показатели у групп ЧМТ и ЛО достоверно не отличались (4.6 ± 0.6 и 6.5 ± 1 соответственно, p > 0.1). При сравнении с исходным уровнем (до операций в возрасте 5 мес) у крыс после травмы отмечали достоверное уменьшение времени пребывания на центральной площадке (44.4 ± 19.9 с до 0 с, p < 0.05) – после ухода с ЦП в рукава лабиринта крысы не выходили в центр. Кроме того, у этих животных выявляли уменьшение исследовательской активности – сумма числа стоек и свешиваний уменьшилась через 6 мес после ЧМТ (с 13.6 ± 1.2 до 8.6 ± 1.4, p < < 0.05). Подобные отличия между данными, полученными в возрасте 5 и 12 мес. у крыс группы ЛО отсутствовали: исходная сумма числа свешиваний и стоек составляла 12.0 ± 0.9, через 6 мес после ложной операции – 10.5 ± 1.8 (p > 0.1); время пребывания на центральной площадке у крыс группы ЛО уменьшилось не достоверно – исходное время на ЦП составляло 52 ± 21 c, через 6 мес после ложной операции – 15 ± 15 c (p > 0.1). В ОП и тесте Порсолта отличий между группами ЛО и ЧМТ нами обнаружено не было.
Изменения поведения крыс, связанные со старением. В возрасте 1 года все животные становились менее активными, чем в возрасте 5 мес. В тесте ПКЛ (рис. 3 (г, д)) уменьшается время пребывания в открытых рукавах (ОР) с одновременным увеличением времени пребывания в закрытых рукавах (ЗР). При этом число пересечений центра и число вхождений в закрытые рукава у всех крыс (ЧМТ и ЛО) при сравнении результатов тестирования в 5 и 12 мес не изменились, а число вхождений в открытые рукава уменьшилось (7 ± 1 при первом тестировании против 4 ± 1 через 6 мес после ЧМТ, р < 0.05). Пройденное расстояние в тесте ПКЛ не изменилось. В тесте ОП (рис. 3 (а, б)) уменьшаются пройденное расстояние и средняя скорость движения. Снижается время, проведенное животными в движении, и увеличивается время, проведенное без движения. Число выходов в центр ОП и длительность пребывания в центре у крыс не изменились. В тесте Порсолта (рис. 3 (в)) у всех животных через 6 мес после операций достоверно снизились число нырков и их продолжительность. Длительность активного плавания и иммобилизации не изменились.
Рис. 3.
Поведенческие изменения в тестах “Открытое поле” (ОП), “Приподнятый крестообразный лабиринт” (ПКЛ) и тесте Порсолта, связанные со старением животных. (а) – Поведение в ОП при исходном тестировании и через 6 мес после краниотомии. (б) – Горячие карты поведения в ОП крыс групп ЛО и ЧМТ при исходном тестировании и через 6 мес после краниотомии. (в) – Поведение в тесте Порсолта крыс при исходном тестировании и через 6 мес после краниотомии. (г) – Поведение в ПКЛ при исходном тестировании и через 6 мес после краниотомии. (д) – Горячие карты поведения в ПКЛ крыс групп ЧМТ и ЛО в фоне и через 6 мес после краниотомии. * – p < 0.05. ** – p < 0.01 при сравнении показателей при исходном тестировании и через 6 мес после краниотомии, тест Вилкоксона (зависимые переменные). § – p < 0.05 при сравнении времени в ЗР и времени в ОР при исходном тестировании и через 6 мес после краниотомии, тест Вилкоксона (зависимые переменные).
Fig. 3. Behavioral changes in the open field (OF), elevated plus maze (EPM) and Porsolt tests associated with aging. (а) – Behavior in the OF at baseline and 6 months after craniotomy. (б) – Hot maps of behavior in the OF of Sham and TBI rats at baseline and 6 months after craniotomy. (в) – Behavior in the Porsolt test at baseline and 6 months after craniotomy. (г) – Behavior in EPM at baseline and 6 months after craniotomy. (д) – Hot maps of behavior in EPM of TBI and Sham rats at baseline and 6 months after craniotomy. * – p < 0.05.** – p < 0.01 baseline assessment vs. 6 months after craniotomy, Wilcoxon test (dependent variables). § – p < 0.05 time spent in the open arms (ОР) and closed arms (ЗР), baseline vs. 6 months after craniotomy, Wilcoxon test (dependent variables).
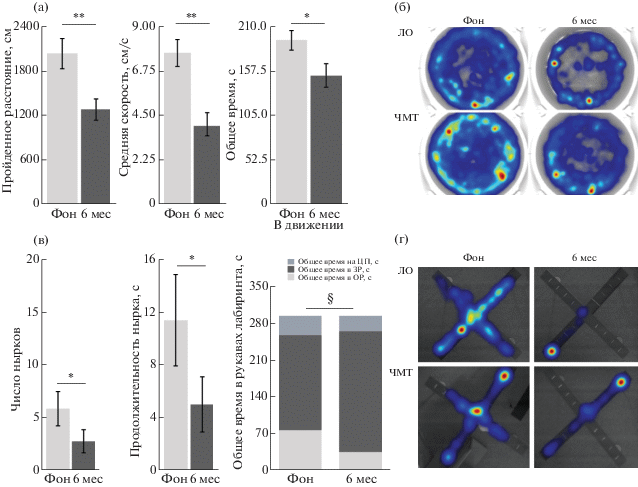
Таким образом, через 6 мес после ЧМТ и ложной операции у всех животных выявляется выраженное снижение двигательной активности, на фоне которого некоторые изменения поведения можно объяснить повышенной тревожностью (увеличение времени пребывания в закрытых рукавах КПЛ при отсутствии изменений числа пересечений центра). У крыс с ЧМТ отмечалось снижение исследовательской активности при сравнении с крысами группы ЛО.
Электрофизиологические изменения через 6 мес после ЧМТ. Отдаленный период ЧМТ у ряда животных может сопровождаться появлением эпилептических приступов, а также появлением эпилептиформной активности. Нами была проанализирована эпилептиформная активность в коре и гиппокампе. Наличие эпилептических приступов подтверждали анализом видео.
Эпилептиформная активность через 6 мес после ЧМТ. Вживление электродов через 6 мес после ЧМТ связано с повторным скальпированием крыс. Животным с изменениями костей черепа в результате первой операции, выявленными во время повторного скальпирования, вживление электродов не проводили из-за невозможности точно определить области вживления электродов и надежно закрепить стоматологический цемент. Регистрацию ЭКоГ и полевых потенциалов проводили у 5 крыс (3 ЧМТ, 2 ЛО).
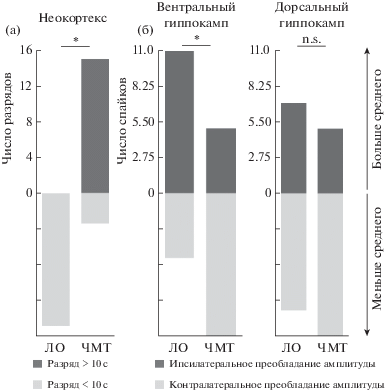
Через 6 мес после ЧМТ на ЭЭГ в коре регистрировали разряды в виде комплексов спайк-медленная волна, частотой около 7 Гц. Подобные разряды описаны не только у крыс при моделировании генетической и приобретенной эпилепсии, но также и у контрольных животных [Rodgers et al., 2015]. Средняя длительность разрядов у крыс через 6 мес после операции составила 9.7 ± 1.5 с, однако у животных с ЧМТ число разрядов длительностью выше среднего значения было существенно больше (p < 0.05) (рис. 4 (а). В группе ЛО средняя длительность разряда составляла 2.6 ± 1.4 с, что не отличается от длительности разрядов у крыс в возрасте полугода, описанных нами ранее [Комольцев и соавт., 2018].
Рис. 4.
Электрофизиологические изменения через 6 мес после ЧМТ. (а) – Число разрядов больше среднего значения (10 с) преобладает у крыс группы ЧМТ. (б) – Число спайков с амплитудным преобладанием в контралатеральном гиппокампе наблюдается у крыс группы ЧМТ, что говорит об асимметрии высокоамплитудной активности в гиппокампе. * – p < 0.05, точный тест Фишера.
Fig. 4. Electrophysiological changes 6 months after TBI. (а) – Number of discharges higher than the average value (10 s) is more prevalent in TBI rats. (б) – Number of spikes with amplitude predominance in the contralateral hippocampus is observed in TBI rats, indicating an asymmetry of high-amplitude activity in the hippocampus. * – p < 0.05, Fisher exact test.
Электрографические эпилептические приступы зарегистрированы у двух из трех крыс группы ЧМТ с вживленными электродам (рис. 5). У одной крысы с большим числом длительных (>10 c) разрядов в коре появление активности соответствовало замиранию животного на акселерометре, что подтверждалось видеозаписью. Проявления могут соответствовать немоторным эпилептическим приступам, описанным на моделях пост-травматической эпилепсии. У другой крысы через 6 мес после ЧМТ зарегистрированы миоклонические приступы, сопровождающиеся спайк-волновой активностью в коре, отличной от предыдущей по частоте (около 1.5 Гц). Каждый разряд сопровождался вздрагиванием крысы, о чем можно судить по записям видео и акселерометра.
Рис. 5.
Электрографические приступы у крыс через 6 мес после ЧМТ. (а) – немоторные приступы в виде остановки поведения (behaviour arrest). (б) – моторные приступы в виде миоклоний. ЛР – левые ростральные отделы коры, ПР – правые ростральные отделы коры, ЛК – левые каудальные отделы коры, ПК – правые каудальные отделы коры, ЛВГп – левый вентральный гиппокамп, ПВГп – правый вентральный гиппокамп, ЛДГп – левый дорсальный гиппокамп, ПДГп – правый дорсальный гиппокамп.
Fig. 5. Electrographic seizures in rats 6 months after TBI. (a) – Non-motor seizure- behavior arrest type. (b) – motor seizures – myoclonic type. ЛР – left rostral cortex, ПР – right rostral cortex, ЛК – left caudal cortex, ПК – right caudal cortex, ЛВГп – left ventral hippocampus, ПВГп – right ventral hippocampus, ЛДГп – left dorsal hippocampus, ПДГп – right dorsal hippocampus.
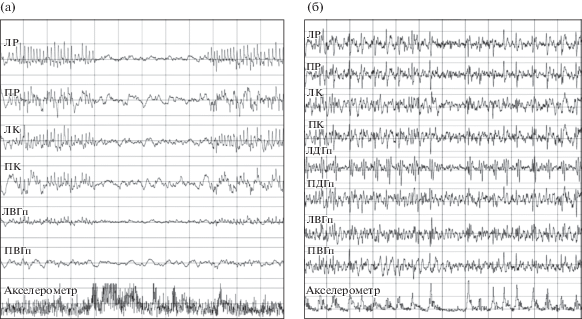
Электрическая активность в гиппокампе. Через 6 мес после ЧМТ у крыс отмечали выраженную асимметрию амплитуды спайков в вентральном, но не в дорсальном гиппокампе (рис. 4 (б)). Эти данные подтверждают наличие у крыс с травмой функциональных изменений, сопровождающих морфологическую асимметрию, описанную выше.
Цикл сон-бодрствование у крыс через 6 мес после ЧМТ. В предыдущих работах в остром периоде ЧМТ мы выявляли нарушения в соотношении фаз цикла сон-бодрствование. В данной работе нами не было обнаружено изменений в соотношении фаз цикла сон-бодрствование и длительности циклов у крыс групп ЧМТ и ЛО. Средняя продолжительность цикла сон-бодрствование составила 47 ± 5 мин. Средняя продолжительность NREM фазы сна у 12-месячных животных в данной работе составила 26 ± 4 мин (49 ± 3%), REM – 5 ± 1 мин (9 ± 1%), бодрствования – 17 ± 1 мин (42 ± %). Структура сна у 6-месячных животных до краниотомии из работы [Комольцев и соавт., 2017]: фаза NREM-сна – 38.8 ± 1.0% и фаза REM-сна – 9.5 ± 0.4%, фаза бодрствования 51.4 ± 1.1%. По сравнению с этими результатами, у всех крыс в возрасте 12 мес отмечаются некоторое уменьшение доли бодрствования и увеличение доли NREM-сна (примерно на 10% фазы цикла сон-бодрствование с возрастом доля NREM-сна увеличилась, а доля бодрствования уменьшилась).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Склероз гиппокампа после ЧМТ. Тип СГ зависит от выраженности глиоза и паттерна гибели нейронов в разных полях гиппокампа [Malmgren, Thom, 2012; Blümcke et al., 2013]. СГ 1-го типа у человека характеризуется глиозом и гибелью нейронов в полях CA1 и CA4, СГ 2-го типа – преимущественно в поле CA1, СГ 3-го типа – преимущественно в поле CA4 (DG) [Blümcke et al., 2013; Blümcke et al., 2017]. По полученным нами данным ЧМТ у крыс приводит к увеличению числа глиальных клеток в отдаленном периоде (при окраске по методу Ниссля) при неизменном числе астроцитов. Увеличение числа глиальных клеток обусловлено, таким образом, неастроцитарной глией – вероятнее всего, микроглией; не исключено также наличие некоторой доли лимфоидных клеток. У крыс с ЧМТ изменения как числа, так и морфологии астроцитов носили выраженный асимметричный характер: в ипсилатеральном гиппокампе (зубчатая извилина (DG) и поле CA3) число астроцитов и степень глиоза были выше, чем в контралатеральном гиппокампе. Кроме того, в области СА3 у крыс с ЧМТ наблюдали истончение пирамидного слоя, что, вероятно, связано с уменьшением числа нейронов в этой области. Истончение слоя коррелировало с числом астроцитов и было больше у крыс с выраженным глиозом. Морфологическую картину повреждения у крыс группы ЧМТ можно соотнести, таким образом, со СГ 3-го типа у человека. У животных группы ЛО при этом наблюдали только изолированный глиоз гиппокампа. Изменения в гиппокампе (склероз гиппокампа) описаны у крыс с посттравматической эпилепсией после латерального гидродинамического удара – они захватывают поля СА1 и СA3-CA4, что соответствует склерозу гиппокампа 1-го типа человека [Aronica et al., 2017]. Тип СГ определяет степень нарушения памяти у пациентов с эпилепсией – у пациентов со СГ 1-го и 3-го типа выявлялись выраженные нарушения декларативной памяти, тогда как при СГ 2-го типа нарушения менее выражены [Coras et al., 2014]. Однако тип повреждения гиппокампа может иметь значение как при деменциях, так и при других патологиях. Рядом авторов склероз гиппокампа, связанный с возрастом, выделяется в отдельную нозологию [Nelson et al., 2013]. Применение классификации склероза гиппокампа для оценки последствий ЧМТ является перспективным для анализа всех коморбидных состояний, связанных с травмой. Аберрантный нейрогенез и спрутинг, происходящие на фоне нейровоспаления в зубчатой извилине гиппокампа, могут быть звеном патогенеза ПТЭ [Gulyaeva, 2010; Parent, Kron, 2010; Klein et al., 2018]. Именно в зубчатой извилине, а также в области СА3 происходили наиболее выраженные изменения, описанные выше. Также нами была обнаружена дисперсия пирамидного слоя в поле СА3 гиппокампа. На данный момент в литературе никаких коррелятов для данного явления не найдено. Феномен дисперсии слоя гранулярных клеток у больных эпилепсией наблюдается в зубчатой извилине гиппокампа и связан с нарушением нейрональной миграции [Houser, 1990] и с нарушением функции рилина [Haas et al., 2002].
Выявленные нами характеристики нейроглии говорят о ее активированном состоянии. Профиль поляризации глии (микроглии – М1/М2 и астроглии – А1/А2) после ЧМТ имеет сложную временную динамику: при хроническом нейровоспалении, как и при остром, преобладает провоспалительная поляризация глии [Biswas, Mantovani 2012; Jin et al., 2012; Donat et al., 2017]. Для нее характерна гиперпродукция провоспалительных медиаторов (ИЛ-1β, ИФН альфа и гамма, РОС), наличие которых, в свою очередь, приводит к продолжающейся гибели нейронов, ассоциированной с поведенческими нарушениями [Puntambekar et al., 2018]. Вторичное повреждение ткани мозга и гибель нейронов включают в себя механизмы как апоптоза, так и некроза [Thompson et al., 2005]. Апоптоз после ЧМТ происходит на фоне воспалительных изменений [Dixon et al., 2017], выраженность апоптоза достигает максимума в коре и гиппокампе через 1–2 нед после травмы [Luo et al., 2002].
Тревожное поведение в отдаленном периоде ЧМТ. Психические расстройства у пациентов после ЧМТ встречаются часто: риск развития депрессии в отдаленном периоде у пациентов, перенесших ЧМТ, достигает 60%, тогда как в общей популяции – только 8–10% [Fann et al., 2009; Scholten et al., 2016]. У пожилых людей с ЧМТ в анамнезе риск депрессии в 2 раза выше, чем в популяции [Albrecht et al., 2015]. У пациентов после травмы повышен риск и других психических нарушений, таких как тревожность, посттравматическое стрессовое расстройство, суицидальные мысли и поведение [Iverson et al., 2011; Fisher et al., 2016; Zaninotto et al., 2016; Brandel et al., 2017].
У крыс наряду с глиозом в гиппокампе, связанным со старением, нами были обнаружены изменения в поведении: выраженное уменьшение подвижности и появление элементов поведения, которые могут быть вызваны повышением тревожности животных (увеличение времени пребывания в закрытых рукавах при отсутствии изменений числа пересечений центра). У травмированных животных нарушения поведения были выражены в большей мере – при сравнении с крысами группы ЛО крысы после травмы проявляли достоверно меньше элементов исследовательской активности. У крыс после ЧМТ в экспериментах было показано наличие когнитивных нарушений [Thompson et al., 2006; Gurkoff et al., 2013], которые могут сохраняться до полугода [Dixon et al., 1999]. Признаки тревожности выявляют через 1 и 3 мес после ЧМТ, но не через полгода [Jones et al., 2008]. По нашим данным, через полгода у всех животных выявлено уменьшение двигательной активности, которое может “маскировать” поведенческие нарушения в результате ЧМТ и объяснять вышеприведенные результаты (собственные данные и данные статей). Интересно, что при моделировании диффузной ЧМТ посредством ускорения (модель травмы, при которой диффузное повреждение вызывается резким ускорением и остановкой движения фиксированного экспериментального животного), не сопровождающейся дистантным нейровоспалением в гиппокампе, через 1, 3 и 12 мес после ЧМТ не обнаруживают признаков тревожного поведения, изменений локомоторной активности и выраженных когнитивных нарушений [Arulsamy et al., 2018, 2019]. Депрессивноподобное поведение в тесте Порсолта при этом выявляли через 1 и 3 мес после травмы [Arulsamy et al., 2018, 2019]. Эти данные показывают исключительное значение повреждения в гиппокампе для формирования поведенческих нарушений. Таким образом, в возрасте 1 года, вместе с формированием глиоза гиппокампа у животных снижается двигательная активность и появляются признаки, которые могут быть вызваны повышенной тревожностью. У крыс с перенесенной ЧМТ глиоз гиппокампа асимметричен и соответствует СГ 3-го типа ипсилатерально, а поведенческие нарушения выражены в большей мере (снижение исследовательской активности).
Эпилептические приступы в отдаленном периоде ЧМТ. Через 6 мес после травмы у 2 из 3 животных зарегистрированы эпилептические моторные (миоклонические) и немоторные (остановка поведения) приступы, что соответствует ранее опубликованным данным и свидетельствует о валидности используемой модели [D’Ambrosio et al., 2004; Pitkänen, Immonen, 2014; Pitkänen et al., 2017]. Кроме того, нами выявлено увеличение длительности разрядов в коре и асимметрия спайков в гиппокампе. Механизмы формирования и роль спайк-волновых разрядов в коре в литературе активно обсуждается [Rodgers et al., 2015]. Длительные разряды в коре могут соответствовать эпилептическим приступам у животных [Dudek, Bertram, 2010]. Малое число животных в данной группе обусловлено техническими сложностями при регистрации ЭЭГ в отдаленном периоде: спустя 6 мес после первой операции кости черепа были деформированы, что затрудняло вживление электродов. В данной работе установить соответствие между электрофизиологическими и морфологическими нарушениями не представляется возможным. Выяснению данного вопроса будут посвящены наши исследования в дальнейшем. Однако наличие эпилептических приступов является важной качественной характеристикой модели, свидетельствующей о протекании процессов эпилептогенеза как минимум у части крыс с ЧМТ при вышеописанной морфологической картине повреждения.
Изменение цикла сон-бодрствование было одинаковым у крыс групп ЛО и ЧМТ – отмечали преобладание NREM-сна над бодрствованием в сравнении с ранее опубликованными данными на молодых животных [Комольцев и соавт., 2017]. В раннем периоде ЧМТ нарушение цикла сон-бодрствование было представлено уменьшением доли REM-сна.
ВЫВОДЫ
1) Через 6 мес после краниотомии у крыс отмечается наличие астроцитарного глиоза в гиппокампе. У крыс с ЧМТ глиоз асимметричен, сопровождается истончением слоя CA3 гиппокампа (что может соответствовать СГ 3 типа у человека) и увеличением числа клеток неастроцитарной глии.
2) Через 6 мес после краниотомии у всех крыс отмечается выраженное уменьшение двигательной активности. На фоне этих изменений развиваются элементы поведения, которые могут быть вызваны повышением тревожности животных. У крыс с ЧМТ поведенческие отклонения выражены в большей мере, в основном за счет уменьшения элементов исследовательской активности.
3) У крыс через 6 мес после ЧМТ регистрируется эпилептиформная активность в коре, асимметричная спайковая активность в гиппокампе, а также у 2 крыс зарегистрированы моторные (остановка поведения) и немоторные (миоклонические) эпилептические приступы, что свидетельствует о протекании процессов эпилептогенеза как минимум у части крыс с ЧМТ.
Поддержано грантом Российского фонда фундаментальных исследований № 19-015-00258 (исследование отдаленного периода ЧМТ), № 18-315-00146 (исследование дистантного повреждения гиппокампа).
Список литературы
Комольцев И.Г., Лёвшина И.П., Новикова М.Р., Тишкина А.О., Степаничев М.Ю., Гуляева Н.В. Острый посттравматический период у крыс сопровождается тревожным состоянием и уменьшением доли REM-сна. Журн. высш. нервн. деят. им. И.П. Павлова. 2017. 67 (2): 1–15.
Комольцев И.Г., Франкевич С.О., Широбокова Н.И., Волкова А.А., Лёвшина И.П., Новикова М.Р., Манолова А.О., Гуляева Н.В. Ранние электрофизиологические последствия дозированной черепно-мозговой травмы у крыс. Журнал неврологии и психиатрии им. Корсакова. 2018. 118 (10): 21–26.
Комольцев И.Г., Франкевич С.О., Широбокова Н.И., Волкова А.А., Новикова М.Р. Острый период при моделировании черепно-мозговой травмы у крыс: немедленные судороги, повреждение функциональных зон новой коры и ухудшение поведения. Журнал неврологии и психиатрии им. Корсакова. 2019. 119 (11): 90–93.
Albrecht J.S., Kiptanui Z., Tsang Y., Khokhar B., Liu X., Simoni-Wastila L., Zuckerman I.H. Depression Among Older Adults After Traumatic Brain Injury: A National Analysis. The American Journal of Geriatric Psychiatry. 2015. 23 (6): 607–614.
Aronica E., Mühlebner A., van Vliet EA., Gorter J.A. Characterization of Pathology. P. in Models of Seizures and Epilepsy: Second Edition. 2017.
Arulsamy A., Corrigan F., Collins-Praino L.E. Cognitive and neuropsychiatric impairments vary as a function of injury severity at 12 months post-experimental diffuse traumatic brain injury: Implications for dementia development. Behavioural Brain Research. 2019. 365: 66–76.
Arulsamy A., Teng J., Colton H., Corrigan F., Collins-Praino L. Evaluation of early chronic functional outcomes and their relationship to pre-frontal cortex and hippocampal pathology following moderate-severe traumatic brain injury. Behavioural Brain Research. 2018. 348: 127–138.
Bailey K.R., Crawley J.N. Anxiety-Related Behaviors in Mice. CRC Press/Taylor & Francis, 2009.
Biswas S.K., Mantovani A. Orchestration of Metabolism by Macrophages. Cell Metabolism. 2012. 15 (4): 432–437.
Blümcke I., Spreafico R., Haaker G., Coras R., Kobow K., Bien C.G., Pfäfflin M., Elger C., Widman G., Schramm J., Becker A., Braun K.P., Leijten F., Baayen J.C., Aronica E., et al. Histopathological Findings in Brain Tissue Obtained during Epilepsy Surgery. New England Journal of Medicine. 2017. 377 (17): 1648–1656.
Blümcke I., Thom M., Aronica E., Armstrong D.D., Bartolomei F., Bernasconi A., Bernasconi N., Bien C.G., Cendes F., Coras R., Cross J.H., Jacques T.S., Kahane P., Mathern G.W., Miyata H., et al. International consensus classification of hippocampal sclerosis in temporal lobe epilepsy: A Task Force report from the ILAE Commission on Diagnostic Methods. Epilepsia. 2013. 54 (7): 1315–1329.
Brandel M.G., Hirshman B.R., McCutcheon B.A., Tringale K., Carroll K., Richtand N.M., Perry W., Chen C.C., Carter B.S. The Association between Psychiatric Comorbidities and Outcomes for Inpatients with Traumatic Brain Injury. Journal of Neurotrauma. 2017. 34 (5): 1005–1016.
Christensen J. The Epidemiology of Posttraumatic Epilepsy. Seminars in Neurology. 2015. 35 (03): 218–222.
Cole J.H., Leech R., Sharp D.J. Prediction of brain age suggests accelerated atrophy after traumatic brain injury. Annals of Neurology. 2015. 77 (4): 571–581.
Coras R., Pauli E., Li J., Schwarz M., Rössler K., Buchfelder M., Hamer H., Stefan H., Blümcke I. Differential influence of hippocampal subfields to memory formation: insights from patients with temporal lobe epilepsy. Brain. 2014. 137 (7): 1945–1957.
D’Ambrosio R., Fairbanks J.P., Fender J.S., Born D.E., Doyle D.L., Miller J.W. Post-traumatic epilepsy following fluid percussion injury in the rat. Brain. 2004. 127 (2): 304–314.
Dixon K.J. Pathophysiology of Traumatic Brain Injury. Physical Medicine and Rehabilitation Clinics of North America. 2017. 28 (2): 215–225.
Dixon C.E., Kochanek P.M., Yan H.Q., Schiding J.K., Griffith R.G., Baum E., Marion D.W., Dekosky S.T. One-Year Study of Spatial Memory Performance, Brain Morphology, and Cholinergic Markers After Moderate Controlled Cortical Impact in Rats. Journal of Neurotrauma. 1999. 16 (2): 109–122.
Donat C.K., Scott G., Gentleman S.M., Sastre M. Microglial Activation in Traumatic Brain Injury. Frontiers in Aging Neuroscience. 2017. 9: 208.
Dudek F.E., Bertram E.H. Counterpoint to “what is an epileptic seizure?” by D’Ambrosio and Miller. Epilepsy currents. American Epilepsy Society, 2010; 10 (4): 91–94.
Fann J.R., Hart T., Schomer K.G. Treatment for Depression after Traumatic Brain Injury: A Systematic Review. Journal of Neurotrauma. 2009. 26 (12): 2383–2402.
Fann J.R., Ribe A.R., Pedersen H.S., Fenger-Grøn M., Christensen J., Benros M.E., Vestergaard M. Long-term risk of dementia among people with traumatic brain injury in Denmark: a population-based observational cohort study. The Lancet Psychiatry. 2018. 5 (5): 424–431.
Fisher L.B., Pedrelli P., Iverson G.L., Bergquist T.F., Bombardier C.H., Hammond F.M., Hart T., Ketchum J.M., Giacino J., Zafonte R. Prevalence of suicidal behaviour following traumatic brain injury: Longitudinal follow-up data from the NIDRR Traumatic Brain Injury Model Systems. Brain Injury. 2016. 30 (11): 1311–1318.
Gulyaeva N.V. Aberrant neurogenesis in adult epileptic brain: compensatory or pathologic. Neurochemical Journal. 2010. 4 (2): 84–89.
Gurkoff G.G., Gahan J.D., Ghiasvand R.T., Hunsaker M.R., Van K., Feng J.-F., Shahlaie K., Berman R.F., Lyeth B.G., Folkerts M.M. Evaluation of metric, topological, and temporal ordering memory tasks after lateral fluid percussion injury. Journal of Neurotrauma. 2013. 30 (4): 292–300.
Haas C.A., Dudeck O., Kirsch M., Huszka C., Kann G., Pollak S., Zentner J., Frotscher M. Role for Reelin in the Development of Granule Cell Dispersion in Temporal Lobe Epilepsy. The Journal of Neuroscience. 2002. 22 (14): 5797–5802.
Houser C.R. Granule cell dispersion in the dentate gyrus of humans with temporal lobe epilepsy. Brain Research. 1990. 535 (2): 195–204.
Iverson K.M., Hendricks A.M., Kimerling R., Krengel M., Meterko M., Stolzmann K.L., Baker E., Pogoda T.K., Vasterling J.J., Lew H.L. Psychiatric Diagnoses and Neurobehavioral Symptom Severity among OEF/OIF VA Patients with Deployment-Related Traumatic Brain Injury: A Gender Comparison. Women’s Health Issues. 2011. 21 (4): S210–S217.
Jin X., Ishii H., Bai Z., Itokazu T., Yamashita T. Temporal Changes in Cell Marker Expression and Cellular Infiltration in a Controlled Cortical Impact Model in Adult Male C57BL/6 Mice. Nataf S (ed). PLoS ONE. 2012. 7 (7): e41892.
Jones N.C., Cardamone L., Williams J.P., Salzberg M.R., Myers D., O’Brien T.J. Experimental traumatic brain injury induces a pervasive hyperanxious phenotype in rats. Journal of neurotrauma. 2008. 25 (11): 1367–1374.
Jorge R., David A. Mood Disorders after TBI. Psychiatr Clin North Am. 2012. 76: 211–220.
Kabadi S.V., Hilton G.D., Stoica B., Zapple D.N., Faden A.I. Fluid-percussion-induced traumatic brain injury model in rats. Nature protocols. 2010. 5 (9): 1552–1563.
Klein P., Dingledine R., Aronica E., Bernard C., Blümcke I., Boison D., Brodie M.J., Brooks-Kayal A.R., Engel J., Forcelli P.A., Hirsch L.J., Kaminski R.M., Klitgaard H., Kobow K., Lowenstein D.H., et al. Commonalities in epileptogenic processes from different acute brain insults: Do they translate? Epilepsia. 2018. 59 (1): 37–66.
Luo C., Jiang J., Lu Y., Zhu C. Spatial and temporal profile of apoptosis following lateral fluid percussion brain injury. Chinese Journal of Traumatology. 2002. 5 (1): 24–27.
Malmgren K., Thom M. Hippocampal sclerosis-Origins and imaging. Epilepsia, 2012; 53 (SUPPL. 4): 19–33.
McIntosh T.K., Vink R., Noble L., Yamakami I., Fernyak S., Soares H., Faden A.L. Traumatic brain injury in the rat: Characterization of a lateral fluid-percussion model. Neuroscience. 1989. 28 (1): 233–244.
Nelson P.T., Smith C.D., Abner E.L., Wilfred B.J., Wang W.-X., Neltner J.H., Baker M., Fardo D.W., Kryscio R.J., Scheff S.W., Jicha G.A., Jellinger K.A., Van Eldik L.J., Schmitt F.A. Hippocampal sclerosis of aging, a prevalent and high-morbidity brain disease. Acta Neuropathologica. 2013 126 (2): 161–177.
Parent J.M., Kron M.M. Neurogenesis and epilepsy. Jasper’s Basic Mechanisms of the Epilepsies [Internet]. 4th edition. Bethesda (MD): National Center for Biotechnology Information (US), 2012.
Pitkänen A., Immonen R. Epilepsy Related to Traumatic Brain Injury. Neurotherapeutics. 2014. 11 (2): 286–296.
Pitkänen A., Kyyriäinen J., Andrade P., Pasanen L., Ndode-Ekane X.E. Epilepsy After Traumatic Brain Injury. Models of Seizures and Epilepsy. Elsevier. 2017: 661–681.
Puntambekar S.S., Saber M., Lamb B.T., Kokiko-Cochran O.N. Cellular players that shape evolving pathology and neurodegeneration following traumatic brain injury. Brain, Behavior, and Immunity. 2018. 71: 9–17.
Rodgers K.M., Dudek F.E., Barth D.S. Progressive, Seizure-Like, Spike-Wave Discharges Are Common in Both Injured and Uninjured Sprague-Dawley Rats: Implications for the Fluid Percussion Injury Model of Post-Traumatic Epilepsy. Journal of Neuroscience. 2015. 35 (24).
Scholten A.C., Haagsma J.A., Cnossen M.C., Olff M., van Beeck E.F., Polinder S. Prevalence of and Risk Factors for Anxiety and Depressive Disorders after Traumatic Brain Injury: A Systematic Review. Journal of Neurotrauma. 2016. 33 (22): 1969–1994.
Simon D.W., McGeachy M.J., Bayır H., Clark R.S.B., Loane D.J., Kochanek P.M. The far-reaching scope of neuroinflammation after traumatic brain injury. Nature Reviews Neurology. 2017. 13 (3): 171–191.
Thompson H.J., LeBold D.G., Marklund N., Morales D.M., Hagner A.P., McIntosh T.K. Cognitive evaluation of traumatically brain-injured rats using serial testing in the Morris water maze. Restorative neurology and neuroscience. 2006. 24 (2): 109–114.
Thompson H.J., Lifshitz J., Marklund N., Grady M.S., Graham D.I., Hovda D.A., McIntosh T.K. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of neurotrauma. 2005. 22 (1): 42–75.
Vezzani A., Auvin S., Ravizza T., Aronica E. Glia-Neuronal Interactions in Ictogenesis and Epileptogenesis: Role of Inflammatory Mediators. Jasper’s Basic Mechanisms of the Epilepsies [Internet], 4th edition. Bethesda (MD): National Center for Biotechnology Information (US). 2012.
Wood R.L. Accelerated cognitive aging following severe traumatic brain injury: A review. Brain Injury. 2017. 31 (10): 1270–1278.
Zaninotto A.L., Vicentini J.E., Fregni F., Rodrigues P.A., Botelho C., de Lucia M.C.S., Paiva W.S. Updates and current perspectives of psychiatric assessments after traumatic brain injury: A systematic review. Frontiers in Psychiatry. 2016. 7: 1–14.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


