Физиология растений, 2023, T. 70, № 7, стр. 782-789
Определение комплекса полифенольных соединений в ягодах камчатской жимолости Lonicera caerulea var. kamtschatica Sevast
М. П. Разгонова a, *, Е. Н. Петруша b, Е. А. Русакова b, К. С. Голохваст c
a Федеральное государственное бюджетное научное учреждение “Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова”
Санкт-Петербург, Россия
b Федеральное государственное бюджетное научное учреждение
“Камчатский научно-исследовательский институт сельского хозяйства”
п. Сосновка, Камчатский край, Россия
c Федеральное государственное бюджетное учреждение науки
“Сибирский федеральный научный центр агробиотехнологий Российской академии наук”
п. Краснообск, Новосибирская область, Россия
* E-mail: m.razgonova@vir.nw.ru
Поступила в редакцию 22.09.2023
После доработки 03.11.2023
Принята к публикации 04.11.2023
- EDN: BFZLWQ
- DOI: 10.31857/S0015330323600791
Аннотация
Впервые проведен комплексный анализ полифенольных соединений в экстрактах ягод жимолости камчатской (Lonicera caerulea var. kamtschatica Sevast.). В работе использовали 5 образцов дикой жимолости и один сортообразец Елена из коллекции Камчатского научно-исследовательского института сельского хозяйства. Для идентификации целевых аналитов в экстрактах применяли тандемную масс-спектрометрию высокого разрешения. Идентифицировано 58 полифенольных соединений, соответствующих семейству Caprifoliaceae. К идентифицированным аналитам некоторые соединения были определены впервые: флавоны ‒ гидроксигенистеин, диосметин О-гексозид, хризоэриол-О-диглюкозид; флаванолы ‒ гербацетин, мирицетин, астрагаллин, таксифолин-О-гексозид, рамноцитрин; флаван-3-олы ‒ эпиафзелехин, эпикатехин-О-гексозид, димер эпигаллокатехин-эпикатехина; фенольные кислоты ‒ гидроксиферуловая кислота, гидроксиметокси диметилбензойная кислота, неохлорогеновая кислота, эллаговая кислота; стильбены ‒ пиносильвин, ресвератрол и многие другие полифенолы. Наиболее богатым по содержанию полифенольных соединений был сортообразец дикой формы № 5 – 23 полифенольных соединения, далее следует сортообразец Елена – 21 полифенольное соединение.
ВВЕДЕНИЕ
Жимолость камчатская (Lonicera caerulea var. kamtschatica Sevast.) – подвид голубых жимолостей, широко распространенный на Камчатке. В центральной и южной частях полуострова она произрастает большими массивами по несколько десятков гектаров. Основным местообитанием данного подвида являются лиственничные и березовые леса, разнотравные луга, заросли кустарников, каменистые осыпи, шикшевники, болота, кустарничковые тундры. Наилучшие условия для произрастания жимолости создаются в производных типах леса, измененных в результате деятельности человека – на вырубках, а также старых лесных гарях. В субальпийском поясе жимолость поднимается до высоты 980 м над уровнем моря [1, 2].
Плоды жимолости камчатской широко используются местным населением в свежем и переработанном виде. Несмотря на повсеместное произрастание жимолости на Камчатке в природе, данная культура с каждым годом получает все большее распространение в камчатском садоводстве. К наиболее ценным характеристикам жимолости относятся ее раннеспелость, что особенно важно для питания населения северных регионов в период витаминного дефицита после длительной зимы, а также высокие питательные и лечебно-профилактические свойства [3, 4].
Согласно результатам последних исследований, класс витаминов в плодах жимолости включает в себя аскорбиновую кислоту (в среднем до 44.4 мг %), каротин (провитамин А), тиамин, рибофлавин, фолиевую кислоту и Р-активные полифенолы (витамин Р). Присутствующие в плодах витамины С и Р усиливают действие друг друга, так как обладают синергизмом. К биологически активным полифенолам, содержащимся в плодах жимолости, относятся свободные катехины, антоцианы, рутин, хлорогеновая кислота. Доля растворимых сухих веществ в плодах составляет 12.8%. Высокая дегустационная оценка плодов жимолости и наличие сбалансированного гармоничного вкуса обусловлены высоким содержанием сахаров (8.5%) при сравнительно низкой кислотности (1.9–25%), а приятный аромат – наличием сложных эфиров лимонной и яблочной кислот. В свежих плодах жимолости определяются также диетические продукты – сорбит и инозит. В числе аминокислот присутствуют аспарагиновая, глютаминовая, аланиновая и лейцетиновая кислоты. В плодах жимолости содержатся такие макроэлементы, как калий, фосфор, кальций, натрий, магний, железо, кремний, и микроэлементы – медь, цинк, стронций, барий и йод [5, 6].
Пищевая ценность и лекарственные свойства жимолости камчатской позволяют широко использовать ее как функциональный природный растительный ресурс. Современные способы промышленной переработки дают возможность получать из ягод жимолости различные продукты, отличающиеся оригинальным вкусом и ароматом, а также насыщенным ярким цветом [7].
В качестве донора десертного кисло-сладкого вкуса, приятного аромата, крупноплодности, высокой зимостойкости и хорошей транспортабельности ягод жимолость камчатская широко используется в селекционных программах в различных регионах страны. [8]. Сорта, созданные на основе отборных форм жимолости камчатской, впервые были зарегистрированы в 1980 г. На Камчатке первый селекционный питомник на основе генетического материала дикорастущей жимолости был заложен в 1987 г. на базе Камчатского научно-исследовательского института сельского хозяйства, расположенного в п. Сосновка (Елизовский район). Почвенно-климатические условия данного района являются наиболее благоприятными для возделывания ягодных культур и в том числе жимолости.
В результате многолетней работы изучено около 4000 сеянцев из различных мест произрастания на территории края. В элиту выделены перспективные селекционно-значимые формы раннего и среднераннего сроков созревания, с высокой зимостойкостью, обладающие привлекательными неосыпающимися плодами десертного и кисло-сладкого вкуса с массой от 1.0 до 1.2 г, с содержанием аскорбиновой кислоты от 50.8 до 56.9 мг %, сухого вещества от 15.2 до 15.6%, сахаров от 7.8 до 10.5%, кислоты от 1.8 до 2.5%. Методом аналитической селекции созданы сорта Соперница-Горянка – сеянец жимолости алтайской от свободного опыления, Сластена, Атлант, Мильковчанка, Даринка, Елена – сеянцы жимолости камчатской от свободного опыления.
Исходным материалом для селекции послужили ягоды жимолости, отобранные в местах естественного произрастания культуры, расположенных в Юго-Восточной и Центральной зонах Камчатки: окрестности г. Петропавловск-Камчатский, г. Елизово, п. Сосновка, с. Раздольное, с. Мильково и др. Административно данные пункты относятся к Елизовскому, Мильковскому, Быстринскому и Усть-Камчатскому районам края. На сегодняшний день селекционный материал планомерно обновляется, закладываются новые питомники, в изучении находится более 500 сеянцев дикорастущих форм посадки 2018–2022 гг. В июле–августе 2023 г. с целью сбора генетического материала была предпринята обширная экспедиция, в результате которой обследованы новые локалитеты во всех основных районах произрастания подвида и отобрана 51 форма жимолости камчатской для закладки новых селекционных питомников.
Целью данной работы является анализ содержания фенольных соединений в ягодах жимолости камчатской пяти дикорастущих образцов и сорта Елена, зарегистрированного в коллекции Камчатского научно-исследовательского института сельского хозяйства. Начальный метаболомный анализ показал наличие 58 соединений полифенольной группы, обнаруженных в экстрактах представленных видов жимолости.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. В качестве объекта исследований использовались шесть сортообразцов жимолости камчатской (Lonicera caerulea var. kamtschatica Sevast.). Экстракты сортообразцов ягод, использованных в эксперименте: № 1–5 ‒ дикие формы жимолости (табл. 1); сорт Елена, зарегистрирован в коллекции Камчатского научно-исследовательского института сельского хозяйства. Все образцы собраны в июле 2023 г. и хранились в морозильной камере при температуре ‒15°С не более недели до начала экспериментов. Все образцы соответствовали морфологическим стандартам Фармакопеи Евразийского экономического союза [9].
Таблица 1.
Места сбора диких форм жимолости камчатской (Lonicera caerulea var. kamtschaticka)
| № образца | Местонахождение | Географические координаты |
|---|---|---|
| 1 | Полуостров Камчатка, район Быстринский, подножие горы Оленгендэ | 541 м над ур. м.; 55°9′15.848″ N 158°71′68.477″ E |
| 2 | Полуостров Камчатка, район Елизовский, окрестности п. Вулканный | 11 м над ур. м.; 53°6′49.618″ N 158°23′10.430″ E |
| 3 | Там же | 21 м над ур. м.; 53°6′50.848″ N 158°23′2.915″ E |
| 4 | Там же | 19 м над ур. м.; 53°6′50.910″ N 158°23′2.722″ E |
| 5 | Там же | 16 м над ур. м.; 53°6′49.974″ N 158°23′10.331″ E |
Дробная мацерация. Для получения высококонцентрированных экстрактов была применена дробная мацерация. Для мацерационного анализа было отобрано по 50 г ягод каждого сортообразца (сорт Елена и пять форм дикорастущей жимолости), при этом общее количество экстрагента (этилового спирта) разделено на 3 части и последовательно настояно на ягодах. Время настаивания каждой части экстрагента составляло 7 дней.
Высокоэффективная жидкостная хроматография. Для разделения многокомпонентных смесей использовался жидкостный хроматограф высокого давления Shimadzu LC-20 Prominence HPLC (Shimadzu, Япония), оборудованный UV-детектором и обратнофазной колонкой Shodex ODP-40 4E (250 × 4.6, размер частиц 4 мкм). Элюировали в градиенте от воды к ацетонитрилу (А, %): 0–4 мин – 0% А; 4-60 мин – 25% А; 60–75 мин – 100% А; 75–120 мин – 100% А, скорость потока 0.5 мл/мин. ВЭЖХ-анализ проведен при помощи UV-VIS-детектора SPD-20A (Kanda-Nishikicho 1-chrome, Shimadzu, Chiyoda-ku, Tokio, Япония) при длинах волн 230 и 330 ηм, температура 50°С. Объем загрузочной петли составлял 200 мкл.
Тандемная масс-спектрометрия. Жидкостный хроматограф высокого давления при прохождении экспериментов был сопряжен с ионной ловушкой amaZon SL в онлайн-режиме. Масс-спектрометрические данные получены с помощью ионной ловушки amaZon SL (Bruker Daltoniks, Германия), оснащенной источником ионизации электрораспылением ESI в режимах отрицательных и положительных ионов. Оптимизированные параметры получены следующим образом: температура источника ионизации ‒ 70°С, поток газа ‒ 8 л/мин, газ-небулайзер (распылитель) ‒ 7.3 psi, капиллярное напряжение ‒ 4500 В, напряжение на изгибе торцевой пластины ‒ 1500 В, фрагментатор ‒ 280 В, энергия столкновения ‒ 60 eV. Масс-спектрометр использовался в диапазоне сканирования m/z 100 – 1.700 для MС и МС/МС. Произведена фрагментация 4 порядка.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Уточнение метаболомного состава растительных матриц – чрезвычайно важный результат в системе биохимического анализа. В данной работе был использован метод ВЭЖХ-MС/MС (ВЭЖХ, сопряженный онлайн с МС источником электрораспыления) и анализом фрагментированных ионов. Масс-спектрометрические данные регистрировались на ионной ловушке AMAZON SL Bruker Daltoniks, оснащенной источником ESI в режиме отрицательных/положительных ионов. Использовалось 4-ступенчатое фрагментирование ионов.
Идентификация химических компонентов проводилась путем сравнения их индекса удерживания, масс-спектров и фрагментации МС с базой данных домашней библиотеки, созданной Группой биотехнологий, биоинженерии и пищевых систем “Передовые инженерные школы” Дальневосточного федерального университета (Россия) на основе данных других спектроскопических методов, таких как ядерный магнитный резонанс, ультрафиолетовая спектроскопия и МС, а также сравнения полученных экспериментальных данных с известными научными результатами, опубликованными в открытой научной литературе, которые постоянно обновляются и пересматриваются. Для простоты идентификации составлена унифицированная системная таблица молекулярных масс целевых аналитов, выделенных из экстрактов плодов L. caerulea var. kamtschatica (табл. 1, Дополнительные материалы). 58 полифенольных соединений, представленных в ней, охватывают практически все классы полифенольных соединений: флавоны, флаванолы, флаван-3-олы, гидроксибензойные и гидроксикоричные кислоты, стильбены, танины, кумарины, лигнаны и т.д.
Несколько соединений было обнаружено впервые в ягодах данного вида жимолости. Это флавоны: гидроксигенистеин, диосметин-О-гексозид, хризоэриол-О-диглюкозид; флаванолы: гербацетин, мирицетин, астрагаллин, таксифолин-О-гексозид, рамноцитрин; флаван-3-олы: эпиафзелехин, эпикатехин-О-гексозид, эпигаллокатехин-эпикатехин димер; фенольные кислоты: гидроксиферуловая кислота, гидроксиметоксидиметилбензойная кислота, неохлорогеновая кислота, эллаговая кислота; стильбены пиносильвин, ресвератрол и многие другие полифенолы. На рис. 1 и 2 представлены масс-спектры идентифицированных полифенольных химических соединений, полученные в результате экспериментов. Масс-спектр флавонола мирицетина из экстракта L. caerulea var. kamtschatica (дикая форма № 3) представлен на рис. 2. [M + H]+ ион продуцирует два фрагментарных иона с m/z 219.13 и m/z 273.09 (рис. 1). Далее дочерний ион с m/z 219.13 продуцирует ион с m/z 191.12. Это соединение в научной литературе по масс-спектрометрии идентифицировано как флавонол мирицетин в следующих растительных матрицах: андская голубика [15], клюква крупноплодная (Vaccinium macrocarpon) [19] и ферокактус голубеющий (Ferocactus glaucescens) [11].
Рис. 1.
Масс-спектры мирицетина из экстракта ягод жимолости камчатской (Lonicera caerulea var. kamtschatica), дикая форма № 3. Вверху ‒ МС-скан в диапазоне 100–1700 m/z, внизу ‒ спектры фрагментации (сверху вниз): МС2 протонированного иона мирицетина (319.19 m/z, красный ромб), МС3 фрагмента 319.19 → 219.13 m/z и МС4 фрагмента 319.19 → 219.13 → 191.12 m/z.
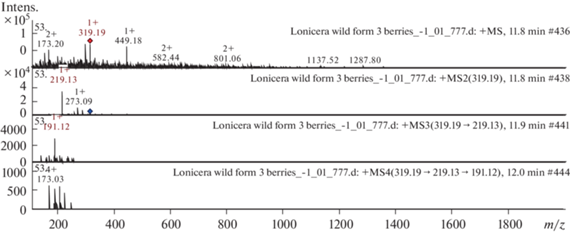
Рис. 2.
Масс-спектры сирингарезинола из экстракта ягод жимолости камчатской (Lonicera caerulea var. kamtschatica), сортообразец Елена. Вверху ‒ МС-скан в диапазоне 100–1700 m/z, внизу ‒ спектры фрагментации (сверху вниз): МС2 протонированного иона сирингарезинола (419.15 m/z, красный ромб), МС3 фрагмента 419.15 → 326.109 m/z и МС4 фрагмента 419.15 → 326.09 → 298.08 m/z.
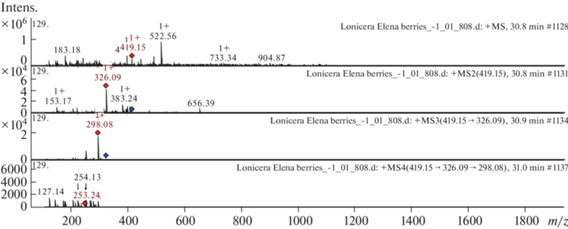
Масс-спектр лигнана сирингарезинола из экстракта L. caerulea var. kamtschatica (сорт Елена) представлен на рис. 2. [M + H]+ ион продуцирует три фрагментарных иона при m/z 326.09, m/z 383.24, и m/z 153.17. Фрагментарный ион при m/z 326.09 порождает один дочерний ион при m/z 298.08. Данный фрагментарный ион продуцирует в свою очередь два дочерних иона при m/z 253.24 и m/z 127.14. Это соединение идентифицировано в научной литературе как лигнан сирингарезинол в экстрактах магнолии [40].
На рис. 3 представлена диаграмма Венна, ярко показывающая совпадения и расхождения по полифенольному составу 5 диких форм L. caerulea var. kamtschatica и сорта Елена. В табл. 2 показаны различия и совпадения по полифенольному составу в анализируемых экстрактах 5 диких форм жимолости и сорта Елена. Анализ данных показывает, что все 6 образцов показали абсолютное совпадение по следующим полифенольным соединениям: Kaempferol и Luteolin-7-O-glucoside. Наиболее богатым по содержанию полифенольных соединений показал себя сортообразец дикой формы № 5 – 23 соединения, далее следует сортообразец Елена – 21 соединение, и в порядке убывания: дикая форма № 1 – 19 соединений, дикая форма № 3 – 13 соединений, дикая форма № 4 – 12 соединений, дикая форма № 2 – 11 соединений. Наибольшее несовпадение по полифенольному составу с остальными представленными в эксперименте образцами показали сортообразец Елена - 13 соединений и дикая форма № 5 – 9 соединений.
Рис. 3.
Диаграмма Венна, показывающая расхождения по полифенольному составу ягод разных форм жимолости камчатской (Lonicera caerulea var. kamtschatica).
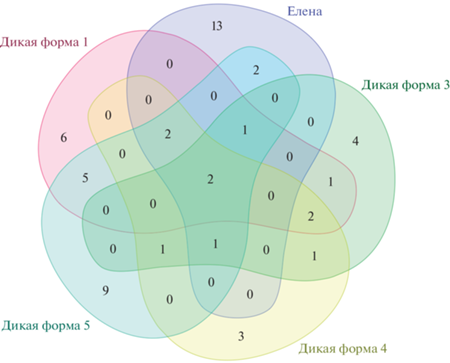
Таблица 2.
Распределение полифенольного состава в экстрактах ягод сортообразца Елена и диких форм (№ 1–5) жимолости камчатской (Lonicera caerulea var. kamtschatica)
| Сортообразцы | Количество совпавших соединений | Совпадения по химическим соединениям |
|---|---|---|
| Дикая форма 1, 2, 3, 4, 5, сорт Елена | 2 | Kaempferol; Luteolin 7-O-glucoside |
| Дикая форма 1, 2, 3, 5, сорт Елена | 1 | Ellagic acid |
| Дикая форма 1, 2, 4, 5, сорт Елена | 1 | Peonidin-3-O-glucoside |
| Дикая форма 1, 4, 5, сорт Елена | 1 | Kaempferol 3-O-rutinoside |
| Дикая форма 3, 4, 5, сорт Елена | 1 | (Epi)-catechin |
| Дикая форма 1, 2, 3, 4 | 1 | Herbacetin |
| Дикая форма 1, 3, 4 | 1 | (Epi)-afzelechin derivative |
| Дикая форма 2, 3, 4 | 1 | Kaempferol-3-O-hexoside |
| Дикая форма 3, 4, 5 | 1 | Myricetin |
| Дикая форма 5, сорт Елена | 2 | Hydroxyferulic acid; Quercetin |
| Дикая форма 1, 3 | 1 | 3,4-Dihydroxyhydrocinnamic acid |
| Дикая форма 1, 5 | 5 | Kaempferol derivative; Delphinidin 3-O-β-D-sambubioside; Caffeoylquinic acid derivative; Proanthocyanidin B1; Taxifolin-3-O-hexoside |
| Дикая форма 2, 3 | 1 | (Epi)-catechin derivative |
| Сорт Елена | 13 | Rutin; Phloretin; Syringaresinol; Hydroxy methoxy dimethylbenzoic acid; Rhamnocitrin; Chlorogenic acid; Pinosylvin; Diosmetin O-hexoside; Kaempferol-3,7-Di-O-glucoside; Delphinidin; p-Coumaroylquinic acid; Dihydroxy-tetramethoxy(iso)flavone; 2'-Hydroxygenistein |
| Дикая форма 1 | 6 | Delphinidin 3-acetylglucoside; Chrysoeriol O-diglucoside; Epiafzelechin; 4-Methylesculetin; Resveratrol; Fraxetin |
| Дикая форма 2 | 3 | Catechin; Astragalin; Quercetin pentosyl hexoside hexoside |
| Дикая форма 3 | 3 | Protocatechuic acid; (Epi)-catechin derivative2; Petunidin |
| Дикая форма 4 | 3 | Proanthocyanidin B-type; Cyanidin-3-O-rutinoside; Di-O-galloyl-HHDP-glucose |
| Дикая форма 5 | 9 | (Epi) gallocatechin-(epi) catechin dimer; Isorhamnetin 3-O-6"-O-rhamnosyl-hexoside; 2,3,4,5,6-pentahydroxybenzoic acid; (epi)Catechin O-hexoside; Quercetin deoxyhexosyl deoxyhexosyl hexoside; Ferulic acid-O-hexoside derivative; Dicaffeoyl shiikimic acid; Neochlorogenic acid; Feruloyl-O-p-coumaroyl-O-caffeoylshikimic acid |
Таким образом, результаты эксперимента показали, что ягоды жимолости камчатской содержат большое количество полифенольных соединений и других биологически активных субстанций. В данной работе нами впервые проведено метаболомное исследование образцов жимолости L. caerulea var. kamtschatica, полученной как из диких образцов зон произрастания данного растения, так и из окультуренного сортообразца Елена. Результаты исследований показали присутствие 58 соединений полифенольного класса, соответствующих семейству Caprifoliaceae. В добавление к обнаруженным целевым соединениям некоторые соединения были идентифицированы впервые в данных сортообразцах жимолости, в их числе, флавоны: гидроксигенистеин, диосметин-О-гексозид, хризоэриол-О-диглюкозид; флаванолы: гербацетин, мирицетин, астрагаллин, таксифолин-О-гексозид, рамноцитрин; флаван-3-олы: эпиафзелехин, эпикатехин-О-гексозид, димер эпигаллокатехин-эпикатехина; фенольные кислоты: гидроксиферуловая кислота, неохлорогеновая кислота, эллаговая кислота; стильбены пиносильвин, ресвератрол и многие другие полифенолы. Наиболее богатым по содержанию полифенольных соединений был сортообразец дикой формы № 5 – 23 полифенольных соединения, далее следует сортообразец Елена – 21 полифенольное соединение. Полученные результаты свидетельствуют о том, что для дальнейшей селекции могут быт крайне интересны как дикие формы L. caerulea var. kamtschatica, так и уже окультуренные образцы. Необходимо дальнейшее более подробное изучение состава L. caerulea var. kamtschatica как по полифенольным группам, так и по соединениям других химических классов. Полученные данные могут поддержать будущие исследования по производству различных фармацевтических и диетических добавок, содержащих экстракты L. caerulea. Широкий спектр биологически активных соединений дает большие возможности для создания новых пищевых и биологически активных добавок на основе экстрактов из семейства Caprifoliaceae.
Исследование выполнено в Федеральном государственном бюджетном научном учреждение “Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова”, за счет средств гранта Российского научного фонда № 23-74-00044.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Гидзюк И.К. Синеплодная садовая жимолость. Томск: Издательство Томского университета, 1978. 153 с.
Якубов В.В., Чернягина О.А. Каталог флоры Камчатки (сосудистые растения). Петропавловск-Камчатский: Камчатпресс, 2004. 165 с.
Ильин В.С. Жимолость синяя // Помология. В пяти томах. Том V. Земляника. Малина. Орехоплодные и редкие культуры. Орел: ВНИИСПК, 2014. 587 с.
Петруша Е.Н. Хозяйственно-биологическая характеристика новых сортов жимолости селекции Камчатского НИИСХ // Плодоводство и ягодоводство России. 2019. Т. 58. С. 273. https://doi.org/10.31676/2073-4948-2019-58-273-278
Петруша Е.Н. Изучение основных биохимических компонентов жимолости Камчатского края // Вестник Российской сельскохозяйственной науки. 2021. № 4. С. 32. https://doi.org/10.30850/vrsn/2021/4/32-34
Соловьева Т.А., Петруша Е.Н. Жимолость на Камчатке. Петропавловск-Камчатский: Камчатпресс, 2004. 48 с.
Куклина А.Г., Сорокопудов В.Н., Упадышев М.Т. Сорокопудова О.А., Прищепина Г.А. Состояние и перспективы селекции жимолости синей // Вестник Pоссийской сельскохозяйственной науки. 2017. № 5. С. 41.
Софронов А.П., Фирсова С.В., Головунин В.П. Жимолость синяя (Lonicera caeruleae L.): технология и селекция. Киров: ФГБНУ ФАНЦ Северо-Востока, 2021. 64 с.
Фармакопея Евразийского экономического союза. Утверждена решением коллегии Евразийской экономической комиссии от 1 августа 2020 г. № 100.
Wojakowska A., Piasecka A., Garcia-Lopez P.M., Zamora-Natera F., Krajewski P., Marczak L., Kachlicki P., Stobiecki M. Structural analysis and profiling of phenolic secondary metabolites of Mexican lupine species using LC–MS techniques // Phytochem. 2013. V. 92. P. 71. https://doi.org/10.1016/j.phytochem.2013.04.006
Hamed A.R., El-Hawary S.S., Ibrahim R.M., Abdelmohsen U.R., El-Halawany A.M. Identification of chemopreventive components from halophytes belonging to Aizoaceae and Cactaceae through LC/MS – bioassay guided approach // J. Chrom. Sci. 2021. V. 59. P. 618. https://doi.org/10.10193/chromsci/bmaa112
Abeywickrama G., Debnath S.C., Ambigaipalan P., Shahidi F. Phenolics of selected cranberry genotypes (Vaccinium macrocarpon Ait.) and their antioxidant efficacy // J. Agr. Food Chem. 2016. V. 64. P. 9342. https://doi.org/10.1021/acs.jafc.6b04291
Jaiswal R., Muller H., Muller A., Karar M.G.E., Kuhnert N. Identification and characterization of chlorogenic acids, chlorogenic acid glycosides and flavonoids from Lonicera henryi L. (Caprifoliaceae) leaves by LC-MSn. // Phytochem. 2014. V. 108. P. 252. https://doi.org/10.1016/j.phytochem.2014.08.023
Cai Z., Wang C., Zou L., Liu X., Chen J., Tan M., Mei Y., Wei L. Comparison of multiple bioactive constituents in the flower and the caulis of Lonicera japonica Based on UFLC-QTRAP-MS/MS combined with multivariate statistical analysis // Molecules. 2019. V. 24. P. 1936. https://doi.org/10.3390/molecules24101936
Aita S.E., Capriotti A.L., Cavaliere C., Cerrato A., Giannelli Moneta B., Montone C.M., Piovesana S., Lagana A. Andean blueberry of the genus Disterigma: a high-resolution mass spectrometric approach for the comprehensive characterization of phenolic compounds // Separations. 2021. V. 8. P. 58. https://doi.org/10.3390/separations8050058
Zhao Y., Lu H., Wang Q., Liu H., Shen H., Xu W., Ge J., He D. Rapid qualitative profiling and quantitative analysis of phenolics in Ribes meyeri leaves and their antioxidant and antidiabetic activities by HPLC-QTOF-MS/MS and UHPLC-MS/MS // J. Sep. Sci. 2021. V. 44. P. 1404. https://doi.org/10.1002/jssc.202000962
Li X., Tian T. Phytochemical characterization of Mentha spicata L. under differential dried-conditions and associated nephrotoxicity screening of main compound with organ-on-a-chip // Front. Pharmacol. 2018. V. 9: 1067. https://doi.org/10.3389/fphar.2018.01067
Pandey R., Kumar B. HPLC–QTOF–MS/MS-based rapid screening of phenolics and triterpenic acids in leaf extracts of Ocimum species and their interspecies variation // J. Liq. Chromatogr. Relat. Technol. 2016. V. 39. P. 225. https://doi.org/10.1080/10826076.2016.1148048
Rafsanjany N., Senker J., Brandt S., Dobrindt U., Hensel A. In vivo consumption of cranberry exerts ex vivo antiadhesive activity against fimH-dominated uropathogenic Escherichia coli: a combined in vivo, ex vivo, and in vitro study of an extract from Vaccinium macrocarpon // J. Agric. Food Chem. 2015. V. 63. P. 8804. https://doi.org/10.1021/acs.jafc.5b03030
Ieri F., Martini S., Innocenti M., Mulinacci N. Phenolic distribution in liquid preparations of Vaccinium myrtillus L. and Vaccinium vitis idaea L. // Phytochem. Anal. 2013. V. 24. P. 467. https://doi.org/10.1002/pca.2462
Abu-Reidah I.M., Ali-Shtayeh M.S., Jamous R.M., Arraes-Roman D., Segura-Carretero A. HPLC–DAD–ESI-MS/MS screening of bioactive components from Rhus coriaria L. (Sumac) fruits // Food Chem. 2015. V. 166. P. 179. https://doi.org/10.1016/j.foodchem.2014.06.011
Mena P., Calani L., Dall’Asta C., Galaverna G., Garcia-Viguera C., Bruni R., Crozier A., Del Rio D. Molecules. 2012. V. 17. P. 14821. https://doi.org/10.3390/molecules171214821
Burgos-Edwards A., Jimenez-Aspee F., Theoduloz C., Schmeda-Hirschmann G. Colonic fermentation of polyphenols from Chilean currants (Ribes spp.) and its effect on antioxidant capacity and metabolic syndrome-associated enzymes // Food Chem. 2018. V. 30. P. 144. https://doi.org/10.1016/j.foodchem.2018.03.053
Yin N.-W., Wang S.-X., Jia L.-D., Zhu M.-C., Yang J., Zhou B.-J., Yin J.-M., Lu K., Wang R., Li J.-N., Qu C.-M. Identification and characterization of major constituents in different-colored rapeseed petals by UPLC−HESI-MS/MS // Agric. Food Chem. 2019. V. 67. P. 11053. https://doi.org/10.1021/acs.jafc.9b05046
Ismail W.M., Ezzat S.M., Aliaa E.M.K., El-Mosallamy, Kadriya S., El Deeb, El-Fishawy A.M. In vivo antihypertensive activity and UHPLC-Orbitrap-HRMS profiling of Cuphea ignea A. DC. // ACS omega. 2022. V. 7. P. 46524. https://doi.org/10.1021/acsomega.2c05356
Liu P., Lindstedt A., Markkinen N., Sinkkonen J., Suomela J., Yang B. Characterization of metabolite profiles of leaves of bilberry (Vaccinium myrtillus L.) and lingonberry (Vaccinium vitis-idaea L.) // J. Agric. Food Chem. 2014. V. 62. P. 12015. https://doi.org/10.1021/jf503521m
Razgonova M.P., Tekutyeva L.A., Podvolotskaya A.B., Stepochkina V.D., Zakharenko A.M., Golokhvast K.S. Zostera marina L. supercritical CO2-extraction and mass spectrometric characterization of chemical constituents recovered from seagrass // Separations. 2022. V. 9. P. 182. https://doi.org/10.3390/separations9070182
Flamini R. Recent applications of mass spectrometry in the study of grape and wine polyphenols // Int. Sch. Res. Notices. 2013. Article ID 813563. https://doi.org/10.1155/2013/813563
Chen Y., Cai X., Li G., He X., Yu X., Yu X., Xiao Q., Xiang Z., Wang C. Chemical constituents of radix Actinidia chinensis planch by UPLC–QTOF–MS // Biomed. Chromatogr. 2021. V. 35:e5103. https://doi.org/10.1002/bmc.5103
Singh J., Kumar S., Rathi B., Bhrara K., Chhikara B.S. Therapeutic analysis of Terminalia arjuna plant extracts in combinations with different metal nanoparticles // J. Mater. NanoSci. 2015. V. 2. P. 1.
Ruiz A., Hermosin-Gutierrez I., Vergara C., von Baer D., Zapata M., Hitschfild A., Obando L., Mardones C. Anthocyanin profiles in south Patagonian wild berries by HPLC-DAD-ESI-MS/MS // Food Res. Int. 2013. V. 51. P. 706. https://doi.org/10.1016/j.foodres.2013.01.043
Fermo P., Comite V., Sredojevic M., Ciric I., Gasic U., Mutic J., Baosic R., Tesic Z. Elemental analysis and phenolic profiles of selected Italian wines // Foods. 2021. V. 10. P. 158. https://doi.org/10.3390/foods10010158
Ruiz A., Hermosin-Gutierrez I., Mardones C., Vergara C., Herlitz E., Vega M., Dorau C., Winterhalter P., von Baer D. Polyphenols and antioxidant activity of calafate (Berberis microphylla) fruits and other native berries from Southern Chile // Agric. Food Chem. 2010. V. 51. P. 706. https://doi.org/10.1021/jf100173x
Zengin G., Mahomoodally M.F., Sinan K.I., Ak G., Etienne O.K., Sharmeen J.B., Brunetti L., Leone S., Di Simone S.C., Recinella L., Chiavaroli A. Chemical composition and biological properties of two Jatropha species: different parts and different extraction methods // Antioxidants. 2021. V. 10. P. 792. https://doi.org/10.3390/antiox10050792
Razgonova M.P., Bazhenova B.B., Zabalueva Y.Y., Burkhanova A.G., Zakharenko A.M., Kupriyanov A.N., Sabitov A.S., Ercisli S., Golokhvast K.S. Rosa davurica Pall., Rosa rugosa Thumb., and Rosa acicularis Lindl. originating from Far Eastern Russia: Screening of 146 chemical constituents in tree species of the genus Rosa // Applied Sci. 2022. V. 12: 9401. https://doi.org/10.3390/app12199401
Bujor O.-C. Extraction, identification and antioxidant activity of the phenolic secondary metabolites isolated from the leaves, stems and fruits of two shrubs of the Ericaceae family. PhD THESIS. 2016. https://theses.hal.science/tel-01722698/
Said R.B., Hamed A.I., Mahalel U.A., Al-Ayed A.S., Kowalczyk M., Moldoch J., Oleszek W., Stochmal A. Tentative characterization of polyphenolic compounds in the male flowers of Phoenix dactylifera by liquid chromatography coupled with mass spectrometry and DFT // Int. J Mol. Sci. 2017. V. 18: 512. https://doi.org/10.3390/ijms18030512
Ekeberg D., Flate P.-O., Eikenes M., Fongen M., Naess-Andresen C.F. Qualitative and quantitative determination of extractives in heartwood of Scots pine (Pinus sylvestris L.) by gas chromatography // J. Chromatogr. A 2006. V. 1109. P. 267. https://doi.org/10.1016/j.chroma.2006.01.027
Zhu X.X., Yang L., Li Y.J., Zhang D., Chen Y., Kostecka P., Kmonickova E., Zidek Z. Effects of sesquiterpene, flavonoid and coumarin types of compounds from Artemisia annua L. on production of mediators of angiogenesis // Pharmacol. Rep. 2013. V. 65. P. 410.
Guo K., Tong C., Fu Q., Xu J., Shi S., Xiao Y. Identification of minor lignans, alkaloids, and phenylpropanoid glycosides in Magnolia officinalis by HPLC-DAD-QTOF-MS/MS // J. Pharm. Biomed. Anal. 2019. V. 170. P. 153. https://doi.org/10.1016/j.jpba.2019.03.044
Дополнительные материалы
- скачать ESM.zip
- Приложение 1.
Таблица 1. Полифенольные соединения, идентифицированные в экстрактах ягод Lonicera caerulea var. kamtschatica
Инструменты
Физиология растений


