Физиология растений, 2022, T. 69, № 5, стр. 490-500
Рост и стрессоустойчивость волосовидных корней табака с конститутивной экспрессией гена ARGOS-LIKE
Х. Г. Мусин a, *, Г. Р. Гумерова a, Э. А. Баймухаметова a, Б. Р. Кулуев a
a Институт биохимии и генетики – обособленное структурное подразделение Федерального государственного бюджетного научного учреждения Уфимский федеральный исследовательский центр Российской академии наук
Уфа, Россия
* E-mail: khalit.musin@yandex.ru
Поступила в редакцию 28.12.2021
После доработки 24.02.2022
Принята к публикации 03.03.2022
- EDN: WEHRET
- DOI: 10.31857/S0015330322050153
Аннотация
Гены семейства ARGOS у растений играют важную роль в контроле размера органов, а также участвуют в регуляции роста растений при действии стрессовых факторов. Механизмы стрессоустойчивости растений с конститутивной экспрессией генов ARGOS остаются малоизученными. Волосовидные (бородатые) корни растений (hairy roots) могут быть использованы в качестве модельного объекта для исследования функций генов, поскольку эти корни сохраняют многие морфофизиологические особенности, характерные для нативных корней. Нами были получены волосовидные корни табака Nicotiana tabacum L. с конститутивной экспрессией гена ARGOS-LIKE Arabidopsis thaliana L. Генетически трансформированные корни набирали большую сырую и сухую массу по сравнению с контролем, как при нормальных условиях, так и при действии засоления, высоких температур и ацетата кадмия. В исследованных культурах трансгенных волосовидных корней, как при нормальных, так и при стрессовых условиях была повышена активность аскорбатпероксидаз, увеличен глутатионовый пул, а также содержание пролина. Таким образом, продукт гена ARGOS-LIKE оказывает свой позитивный эффект на продуктивность и стрессоустойчивость растений не только за счет стимуляции роста, но и за счет влияния на антиоксидантную систему.
ВВЕДЕНИЕ
Гены семейства ARGOS часто рассматриваются как подходящие мишени для повышения продуктивности и стрессоустойчивости растений [1]. Эта группа генов кодирует небольшие трансмембранные белки с доменом OSR (Organ Size Related), расположенные на эндоплазматическом ретикулуме, аппарате Гольджи [1] и на плазмалемме [2]. Только четыре гена этого семейства были идентифицированы у Arabidopsis thaliana: ARGOS, ARGOS-LIKE (ARL), OSR1 и OSR2 [1, 3, 4]. Экспрессия гомологов гена ARGOS, как в гомологичных, так и в гетерологичных условиях способствовала значительному увеличению размера органов трансгенных растений [2–5]. Экспрессия белков с доменом OSR наиболее интенсивна в молодых растущих органах и регулируется в основном ауксинами и этиленом [3, 4, 6, 7]. Конститутивная экспрессия белков с доменом OSR способствовала повышению уровня содержания транскриптов генов, кодирующих факторы транскрипции AINTEGUMENTA, AtGRF1 и AtGIF1, циклины CYCD3;1, ксилоглюканэндотрансгликозилазы (XTHs) AtXTH22, NtEXGT и PtrXTH, экспансины AtEXPA10 и NtEXPA5 [3, 5, 7, 8]. Белки, кодируемые этими генами, участвуют в регуляции роста растений, влияя как на деление клеток, так и на рост клеток растяжением.
Дальнейшие исследования показали, что гены семейства ARGOS кодируют белки, действующие как негативные регуляторы передачи сигналов этилена. Обратная корреляция между уровнем экспрессии генов ARGOS и чувствительностью к этилену наблюдалась, как у A. thaliana [6], так и у кукурузы [1]. Было показано, что белок ARGOS1 и рецепторы этилена имеют одинаковую локализацию [6]. ARGOS1 активирует рецепторы этилена через белки RTE и RTL и блокирует передачу сигналов этилена даже в присутствии этого гормона [1]. Также есть данные об участии генов семейства ARGOS в стрессовых реакциях. Полевые эксперименты показали, что этилен увеличивает уровень экспрессии гена ARGOS8 в кукурузе и увеличивает ее урожай, как в засушливых, так и в обычных условиях [1]. Уровень экспрессии гена TaARGOS-D мягкой пшеницы увеличивался в ответ на засуху и засоление, а растения A. thaliana со сверхэкспрессией этого гена демонстрировали повышенную стрессоустойчивость [9].
Ранее нами были созданы трансгенные растения табака с конститутивной экспрессией гена ARGOS-LIKE (ARL) A. thaliana под контролем промотора вируса мозаики георгина [10]. Эти растения продемонстрировали увеличение длины листьев и стебля на 10‒25% по сравнению с диким типом. Мы предположили, что создание волосовидных корней (ВК), несущих ген ARL так же может увеличить их размеры, что благоприятно скажется на продуктивности корней, а возможно, и стрессоустойчивости. Поэтому целью данного исследования было создание ВК с конститутивной экспрессией гена ARL и анализ их продуктивности, стрессоустойчивости и состояния антиоксидантной системы.
ВК (hairy roots) – природный феномен, обусловленный генетической трансформацией растений агробактериями вида Agrobacterium rhizogenes (Rhizobium rhizogenes) [11]. Ri-плазмида A. rhizogenes кодирует генный локус rol (англ. root locus), содержащий гены rolA, rolB и rolC (иногда еще и rolD), которые встраиваются в геном клетки-хозяина. Такая генетическая трансформация может вызвать обильное образование сильно разветвленных ВК на месте заражения. Эти корни представляют собой генетически трансформированные органы растений, способные к неограниченному росту на безгормональных питательных средах. ВК – это перспективные продуценты ценных вторичных метаболитов, а также рекомбинантных белков [12]. Из-за большой практической значимости культур ВК для биотехнологии, повышение их продуктивности и стрессоустойчивости является актуальной задачей, что может быть достигнуто путем использования генов семейства ARGOS.
МАТЕРИАЛЫ И МЕТОДЫ
Создание трансгенных растений и ВК табака с конститутивной экспрессией гена ARL
Для генетической трансформации были использованы растения табака Nicotiana tabacum L. сорта Petit Havana линии SR1. При создании трансгенных растений использовали метод агробактериальной трансформации листовых дисков и бинарный вектор pCambia 1301, содержащий ген гигромицинфосфотрансферазы (HPT) и целевой ген ARL под контролем промотора вируса мозаики георгина (DMVPr). Создание целевых генно-инженерных конструкций и трансгенных растений табака подробно описаны нами ранее [10]. Трансгенность полученных растений и ВК доказывалась при помощи ПЦР-анализа на наличие целевого (ARL), селективного (HPT) и репортерного (uidA) генов с использованием праймеров, представленных в дополнительных материалах (табл. 1 ). Уровень содержания транскриптов, а соответственно экспрессию встроенного гена, изучали с помощью полуколичественного ОТ-ПЦР, последовательности праймеров для которой так же приведены в дополнительных материалах (табл. 1 ).
Для создания культур ВК семена трансгенных растений табака DMVPr::ARL поколения T2 с единичной копией трансгена стерилизовали в 75% этиловом спирте (~30 сек) и в 2.5% гипохлорите натрия (~5 мин), после чего промывали стерильной дистиллированной водой 5 раз и высаживали в чашки Петри с селективной (200 мг/л антибиотика гигромицина), твердой (7 г/л агара) питательной средой МС (50% от стандартной концентрации солей МС, 14 г/л сахарозы, 60 мг/л инозитола, 2 мг/глицина, 1 мг/л тиамина и 1 мг/л никотиновой кислоты). Спустя 20 дней проростки одинаковых размеров, не имеющих морфологических аномалий, высаживали в смесь почвы и вермикулита (3 : 1 соответственно). Растения выращивали в вегетационных сосудах объемом 500 мл при температуре воздуха +24±1°С, освещенности 120 мкмоль/м2 с и фотопериоде 16 ч.
Культуры ВК были созданы из листовых эксплантов двухмесячных растений при помощи A. rhizogenes штамма А4. Агробактерии предварительно выращивали на жидкой селективной среде LB (100 мг/л рифампицина). Экспланты листьев табака стерилизовали с использованием 75% этилового спирта (~1 мин) и 2% гипохлорита натрия (~8 мин). Совместное культивирование листовых эксплантов и агробактерий проводили на твердой (7 г/л агара) среде МС (стандартная концентрация солей МС, 28 г/л сахароза, 120 мг/л инозитола, 2 мг/л глицина, 1 мг/л тиамина и 1 мг/л никотиновой кислоты) в течении трех суток при температуре +26°С, после чего листовые экспланты были перенесены на твердую среду МС, содержащую антибиотик (100 мг/л цефотаксима). Все образованные на эксплантах ВК фрагменты длиной по 1.5‒2 см помещались в отдельные чашки Петри со средой МС и содержались при температуре воздуха +24 ± 1°С, в темноте. Была проведена предварительная селекция, для отбора наиболее активно и стабильно растущих корней. После двух месяцев культивации на селективной среде МС фрагменты ВК вместе с апикальной меристемой (~1‒2 см длиной), были пересажены на свежую среду МС. В качестве контрольной линии, относительно которого делали выводы об эффектах трансгена, выступали линии ВК, созданные из нетрансгенных растений N. tabacum сорта Petit Havana линии SR1.
ПЦР и ОТ-ПЦР анализ ВК
ДНК из ВК выделяли стандартным CTAB-методом. Для подтверждения трансгенности созданных ВК использовали классический метод ПЦР с соответствующими праймерами (дополнительный материал, табл. 1 ). Тотальную РНК из ВК выделяли при помощи тризола, первая цепь кДНК была синтезирована с использованием олиго(dT) праймера и M-MuLV обратной транскриптазы (NEB, USA). В качестве референсного гена был использован ген фактора элонгации EF-1α (AF120093.1). Полуколичественную ОТ-ПЦР проводили при следующих условиях: 94°C ‒ 1 мин, затем 94°C ‒ 30 с, 53°C ‒ 30 с, 72°C ‒ 1 мин, 30 циклов и финальная элонгация 72°С – 5 мин. Для каждого эксперимента использовали по три контрольных и опытных растения (n = 3).
Морфометрический анализ ВК при действии стрессовых факторов
Общая схема испытаний на устойчивость культур ВК к стрессовым факторам представлена в дополнительных материалах (табл. 2 ) и включает 3 различных варианта обработки. Контрольным вариантом выступали линии ВК, выращенные в нормальных условиях (дополнительный материал, табл. 2 , схема 1 ). Все опыты проводились в чашках Петри в агаризованной среде МС. Интенсивность стрессовых факторов была подобрана в ходе предварительных исследований по отношению к ВК табака без трансгена, таким образом, чтобы она значительно (до 20 раз) замедляла рост, но вызывала гибель не более 10% образцов корней после 40 дней культивации в данной среде. Морфометрический анализ заключался в измерении среднего прироста в длину культуры ВК каждые 2 дня в течение 52 дней культивации. Средний прирост рассчитывался как отношение удлинения всех корней к числу корней. Для оценки продуктивности также анализировали прирост сырой и сухой массы корней. Поскольку начальная масса фрагментов корней была ничтожно мала (не более 1 мг) им было решено пренебречь. Для измерения сухой массы корни высушивали в сухожаровом шкафу при 105°С в течении 16 ч. Все испытания по стресс-физиологии велись в 60 биологических повторностях (n = 60).
Анализ антиоксидантной системы и содержания общего растворимого белка культур ВК
Для проведения анализа стресс-опосредованных изменений антиоксидантной системы культуры ВК выращивали в течение 30 ± 1 дней в условиях действия стресс-факторов. Активность всех ферментативных систем была пересчитана на мг общего растворимого белка. Остальные показатели пересчитывали на 1 г сырой массы ВК. Все биохимические исследования проводили в 15 повторностях (n = 15).
Для определения активности супероксиддисмутазы (СОД) применяли метод, основанный на способности СОД конкурировать с нитросиним тетразолием за супероксид-анионы [13] Активность аскорбатпероксидаз (АПОК) определяли методом, основанном на определении скорости разложения перекиси водорода аскорбатпероксидазой с образованием воды и дегидроаскорбата [14]. Активность гваяколпероксидазы (ГПОК) определяли по способности полимеризации гваякола до тетрагваякола [15]. Активность каталаз (КАТ) проверяли по скорости деградации молекул перекиси водорода [16]. Количество малонового диальдегида (МДА) в навеске определяли с помощью тиобарбитуровой кислоты [17]. Метод определения пролина был основан на работе Khedr с соавт. [18]. Скорость образования супероксид-аниона (СА) определяли акцепторным методом, основанным на определении окрашенного продукта окисления адреналина – аденохрома [19]. Экстракцию перекиси водорода проводили по Chaouch с соавт. [20], измерение его содержания по Bindschedler с соавт. [21]. Общая антиоксидантная способность (ОAC) оценивалась на метанольных (80%) экстрактах по восстановлению Mo (VI) до Mo (V) при кислом pH [22]. Активность глутатион-S-трансфераз (GST) определяли по скорости образования конъюгатов между восстановленным глутатионом и 1-хлор-2,4-динитробензолом [23]. Активность глутатионредуктаз (GR) определяли по восстановлению глутатиона в присутствии НАДФН, описанному Верлан [24]. Содержание общего растворимого белка определяли по методу Бредфорда. Для калибровочной кривой использовали стоковые растворы бычьего сывороточного альбумина.
Результаты всех исследований представлены в виде гистограмм со средними значениями выборки. Барами обозначали стандартную ошибку среднего (M ± SEM). Достоверность различий во всех экспериментах оценивали при помощи U-критерия Манна-Уитни (Р < 0.05).
Получение трансгенных растений и ВК табака, несущих ген ARL
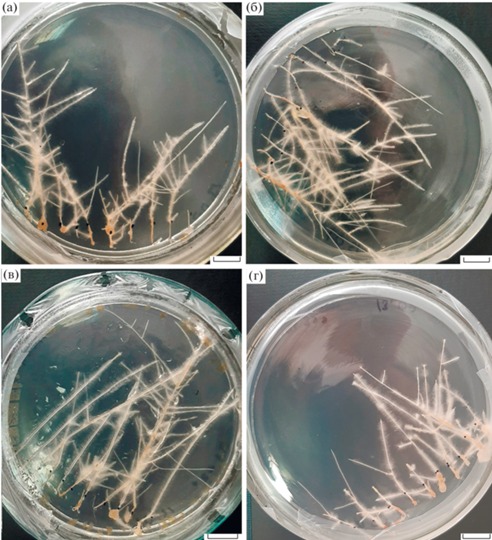
Ранее были получены 44 линии трансгенных растений табака DMVPr::AtARL [10]. Наиболее высокий уровень транскриптов целевого гена был обнаружен в линиях 2, 4, 6, 7, 14, 18, 21, 33, и 38. В настоящем исследовании для генетической трансформации при помощи A. rhizogenes были отобраны линии 2, 4, 6, 7, 18, 33, характеризующиеся наибольшим уровнем экспрессии гена ARL [10]. После агробактериальной трансформации листовых дисков трансгенных растений табака было получено 276 линий ВК DMVPr::ARL. Полученные корни прошли селекционный отбор на среде с гигромицином в течение 60 дней. Отбирали такие культуры, которые не имели обнаруживаемых визуально морфологических патологий (рис. 1). По результатам ПЦР-анализа, все отобранные культуры корней имели генетическую конструкцию, содержащую DMVPr::ARL, а также включали гены rolA и rolB (дополнительный материал, рис. 1а-в). По результатам полуколичественной ОТ-ПЦР было отобрано 3 линии ВК (впоследствии получившие номера ARL2, ARL6, ARL7) с наиболее высоким уровнем содержания транскриптов гена ARL (Дополнительные материалы, рис. 1г).
Морфометрический анализ ВК при нормальных условиях и при действии стрессовых факторов
ВК, несущие трансген ARL, росли достоверно быстрее, чем ВК контрольной линии (рис. 2а). Была замечена интересная особенность трансгенных линий: большинство из них мало разветвлялись в первые две недели роста и представляли собой один длинный корень (рис. 1), тогда как контрольные линии имели не менее одного бокового разветвления. Так же надо отметить, что у трансгенных ВК была укорочена лаг-фаза роста, которая длилась около 2‒3 дней, тогда как у контрольных ВК лаг-фаза длилась около 6‒8 дней. В то же время интенсивность удлинения корня в фазе экспоненциального (красная область для трансгенных и синяя для контрольных на рис. 2а) роста практически не отличалось и составляло около 4‒7 мм в сутки. Однако у трансгенных ВК она была разбита на 2 части, с 4 по 12‒14 дни происходил наиболее интенсивный рост корней в длину, после чего корни начинали ветвиться, и начиналась менее интенсивная фаза роста. Надо отметить, что, несмотря, на более короткую лаг-фазу у трансгенных корней, фаза интенсивного роста не увеличилась. Примерно с 32‒36 дня для трансгенных и с 36‒38 дня для контрольных ВК начиналась фаза линейного роста. По итогу трансгенные ВК оказывались достоверно длиннее контрольных корней. В целом трансгенные корни оказывались более длинными в основном благодаря первой части фазы интенсивного роста. Сырая масса (рис. 2б) трансгенных ВК у подавляющего большинства линий была достоверно выше сырой массы контрольных ВК как при действии стрессовых факторов, так и при нормальных условиях. Внимание стоит уделить также особенностям роста ВК при содержании в среде ацетата кадмия. В данных условиях масса трансгенных корней превысила массу контрольных ВК в среднем в 2.5 раза, тогда как при нормальных условиях эта разница составляла всего в 1.2 раза. Так же весьма высокие результаты для трансгенных линий были получены при действии 150 мМ NaCl. В условиях засоления трансгенные корни набирали в 2.4 раза большую массу, чем контрольные ВК. В нормальных условиях мы также наблюдали достоверное превышение (в среднем в 1.2 раза) сухой массы трансгенных корней относительно контрольных ВК (рис. 2в). В условиях солевого стресса также трансгенные корни превосходили контроль. При гипертермии сохранялась такая же тенденция, однако, достоверное различие от контроля наблюдали у двух линий трансгенных корней – ARL6 и ARL7. При действии CdAc сухая масса контрольных ВК снизилась примерно в 6.3 раза относительно нормальных условий, тогда как средняя сухая масса трансгенных только в 2.2 раза. Сухая масса трансгенных ВК при этом была выше сухой массы контрольных ВК примерно в 3.5 раза. Таким образом, можно говорить о том, что трансгенные по гену ARL ВК набирают большую массу в нормальных условиях культивирования и легче переживают стресс, связанный с засолением, гипертермией и особенно загрязнении среды кадмием.
Рис. 2.
Рост ВК табака в стандартных условиях (а), а также их сырая (б) и сухая (в) масса. Сплошной линией для ARL2-7 и пунктирной – для контрольных ВК выделена область, указывающая на фазу экспоненциального роста корней. 1 – контрольная и 2‒4 – трансгенные линии ВК (ARL2, ARL6, ARL7, соответственно). Звездочки (*) указывают на достоверное различие данных между трансгенным и контрольным линиями ВК (P ≤ 0.05).

Анализ антиоксидантной системы ВК
В нормальных условиях трансгенные ВК содержали больше перекиси водорода по сравнению с нетрансгенными (рис. 3а). При засолении перекись водорода активнее накапливалась в контрольных ВК (в среднем больше на 27%, по сравнению с трансгенными ВК). В среде с содержанием 100 мкМ CdAc трансгенные ВК накапливали в среднем на 20% меньше перекиси водорода, чем контрольные ВК.
Рис 3.
Состояние антиоксидантной системы анализируемых ВК: (а) содержание Н2О2, (б) скорость образования СА, (в) ОАС, (г) содержание МДА, (д) содержание пролина, (е) активность каталаз, (ж) активность АПОК, (з) активность ГПОК, (и) активность СОД. 1 – контрольная и 2–4 – трансгенные линии ВК (ARL2, ARL6, ARL7, соответственно). Звездочки (*) указывают на достоверное различие данных между контрольной и трансгенной линиями корней (P ≤ 0.05).

Скорость образования супероксид-аниона (СА) (рис. 3б) в трансгенных корнях при нормальных условиях была примерно такой же, как в контрольных корнях. Следует обратить внимание на то, что, в условиях гипертермии и кадмиевого стресса в трансгенных корнях супероксид-анион вырабатывался в значительно меньших количествах, чем в контрольных ВК (рис. 3б).
Контрольные и трансгенные ВК достоверно не отличались по ОАС (рис. 3в) при нормальных условиях. Однако при засолении в трансгенных корнях накапливалось меньшее количество (в среднем на 27% ниже, чем в контрольных ВК) эквивалентов аскорбиновой кислоты, а при действии ионов кадмия – большее (в среднем на 160% выше, чем в контрольных ВК).
Содержание МДА (рис. 3г) при нормальных условиях в контрольных и трансгенных корнях было на одном уровне. При действии стрессоров в трансгенных корнях МДА накапливалось меньше, чем в контрольных ВК. При этом разница в содержании МДА в условиях засоления составила в среднем 2.1 раза, а в условиях действия тяжелого металла кадмия – 1.6 раза, по сравнению с контролем. Стоит отметить то, что при действии засоления и высоких температур в трансгенных корнях содержание МДА поднималось незначительно (в среднем на 3%, по сравнению с нормальными условиями), тогда как при действии ацетата кадмия возросло в 2.6‒3.1 раза, по сравнению с нормальными условиями. В то же время в контрольных линиях ВК при действии ацетата кадмия содержание МДА возрастало в 10 раз.
Количество пролина (рис. 3д) в нормальных условиях во всех исследованных образцах ВК было примерно одинаково. В условиях засоления в трансгенных ВК количество пролина возросло в среднем в 5 раз, тогда как в контрольных ВК в 2.4 раза. При гипертермии в контрольных ВК количество пролина возросло до 10 раз, а в трансгенных – в 2.3‒3.3 раза, по сравнению с нормальными условиями. При действии кадмия в контрольных ВК количество пролина было выше в 2.5 раза, а в трансгенных от 5.0 до 5.4 раз, чем в нормальных условиях.
По активности каталаз (рис. 3е) при нормальных условиях контрольные и трансгенные ВК не различались. При добавлении 150 мМ NaCl активность каталаз повышалась во всех исследованных корнях в среднем на 50%, а при действии 100 мкМ CdAc снижалась в среднем на 30%. При засолении и гипертермии достоверных различий между трансгенными и контрольными ВК не было найдено. При действии кадмия каталазная активность у трансгенных растений была несколько выше (рис. 3е).
В нормальных условиях в трансгенных ВК активность аскорбатпероксидаз (АПОК) (рис. 3ж) была достоверно выше, чем у контрольных ВК на 54‒155%. При засолении активность аскорбатпероксидаз в трансгенных корнях ARL2 и ARL6 снижалась (и была меньше, чем у контрольных ВК в 1.5 и 2.3 раз, соответственно), тогда как в ARL7 – не изменилась. В условиях гипертермии в трансгенных ВК наблюдалась достоверно более высокая активность аскорбатпероксидаз на 53‒140%, по сравнению с контролем. При действии кадмия в контрольных ВК наблюдалось снижение активности АПОК на 28%, а в трансгенных корнях – увеличение от 44% до 277%.
Активность гваяколпероксидаз (ГПОК) (рис. 3з) трансгенных корней в нормальных условиях была ниже, чем у контрольных ВК в среднем в 2 раза. При засолении активность ГПОК в двух линиях трансгенных ВК повысилась в среднем в 1.8 раза, превысив значение контрольной линии в среднем в 1.5 раза. При гипертермии не было выявлено достоверных различий в активности ГПОК между трансгенными и контрольными ВК. Однако стоит отметить, что при гипертермии в трансгенных ВК активность ГПОК повысилась в среднем на 61%, а в контрольных ВК уменьшилась на 24% относительно показателей в нормальных условиях. В среде с содержанием CdAc активность ГПОК в контрольных ВК снизилась в 6.1 раза, тогда как в трансгенных корнях наблюдалось незначительное увеличение активности ГПОК. Стоит отметить, что при действии CdAc активность ГПОК в трансгенных ВК была выше значений контрольной линии в среднем в 3.3 раза. Активность СОД (рис. 3и) в трансгенных ВК была достоверно выше, чем у контрольных ВК только при засолении в среднем в 1.3 раза.
Глутатион-S-трансферазная (GST) активность (рис. 4а) повышалась во всех исследованных корнях при действии засоления, и понижалась при действии высоких температур. Причем, в контрольных корнях активность GST была ниже во всех случаях: в нормальных условиях на 45%, при засолении – на 27%, при гипертермии – на 88%, при действии тяжелых металлов на 44%, по сравнению с трансгенными ВК.
Рис. 4.
Состояние антиоксидантной системы анализируемых ВК: (а) активность GSTs, (б) активность GRs, (в) количество окисленного глутатиона, (г) количество восстановленного глутатиона. 1 – контрольная и 2–4 – трансгенные линии ВК (ARL2, ARL6, ARL7, соответственно). Звездочки (*) указывают на достоверное различие данных между контрольной и трансгенной линиями корней (P ≤ 0.05)

Активность глутатионредуктаз (GR) (рис. 4б) в трансгенных ВК в нормальных условиях была выше в среднем в 4 раза, по сравнению с контрольными ВК. При засолении активность GR в трансгенных ВК резко падала (в среднем в 2.5 раза), тогда как в контрольных ВК она уменьшалась лишь на 21%. При высокой температуре в трансгенных ВК активность GR уменьшилась до 12.5 раз, а в контрольных ВК в 1.5 раза. Таким образом в стрессовых условиях контрольные и трансгенные ВК по активности GR отличались в меньшей степени, чем при нормальных условиях.
При нормальных условиях культивации содержание окисленного глутатиона (GSSG) (рис. 4в) было немного больше в трансгенных корнях, по сравнению с контрольными ВК. А вот при действии стрессовых факторов содержание GSSG в трансгенных ВК было меньше, чем в контрольных ВК.
Количество восстановленного глутатиона (GSH) (рис. 4г) при стандартных условиях было в среднем в 5 раз выше в трансгенных ВК, чем в контрольных корнях. При засолении GSH в контрольных корнях уменьшилось в 4.9 раза, а в трансгенных корнях в среднем в 1.9 раза. При гипертермии количество восстановленного глутатиона в контрольных корнях уменьшилось в 5 раз, а в трансгенных ВК увеличилось в среднем в 1.5 раза, превысив значение контрольных линий в среднем в 46 раз. Эта разница была максимальной при загрязнении среды кадмием. Так при росте на среде со 100 мкМ CdAc в трансгенных ВК накапливалось в 61 раз больше восстановленного глутатиона, чем в контрольных корнях.
Содержание общего растворимого белка в ВК
В нормальных условиях содержание белка (Дополнительные материалы, табл. 3 ) в контрольных ВК было достоверно выше, чем в трансгенных корнях (на 33%). Однако в условиях засоления в контрольных ВК содержание растворимых белков резко снижалось, в то же время в трансгенных корнях содержание белков в этих условиях наоборот возрастало и превысило значение контроля на 50‒80%. При гипертермии количество водорастворимых белков было достоверно выше, чем в контрольных ВК только в корнях линии ARL7. При добавлении кадмия содержание водорастворимых белков было одинаковым в контрольных и трансгенных ВК, за исключением линии ARL7, где содержание белков было достоверно выше контроля на 23%. Стоит отметить, что на среде с содержанием CdAc количество белков было выше, чем в нормальных условиях в трансгенных ВК в среднем в 2.3 раза, а в контрольных ВК в 1.4 раза (Дополнительные материалы, табл. 3 ).
ОБСУЖДЕНИЕ
Гены семейства ARGOS оказывают положительное влияние на быстрый рост растений именно на начальных этапах развития организма [9]. Действительно ВК табака содержащие трансген ARL характеризовались укороченной лаг-фазой роста (рис. 2а). Интересно, что в трансгенных по гену TaARGOS растениях A. thaliana наблюдали подавление путей сигналинга абсцизовой кислоты (АБК), кроме того, есть исследования, которые доказывают, что трансгены AtARL ингибируют пути сигналинга этилена [1, 6, 7]. Все это заставляет клетки активно делиться и дифференцироваться даже при росте в стрессовых условиях [5]. Так же был сделан вывод о том, что именно увеличение числа клеток и их размеров при экспрессии генов ARGOS является основой увеличения размера органов [5, 9]. Поэтому логично то, что наибольшие уровни экспрессии данного гена были обнаружены в молодых и быстро растущих тканях [3, 4]. Таким образом, увеличение интенсивности роста и сокращение лаг-фазы (рис. 2а) трансгенных ВК можно объяснить именно ускорением удлинения и последующей пролиферации клеток. Ускоренный рост ВК на начальных этапах оказывал сильное позитивное влияние на последующее накопление сухой и сырой массы.
Интересный характер роста был у ВК в условиях абиотического стресса. Засоление снижало темпы роста как контрольных ВК, так и трансгенных. При измерении сырой массы (рис. 2б) было замечено сильное различие между трансгенными и контрольными ВК – первые были более продуктивными. Это расхождение несколько уменьшалось при измерении сухой массы, но достоверная разница все равно сохранялась во всех линиях. Как известно, гены ARGOS связаны с гормонами ауксинами [25], которые в свою очередь активизируют рост клеток растяжением из-за влияния на белки экспансины [5, 26]. Возможно, что при нормальных условиях роста, когда клетки активно делятся и растут такое влияние продуктов гена не проявлялось, но в стрессовых условиях это могло оказать позитивный эффект на параметры роста. Это так же могло бы объяснить накопление бóльшей сырой массы трансгенными корнями при действии ацетата кадмия. Поскольку кадмий способен ингибировать пролиферацию клеток [27], а компенсаторный рост клеток растяжением в данном случае объяснило бы бóльшее накопление сырой массы культурами корней. Данное предположение поддерживается исследованием Hu с соавт. [3], которые доказали, что сверхэкспрессия гена ARL в A. thaliana увеличивает именно размеры клеток.
Ранее нами было показано, что трансгенные по гену ARL растения табака обладают большей устойчивостью к таким абиотическим стрессовым факторам, как засоление, гипотермия и действие ацетата кадмия [7]. Однако, до сих пор до конца не понятен механизм увеличения устойчивости к абиотическим факторам у растений конститутивно экспрессирующих ген ARL. Редокс-статус ВК табака, экспрессирующих ген ARL отличался от контрольных корней даже в нормальных условиях. Например, в ВК с геном ARL были достоверно выше концентрации перекиси водорода (рис. 3а), окисленного и восстановленного глутатиона (рис. 4в, г), более высокая активность АПОК (рис. 3ж), GSTs и GRs (рис. 4а, б), а активность ГПОК была более низкой (рис. 3з). Высокие активности ферментов GSTs и GRs (рис. 4а, б) можно объяснить более быстрыми темпами роста трансгенных ВК и участием этих ферментов в жизнедеятельности культур [28]. Это так же может объяснить более высокие концентрации восстановленного и окисленного глутатиона у культур трансгенных корней, что может поддерживать стабильный рост при действии различных стресс-факторов. Восстановленный глутатион, которого было много в трансгенных ВК способен прямо или косвенно контролировать уровень АФК и считается одним из важнейших клеточных антиоксидантов. В отличие от многих антиоксидантных метаболитов глутатион быстро восстанавливается ферментами GRs, активность которых в трансгенных ВК была выше в 4 раза, чем в контроле. Широко известно, что растения с повышенным содержанием восстановленного глутатиона легче переживают стрессы, вызванные засолением, присутствием тяжелых металлов и гербицидов [29]. К сожалению, пока остается непонятным механизм увеличения глутатионового пула при конститутивной экспрессии гена ARL, однако, есть убедительные доказательства, что синтез глутатиона усиливается при подавлении сигналинга АБК и этилена, а также связан с активацией ауксинового сигналинга [29]. При этом, хорошо известно, что продукты генов ARGOS, как раз являются негативными регуляторами этиленового сигналинга [1, 6], а также могут частично блокировать сигналинг АБК [5, 29].
При засолении наблюдали за более резким увеличением концентрации пролина в трансгенных корнях, по сравнению с контрольными ВК (рис. 3д). Повышенное содержание пролина при высоких концентрациях соли помогает стабилизировать пероксидазы и каталазы [30], благодаря чему также повышается стрессоустойчивость тканей. Также, известно, что экзогенное внесение пролина способно усиливать активность пероксидаз и каталаз табака при засолении [31]. Несмотря на более высокую выработку СА (рис. 3б), а также повышение активности СОД (рис. 3и) при засолении, количество перекиси в трансгенных ВК не возрастало (рис. 3а), а количество МДА лишь незначительно возросло (рис. 3г). В то время как в контрольных корнях количество перекиси и МДА при засолении увеличилось в разы. Таким образом, в трансгенных корнях именно благодаря работе пероксидаз поддерживался уровень пероксида водорода на приемлемом для клеток уровне. Стоит так же отметить характер изменения активности ферментов глутатионового цикла. Если активность глутатион-S-трансфераз в трансгенных ВК возросла в 1.8 раз (в среднем), то активность GRs снизилась в среднем в 2.5 раза. Таким образом, окисленный с помощью GSTs (и не только) глутатион в контрольных корнях восстанавливался медленнее, чем в трансгенных. Однако стоит заметить, что и в трансгенных корнях количество GSSG увеличилось в среднем в 2 раза.
При длительном росте корней в условиях гипертермии в волосовидных корнях дикого типа накапливался пролин (увеличился в 10 раз относительно контроля) (рис. 3д). Увеличение количества пролина обычно является индикатором засухи и осмотического стресса, что испытывают растения [32]. В то же время в трансгенных корнях концентрация пролина увеличилась только в 2.3 раза. Имеются данные, что гомологи гена ARL ингибируют ответ на повышение уровня АБК в клетках [5]. Таким образом, клетки продолжают дифференциацию и пролиферацию, что придает устойчивость растениям к действию таких стрессовых факторов, как засуха и гипертермия.
При действии ацетата кадмия в волосовидных корнях мы наблюдали за повышением содержания и продукции таких АФК, как перекись водорода и супероксид-анион. Стоит отметить, что в трансгенных волосовидных корнях накопление перекиси было достоверно ниже контрольных линий на 20%, а выработка СА ниже в среднем на 14%. Известно, что соли кадмия могут инициировать хромосомные повреждения уже после двухчасовой обработки концентрациями близкими к 50 мкМ. Кроме того, кадмий может ингибировать пролиферацию клеток в более высоких концентрациях независимо от продолжительности воздействия. Достаточно активно растения борются с окислительным стрессом вызванным присутствием кадмия с помощью GSTs. При повышении концентрации кадмия, как правило, увеличивается активность GSTs [33]. Глутатион используется как субстрат для ликвидации АФК. Метаболизм глутатиона является жизненно важным при противодействии окислительному стрессу, вызванном присутствием кадмия [34]. В связи, с чем характерный для трансгенных ВК высокий уровень восстановленного глутатионового пула может лежать также в основе их устойчивости к кадмиевому стрессу.
Из всех анализируемых линий ВК наибольший уровень экспрессии трансгена ARL был характерен для линии 7. Что характерно, именно у этой линии было выявлено более высокое содержание белка при действии всех трех стрессовых факторов (Дополнительные материалы, табл. 3 , рис. 1). Вероятнее всего это также связано с защитным эффектом сверхэкспрессии гена ARL при действии абиотических стресс-факторов.
ЗАКЛЮЧЕНИЕ
Таким образом, ВК табака конститутивно экспрессирующие ген ARL имели более короткую лаг-фазу при пересадке культур на новую среду (а значит большим адаптационным потенциалом), обладали повышенной устойчивостью к засолению, высоким температурам и загрязнению среды кадмием. Показано, что позитивные эффекты продукта гена ARL на стрессоустойчивость реализуются не только через влияние на пролиферацию и рост клеток, но и через влияние на антиоксидантную систему. Данный механизм связан, в первую очередь, с увеличением в клетках пула восстановленного глутатиона и частично с увеличением содержания пролина и повышением аскорбатпероксидазной активности. Связаны ли эти особенности трансгенных ВК с прямым или косвенным действием продукта гена ARL остается пока неизвестным. Полученные нами результаты говорят о перспективности использования гена ARL в качестве целевого для получения высокопродуктивных и стрессоустойчивых культур ВК. К тому же в стрессовых условиях у трансгенных ВК увеличилось накопление белков по сравнению с контрольными ВК, что так же может быть полезным в биотехнологии растений.
Работа выполнена в рамках Государственного задания № AAAA-A19-119021190011-0 при поддержке гранта Президента Российской Федерации МД-2304.2020.4.
Настоящая статья не содержит каких-либо исследований с участием животных и людей в качестве объектов исследований. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Shi J., Gao H., Wang H., Lafitte H.R., Archibald R.L., Yang M., Hakimi S.M., Mo H., Habben J.E. ARGOS8 variants generated by CRISPR-Cas9 improve maize grain yield under field drought stress conditions // Plant Biotech. J. 2017. V. 15. P. 207. https://doi.org/10.1111/pbi.12603
Qin Z., Zhang X., Zhang X., Feng G., Hu Y. The Arabidopsis ORGAN SIZE RELATED 2 is involved in regulation of cell expansion during organ growth // BMC Plant Biology. 2014. V. 14. P. 349. https://dx.doi.org/10.1186%2Fs12870-014-0349-5
Hu Y., Poh H., Chua N. The Arabidopsis ARGOS-LIKE gene regulates cell expansion during organ growth // Plant. 2006. V. 47 P. 1. https://doi.org/10.1111/j.1365-313x.2006.02750.x
Feng G., Qin Z., Yan J., Zhang X., Hu Y. Arabidopsis ORGAN SIZE RELATED1 regulates organ growth and final organ size in orchestration with ARGOS and ARL. // New Phytol. 2011. V. 191. P. 635. https://doi.org/10.1111/j.1469-8137.2011.03710.x
Wang B., Zhou X., Xu F., Gao J. Ectopic expression of a Chinese cabbage BrARGOS gene in Arabidopsis increases organ size // Transgenic Res. 2010. V. 19. P. 461. https://doi.org/10.1007/s11248-009-9324-6
Rai M.I., Wang X., Thibault D.M., Kim H.J., Bombyk M.M., Binder B.M., Shakeel S.N., Schaller G.E. The ARGOS gene family functions in a negative feedback loop to desensitize plants to ethylene // BMC Plant Biol. 2015. V. 15. P. 157. https://doi.org/10.1186/s12870-015-0554-x
Kuluev B., Mikhaylova E., Ermoshin A., Veselova S., Tugbaeva A., Gumerova G., Gainullina K., Zaikina E. The ARGOS-LIKE genes of Arabidopsis and tobacco as targets for improving plant productivity and stress tolerance // J. Plant Physiol. 2019. V. 242. P. 153033. https://doi.org/10.1016/j.jplph.2019.153033
Kuluev B.R., Knyazev A.V., Postrigan B.N., Chemeris A.V. The creation of transgenic tobacco plants expressing fragments of the ARGOS and NtEXPA4 genes in antisense orientation. // Russ. J. Genet. 2014. V. 50. P. 37.
Zhao Y., Tian X., Li Y., Zhang L., Guan P., Kou X., Wang X., Xin M., Hu Z., Yao Y., Ni Z., Sun Q., Peng H. Molecular and functional characterization of wheat ARGOS genes influencing plant growth and stress tolerance // Front. Plant Sci. V. 20178. P. 170.
Kuluev B.R., Knyazev A.V., Safiullina M.G., Chemeris A.V. Effect of constitutive expression of ARGOS-LIKE gene on sizes of cells and organs of transgenic tobacco plants // Russ. J. Genet. 2013. V. 49. P. 503.
Flores-Félix J.D., Menéndez E., Peix A., García-Fraile P., Velázquez E. History and current taxonomic status of genus Agrobacterium // Syst. Appl. Microbiol. 2020. V. 43. P.126046. https://doi.org/10.1016/j.syapm.2019.126046
Talano M.A., Wevar O.A.L., González P.S., Agostini E. Hairy roots, their multiple applications and recent patents // Recent Pat. Biotechnol. 2012. V. 6. P. 115. https://doi.org/10.2174/187220812801784713
Чевари С., Чаба И., Секей И. Роль супероксиддисмутазы в окислительных процессах клетки и метод определения ее в биологических материалах // Лабораторное дело. 1985. № 11. С. 578.
Verma S., Dubey R.S. Lead toxicity induces lipid peroxidation and alert the activities of antioxidant enzymes in grooving rice plants // Plant Sci. 2003. V. 64. P. 645. https://doi.org/10.1016/S0168-9452(03)00022-0
Ермаков А.И., Арисимович В.В., Ярош Н.П., Перуанский Ю.В., Луковникова Г.А., Иконникова М.И. Методы биохимического исследования растений // Ленинград: Агропромиздат. 1987. 430 с.
Panchuck I.I., Volkov R.A., Schoff F. Heat stress and heat shock transcription factor-depend expression and activity of ascorbate peroxidase in Arabidopsis // Plant Physol. 2002. V. 129. P. 838.
Taylor N.L., Millar A.H. Oxidative stress and plant mitochondria // Methods in molecular Biology. 2007. V. 372. P. 389. https://doi.org/10.1007/978-1-59745-365-3_28
Khedr A.H.A., Abbas M.A., Abdel W.A.A., Quick W.P., Abogadallah G.M. Proline induces the expression of salt-stress-responsive proteins and may improve the adaptation of Pancratium maritimum L. to salt-stress // J. Exp. Bot. 2003. V. 54. P. 2553. https://doi.org/10.1093/jxb/erg277
Minibayeva F.V., Kolesnikov O.P., Gordon L.K. Contribution of a plasma membrane redox system to the superoxide production by wheat root cells // Protoplasma. 1998. V. 205. P. 101. https://doi.org/10.1007/BF01279299
Chaouch S., Queval G., Vanderauwera S., Mhamdi A., Vandorpe M., Langlois-Meurinne M., Breusegem F., Saindrenan P., Noctor G. Peroxisomal hydrogen peroxide is coupled to biotic defense responses by ISOCHORISMATE SYNTHASE1 in a daylength-related manner // Plant Physiol. 2010. V. 153. P. 1692 https://doi.org/10.1104/pp.110.153957
Bindschedler L.V., Minibayeva F., Gardner S.L., Gerrish C., Davies D.R., Bolwell G.P. Early signalling events in the apoplastic oxidative burst in suspension cultured French bean cells involve cAMP and Ca2+ // New Phytol. 2001. V. 151. P. 185. https://doi.org/10.1046/j.1469-8137.2001.00170.x
Boestfleisch C., Wagenseil N.B., Buhmann A.K., Seal C.E., Wade E.M., Muscolo A., Papenbrock J. Manipulating the antioxidant capacity of halophytes to increase their cultural and economic value through saline cultivation // AoB Plants. 2014. V. 13. P.6. https://doi.org/10.1093/aobpla/plu046
Habig W.H., Pabst M.S., Jakoby W.B. Glutathione-S-transferase. The first enzymatic step in mercapturic acid formation // J. Biol. Chem. 1974. V. 246. P. 7130. https://doi.org/10.1016/S0021-9258(19)42083-8
Верлан Н.В. Клинико-фармакологический анализ состояния системы глутатиона при церебральной ишемии. Дис. … докт. мед. наук. Москва: ЦНМБ ММА им. И.М. Сеченова, 2008. 210 с.
Karamat U., Sun X., Li N. Genetic regulators of leaf size in Brassica crops // Horticulture Research. 2021. V. 8. P. 1. https://doi.org/10.1038/s41438-021-00526-x
Khan M.A., Imtiaz M., Hussain A., Jalal F., Hayat S., Hussain S., Said F., Alam M., Amir R. Isolation and functional characterization of an Ethylene Response Factor (RhERF092) from rose (Rosa hybrida) // Plant Cell, Tissue Organ Cult. 2020. V. 140. P. 157. https://doi.org/10.1007/s11240-019-01719-y
Jaiswal S., Dey R., Bag A. Effect of heavy metal cadmium on cell proliferation and chromosomal integrity in Allium cepa // Natl Acad Sci Let. 2021. P. 1. https://doi.org/10.1007/s40009-021-01072-9
Gallé A., Czékus Z., Bela K., Horváth E., Ördög A., Csiszár J., Poór P. Plant glutathione transferases and light // Front. Plant Sci. 2019. V. 9. P. 1944. https://doi.org/10.3389/fpls.2018.01944
Noctor G., Mhamdi A., Chaouch S., Han Y., Neukermans J., Marquez-Garcia B., Queval G., Foyer H.C. Glutathione in plants: an integrated overview // Plant Cell Environ. 2012. V. 35. P. 454. https://doi.org/10.1111/j.1365-3040.2011.02400.x
Halperin S.J., Flores H.E. Hyoscyamine and proline accumulation in water-stressed Hyoscyamus muticus ‘hairy root’ cultures // In Vitro Cell. Dev. Biol. 1997. V. 33. P. 240. https://doi.org/10.1007/s11627-997-0030-x
Hoque M.A., Okuma E., Banu M.N. Exogenous proline mitigates the detrimental effects of salt stress more than exogenous betaine by increasing antioxidant enzyme activities // J. Plant Physiol. 2007. V. 164. P. 553. https://doi.org/10.1016/j.jplph.2006.03.010
Munns R., Tester M. Mechanisms of salinity tolerance // Ann. Rev. Plant Biol. 2008. V. 59. P. 651. https://doi.org/10.1146/annurev.arplant.59.032607.092911
Zhang C.H., Ying G. E. Response of glutathione and glutathione S-transferase in rice seedlings exposed to cadmium stress // Rice Sci. 2008. V. 15. P. 73. https://doi.org/10.1016/S1672-6308(08)60023-2
Huybrechts M., Hendrix S., Kyndt T., Demeesterec K., Vandammed D., Cuypers A. Short-term effects of cadmium on leaf growth and nutrient transport in rice plants // Plant Sci. 2021. V. 313. P. 111054. https://doi.org/10.1016/j.plantsci.2021.111054
Дополнительные материалы
- скачать ESM.docx
- Таблица 1. Последовательности праймеров использованных для ПЦР и ОТ-ПЦР анализа трансгенных растений и ВК
Таблица 2. Схемы стресс-обработки волосовидных корней
Таблица 3. Содержание белка в трансгенных и контрольных линиях волосовидных корней табака при нормальных и стрессовых условиях (мг/г сырой массы)
Рис. 1. Результаты ПЦР и полуколичественного ОТ-ПЦР отобранных волосовидных корней табака, предположительно включающих трансген AtARL
Инструменты
Физиология растений