Журнал физической химии, 2020, T. 94, № 9, стр. 1424-1426
Кинетика роста пленки газового гидрата вдоль поверхности раздела вода–газ
В. А. Власов a, *, А. Н. Нестеров a, А. М. Решетников a
a Российская академия наук, Сибирское отделение, Тюменский научный центр,
Институт криосферы Земли
Тюмень, Россия
* E-mail: vlasov.ikz@gmail.com
Поступила в редакцию 20.12.2019
После доработки 06.02.2020
Принята к публикации 11.02.2020
Аннотация
Проанализирован процесс роста пленки газового гидрата вдоль поверхности раздела вода–газ. Предполагается, что движущей силой данного процесса является концентрационная движущая сила. Проведено сравнение имеющихся экспериментальных данных по кинетике рассматриваемого процесса с расчетными данными, полученными в рамках ранее предложенной теоретической модели. В результате такого сравнения определена зависимость толщины пленки гидрата диоксида углерода от концентрационной движущей силы.
Образование газового гидрата из воды и газа в статических условиях (без перемешивания воды) начинается со стадии формирования тонкой пленки газового гидрата на поверхности раздела вода–газ. Данная стадия имеет большое практическое значение, определяя кинетику дальнейшего роста газового гидрата вглубь водной фазы [1–3].
В ходе экспериментальных исследований роста пленки газового гидрата вдоль поверхности раздела вода–газ было установлено, что эта пленка растет со стороны водной фазы [4, 5] с постоянной скоростью. При этом скорость роста пленки газового гидрата вдоль поверхности раздела вода–газ ${v}$ и толщина пленки газового гидрата $\delta $ зависят от термобарических условий [5–7]. Следует отметить, что величины ${v}$ и $\delta $ полностью описывают процесс роста пленки газового гидрата вдоль поверхности раздела вода–газ при текущих термобарических условиях (рис. 1).
Рис. 1.
Схематическое изображение процесса роста пленки газового гидрата вдоль поверхности раздела вода–газ.
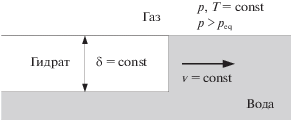
На сегодняшний день существует ряд теоретических моделей процесса роста пленки газового гидрата вдоль поверхности раздела вода–газ, построенных на предположении, что кинетика данного процесса контролируется только теплопереносом [8]. Во всех этих моделях считается, что температура на фронте роста пленки газового гидрата равна температуре равновесия жидкая вода–гидрат–газ ${{T}_{{{\text{eq}}}}}$ при текущем давлении газа $p$. Поэтому во всех этих моделях движущей силой процесса роста пленки газового гидрата вдоль поверхности раздела вода–газ является разность температур $\Delta T = {{T}_{{{\text{eq}}}}} - T$, где $T$ – текущая температура.
В недавней работе [9] было показано, что в ходе процесса роста пленки газового гидрата вдоль поверхности раздела вода–газ температура на фронте роста пленки газового гидрата мало отличается от текущей температуры $T$, и поэтому кинетика этого процесса контролируется не только теплопереносом. Более того, в работе [9] было показано, что кинетика этого процесса в большей мере контролируется массопереносом молекул растворенного в воде газа к фронту роста пленки газового гидрата. Таким образом, кинетические модели процесса роста пленки газового гидрата вдоль поверхности раздела вода–газ, основанные на предположении, что данный процесс контролируется только теплопереносом, не являются корректными. Также не корректно считать, что величина $\Delta T$ является движущей данного процесса. Вместо этой движущей силы следует использовать концентрационную движущую силу [4], которую можно представить как
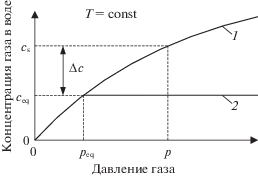
где ${{c}_{{\text{s}}}}(p,T)$ и ${{c}_{{{\text{eq}}}}}({{p}_{{{\text{eq}}}}},T)$ – молярная концентрация растворенного в воде газа при равновесии жидкая вода–газ и раствор газа в воде–гидрат соответственно; ${{p}_{{{\text{eq}}}}}$ – давление равновесия жидкая вода–гидрат–газ при текущей температуре $T$ (рис. 2). Давление ${{p}_{{{\text{eq}}}}}$ можно определить с помощью программы CSMGem [2], а величины ${{c}_{{\text{s}}}}(p,T)$ и ${{c}_{{{\text{eq}}}}}({{p}_{{{\text{eq}}}}},T)$ можно рассчитать, используя уравнение Кричевского–Казарновского.Рис. 2.
Зависимости растворимости газа в воде от давления при постоянной температуре: 1 – молярная концентрация растворенного в воде газа при равновесии жидкая вода–газ (включая метастабильное равновесие при давлении выше ${{p}_{{{\text{eq}}}}}$), 2 – молярная концентрация растворенного в воде газа при равновесии раствор газа в воде–гидрат.
Скорость роста пленки газового гидрата вдоль поверхности раздела вода–газ можно рассматривать как скорость движения фронта химической реакции образования газового гидрата из воды и газа [10]. Исходя из этого, в работе [11] было получено следующее выражение для данной скорости:
(1)
${v} = \frac{{{{M}_{{\text{h}}}}{{\nu }^{n}}{{D}^{{1 - n}}}\Delta c}}{{{{\rho }_{{\text{h}}}}\delta }},$(3)
${v} = \frac{{{{M}_{{\text{h}}}}{{\nu }^{n}}{{D}^{{1 - n}}}\Delta {{c}^{2}}}}{{{{\rho }_{{\text{h}}}}B}}.$В работах [6, 7, 12] при различных термобарических условиях были определены скорости роста пленки гидрата метана вдоль поверхности раздела вода–метан. При этом в работах [6, 7] объектом исследования была плоская поверхность воды, а в работе [12] объектом исследования были капли воды размером 0.25–2.5 мм, находящиеся на подложке. Кроме того, в работе [12] часть экспериментов была выполнена с переохлажденной водой при температурах ниже 273 K. Следует отметить, что образование газовых гидратов из переохлажденной воды и газа является надежно установленным экспериментальным фактом [12–18]. Экспериментальные данные из работ [6, 7, 12] в координатах ${v} - \Delta c$ представлены на рис. 3. Анализ всех экспериментальных данных, представленных на рис. 3, показывает, что при одинаковых термобарических условиях скорость роста пленки газового гидрата по плоской поверхности воды совпадает со скоростью роста пленки газового гидрата по поверхности капель воды на подложке. Также анализ всех экспериментальных данных, представленных на рис. 3, показывает, что кинетические закономерности процесса образования газового гидрата из переохлажденной воды и газа в области температур ниже 273 K совпадают с кинетическими закономерностями процесса образования газового гидрата из воды и газа в области температур выше 273 K.
Рис. 3.
Зависимости скорости роста пленки гидрата метана вдоль поверхности раздела вода–метан от движущей силы этого процесса при различных температурах: 1 – экспериментальные данные из работы [6], 2 – экспериментальные данные из работы [7], 3 – экспериментальные данные из работы [12], 4 – расчетные данные.
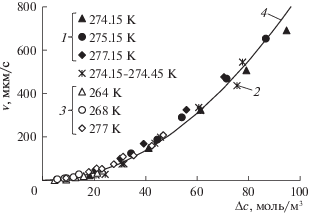
Из рис. 3 хорошо видно, что скорость ${v}$ нелинейно зависит от движущей силы $\Delta c$ и слабо зависит от температуры. Эти два факта подтверждают справедливость использования формулы (3) для описания кинетики роста пленки газового гидрата вдоль поверхности раздела вода–газ. Из сопоставления расчетных данных, полученных по формуле (3), с экспериментальными данными, представленными на рис. 3, было установлено, что коэффициент $n$ имеет значение от 0.70 до 0.72. На рис. 3 представлены расчетные данные, полученные по формуле (3) при $T = 275$ K, $B = 285$ мкм моль м–3 и $n = 0.71$.
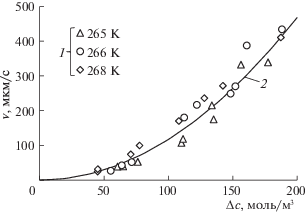
В работе [15] при различных термобарических условиях были определены скорости роста пленки гидрата диоксида углерода вдоль поверхности раздела вода–диоксид углерода. В этой работе объектом исследования были капли переохлажденной воды размером 0.25–2.5 мм, находящиеся на подложке. Экспериментальные данные из работы [15] в координатах ${v} - \Delta c$ представлены на рис. 4. Помимо этих экспериментальных данных, на рис. 4 представлены расчетные данные, полученные по формуле (3) при $T = 266.5$ K, $n = 0.71$ и $B = 2.6$ мм моль м–3.
Рис. 4.
Зависимости скорости роста пленки гидрата диоксида углерода вдоль поверхности раздела вода–диоксид углерода от движущей силы этого процесса при различных температурах: 1 – экспериментальные данные из работы [15], 2 – расчетные данные.
Таким образом, в настоящей работе из сопоставления расчетных и экспериментальных данных удалось установить значение коэффициента $n$, а также значение коэффициента $B$ для гидрата диоксида углерода. Кроме того, в настоящей работе показано, что теоретическую модель из работы [11] можно успешно использовать для описания кинетики роста пленки газового гидрата вдоль поверхности раздела вода–газ.
Работа выполнена в рамках Программы фундаментальных исследований РАН (проект IX.135.2.3).
Список литературы
Истомин В.А., Якушев В.С. Газовые гидраты в природных условиях. М.: Недра, 1992. 236 с.
Sloan E.D., Koh C.A. Clathrate Hydrates of Natural Gases. 3rd ed. Boca Raton: CRC Press, 2008. 752 p.
Манаков А.Ю., Пеньков Н.В., Родионова Т.В. и др. // Успехи химии. 2017. Т. 86. № 9. С. 845.
Taylor C.J., Miller K.T., Koh C.A., Sloan E.D. // Chem. Eng. Sci. 2007. V. 62. P. 6524.
Li S.-L., Sun C.-Y., Liu B. et al. // AIChE J. 2013. V. 59. P. 2145.
Freer E.M., Selim M.S., Sloan E.D. // Fluid Phase Equilib. 2001. V. 185. P. 65.
Kitamura M., Mori Y.H. // Cryst. Res. Technol. 2013. V. 48. P. 511.
Yin Z., Khurana M., Tan H.K., Linga P. // Chem. Eng. J. 2018. V. 342. P. 9.
Mochizuki T., Mori Y.H. // Chem. Eng. Sci. 2017. V. 171. P. 61.
Vlasov V.A. // React. Kinet. Mech. Catal. 2013. V. 110. P. 5.
Vlasov V.A. // Heat Mass Transf. 2019. V. 55. P. 3537.
Melnikov V.P., Nesterov A.N., Reshetnikov A.M. et al. // Chem. Eng. Sci. 2010. V. 65. P. 906.
Мельников В.П., Нестеров А.Н., Решетников А.М. // Докл. АН. 2007. Т. 417. № 2. С. 217.
Melnikov V.P., Nesterov A.N., Reshetnikov A.M., Zavodovsky A.G. // Chem. Eng. Sci. 2009. V. 64. P. 1160.
Melnikov V.P., Nesterov A.N., Reshetnikov A.M., Istomin V.A. // Ibid. 2011. V. 66. P. 73.
Ohno H., Oyabu I., Iizuka Y. et al. // J. Phys. Chem. A. 2011. V. 115. P. 8889.
Власов В.А., Заводовский А.Г., Мадыгулов М.Ш. и др. // Журн. физ. химии. 2013. Т. 87. № 11. С. 1814.
Madygulov M.Sh., Nesterov A.N., Reshetnikov A.M. et al. // Chem. Eng. Sci. 2015. V. 137. P. 287.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


