Журнал физической химии, 2020, T. 94, № 9, стр. 1418-1423
Закономерности озонной предобработки лигноцеллюлозной биомассы для последующей ферментации в сахара
Е. М. Бенько a, *, В. В. Лунин a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: benko_elena@mail.ru
Поступила в редакцию 11.12.2019
После доработки 11.12.2019
Принята к публикации 21.01.2020
Аннотация
На примере растительной биомассы разного типа установлены некоторые общие закономерности озонной предобработки для последующей ферментации в сахара. Показано, что реакционная способность предобработанных озоном растительных субстратов определяется количеством поглощенного озона, а скорость поглощения озона зависит от содержания воды в образце. Найдены оптимальные значения влажности (~2ТНВ) и расхода озона (2–3 моль О3/ С9ФПЕ лигнина).
Озонирование, как метод предварительной обработки лигноцеллюлозного сырья с целью повышения его реакционной способности при последующей ферментации в сахара и спирты, исследуется уже несколько десятков лет [1–3]. Установлено, что озон реагирует предпочтительно с лигнином, способствует деструкции лигно-целлюлозного материала и его делигнификации и тем самым облегчает высвобождение сахаров при гидролизе целлюлолитическими ферментами [2, 4]. Метод озонной обработки характеризуется высокой эффективностью, мягкими условиями проведения и экологической безопасностью процесса [4].
Практическое применение озонных технологий долгое время сдерживала необходимость использования больших количеств озона, что делало метод экономически невыгодным. В последние годы, достигнут существенный прогресс в области синтеза озона, позволяющий значительно снизить стоимость озона, и интерес к методу озонной предобработки возрос. Об этом свидетельствует большое количество посвященных этой проблеме публикаций. Однако до сих пор остается открытым вопрос об оптимальных условиях озонирования, позволяющих сократить расход озона и увеличить выход целевых продуктов в процессах биоконверсии растительного сырья. Для его решения необходимо понимание физико-химических закономерностей озонирования растительной биомассы, определение и разделение роли рабочих параметров процесса. Накопленный нами экспериментальный материал, а также обширная база литературных данных позволяют сделать определенные обобщения и высказать предположения относительно оптимальных условий озонной предобработки растительной биомассы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы древесины и однолетних растений предоставлены и охарактеризованы по стандартным методикам [5] Алтайским государственным университетом (Барнаул). В табл. 1 приведены характеристики некоторых из использованных лигноцеллюлозных материалов: содержание основных компонентов, состав лигнина, средняя молекулярная масса фенилпропановой (ФПЕ) структурной субъединицы лигнина.
Таблица 1.
Характеристика образцов растительной биомассы и параметры озонирования
| Тип биомассы | Содержание компонентов, % | Состав лигнина | Mr С9ФПЕ [6] | τ, мин | Х × 103 моль/г | ВС48, мг/г |
||
|---|---|---|---|---|---|---|---|---|
| ЛГ | Ц | ГЦ | ||||||
| Осина обыкновенная (Populus tremula L.) |
24 | 45 | 26 | G-S | 210 | 0 | 0 | 45 |
| 5 | 1.2 | 195 | ||||||
| 10 | 1.5 | 240 | ||||||
| 15 | 2.3 | 240 | ||||||
| 30 | 3.1 | 378 | ||||||
| 60 | 3.6 | 310 | ||||||
| 100 | 5.3 | 300 | ||||||
| 150 | 8.1 | 160 | ||||||
| Сосна обыкновенная (Pinus sylvestris L.) |
27 | 49 | 16 | G | 190 | 0 | 0 | 39 |
| 5 | 1 | 217 | ||||||
| 7 | 1.8 | 238 | ||||||
| 10 | 2.2 | 285 | ||||||
| 20 | 2.9 | 245 | ||||||
| 30 | 3.1 | 266 | ||||||
| 60 | 5.8 | 116 | ||||||
| 120 | 7.6 | 105 | ||||||
| Солома пшеничная (Tritcum L.) |
20 | 40 | 24 | H-G-S | 196 | 0 | 0 | 27 |
| 3 | 0.78 | 142 | ||||||
| 10 | 1.23 | 175 | ||||||
| 12 | 1.32 | 228 | ||||||
| 20 | 1.96 | 297 | ||||||
| 30 | 2.4 | 412 | ||||||
| 60 | 3.4 | 344 | ||||||
Перед обработкой озоном образцы увлажняли, добавляя необходимое количество дистиллированной воды, и выдерживали в закрытой емкости несколько суток. Влажность образца (W, %) определяли путем взвешивания как отношение массы воды к массе абсолютно сухого лигноцеллюлозного материала.
Озонирование образцов проводили при комнатной температуре в проточном реакторе с неподвижным слоем. Подробно методика озонирования и способ расчета расхода озона описаны в [7]. Ферментативный гидролиз осуществляли с помощью коммерческого препарата целлюлозного комплекса Trichoderma Viride по методике, описанной в [7]. Содержание восстанавливающих сахаров (ВС) в реакционной смеси определяли по методу Шомоди–Нельсона [8].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Влияние содержания воды на эффективность взаимодействия лигноцеллюлозной биомассы с озоном
Из литературы известно, что на эффективность озонной предобработки влияют такие параметры как тип биомассы, влажность образца, размер частиц, концентрация озона, скорость газового потока, рН, конструкция реактора [2, 4]. Однако, необходимо понимание и разделение роли рабочих параметров процесса.
Многочисленные экспериментальные данные позволяют предположить, что наиболее значимыми параметрами озонирования являются влажность образца и количество поглощенного озона. При этом влажность образца влияет на скорость реакции биомассы с озоном, а расход озона определяет количество удаленного лигнина и выход сахаров в ферментативной реакции.
Высказывается предположение, что каждый тип растительного сырья имеет свою оптимальную влажность, причем для однолетних растений она обычно выше, чем для древесины. В литературе приводятся следующие величины оптимальной влажности при озонировании: 25–35% (точка насыщения волокна – ТНВ) для древесины дуба [2], 40% – тополя, кедра и кипариса [9–11], 50–60% – осины [12], 40–50% для сахарного тростника [13, 14], 60% – стеблей кукурузы [15], 30–60% – пшеничной и рисовой соломы [16]. Следует отметить, что сравнение приведенных в литературе величин затруднено из-за отсутствия однозначных критериев оценки оптимальной влажности. Нами в качестве такого критерия выбрана начальная скорость поглощения озона. На примере различных образцов биомассы (опилок лиственной и хвойной древесины, пшеничной соломы, костры льна, подсолнечной лузги) установлено, что значения оптимального содержания воды, позволяющие реализовать максимальную скорость поглощения озона и свести к минимуму долю непрореагировавшего озона, находятся в интервале значений 50–70%, т.е. вблизи 2ТНВ [17]. Такую влажность образца следует поддерживать на протяжении всего времени обработки. Озонирование сухих образцов, так же как и водных суспензий не эффективно. Зависимость начальной скорости поглощения озона от содержания воды в растительном материале показана на рис. 1.
Рис. 1.
Зависимости начальной скорости поглощения озона (${v}$) от содержания воды в растительном материале [17]. Обозначения: ВС – воздушно-сухие (5–7%), ТНВ – точка насыщения волокна (30–40%).
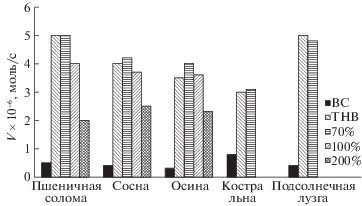
Полученные результаты согласуются с выводами работы [15], в которой показано, что оптимальными по влажности условиями являются такие, при которых соблюдается определенное соотношение между свободной и связанной водой. Найденное для биомассы стеблей кукурузы оптимальное значение (mсвоб/mсвяз) составляет ∼0.8 [15].
Наблюдаемые закономерности можно объяснить влиянием двух процессов – набухания лигноцеллюлозного материала в воде, приводящего к увеличению внутренней поверхности и доступности поверхностных реакционных центров субстрата, и диффузии озона к поверхностным реакционным группам в порах субстрата, замедляющейся по мере заполнения пор водой. Показано, что вода необходима не только для формирования структуры лигноцеллюлозного материала, но и для создания среды, обеспечивающей транспорт реагента и продуктов реакции.
Поскольку значения ТНВ для растительной биомассы различного типа близки – для древесины в среднем 30%, для однолетних культур 40–50%, то можно предположить, что оптимальное содержание воды при озонировании любых видов растительных материалов должно составлять 50–80% (${{m}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$/mраст. мат).
Лигнин лиственной древесины содержит гваяцильные и сиренгильные структурные субъединицы, хвойной – гваяцильные, лигнин соломы – гваяцильные, сиренгильные, и кумаровые. Известно, что в ряду соединений “фенол-гваякол-2,6-диметоксифенол”, моделирующих соответственно кумаровые (H), гваяцильные (G) и сиренгильные (S) остатки, константы скорости реакции с молекулярным озоном возрастают на несколько порядков: 103 → 105 → >107 л/(моль с) [18, 19], что должно было бы отразиться на различии в реакционной способности образцов биомассы разной природы. Однако, как показано в [17], на практике этого не наблюдается. Кинетические кривые поглощения озона для древесины сосны, осины и пшеничной соломы практически совпадают, из чего можно заключить, что окислительная деструкция лигнина при озонировании растительной биомассы полностью лимитируется процессами диффузии озона.
Влияние расхода озона на реакционную способность растительной биомассы в процессах ферментативного гидролиза в сахара
Известно, что в процессе озонирования лигноцеллюлозных материалов озон, как электрофильный агент, в первую очередь атакует ароматические структуры лигнина [20]. В результате происходит разрыв ароматического кольца с образованием низкомолекулярных водорастворимых органических кислот (муравьиной, глиоксалевой, щавелевой, уксусной и др.). Эти продукты обнаружены с помощью ВЭЖХ при озонировании древесных опилок осины [7], пшеничной соломы [21] и сосны [22]. ИК-спектры образцов соломы [21] и осины [23] различной степени обработки озоном показывают разрушение ароматической структуры лигнина и образование большого количества алифатических карбонильных и карбоксильных групп.
При озонировании возможны также реакции деполимеризации за счет разрыва эфирных связей, а также неспецифические радикальные реакции [24, 25]. Однако роль радикальных процессов невелика, по крайней мере, в начале обработки, так как озонирование протекает фактически в сильно кислой среде. Эта среда формируется в порах биомассы, вследствие накопления продуктов озонолиза. Значение рН резко падает от исходных нейтральных значений (биомасса пропитана дистиллированной водой) до 2 при расходе озона 2 ммоль/г [7].
Как показано в [21], при озонировании пшеничной соломы на продолжительном этапе озонирования (время озонирования 50 мин, расход озона до 2 ммоль/г) озон расходуется преимущественно на реакцию с ароматическими структурными единицами лигнина.
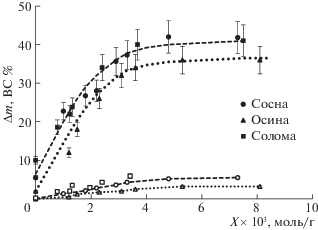
В результате окислительной деструкции лигнина происходит разрушение лигноуглеводного комплекса, и часть гемицеллюлоз может быть также удалена из образца промыванием. Зависимость потери массы образцов древесины и соломы после озонирования и промывания водой показана на рис. 2. На рис. 2 также представлена зависимость количества восстанавливающих сахаров, в водорастворимых продуктах озонирования образцов от расхода озона. Эта величина не превышает 10% от массы входящих в растительный материал углеводов. Общая потеря массы образцов древесины и соломы составляет 35–40%. На основании вида кривых и оценки материального баланса водорастворимых продуктов озонирования можно предположить, что потеря массы образца обусловлена, в основном, удалением лигнина. После деструкции лигнина и выхода из лигноуглеводной матрицы части связанных с ним гемицеллюлоз (расход озона ≥3 ммоль О3/г) потеря массы практически прекращается. Дальнейшие окислительные превращения биомассы не сопровождаются заметной потерей массы образца.
Рис. 2.
Зависимости потери массы (∆m) образцов лигноцеллюлозных материалов после озонирования и промывания водой и количества восстанавливающих сахаров (ВС) в водорастворимых продуктах озонирования от расхода озона.
В табл. 1 приведены величины выхода продуктов ферментативного гидролиза обработанных озоном образцов растительной биомассы (восстанавливающих сахаров за 48 ч реакции ВС48). Расход озона в процессе обработки указан в единицах “моль/г”. Для оценки стехиометрических соотношений озона и окисляемых компонентов древесины, расход озона удобно пересчитать на фенилпропановую структурную единицу лигнина (ФПЕ). Зная среднюю молекулярную массу структурной единицы лигнина, характерного для данного типа биомассы, и содержание лигнина в образце, можно рассчитать содержание структурных субъединиц в единице массы образца. Сделав допущение, что озон реагирует только с ароматическими структурными единицами лигнина по механизму [20], можно оценить количество озона, необходимое для разрушения ароматики (из расчета 3 моль О3/моль ФПЕ). На рис. 3 приведены зависимости выхода восстанавливающих сахаров от расхода озона в пересчете на ФПЕ содержащегося в материале лигнина.
Рис. 3.
Зависимости выхода восстанавливающих сахаров за 48 ч гидролиза образцов растительной биомассы от расхода озона в процессе предобработки.
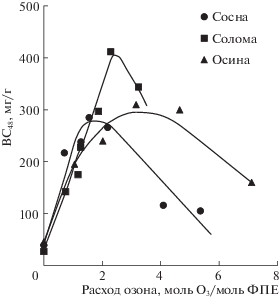
Как видно из рис. 3, обработка озоном приводит к значительному повышению реакционной способности растительных субстратов: Количество продуктов реакции сначала растет пропорционально увеличению расхода озона. На основании данных, полученных в [21, 26] можно заключить, что область роста реакционной способности озонированных образцов соответствует области удаления из лигноцеллюлозного материала лигнина. Удаление лигнина и частично связанных с ним гемицеллюлоз делает целлюлозу более доступной для ферментов, и реакция гидролиза протекает быстрее и более глубоко.
Длительное озонирование (расход озона >3–4 ммоль/г) вызывает уменьшение степени конверсии субстратов. Аналогичный результат, полученный в [27] для пшеничной соломы, объясняется авторами ингибирующим действием продуктов окисления лигнина (карбоновых кислот) и гемицеллюлоз (фурановых производных). Однако, для образцов осины, тщательно промытых после озонирования водой, также наблюдается уменьшение выхода ВС [7].
Другой причиной дезактивации озонированных растительных субстратов может быть, так называемый, структурный коллапс. При высокой степени делигнификации происходит деструкция лигноуглеводной матрицы, целлюлозные волокна слипаются, что приводит к значительному уменьшению доступной для ферментов поверхности субстрата. С помощью СЭМ этот процесс был визуализирован нами при исследовании образцов озонированной пшеничной соломы с расходом озона >3 моль О3/моль ФПЕ [28].
Авторы [29, 30] при длительной обработке биомассы (пшеничной соломы) озоном наблюдали конденсацию ароматических фрагментов макромолекул лигнина, которые могут частично экранировать целлюлозу.
При избыточных дозах озона и небольшом содержании остаточного лигнина также повышается вероятность окислительной деструкции целлюлозы. Хотя скорость реакции целлюлозы [19] с молекулярным озоном невелика по сравнению с лигнином [31], целлюлоза может подвергаться неспецифическому действию радикалов, образующихся при разложении озона. Происходящее при расщеплении гликозидных связей модифицирование целлюлозы [32], приводит к снижению выхода глюкозы при последующем ферментативном гидролизе. Частичное окисление полисахаридов при длительном озонировании пшеничной соломы, а также опилок сосны установлено с помощью ИК-спектроскопии [21, 33].
Из рис. 3 следует, что максимум выхода сахаров при гидролизе образцов древесины и соломы наблюдается при расходе озона около 3 моль О3/моль ФПЕ. Такой результат подтверждает предположение о том, что в процессе предобработки озон преимущественно расходуется на озонолиз ароматической структуры лигнина. Таким образом, при содержании лигнина в биомассе, в среднем, 20–30%, для максимального выхода сахаров в процессе озонной предобработки расход озона должен составлять 10–15 мас. %.
В [34] нами показано, что реакционная способность предобработанных озоном растительных субстратов определяется количеством поглощенного озона и практически не зависит от того, при каких условиях озонирования данный расход озона достигнут (обработка должна осуществляться в условиях оптимальной влажности 50–100%).
При оценке расхода озона, необходимого для оптимальной степени делигнификации, следует исходить из величины содержания лигнина в образце. Если расход озона будет превышать количество, достаточное для разрушения системы сопряженных связей лигнина, будут созданы условия для нежелательной окислительной деструкции полисахаридов. Кроме того, следует учитывать, что не весь лигнин может вступать в реакцию с озоном. Исследование динамики озонной делигнификации пшеничной соломы показало структурную гетерогенность лигнина (наличие “свободного” и “связанного” или “доступного” и “малодоступного” лигнина) [28]. При изучении образцов озонированной соломы с помощью метода ИК-спектроскопии установлено, что даже при высоком значении поглощения озона (7.0 ммоль/г) интенсивность полос поглощения, характерных для ароматического кольца лигнина, остается достаточно высокой [21]. Этот результат свидетельствует о том, что часть ароматических структур биомассы недоступна озону.
Известно, что основная часть лигнина совместно с гемицеллюлозами в виде аморфной массы локализована между целлюлозными микрофибриллами. Другая часть лигнина может быть более тесно связана с целлюлозой за счет образования ковалентных связей и проникновения внутрь микрофибрилл целлюлозы [35]. В [36] показано, что в хвойной (конифериловой) древесине до половины целлюлозы ковалентно связано с лигнином, в лиственной древесине не более 17%. Таким образом, удалить лигнин из хвойной древесины сложнее. Возможно, этим объясняется тот факт, что максимум выхода ВС48 на рис. 3 для сосны наблюдается при более низких расходах озона: пролонгированное озонирование не может удалить малодоступный лигнин, но может привести к окислению полисахаридов и другим нежелательным процессам.
Таким образом, на основании проведенных исследований и анализа литературных данных можно заключить, что озонирование лигноцеллюлозной биомассы является эффективным методом повышения ее реакционной способности в последующих реакциях ферментативного гидролиза в сахара.
Для обеспечения максимальной скорости реакции растительных материалов с озоном и минимальных затрат озона процесс предобработки необходимо проводить при относительной влажности образца, близкой к значениям удвоенной точки насыщения волокна 2ТНВ, что соответствует 50–80% (${{m}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$/mраст. мат).
Определяющим параметром предобработки является количество поглощенного озона. При соблюдении оптимального режима влажности образца практически не имеет значения, при каких условиях озонирования данный расход озона достигнут. Оптимальные значения расхода озона составляют 2–3 моль О3/моль ФПЕ (в пересчете на фенилпропановую структурную субъединицу лигнина). Пролонгированное озонирование с расходом озона >3 моль О3/моль ФПЕ приводит к дезактивации образцов.
Список литературы
Binder A., Pelloni L., Fiechter A. // Eur. J. Appl. Microbiol. Biotechnol. 1980. V. 11. P. 1.
Neely W.C. // Biotechnol. Bioeng. 1984. V. 26. P. 59.
Vidal P.F., Molinier J. // Biomass. 1988. V. 16. P. 1.
Travaini R., Martín-Juárez J., Lorenzo-Hernando A., Bolado-Rodríguez S. // Bioresour. Technol. 2016. V. 199. P. 2.
Dowe N., McMillan J. SSF Experimental Protocols – Lignocellulosic Biomass Hydrolysis and Fermentation. Laboratory Analytical Procedure (LAP) Issue Date: 10/30/2001.
Фенгель Д., Вегенер Г. Древесина: химия, ультраструктура, реакции. М.: Лесная промышленность, 1988. 512 с.
Ben’ko E.M., Manisova O.R., Lunin V.V. // Russ. J. Phys. Chem. A. 2013. V. 87 (7). P. 1108.
Somogyi M. // J. Biol. Chem. 1952. V. 200. P. 200.
Sugimoto T., Magara K., Hosoya S. et al. // Holzforshung. 2009. V. 63 (5). P. 537.
Miura T., Lee S.H., Inoue S., Endo T. // Bioresour. Technol. 2012. V. 126. P. 182.
Vidal P.F., Molinier J. // Biomass. 1988. V. 16. P. 1.
Mamleeva N.A., Kharlanov A.N., Lunin V.V. // Russ. J. Phys. Chemi. A. 2013. V. 87 (1). P. 32.
Travaini R., Otero M.D.M., Coca M. et al. // Bioresour. Technol. 2013. V. 133. P. 332.
Souza-Correa J.A., Oliveira C., Nascimento V.M. et al. // Appl. Biochem. Biotechnol. 2014. V. 172. P. 1663.
Cheng Li, Li Wang, Zhengxing Chen et al. // Bioresource Technology. 2015. V. 183. P. 240.
Garcia-Cubero M.T., Gonzalez-Benito G., Indacoechea I. // Ibid. 2009. V. 100. P. 1608.
Ben’ko E.M., Manisova O.R., Lunin, V.V. // Russ. J. Phys. Chem. A. 2017. V. 91. P. 1117.
Kaneko H., Hosoya S., Iiyama K., Nakano J. // J. Wood Chem. Technol. 1983. V. 3. P. 399.
Hoigne J. Hand book of ozone technology and Applications. Ann. Aiber Science Publisher. M. I. 1982. V. 1.
Bailey P.S. Ozonation in Organic Chemistry. V. II. N.Y.: Acad. Press, 1982.
Ben’ko E.M., Chukhchin D.G., Mamleeva N.A. et al. // Russ. J. Phys. Chem. A. 2020. № 6.
Mamleeva N.A., Babayeva N.A., Kharlanov A.N., Lunin V.V. // Ibid. 2019. A. V. 93 (1). P. 37.
Mamleeva N.A., Kharlanov A.N., Lunin V.V. // Sctechnology. 2019. № 19. P. 32.
Gierer J. // Holzforschung. 1982. V. 36. P. 55.
Ragnar M., Eriksson T., Reitberger T. // Holzforschung. 1999. V. 53. P. 292.
Mamleeva N.A., Autlov S.A., Bazarnova N.G. et al. // Pure Appl. Chem. 2009. V. 81 (11). P. 2081.
García-Cubero M.T., Palacín L.G., González-Benito G., et al. // Bioresour. Technol. 2012. V. 107. P. 229.
Ben’ko E.M., Chukhchin D.G., Lunin V.V. // Holzforschung. 2020 (accepted for publication).
Bule M.V., Gao A.H., Hiscox B., Chen S. // J. Agric. Food Chem. 2013. V. 61. P. 3916.
Kádár Z., Schultz-Jensen N., Jensen J.S. et al. // Biomass Bioenergy. 2015. V. 81. P. 26.
Nompex P., Dore M. // Ozone Sci. Eng. 1991. V. 13 (3). P. 265.
Marcq O., Barbe J.M. // Res. Chem. Intern. 1995. V. 21 (3–5). P. 205.
Мамлеева Н.А., Харланов А.Н., Чухчин Д.Г. и др. // Химия растительного сырья. 2019. № 1. С. 85.
Бенько Е.М., Лунин В.В. // Химия растительного сырья. 2019. № 4. В печати.
Sjostrom E. Wood Chemistry: fundamentals and applications. Academic Press Inc., 1981. 223 p. ISBN: 012647480X, 9780126474800
Jin Z., Katsumata K.S., Lam T.B.T., Iiyama K. // Biopolymers. 2006. V. 83. P. 103.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


