Журнал физической химии, 2020, T. 94, № 9, стр. 1379-1384
Кинетические особенности деструкции тетра(1,2,5-селенодиазоло)порфиразина в протоноакцепторных средах
О. А. Петров a, *, К. А. Аганичева a, Г. А. Гамов a, А. Н. Киселев b
a Ивановский государственный химико-технологический университет
Иваново, Россия
b Российская академия наук, Институт химии растворов им. Г.А. Крестова
Иваново, Россия
* E-mail: poa@isuct.ru
Поступила в редакцию 04.12.2019
После доработки 18.12.2019
Принята к публикации 21.01.2020
Аннотация
Исследовано состояние тетра(1,2,5-селенодиазоло)порфиразина в различных по основности протоноакцепторных средах. Показано, что порфиразин с селенодиазольными кольцами образует в диметилсульфоксиде устойчивый во времени комплекс с переносом протонов. Введение добавок азотсодержащих оснований в диметилсульфоксид приводит к дестабилизации этого комплекса с последующей деструкцией порфиразинового макроцикла. Установлено, что кинетические параметры процесса зависят от величины рKа основания, а также от пространственного экранирования атома азота в составе молекулы.
Аннелированные порфиразины, благодаря разнообразным возможностям модификации их структуры, относятся к числу перспективных соединений в качестве электро- и фотокатализаторов окисления и восстановления, жидкокристаллических веществ, химических сенсоров и фотосенсибилизаторов [1, 2]. Более или менее жесткие ограничения на их практическое применение оказывает поведение порфиразиновых молекул в протоноакцепторных средах. К настоящему времени наиболее полные сведения о деструкции тетрапиррольных макроциклов получены для β-замещенных порфиразинов, замещенных фталоцианина и тетрапиразинопорфиразина в системе азотсодержащее основание – диметилсульфоксид (бензол) [3–5]. Данных об устойчивости порфиразинов с аннелированными пятичленными гетероциклами в протоноакцепторных средах существенно меньше [6, 7].
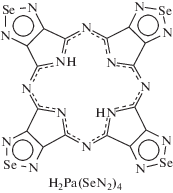
В связи с этим в данной работе исследовано состояние тетра(1,2,5-селенодиазоло)порфиразина (H2Pa(SeN2)4) в диметилсульфоксиде, а также в системе азотсодержащее основание (В) – диметилсульфоксид (ДМСО). В качестве В были взяты пиридин (Py), 2-метилпиридин (MePy), морфолин (Morph), пиперидин (Pip), н-бутиламин (BuNH2), трет-бутиламин (ButNH2), диэтиламин (Et2NH)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тетра(1,2,5-селенодиазоло)порфиразин синтезировали по методике [8]. Основания подвергали очистке [9]. В инертных малополярных растворителях (бензоле, хлороформе и др.) исследуемый порфиразин не растворим, подобно большинству замещенных тетрапиразинопорфиразина [5–7]. Поэтому, исследования проводили в диметилсульфоксиде, который выдерживали в течение суток над MgSO4 и CaO, а затем перегоняли под уменьшенным давлением (2–3 мм рт. ст., температура кипения –40°С). Для проведения кинетических измерений в термостатируемую кювету спектрофотометра SHIMADZU–UV-1800 помещали свежеприготовленный раствор H2Pa(SeN2)4 в ДМСО с постоянной концентрацией и добавляли переменные количества азотсодержащих оснований. Скорость деструкции комплекса с переносом протонов – H2Pa(SeN2)4 · 2ДМСО определяли по уменьшению оптической плотности раствора на длине волны λ = 676 нм. Текущую и конечную концентрации комплекса определяли по формуле:
где Ао, Аτ, А∞ – оптические плотности растворов в начальный момент времени, в момент времени τ и после завершения реакции (τ∞); C° и C – начальная и текущая концентрации комплекса H2Pa(SeN2)4 · 2ДМСО. Все измерения проводили в условиях реакции псевдопервого порядка, поэтому наблюдаемую константу скорости деструкции H2Pa(SeN2)4 · 2ДМСО рассчитывали по формуле: Точность кинетических параметров оценивалась с помощью обычных методов статистики при доверительном интервале 95%. Использование метода Стьюдента позволило определить относительную ошибку в значениях kH, которая составила 2–6%, а в определении Еа не более 10%. Квантовохимические расчеты были выполнены с помощью программного обеспечения Gaussian09 [10] и оптимизированы с использованием полуэмпирического метода РМ6 [11]. Оптимизированная структура соответствовала точке минимума полной энергии, что было подтверждено путем расчета частот колебаний. Диметилсульфоксид учитывался в рамках подхода CPCM.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
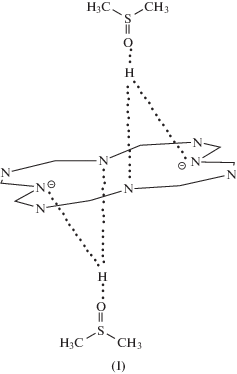
В предварительных опытах было установлено, что электронный спектр поглощения (ЭСП) H2Pa(SeN2)4 в ДМСО содержит в видимой области нерасщепленную Q-полосу с λ = 676 нм, подобно спектрам металлокомплексов H2Pa(SeN2)4 (D4h-симметрия молекулы [12]). Этот факт указывает на то, что H2Pa(SeN2)4 в присутствии слабоосновного ДМСО проявляет свойства двухосновной NH-кислоты и образует комплекс с переносом протонов – H2Pa(SeN2)4 · 2ДМСО. В подобных комплексах протоны NH-групп, связанные с двумя внутрициклическими атомами азота и атомом кислорода молекул ДМСО, посредством водородных связей, располагаются над и под плоскостью макроцикла, что обеспечивает D4h-симметрию распределения зарядов [3, 4, 13]. При этом перенос протонов от NH-кислоты к основанию, приводящий к возникновению разделенных растворителем ионных пар с последующей их диссоциацией в среде слабоосновного ДМСО представляется маловероятным. Кислотно-основное взаимодействие (КОВ) H2Pa(SeN2)4 с ДМСО, скорее всего, ограничивается стадией образования Н-комплекса (Н-ассоциата I)
Полученные спектральные данные и выводы на их основе по строению H2Pa(SeN2)4 · 2ДМСО достаточно хорошо согласуются с данными квантово-химических расчетов, согласно которым образование Н-комплекса в среде ДМСО является стабильной структурой, но только при достаточно сильном отклонении селенодиазольных колец от плоскости σ – остова порфиразинового макроцикла (рис. 1). Этот факт не является неожиданным, поскольку наблюдается для порфиразинов с различным типом аннелирования или замещения по пиррольным кольцам молекулы [14].
Образующийся в результате КОВ комплекс H2Pa(SeN2)4 · 2ДМСО не подвергается распаду стечением времени. На это указывает характер ЭСП H2Pa(SeN2)4 в ДМСО, который остается без изменений в течение ∼80 ч при 323 K.
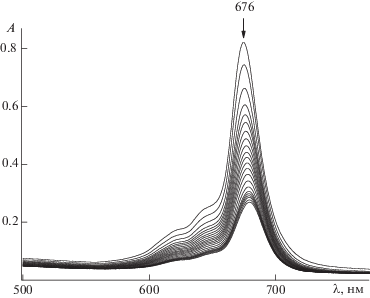
Дальнейшие исследования показали, что если в диметилсульфоксид вводить достаточно слабые основания (пиридин, 2-метилпиридин), то комплекс H2Pa(SeN2)4 · 2ДМСО сохраняет ЭСП с λ = = 676 нм в течение ∼300 мин при 323 K в интервале концентраций $С_{{{\text{Py}}}}^{^\circ }$ = $С_{{{\text{Mepy}}}}^{^\circ }$ = 0.31–9.93 моль/л. Напротив, добавки более сильных оснований (морфолина, пиперидина, н-бутиламина, трет-бутиламина, диэтиламина) приводят к деструкции комплекса H2Pa(SeN2)4 · 2ДМСО. Независимо от природы основания с течением времени наблюдается уменьшение интенсивности нерасщепленной Q-полосы при λ = 676 нм (рис. 2) и полосы Соре, характеризующей наличие пиррольных фрагментов в макроцикле. Одновременно с этим наблюдается обесцвечивание раствора. При СMorph > 2.89 [7], СPip > 2.02 [7], ${{С}_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}}$ > 1.01 и $С_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{{\text{t}}}$ > 6.78 моль/л в ДМСО деструкция комплекса H2Pa(SeN2)4 · 2ДМСО существенно облегчается и протекает со скоростями, не позволяющими измерить их обычными спектрометрическими методами.
Рис. 2.
Изменение электронного спектра поглощения H2Pa(SеN2)4 · 2ДМСО в системе н-бутиламин–ДМСО в течение 40 мин при $С_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = 0.05 моль/л, Т = 308 K.
Результаты эксперимента (табл. 1) показывают, что среди изученных ациклических азотсодержащих оснований максимальная скорость деструкции комплекса H2Pa(SeN2)4 · 2ДМСО наблюдается в присутствии н-бутиламина (pKа = = 10.60 [15]). Замена н-бутиламина на близкий по основности трет-бутиламин (pKа = 10.68 [15]), имеющий у атома азота более объемный алкильный заместитель, приводит к уменьшению значений k298 более, чем в 90 раз. При этом величина Еа процесса не претерпевает изменений. Наряду с разветвлением углеводородной цепи, стабилизации комплекса H2Pa(SeN2)4 · 2ДМСО способствует увеличение числа алкильных заместителей в амине. Так, в ряду BuNH2 → ButNH2 → Et2NH скорость деструкции, судя по величинам k298, уменьшается в ∼140 раз. В случае циклических азотсодержащих оснований достаточно быстрый распад комплекса H2Pa(SeN2)4 · 2ДМСО происходит в присутствии пиперидина (табл. 2), который обладает достаточно высокой протоноакцепторной способностью и имеет стерически доступный атом азота в составе молекулы [16]. Понижение pKа на ∼2.5 единицы при переходе от пиперидина (pKа = 11.23 [15]) к морфолину (pKа = 8.50 [15]) не влияет на пространственное строение молекулы [17], однако, судя по величинам k298, противодействует деструкции комплекса H2Pa(SeN2)4 · · 2ДМСО. В отличие от морфолина, добавки более слабых оснований (пиридина (pKа = 5.23 [14]), 2-метилпиридина (pKа = 5.97 [14]) в ДМСО не приводят к потере кинетической устойчивости комплекса H2Pa(SeN2)4 · 2ДМСО.
Таблица 1.
Кинетические параметры реакции деструкции комплекса H2Pa(SеN2)4 · 2ДМСО в системе азотсодержащее основание – ДМСО, ($С_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa(Sе}}{{{\text{N}}}_{{\text{2}}}}{{{\text{)}}}_{{\text{4}}}}\, \cdot \,{\text{2ДМСО}}}}^{^\circ }$ = = 1.09 × 10–5 моль/л)
| $С_{{\text{B}}}^{^\circ }$, моль/л | Т, K | kН × 104, с–1 | k × 104, л/(моль с) | Еа, кДж/моль |
|---|---|---|---|---|
| н-Бутиламин | ||||
| 0.05 | 298 | 2.75 | 55.00 | 39 |
| 308 | 4.40 | 88.00 | ||
| 318 | 7.45 | 149.10 | ||
| 0.13 | 298 | 7.85 | 56.05 | 40 |
| 308 | 13.30 | 95.00 | ||
| 318 | 22.00 | 157.05 | ||
| 0.25 | 298 | 14.17 | 54.50 | 38 |
| 308 | 22.60 | 87.00 | ||
| 318 | 37.45 | 144.07 | ||
| 0.51 | 298 | 28.85 | 55.50 | 39 |
| 308 | 47.00 | 90.40 | ||
| 318 | 77.50 | 149.00 | ||
| 1.01 | 298 | 55.55 | 55.00 | 40 |
| 308 | 91.90 | 91.05 | ||
| 318 | 153.50 | 152.00 | ||
| трет-Бутиламин | ||||
| 1.13 | 298 | 0.65 | 0.57 | 29 |
| 303 | 0.80 | 0.70 | ||
| 313 | 1.10 | 0.98 | ||
| 323 | 1.60 | 1.41 | ||
| 2.26 | 298 | 1.50 | 0.67 | 27 |
| 303 | 1.80 | 0.80 | ||
| 313 | 2.55 | 1.12 | ||
| 323 | 3.50 | 1.54 | ||
| 4.52 | 298 | 2.83 | 0.62 | 28 |
| 303 | 3.40 | 0.75 | ||
| 313 | 4.75 | 1.05 | ||
| 323 | 6.80 | 1.50 | ||
| 6.78 | 298 | 4.80 | 0.70 | 28 |
| 303 | 5.76 | 0.85 | ||
| 313 | 8.20 | 1.21 | ||
| 323 | 11.50 | 1.70 | ||
| Диэтиламин | ||||
| 1.20 | 298 | 0.50 | 0.40 | 32 |
| 303 | 0.60 | 0.50 | ||
| 313 | 0.90 | 0.75 | ||
| 323 | 1.35 | 1.10 | ||
| 2.40 | 298 | 1.05 | 0.42 | 30 |
| 303 | 1.25 | 0.50 | ||
| 313 | 1.75 | 0.70 | ||
| 323 | 2.65 | 1.05 | ||
| 4.80 | 298 | 1.80 | 0.35 | 34 |
| 303 | 2.35 | 0.45 | ||
| 313 | 3.60 | 0.70 | ||
| 323 | 5.45 | 1.05 | ||
| 9.18 | 298 | 4.10 | 0.40 | 31 |
| 303 | 5.40 | 0.53 | ||
| 313 | 7.60 | 0.75 | ||
| 323 | 11.70 | 1.15 | ||
Таблица 2.
Кинетические параметры реакции деструкции комплекса H2Pa(SеN2)4 · 2ДМСО в системе азотсодержащее основание – ДМСО [7], ($С_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa(Sе}}{{{\text{N}}}_{{\text{2}}}}{{{\text{)}}}_{{\text{4}}}}\, \cdot \,{\text{2ДМСО}}}}^{^\circ }$ = = 1.09 × 10–5 моль/л)
| Основание | $С_{{\text{B}}}^{^\circ }$, моль/л | kН × 104, с–1 | k298 × 104, л/(моль с) | Еа, кДж/моль |
|---|---|---|---|---|
| Морфолин | 1.44 | 14.80 | 10.25 | 28 |
| Пиперидин | 1.01 | 51.50 | 51.00 | 36 |
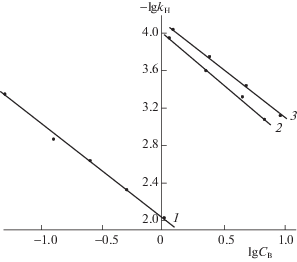
Процесс деструкции H2Pa(SeN2)4 · 2ДМСО описывается уравнением первого порядка по комплексу с переносом протонов (рис. 3). Порядок реакции по н-бутиламину, трет-бутиламину и диэтиламину, численно равный тангенсу угла наклона прямых, представленных на рис. 4, близок к единице.
Рис. 3.
Зависимости lg(С°/С) от времени деструкции комплекса H2Pa(SеN2)4 · 2ДМСО в системе азотсодержащее основание – ДМСО при концентрациях (моль/л): 1 – $С_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = 0.13 (308 K), 2 – $С_{{{\text{B}}{{{\text{u}}}^{{\text{t}}}}{\text{N}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = 6.78 (313 K), 3 – $С_{{{\text{E}}{{{\text{t}}}_{{\text{2}}}}{\text{NH}}}}^{^\circ }$ = 4.80 (323 K).
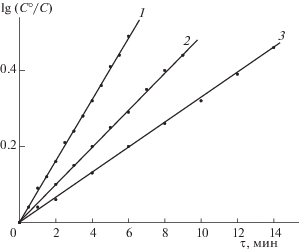
Рис. 4.
Зависимости lg kН от $\lg С_{{\text{B}}}^{^\circ }$ для деструкции комплекса H2Pa(SеN2)4 · 2ДМСО в системе азотсодержащее основание – ДМСО в присутствии н-бутиламина при 308 K (1), трет-бутиламина при 313 K (2) и диэтиламина при 313 K (3).
Следовательно,
(4)
$--d{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa}}{{{({\text{Se}}{{{\text{N}}}_{{\text{2}}}})}}_{{\text{4}}}}}}}{\text{/}}d\tau = k{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa}}{{{({\text{Se}}{{{\text{N}}}_{{\text{2}}}})}}_{{\text{4}}}}}}}{{C}_{{\text{В}}}},$Аналогичным кинетическим уравнением второго порядка описывается процесс деструкции комплекса H2Pa(SN2)4 · 2ДМСО в системе ДМСО – морфолин (пиперидин) [6].
Представляется вполне вероятным, что причина распада порфиразинового макроцикла в сильноосновных средах с достаточно высокой диэлектрической проницаемостью среды связана с протеканием конкурентной реакции за протон, которая может быть представлена в виде последовательно протекающих стадий:
(5)
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{\text{Pa(Sе}}{{{\text{N}}}_{{\text{2}}}}{{{\text{)}}}_{4}} \cdot 2{\text{ДМСО}} + {\text{В}}\;\xrightarrow{{{{k}_{1}}}} \\ \xrightarrow{{{{k}_{1}}}}\;{{{\text{[HPa(Sе}}{{{\text{N}}}_{{\text{2}}}}{{{\text{)}}}_{{\text{4}}}} \cdot {\text{ДМСО}}]}^{--}} + {\text{Н}}{{{\text{В}}}^{ + }} + {\text{ДМСО}}, \\ \end{gathered} $(6)
$\begin{gathered} {{{\text{[HPa(Sе}}{{{\text{N}}}_{{\text{2}}}}{{{\text{)}}}_{4}} \cdot {\text{ДМСО}}]}^{--}} + {\text{В}}\;\xrightarrow{{{{k}_{2}}}} \\ \xrightarrow{{{{k}_{2}}}}\;{{{\text{[Pa(Sе}}{{{\text{N}}}_{{\text{2}}}}{{{\text{)}}}_{{\text{4}}}}{\text{]}}}^{{2--}}} + {\text{Н}}{{{\text{В}}}^{ + }} + {\text{ДМСО}}. \\ \end{gathered} $На стадиях (5) и (6) молекулы основания вступают во взаимодействие с выведенными из плоскости макроцикла атомами водорода H2Pa(SеN2)4 · · 2ДМСО и благодаря более выраженной протоноакцепторной способности вытесняют молекулы ДМСО. Образующаяся при этом дианионная форма тетра(1,2,5-селенодиазоло)порфиразина относится к группе симметрии D4h и спектрально не отличается от комплекса H2Pa(SеN2)4 · · 2ДМСО. Из-за отсутствия эффективной компенсации избыточного отрицательного заряда в макроцикле дианионная форма [Pa(SеN2)4]2– подвергается деструкции с образованием низкомолекулярных бесцветных продуктов реакции. При этом уменьшение концентрации H2Pa(SеN2)4 · · 2ДМСО происходит без появления в реагирующей системе промежуточной спектральной формы – [НPa(SеN2)4]–. Это обстоятельство дает основание полагать, что k1 < k2.
Увеличение рKа основания приводит к увеличению скорости деструкции H2Pa(SеN2)4 · · 2ДМСО и способствует образованию кинетически неустойчивой формы – [Pa(SеN2)4]2–. Напротив, если протоноакцепторный центр основания оказывается пространственно экранирован объемными алкильными заместителями, то это создает пространственные помехи при протекании стадии (5), и как следствие, более быстро протекающей стадии (6). В этом случае основанию труднее конкурировать с ДМСО за протон, несмотря на его высокую протоноакцепторную способность.
Список литературы
Novakova V., Donzello P.A., Ercolani C. et al. // Coord. Chem. Rev. 2018. V. 361. P. 73.
The Porphyrins Handbook. Phthalocyanines: Properties and Materials / Ed. by K.M. Kadish, M.K. Smith, R. Guilard. Amsterdam, Boston, London, N.Y., Oxford, Paris, S. Diego, S. Francisco, Singapore, Sydney, Tokio: Acad. Press, 2003. V. 17. 284 p.
Петров О.А. // Журн. общ. химии. 2013. Т. 83. № 4. С. 681.
Петров О.А. // Там же. 2013. Т. 83. № 6. С. 1006.
Петров О.А., Осипова Г.В., Горнухина О.В. // Журн. физ. химии. 2017. Т. 91. № 3. С. 459.
Петров О.А., Киселев А.Н., Сырбу С.А. // Росс. хим. журнал. 2016. Т. 60. № 2. С. 89.
Петров О.А., Киселев А.Н., Телецкий З.А., Беляева А.О. // Журн. общ. химии. 2019. Т. 89. № 3. С. 400.
Bauer E., Ercolani C., Galli P., Popkova I., Stuzhin P. // J. Pophyrins Phthalocyanines. 1999. V. 3. P. 371.
Титце Л., Айхер Т. Препаративная органическая химия. М.: Мир, 1999. 704 с.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 09, Revision A.02. Gaussian Inc., Wallingford CT, 2016.
Stewart J.J.P. // J. Mol. Model. 2007. V. 13. Iss. 12. P. 1173.
The Porpyrins Handbook. Phthalocyanines: Synthesis / Ed. by K.M. Kadish, M.K. Smith, R. Guilard. Amsterdam, Boston, London, N.Y., Oxford, Paris, S. Diego, S. Francisco, Singapore, Sydney, Tokio: Acad. Press, 2003. V. 15. 369 p.
Кокарева Е.А., Петров О.А., Хелевина О.Г. // Журн. общ. химии. 2009. Т. 79. № 11. С. 1918.
Donzello P.M., Ercolani C., Novakova V. et al. // Coord. Chem. Rev. 2016. V. 309. № 2. P. 107.
CRC Handbook of Chemistry and Physics / Ed. by W.M. Haynes. N.Y.: Taylor and Francis, 2013. 2668 p.
Crowley P.J., Morris G.A., Robinson M.J.T. // Tetrahedron. Lett. 1976. V. 36. P. 3575.
Blackburne I., Katritzky A.R., Takeuchi Y. // Accounts. Chem. Res. 1975. V. 8. № 9. P. 3575.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии