Журнал физической химии, 2020, T. 94, № 8, стр. 1161-1166
Количественная оценка высаливающей способности неорганических солей в отношении оксиэтилированных поверхностно-активных веществ
А. М. Елохов a, b, *, А. В. Станкова a, c, А. Е. Леснов c, d
a Пермский государственный национальный исследовательский университет
614990 Пермь, Россия
b Естественнонаучный институт Пермского государственного национального исследовательского университета
614990 Пермь, Россия
c Российская академия наук, Уральское отделение, Институт технической химии
614013 Пермь, Россия
d Пермский государственный аграрно-технологический университет им. Д.Н. Прянишникова
614990 Пермь, Россия
* E-mail: elhalex@yandex.ru
Поступила в редакцию 26.08.2019
После доработки 24.10.2019
Принята к публикации 12.11.2019
Аннотация
Обобщены результаты оценки высаливающей способности неорганических солей в отношении моноалкилополиэтиленгликолей (синтанолов ДС-10 и АЛМ-10). Установлено влияние длины алифатического заместителя в молекуле ПАВ на способность к высаливанию. Установлены корреляционные зависимости между энергией гидратации ионов и их высаливающей способностью для моноалкиполиэтиленгликолей и оксиэтилированных нонилфенолов (неонолов АФ 9-12 и АФ 9-25).
Водорастворимые полимеры и оксиэтилированные поверхностно-активные вещества активно используются для выделения продуктов биотехнологических производств [1, 2] и предварительного концентрирования загрязнителей с последующим их определением различными физико-химическими методами [3, 4]. Наиболее сложным этапом разработки систем для жидкостной экстракции на основе водорастворимых полимеров и ПАВ является выбор высаливателя, обеспечивающего минимальную температуру экстракции и низкий расход используемых реагентов. Подробно исследованы закономерности высаливания неорганическими солями полиэтиленгликолей [5, 6] триблоксополимеров этиленоксида и пропиленоксида [7, 8], оксиэтилированных октилфенолов [9, 10], нонилфенолов [11, 12], алкилфенолов [13, 14] и первичных спиртов [15, 16]. Большая часть работ посвящена качественной оценке, при этом высаливающую способность можно оценить по зависимости температуры помутнения (Tп) раствора с фиксированной концентрацией ПАВ от концентрации электролита (молярной или моляльной) [17]. Предложено несколько подходов количественной оценки высаливающей способности. Первый подход основан на предположении, что зависимость ТП или ∆T от молярной концентрации высаливателя (C) является линейной [18]:
(1)
${{T}_{{\text{п}}}} = {{T}_{0}} + bC,\quad {\text{или}}\quad \Delta T = {{T}_{{\text{п}}}}--{{T}_{0}} = bC,$Высаливающую способность при этом оценивают по величине коэффициента b. При b < 0 соль обладает высаливающим действием, при b > 0 – всаливающим.
H. Schott [19] предложил оценивать высаливающую способность не солей, а отдельных ионов. Для расчета величины снижения температуры помутнения ионом (∆Tион) принимают, что $\Delta {{T}_{{{\text{N}}{{{\text{O}}}_{{\text{3}}}}}}}$ = 0, при этом общая величина снижения температуры помутнения солью KatnAnm – величина аддитивная:
(2)
$\Delta T = n\Delta {{T}_{{{\text{Kat}}}}} + m\Delta {{T}_{{{\text{An}}}}}\quad {\text{при}}\quad С = {\text{const}}.$Наиболее приемлемым является подход, основанный на модифицированном уравнении Сеченова [20]:
(3)
$\lg \frac{{{{T}_{{\text{O}}}}}}{{{{T}_{{\text{П}}}}}} = kC\quad {\text{или}}\quad \lg {{T}_{{\text{П}}}} = \lg {{T}_{{\text{O}}}} - kC.$Настоящая работа посвящена разработке подхода к оценке высаливающей способности неорганических солей в отношении оксиэтилированных ПАВ с использованием уравнения Сеченова.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В работе использовали неионные оксиэтилированные ПАВ моноалкилполиэтиленгликоли, CnH2n – 1O(C2H4O)10H (n = 10–18 для синтанола ДС-10, n = 10–12 для синтанола АЛМ-10), хлориды натрия, калия, лития и аммония, гексагидраты хлорида магния и алюминия, бромид, нитрат и сульфат натрия, додекагидрат ортофосфата натрия квалификации “ч. д. а.”, дистиллированная вода.
Для оценки высаливающей способности неорганических солей строили графические зависимости температуры фазовых переходов “раствор” ↔ “расслаивание” (далее температура помутнения) от концентрации высаливателя в растворах содержащих 5.0 мас. % ПАВ. Методика исследования подробна изложена в работе [21].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментально установлено, что в двойных системах вода–синтанол ДС-10 и вода–синтанол АЛМ-10 наблюдается неограниченная растворимость компонентов во всем температурном интервале жидкого состояния.
На рис. 1 представлены политермы, характеризующие высаливающую способность неорганических солей непереходных металлов и аммония в отношении синтанола ДС-10. Вид политерм является аналогичным полученным ранее для оксиэтилированных нонилфенолов [22] и бис(алкилполиоксиэтилен)фосфата калия [23].
Рис. 1.
Политермы изоконцентрационных сечений систем вода–синтанол ДС-10–неорганическая соль (а–в), содержащие 5 мас. % синтанола ДС-10.
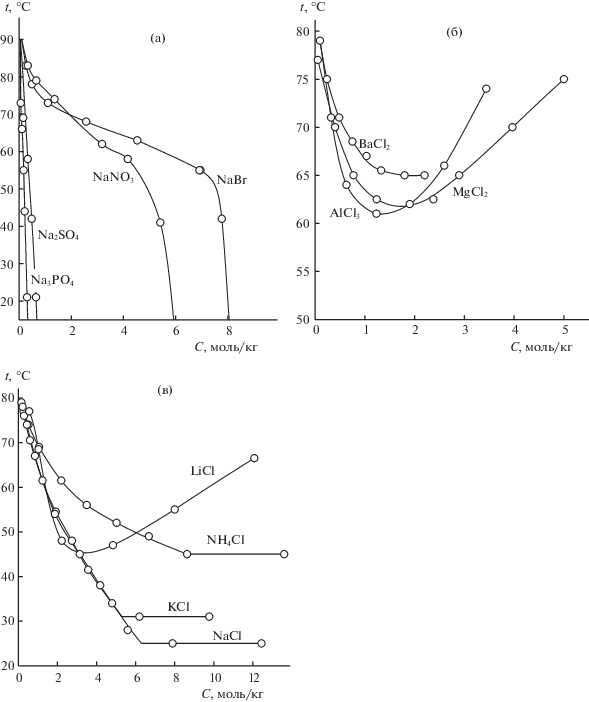
На рис. 1а представлены политермы иллюстрирующие влияние природы аниона соли на ее высаливающую способность. Для всех солей наблюдается высаливающий эффект, участок, отвечающий образованию области монтектического равновесия установлен не был, вследствие того, что ему отвечают температуры менее 0°С. Обращает на себя внимание бромид и нитрат натрия, политермы которых имеют характерный перегиб, отвечающий резкому увеличению высаливающей способности при концентрации более 4.5 моль/кг нитрата натрия и 7.5 моль/кг бромида натрия. Приняв за критерий минимальную концентрацию соли достаточную для образования расслаивания получим следующий ряд высаливающей способности солей натрия:
С ростом концентрации хлоридов однозарядных катионов в смесях, за исключением лития, температура помутнения снижается вплоть до насыщения смесей неорганической солью и образования области монотектического равновесия (рис. 1в). У хлоридов многозарядных катионов (рис. 1б) и катиона лития (рис. 1а) политерма характеризуется минимумом, отвечающему переходу от высаливающего действия с доминирующим влиянием аниона, к всаливающему с определяющим влиянием катиона соли. Критерием сравнения высаливающей способности можно считать температуру образования области монотектического равновесия для хлоридов однозарядных катионов и концентрацию соли, отвечающую минимуму температуры помутнения для хлоридов многозарядных катионов и лития. В этом случае ряды высаливающей способности следующие:
Общий вид политерм для синтанола АЛМ-10 аналогичен рассмотренным ранее для синтанола ДС-10. На рис. 2 представлено сопоставление политерм с хлоридами натрия и магния для обоих ПАВ. Так как определяющую роль в способности к высаливанию оксиэтилированных ПАВ играет количество оксиэтиленовых фрагментов в молекуле ПАВ, поэтому для синанолов ДС-10 и АЛМ-10 имеющих равную степень оксиэтилирования различия в высаливающей способности обусловлены строением гидрофобного радикала. Количественно степень гидрофильности ПАВ можно оценить по величине гидрофильно-липофильного баланса (ГЛБ), расчет которой осуществляли по способу Девиса [24]. В случае сильных высаливателей, например хлорида натрия, различие между изученными ПАВ минимально и наблюдается только в температуре образования области монотектического равновесия – для более гидрофильного синтанола АЛМ-10 (ГЛБ 4.95) она несколько выше, чем для синтанола ДС-10 (ГЛБ 6.14).
Рис. 2.
Политермы изоконцентрационных сечений систем: 1 – вода–синтанол АЛМ-10–NaCl, 2 – вода–синтанол ДС-10–NaCl, 3 – вода–синтанол ДС-10–MgCl2, 4 – вода–синтанол АЛМ-10–MgCl2.
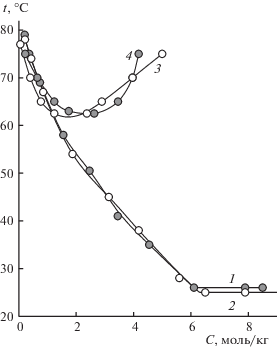
Для слабых высаливателей, например хлорида магния, различия в способности к высаливанию более выражены: в области высаливания (участок, отвечающий снижению температуры помутнения) более гидрофобный синтанол ДС-10 высаливается легче, а более гидрофильный синтанол АЛМ-10 легче всаливается (участок, отвечающий росту температуры помутнения).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для вычисления коэффициентов Сеченова использовали участок политермы наиболее близкий к экспоненциальной зависимости, чтобы коэффициент корреляции был не менее 0.95. Результаты вычисления k по уравнению (3) для синтанолов ДС-10, АЛМ-10, неонолов АФ 9-12 и АФ 9-25 представлены в табл. 1. Экспериментальные данные для расчета в случае неонолов взяты из работы [22].
Таблица 1.
Коэффициенты Сеченова (–k) для изученных солей
| ПАВ | LiCl | NaCl | KCl | NH4Cl | MgCl2 | BaCl2 | AlCl3 | NaNO3 | Na2SO4 | Na3PO4 |
|---|---|---|---|---|---|---|---|---|---|---|
| Неонол АФ-9-12 | 0.031 | 0.078 | 0.074 | 0.030 | 0.049 | 0.039 | 0.067 | 0.039 | 0.618 | 1.200 |
| Неонол АФ-9-25 | 0.015 | 0.067 | 0.075 | 0.022 | 0.044 | 0.045 | 0.034 | 0.018 | 0.820 | 1.565 |
| Синтанол ДС-10 | 0.125 | 0.079 | 0.081 | 0.049 | 0.102 | 0.118 | 0.146 | 0.022 | 0.655 | 1.488 |
| Синтанол АЛМ-10 | 0.029 | 0.060 | 0.069 | 0.050 | 0.061 | 0.122 | 0.153 | 0.025 | 0.640 | 1.520 |
Отрицательное значение коэффициента k свидетельствует о высаливающем действии всех изученных солей, причем, чем меньше значение k, тем выше высаливающая способность.
Величину коэффициента Сеченова для неорганической соли KatnAnm можно представить как сумму двух коэффициентов, отвечающих действию катиона (kkat) и аниона(kAn), при этом kkat должен быть положительным (всаливающее действие), а kAn как правило отрицательным (высаливающее действие):
Так как определяющим в высаливании является эффект аниона, построив линейную зависимость ln|ΔGhyd, An| = a + bk для солей натрия (табл. 2) и экстраполировав ее до ln|ΔGhyd, An| = 0 можно вычислить коэффициент Сеченова для катиона натрия: kNa = a/k.
Таблица 2.
Коэффициенты корреляционных уравнений ln|ΔGhyd, An| = a + bk для солей натрия
| ПАВ | a | –b | R2 |
|---|---|---|---|
| Неонол АФ-9-12 | 5.707 | 1.891 | 0.995 |
| Неонол АФ-9-25 | 5.749 | 1.415 | 0.998 |
| Синтанол ДС-10 | 5.779 | 1.504 | 0.980 |
| Синтанол АЛМ-10 | 5.802 | 1.463 | 0.975 |
Далее, зная величины kNa и k солей можно по уравнению (4) вычислить коэффициенты Сеченова для всех ионов (табл. 3). Полученные значения коэффициентов Сеченова для ионов удовлетворительно коррелируют с логарифмом абсолютного значения энергии Гиббса гидратации соответствующих ионов (табл. 4). Наблюдаемый разброс значений величины k для катионов связан с более сложным характером их взаимодействия с оксиэтиленовым фрагментом ПАВ. Так максимальные отклонения от корреляционной прямой имеют катионы, способные к ион-дипольному взаимодействию с оксиэтиленовыми фрагментами – катионы бария, калия, аммония.
Таблица 3.
Рассчитанные значения коэффициентов Сеченова для ионов
| ПАВ | kKat | –kAn | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Li+ | Na+ | K+ | ${\text{NH}}_{4}^{ + }$ | Mg2+ | Ba2+ | Al3+ | ${\text{NO}}_{3}^{ - }$ | Cl– | ${\text{SO}}_{4}^{{2 - }}$ | ${\text{PO}}_{4}^{{3 - }}$ | |
| ΔGhyd, кДж/моль | –475 | –365 | –295 | –285 | –1830 | –1250 | –4525 | 300 | 340 | 1080 | 2765 |
| Неонол АФ-9-12 | 3.065 | 3.018 | 3.022 | 3.066 | 6.143 | 6.153 | 9.221 | 3.057 | 3.096 | 6.654 | 10.25 |
| Неонол АФ-9-25 | 4.115 | 4.063 | 4.055 | 4.108 | 8.216 | 8.215 | 12.356 | 4.081 | 4.130 | 8.946 | 13.750 |
| Синтанол ДС-10 | 3.796 | 3.842 | 3.840 | 3.872 | 7.740 | 7.724 | 11.617 | 3.864 | 3.921 | 8.339 | 13.014 |
| Синтанол АЛМ-10 | 3.977 | 3.966 | 3.957 | 3.976 | 7.991 | 7.930 | 11.925 | 3.991 | 4.026 | 8.572 | 13.418 |
Таблица 4.
Коэффициенты корреляционных уравнений ln|ΔGhyd| = m + nk
| ПАВ | Анионы | Катионы | ||||
|---|---|---|---|---|---|---|
| m | –n | R2 | m | n | R2 | |
| Неонол АФ-9-12 | 4.889 | 0.300 | 0.996 | 4.572 | 0.429 | 0.960 |
| Неонол АФ-9-25 | 4.895 | 0.224 | 0.996 | 4.568 | 0.321 | 0.960 |
| Синтанол ДС-10 | 4.864 | 0.240 | 0.992 | 4.573 | 0.341 | 0.957 |
| Синтанол АЛМ-10 | 4.867 | 0.233 | 0.991 | 4.555 | 0.334 | 0.960 |
Полученные данные позволяют предсказывать высаливающую способность неорганических солей в отношении оксиэтилированных ПАВ. Например, используя табл. 3 можно оценить коэффициент Сеченова для любой комбинации анионов и катионов в соли. В табл. 5 показано сравнение расчетных и экспериментальных значений коэффициента Сеченова сульфата аммония в отношении неонолов. Полученные расчетные данные удовлетворительно коррелируют с экспериментальными, что позволяет использовать предложенную методику для комплексной оценки высаливающей способности неорганических солей в отношении оксиэтилированных неионных ПАВ.
Величина коэффициента k в уравнении Сеченова зависит от концентрации ПАВ в исследуемых смесях. Произведен расчет величины k для хлорида натрия в отношении неонола АФ 9-12 по трем изоконцентрационным сечениям (мас. %): 5.0 (k = –0.078, R2 = 0.999), 10.0 (k = –0.086, R2 = = 0.992) и 20.0 (k = –0.092, R2 = 0.991). С ростом концентрации ПАВ высаливающая способность хлорида натрия в отношении неонола АФ 9-12 незначительно увеличивается, поэтому при расчете коэффициентов Сеченова для солей и ионов следует использовать сечения с одинаковым содержанием ПАВ для всех солей. При этом концентрация ПАВ в исследуемой изоконцентрате должна обеспечивать низкую вязкость растворов, что необходимо для точной фиксации температуры помутнения и при этом достоверно описывать изменение границ области расслаивания с ростом температуры. На основании обобщенной схемы топологической трансформации систем вода–ПАВ–неорганическая соль [25] и экспериментальных исследований установлено, что оптимальное содержание ПАВ в исследуемом сечении для солей, обладающих преимущественно высаливающим действием, является 5.0 мас. %.
ЗАКЛЮЧЕНИЕ
Метод количественной оценки высаливающей способности неорганических солей в отношении оксиэтилированных ПАВ в перспективе поможет минимизировать эксперимент при оптимизации температурно-концентрационных параметров экстракции в системах на основе ПАВ за счет целенаправленного выбора высаливателя и последующего выбора параметров экстракции на основе схем топологической трансформации фазовых диаграмм систем неорганическая соль–оксиэтилированный ПАВ–вода [25]. При использовании предложенного метода необходимо обеспечить правильный выбор экспериментальных данных, используемых для расчета коэффициентов Сеченова для солей и ионов, что позволит минимизировать ошибку при осуществлении расчетов по корреляционным уравнениям.
Список литературы
Murugesan S., Iyyasamy R. // Separation Science and Technology. 2017. V. 52. № 12. P. 1929.
Wang Z., Dai Z. // Enzyme and Microbial Technology. 2010. V. 46. № 6. P. 407.
Paleologos E.K. // The Application of Green Solvents in Separation Processes. Elsevier, 2017. P. 349.
Haddou B., Canselier J.P., Gourdon C. // The Role of Colloidal Systems in Environmental Protection. Elsevier, 2014. P. 97.
Ataman M. // Colloid and polymer science. 1987. V. 265. № 1. P. 19.
Нифантьева Т.И., Матоушова В., Адамцова З. и др. // Высокомолекуляр. соединения. 1989. Т. 31. № 10. С. 2131.
Shaheen A., Kaur N., Mahajan R.K. // Colloid and Polymer Science. 2008. V. 286. № 3. P. 319.
Patel K., Bharatiya B., Kadam Y. et al. // J. of surfactants and detergents. 2010. V. 13. № 1. P. 89.
Santos-Ebinuma V.C., Lopes A.M., Converti A. et al. // Fluid Phase Equilibria. 2013. V. 360. P. 435.
Mahajan R.K., Vohra K.K., Kaur N., Aswal V.K. // J. of Surfactants and Detergents. 2008. V. 11. № 3. P. 243.
Salabat A., Alinoori M. // Computer Coupling of Phase Diagrams and Thermochemistry. 2008. V. 32. P. 611.
Shinoda K., Takeda H. // J. of Colloid and Interface Science. 1970. V. 32. № 4. P. 642.
Шестопалова Н.Б., Чернова Р.К. // Вестн. Тамбовского государственного технического университета. 2014. Т. 20. № 2. С. 322.
Чернова Р.К., Шестопалова Н.Б., Козлова Л.М. // Изв. Саратовского университета. Новая серия. Серия Химия. Биология. Экология. 2012. Т. 12. № 4. С. 10.
Batıgöç Ç., Akbaş H. // Fluid Phase Equilibria. 2011. V. 303. № 1. P. 91.
Sharma K.S., Patil S.R., Rakshit A.K. // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2003. V. 219. № 1. P. 67.
Schott H. // Journal of Colloid and Interface Science. 1973. V. 43. № 1. P. 150.
Schott H. // Journal of colloid and interface science. 1998. V. 205. № 2. P. 496.
Schott H., Royce A.E., Hant S.K. // J. of Colloid and Interface Science. 1984. V. 98. № 1. P. 196.
Архипов В.П., Идиятуллин З.Ш. // Вестн. Казанского технологического университета. 2016. Т. 19. № 5. С. 8.
Елохов А.М., Леснов А.Е., Кудряшова О.С. // Журн. физ. химии. 2016. Т. 90. № 10. С. 1491.
Станкова А.В., Елохов А.М., Кудряшова О.С. // Там же. 2018. V. 92. № 7. P. 1145.
Елохов А.М., Кудряшова О.С., Леснов А.Е. // Журн. неорган. химии. 2017. Т. 62. № 9. С. 1274.
Davies J.T., Rideal R.K. Interfacial Phenomena. New York, London: Academic Press, 1961. 461 p.
Елохов А.М., Кудряшова О.С., Леснов А.Е. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1622.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


