Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 3, стр. 215-222
Иммунофенотип мезенхимальных стволовых клеток, полученных из эпикардиальной и периваскулярной жировой ткани у пациентов с сердечно-сосудистыми заболеваниями
Е. Г. Учасова 1, *, Ю. А. Дылева 1, Е. В. Белик 1, В. Г. Матвеева 1, С. М. Гусев 1, О. Л. Тарасова 2, О. В. Груздева 1, 2
1 Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний
Кемерово, Россия
2 Кемеровский государственный медицинский университет
Кемерово, Россия
* E-mail: evg.uchasova@yandex.ru
Поступила в редакцию 13.02.2023
После доработки 21.04.2023
Принята к публикации 21.04.2023
- EDN: YHWKHY
- DOI: 10.31857/S0044452923030099
Аннотация
Цель работы – оценить иммунофенотип стволовых клеток жировой ткани, выделенных из жировых депо эпикардиальной и периваскулярной области у пациентов с ишемической болезнью сердца и приобретенными пороками сердца. В культуре клеток, полученной из эпикардиальной и периваскулярной жировой ткани (2-й пассаж) у пациентов как с ишемической болезнью сердца, так и с приобретенными пороками сердца, наблюдалась высокая (более 90%) экспрессия мембранных белков, характерных для стволовых клеток. Кроме основной популяции, как в культуре эпикардиальной, так и в периваскулярной жировой ткани присутствовали две минорные: 1) – CD90-, CD105+, CD34-/+, CD73+, CD45- – предположительно эндотелиальная популяция; 2) – CD90+, CD105-, CD34-, CD73-, CD45- – самая малочисленная популяция. Вывод: на ранних сроках культивирования клетки стромально-васкулярной фракции, выделенные из эпикардиальной и периваскулярной жировой ткани, экспрессируют поверхностные маркеры, характерные для стволовых клеток жировой ткани.
ВВЕДЕНИЕ
Благодаря набору уникальных свойств, например, способности дифференцироваться в различные типы клеток соединительной ткани, мезенхимальные стволовые клетки (МСК) все больше привлекают внимание исследователей. До настоящего времени большое число работ было посвящено изучению мезенхимальных стволовых клеток костного мозга. Однако не так давно в стромально-васкулярной фракции жировой ткани обнаружили стволовые клетки, которые в отличие от стволовых клеток костного мозга быстрее растут и доступны в большом количестве при сборе из небольшого объема жировой ткани [1, 2]. Так, например, только 0.001–0.01% мононуклеарных клеток в костном мозге являются стволовыми, в то время как из 1 г жировой ткани можно выделить 5 × 103 стволовых клеток, что в 500 раз больше, чем из такого же количества клеток в костном мозге [3]. В результате, в последнее время МСК жировой ткани (МСК-ЖТ) становятся привлекательной и альтернативной популяцией мультипотентных клеток – как для исследований, так и для тканевой заместительной терапии [4].
Согласно определению Международного общества по клеточной терапии (ISCT), МСК обладают следующим иммунофенотипом: CD73+, CD90+ и CD105+, CD45-, CD34-, CD14-, CD11b-, CD79a-, CD19- и характеризуются отсутствием поверхностных молекул HLA-DR. Учитывая различные источники выделения МСК, в 2013 г. ISCT внесла небольшую редакцию для характеристики мезенхимальных клеток, выделенных из жировой ткани [3]. Помимо уже описанных положительных маркеров [4], были включены поверхностные маркеры CD13, CD29, CD44; к отрицательным маркерам были отнесены CD31 и CD235a. Кроме того, были описаны и другие маркеры, но их экспрессия на МСК-ЖТ достаточно вариабельна и сильно зависит от условий культивирования и количества пассажей [5]. Есть предположения, что иммунофенотип МСК-ЖТ может различаться в зависимости от условий культивирования, количества пассажей и локализации жировой ткани в организме [6].
В настоящее время большое количество исследований посвящено изучению морфологии и иммунофенотипа подкожных и висцеральных МСК-ЖТ из-за возможности легкого получения клеток. Экспериментальных работ, направленных на изучение МСК кардиальной локализации, в настоящее время недостаточно
Цель работы – оценить иммунофенотип стволовых клеток жировой ткани, выделенных из эпикардиальной и периваскулярной жировой ткани, у пациентов с ишемической болезнью сердца (ИБС) и приобретенными пороками сердца.
МЕТОДЫ ИССЛЕДОВАНИЯ
Выделение мезенхимальных стволовых клеток жировой ткани
В исследование было включено 8 пациентов, подписавших добровольное информированное согласие на участие, среди которых было 4 пациента с ИБС в возрасте до 75 лет (основная группа) и 4 пациента с некоронарогенной патологией сердца – дегенеративные приобретенные неревматические пороки сердца (аортальный стеноз/недостаточность) и показаниями для проведения открытой операции на клапанах сердца, сопоставимых по полу и возрасту с основной группой. Все пациенты имели показания для проведения открытого вмешательства на сердце – прямой реваскуляризации миокарда методом коронарного шунтирования или операции на клапанах сердца. В исследование не включали пациентов старше 75 лет, с наличием клинически значимых сопутствующих патологий (сахарного диабета 1-го и 2-го типа, инфаркта миокарда, анемии, почечной и печеночной недостаточностью, онкологических и инфекционно-воспалительных заболеваний в период обострения, аутоиммунных заболеваний). Стволовые клетки жировой ткани выделяли из биоптатов жировой ткани подкожной, эпикардиальной и периваскулярной локализации (3–5 г). Источник эпикардиальной жировой ткани – правые отделы сердца, зоны ее наибольшего присутствия (правое предсердие и правый желудочек); периваскулярной жировой ткани – область правой коронарной артерии. Полученные образцы жировой ткани тщательно промывали стерильным фосфатно-солевым буфером (PBS) (Gibco, Китай) для очистки поверхности жировой ткани от тромбов, эритроцитов и местных анестетиков. Затем жировую ткань помещали в 20 мл PBS с добавлением пенициллина (600 ЕД/мл) (Gibco, США) и стрептомицина (300 мг/мл, Gibco, США) в пробирку объемом 50 мл на 5–10 мин при комнатной температуре для удаления остатков кровеносных сосудов, соединительной ткани и/или дермы жировой ткани. После повторной промывки и очистки ткань была перенесена в культуральную чашку диаметром 10 см с добавлением 2 мл PBS и разрезана на маленькие кусочки неправильной формы (1–3 мм2) ножницами, средняя масса кусочков была около 4 г. Далее маленькие кусочки жировой ткани были пипетированы в культуральные флаконы (Biologix, Германия) объемом 25 см2 и выровнены с интервалами расстояния 0.3–0.4 см. Клетки инкубировали в СО2 – инкубаторе (5% СО2, 95% воздуха, 37°С), в среде, поддерживающей рост МСК (MesenCult Proliferation Kit, STEMCELL Technologies, Канада), с добавлением антибиотиков и антимикотика (100 Ед/мл пенициллина, 100 Ед/мл стрептомицина, 0.4% амфотерицина В, Gibco, США). Когда первичные клетки достигали 80–90% конфлюентности, их обрабатывали 0.25%-ным раствором трипсина, содержащим 0.02% ЭДТА (Tripsin/EDTA, CELL, США), переносили в культуральные флаконы объемом 75 см2 (Biologix, Германия) и культивировали до 80–90% слияния клеток. Далее производили подсчет клеток с помощью автоматического клеточного счетчика Countess II FL Automated Cell Counter (Thermo Fisher Scientific, Финляндия) и осуществляли иммунофенотипирование клеток.
Иммунофенотипирование клеток (проточная цитометрия)
Клеточную суспензию МСК-ЖТ на пассаже 2, собранную с использованием 0.25%-ного трипсина/ЭДТА, центрифугировали при 100 g в течение 5 мин. Для окрашивания в пробирки отбирали 1 × 105 клеток культуры, снятых с пластика и отмытых PBS. В работе использовали комбинацию конъюгированных моноклональных антител: CD90 FITC (BC, IM1839U), CD 34 APC (BC, PN IM2472U), CD73 APC Cy7 (Biolegend, 344022), CD 105 PE (Biolegend,323206), Pacific Blue CD 45 (Biolegend, 304029). В пробу вносили антитела в объеме, указанном производителем, с дальнейшей инкубацией в течение 30 мин при комнатной температуре в защищенном от света месте. Окрашенные пробы ресуспендировали в PBS и анализировали на проточном лазерном цитометре CytoFlex (США) в программе CytExpert 2.1. Для настройки прибора использовали образцы с соответствующими изотипическими контролями и последующим выполнением всех этапов аналогично основной пробе. Анализ всех образцов выполняли на единых настройках прибора.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Стромально-сосудистую фракцию, взятую из эпикардиальной и периваскулярной области у пациентов с ишемической болезнью сердца и приобретенными пороками сердца, культивировали в стандартных условиях. На третий день первичной культуры во всех флаконах эпикардиальной и периваскулярной жировой ткани по краям кусочков ткани появилось множество мелких пятнистых клеток, которые продолжали расти и пролиферировать. На 5–6-е сутки культивируемые in vitro жировые стволовые клетки стали приобретать фибробластоподобную и веретеновидную форму, и эта морфология сохранялась на протяжении всего времени культивирования. При этом морфология клеток не различалась от локализации жировой ткани (рис. 1).
Рис. 1.
МСК в культурах, полученных из эпикардиальной жировой ткани на 5-е сутки (a), эпикардиальной жировой ткани на 9-е сутки (b), эпикардиальной жировой ткани на 16-е сутки (c) у пациента с ИБС.

К 9–11-м суткам культивирования стали появляться множественные колонии клеток, при этом у пациента с ишемической болезнью сердца процент конфлюентности монослоя в периваскулярной жировой ткани составил около 45%, а в эпикардиальной жировой ткани в среднем 35%, в то время как у больного с приобретенным пороком сердца данный процент во всех жировых депо составил больше 50%.
На 16-й день культивирования процент плотности заселения монослоя клеток во всех исследованных образцах составил более 80%, и клетки были пересажены на культуральный флакон объемом 75 см2. При достижении клетками 80–90% монослоя производили подсчет клеток и получили, что у пациента с ИБС из эпикардиальной жировой ткани выделено 2.53 × 106/мл клеток, в то время как из периваскулярной жировой ткани – 9.44 × 106/мл клеток. У пациента с приобретенными пороками сердца число выделенных клеток из эпикардиальной жировой ткани составило 5.51 × 106/мл, из периваскулярной жировой ткани – 1.57 × 106/мл.
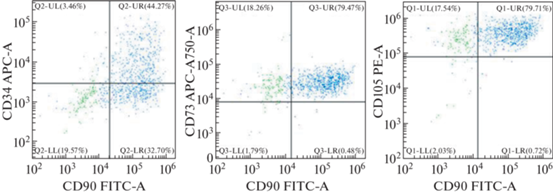
При оценке иммунофенотипа культур клеток второго пассажа получено, что в эпикардиальной жировой ткани пациента с ИБС на 79.7% клеток присутствовали поверхностные маркеры CD105 и CD 90, при этом один антигенный маркер CD105 был на 17.5% клеток (рис. 2). Мезенхимальные маркеры CD73 и CD90 присутствовали на 79.5% клеток, один CD73 на поверхности 18.3% клеток, в то время как CD34 был только на 3.8% клеток. Таким образом, фенотип культуры клеток, полученной из эпикардиальной жировой ткани, был CD73+, CD 90+, CD 105+, CD34-/+. Кроме основной популяции клеток в культуре эпикардиальной жировой ткани присутствовали 2 минорные популяции: 1) CD90+, CD34+, CD73+, CD105- (зеленый цвет на рис. 2) – предположительно эндотелиальная популяция; 2) CD90+, CD105-, CD34-, CD73- (розовой цвет) – самая малочисленная популяция клеток, полученных из эпикардиальной жировой ткани.
Рис. 2.
Проточная цитометрия клеток, полученных из эпикардиальной жировой ткани пациента с ИБС. Cиним цветом на рисунке обозначена самая большая популяция клеток по иммунофенопитипу, принадлежит к МСК, зеленый и розовый цвет – две минорные популяции клеток.
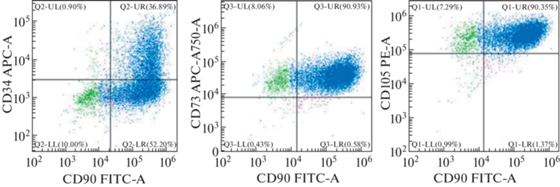
В культуре клеток, полученной из периваскулярной жировой ткани пациента с ИБС, так же, как и в клетках, полученных из эпикардиальной жировой ткани, наблюдалась высокая (более 90%) экспрессия мембранных белков, характерных для стволовых клеток (рис. 3). Так, клеточные маркеры СD90 и СD105 совместно экспрессировались у 90.3% клеток, похожий процент мембранных белков отмечен в отношении СD73 и СD90 (90.9%). Антигенный маркер СD34 экспрессировали только 0.9% клеток, полученных из культуры периваскулярной жировой ткани. Так же, как и в культуре эпикардиальной жировой ткани в периваскулярной жировой ткани, мы наблюдали 3 популяции клеток (рис. 3).
Рис. 3.
Проточная цитометрия клеток, полученных из периваскулярной жировой ткани пациента с ИБС. Cиним цветом на рисунке обозначена самая большая популяция клеток, которая по иммунофенотипу принадлежит к МСК, зеленый и розовый цвет – две минорные популяции клеток.
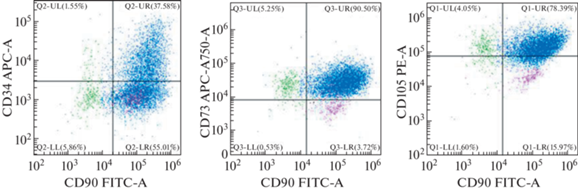
Клетки, полученные из эпикардиальной и периваскулярной жировой ткани пациентов с приобретенным пороком сердца и ИБС имели схожий фенотип, однако были некоторые особенности. В культуре клеток эпикардиальной жировой ткани пациента с приобретенным пороком сердца уровень совместной экспрессии основных поверхностных маркеров МСК был немного ниже, чем в эпикардиальной жировой ткани пациента с ИБС. СD90 и СD105 одновременно экспрессировали около 61% клеток, а СD90 и СD73 – около 59%. Уровень поверхностного маркера СD34 был равен 32.3%, а совместный уровень СD90 и СD34 – 47.3%. При иммунофенотипировании клеток, полученных из эпикардиальной жировой ткани, также обнаружили три популяции клеток с преобладанием основной популяции с фенотипом, характерным для МСК (рис. 4).
Рис. 4.
Проточная цитометрия клеток, полученных из эпикардиальной жировой ткани пациента с приобретенными пороками сердца. Cиним цветом на рисунке обозначена самая большая популяция клеток, которая по иммунофенотипу принадлежит к МСК, зеленый и розовый цвет – две минорные популяции клеток.

В культуре клеток, полученных из периваскулярной жировой ткани, были обнаружены высокие уровни совместной экспрессии CD90 и CD105 – 78.4%, CD90 и CD73 – 90.5%. Экспрессия антигенного маркера CD34 обнаружена на 1.5% клеток (рис. 5).
Рис. 5.
Проточная цитометрия клеток, полученных из периваскулярной жировой ткани пациента с приобретенными пороками сердца. Синим цветом на рисунке обозначена самая большая популяция клеток, которая по иммунофенотипу принадлежит к МСК, зеленый и розовый цвет – две минорные популяции клеток.
Таким образом, на ранних сроках культивирования на клетках стромально-васкулярной фракции, выделенных из периваскулярной и эпикардиальной жировой ткани пациентов с ИБС и приобретенными пороками сердца, доминируют поверхностные маркеры, характерные для мезенхимальных стволовых клеток жировой ткани.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
МСК-ЖТ локализуются в стромально-васкулярной фракции, присутствующей в сосудистой нише, и имеют специфичный для этой области профиль экспрессии маркеров клеток [6, 7]. Клетки стромально-васкулярной фракции представляют собой гетерогенную смесь эндотелиальных и гладкомышечных клеток, перицитов, фибробластов, тучных клеток и преадипоцитов [8]. На ранних этапах культивирования (1–2 пассажа клеток) в составе стромально-васкулярной фракции обнаруживаются клетки, несущие не только стволовые маркеры (CD44, CD73, CD90, CD105, CD166), но и маркеры гемопоэтических стволовых клеток (CD34, митохондриальный ALDH, ABCG2). По данным Mohamed-Ahmed и соавт., классические маркеры МСК (CD73, CD90, CD105) присутствуют на 0.8–54% клетках на ранних стадиях культивирования (1 пассаж) [9]. К 4–5-му пассажу количество стромальных маркеров на культивированных клетках увеличивается, достигая 98% [7, 10, 11].
К одним из стромальных маркеров относится CD90, также известный как Thy-1, он представляет собой заякоренный белок клеточной поверхности, обычно экспрессируемый различными типами клеток, в том числе, и стволовыми. В исследовании Pan и соавт. обнаружено, что степень экспрессии стволовыми клетками CD90 может отличаться в зависимости от локализации жировой ткани [12]. В работе было получено, что СD90 в большей степени экспрессируется на стволовых клетках подкожной, а не висцеральной жировой ткани. Уровень экспрессии другого поверхностного маркера – CD73 – также может зависеть от локализации стволовых клеток. Так, показано, что экспрессия CD73 на МСК-ЖТ, выделенной из перикарда у экспериментальных животных (мыши), выше, чем экспрессия CD73 на стволовых клетках, полученных из подкожно-жировой ткани [13, 14]. CD105 – еще один классический маркер стволовых клеток, также имеет более высокий процент экспрессии в клетках подкожного жира по сравнению с таковым в висцеральном жире [15, 16].
Стоит отметить, что в настоящее время большое количество экспериментальных работ посвящено изучению стромально-васкулярной фракции, выделенной из висцеральных и подкожных депо, в то время как исследований, посвященных жировой ткани кардиальной области у человека, недостаточно.
В данном исследовании нами был впервые изучен иммунофенотип клеток, полученных из стромально-васкулярной фракции эпикардиальной и периваскулярной жировой ткани у пациентов с ИБС и приобретенными пороками сердца. Полученные результаты показали, что культура МСК 2-го пассажа характеризовалась повышенной экспрессией антигенов CD73, CD90, CD105. Примерно 90% клеток 2-го пассажа, полученных из эпикардиальной и периваскулярной жировой ткани пациента с ИБС, экспрессировали классические маркеры МСК (CD73, CD90, CD105). В культуре клеток эпикардиальная жировая ткань у пациента с приобретенными пороками сердца наблюдался более низкий уровень совместной экспрессии основных маркеров стволовых клеток в отличие от пациента с ИБС (СD90 и СD105 около 61% клеток, а СD90 и СD73 – 58.2%). Процентное содержание изучаемых стволовых маркеров на клетках, выделенных из периваскулярной жировой ткани у пациента с пороком сердца, существенно не отличалось от уровня экспрессии этих маркеров у пациента с ИБС. Уровень экспрессии СD34 варьировал в зависимости от локализации жировой ткани и заболевания: так, у пациентов с ИБС уровень СD34 не превышал 3.5% как в эпикардиальной, так и в периваскулярной жировой ткани. При этом в эпикардиальной жировой ткани у пациента с пороками сердца обнаружен более высокий процент СD34 (32.3%). Относительно экспрессии маркера гемопоэтических стволовых клеток – CD34 на МСК-ЖТ в литературе существуют некоторые противоречения. Некоторые исследовательские группы [17, 18] выявили популяцию CD34 в стромально-васкулярной фракции. Эти данные позволили предположить наличие общего предшественника у клеток с эндотелиальным и адипоцитарным фенотипом [18]. В то же время по данным других авторов [13, 19] экспрессия CD34 была слабой, либо не обнаруживалась. Однако более поздние исследования иммунофенотипа клеток стромально-васкулярной фракции показали, что гемопоэтические CD34+ клетки попадают в жировую ткань из циркулирующей крови и при длительном культивировании клеток с увеличением количества пассажей уровень экспрессии СD34 уменьшался [8, 10].
В то же время в культуре клеток второго пассажа были обнаружены две минорные популяции клеток, которые отличались по экспрессии CD73, CD90 и CD105. Фенотип клеток первой популяции был представлен положительными CD105+, CD73+ и отсутствием экспрессии или экспрессией в малом количестве – CD90 и CD34. Содержание клеток с фенотипом CD105+, CD73+/CD90-, CD34- варьировало в зависимости от типа жировой ткани, максимальное содержание клеток этой популяции было обнаружено в эпикардиальной жировой ткани пациентов с приобретенными пороками сердца. Третья популяция клеток была самая малочисленная, и ее количество варьировало в зависимости от типа жировой ткани, из которой были получены клетки.
Таким образом, на ранних этапах культивирования клеток в составе стромально-васкулярной фракции эпикардиальной и периваскулярной жировой ткани у пациентов с сердечно-сосудистыми заболеваниями идентифицируются клетки, несущие поверхностные маркеры, присущие стволовым клеткам жировой ткани.
CОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены биоэтическим комитетом Федерального государственного бюджетного научного учреждения “Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний” (Кемерово). Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Статья подготовлена в рамках проекта фундаментальных исследований НИИ Комплексных проблем сердечно-сосудистых заболеваний № 0419-2022-0002 “Разработка инновационных моделей управления факторами риска сердечно-сосудистых заболеваний и сопутствующими заболеваниями на основе изучения фундаментальных, клинико-эпидемиологических механизмов и методов управления здравоохранением в условиях промышленного района Сибири”.
Список литературы
Zuk PA, Zhu M, Mizuno H, Huang J, Katz AJ, Benhaim P, Lorenz HP, Hedrick MH (2001) Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng 7: 211–228. https://doi.org/10.1089/107632701300062859
Robert AW, Marcon BH, Dallagiovanna B, Shigunov P (2020) Adipogenesis, Osteogenesis, and Chondrogenesis of Human Mesenchymal Stem/Stromal Cells: A Comparative Transcriptome Approach. Front Cell Dev Biol 8: 561. https://doi.org/10.3389/fcell.2020.00561
Bourin P, Bunnell BA, Casteilla L, Dominici M, Katz AJ, March KL, Redl H, Rubin JP, Yoshimura K, Gimble JM (2013) Stromal cells from the adipose tissue-derived stromal vascular fraction and culture expanded adipose tissue-derived stromal/stem cells: a joint statement of the International Federation for Adipose Therapeutics and Science (IFATS) and the international So. Cytotherapy 15: 641–648. https://doi.org/10.1016/j.jcyt.2013.02.006
Bucan A, Dhumale P, Jørgensen MG, Dalaei F, Wiinholt A, Hansen CR, Hvidsten S, Baun C, Hejbøl EK, Schrøder HD, Sørensen JA (2020) Comparison between stromal vascular fraction and adipose derived stem cells in a mouse lymphedema model. J Plast Surg and Hand Surg 54 (5): 302–311. https://doi.org/10.1080/2000656X.2020.1772799
Krawczenko A, Klimczak A (2022) Adipose Tissue-Derived Mesenchymal Stem/Stromal Cells and Their Contribution to Angiogenic Processes in Tissue Regeneration. Int J Mol Sci 23 (5): 2425. https://doi.org/10.3390/ijms23052425
Dubey NK, Mishra VK, Dubey R, Deng YH, Tsai FC, Deng WP (2018) Revisiting the Advances in Isolation, Characterization and Secretome of Adipose-Derived Stromal/Stem Cells. Int J Mol Sci 19 (8): 2200. https://doi.org/10.3390/ijms19082200
Silva KR, Baptista S (2019) Adipose-derived stromal/stem cells from different adipose depots in obesity development. World J Stem Cells 11 (3): 147–166. https://doi.org/10.4252/wjsc.v11.i3.14
Mitchell JB, Mcintosh K, Zvonic S, Garrett S, Floyd ZE, Kloster A, Di Halvorsen Y, Storms RW, Goh B, Kilroy G, Wu X, Gimble JM (2006) Immunophenotype of Human Adipose-Derived Cells: Temporal Changes in Stromal-Associated and Stem Cell–Associated Markers. Stem Cells 24 (2): 376–385. https://doi.org/10.1634/stemcells.2005-0234
Mohamed-Ahmed S, Fristad I, Lie SA, Suliman S, Mustafa K, Vindenes H, Idris SB (2018) Adipose-derived and bone marrow mesenchymal stem cells: a donor-matched comparison. Stem Cell Res Ther 9 (1): 168. https://doi.org/10.1186/s13287-018-0914-1
Ni H, Zhao Y, Ji Y, Shen J, Xiang M, Xie Y (2019) Adipose-derived stem cells contribute to cardiovascular remodeling. Aging 11 (23): 11756–11769. https://doi.org/10.1186/s13287-018-0914-1
Dykstra JA, Facile T, Patrick RJ, Francis KR, Milanovich S, Weimer JM, Kota DJ (2017) Concise Review: Fat and Furious: Harnessing the Full Potential of Adipose-Derived Stromal Vascular Fraction. Stem Cells Transl Med 6 (4): 1096–1108. https://doi.org/10.1002/sctm.16-0337
Pan Z, Zhou Z, Zhang H, Zhao H, Song P, Wang D, Yin J, Zhao W, Xie Z, Wang F, Li Y, Guo C, Zhu F, Zhang L, Wang Q (2019) CD90 serves as differential modulator of subcutaneous and visceral adipose-derived stem cells by regulating AKT activation that influences adipose tissue and metabolic homeostasis. Stem Cell Res Ther 10 (1): 355.
Tang Y, Pan ZY, Zou Y, He Y, Yang PY, Tang QQ, Yin FA (2017) A comparative assessment of adipose-derived stem cells from subcutaneous and visceral fat as a potential cell source for knee osteoarthritis treatment. J Cell Mol Med 21 (9): 2153–2162. https://doi.org/10.1111/jcmm.13138
Tan K, Zhu H, Zhang J, Ouyang W, Tang J, Zhang Y, Qiu L, Liu X, Ding Z, Deng X (2019) CD73 Expression on Mesenchymal Stem Cells Dictates the Reparative Properties via Its Anti-Inflammatory Activity. Stem Cells Internat 8717694. https://doi.org/10.1155/2019/8717694
Lv XJ, Zhou GD, Liu Y, Liu X, Chen JN, Luo XS, Cao YL (2012) In vitro proliferation and differentiation of adipose-derived stem cells isolated using anti-CD105 magnetic beads. Int J Mol Med 30 (4): 826–834. https://doi.org/10.3892/ijmm.2012.1063
Li Q, Qi LJ, Guo ZK, Li H, Zuo HB, Li NN (2013) CD73+ adipose-derived mesenchymal stem cells possess higher potential to differentiate into cardiomyocytes in vitro. J Mol Histol 44 (4): 411–422. https://doi.org/10.1007/s10735-013-9492-9
Gronthos S, Franklin DM, Leddy HA, Robey PG, Storms RW, Gimble JM (2001) Surface protein characterization of human adipose tissuederived stromal cells. J Cell Physiol 189: 54–63.https://doi.org/10.1002/jcp.1138
Planat-Benard V, Silvestre JS, Cousin B, André M, Nibbelink M, Tamarat R, Clergue M, Manneville C, Saillan-Barreau C, Duriez M, Tedgui A, Levy B, Pénicaud L, Casteilla L (2004) Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives. Circulation 109: 656–663. https://doi.org/10.1161/01.CIR.0000114522.38265.61
Fraser JK, Wulur I, Alfonso Z, Hedrick MH (2006) Fat tissue: an underappreciated source of stem cells for biotechnology. Trends Biotechnol 24 (4): 150–154. https://doi.org/10.1016/j.tibtech.2006.01.010
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


