Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 3, стр. 207-214
Билатеральная синхронизация гиппокампальных тета-осцилляций in vitro
И. Халилов 1, 2, А. Гайнутдинов 1, Р. Хазипов 1, 2, *
1 Институт нейробиологии Средиземноморья АМН Франции,
Университет Экс-Марселя
Марсель, Франция
2 Казанский (Приволжский) федеральный университет
Казань, Россия
* E-mail: roustem.khazipov@inserm.fr
Поступила в редакцию 30.03.2023
После доработки 21.04.2023
Принята к публикации 22.04.2023
- EDN: YHGGYA
- DOI: 10.31857/S004445292303004X
Аннотация
Тета-осцилляции гиппокампа являются ключевым сетевым паттерном активности, вовлеченным в реализацию таких функций, как пространственная навигация, обучение и память. У животных in vivo тета-осцилляции гиппокампа демонстрируют билатеральную синхронизацию. Осцилляции в тета-частотном диапазоне также были описаны в интактных препаратах гиппокампа in vitro. Однако остается неясным, каким образом тета-осцилляции синхронизируются между левым и правым гиппокампами. Для исследования этого вопроса был использован препарат интактных гиппокампов, соединенных вентральными гиппокампальными комиссурами in vitro, полученных от ювенильных и взрослых крыс или мышей. Локальные полевые потенциалы и спайковая активность нейронов регистрировались с помощью внеклеточных электродов из слоя пирамидных клеток и stratum radiatum СА1 области левого и правого гиппокампа. Было обнаружено, что активность нейронной сети в левом и правом гиппокампе организована в тета-осцилляции, которые модулируют спайковую активность СА1 нейронов. Как спайковая активность СА1 нейронов, так и полевые тета-осцилляции демонстрировали высокий уровень двусторонней синхронизации в левом и правом гиппокампах. После хирургического рассечения вентральной комиссуры тета-осцилляции сохранялись с обеих сторон, но их двусторонняя синхронизация полностью устранялась. Таким образом, тета-осцилляции синхронизированы в левом и правом гиппокампах in vitro, и билатеральная синхронизация тета-осцилляций in vitro обеспечивается межгиппокампальными комиссуральными связями.
ВВЕДЕНИЕ
Межполушарная (билатеральная) синхронизация является важным свойством нейронной сетевой активности в гиппокампальной системе. Одновременная регистрация активности в правом и левом гиппокампах позволила выявить высокий уровень синхронизации различных паттернов электрической активности в этих структурах [1–12]. Билатеральная синхронизация нейрональной активности является характерным свойством также и тета-осцилляций в гиппокампальной системе in vivo [3]. Тета-осцилляции возникают в гиппокампе во время движения животного (а также во время быстрого сна) и являются инструментом для связывания нейрональных ансамблей гиппокампа (так называемых “клеток места”) при навигации в пространстве [13–16]. Предполагается, что этот процесс основан на сравнении сенсорной информации, поступающей в гиппокамп из энторинальной коры, и внутренних моделей, закодированных в нейронных сетях самого гиппокампа, в каждом цикле тета-осцилляций. Учитывая контралатеральную организацию сенсорных потоков, билатеральная синхронизация тета-активности в гиппокампальной системе является необходимым условием для их интеграции в ходе пространственной навигации. Было предположено, что это может достигаться синхронным входом из энторинальной коры, а также в результате билатеральной синхронизации в энторинальной коре посредством межкорковых связей [9, 17–19]. Было также предположено, что билатеральная синхронизация внутренних моделей может, в свою очередь, осуществляться посредством СА3-СА3 и СА3-СА1 билатеральных связей в составе гиппокампальной комиссуры [20]. Однако механизмы билатеральной синхронизации тета-осцилляций до сих пор остаются лишь гипотетическими и требуют прямой экспериментальной проверки.
Ранее было показано, что в in vitro препарате изолированного гиппокампа ювенильных и взрослых мышей возникают автономные спонтанные осцилляции в частотном диапазоне, близком к частоте тета-осцилляций, наблюдаемых in vivo [21–24]. Мы предположили, что более комплексная модель гиппокампальной системы in vitro, которая включает в себя оба изолированных интактных гиппокампа, соединенных вентральной комиссурой [25–28], может быть использована для исследования межгиппокампальной синхронизации тета-осцилляций посредством комиссуральных связей, что и было реализовано в настоящем исследовании.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проводили на препаратах целых гиппокампов, соединенных вентральной гиппокампальной комиссурой, выделенных у крыс породы Вистар в возрасте от P13 до P15 (n = 4; P – возраст в днях после рождения) и мышей линии C57BL в возрасте P22, P57 и 1 год (n = 3). Процедуры приготовления препарата гиппокампов подробно описаны ранее [26]. После декапитации под изофлюрановым наркозом мозг животных быстро извлекали и погружали ледяной оксигенированный (95% O2/5% CO2) раствор искусственной цереброспинальной жидкости (ИЦСЖ) следующего состава (в мM): NaCl – 126; KCl – 3.5; CaCl2 – 2.0; MgCl2 – 1.3; NaHCO3 – 25; NaH2PO4 – 1.2; глюкоза – 11 (pH – 7.4). После удаления мозжечка и лобных долей комплекс, включающий два взаимосвязанных комиссурой гиппокампа, изолировался от окружающих структур с помощью следующей процедуры: ствол мозга, средний мозг и полосатое тело аккуратно отделялись от гиппокамп двумя шпателями. Затем неокортекс отсекался путем скольжения вдоль мозолистого тела вдоль дорсальной поверхности гиппокампа и перегородки шпателем, вставленным в боковой желудочек. Далее препарат двойного гиппокампа выделялся из септо-гиппокампального комплекса. В препарате сохранялись небольшие фрагменты окружающей ткани для механической фиксации в камере с дном, покрытым сильгардом, с использованием энтомологических игл. Полная процедура извлечения препарата гиппокампов занимала 8–10 мин. Затем препарат осторожно переносили и выдерживали в ИЦСЖ при комнатной температуре (20–22°С) не менее одного часа перед регистрацией. Для регистрации препарат помещали в специальную камеру с дном из нейлоновой сетки и непрерывно перфузировали ИЦСЖ со скоростью ~15 мл/мин. Внеклеточную регистрацию локальных полевых потенциалов (ЛПП [local field potentials, LFP]) и множественных потенциалов действия нейронов (МПД [multiple unit activity, MUA]) проводили с помощью электродов, изготовленных из вольфрамовой проволоки (диаметр 50 мкм, California Fine Wire, Grover Beach, CA, США), располагаемых в зоне пирамидного слоя или в stratum radiatum СА1 зоны гиппокампов. Регистрирующие электроды располагались в средней части гиппокампов на равном удалении от септального полюса. Усиление и оцифровку регистрируемых сигналов осуществляли с помощью усилителя DAM–8A (×1000, в полосе 0.1 Гц – 3 кГц) и аналого-цифрового преобразователя Digidаta 1440A (Molecular Devices, CA, США) с частотой 10 кГц. Исходные данные были предварительно обработаны с помощью разработанных нами функций на основе пакета программ Matlab. Исходный сигнал был прорежен до 1 кГц и в дальнейшем использовался для анализа ЛПП. Для детекции потенциалов действия исходный сигнал был пропущен через фильтр низких частот (порог пропускания 200 Гц), и отрицательные события с амплитудой, превышающей 3 стандартные девиации, принимались за потенциалы действия. ЛПП и МПД анализировались с помощью разработанных нами функций на основе пакета программ Matlab (MathWorks, США). Для определения фазы тета-осцилляций применялись следующие операции. ЛПП раскладывался на реальную и воображаемую часть через преобразование Гильберта. Затем, чтобы получить угол в радианах в интервале [–π, π], над полученными реальной и воображаемой частью применялась операция четырех-квадрантного арктангенса. Для анализа фазовой модуляции частоты МПД тета-осцилляциями использовался тест Релея из пакета функций для Matlab – circular statistics. Амплитуда результирующего вектора Релея показывает степень модуляции частоты МПД тета-осцилляциями, а его угол – фазу тета-осцилляции, на которой располагается результирующий вектор Релея. Групповые данные представлены как медиана (Q1 – Q3). Для сравнения тета-частот до и после перерезки комиссуральных связей применялся тест Уилкоксона для связных выборок. Статистическую оценку различий в сравниваемых выборках оценивали для 5%-ного уровня значимости.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
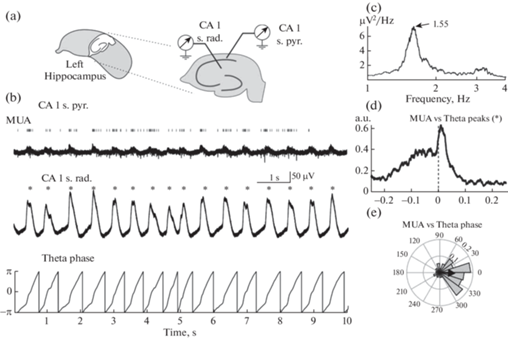
Спонтанная активность в изолированном гиппокампе крыс и мышей в возрасте старше 2 нед характеризовалась осцилляциями в тета-частотном диапазоне с циклическими изменениями ЛПП с максимальной амплитудой в stratum radiatum СА1 (рис. 1). По результатам анализа c использованием быстрого предобразования Фурье пиковые значения мощности 1.8 (0.6 – 8.0) мкВ2/Гц тета-осцилляций наблюдались на частоте 2.0 (1.5 – 2.4) Гц (n = 7; минимум 1.5 и максимум 8.1 Гц). Спайковая активность в пирамидном слое СА1 значительно модулировалась тета-осцилляциями, что характеризовалось высокими значениями кросс-корреляции между МПД и ЛПП тета-осцилляций (рис. 1d). В соответствии с этими наблюдениями, циркулярный статистический анализ активности нейронов выявил, что амплитуда значений вектора Релея (0.075 (0.054 – 0.112)) достигается непосредственно перед пиком тета-осцилляций (угол вектора Релея –32.8 (–35.7 – –5.1) градусов) (n = 7) (рис. 1e).
Рис. 1.
Тета-осцилляции в изолированном гиппокампе in vitro. (a) – Схема расположения электродов в интактном гиппокампе in vitro. (b) – Примеры одновременной регистрации ЛПП и МПД в пирамидном слое и stratum radiatum СА1 гиппокампа. МПД обозначены вертикальными серыми линиями. * – пики тета-осцилляций. Под записью ЛПП в stratum radiatum слое представлен результат преобразования Гильберта ЛПП-сигнала в фазы тета-осцилляции. (c) – График спектра мощности ЛПП в stratum radiatum СА1. (d) – Временная кросс-корреляции МПД в СА1 пирамидном слое с пиком ЛПП тета-осцилляций, записанных в stratum radiatum. (e) – Циркулярная гистограмма частоты МПД относительно фазы тета-осцилляции. Вектор Релея обозначен черным цветом.
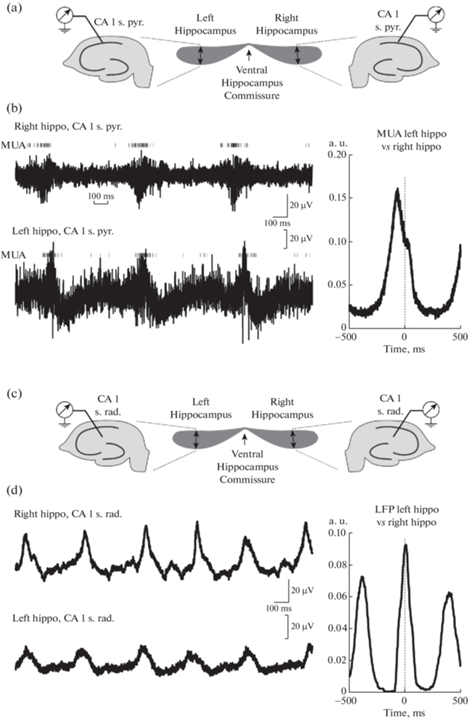
Для исследования билатеральной организации тета-осцилляций была проведена одновременная регистрация активности в левом и правом гиппокампах с сохраненными комиссуральными связями (рис. 2). Было обнаружено, что тета-осцилляции высоко синхронизированы между обоими гиппокампами, о чем свидетельствовал высокий уровень кросс-корреляции между ЛПП в двух гиппокампах, значения которой достигали 0.77 (0.55 – 0.93), с временной задержкой 4.4 (–10.3 – 6.6) мс пиковых значений кросс-корреляции между правым и левым гиппокампом (n = 7). Также о высоком уровне билатеральной синхронизации тета-осцилляций свидетельствовала высокая корреляция между МПД в правом и левом гиппокампах, достигающая значений 0.15 (0.12 – 0.18) с временной задержкой 2.9 (‒43.7 – 19.8) мс пиковых значений кросс-корреляции МПД между правым и левым гиппокампами (n = 5). В различных экспериментах наблюдалось преобладающее лидирование либо левого, либо правого гиппокампа, но достоверного лидирования одной из сторон в генерации тета-осцилляций на групповом уровне не выявлялось.
Рис. 2.
Билатеральная синхронизация тета-осцилляции в связанных комиссурой правом и левом гиппокампах in vitro. (a) – Схема расположения электродов в препарате связанных комиссурой гиппокампов in vitro. (b) – Примеры одновременной регистрации ЛПП и МПД в пирамидном слое СА1 левого и правого гиппокампов. МПД обозначены вертикальными серыми линиями. Справа – график кросс-корреляции МПД в СА1 пирамидном слое левого и правого гиппокампов. (c) – Схема расположения электродов в препарате связанных комиссурой гиппокампов in vitro для регистрации ЛПП. (d) – Примеры одновременной регистрации ЛПП в stratum radiatum СА1 левого и правого гиппокампов. Справа – график кросс-корреляции ЛПП в левом и правом гиппокампах.
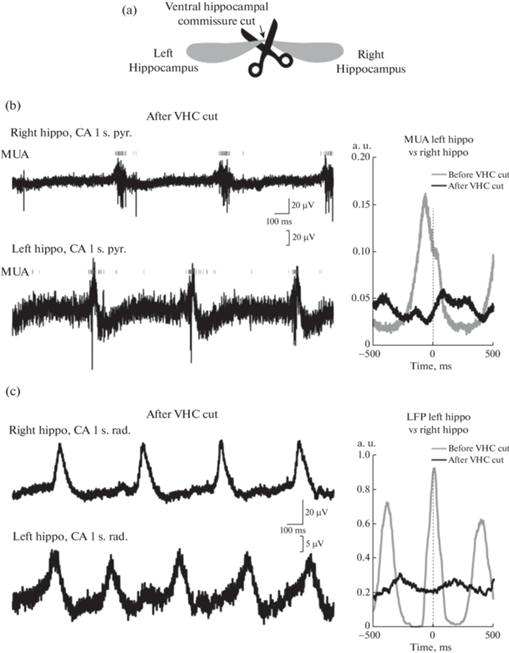
Перерезка комиссуральных связей приводила к полной десинхронизации тета-осцилляций в левом и правом гиппокампах, о чем свидетельствовало исчезновение достоверной билатеральной корреляции между колебаниями ЛПП и МПД (n = 4; рис. 3). Частота тета-осцилляций после перерезки комиссуральных связей достоверно не изменялась ни в правом, ни в левом гиппокампах (p = 0.93; n = 4).
Рис. 3.
Перерезка гиппокампальной комиссуры устраняет билатеральную синхронизацию тета-осцилляций. (a) – Схема расположения электродов в препарате двух гиппокампов in vitro после полной перерезки вентральной и дорсальной комиссур. (b) – Примеры одновременной регистрации ЛПП и МПД в пирамидном слое СА1 левого и правого гиппокампов. МПД обозначены вертикальными серыми линиями. Справа – график кросс-корреляции МПД в СА1 пирамидном слое левого и правого гиппокампов до и после перерезки вентральной комиссуры. (c) – Примеры одновременной регистрации ЛПП в stratum radiatum СА1 левого и правого гиппокампов. Справа – график кросс-корреляции ЛПП в левом и правом гиппокампах до и после перерезки вентральной комиссуры.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Основными результатами настоящего исследования являются демонстрация высокого уровня синхронизации тета-осцилляций в препарате левого и правого гиппокампов ювенильных и взрослых крыс и мышей in vitro, и доказательство того, что билатеральная синхронизация этих тета-осцилляций обеспечивается комиссуральными связями между гиппокампами.
Модель гиппокампальной системы in vitro, которая включает в себя оба изолированных интактных гиппокампа, соединенных вентральной комиссурой [25–28], была изначально разработана для онтогенетических исследований. Эта модель позволила охарактеризовать билатеральную синхронизацию посредством комиссуральных связей во время гигантских деполяризующих потенциалов [28], а также при распространении пароксизмальных разрядов [25, 27, 29–31] в развивающейся гиппокампальной системе крыс и мышей. Изначально предполагалось, что данная модель имеет возрастные ограничения и может быть использована лишь в постнатальном периоде (до постнатального дня Р10) в связи с увеличением толщины гиппокампа и сужения внеклеточного пространства, что ухудшает проникновение метаболитов из омывающего раствора вглубь препарата по мере взросления, а также в связи с возрастным увеличением энергопотребления [26]. Однако оптимизация экспериментальных условий, в первую очередь, значительное увеличение скорости протока омывающего препарат раствора позволили добиться условий, при которых сохраняются мембранный потенциал нейронов, функциональные синаптические связи и сетевые взаимодействия в интактных гиппокампах даже взрослых животных [21]. Обнаружилось, что в этих условиях в изолированном гиппокампе ювенильных и взрослых мышей возникают автономные спонтанные осцилляции в частотном диапазоне, близком к частоте тета-осцилляций, наблюдаемых in vivo. Данная модель тета-осцилляций позволила получить важные знания о клеточных, синаптических и сетевых механизмах тета-осцилляций [21–24]. Очевидно, что данная модель имеет ограничения, связанные с отсутствием ряда ключевых корковых и подкорковых структур, которые принимают участие в тета-генезе in vivo, но при этом является вполне адекватной для исследования интрагиппокампального компонента тета-осцилляций.
Тета-осцилляции в изолированных гиппокампах in vitro, которые описываются в настоящем исследовании, генерируются в нейрональных сетях самих гиппокампов, поскольку энторинальная кора в этом препарате отсутствует. Таким образом, тета-осцилляции изолированных гиппокампов могут быть релевантными компоненту “внутренних моделей” тета-осцилляций in vivo и также соответствовать, например, генерируемым в СА3 сетях тета-осцилляциям у животных, находящихся под уретановым наркозом или после билатеральной резекции энторинальной коры [32–34]. Соответственно билатеральная синхронизация тета-осцилляций в препарате двух гиппокампов in vitro, которая была обнаружена в настоящем исследовании, может свидетельствовать о наличии механизма интеграции “внутренних моделей” путем билатеральной синхронизации нейрональных сетей гиппокампов в тета-осцилляции посредством прямых связей, организованных в вентральной гиппокампальной комиссуре. Для того, чтобы установить значимость комиссуральных связей в билатеральной синхронизации физиологических тета-осцилляций in vivo, в дальнейших исследованиях представляет интерес проверить эффект перерезки комиссуральных связей на билатеральную тета-сихронизацию в интактном животном.
Список литературы
Suzuki SS, Smith GK (1987) Spontaneous EEG spikes in the normal hippocampus. I. Behavioral correlates, laminar profiles and bilateral synchrony. Electroencephalogr Clin Neurophysiol 67 (4): 348–359. https://doi.org/10.1016/0013-4694(87)90123-4
Buzsaki G (1989) Two-stage model of memory trace formation: a role for “noisy” brain states. Neuroscience 31 (3): 551–570. https://doi.org/10.1016/0306-4522(89)90423-5
Buzsaki G, Buhl DL, Harris KD, Csicsvari J, Czeh B, Morozov A (2003) Hippocampal network patterns of activity in the mouse. Neuroscience 116 (1): 201–211. https://doi.org/10.1016/S0306-4522(02)00669-3
Buzsaki G (2015) Hippocampal sharp wave-ripple: A cognitive biomarker for episodic memory and planning. Hippocampus 25 (10): 1073–1188. https://doi.org/10.1002/hipo.22488
Carr MF, Karlsson MP, Frank LM (2012) Transient slow gamma synchrony underlies hippocampal memory replay. Neuron 75 (4): 700–713. https://doi.org/10.1016/j.neuron.2012.06.014
Shinohara Y, Hosoya A, Hirase H (2013) Experience enhances gamma oscillations and interhemispheric asymmetry in the hippocampus. Nat Commun 4: 1652. https://doi.org/10.1038/ncomms2658
Pfeiffer BE, Foster DJ (2015) PLACE CELLS. Autoassociative dynamics in the generation of sequences of hippocampal place cells. Science 349 (6244): 180–183. https://doi.org/10.1126/science.aaa9633
Wang Y, Toprani S, Tang Y, Vrabec T, Durand DM (2014) Mechanism of highly synchronized bilateral hippocampal activity. Exp Neurol 251: 101–111. https://doi.org/10.1016/j.expneurol.2013.11.014
Benito N, Martin-Vazquez G, Makarova J, Makarov VA, Herreras O (2016) The right hippocampus leads the bilateral integration of gamma-parsed lateralized information. Elife 5. https://doi.org/10.7554/eLife.16658
Tanaka M, Wang X, Mikoshiba K, Hirase H, Shinohara Y (2017) Rearing-environment-dependent hippocampal local field potential differences in wild-type and inositol trisphosphate receptor type 2 knockout mice. J Physiol 595 (20): 6557–6568. https://doi.org/10.1113/JP274573
Valeeva G, Nasretdinov A, Rychkova V, Khazipov R (2019) Bilateral Synchronization of Hippocampal Early Sharp Waves in Neonatal Rats. Front Cell Neurosci 13: 29. https://doi.org/10.3389/fncel.2019.00029
Khazipov R, Holmes GL (2003) Synchronization of kainate-induced epileptic activity via GABAergic inhibition in the superfused rat hippocampus in vivo. J Neurosci 23 (12): 5337–5341. https://doi.org/10.1523/JNEUROSCI.23-12-05337.2003
Buzsaki G (2002) Theta Oscillations in the hippocampus. Neuron 33: 325–340. https://doi.org/10.1016/s0896-6273(02)00586-x
Buzsaki G, Moser EI. (2013) Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat Neurosci 16 (2): 130–138. https://doi.org/10.1038/nn.3304
Colgin LL (2013) Mechanisms and functions of theta rhythms. Annu Rev Neurosci 36: 295–312. https://doi.org/10.1146/annurev-neuro-062012-170330
Hasselmo ME (2005) What is the function of hippocampal theta rhythm?–Linking behavioral data to phasic properties of field potential and unit recording data. Hippocampus 15 (7): 936–949. https://doi.org/10.1002/hipo.20116
Mizuseki K, Sirota A, Pastalkova E, Buzsaki G (2009) Theta oscillations provide temporal windows for local circuit computation in the entorhinal-hippocampal loop. Neuron 64 (2): 267–80. https://doi.org/10.1016/j.neuron.2009.08.037
Shinohara Y, Hosoya A, Yahagi K, Ferecsko AS, Yaguchi K, Sik A, Itakura M, Takahashi M, Hirase H (2012) Hippocampal CA3 and CA2 have distinct bilateral innervation patterns to CA1 in rodents. Eur J Neurosci 35 (5): 702–710. https://doi.org/10.1111/j.1460-9568.2012.07993.x
Fernandez-Ruiz A, Oliva A, Nagy GA, Maurer AP, Berenyi A, Buzsaki G (2017) Entorhinal-CA3 Dual-Input Control of Spike Timing in the Hippocampus by Theta-Gamma Coupling. Neuron 93: 1213–1226. https://doi.org/10.1016/j.neuron.2017.02.017
Buzsaki G, Eidelberg E (1982) Convergence of associational and commissural pathways on CA1 pyramidal cells of the rat hippocampus. Brain Res 237 (2): 283–295. https://doi.org/10.1016/0006-8993(82)90442-5
Goutagny R, Jackson J, Williams S (2009) Self-generated theta oscillations in the hippocampus. Nat Neurosci 12 (12): 1491–1493. https://doi.org/10.1038/nn.2440
Ducharme G, Lowe GC, Goutagny R, Williams S (2012) Early Alterations in Hippocampal Circuitry and Theta Rhythm Generation in a Mouse Model of Prenatal Infection: Implications for Schizophrenia. Plos One 7 (1):8. https://doi.org/10.1371/journal.pone.0029754
Jackson J, Amilhon B, Goutagny R, Bott JB, Manseau F, Kortleven C, Bressler SL, Williams S (2014) Reversal of theta rhythm flow through intact hippocampal circuits. Nat Neurosci 17 (10): 1362–1370. https://doi.org/10.1038/nn.3803
Amilhon B, Huh CYL, Manseau F, Ducharme G, Nichol H, Adamantidis A, Williams S (2015) Parvalbumin Interneurons of Hippocampus Tune Population Activity at Theta Frequency. Neuron 86 (5): 1277–1289. https://doi.org/10.1016/j.neuron.2015.05.027
Khalilov I, Dzhala V, Medina I, Leinekugel X, Melyan Z, Lamsa K, Khazipov R, Ben-Ari Y (1999) Maturation of kainate-induced epileptiform activities in interconnected intact neonatal limbic structures in vitro. Eur J Neurosci 11 (10): 3468–3480. https://doi.org/10.1046/j.1460-9568.1999.00768.x
Khalilov I, Esclapez M, Medina I, Aggoun D, Lamsa K, Leinekugle X, Khazipov R, BenAri Y (1997) A novel in vitro preparation: the intact hippocampal formation. Neuron 19 (4): 743–749. https://doi.org/10.1016/s0896-6273(00)80956-3
Khazipov R, Desfreres L, Khalilov I, Ben-Ari Y (1999) Three-independent-compartment chamber to study in vitro commissural synapses. J Neurophysiol 81 (2): 921–924. https://doi.org/10.1152/jn.1999.81.2.921
Leinekugel X, Khalilov I, Ben-Ari Y, Khazipov R (1998) Giant depolarizing potentials: the septal pole of the hippocampus paces the activity of the developing intact septohippocampal complex in vitro. J Neurosci 18 (16): 6349–6357. https://doi.org/10.1523/JNEUROSCI.18-16-06349.1998
Khalilov I, Holmes GL, Ben Ari Y (2003) In vitro formation of a secondary epileptogenic mirror focus by interhippocampal propagation of seizures. Nat Neurosci 6 (10): 1079–1085. https://doi.org/10.1038/nn1125
Khalilov I, Le Van QM, Gozlan H, Ben Ari Y (2005) Epileptogenic Actions of GABA and Fast Oscillations in the Developing Hippocampus. Neuron 48 (5): 787–796. https://doi.org/10.1016/j.neuron.2005.09.026
Nardou R, Ben-Ari Y, Khalilov I (2009) Bumetanide, an NKCC1 antagonist, does not prevent formation of epileptogenic focus but blocks epileptic focus seizures in immature rat hippocampus. J Neurophysiol 101 (6): 2878–2888. https://doi.org/10.1152/jn.90761.2008
Ylinen A, Soltesz I, Bragin A, Penttonen M, Sik A, Buzsaki G (1995) Intracellular correlates of hippocampal theta rhythm in identified pyramidal cells, granule cells, and basket cells. Hippocampus 5 (1): 78–90. https://doi.org/10.1002/hipo.450050110
Buzsaki G, Czopf J, Kondakor I, Kellenyi L (1986) Laminar distribution of hippocampal rhythmic slow activity (RSA) in the behaving rat: current-source density analysis, effects of urethane and atropine. Brain Res 365 (1): 125–137. https://doi.org/10.1016/0006-8993(86)90729-8
Kamondi A, Acsady L, Wang XJ, Buzsaki G (1998) Theta oscillations in somata and dendrites of hippocampal pyramidal cells in vivo: activity-dependent phase-precession of action potentials. Hippocampus 8 (3): 244–261. https://doi.org/10.1002/(SICI)1098-1063(1998)8:3<244::AID-HIPO7>3.0.CO;2-J
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


