Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 3, стр. 223-231
Длительная световая депривация влияет на пищеварительную функцию у крыс в онтогенезе
Е. П. Антонова 1, *, А. В. Морозов 1, В. А. Илюха 1, Е. А. Хижкин 1, 2, С. Н. Калинина 1, 2
1 Институт биологии Карельского научного центра РАН
Петрозаводск, Россия
2 Петрозаводский государственный университет
Петрозаводск, Россия
* E-mail: antonova88ep@mail.ru
Поступила в редакцию 28.02.2023
После доработки 21.04.2023
Принята к публикации 22.04.2023
- EDN: YGXTXU
- DOI: 10.31857/S0044452923030038
Аннотация
Проведено исследование влияния световой депривации на возрастные изменения массы тела, кормо- и водопотребления, а также активности пищеварительных ферментов в тканях поджелудочной железы у самцов крыс. Животные были разделены на три группы: первая находилась в стандартном регулярно чередующемся освещении (12 ч свет/12 ч темнота, контроль, LD), вторая содержалась в условиях длительной световой депривации с момента рождения (LD/DD), а третья – с периода эмбрионального развития (DD/DD). Длительное пребывание крыс в условиях световой депривации приводило к нарушению возрастной динамики изученных показателей, при этом обнаруженные изменения в ответ на специфический световой режим различались в зависимости от того, на каком этапе онтогенеза начиналось его воздействие. Так, масса тела (возраст 3 и 18 мес) и потребление корма и воды (12 мес), активности амилазы и липазы (18 месяцев) были ниже, а активности протеаз после окончания стадии стабильного роста (12, 18 и 24 мес) были выше у крыс в LD/DD режиме, чем у LD. Значительные изменения изученных показателей наблюдались в условиях DD/DD в возрасте 12 и 18 мес – масса тела была максимальна, а потребление корма и воды минимальны по сравнению с LD и LD/DD. В дополнение у крыс в DD /DD отмечены максимальная активность амилазы (1 и 6 месяцев) и более высокие значения общей протеолитической активности в период стабильного роста (6 и 12 мес) по сравнению с контролем. Таким образом, в результате настоящего исследования показано, что световая депривация нарушает онтогенетическую программу развития пищеварительной системы млекопитающих.
ВВЕДЕНИЕ
В основе циклических проявлений жизнедеятельности находится эндогенная программа циркадианной ритмичности, нарушение которой может приводить к системной десинхронизации и к пагубным для здоровья последствиям. Для большинства живых существ временным синхронизатором служит внешний фактор – световой режим. У позвоночных животных информация о свете поступает в центральные циркадные биологические часы (супрахиазматические ядра передней части гипоталамуса, СХЯ), затем распространяется по всему организму посредством автономной нервной системы и гормона пинеальной железы – мелатонина (N-ацетил-5-метокситриптамина) [1]. Показано, что условия освещенности оказывают значительное влияние на морфологию пинеальной железы [2], которая, в свою очередь, участвует в регуляции функций физиологических систем [3, 4]. Так, в условиях стандартного светового режима LD (12 ч свет/12 ч темнота) колебания синтеза мелатонина достаточно стабильны в течение суток [5] и сохраняются, но становятся менее выраженными или нерегулярными у крыс, перемещенных из LD в режим постоянной темноты (DD) [3, 5]. Хроническое воздействие как постоянной темноты DD, так и постоянного света (LL) приводит к нарушению циркадных ритмов [1, 3, 5], снижению массы пинеальной железы [6], изменению морфологии этого органа [2], а также к тревожно-депрессивному поведению [1, 3] и к световому десинхронозу [1, 7].
На сегодняшний день существует очень ограниченное число работ, целью которых являлось изучение влияния светового десинхроноза в период беременности на циркадные ритмы физиологических систем у потомства [1, 8, 9]. В отличие от циркадной системы взрослого организма, скоординированной с циклами свет/темнота, циркадная система плода и новорожденного в значительной степени зависит от эндогенных материнских ритмов (в частности, ритма мелатонина) [8, 9]. При этом, если становление и синхронизация циркадной системы эмбриона происходят под влиянием материнских циркадианных ритмов через плацентарный барьер, то в раннем постнатальном периоде – за счет мелатонина, содержащегося в материнском молоке, и интенсивного социального взаимодействия с матерью [1, 8, 9]. Такие сигналы от матери напрямую управляют ритмами в раннем постнатальном онтогенезе до тех пор, пока у новорожденного не сформируются собственный генератор эндогенных ритмов в СХЯ и суточный ритм синтеза мелатонина пинеальной железы [4]. В организме новорожденных животных мелатонин участвует в регуляции большого количества биохимических процессов и физиологических функций (пролиферация и дифференцировка клеток, половое созревание, поведение, ритм сна и бодрствования, иммунный ответ) [9, 10]. Поэтому нарушение циркадного ритма секреции мелатонина в период беременности и в раннем постнатальном онтогенезе может привести к негативным последствиям и проявиться на более поздних сроках развития.
Пинеальная железа претерпевает в процессе онтогенеза перестройки инволютивного характера [11]. Уменьшение продукции мелатонина при старении индуцирует резистентность к инсулину, нарушение сна, метаболизма и приводит к ожирению [12]. Поэтому среди проблем физиологии очевидный интерес представляет и возрастной аспект исследования модификации циркадной ритмики физиологических систем у млекопитающих, особенно при системной десинхронизации. Анализ современных источников литературы показывает, что воздействие как света ночью, так и длительных периодов темноты, оказывает значительное влияние на эндогенные циркадные ритмы гормонов, участвующих в метаболизме липидов и углеводов у млекопитающих [1, 7]. Однако несмотря на активные исследования в этой области, недостаточно изучена роль пинеальной железы и продуцируемого ею мелатонина в регуляции пищеварительной функции, особенно в возрастном аспекте.
В связи с этим целью настоящей работы являлось изучение влияния длительной (пожизненной) световой депривации, воздействие которой начиналось с периода эмбрионального развития (DD/DD) или с момента рождения (LD/DD), на возрастные изменения массы тела, кормо- и водопотребления, а также активности пищеварительных ферментов в тканях поджелудочной железы у самцов крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”. Опыты проводили на крысах Вистар (самцы и самки) собственной разводки, первоначально полученных из питомника лабораторных животных “Пущино” (научно-производственное подразделение Филиала Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова, Московская область). Всех животных содержали в стандартных помещениях вивария Петрозаводского государственного университета площадью 25 м2 в индивидуальных клетках размером 42 × 26 × ×18.5 см при температуре 23 ± 1° и влажности в диапазоне от 45 до 55%, в качестве подстилочного материала использовали древесную стружку. Крысы получали стандартный готовый лабораторный корм (РФ, ЗАО “Тосненский комбикормовый завод”, ГОСТ Р50258-92) и фильтрованную водопроводную воду без ограничений. Для разведения 4-месячных самцов и самок крыс содержали в условиях стандартного фиксированного режима освещения (12 ч света 750 лк/12 ч темноты; LD) или при постоянной темноте (0–0.5 лк, DD). После рождения потомства самок первой группы вместе с приплодом в случайном порядке разделили на две подгруппы – либо оставили при стандартном регулярно чередующемся освещении (LD; контрольные животные), либо перенесли в постоянную темноту (LD/DD). Самок и потомство, рожденное в группе DD, оставили в условиях постоянной темноты (DD/DD). Последующие исследования проводили на потомстве. Все манипуляции с животными проводились при красном свете ламп (не более 0.5 лк). В ходе эксперимента проводилось определение таких физиологических показателей, как масса тела (ежемесячно), а также с использованием метаболических клеток для лабораторных животных кормо- и водопотребление (в 6, 12 и 18 мес).
В возрасте 1, 2, 3, 6-ти, 12, 18 и 24 мес по 4 самца из каждой группы декапитировали и отбирали образцы тканей поджелудочной железы для последующего анализа. Для определения активности пищеварительных ферментов образцы тканей гомогенизировали в 2.0 мл ледяного буферного раствора (рН 6.9, состоящего из 20 мМ Na2HPO4 и 6.7 мМ NaCl). Гомогенаты поджелудочной железы центрифугировали при 6000 g в течение 15 мин, при 4°С. Общую протеолитическую активность определяли спектрофотометрически (спектрофотометр СФ-2000, Россия) с использованием субстрата гемоглобина – по приросту тирозина при 280 нм. Активность амилазы определяли с помощью спектрофотометра Thermo Spectronic Genesys 20 (Thermo Fisher Waltham, США), используя в качестве субстрата крахмал (концентрацию продукта комплекс крахмала с йодом измеряли при 600 нм). Липаза гидролизует трибутират глицерина до свободной жирной кислоты и глицерина. Количество продукта активности липазы (глицерина) определяли спектрофотометрически при 530 нм (спектрофотометр Thermo Spectronic Genesys 20, Thermo Fisher Waltham, США). Активность ферментов выражали в мкмоль продуктов гидролиза (для амилазы – в мг крахмала), образующихся за 1 мин в расчете на 1 г ткани [подробное описание методик см. 13].
Полученные данные обработаны общепринятыми статистическими методами, используя пакеты программ MS Excel и Prism 7, и были представлены в виде медианы (Me) и процентилей (25%, 75%) (распределение, отличное от нормального). Ввиду небольшого количества образцов использовали критерий Краскела–Уоллиса (Kruskal–Wallis H-test, непараметрический дисперсионный анализ) с post-hoc тестом по Манна–Уитни, использовали поправку на множественность сравнений FDR (false discovery rate). Различия считались статистически достоверными при p < 0.05. Взаимосвязь между исследуемыми показателями у крыс (n = 24) в разных режимах освещения анализировали с помощью коэффициента корреляции Спирмена. Анализ статистической мощности не производили.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние длительной световой депривации, воздействие которой начиналось с момента рождения (LD/DD), на исследуемые показатели
В результате проведенного исследования обнаружено, что крысы в режиме LD/DD в возрасте 12 мес потребляли меньше корма (H = 13.768, р < 0.05) и воды (H = 13.789, р < 0.05) по сравнению с LD (табл. 1), и масса их тела в возрасте 3 и 18 мес была минимальна среди всех исследуемых групп (значения H – 8.375 и 8.909 соответственно, р < 0.05) (рис. 1а). Помимо этого, содержание крыс в LD/DD режиме привело к изменению активности пищеварительных ферментов в поджелудочной железе в месячном возрасте (липаза, H = 11.61, р < 0.05) (рис. 1d) и с 12-месячного возраста (протеазы, амилаза и липаза) по сравнению с контролем. Так, в 6, 12, 18 и 24 мес активность протеаз была выше у животных LD/DD (рис. 1b), чем у LD (р < 0.05). При этом активности амилазы (рис. 1c) и липазы (рис. 1d) в 18 мес были ниже у LD/DD животных по сравнению с контрольными животными (р < 0.05).
Таблица 1.
Медианы значений потребления корма и воды самцами крыс линии Wistar в разных экспериментальных группах (в скобках указаны нижний и верхний квартили)
| Возраст, месяц | Потребление корма в сутки, г | Потребление воды в сутки, мл | ||||
|---|---|---|---|---|---|---|
| LD | LD/DD | DD/DD | LD | LD/DD | DD/DD | |
| 6 | 46 | 43.5 | 35.5* | 52.5 | 62.5 | 45 |
| (43; 50) | (34.5; 50) | (29.5; 38) | (47.5; 62.5) | (53; 68.5) | (33; 50) | |
| 12 | 45.5 | 35$\diamondsuit $ | 28* | 49 | 33$\diamondsuit $ | 31* |
| (38; 51.5) | (26; 36) | (26;32) | (41; 69.5) | (30; 40) | (29; 36) | |
| 18 | 43.5 | 40 | 28* |
50 | 44 | 32* |
| (40; 45) | (30; 49) | (25; 34) | (41; 58) | (37; 50) | (23; 36) | |
* Здесь и в табл. 2: LD, LD/DD и DD/DD – группы животных; $\diamondsuit $ – различия достоверны между животными LD и LD/DD (р < 0.05, критерий Краскела–Уоллиса с post-hoc тестом по Манна–Уитни, поправка FDR),
* – различия достоверны между животными LD и DD/DD (р < 0.05, критерий Краскела–Уоллиса с post-hoc тестом по Манна–Уитни, поправка FDR),
 – различия достоверны между животными LD/DD и DD/DD (р < 0.05, критерий Краскела–Уоллиса с post-hoc тестом по Манна–Уитни, поправка FDR);
в каждой группе n = 4.
– различия достоверны между животными LD/DD и DD/DD (р < 0.05, критерий Краскела–Уоллиса с post-hoc тестом по Манна–Уитни, поправка FDR);
в каждой группе n = 4.
Рис. 1.
Возрастная динамика изученных показателей у самцов крыс при различных световых режимах.
(a) – Изменение массы тела, (b) – общей протеолитической активности, (c) – активности
амилазы, (d) – активности липазы в поджелудочной железе. LD, LD/DD и DD/DD – группы
животных; $\diamondsuit $ – различия достоверны между животными LD и LD/DD (р < 0.05, критерий Краскела–Уоллиса с post-hoc тестом по Манна–Уитни, поправка FDR),
* – различия достоверны между животными LD и DD/DD (р < 0.05, критерий Краскела–Уоллиса с post-hoc тестом по Манна–Уитни, поправка FDR),
 – различия достоверны между животными LD/DD и DD/DD (р < 0.05, критерий Краскела–Уоллиса с post-hoc тестом по Манна–Уитни, поправка FDR);
в каждой группе n = 4.
– различия достоверны между животными LD/DD и DD/DD (р < 0.05, критерий Краскела–Уоллиса с post-hoc тестом по Манна–Уитни, поправка FDR);
в каждой группе n = 4.
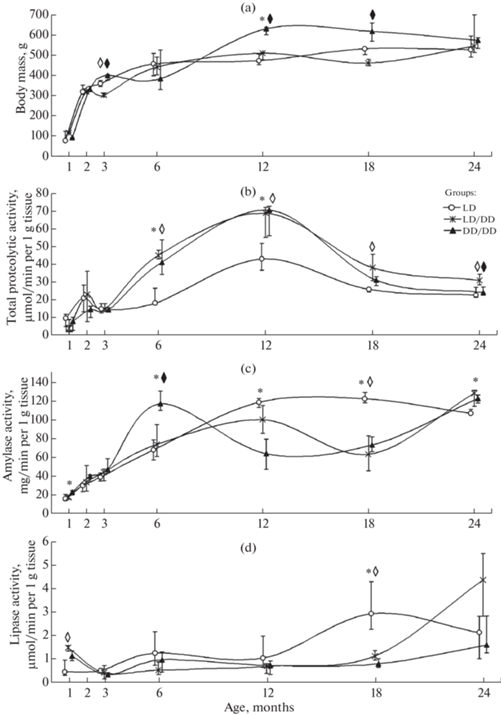
Таблица 2.
Корреляции (r) и уровни значимости (p) между исследуемыми показателями у крыс в разных условиях освещения
| Параметры корреляции | Коэффициент Спирмена | ||
|---|---|---|---|
| r | p | ||
| Общая протеолитическая активность – масса тела | LD | 0.50 | 0.0332* |
| LD/DD | 0.66 | 0.0051* | |
| DD/DD | 0.63 | 0.0095* | |
| Активность амилазы– масса тела | LD | 0.88 | 0.0002* |
| LD/DD | 0.87 | 0.0002* | |
| DD/DD | 0.36 | 0.1398 | |
| Активность липазы – масса тела | LD | 0.57 | 0.0152* |
| LD/DD | 0.14 | 0.5563 | |
| DD/DD | 0.13 | 0.6063 | |
Влияние длительной световой депривации, воздействие которой начиналось с периода эмбрионального развития (DD/DD), на изучаемые параметры
Содержание крыс в DD/DD привело к минимальным значениям потребления корма (6, 12 и 18 мес, р < 0.05) и воды (12 и 18 месяцев, р < 0.05) (табл. 1), но при этом масса тела животных увеличивалась с 3 мес – животные в этой группе имели бо́льшие размеры тела по сравнению с LD и LD/DD в 3 (H = 8.375, р < 0.05), 12 (H = 7.449, р < 0.05) и 18 мес (H = 8.909, р < 0.05) (рис. 1a). Обнаружено, что в возрасте 6 и 12 мес общая протеолитическая активность у крыс в режиме DD/DD была выше в среднем на 20%, чем у LD-животных (р < 0.05), однако в 18 и 24 мес активность протеаз снизилась до контрольных значений (рис. 1b). Активность амилазы к 6 месяцам в DD/DD увеличилась до максимальных значений (H = 8.721, р < 0.05), но уже к 12 мес она снизилась на 40% и была ниже, чем у животных в LD (H = 9.707, р < 0.05) (рис. 1c). В 18 мес как активность амилазы (рис. 1c), так и активность липазы (рис. 1d) были ниже у DD/DD по сравнению с контрольными значениями (р < 0.05). Отмечены следующие различия между группами LD/DD и DD/DD: активность протеаз была выше у крыс в группе LD/DD, чем в DD/DD (возраст 24 мес, р < 0.05) (рис. 1b); активность амилазы в 6‑месячном возрасте была ниже (р < 0.05) у LD/DD-животных по сравнению с DD/DD (р < < 0.05) (рис. 1c).
Корреляции
В стандартном регулярно чередующемся освещении выявлены положительные корреляции между активностями ферментов (протеазы, амилаза и липаза) и массой тела животных (р < 0.05) (табл. 2). Световая депривация нарушала эти корреляционные связи, так, в режиме LD/DD не обнаружено корреляции между активностью липазы и массой тела, а в DD/DD – не было корреляций между активностью амилазы и массой тела, а также между активностью липазы и массой тела (табл. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На становление пищеварительной функции могут оказывать влияние различные факторы (голод, изменение температуры и др.) [14–16]. К таковым также стоит отнести нестандартные световые режимы, например, постоянное освещение и постоянная темнота [1, 7]. В настоящем эксперименте длительное содержание крыс в условиях световой депривации приводило к нарушению возрастной динамики массы тела животных, кормо- и водопотребления, а также активности пищеварительных ферментов в поджелудочной железе. Однако эти изменения в ответ на специфический световой режим различались в зависимости от того, на каком этапе онтогенеза начиналось его воздействие. Так, содержание крыс в LD/DD режиме привело к снижению массы тела в возрасте 3 и 18 мес и потребления корма и воды в 12 мес по сравнению с LD. При этом у животных в режиме DD/DD в возрасте 12 и 18 мес масса тела была максимальна, а потребление корма и воды было минимально среди исследованных групп (рис. 1а, табл. 1). Результаты нашего исследования частично согласуются с ранее полученными данными – в условиях DD (животные содержались в режиме с 25-дневного возраста) у самцов крыс наблюдались увеличение фазы прогрессивного роста и сниженное количество потребляемого корма по сравнению с контролем [7]. Необходимо отметить, что точно так же, как и в нашем эксперименте, в возрасте 3 мес LD/DD-крысы имели минимальную массу тела среди всех исследуемых групп [7].
В результате проведенного нами исследования у крыс во всех световых режимах обнаружены схожие возрастные изменения активности протеаз в поджелудочной железе: до 12 мес протеолитическая активность увеличивалась, что соответствует окончанию фазы стабильного роста и связано с необходимостью в пластическом материале, а затем наблюдалось постепенное ее снижение (рис. 1b). В условиях световой депривации выявлена более высокая активность протеаз (LD/DD – 6, 12, 18, 24 и DD/DD – 6 и 12 мес) по сравнению с контролем. Онтогенетические изменения активности амилазы у крыс в условиях длительной световой депривации с момента рождения (LD/DD) были сходны с группой LD. Достоверные различия между указанными группами в активности фермента отмечались только в возрасте 18 мес, в LD/DD она была ниже (рис. 1c). Значительные нарушения возрастной динамики изменения амилолитической активности выявлены в условиях DD/DD – у 6- и 24-месячных крыс этой группы активность фермента была выше, а у 12- и 18-месячных ниже, чем у контрольных животных тех же возрастов (рис. 1c). Изменение большинства показателей указывает на значительные метаболические перестройки у крыс, находившихся в темноте с момента внутриутробного развития (DD/DD), что подтверждают результаты корреляционного анализа – в DD/DD режиме часть корреляционных связей отсутствовала (табл. 2). Увеличение массы тела при уменьшении потребления пищи может являться результатом нарушения обмена углеводов. В исследовании Kang и соавт. [17] было обнаружено, что при содержании крыс в режиме DD (120 дней) наблюдаются снижение уровня инсулина и увеличение содержания глюкозы в крови по сравнению с LD. В условиях гипергликемии печень начинает активно синтезировать жирные кислоты и триглицериды, параллельно активируется липогенез в жировой ткани, что приводит к увеличению массы тела.
Обмен липидов, как и многие процессы, протекающие в организме, координируется циркадными часами, синхронизирующими функцию адипоцитов, которые, в свою очередь, способствуют липолизу в течение биологической ночи и липогенезу в течение биологического дня, таким образом, поддерживается баланс между окислением липидов и углеводов и накоплением глюкозы [18]. Нарушение работы этих часов может приводить к изменениям экспрессии ферментов, участвующих в метаболизме липидов, а также оказывать негативное воздействие на гомеостаз жирных кислот и регуляцию абсорбции липидов в течение суток [19, 20]. В нашем эксперименте возрастные изменения липолитической активности в поджелудочной железе у животных во всех экспериментальных группах носили схожий характер. Тем не менее у крыс, содержавшихся в темноте независимо от момента начала ее воздействия, активность липазы в 18 мес была достоверно ниже, чем у животных того же возраста в режиме LD (рис. 1d). Необходимо отметить, что у взрослых грызунов длительная световая депривация оказывает влияние только на период и амплитуду при сохранении ритмичности колебаний экспрессии часовых генов и генов метаболизма липидов [1, 20].
Согласно данным литературы, эффекты влияния DD на незрелую циркадную систему грызунов обширны [1]. Большинство исследований по данной тематике посвящено изучению развития структур головного мозга и физиологии поведения [21–24]. Доказано, что воздействие DD как во время эмбрионального развития, так и с момента рождения приводит к снижению нейрогенеза и числа нейронов, ответственных за связь между осцилляторами СХЯ, с последующей десинхронизацией ритмов синтеза ряда гормонов (нейропептиды и кортикостерон), развитием депрессивно-подобного поведения и снижением пространственной памяти [1, 3, 21, 22]. В результате оценки психоэмоционального состояния крыс из нашего эксперимента [25] выявлено, что световая депривация (группы LD/DD и DD/DD) вызывала увеличение уровня тревожности по сравнению с контрольными животными, при этом крысы, матери которых содержались в условиях темноты в период беременности (группа DD/DD), чувствовали себя комфортнее, и уровень их тревожности был ниже, чем у крыс в LD/DD условиях освещения. Об этом свидетельствуют более низкие значения количества реакций фризинга и актов дефекаций у крыс в DD/DD группе по сравнению с LD/DD. Вероятно, отмеченные эффекты DD/DD на поведение крыс связаны с более длительным воздействием темноты и развитием компенсаторных реакций [25]. Опираясь на эти данные, можно предположить, что крысы в LD/DD условиях были более стрессочувствительны. Ранее показано, что воздействие DD на мышей (C57BL/6J) на ранних этапах постнатального онтогенеза (10 дней) приводило к повышению экспрессии глюкокортикоидного рецептора в паравентрикулярном ядре гипоталамуса, что, в свою очередь, вызывало рост уровня активности гипоталамо-гипофизарно-надпочечниковой системы [26], которая является ключевым регулятором стрессовой реакции. Авторы предполагают, что световые условия, которым мышь подвергается в течение первых трех постнатальных недель (критических), оказывают долгосрочное влияние на циркадные ритмы гипоталамо-гипофизарно-надпочечниковой системы [24, 26], так как у мышей, выращенных в DD режиме (до 21 дня, потом переместили в режим LD), наблюдались повышенная концентрация кортикостерона в плазме и высокий уровень тревожности на более поздних этапах онтогенеза. Схожие данные были получены на взрослых крысах – содержание животных в условиях DD приводило к росту уровня кортикостерона в крови [3]. Длительное воздействие глюкокортикоидов вызывает различные метаболические нарушения обмена веществ [27]. Так, например, острые психогенные или системные стрессоры приводят к быстрому снижению потребления пищи и последующему истощению запасов питательных веществ у крыс [28, 29]. При этом животные теряют массу тела за счет использования питательных веществ не из жировой ткани, а из других органов [29]. Метаболически у этих крыс нарушена регуляция обмена углеводов, что является ранним признаком резистентности к инсулину [27]. Возможно, именно поэтому в нашем исследовании мы обнаружили различия между группами LD/DD и DD/DD по массе тела и потреблению корма (рис. 1, табл. 1).
Таким образом, содержание крыс в условиях световой депривации как в период эмбрионального развития, так и с момента рождения приводило к изменению изученных показателей. У крыс в LD/DD режиме отмечены более низкие значения массы тела (возраст 3, 18 мес), потребления корма и воды (12 мес), активности амилазы и липазы (18 мес) и более высокая активность протеаз после окончания стадии стабильного роста (12, 18 и 24 мес) по сравнению с контрольными животными. В DD/DD условиях у животных выявлены минимальные значения потребления корма и воды и увеличенная масса тела в возрасте 12 и 18 мес, а также максимальная активность амилазы (1 и 6 мес) и более высокая общая протеолитическая активность в период стабильного роста (6 и 12 мес) по сравнению с LD. Полученные результаты свидетельствуют о значительных метаболических перестройках у животных в условиях световой депривации и дополняют имеющиеся сведения о том, что нарушение циркадного ритма секреции мелатонина в период беременности и в раннем постнатальном онтогенезе может привести к негативным последствиям и проявиться на более поздних сроках развития [9, 10].
Список литературы
González MMC (2018) Dim Light at Night and Constant Darkness: Two Frequently Used Lighting Conditions That Jeopardize the Health and Well-being of Laboratory Rodents. Front Neurol 9: 609. https://doi.org/10.3389/fneur.2018.00609
Sergina S, Ilyukha V, Uzenbaeva L, Khizhkin E, Anto-nova E (2016) Morphologic changes in the pineal gland of rats exposed to continuous darkness. Biol Rhythm Res 47 (5): 691–701. https://doi.org/10.1080/09291016.2016.1183842
Tapia-Osorio A, Salgado-Delgado R, Angeles-Castellanos M, Escobar C (2013) Disruption of circadian rhythms due to chronic constant light leads to depressive and anxiety-like behaviors in the rat. Behav Brain Res 252: 1–9. https://doi.org/10.1016/j.bbr.2013.05.028
Reiter RJ, Tan DX, Korkmaz A, Rosales-Corral SA (2014) Melatonin and stable circadian rhythms optimize maternal, placental and fetal physiology. Hum Reprod Update 20: 293–307. https://doi.org/10.1093/humupd/dmt054
Borjigin J, Zhang LS, Calinescu AA (2012) Circadian regulation of pineal gland rhythmicity. Mol Cell Endocrinol 349 (1): 13–19. https://doi.org/10.1016/j.mce.2011.07.009
Wurtman RJ, Axelrod J, Fischer JE (1964) Melatonin Synthesis in the Pineal Gland: Effect of Light Mediated by the Sympathetic Nervous System. Science 143 (3612): 1328–1329. https://doi.org/10.1126/science.143.3612.1328
Анисимов ВН, Виноградова ИА, Букалев АВ, Попович ИГ, Забежинский МА, Панченко АВ, Тындык МЛ, Юрова МН (2014) Световой десинхроноз и риск злокачественных новообразований у лабораторных животных: состояние проблем. Вопр онкол 60 (2): 15–27. [Anisimov VN, Vinogradova IA, Bukalev AV, Popovich IG, Zabezhinskii MA, Panchenko AV, Tyndyk ML, Iurova MN (2014) Light-induced disruption of the circadian clock and risk of malignant tumors in laboratory animals: state of the problem. Vopr Onkol 60 (2): 15–27. (In Russ)].
Astiz M, Oster H (2021) Feto-Maternal Crosstalk in the Development of the Circadian Clock System. Front Neurosci 14: 631687. https://doi.org/10.3389/fnins.2020.631687
Mendez N, Halabi D, Salazar-Petres ER, Vergara K, Corvalan F, Richter HG, Bastidas C, Bascur P, Ehrenfeld P, Seron-Ferre M, Torres-Farfan C (2022) Maternal melatonin treatment rescues endocrine, inflammatory, and transcriptional deregulation in the adult rat female offspring from gestational chronodisruption. Front Neurosci 16: 1039977. https://doi.org/10.3389/fnins.2022.1039977
Torres-Farfan C, Mendez N, Ehrenfeld P, Seron-Ferre M (2020) In utero circadian changes; facing light pollution. Curr Opin Physiol 13: 128–134. https://doi.org/10.1016/j.cophys.2019.11.005
Tan DX, Xu B, Zhou X, Reiter RJ (2018) Pineal Calcification, Melatonin Production, Aging, Associated Health Consequences and Rejuvenation of the Pineal Gland. Molecules 23 (2): 301. https://doi.org/10.3390/molecules23020301
Cipolla-Neto J, Amaral FG, Afeche SC, Tan DX, Reiter RJ (2014) Melatonin, energy metabolism, and obesity: a review. J Pineal Res 56 (4): 371–381. https://doi.org/10.1111/jpi.12137
Antonova EP, Belkin VV, IlyukhaVA, Khizhkin EA, Kalinina SN (2022) Seasonal Changes in Body Mass and Activity of Digestive Enzymes in Eptesicus nilssonii (Mammalia: Chiroptera: Vespertilionidae) during hibernation. J Evol Biochem Phys 58: 1055–1064. https://doi.org/10.1134/S002209302204010X
Никитина АА, Филаретова ЛП, Егорова ВВ, Тимофеева НМ (1994) Активность пищеварительных ферментов в пищеварительных и непищеварительных органах при стрессорных воздействиях. Физиол журнал им ИМ Сеченова 5: 67–74. [Nikitina AA, Filaretova LP, Egorova VV, Timofeeva NM (1994) Activity of digestive enzymes in the digestive and non-digestive organs under stress effects. Russ J Physiol 5: 67–74. (In Russ)].
Toyoda A, Iio W, Matsukawa N, Tsukahara T (2015) Influence of Chronic Social Defeat Stress on Digestive System Functioning in Rats. J Nutr Sci Vitaminol (Tokyo) 61 (3): 280–284. https://doi.org/10.3177/jnsv.61.280
Громова ЛВ, Савочкина ЕВ, Алексеева АС, Дмитриева ЮВ, Груздков АА (2020) Мембранный гидролиз углеводов и всасывания глюкозы в тонкой кишке крыс при хроническом иммобилизационном стрессе. Рос физиол журн им ИМ Сеченова 106 (11): 1421–1435. [Gromova LV, Savochkina EV, Aleksseva AS, Dmitrieva YV, Gruzdkov AA (2020) Membrane hydrolysis of carbohydrates and glucose absorption in the rat small intestine under chronic immobilization stress. Russ J Physiol 106 (11): 1421–1435. (In Russ)]. https://doi.org/10.31857/S0869813920100040
Kang XZ, Jia LN, Zhang X, Li YM, Chen Y, Shen XY, Wu YC (2016) Long-Term Continuous Light Exposure Affects Body Weight and Blood Glucose Associated with Inflammation in Female Rats. J Biosci Med 4: 11–24. https://doi.org/10.4236/jbm.2016.49002
Morris CJ, Yang JN, Garcia JI, Myers S, Bozzi I, Wang W, Buxton OM, Shea SA, Scheer FA (2015) Endogenous circadian system and circadian misalignment impact glucose tolerance via separate mechanisms in humans. Proc Natl Acad Sci U S A 112 (17): E2225–2234. https://doi.org/10.1073/pnas.1418955112
Hussain MM, Pan X (2015) Circadian regulators of intestinal lipid absorption. J Lipid Res 56 (4): 761–770. https://doi.org/10.1194/jlr.R051573
Li H, Zhang S, Zhang W, Chen S, Rabearivony A, Shi Y, Liu J, Corton CJ, Liu C (2020) Endogenous circadian time genes expressions in the liver of mice under constant darkness. BMC Genomics 21 (1): 224. https://doi.org/10.1186/s12864-020-6639-4
Jameie SB, Mousavi M, Farhadi M, Mehraein F, Ababzadeh Soleimani M, Kerdari M, Jalilpouraghdam M (2016) Effects of total light deprivation on hippocampal neurogenesis and memory of adult rats: a sexual dimorphic study. Thrita 5: e36420. https://doi.org/10.5812/thrita.36420
Cambras T, Lopez L, Arias JL, Diez-Noguera A (2005) Quantitative changes in neuronal and glial cells in the suprachiasmatic nucleus as a function of the lighting conditions during weaning. Brain Res Dev Brain Res 157: 27–33. https://doi.org/10.1016/j.devbrainres.2005.02.014
Bedont JL, Blackshaw S (2015) Constructing the suprachiasmatic nucleus: a watchmaker’s perspective on the central clockworks. Front Syst Neurosci 9: 74. https://doi.org/10.3389/fnsys.2015.00074
Coleman G, Gigg J, Canal MM (2016) Postnatal light alters hypothalamic-pituitary-adrenal axis function and induces a depressive-like phenotype in adult mice. Eur J Neurosci 44 (10): 2807–2817. https://doi.org/10.1111/ejn.13388
Хижкин ЕА, Гулявина АВ, Илюха ВА, Виноградова ИА, Морозов АВ, Брулер ЕС (2018) Возрастные изменения поведения и тревожно-фобических реакций крыс при воздействии световой депривации и лузиндола. Труды Карельск научн центра РАН. 12: 110–124. [Hizhkin EA, Gulyavina AV, Ilyukha VA, Vinogradova IA, Morozov AV, Bruler ES (2018) Аge-related changes in the behavior and phobic anxiety reactions in rats under exposure to light deprivation and luzindole. Transact. KarRC RAS 12: 110–124. (In Russ)]. https://doi.org/10.17076/eb932
Coleman G, Canal MM (2017) Postnatal light effects on pup stress axis development are independent of maternal behavior. Front Neurosci 11: 46. https://doi.org/10.3389/fnins.2017.00046
Patterson ZR, Abizaid A (2013) Stress induced obesity: lessons from rodent models of stress. Front Neurosci 7: 130. https://doi.org/10.3389/fnins.2013.00130
Black PH (2006) The inflammatory consequences of psychologic stress: relationship to insulin resistance, obesity, atherosclerosis and diabetes mellitus, type II. Med Hypotheses 67: 879–891. https://doi.org/10.1016/j.mehy.2006.04.008
Depke M, Fusch G, Domanska G, Geffers R, Volker U, Schuett C, Kiank C (2008) Hypermetabolic syndrome as a consequence of repeated psychological stress in mice. Endocrinology 149: 2714–2723. https://doi.org/10.1210/en.2008-0038
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


