Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 3, стр. 168-177
Влияние холодового шока на размеры и активность ядерных эритроцитов Scorpaena porcus (linnaeus, 1758) (эксперименты in vitro)
Н. Е. Шалагина 1, *, А. А. Солдатов 1, Ю. В. Богданович 1
1 Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр
“Институт биологии южных морей имени А.О. Ковалевского РАН”
Севастополь, Россия
* E-mail: nadezda-shalagina@yandex.ru
Поступила в редакцию 10.02.2023
После доработки 23.03.2023
Принята к публикации 26.03.2023
- EDN: YHVVCU
- DOI: 10.31857/S0044452923030087
Аннотация
В условиях эксперимента in vitro исследовали влияние холодового шока на эритроциты морского ерша (Scorpaena porcus L., 1758). Образцы крови содержали при 22°С (контроль) и 4°С (опыт) (градиент 18°С). Экспозиция составляла 3 ч. Холодовой шок не оказывал значимого влияния на показатели жизнедеятельности эритроцитов морского ерша. Клетки сохраняли целостность цитоплазматических мембран, потенциал митохондрий и уровень окислительных процессов, о чем свидетельствовали постоянные значения интенсивности флуоресценции пропидиум йодида (PI), родамина123 (R123) и 2-7-дихлорфлуоресцеин-диацетата (DCF-DA). Основные изменения были связаны с формой эритроцита и функциональной активностью ядра. Клетки приобретали округлые очертания, размеры ядра увеличивались, что привело к росту ядерно-цитоплазматического отношения (NCR) на фоне снижения интенсивности флуоресценции SYBR Green I. Допускается, что это связано с изменением состояния цитоскелета и активизацией транскрипционных процессов.
ВВЕДЕНИЕ
Влиянию холодового шока на организм низших позвоночных (рыбы, амфибии) за последние 10–15 лет посвящено значительное число работ. Свидетельством тому является появление двух крупных обзоров [1, 2]. Данный фактор ранее рассматривался исключительно как стрессорный. У многих организмов отмечали повышение концентрации в крови кортизола [3–6], который является молекулярным маркером стресса. Однако, как показали дальнейшие наблюдения, это затрагивало не всех пойкилотермов, особенно тех, которые обитали в водоемах (акваториях) с неустойчивым температурным режимом и подвергались периодическому действию гипотермии (мелководные водоемы, лагуны, прибрежный апвеллинг). Состояние холодового стресса для них не было характерно, несмотря на значительные температурные градиенты (10–15°С) [7, 8]. При этом в организме развивался комплекс процессов, направленных на компенсацию действия данного фактора. Мозг переходил на утилизацию лактата как питательного субстрата, в нем существенно повышалась активность лактатдегидрогеназы (LDH1) и цитратсинтазы [9]. В плазме крови отмечали снижение концентрации глюкозы [10] на фоне роста уровня триацилглицеридов [4], что не характерно для состояния стресса. При этом осмолярность плазмы понижалась [11]. В скелетных мышцах усиливались процессы анаэробного гликолиза [12]. Количество эритроцитов и лейкоцитов в циркулирующей крови в большинстве случаев сохранялось на уровне прежних значений [7, 13].
Особо интересны были изменения, затрагивающие клеточные системы. Изменялась активность АТФаз, лактатдегидрогеназы, супероксидредуктазы, каталазы [14–16]. При этом реакция на холодовой шок была тканеспецифична. Общим для всех тканей было увеличение содержания белков теплового (HSP) и холодового шока (CSP) [17, 18]. При этом авторами отмечалась роль HSP как молекулярных шаперонов, участвующих в сворачивании, репарации и расщеплении белков, поврежденных стрессорами и контроле уровня АФК в клетке [19].
Как видно, представленная информация не позволяет составить цельного представления о реакции клеточных систем пойкилотермов на условия холодового шока, так как она получена для целого организма. Управляющие гуморальные сигналы, координирующие работу органов и тканей, делают эту реакцию дифференцированной (тканеспецифичной), о чем говорилось выше. В этом отношении могут быть интересны относительно автономные клеточные системы, которые на определенном отрезке клеточного цикла перестают быть зависимы от действия гуморальных факторов. К ним можно отнести зрелые эритроциты костистых рыб. Процесс созревания и дифференцировки эритроидных клеток у данной группы организмов происходит в головной почке в течение 2–3 мес после нереста и находится под контролем эритропоэтинов [20]. Затем они поступают в кровоток, где находятся до следующего нерестового периода. Продолжительность жизни этих клеток составляет 270–310 сут [21, 22]. Этот тип клеток используется как модель в ряде экспериментальных работ [23]. Они обладают развитыми системами переноса органических и неорганических ионов через клеточную мембрану, что позволяет осуществлять адаптивную регуляцию объема клетки [24]. У них обнаружены митохондрии, ферменты цикла Кребса [23, 25], что делает их функционально ближе к клеткам соматических тканей. Исследования по изучению влияния гипоксии на эритроциты морского ерша, проведенные в условиях in vivo и in vitro, дали близкие результаты, что свидетельствует об относительной автономности данных клеточных систем [26, 27].
В качестве объекта исследования нами выбран морской ерш Scorpaena porcus (Linnaeus, 1758). Это эврибионтный донный вид, широко представленный по побережью Черного и Азовского морей [28]. Его популяции часто подвергаются действию прибрежного апвеллинга, который у берегов Крыма может наблюдаться 2–3 раза за сезон. Перепад температур при этом составляет 10–12°С. Для мелководных прибрежных акваторий (глубина 5–7 м) скачок температур еще более выражен – 18–19°С [29].
Цель работы – в условиях эксперимента in vitro исследовать влияние холодового шока на морфофункциональные показатели эритроцитов морского ерша.
МЕТОДЫ ИССЛЕДОВАНИЯ
Материал
Объектом исследования являлись образцы цельной крови взрослых особей морского ерша (Scorpaena porcus L., 1758) (длина тела 12–14 см, вес 90–114 г) в состоянии относительного функционального покоя (стадия зрелости гонад II–III).
Рыбу отлавливали ставным неводом в Мартыновой бухте (р-н Севастополя, Крым). Транспортировка осуществлялась в баках емкостью 50 л с применением воздушной аэрации на протяжении всего времени перевозки. Особи проходили акклимацию к лабораторным условиям в течение 7 дней в аквариуме, имеющем систему естественного протока. Плотность посадки – не менее 10 л на особь. Режим освещения – искусственный (12 ч день: 12 ч ночь). На протяжении периода акклимации особей кормили фаршем из малоценных рыб. Суточный пищевой рацион составлял 6–7% от массы тела. В экспериментах использовали подвижных активно питающихся рыб. Температура воды поддерживалась на уровне 20–22°С. Концентрация кислорода в воде не понижалась ниже 7.0 мг/л. Контроль за температурой и концентрацией кислорода осуществляли при помощи кислородомера ST300DRU (“Ohaus” США).
Экспериментальная схема
Перед отловом и отбором образцов крови применяли уретановую анестезию. Уретан растворяли в воде аквариума до финальных концентраций, которые были определены для морского ерша ранее [30].
Образцы крови в количестве 0.5–0.7 мл получали пункцией хвостовой артерии. В качестве антикоагулянта применяли гепарин (Рихтер, Венгрия). Полученные образцы делили на две равные доли, которые подвергали экспериментальной нагрузке. Одну содержали при исходных условиях – 22°С (контроль), другую – в холодильнике при 4°С (опыт). Экспозиция – 3 ч.
Лабораторная обработка проб
После инкубации изготавливали мазки крови, которые окрашивали по комбинированному методу Паппенгейма:Май-Грюнвальд (краситель-фиксатор на метиловом спирте) + Романовский-Гимза [31]. Их использовали для оценки морфометрических характеристик клеток красной крови.
Часть эритроцитарной массы трижды отмывали от плазмы с применением центрифугирования при 500 g в течение 5 мин: контроль при 20–22°С, опыт – 4–5°С. В работе применяли рефрижераторную центрифугу Eppendorf Centrifuge 5424 R. Клетки ресуспензировали в среде следующего состава: 128 mM NaCl, 3 mМ KC1, 1.5 mМ CaCl2, 1.5 mМ MgCl2, 15 mМ Тris, 2.2 mМ D-glucose (рН 7.8) [32]. Полученные образцы использовали для проведения цитометрических исследований.
Определение морфометрических показателей
Мазки крови просматривали и фотографировали при помощи светооптического микроскопа Biomed PR-2 Lum, оборудованном камерой Levenhuk CNG Series. Линейные размеры клеток крови определяли по фотографиям в компьютерной программе ImageJ 1.44p [33]. При проведении морфометрического анализа зрелых эритроцитов для каждой клетки определялось 4 линейных размера (длина большой и малой оси клетки, С1 и С2; длина большой и малой оси ядра, N1 и N2). На каждом препарате измерения выполнялись на 100 зрелых эритроцитах. Незрелые формы в расчет не принимались.
На основании полученных значений рассчитывали ряд морфофункциональных характеристик клеток красной крови. Показатель формы клетки (CSI) определяли по формуле (1):
Объем клетки (Vc) с учетом объема ядра (Vn) определяли по формуле (2) [34], объем ядра определяли по формуле (3) [35] и толщину клетки (h) по формуле (3) [36]:
Одновременно рассчитывали площадь поверхности клетки (Sc) по формуле (5) [35] и ее ядра (Sn) по формуле (6) [34]:
где
(6)
$\begin{gathered} a = \frac{{{{C}_{1}} + {{C}_{2}}}}{4},\quad b = 0.67h,\quad e = \frac{{\sqrt {{{a}^{2}} - {{b}^{2}}} }}{a}, \\ {{S}_{n}}\, = \,4\pi {{\left( {\frac{{2{{{({{N}_{1}}{\text{/}}2)}}^{{1.6075}}}{\kern 1pt} {{{({{N}_{2}}{\text{/}}2)}}^{{1.6075}}}\, + \,{{{({{N}_{2}}{\text{/}}2)}}^{{2 \times 1.6075}}}}}{3}} \right)}^{{1/1.6075}}}. \\ \end{gathered} $На основании полученных значений Vc и Vn определяли величину ядерно-цитоплазматического отношения (NCR) по формуле (7):
и рассчитывали удельную поверхность эритроцитов (SSc) и их ядер (SSn) по формулам (8) и (9):
Проточная цитометрия
Все измерения цитометрических показателей эритроцитов проводились на проточном цитометре Cytomics FC500 (Beckman Coulter, USA), оборудованном однофазным аргоновым лазером (длина волны 488 нм). Пробоподготовка проводилась в соответствии с лабораторным регламентом. Окраска проб предполагает одновременную фиксацию состояния клеток.
Для оценки однородности клеточной массы готовую суспензию эритроцитов окрашивали ДНК-красителем SYBR Green I (Sigma Aldrich, США): финальная концентрация в пробе 10 мкл/л, время инкубации составляло 40 мин в темноте. Флуоресценцию красителя анализировали на канале FL1 (экстинкция – 497 нм, эмиссия – 521 нм). Характер распределения клеток во взвеси классифицировали на основании их относительного размера: по величине прямого рассеяния FSC и бокового рассеяния SSC.
Способность эритроцитов к спонтанной продукции активных форм кислорода оценивали по флуоресценции красителя 2-7-дихлорфлуоресцеин-диацетата (DCF-DA, Sigma Aldrich, USA). Для этого 1 мл суспензии эритроцитов инкубировали с 10 мкл раствора DCF-DA в течение 40 мин в темноте. Финальная концентрация красителя в пробе составляла 10 мкл/л. Флуоресценцию красителя анализировали на канале FL1 (экстинкция – 485 нм, эмиссия – 525 нм).
Изменения мембранного потенциала митохондрий (МПМ) в эритроцитах контролировали, оценивая интенсивность флуоресценции клеток, окрашенных R123 (Molecular Probes, USA). Эритроциты окрашивали R123 в течение 40 мин. Концентрация красителя в пробе составляла 10 мкл/л. Интенсивность флуоресценции красителя определяли на канале FL1 (экстинкция – 508 нм, эмиссия – 528 нм).
Долю поврежденных эритроцитов в суспензии при гипотермии анализировали, используя краситель PI (Molecular Probes, USA). Окрашивание суспензии эритроцитов проводили в течение 30 мин. Конечная концентрация красителя – 10 мкл/л. Измерение интенсивности флуоресценции PI осуществляли в канале FL2 (экстинкция – 535 нм, эмиссия – 617 нм).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
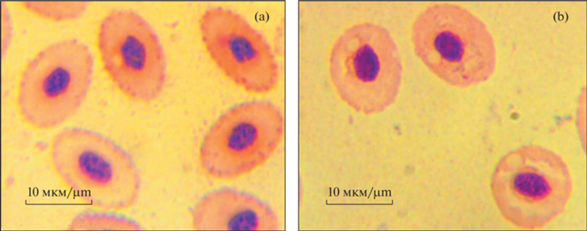
Эритроциты морского ерша имеют эллипсоидную форму (рис. 1a). Цитоплазма ацидофильная, что определяется высоким содержанием гемоглобина. Ядро компактное, расположено у большинства эритроидных форм в центре клетки и также имеет форму эллипса. Хроматин в значительной степени конденсирован (гетерохроматин), что отражает низкую функциональную активность данной структуры. В условиях холодового шока клетки явно приобретали более округлую форму (рис. 1b). Визуально отмечали и рост размеров ядра. Это нашло отражение в изменении морфометрических параметров клеток красной крови.
Рис. 1.
Эритроциты циркулирующей крови морского ерша. (а) – контрольная группа (22°С), (b) – опытная группа (4°С); в условиях гипотермии клетки становились более округлыми; явно увеличивались значения С2 и уменьшались значения С1.
Морфометрические характеристики
Средняя длина большой оси эритроцитов (С1) у образцов крови, находящихся при 22°С, составила 14.01 ± 0.17 мкм, малой оси (С2) – 8.97 ± 0.13 мкм (рис. 2).
Рис. 2.
Морфометрические характеристики эритроцитов циркулирующей крови морского ерша. 1 – контрольная группа (22°С), 2 – опытная группа (4°С); (a) – размер большой оси клетки, С1; (b) – размер малой оси клетки, С2; (с) – показатель формы клетки, CSI; (d) – площадь поверхности клетки, Sc; (e) – объем клетки, Vc; (f) – удельная поверхность клетки, SSc. M ± m. *Отличия от контроля достоверны при p < 0.01. Критерий Манна–Уитни (n = 12).
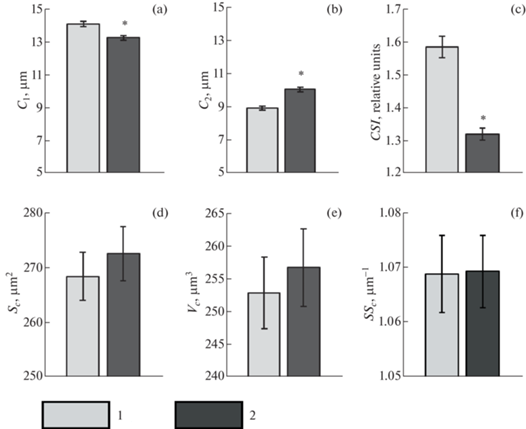
Инкубация при 4°С приводит к уменьшению С1 на 5.9% (p < 0.01), и увеличению С2 на 11.1% (p < < 0.01). Показатель формы клетки (CSI) уменьшался почти на 17% (p < 0.01), т.е. эритроциты приобретали более округлую форму, что хорошо согласовывалось с результатами визуального наблюдения. При этом объем клеток (Vc) и их поверхностные характеристики (Sc, SSc) не претерпевали статистически значимых изменений (p > 0.05).
Ядро эритроцитов, как уже отмечалось, имело эллипсоидную форму. Содержание гетерохроматина явно превалировало над уровнем эухроматина. Анализ метрических характеристик ядер у образцов, содержащихся при 22°С, дал следующие результаты: длина большой оси ядра (N1) составила 5.10 ± 0.06 мкм, малой оси ядра (N2) – 3.26 ± 0.05 мкм (рис. 3).
Рис. 3.
Морфометрические характеристики ядер эритроцитов морского ерша. 1 – контрольная группа (22°С), 2 – опытная группа (4°С); (a) – размер большой оси ядра, N1; (b) – размер малой оси ядра, N2; (с) – площадь поверхности ядра, Sn; (d) – объем ядра, Vn; (e) – удельная поверхность ядра, SSn; (f) – ядерно-цитоплазматическое отношение, NCR. M ± m. *Отличия от контроля достоверны при p < 0.01. Критерий Манна–Уитни (n = 12).
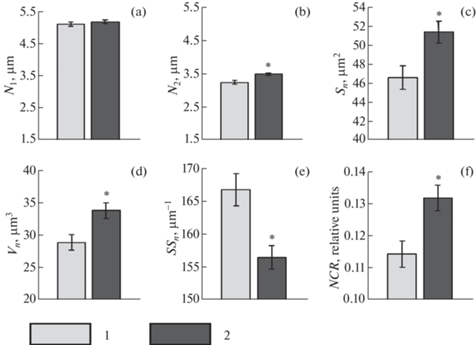
Инкубация проб крови при 4°С приводила к изменению значений N2. Они увеличивались на 7.6% (p < 0.01). Рост N1 не был статистически выражен (p > 0.05). Это происходило на фоне значимого роста объема (Vn) и площади поверхности (Sn) ядер клеток соответственно на 16.8% и 10.2% (p < 0.01). Закономерные изменения претерпевала и удельная поверхность данной структуры (SSn).
В целом можно констатировать опережающий рост объема ядер эритроцитов при 4°С по отношению к их клеточному объему. Величина ядерно-цитоплазматического отношения (NCR) увеличивалась на 15.2% (p < 0.01) (рис. 3).
Проточная цитометрия
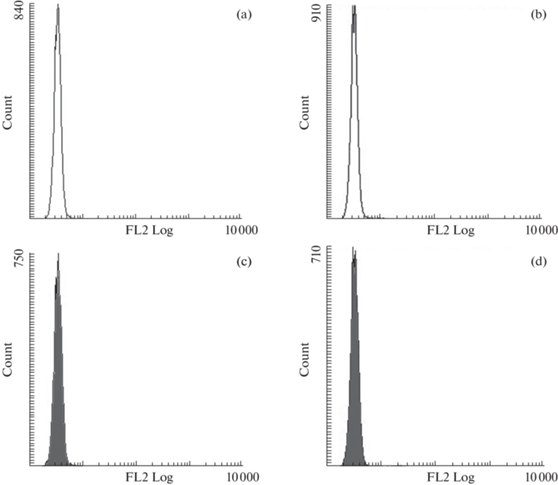
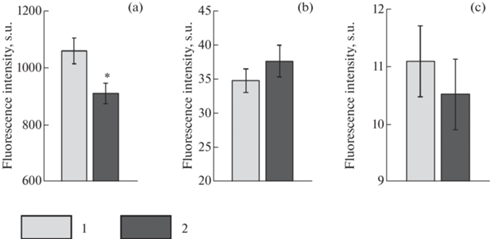
Сравнение состояния эритроцитов, находящихся в образцах крови при 22°С и 4°С, показало однозначное снижение интенсивности флуоресценции SYBR Green I. Различия составили 14% (p < 0.01) (рис. 4a). Эритроцитарная масса сохраняла однородность, что видно из характера распределения клеток по величинам прямого (FSC) и бокового рассеивания (SSC). Принципиальных отличий в интенсивности флуоресценции R123 и DCF-DA между образцами крови (при 22°С и 4°С) не отмечали (рис. 4b, с) (p > 0.05). То же можно сказать и в отношении PI (рис. 5).
Рис. 4.
Данные проточной цитометрии для эритроцитарных взвесей морского ерша. 1 – контрольная группа (22°С), 2 – опытная группа (4°С); (a) – интенсивность флуоресценции SYBR Green I; (b) – интенсивность флуоресценции R123; (с) – интенсивность флуоресценции DCF-DA. M ± m. *Отличия от контроля достоверны при p < 0.01. Критерий Манна–Уитни (n = 12).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Из представленных результатов исследования влияния холодового шока на ядерные эритроциты морского ерша следует обратить внимание на следующие моменты:
• в условиях холодового шока клетки красной крови приобретали округлую форму без значимых изменений их объема и площади поверхности;
• гипотермия сопровождалась существенным увеличением объема клеточных ядер, ростом NCR на фоне понижения интенсивности флуоресценции SYBR Green I;
• холодовой шок не оказывал значимого влияния на интенсивность флуоресценции R123, DCF-DA и PI эритроцитов.
При действии гипотермии при условии медленного охлаждения до 0°С в большинстве клеточных систем развиваются необратимые изменения. Они, прежде всего, затрагивают структуру цитоплазматических мембран. Отмечаются рост их вязкости и снижение текучести, следствием чего является уменьшение проницаемости в основном в отношении ионов [1], подавляется активность Na+/K+-АТФазы, растет концентрация Na+ в клетке, развивается внутриклеточный ацидоз. Клетка набухает (свеллинг), что часто приводит к ее лизису.
В нашем случае это не происходило. Рост объема эритроцита был незначителен и статистически не выражен, признаки нарушения целостности клеточных мембран отсутствовали. Об этом свидетельствовали близкие значения уровня флуоресценции PI при 22 и 4°С. Известно, что виды, толерантные к условиям экстремально низких температур, не допускают значительных изменений вязкости липидного бислоя. Более того вязкость в условиях гипотермии у них понижается. Это было показано в отношении Fundulus heteroclitus (L., 1766) [37]. Холодовая акклимация повышала содержание ненасыщенных жирных кислот (С18:1) и уменьшала уровень насыщенных (С18:0) в мембранных структурах гепатоцитов данного вида.
Причину же изменения формы клеток красной крови у морского ерша в условиях низкотемпературного шока, по-видимому, нужно искать в особенностях организации цитоскелета его эритроцитов. Известно, что образование эллипсоидной формы у эритроцитов рыб происходит на стадии полихроматофильного нормобласта в момент повышения содержания в клетке гемоглобина [38]. При этом обнаружена прямая связь между содержанием гемоглобина и уровнем спектрина в клетке (r > 0.5) [39]. Спектрин относится к группе интегральных мембранных белков и составляет основу цитоскелета эритроцита (полоса 1 и 2 по Фейрбанксу) [40], а гемоглобин является одним из основных белков примембранного слоя, стабилизирующего конфигурацию клетки [41]. Существует также положительная связь между содержанием гемоглобина и уровнем тропомиозина (полоса 7 по Фейрбанксу) (r около 0.6) [39]. Последний организует структуру полимерного актина, что обеспечивает его взаимодействие со спектрином цитоплазматической мембраны [42]. Из выше перечисленного следует, что гемоглобин является важным элементом цитоскелета эритроцита. Известно, что в условиях экстремальной гипотермии должен происходить чрезмерный рост сродства гемоглобина к кислороду [43]. Это приводит к изменению конформации белка и сопровождается высвобождением боровских протонов. Связь гемоглобина со спектрином должна нарушаться, что однозначно должно сказываться и на состоянии цитоскелета. В результате клетка приобретает округлую форму, свойственную эритроидным элементам более ранних генераций.
Снижение флуоресценции SYBR Green I, показанное в настоящей работе, может определяться следующими процессами. Известно, что данный флуорохром проявляет максимальное свечение при взаимодействии с двухцепочной молекулой ДНК [44]. Он может также взаимодействовать с одноцепочной ДНК и РНК. В этом случае интенсивность флуоресценции падает [44]. Рост содержания РНК в ядре может отражать усиление процессов транскрипции в данной структуре.
Об усилении транскрипционных процессов в клеточных системах в условиях холодового шока свидетельствует сравнительно большое количество работ. У многих видов костистых рыб зарегистрирован рост экспрессии и содержания белков теплового шока (HSP), преимущественно HSP70 и HSP90 [18, 45, 46]. Для ряда видов показана активная экспрессия и повышение содержания в клетках белков холодового шока (СSP) [17], уровня микроРНК [47] и ряда специфических белков, связанных с процессами энергетического обмена [48]. В экспериментах, выполненных на Cyprinus carpio (L., 1758) показано, что в условиях гипотермии изменяется структура ядрышек и происходит репрессия рибосомных генов [49]. Это наблюдается на фоне экспрессии macroH2A и усиления процессов метилирования ДНК. Считается, что это подавляет процесс транскрипции в целом и препятствует реорганизации структуры хроматина в условиях холодового шока.
Вместе с тем в ряде работ показано, что холодовой шок у рыб может индуцировать повреждение ДНК [50]. Теоретически это может приводить к образованию однонитевых разрывов и понижению интенсивности флуоресценции SYBR Green I. Однако допустить, что этот процесс имеет место в отношении эвритермного морского ерша, сложно. Этот вид часто сталкивается со случаями апвеллинга, при которых перепад температур превышает 10°С. Доказательством тому также являются данные по флуоресценции R123, DCF-DA и PI, представленные в настоящей работе. Значения этих показателей не претерпевали статистически значимых изменений. Это означает, что в клетках сохранялся мембранный потенциал митохондрий, поддерживалась целостность цитоплазматических мембран и отсутствовало усиление окислительных процессов.
ЗАКЛЮЧЕНИЕ
Из представленной информации следует, что холодовой шок (22°С → 4°С) не оказывал значимого влияния на показатели жизнедеятельности эритроцитов морского ерша. Клетки сохраняли целостность цитоплазматических мембран, потенциал митохондрий и уровень окислительных процессов, о чем свидетельствовали постоянные значения интенсивности флуоресценции PI, R123 и DCF-DA. Основные изменения были связаны с формой эритроцита и функциональной активностью ядра. Клетки приобретали округлые очертания, размеры ядра увеличивались на фоне роста значений NCR и снижения интенсивности флуоресценции SYBR Green I.
Список литературы
Donaldson MR, Cooke SJ, Patterson DA, Macdonald JS (2008) Cold shock and fish. J Fish Biol 73: 1491–1530. https://doi.org/10.1111/j.1095-8649.2008.02061.x
Reid CH, Patrick PH, Rytwinski T, Taylor JJ, Willmor WG, Reesor B, Cooke SJ (2022) An updated review of cold shock and cold stress in fish. J Fish Biol 100: 1102–1137. https://doi.org/10.1111/jfb.15037
Koakoski G, Oliveira TA, da Rosa JGS, Fagundes M, Kreutz LC, Barcellos LJG (2012) Divergent time course of cortisol response to stress in fish of different ages. Physiol Behav 106 (2): 129–132. https://doi.org/10.1016/j.physbeh.2012.01.013
He J, Qiang J, Yang H, Xu P, Zhu ZX, Yang RQ (2015) Changes in the fatty acid composition and regulation of antioxidant enzymes and physiology of juvenile genetically improved farmed tilapia Oreochromis niloticus (L.), subjected to short-term low temperature stress. J Thermal Biol 53:90–97. https://doi.org/10.1016/j.jtherbio.2015.08.010
Bai Y, Liu H, Huang B, Wagle M, Guo S (2016) Identification of environmental stressors and validation of light preference as a measure of anxiety in larval zebrafish. BMC Neurosci 17 (1): 1–12. https://doi.org/10.1186/s12868-016-0298-z
Mattioli CC, Takata R, de Oliveira Paes Leme F, Costa DC, Luz RK (2020) Response of juvenile Lophiosilurus alexandri to osmotic and thermic shock. Fish Physiol Biochem 46 (1): 51–61. https://doi.org/10.1007/s10695-019-00696-5
Inoue LAKA, Moraes G, Iwama GK, Afonso LOB (2008) Physiological stress responses in the warm-water fish matrinxã (Brycon amazonicus) subjected to a sudden cold shock. Acta Amazonica 38: 603–609. https://doi.org/10.1590/S0044-59672008000400002
Adloo MN, Soltanian S, Hafeziyeh M, Ghadimi N (2015) Cortisol and glucose responses in juvenile striped catfish subjected to a cold shock. Veterinary Sci Devel 5 (2): 78–81.
Tseng YC, Liu ST, Hu MY, Chen RD, Lee JR, Hwang PP (2014) Brain functioning under acute hypothermic stress supported by dynamic monocarboxylate utilization and transport in ectothermic fish. Front Zool 11 (1): 1–20.
Choi CY, Kim TH, Choi YJ, Choi JY, Oh SY, Kim BS (2017) Effects of various wavelengths of light on physiological stress and non-specific immune responses in black rockfish Sebastes schlegelii subjected to water temperature change. Fish Sci 83 (6): 997–1006. https://doi.org/10.1007/s12562-017-1136-7
Giacomin M, Eom J, Schulte PM, Wood CM (2019) Acute temperature effects on metabolic rate, ventilation, diffusive water exchange, osmoregulation, and acid–base status in the Pacific hagfish (Eptatretus stoutii). J Compar Physiol B 189 (1): 17–35. https://doi.org/10.1007/s00360-018-1191-0
Chang CH, Zhou XW, Wang YC, Lee TH (2020) Differential effects of hypothermal stress on lactate metabolism in fresh water-and seawater-acclimated milkfish, Chanos chanos. Compar Biochem Physiol Part A: Mol & Integr Physiol 248: 110744. https://doi.org/10.1016/j.cbpa.2020.110744
Bacchetta C, Ale A, Rossi AS, Karakachoff M, Cazenave J (2020) Effects of cold stress on juvenile Piaractus mesopotamicus and the mitigation by β-carotene. J Thermal Biol 88: 102497. https://doi.org/10.1016/j.jtherbio.2019.102497
Hwang GC, Watabe S, Hashimoto K (1990) Changes in carp myosin ATPase induced by temperature acclimation. J Comp Physiol B 160 (3): 233–239. https://doi.org/10.1007/bf00302588
Vanlandeghem MM, Wahl DH, Suski CD (2010) Physiological responses of largemouth bass to acute temperature and oxygen stressors. Fishe Managem Ecol 17 (5): 414–425. https://doi.org/10.1111/j.1365-2400.2010.00740.x
Jun Q, Hong Y, Hui W, Didlyn KM, Jie H, Pao X (2015) Physiological responses and HSP70 mRNA expression in GIFT tilapia juveniles, Oreochromis niloticus under short-term crowding. Aquacult Res 46 (2): 335–345. https://doi.org/10.1111/are.12189
Mihailovich M, Militti C, Gabaldo T, Gebauer F (2010) Eukaryotic cold shock domain proteins: Highly versatile regulators of gene expression. Bioessays 32: 109–118. https://doi.org/10.1002/bies.200900122
Sharma J, Singh SP, Chakrabarti R (2017) Effect of temperature on digestive physiology, immune-modulatory parameters, and expression level of Hsp and LDH genes in Catla catla (Hamilton, 1822). Aquaculture 479: 134–141. https://doi.org/10.1016/j.aquaculture.2017.05.031
Basu N, Todgham AE, Ackerman PA, Bibeau MR, Nakano K, Schulte PM, Iwama GK (2002) Heat shock protein genes and their functional significance in fish. Gene 295 (2): 173–183. https://doi.org/10.1016/S0378-1119(02)00687-X
Soldatov AA (2005) Peculiarities of organization and functioning of the fish red blood system. Journal of Evolutionary Biochemistry and Physiology 41(3):272–281.
Khrushchov NG, Lange MA, Zolotova TE, Bessonov AV (1993) Characteristics of erythroid sprout cells in mirror carp (perspectives of use in estimating the fish physiological-state). Izvestiya akademii nauk seriya biologicheskaya (1): 83–87.
Fischer U, Ototake M, Nakanishi T (1998) Life span of circulating blood cells in ginbuna crucian carp (Carassius auratus langsdorfii). Fish & Shellfish Immunology 8 (5): 339–349. https://doi.org/10.1006/fsim.1998.0144
Phillips MC, Moyes CD, Tufts BL (2000) The effects of cell ageing on metabolism in rainbow trout (Oncorhynchus mykiss) red blood cells. J Exp Biol 203 (6): 1039–1045. https://doi.org/10.1242/jeb.203.6.1039
Cossins AR, Gibson JS (1997) Volume-sensitive transport systems and volume homeostasis in vertebrate red blood cells. J Exp Biol 200 (2): 343–352. https://doi.org/10.1242/jeb.200.2.343
Boutilier RG, Ferguson RA (1989) Nucleated red cell function: metabolism and pH regulation. Canad J Zool 67 (12): 2986–2993. https://doi.org/10.1139/z89-421
Андреева АЮ, Солдатов АА (2012) Изменения объема ядерных эритроцитов скорпены в условиях внешней гипоксии (эксперименты in vitro). Доповіді Національної академії наук України (10): 149–153. [Andreeva AYu, Soldatov AA (2012) Changes in the volume of nuclear erythrocytes of scorpaena under conditions of external hypoxia (in vitro experiments). Dopovіdі Nacіonal’noї akademії nauk Ukraїni (10): 149–153. (In Russ)].
Soldatov AA, Kukhareva TA, Andreeva AY, Parfenova IA, Rychkova VN, Zin’kova DS (2017) The functional morphology of erythrocytes of the black scorpion fish Scorpaena porcus (Linnaeus, 1758) (Scorpaeniformes: Scorpaenidae) during hypoxia. Russ J Marine Biol 43 (5): 368–373. https://doi.org/10.1134/S1063074017050091
Световидов АН (1964) Рыбы Черного моря. М.: Наука. [Svetovidov AN (1964) Ruby Chernogo moray [Fish of the Black Sea] M.: Nauka. (In Russ)].
Silvestrova KP, Zatsepin AG, Myslenkov SA (2017) Coastal upwelling in the Gelendzhik area of the Black Sea: Effect of wind and dynamics. Oceanology 57 (4): 469–477. https://doi.org/10.1134/S0001437017040178
Soldatov AA (2005) Physiological aspects of effects of urethane anesthesia on the organism of marine fishes. Hydrobiological J 41 (1): 113–126. https://doi.org/10.1615/HydrobJ.v41.il.130
Золотницкая РП (1987) Методы гематологических исследований. Лабораторные методы исследования в клинике (справочник) М. Медицина 106–148. [Zolotnickaya RP (1987) Metody gematologicheskih issledovanij. Laboratornye metody issledovaniya v klinike (spravochnik) [Methods of hematological research. Laboratory research methods in the clinic (reference book)]. M. Medicina. 106–148. (In Russ)].
Tiihonen K, Nikinmaa M (1991) Substrate utilization by carp (Cyprinus carpio) erythrocytes. J Exp Biol 161: 509–551.
Girish V, Vijayalakshmi A (2004). Affordable image analysis using NIH Image/ImageJ. Indian J Cancer 41 (1): 47.
Houchin DN, Munn JI, Parnell BL (1958) A method for the measurement of red cell dimensions and calculation of mean corpuscular volume and surface area. Blood 13 (12): 1185–1191.
Ташкэ К (1980) Введение в количественную цито-гистологическую морфологию. Бухарест: изд-во АНСРР. [Tashke K (1980) Vvedenie v kolichestvennuyu cito-gistologicheskuyu morfologiyu [Introduction to quantitative cyto-histological morphology]. Buharest: izd-vo AN SRR. (In Russ)].
Чижевский АЛ (1959) Структурный анализ движущейся крови. АНСССР. [Chizhevskij AL (1959) Strukturnyj analiz dvizhushchejsya krovi [Structural analysis of moving blood]. AN SSSR. (In Russ)].
Buhariwalla HEC, Osmond EM, Barnes KR, Cozzi RRF, Robertson GN, Marshall WS (2012) Control of ion transport by mitochondrion-rich chloride cells of eurythermic teleost fish: cold shock vs. cold acclimation. Comp Biochem Physiol Part A: Mol Integrat Physiol 162 (3): 234–244. https://doi.org/10.1016/j.cbpa.2012.03.010
Kukhareva TA, Soldatov AA (2016) Functional morphology of blood erythroid cells in Neogobius melanostomus P. during cell differentiation. J Evol Biochem Physiol 52 (3): 261–266. https://doi.org/10.1134/S0022093016030091
Гончарова ЕИ, Пинаев ГП (1988) Белки цитоскелета эритроцитов. Цитология 30 (1): 5–18. [Goncharova EI, Pinaev GP (1988) Belki citoskeleta eritrocitov. Citologiya 30 (1): 5–18. (In Russ)].
Bogusławska D, Machnicka B, Hryniewicz-Jankowska A, Czogalla A (2014) Spectrin and phospholipids – the current picture of their fascinating interplay. Cell Mol Biol Let 19 (1): 158–179. https://doi.org/10.2478/s11658-014-0185-5
Wong P (2004) A hypothesis on the role of the electrical charge of haemoglobin in regulating the erythrocyte shape. Med Hypoth 62 (1): 124–129.
Vera C, Lao J, Hamelberg D, Sung LA (2005) Mapping the tropomyosin isoform 5 binding site on human erythrocyte tropomodulin: further insights into E-Tmod/TM5 interaction. Arch Biochem Biophys 444 (2): 130–138. https://doi.org/10.1016/j.abb.2005.10.002
Soldatov AA (2003) Effects of temperature, pH, and organic phosphates on fish hemoglobins. J Evol Biochem Physiol 39 (2): 159–168.
Jin X, Yue S, Wells KS, Singer VL (1994) Sybr Green (Tm)-1-a new fluorescent dye optimized for detection of picogram amounts of DNA in gels. Biophys J 66 (2): A159–A159.
Said AliK, Ferencz Á, Nemcsók J, Hermesz E (2010) Expressions of heat shock and metallothionein genes in the heart of common carp (Cyprinus carpio): effects of temperature shock and heavy metal exposure. Acta Biol Hungar 61 (1): 10–23. https://doi.org/10.1556/abiol.61.2010.1.2
Ji L, Jiang K, Liu M, Wang B, Han L, Zhang M, Wang L (2016) Low temperature stress on the hematological parameters and HSP gene expression in the turbot Scophthalmus maximus. Chinese J Oceanol Limnol 34 (3): 430–440. https://doi.org/10.1007/s00343-016-4367-z
Hung I, Hsiao YC, Sun HS, Chen TM, Lee SJ (2016) MicroRNAs regulate gene plasticity during cold shock in zebrafish larvae. BMC Genomics17 (1): 1–18. https://doi.org/10.1186/s12864-016-3239-4
Lu Y, Nie M, Wang L, Xiong Y, Wang F, Wang L, You F (2018) Energy response and modulation of AMPK pathway of the olive flounder Paralichthys olivaceus in low-temperature challenged. Aquaculture 484: 205–213. https://doi.org/10.1016/j.aquaculture.2017.11.031
Pinto R, Ivaldi C, Reyes M, Doyen C, Mietton F, Mongelard F, Bouvet P (2005) Seasonal environmental changes regulate the expression of the histone variant macroH2A in an eurythermal fish. FEBS Letters 579 (25): 5553–5558. https://doi.org/10.1016/j.febslet.2005.09.019
Cheng CH, Ye CX, Guo ZX, Wang AL (2017) Immune and physiological responses of pufferfish (Takifugu obscurus) under cold stress. Fish Shellfish Immunol 64: 137–145. https://doi.org/10.1016/j.fsi.2017.03.003
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии