Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 3, стр. 145-167
Консерватизм и вариабельность системы антиоксидантной защиты ретинального пигментного эпителия позвоночных
Ю. В. Маркитантова 1, *, В. Н. Симирский 1, **
1 Институт биологии развития им. Н.К. Кольцова РАН
Москва, Россия
* E-mail: yuliya.mark@gmail.com
** E-mail: simir@mail.ru
Поступила в редакцию 08.11.2022
После доработки 05.03.2023
Принята к публикации 17.03.2023
- EDN: YHGTNX
- DOI: 10.31857/S0044452923030051
Аннотация
В ходе эволюции организмы разработали стратегии, позволяющие использовать активные формы кислорода (АФК) в регуляции физиологических процессов и поддержании гомеостаза. Клетки тканей с высоким уровнем метаболизма и внутриклеточных АФК, одним из ярких примеров которых является ретинальный пигментный эпителий (РПЭ), более подвержены риску повреждения под действием окислительного стресса (ОС), под влиянием экзогенных или эндогенных факторов. Клетки РПЭ позвоночных, несмотря на консервативность строения глаза и основных функций его тканей, по-разному реагируют на ОС, что обусловлено видоспецифичностью компонентов сигнальных путей, формирующих систему антиоксидантной защиты (АОЗ). Важная роль в АОЗ принадлежит факторам транскрипции, в частности, Nrf2. Cистема АОЗ в РПЭ включает несколько уровней регуляции, взаимодействие которых обеспечивает стабильность морфофункционального состояния клеток. Филогенетический анализ демонстрирует не только консерватизм, но и вариабельность компонентов АОЗ, что может иметь адаптационное значение, отражать различия функциональной нагрузки и регенеративного потенциала. Выявление механизмов АОЗ, обеспечивающих морфофункциональную стабильность клеток РПЭ, имеет фундаментальное значение и нацелено на поиск тканеспецифичных мишеней для эффективной терапии спектра заболеваний глаза.
СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
| АОЗ | от англ. “Antioxidant defense system, AODS”, антиоксидантная система защиты |
| АТФ | от англ. “Adenosine triphosphate, ATP”, аденозинтрифосфат |
| АТФаза | от англ. “Adenosine 5'-TriPhosphatase, ATPase”, аденозинтрифосфатаза |
| АФК | от англ. “Reactive oxygen species, ROS”, активные формы кислорода |
| ВМД | от англ. “Age-related macular degeneration, AMD”, возрастная макулярная дегенерация сетчатки |
| ГРБ | гематоретинальный барьер |
| ЛФ | от англ. “Lipofuscinum, LP”, липофусцин |
| MAPК | от англ. “Mitogen-activated protein kinases”, митоген-активируемые протеинкиназы |
| МБ | от англ. “Bruch’s membrane, BM”, мембрана Бруха |
| Мт | от англ. “Metallothionein”, металлотионеин |
| ОС | от англ. “Oxidative stress, OS”, окислительный стресс |
| ПЖК | от англ. “Polyunsaturated fatty acids, PFA”, полиненасыщенные жирные кислоты |
| ПМЛ | от англ. “Lysosomal membrane permeabilization, LMP”, пермеабилизация мембран лизосом |
| ПОЛ | от англ. “Lipid peroxidation, LP”, перекисное окисление липидов |
| Протеинкиназа CK2 | от англ. “Protein kinase CK2”, казеинкиназа II |
| РПЭ | от англ. “Retinal pigment epithelium, RPE”, ретинальный пигментный эпителий |
| СОД | от англ. “Superoxide dismutase, SOD”, супероксиддисмутаза |
| цAMФ | от англ. “Cyclic adenosine monophosphate, cAMP”, циклический аденозинмонофосфат, сAMP |
| ЭМП | от англ. “Epithelial–mesenchymal transition, EMT”, эпителиально-мезенхимный переход |
| ЭПР | от англ. “Endoplasmic reticulum, EPR”, эндоплазматический ретикулум |
| А2Е | от англ. “bis-retinoid N-retinyl-N-retinylidene ethanolamine”, бис-ретинилиденэтаноламин |
| A2AR | от англ. “Adenosine A2A receptor”, аденозиновые рецепторы подтипа A2A |
| ACOX | от англ. “Acyl-CoA Oxidase”, ацетил-КоА ацилтрансфераза |
| AGEs | от англ. “Advanced glycation end products”, конечные продукты гликирования |
| Akt | от англ. “Protein kinase B alpha”, протеинкиназа B-α |
| ARE | от англ. “Antioxidant Response Element”, антиоксидантный реагирующий элемент |
| AP-1 | от англ. “Activator protein 1 (AP-1), transcription factor” |
| ASK1 | от англ. “Аpoptosis signal-regulating kinase1”, киназа, регулирующая сигнал к апоптозу, тип 1 |
| AIF | от англ. “Apoptosis-inducing factor”, апоптоз-индуцирующий фактор |
| ATF -1 | от англ. “ATF-1 activating transcription factor 3”, активатор фактора транскрипции-1 |
| CAT | от англ. “catalase”, каталаза |
| CBP | от англ. “Cyclic adenosine monophosphate Response Element Binding protein, CREB-binding protein”, CREB-свя́зывающий белок |
| CUL3-E3 | от англ. “Cullin 3-based ubiquitin ligase”, Е3 убиквитин лигаза |
| DUOX1 | от англ. “Dual Oxidase 1”, двойная оксидаза-1 |
| ET-1 | от англ. “Endothelin 1”, эндотелин |
| ERK | от англ. “Extracellular signal-related kinase”, экстраклеточная сигнал регулирующая киназа |
| FAS (CD95) | от англ. “Fas receptor (FasR) induces programmed cell death”, cluster of differentiation 95, апоптозный антиген, кластер дифференцировки 95 |
| FGFβ | от англ. “Fibroblast Growth Factor β”, фактор роста фибробластов |
| GAPDH | от англ. “Glyceraldehyde-3-phosphate dehydrogenase”, глицеральдегид-3-фосфат дегидрогеназа |
| GCLC | от англ. “Glutamate-Cysteine Ligase Catalytic Subunit”, каталитическая субъединица глутамат-цистеин лигазы |
| GCLM | от англ. “Glutamate-Cysteine Ligase Modifier Subunit”, субъединица-модификатор глутамат-цистеин лигазы |
| GLUT | от англ. “Glucose transporter”, белок-переносчик глюкозы |
| GSH | от англ. “Glutathione”, глутатион |
| GPХ | от англ. “Glutathione Peroxidase”, глутатионпероксидаза |
| НО-1 | от англ. “Hemo-oxigenasa-1”, гем-оксигеназа-1 |
| HIF-1α | от англ. “Hypoxia-inducible factor 1-α”, фактор, индуцируемый гипоксией 1-alpha |
| HSP70 | от англ. “70kDa heat shock protein”, белки теплового шока-70 |
| ICAM | от англ. “Inter-Cellular Adhesion Molecule”, молекулы межклеточой адгезии |
| IL-6 | от англ. “Interleukin 6” |
| JNK/SAPK | от англ. “c-Jun N-terminal kinase/Stress activated protein kinase”, каскад стресс-активируемых протеинкиназ |
| Keap1 | от англ. “Kelch-like ECH-associated protein 1”, Kelch-подобный белок 1, ассоциированный с ЕСН |
| MAPK ERK1/2 | от англ. “Extracellular signal-regulated kinase 1/2 (ERK1/2) cascade”, митоген-активируемый протеинкиназный сигнальный каскад |
| Mitf | от англ. “Microphthalmia-associated transcription factor”, фактор транскрипции, ассоциированный с микрофтальмией |
| MMP-9 | от англ. “Matrix metalloproteinase 9”, матриксная металлопротеиназа-9 |
| NAC | от англ. “NAC transcription factors”, N-ацетилцистеин |
| NADPH-оксидаза | от англ. “Nicotinamide adenine dinucleotide phosphate oxidase”, NOX, никотинамид-β-аденин динуклеотид фосфат оксидаза |
| Na+/K+-ATPase | от англ. “sodium–potassium adenosine triphosphatase”, фермент из группы транспортных аденозинтрифосфатаз (NKA) |
| NaIO3 | от англ. “Sodium iodate”, йодат натрия |
| NF-kB | от англ. “nuclear factor kappa-light-chain-enhancer of activated B cells” |
| NLS | от англ. “nuclear localization signal”, сигнал ядерной локализации |
| NO synthase | от англ. “Nitric oxide synthases”, синтаза оксида азота |
| Nrf2 | от англ. “Nuclear factor erythroid 2-related factor 2”, транскрипционный ядерный фактор 2, связанный с эритроидным фактором 2 |
| PAI-1 | от англ. “Plasminogen activator inhibitor-1”, ингибитор активатора плазминогена-1 |
| PEDF | от англ. “Pigment Epithelium-derived Factor”, фактор роста происхождения из пигментного эпителия |
| PI3K/Akt | от англ. “Phosphatidylinositol 3‑kinase (PI3K)/protein kinase B (AKT) signaling pathway, фосфатидилинозитол-3-киназа/киназа Akt”, |
| PI3K-Akt-mTOR | от англ. “сигнальный путь, опосредуемый киназами: фосфатидилинозитол-3-киназой (PI3K), AKT и mTOR |
| PKC | от англ. “Protein kinase C, протеинкиназа С |
| PRDX | от англ. “peroxiredoxin”, пероксиредоксин |
| PTPN26 | Protein Tyrosine Phosphatase Non-Receptor Type 26, протеинтирозинфосфатаза 26 |
| P2X7 | от англ. “ATP-gated P2X receptor cation channel family”, P2X семейство рецепторов АТФ-управляемых катионных каналов |
| P2YR | от англ. “Metabotropic G protein-coupled P2Y receptors”, метаботропные связанные с G-белком пуринергические рецепторы |
| R-SOH | от англ. “sulfenic acid”, сульфоновая кислота |
| SIRT-1 | от англ. “Sirtuin 1, NAD-dependent deacetylase sirtuin-1”, cиртуин 1, деацетилаза сиртуин-1 зависимая от НАД |
| TGFβ | от англ. “Transforming Growth Factor”, трансформирующий фактор роста |
| TLR | от англ. “Toll-like receptor, Толл-подобные рецепторы” |
| TIMP2 | от англ. “Tissue inhibitor of metalloproteinases 2”, тканевый ингибитор металлопротеиназ 2 |
| TNFα | от англ. “Тumor necrosis factor alpha”, фактор некроза опухоли |
| TNFR1 | от анг. “Тumor necrosis factor alpha receptors”, рецепторы фактора некроза опухоли |
| XO | от англ. “Xanthine-oxidase”, ксантин-оксидаза |
| VEGF | от англ. “Vascular Endothelial Growth Factor”, фактор роста эндотелия сосудов |
| ·OH | гидроксильный радикал |
| ${}^{\centerdot }{\text{O}}_{2}^{ - }$ | супероксидный анион |
| 1O2 | синглетный кислород |
| H2O2 | перекись водорода |
| NO | оксид азота |
| ONOO– | пероксинитрит |
ВВЕДЕНИЕ
Появление 2–2.5 миллиарда лет назад цианобактерий, способных к оксигенному фотосинтезу, который сопровождается выделением кислорода (O2), привело к возрастанию его концентрации в атмосфере. В этих условиях увеличился внутриклеточный уровень активных форм кислорода (АФК). Живые организмы приспособились к сосуществованию с АФК, разработали стратегии, позволяющие использовать их в различных физиологических процессах, оптимизировали аэробный энергетический метаболизм и развили механизмы нейтрализации токсичных АФК [1]. Наличие абиотических фотохимических процессов позволяет предполагать, что даже более ранние формы жизни, предшествующие цианобактериям, могли обладать системами метаболизма O2/АФК и антиоксидантной защиты [2]. Клетки тканей с высоким уровнем метаболизма и энергетическими затратами имеют высокий уровень внутриклеточных АФК и приобрели в ходе эволюции хорошо развитую систему антиоксидантной защиты (АОЗ). К таким клеткам относятся, в частности, клетки ретинального пигментного эпителия (РПЭ) и фоторецепторы сетчатки, которые подвергаются воздействию света и обладают интенсивным метаболизмом [3]. Удовлетворение энергетических потребностей фоторецепторов требует усиленного потребления O2, поступающего в сетчатку через сеть капилляров сетчатки или капилляров сосудистой оболочки [4]. Интенсивность аэробных процессов в сетчатке, приводящих к выработке большого количества АФК, вызвала необходимость формирования специализированного интенсивно пигментированного слоя клеток РПЭ, способного к активной нейтрализации АФК и предотвращению окислительного стресса (ОС). РПЭ образует плотные контакты с наружными сегментами фоторецепторами сетчатки, участвуя в создании иммунной привилегии сетчатки, и взаимодействует с сосудистой оболочкой глаза [5]. Со стороны сосудистой оболочки РПЭ подстилает мембрана Бруха (МБ), в состав которой входят компоненты эндотелия сосудистой оболочки, богатой капиллярами, и уплотненного фибриллярного слоя собственно базальной пластинки РПЭ [6]. МБ участвует в регуляции диффузии биомолекул (протеогликанов, хемокинов, цитокинов, факторов роста, токсичных продуктов жизнедеятельности) между фоторецепторами, РПЭ и сосудистой оболочкой. Комплекс фоторецепторы-РПЭ-MБ-сосудистая оболочка обеспечивает формирование гематоретинального барьера (ГРБ) [7].
РПЭ играет центральную роль в обеспечении функционирования сетчатки, осуществляя фагоцитоз дисков наружных сегментов фоторецепторов и защиту фоторецепторов от избытка света, поддержание баланса рН и ионов в субретинальном пространстве, доставку в нейральные слои сетчатки метаболитов (глюкоза, аминокислоты), продукцию факторов роста [8]. Регуляция баланса окислительно-восстановительных реакций, постоянно протекающих в РПЭ и фоторецепторах, обеспечивает контроль процессов пролиферации, гибели, дифференцировки клеток РПЭ на протяжении всего онтогенеза [7]. Поддержание стабильного состояния дифференцировки клеток РПЭ имеет решающее значение для функционирования сетчатки. Структурные, метаболические и генетические нарушения в РПЭ и пограничных тканях, под воздействием экзогенных или эндогенных факторов, сопровождающиеся накоплением избытка АФК, ведут к активации ОС [9], который является важным звеном в патогенезе дегенеративных патологий сетчатки [10].
В процессе эволюции в организмах сформировались сложные системы АОЗ, которые представлены несколькими уровнями регуляции (звеньями), обеспечивающие снижение уровня АФК и их негативных последствий. Системы АОЗ предусматривают использование репаративных механизмов для восстановления поврежденных структур, в числе которых аутофагия РПЭ и ремоделирование поврежденных белков [11].
Несмотря на прогресс в понимании механизмов, роль факторов АОЗ в регуляции гомеостаза клеток и стратегиях клеточного ответа РПЭ, а также связь этих факторов с другими эндогенными защитными регуляторными системами у позвоночных охарактеризованы далеко не полностью. Существуют эволюционно закрепленные видовые отличия реакции клеток РПЭ на ОС у позвоночных. Клеточный ответ РПЭ позвоночных на повреждение и воспаление, сопровождающихся нарушением ГРБ, баланса окислительно-восстановительных реакций и активацией ОС, может вызвать как развитие патологических процессов в нейронах и глии сетчатки (у млекопитающих), так и обеспечить их восстановление (у ряда хвостатых амфибий) [12]. Изучение роли ОС и АОЗ в клеточном ответе РПЭ хвостатых амфибий заслуживает особого внимания, поскольку эти животные, в отличие от млекопитающих, способны к трансдифференцировке РПЭ в нейроны и глию сетчатки, а также к структурному и функциональному восстановлению слоя РПЭ после повреждения [13]. Отдельные сведения о роли ОС в пигментированных клетках эпителия радужки – источника для регенерации хрусталика у хвостатых амфибий, получены на уровне анализа изменений транскриптома. Конверсия пигментный эпителий-хрусталик сопровождается активацией редокс-чувствительных генов: Hmox1, Fam213a, Erg1, Serpinb10 и др. [14].
В обзоре проведен анализ накопленных с использованием современных подходов данных о молекулярно-генетических механизмах регуляции окислительно-восстановительного метаболизма и стабильности клеток РПЭ позвоночных. Особое внимание уделено обсуждению роли в системе АОЗ ключевых ОС-зависимых факторов транскрипции Nrf2, с точки зрения консерватизма и эволюционной вариабельности. Высказано предположение о том, что разный ответ клеток РПЭ на действие ОС, у позвоночных с высокими или ограниченными регенерационными способностями, обусловлен особенностями эндогенных систем защиты, в частности, системы АОЗ.
ЭКЗОГЕННЫЕ И ЭНДОГЕННЫЕ ФАКТОРЫ ОКИСЛИТЕЛЬНОГО ПОВРЕЖДЕНИЯ РЕТИНАЛЬНОГО ПИГМЕНТНОГО ЭПИТЕЛИЯ
Воздействие экзогенных факторов (избыточный свет, ионизирующее излучение, высокие температуры, гипоксия, химические вещества, механическое повреждение) обусловливает высокий риск окислительного повреждения РПЭ и фоторецепторов [15–18]. Смена светового режима влияет на pH, концентрацию ионов Ca2+ и K+, увеличивает потребление кислорода, вызывая генерацию АФК в этих клетках [19]. В РПЭ и нейральных слоях сетчатки относительно высокое парциальное напряжение кислорода обеспечивает синтез АТФ в митохондриях. При этом более 90% O2 восстанавливается до H2O, а 1–5% O2 участвуют в образовании АФК. Эндогенными источниками АФК, помимо митохондрий, являются мембранно связанные NADPH-оксидазы (Nicotinamide adenine dinucleotide phosphate oxidase, NOX), лизосомы (фагосомы), пероксисомы, меланосомы [20–22].
Эндогенные факторы предрасположенности РПЭ к ОС включают высокую скорость метаболизма и окислительных реакций в РПЭ и фоторецепторах. В сетчатке постоянно обновляются внешние диски фоторецепторов: слущивающиеся “отработанные” диски, мембраны которых содержат большое количество полиненасыщенных жирных кислот (ПЖК), утилизируются в РПЭ [20]. В процессе зрительного цикла происходит изомеризация 11-цис-ретиналя в транс-ретиналь в составе родопсина и продуцируются АФК, которые вызывают перекисное окисление ПЖК [23, 24], накопление липофусцина (ЛФ) [21], окисление (обесцвечивание) меланина, выполняющего защитную роль, за счет активного участия в “нейтрализации” АФК, в первую очередь, синглетного кислорода [22]. В большинстве случаев поврежденные под действием ОС в РПЭ клеточные компоненты деградируют и заменяются вновь синтезированными в результате репаративной аутофагии [25]. В постмитотических клетках РПЭ интенсивность повреждения зависит от степени аутофагии, накопления продуктов клеточного распада. Возрастные изменения, связанные с накоплением и депонированием ЛФ в лизосомах, являются значимым фактором риска развития ОС-зависимых патологий РПЭ [26]. Метаболические нарушения, приводящие к накоплению ионов Н+ и снижению рН в РПЭ, являются общей характеристикой апоптотических стимулов, связанных с депривацией цитокинов или усилением генерации АФК. В условиях ОС возрастает фагоцитарная нагрузка клеток РПЭ, что проявляется в повышении интенсивности фагоцитоза апоптотических фрагментов и утилизации продуктов метаболизма МБ [20].
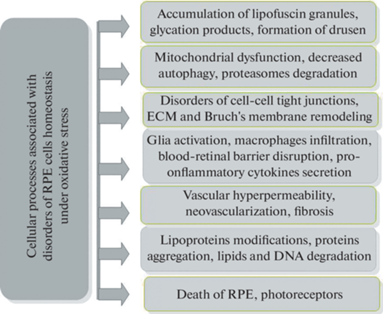
Разобщение контактов РПЭ с фоторецепторами при отслойке сетчатки, действии ультрафиолета, светового облучения, значительно увеличивает накопление в РПЭ продуктов перекисного окисления липидов (ПОЛ) [27]. Процессы свободнорадикального окисления при нарушении целостности и гомеостаза РПЭ усиливаются, что, в совокупности с факторами воспаления, нарушает работу регуляторных и ферментных систем [28]. Эти процессы вызывают накопление продуктов окисления (малоновый диальдегид, 4-гидроксиноненаль, конечные продукты гликолиза), повреждение липидов клеточных мембран, белков и нуклеиновых кислот [20]. ОС нарушает общий клеточный гомеостаз клеток РПЭ, затрагивает большинство внутриклеточных процессов и взаимодействие с окружающими тканями (фагоцитоз, аутофагия, транспорт метаболитов) (рис. 1). Деструктивная активность АФК в клетках проявляется в окислении белков, мембранных липидов, повреждении ДНК [29]. В клетках РПЭ происходит накопление и нарушение метаболизма остаточных молекулярных компонентов, их экспорта, из-за высвобождения лизосомальных ферментов в цитозоль, что приводит к снижению экранирующей и антиокислительной функций РПЭ и является пусковым звеном дегенеративных процессов [10].
Рис. 1.
Клеточные процессы в ретинальном пигментном эпителии и пограничных с ним тканях млекопитающих, при окислительном стрессе. Внутриклеточными мишенями являются липиды, белки, ДНК, повреждение которых отражает интенсивность окислительного стресса и степень поражения клеток. Условные обозначения: RPE – retinal pigment epithelium, DNA – deoxyribonucleic acid, ECM – extracellular matrix.
Клеточные процессы, контролирующие продукцию и элиминацию избыточного количества АФК, обеспечивают реализацию функций клеток РПЭ и фоторецепторов [21, 26]. Важная роль в контроле состояния клеток принадлежит окислительно-восстановительным процессам, равновесию между прооксидантной и антиоксидантной системами [10]. Это равновесие обеспечивается активностью сигнальных белков, ферментов, редокс-чувствительных генов, которые контролируют синтез ДНК, проницаемость мембранных каналов и другие процессы, направленные на поддержание стабильности гомеостаза клеток [30, 31]. Сдвиг равновесия в РПЭ в сторону окислительных процессов ведет к ОС, дисфункции РПЭ и фоторецепторов [10].
Большинство генов, мутации в которых приводят к ОС-зависимым патологиям сетчатки, кодируют факторы транскрипции с высокой и специфической экспрессией в РПЭ и фоторецепторах. Такие мутации могут вызывать интенсификацию накопления ЛФ в РПЭ, приводить к снижению числа или полному отсутствию меланосом, дезорганизации МБ и внеклеточного матрикса (ВКМ) [12, 26].
ПРООКСИДАНТНАЯ СИСТЕМА И ИСТОЧНИКИ АФК В РЕТИНАЛЬНОМ ПИГМЕНТНОМ ЭПИТЕЛИИ
Прооксидантная система, компоненты которой вовлечены в развитие ОС, включает различные виды АФК (супероксидный анион ${}^{\centerdot }{\text{O}}_{2}^{ - }$, гидроксильный радикал ·OH, синглетный кислород 1O2, перекись водорода H2O2), низкомолекулярные прооксиданты (ионы переходных металлов Mn, Fe, Cu), а также специализированные ферменты, которые генерируют АФК (NADPH-оксидаза, NO-синтаза, ксантиноксидаза) [29, 32] (рис. 2).
Рис. 2.
Эндогенные системы (антиоксидантная и др.), обеспечивающие поддержание гомеостаза и защиту клеток ретинального пигментного эпителия млекопитающих от экзогенных и эндогенных факторов окислительного стресса. Интенсификация окислительных процессов приводит к развитию ОС, патологическим процессам и гибели клеток. Условные обозначения: 1 – фоторецепторы, 2 – ретинальный пигментный эпителий (RPE), 3 – меланосомы, 4 – ядро, 5 – липофусцин, 6 – друзы, 7 – мембрана Бруха, 8 – хориокапиляры сосудистой оболочки. SOD – superoxide dismutase, CAT – catalase, GPX – glutathione peroxidase, PRDX – peroxiredoxin; ROS – reactive oxygen species, ·OH – hydroxyl radical, 1O2 – singlet oxygen, ${}^{\centerdot }{\text{O}}_{2}^{ - }$ – superoxide, H2O2 – hydrogen peroxide, NO – nitric oxide. DNA – deoxyribonucleic acid.
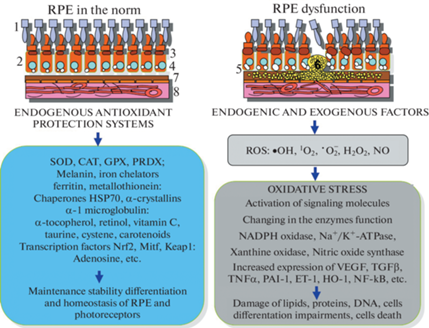
Супероксидные анионы •O2 возникают в клетках РПЭ и сетчатки как продукт цепи окислительного фосфорилирования митохондрий при синтезе АТФ [33], а в цитозоле – в результате активности NADPH-оксидаз [34]. NADPH-оксидазная система генерирует •O2 и H2O2, участвующие в нейтрализации патогенов [35]. У большинства млекопитающих идентифицированы 7 изоформ NADPH-оксидаз: NOX1–5 и DUOX1–2 [36]. Уже на ранних этапах эволюции произошла дивергенция на кальций-регулируемые NOX (NOX5, DUOX1-2), являющиеся наиболее “древними” и консервативными, и NOX, активируемые регуляторными субъединицами (NOX 1–4). NOX2 и NOX4 присутствуют у всех позвоночных, NOX1 появляется у рыб и амфибий, а NOX3, очевидно, является самым “молодым” членом семейства, обнаруженным только у птиц и млекопитающих [37]. Источником фотоиндуцированной генерации супероксидных анионов •O2 в РПЭ служит ЛФ, который при облучении видимым светом (преимущественно в синем диапазоне) восстанавливает молекулы кислорода O2 до •O2 [38], которые, как предполагается, инициируют процесс деградации меланина [39, 40]. Гидроксильный радикал ·OH может продуцироваться лизосомами, в результате радиолитического расщепления воды, или образования пероксинитрита (ONOO–), в результате реакции между супероксид-ионом ${\text{O}}_{2}^{ - }$ и оксидом азота NO. Синглетный кислород 1O2, который образуется в результате фотосенсибилизации и возбуждения молекул ЛФ, рибофлавина или ретиналя, также является разрушительным метаболитом, который, как и ·OH, агрессивен, но не стоек, и быстро реагирует с разными клеточными компартментами [41].
Органеллами, специализирующимися на метаболизме перекиси водорода H2O2, также являются пероксисомы, содержащие FAD-оксидоредуктазы (флавинадениндинуклеотид зависимые оксидоредуктазы), которые участвуют в бета-окислении ПЖК. В пероксисомах образуются ацетил-КоА ацилтрансфераза (ACOX), альдегидогенные фосфолипиды (плазмалогены) и желчные кислоты, а в качестве побочных продуктов – H2O2, которая утилизируется каталазой [42]. Фермент ACOX появляется у эукариот, известно, что у человека он представлен тремя изоформами (ACOX1-3) [43].
При накоплении продуктов перекисного окисления в РПЭ со стороны эндоплазматического ретикулума (ЭПР) развивается реакция на неструктурируемый белок, направленная на восстановление протеостаза. При избыточном накоплении окисленные формы белков теряют свойственную им структуру и агрегируют, что может приводить к дополнительной активации стресса ЭПР. Накопление агрегированных белков усугубляет ОС, вызывая разрыв лизосом и развитие реакций воспаления [44]. Повреждение РПЭ и сетчатки, действие АФК (Н2О2) вызывают секрецию АТФ, активацию АТФ-зависимых Са2+-каналов (P2XR7), высвобождение из внутриклеточных депо ионов Са2+ и усиление их транспорта в клетку. Цепь этих реакций увеличивает проницаемость мембран, вызывая набухание митохондрий, выход цитохрома C в цитоплазму [45].
Несмотря на тот факт, что АФК являются неустойчивыми соединениями, они оказывают существенное влияние на работу важных внутриклеточных ферментных систем (протеиназы, фосфатазы, фосфолипазы); обеспечивая изменения активности генов, кодирующих факторы транскрипции, и редокс-зависимых генов, которые принимают участие в контроле дифференцировки, метаболизма и пластичности клеток РПЭ [46–48]. Глобальные изменения экспрессии генов, принадлежащих к различным функциональным кластерам, затрагивают сигнальные пути, которые обеспечивают защиту клеток от ОС или контролируют гибель клеток РПЭ и сетчатки (апоптоз, некроз и др.) [49].
КЛЮЧЕВЫЕ КОМПОНЕНТЫ СИСТЕМЫ АНТИОКСИДАНТНОЙ ЗАЩИТЫ В РЕТИНАЛЬНОМ ПИГМЕНТНОМ ЭПИТЕЛИИ
Транскрипционное профилирование выявило активацию редокс-чувствительных генов, регулирующих апоптоз, аутофагию в клетках РПЭ, при развитии патологических процессов [50, 51]. Обнаружены возрастание уровня экспрессии ОС-чувствительных генов и изменение уровня экспрессии генов, обеспечивающих устойчивость к окислительным реакциям в клетках РПЭ человека, в ответ на действие перекиси водорода H2O2 [52].
Редокс-чувствительные факторы транскрипции. К редокс-чувствительным факторам первой линии защиты клеток в РПЭ относят факторы транскрипции Nrf2, FOXO, HSF1 и другие, которые являются сенсорами АФК и обеспечивают запуск системы АОЗ [52]. Позвоночные имеют шесть паралогичных генов, которые кодируют факторы транскрипции семейства “cap ‘n’ collar” суперсемейства лейциновой молнии (bZip). Из них четыре фактора являются активирующими (Nrf1, Nrf2, Nrf3, NF–E2), а два – ингибирующими (Bach1 и Bach2) [53]. Центральную роль в активации системы АОЗ, наряду с белками теплового шока, играет фактор транскрипции Nrf2 (Nuclear factor E2 p45-Related Factors) [54]. Nrf2 контролирует экспрессию антиоксидантных, противовоспалительных и целого ряда метаболических генов [55]. Появление Nrf2 связывают с глобальным переходом от анаэробных условий обитания к аэробным. Ортологи Nrf2 появились у предков грибов около 1.5 млрд лет назад. Первая дивергенция Nrf2 произошла во время разделения грибов и Metazoa (1.0–1.2 млрд лет назад). Уровень атмосферного O2 постепенно возрастал во второй половине палеозойской эры (359–252 млн лет назад), в конце этого периода произошла очередная дивергенция Nrf2, сопровождающая появление и эволюцию млекопитающих [56].
Nrf2 имеет в своем составе 7 консервативных доменов Neh1-Neh7. Домен Neh1 содержит два сайта: “cap ‘n’ collar” – щелочную область лейциновой молнии (bZIP), которая обеспечивает связывание с ДНК, и сигнал ядерной локализации. N-концевой домен Neh2 содержит 7 остатков лизина, участвующих в убиквитинировании, и два мотива (ETGE и DLG), которые обеспечивают связывание с Keap1. Neh3, Neh4 и Neh5 являются трансактивационными доменами, которые опосредуют взаимодействие Nrf2 с другими коактиваторами (CBP, CREB-binding protein). Neh5 отвечает за цитоплазматическую локализацию Nrf2 [57]. Neh6, обогащенный остатками серина, обеспечивает связывание с белком, включающим бета-трансдуциновые повторы, содержащие дипептиды триптофана и аспарагиновой кислоты (WD-повторы), что ведет к убиквитинированию Nrf2 и его деградации [58]. Neh7 взаимодействует с ретиноидным Х-рецептором-α (RXR-α), что блокирует сигнальную ось Nrf2-ARE [59].
Древний белок Nrf2 вместо 7 доменов, характерных для млекопитающих, по-видимому, имел всего три домена: Neh1, -3 и -6, а также область связывания с ЭПР. Такая структура Nrf2 сохранилась у современной гидры. Домен Neh2, обеспечивающий связь с Keap1, появился у триплобластов (многоклеточные животные, начиная с плоских червей). У вторичноротых появляются домены Neh4 и Neh5. В то же время у нематоды (Caenorhabditis elegans) Nrf2 теряет большинство исходных доменов, включая C-концевую часть домена Neh1, который обеспечивает связь с ДНК. С появлением позвоночных в Nrf2 окончательно сформировались шесть функциональных доменов (Neh1-Neh6), тогда как был утрачен домен, обеспечивающий локализацию белка в ЭПР [54].
Фактор транскрипции Nrf2 является одним из ключевых факторов регуляции ОС у позвоночных. Ортологи Nrf2 обнаружены у представителей всех классов позвоночных, причем степень их идентичности – наиболее высокая в пределах класса, и минимальная у наиболее удаленных эволюционно классов позвоночных (рис. 3).
Рис. 3.
Филограмма ортологов Nrf2, построенная методом ближайших соседей на основе базы данных Национального центра биотехнологической информации США (NCBI) (https://www.ncbi.nlm.nih.gov/protein/).
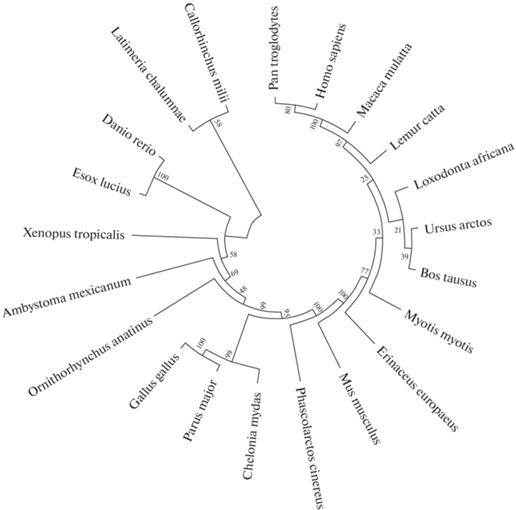
Филогенетический анализ доменов Nrf2 показывает, что домены Neh1 (обеспечивает связывание фактора с ДНК) и Neh2 (ответственен за взаимодействие с Keap1) являются наиболее консервативными (идентичность не менее 70%) у всех классов позвоночных (от древнего класса лопастоперых рыб, представителем которых является латимерия, до человека). Домены Neh3-Neh6 демонстрируют вариабельность у низших позвоночных (амфибии, рыбы), а домен Neh7, ответственный за взаимодействие с RXR-α, эволюционирует, по-видимому, наиболее быстро: у рыб его сходство с человеком не превышает 27%, у птиц – 41%, у яйцекладущих млекопитающих (утконос) – 33% (табл. 1).
Рис. 4.
Филогенетический анализ ортологов фактора транскрипции Nrf2 позвоночных. Множественное выравнивание аминокислотных последовательностей фактора транскрипции Nrf2 позвоночных выполнено с помощью алгоритма CrustalO из пакета программ Unipro UGENE (ver. 45.00). Консервативные аминокислотные остатки выделены синим цветом, интенсивность метки пропорциональна степени консервативности. Границы доменов (Neh1-Neh7) даны в соответствии с [57] и выделены прямоугольными рамками.
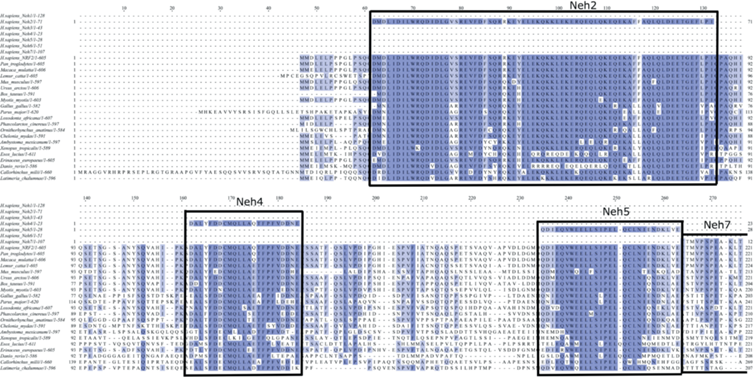
Рис. 4.
Окончание
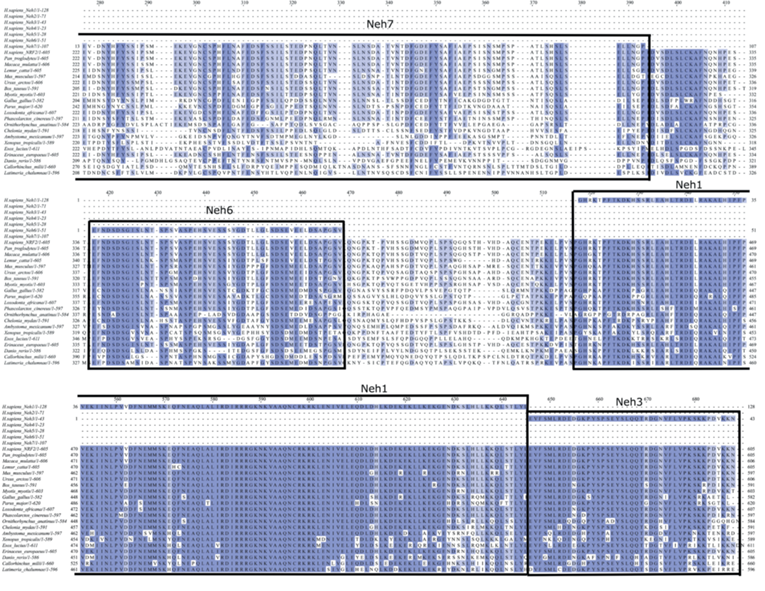
В норме Nrf2 находится в неактивном состоянии в комплексе с Keap1 (Kelch-like ECH-associated protein 1). В результате активности CUL3-E3 (Cullin 3-based ubiquitin ligase) Nrf2 подвергается поли-убиквитинированию и деградации протеасомами. ОС вызывает конформационные изменения Keap1, высвобождая Nrf2, который фосфорилируется, мигрирует в ядро клетки, где образует комплекс с факторами транскрипции Maf [60]. Этот комплекс индуцирует экспрессию ряда генов, взаимодействуя с их цис-регуляторными последовательностями – антиоксидантными реагирующими элементами (Antioxidant Response Elements, ARE) [61].
Таблица 1.
Степень идентичности доменов фактора транскрипции Nrf2 позвоночных относительно доменов NRF2 человека (NP_006155.2, изоформа 1)
| Виды | Домены NRF2 Homo sapiens, % | NRF2 Homo sapiens NP_006155.2 | ||||||
|---|---|---|---|---|---|---|---|---|
| Neh1 | Neh2 | Neh3 | Neh4 | Neh5 | Neh6 | Neh7 | ||
| Pan_troglodytes (обыкновенный_шимпанзе) XP_001145876.3 | 100 | 99 | 100 | 100 | 100 | 100 | 100 | 100 |
| Macaca_mulatta (Макак-резус) NP_001244536.1 | 99 | 99 | 100 | 100 | 100 | 100 | 99 | 99 |
| Lemur_catta (кошачий_лемур) XP_045415392.1 | 97 | 87 | 100 | 96 | 100 | 86 | 91 | 91 |
| Mus_musculus (домовая_мышь) NP_035032.1 | 92 | 95 | 98 | 87 | 71 | 86 | 73 | 80 |
| Bos_tausus (домашний_бык) XP_005202370.1 | 98 | 79 | 91 | 91 | 93 | 84 | 86 | 86 |
| Ursus_arctos (бурый_медведь) XP_026348256.1 | 99 | 99 | 98 | 96 | 93 | 86 | 87 | 90 |
| Loxodonta_africana (саванный_слон) XP_003406250.2_L | 97 | 94 | 98 | 87 | 86 | 84 | 83 | 87 |
| Erinaceus_europaeus (обыкновенный_еж) XP_016044349.1 | 96 | 94 | 100 | 87 | 89 | 82 | 76 | 86 |
| Phascolarctos_cinereus (коала) XP_020846698.1 | 95 | 88 | 91 | 78 | 89 | 78 | 66 | 77 |
| Myotis_myotis (большая_ночница) XP_036174805.1 | 98 | 98 | 95 | 87 | 96 | 86 | 79 | 86 |
| Ornithorhynchus_anatinus (утконос) XP_007669464.2 | 84 | 73 | 77 | 87 | 89 | 55 | 33 | 57 |
| Gallus_gallus (курица) NP_001383833.1 | 88 | 70 | 81 | 78 | 86 | 71 | 40 | 61 |
| Parus_major (большая_синица) XP_015489930.1 | 83 | 74 | 84 | 70 | 86 | 73 | 41 | 62 |
| Chelonia_mydas (зеленая_черепаха) XP_037768002.1 | 87 | 81 | 79 | 74 | 89 | 73 | 35 | 63 |
| Ambystoma_mexicanum (мексиканский_аксолотль)* | 80 | 78 | 77 | 61 | 71 | 61 | 28 | 56 |
| Xenopus_tropicalis (шпорцевая_лягушка) NP_001007490.1 | 73 | 83 | 67 | 39 | 61 | 49 | 22 | 50 |
| Esox_lucius (щука) XP_010878224.2 | 73 | 64 | 77 | 65 | 54 | 49 | 21 | 45 |
| Danio_rerio (данио-рерио) NP_878309 | 77 | 66 | 65 | 52 | 46 | 47 | 21 | 44 |
| Callorhinchus_milii (австралийский_каллоринх) XP_007888253.1 | 79 | 74 | 74 | 74 | 54 | 45 | 21 | 50 |
| Latimeria_chalumnae_(латимерия) XP_014349356.1 | 80 | 74 | 74 | 74 | 68 | 57 | 27 | 54 |
Примечание. Данные вычислены на основе множественного выравнивания (рис. 4). * – последовательность из базы данных https://genome.axolotl-omics.org. Остальные последовательности приведены согласно базе данных Национального центра биотехнологической информации США (NCBI).
Регуляторная ось Keap1-Nrf2-Maf является эволюционно консервативной и обнаружена у всех видов, от Drosophila melanogaster до человека [61]. Nrf2 активирует в РПЭ как антиоксидантные, так и противовоспалительные сигнальные каскады [62, 63]. Под контролем Nrf2 находятся гены, регулирующие энергетический метаболизм, репарацию ДНК и детоксикацию. Nrf2 связывается с промоторными областями генов, кодирующих цитопротекторные белки, в частности, гемоксигеназу-1 (НО-1) [64]. Мыши с нокаутом Nrf2 демонстрируют снижение аутофагии клеток РПЭ, с ярко выраженными признаками возрастной макулярной дегенерации сетчатки (ВМД) [65]. В свою очередь, экспрессия Nrf2 регулируется в РПЭ фактором транскрипции, ассоциированным с микрофтальмией (Mitf) [66], который действует как антиоксидант, регулируя биогенез митохондрий и окислительно-восстановительный гомеостаз в РПЭ [30].
Факторы транскрипции Nrf1 и Nrf3, по-видимому, возникли в ходе дивергентной эволюции Nrf2, и функционируют независимо от Keap1. Они локализованы в ЭПР и участвуют в защитной реакции на неструктурированный белок. Гены, содержащие ARE, могут быть активированы также факторами транскрипции EP300 и CREB [67]. С другой стороны, существуют репрессоры факторов транскрипции Nrf (Bach1, Bach2), которые предотвращают избыточную активацию системы АОЗ [68]. Среди редокс-чувствительных факторов транскрипции, принимающих участие в регуляции метаболизма и аутофагии, важную роль в РПЭ играют PPAR, CREB, TFEB, FOXO1/3, FXR [69], а также регуляторные белки ATG7 и Beclin-1 [70]. Биоинформационный анализ позволил выявить потенциальные ARE в ряде генов, участвующих в АОЗ клеток позвоночных [71], в частности, у представителей семейства PITX/Pitx, кодирующие факторы транскрипции [72–74].
Антиоксидантные ферментные системы защиты включают ферменты, нейтрализующие, и восстанавливающие АФК (рис. 2). ОС индуцирует экспрессию ферментов фазы II метаболической детоксикации: хинон-акцепторную оксидоредуктазу, гемоксигеназу-1 (НО-1), каталитическую субъединицу (GCLC) и субъединицу-модификатор глутамат-цистеин лигазы (GCLM) [75, 76].
Действие света или H2O2 вызывают активацию в РПЭ и сетчатке таких ферментов АОЗ как супероксиддисмутазы (SOD), пероксиредоксины (PRDX), каталазы (CAT), глутатионпероксидазы (GPX) [77–79]. SOD – металлофермент, который катализирует превращение ${}^{\centerdot }{\text{O}}_{2}^{ - }$ в H2O2. С использованием генетических моделей млекопитающих (мышей) показано, что мутации SOD1–/– и SOD2–/– обусловливают высокую восприимчивость к ОС, патологическую неоваскуляризацию и дегенерацию сетчатки [80, 81]. Основной функцией PRDX является восстановление пероксидов (H2O2, алкилгидропероксиды и др.) в результате окисления тиоловой группы (R-SH) цистеина в активном центре этого фермента до сульфоновой кислоты (R-SOH) [77]. CAT превращают H2O2, которая образуется в результате β-окисления жирных кислот в пероксисомах, в воду и кислород. В РПЭ содержание CAT на порядок выше, чем в других тканях глаза [82]. GPX является ферментом, “нейтрализующим” H2O2 при низком уровне ОС. У млекопитающих описано 7 изоформ GPX. GPX4 широко представлен у позвоночных, обладающих развитой нервной системой и имеющих ПЖК в составе плазматических мембран. GPX4 содержит в своем составе селеноцистеин и катализирует расщепление H2O2 до H2O в цитозоле или восстановление гидроперекисей липидов в спирты, используя глутатион в качестве восстанавливающего агента [79]. Снижение активности GPX4 в РПЭ и фоторецепторах повышает их чувствительность к ОС [83].
Еще одна группа ферментов (дегидрогеназы, липазы, пептидазы, протеазы, трансферазы, ферменты репарации ДНК) участвуют в восстановлении или элиминации поврежденных биомолекул в РПЭ [43, 84]. АФК, генерируемые в РПЭ через электронно-транспортную цепь под воздействием света, кислорода, окислительного фосфорилирования, могут восстанавливаться с помощью систем NADPH, глутатиона и антиоксидантных ферментов [77, 79]. NADPH-оксидазы участвуют в регуляции клеточных сигнальных каскадов – наиболее изученный механизм их действия – окисление редокс-активных цистеинов в активном центре протеинфосфатаз. Показано участие протеинтирозинфосфатазы 26 (PTPN26) в фосфорилировании белков-компонентов сигнальных путей, управляющих пролиферацией, гибелью, дифференцировкой, метаболизмом клеток РПЭ [85].
Компоненты антиоксидантной защиты с функциями шаперонов и хелаторов ионов металла. Важным аспектом, негативно влияющим на стабильность клеток РПЭ, является нарушение метаболизма железа, накопление которого токсично для клеток и связано со снижением аутофагии и эффективности хелатирующих агентов [86]. В РПЭ функцию фотозащиты и антиоксиданта, нейтрализующего АФК, выполняет меланин, посредством хелатирования редокс-активных ионов железа и меди, связывания свободных радикалов (главным образом, синглетный кислород 1O2) [87]. Меланин взаимодействует с анионами •O2, вызывая их окисление в молекулярный кислород, а также способен восстановливать •O2 до H2O2 [88]. Присутствующий в РПЭ железосвязывающий цитозольный и митохондриальный ферритин хелатирует и “нейтрализует” ионы железа, которые способны катализировать образование гидроксильного радикала ·OH, снижая их концентрацию [89].
Другим эндогенным белком с металлосвязывающими свойствами является металлотионеин (Мт), который содержит большое количество остатков серина и активируется, помимо ОС, глюкокортикоидами и ионами тяжелых металлов, такими как цинк, медь и ртуть, действуя в качестве “поглотителя” свободных радикалов [90]. Эволюция форм Мт, также как и SOD, непосредственно связана с появлением в земной атмосфере свободного кислорода. У млекопитающих число изоформ Мт достигает максимума, появляются две дополнительные группы Мт, специфичные для нейральной ткани и многослойных слущивающихся эпителиев [91].
В клетках РПЭ конститутивно экспрессируются шапероны: DJ-1 [92], антиоксидант/шаперон α-1 микроглобулин, связывающий АФК [93], низкомолекулярные шапероны (sHSP). Основная роль шаперонов состоит в предотвращении внутриклеточного накопления цитотоксических белков и регуляции фолдинга белков [94]. sHSP обнаружены во всех доменах живых организмов и, по-видимому, эволюционировали независимо у многоклеточных животных (Eumetazoa), грибов и растений. sHSP содержат эволюционно консервативный домен α-кристаллинов и вариабельные N- и C-концевые последовательности, которые эволюционировали независимо друг от друга. α-кристаллины препятствуют апоптозу клеток РПЭ, участвуя в активации реакций фосфорилирования в сигнальном пути PI3K/Akt, что обеспечивает устойчивость клеток РПЭ к ОС. αB-кристаллин обеспечивает восстановление уровня GSH в митохондриях [79]. У мышей с нокаутом генов αA- и αB-кристаллинов в условиях ОС наблюдали накопление АФК клетками РПЭ и последующую дегенерацию фоторецепторов [95, 96]. В геноме человека, кроме αA- и αB-кристаллинов, представлены еще восемь sHSP. ОС вызывает снижение уровня АТФ в клетках РПЭ и сетчатки, в числе первых защитных факторов начинают действовать АТФ-независимые sHSP. Активация HSPB1 (HSP27) приводит к блокаде Ca2+-индуцируемого апоптоза в результате ингибирования каспазы-3 и предотвращения выхода цитохрома С из митохондрий в цитоплазму [97]. После частичного восстановления клеток включается экспрессия индуцируемого стрессом АТФ-зависимого шаперона HSP70, который поддерживает окислительно-восстановительный гомеостаз, путем восстановления активности GPX и глутатионредуктазы. Снижение уровня глутатиона при ОС ведет к накоплению продуктов ПОЛ и гибели клеток путем ферроптоза [98]. HSP70 также участвует в регуляции опосредованного аутофагией протеолиза белков в РПЭ [99].
Шаперон HSP70 и близкий ему белок HSP110 являются наиболее эволюционно консервативными. Процент идентичности гомологов белков этих семейств у прокариот и эукариот достигает 50%. У человека насчитывается 13 генов HSP70, причем два из них видоспецифичны и отсутствуют у других позвоночных. В геноме ряда рыб обнаружены множественные копии генов HSP70, что, очевидно, является следствием дупликации генома [100].
Низкомолекулярные антиоксиданты включают жирорастворимые и водорастворимые. Жирорастворимые антиоксиданты (α-токоферол, убихинон кофермент Q10, витамин A, каротиноиды) локализуются в основном в мембранах митохондрий и лизосом, обеспечивая защиту липидов от перекисного окисления, за счет прерывания автокаталитической реакции ПОЛ [98, 101]. Водорастворимые антиоксиданты (витамин С, глутатион, флавоноиды) локализуются в цитозоле, где они действуют как “поглотители” АФК. Витамин C необходим для поддержания метаболизма ионов железа, обеспечения восстановления Fe3+ до Fe2+ [102]. Большинство позвоночных способны синтезировать витамин C из глюкозы в печени (млекопитающие), в почках (рыбы, амфибии, рептилии). Однако некоторые млекопитающие (человек, морская свинка, летучие мыши) утратили способность к синтезу витамина C [103].
СИГНАЛЬНЫЕ ПУТИ, ИНДУЦИРОВАННЫЕ ОКИСЛИТЕЛЬНЫМ СТРЕССОМ, И МОЛЕКУЛЯРНЫЕ МИШЕНИ В РЕТИНАЛЬНОМ ПИГМЕНТНОМ ЭПИТЕЛИИ
Наиболее стабильные виды АФК (H2O2, оксид азота) служат посредниками в межклеточной передаче сигналов, фосфорилировании белков, метаболизме нуклеотидов [104]. Под влиянием умеренного ОС в РПЭ и фоторецепторах активируются сигнальные пути АОЗ, тогда как интенсивный и продолжительный ОС запускает сигнальные пути запрограммированной гибели клеток, формы которой (апоптоз, пироптоз, ферроптоз, некроптоз) превалируют в той или иной степени, в зависимости от интенсивности ОС и степени деструкции клеток [48, 105]. Апоптоз и пироптоз наблюдаются у всех многоклеточных, хотя могут обеспечиваться различными сигнальными путями. Наиболее “молодой” формой гибели клеток является некроптоз, который появляется у млекопитающих [106].
Факторы стресса могут вызывать апоптоз с использованием внешнего или внутреннего сигнальных путей. Каспаза-зависимые сигнальные пути, как внешний, так и внутренний, вовлечены в начальные стадии развития ОС в РПЭ. Внешний (рецептор-зависимый) апоптоз в РПЭ может запускаться двумя типами рецепторов на плазматической мембране: FAS (CD95) и рецепторами фактора некроза опухоли (TNFR1), которые активируют сигнальные каскады, с участием каспаз [107]. Внутренний путь апоптоза инициируется повреждением клеток, с высвобождением цитохрома С из пермеабилизированных митохондрий. Оба пути активируют эффекторный протеолитический фермент каспазу-3 [106]. Количество генов, кодирующих каспазы, варьирует у разных видов [108].
Ключевые ОС-зависимые сигнальные пути апоптоза в клетках РПЭ опосредованы каскадами протеинкиназ: JNK/SAPK (c-Jun N-terminal kinase/Stress activated protein kinase), p38, ASK1 (Apoptosis signal-regulating kinase 1), PKC (Protein kinase C) [48, 109]. Процессы ПОЛ в РПЭ человека значительно усиливаются при гипоксии, часто сопровождающей ОС. В перинуклеарном пространстве происходит накопление HIF-1α, NF-kB, синтез VEGF, каспазы-3 и поли(АДФ-рибоза)-полимеразы, что связано с развитием апоптоза [17, 110].
Среди всех АФК наиболее изучено действие на клетки РПЭ экзогенной H2O2. В нескольких работах показано, что Н2О2 в физиологическом диапазоне концентраций (1 нМ до 0.1–0.5 мкМ) действует как сигнальная молекула, активирует рецептор-зависимую стимуляцию пролиферации клеток, опосредованно оказывая влияние на экспрессию генов [110, 111]. Низкие концентрации H2O2 индуцируют в РПЭ чувствительные к ОС сигнальные пути, в которые вовлечены факторы транскрипции Nrf2, Keap1 и активируемые ими антиоксидантные ферменты, что приводит к стимуляции пролиферации и увеличению жизнеспособности клеток [112].
Более высокие концентрации H2O2 вызывают умеренный ОС в РПЭ, сопровождаемый воспалительными реакциями с участием NF-kB и AP-1 [110] и гибелью клеток путем пироптоза. Обработка клеток РПЭ человека in vitro H2O2 в течение 24 ч индуцирует мобилизацию кальция, усиленную продукцию провоспалительных цитокинов IL-6, IL-8, фосфорилирование белков p38, MAPK, ERK, JNK и ICAM-1, перинуклеарное накопление фактора транскрипции NF-κB, продукцию HIF-1α [111].
Сильно выраженный ОС вызывает накопление продуктов ПОЛ (акролеин и др.), нарушение целостности и деполяризацию мембран митохондрий, стимулирует продукцию АФК поврежденными митохондриями [105]. Развивающиеся молекулярные процессы в РПЭ и фоторецепторах сетчатки на фоне накопления продуктов гликолитического распада и полиолов связаны с нарушениями функций Nrf2, мембранных транспортеров и митохондрий, что ведет к апоптозу или некроптозу клеток [113]. Избыточная продукция АФК (H2O2) повышает активность кальциевой АТФазы в РПЭ и нейронах, приводит к снижению внутриклеточного и возрастанию внеклеточного уровня АТФ [114], активации пуринорецепторов P2RX7, индуцирует приток внеклеточного Ca2+ в клетку. Ca2+ активирует окислительные ферменты (DUOX1, NADPH-оксидазу), стимулируя быстрый выброс H2O2. Эти процессы сопровождаются снижением активности глицеральдегид-3-фосфат дегидрогеназы (GAPDH), активацией сигнального пути с участием PKC, приводят к подщелачиванию лизосом, накоплению ЛФ, образованию друз, содержащих окисленные формы липопротеинов, повышают уязвимость клеток РПЭ к ОС, вызывая их гибель по пути апоптоза или некроза [115].
Существует перекрестная связь между митохондриями и лизосомами при апоптозе клеток РПЭ, вызванном ОС. Пермеабилизация мембран лизосом (ПМЛ) является ранним событием во многих случаях апоптоза. Высвобождаемые лизосомальные ферменты пермеабилизуют мембраны митохондрий, что еще более усиливает продукцию АФК и ПМЛ [99]. Если ПМЛ не является триггерным событием апоптоза, этот процесс индуцируется на более поздних стадиях несколькими механизмами, усиливающими сигналы гибели клеток. Процесс опосредован действием высвобождаемых катепсинов, участвующих в каспаза-независимом сигнальном пути апоптоза клеток РПЭ. На линии клеток ARPE-19 человека показано, что окислительный стрессор 7-кетохолестерол индуцирует стресс ЭПР, каспаза-зависимый апоптоз в результате использования опосредованных рецепторами сигнальных путей с участием каспаз-8 и -12 [116]. При этом в клетках РПЭ не было выявлено активации митохондриального пути апоптоза, с участием каспазы-9, что, как предполагается, может объясняться возрастанием активности белков теплового шока, препятствующих расщеплению (активации) каспазы-9 во время инициации апоптоза [95, 117]. Каспаза-12 в неактивном состоянии локализуется на цитозольной поверхности ЭПР, при ОС она запускает каскад реакций, приводящий к активации эффекторной каспазы-3 [116].
В экспериментах, моделирующих в РПЭ ОС действием H2O2, с использованием нокдауна и/или специфических блокаторов, обнаружена роль ряда генов, участвующих в регуляции аутофагии. В клетках ARPE-19, обработанных ингибитором внутриклеточных регуляторов рН и обмена ионов Na+/H+ (5-N, N-гексаметилен)-амилоридом (HMA), происходит активация этого процесса. Применение ингибиторов протеасом стимулирует процесс аутофагии клеток РПЭ, в результате ингибирования сигнального пути PI3K-Akt-mTOR [118, 119]. Предполагается, что индукция аутофагии может быть общей реакцией клеток РПЭ и важным механизмом, обеспечивающим их устойчивость и стабильность в условиях умеренного ОС [105]. Другим аспектом действия H2O2 является усиление секреции клетками РПЭ трансформирующего фактора роста TGFβ, который стимулирует продукцию ангиогенного фактора роста сосудов VEGF и нейротрофического фактора TNFα [120, 121]. Накопление в РПЭ окисленных фосфолипидов усиливает ATF4-зависимую секрецию VEGF, опосредованную протеинкиназой CK2 [122].
Механизмы действия ОС на дифференцировочный статус клеток РПЭ включают множественные сигнальные пути, которые используют общие компоненты и могут действовать антагонистически. В настоящее время наиболее эффективными стратегиями восстановления функций РПЭ при различных дегенеративных заболеваниях остаются стратегии, направленные на мобилизацию эндогенных защитных систем клеток, которые обеспечивают предотвращение ОС и преодоления его последствий [123–125]. Возможные способы стабилизации функционального состояния клеток РПЭ нацелены на акцепторы АФК, восстановление метаболизма пограничных тканей (фоторецепторов, сосудистой оболочки), стабилизацию МБ. Особого внимания, в связи с этим, заслуживает регуляция важных звеньев системы АОЗ, в которых участвует Nrf2 [112, 113].
Предлагаемые стратегии терапии патологий, ассоциированных с ОС-зависимым эпителиально-мезенхимным переходом (ЭМП) в РПЭ, направлены на прямую нейтрализацию АФК с помощью экзогенных антиоксидантов [126, 127], подавление продукции АФК путем снижения экспрессии прооксидантных генов и активности ферментов прооксидантной системы, активацию аутофагии, образование аутолизосом [52, 128], индукцию экспрессии антиоксидантного фактора транскрипции Nrf2 [64, 75, 76, 112], активацию HO-1 [126], SIRT-1 [129], GPХ, SOD и CAT [130–133], регуляцию редокс-чувствительных микро РНК [134, 135], использование хелаторов железа [136].
Молекулярными мишенями для терапии ОС могут являться NADPH-оксидазы, фактор эндотелия сосудов VEGF, под влиянием которого усиливается продукция АФК NADPH-оксидазами [137], каспаза-3 [138], индуцируемый гипоксией фактор HIF-1α [139]. Ингибиторы протеасом стимулируют аутофагию клеток РПЭ, в результате блокирования сигналов PI3K-Akt-mTOR [119]. Стимуляция пуринорецепторов A2AR обеспечивает поддержание баланса между АТФ и аденозином в РПЭ, постоянство уровня cAMP и рН лизосом, препятствует избыточному накоплению ЛФ [140, 141]. Активация металлопротеиназ MMP-14 и TIMP2 [142], сигнального пути ERK/CREB [143], сигналов, запускаемых через рецепторы TLR3 (Toll-like receptor 3) защищает клетки РПЭ от негативного действия H2O2 [144]. Действие азапептидных лигандов направлено на поддержание процесса аутофагии и восстановление окислительно-восстановительного гомеостаза РПЭ [133, 145].
ОКИСЛИТЕЛЬНЫЙ СТРЕСС И СТРАТЕГИИ ОТВЕТА КЛЕТОК РЕТИНАЛЬНОГО ПИГМЕНТНОГО ЭПИТЕЛИЯ ПРИ ПОВРЕЖДЕНИИ
Ранние события при нарушении целостности РПЭ при повреждении или патологии у позвоночных в ответ на ОС универсальны, характеризуются развитием реакций воспаления, направленных на защиту и выживание клеток. Разобщение связи РПЭ и фоторецепторов приводит к изменению полярности клеток РПЭ, ремоделированию МБ и плотных контактов, реорганизации ВКМ, интерфоторецепторного матрикса, цитоскелета, в норме обеспечивающих стабильное состояние клеток. Нарушение барьерных функций РПЭ сопровождается усилением продукции АФК. Эти изменения нарушают баланс факторов микроокружения РПЭ, вызывая повышение продукции проокислительных и снижение противовоспалительных факторов [19, 146].
Важным аспектом изменений межклеточных взаимодействий РПЭ, сопровождаемых ОС, является проявление свойств пластичности клеток РПЭ [5, 146]. У млекопитающих ОС, возникающий при разобщении контактов РПЭ и фоторецепторов (отслойка сетчатки), является триггером дедифференцировки клеток РПЭ [12], запуска их конверсии по пути возникновения мезенхимного фенотипа и фиброзной ткани [13]. В то же время у хвостатых амфибий разобщение связи РПЭ и фоторецепторов запускает трансдифференцировку (конверсию) клеток РПЭ в фенотип нейронов и глии. В итоге происходит восстановление структуры и функций как всех слоев сетчатки, так и собственно слоя РПЭ (редифференцировка) [147]. В тканях этих животных большинство процессов, часто рассматриваемых с точки зрения физиологии как разрушительные и направленные на защиту клетки (реакции воспаления, иммунный ответ, гибель клеток, продукция АФК, активация белков стресса), могут выполнять позитивную роль в регенерации. Так, АФК рассматриваются в качестве ведущих кандидатов для триггерных сигналов активации и поддержания регенерации тканей у хвостатых амфибий [148, 149]. При повреждении мозга у взрослых тритонов в ткани присходит запуск репаративного нейрогенеза, необходимого для компенсации погибающих нейронов. Однако интенсивность этого процесса снижается при ингибировании продукции АФК [149]. Ранее полученные на модели регенерации аксонов нейронов у рыб сведения свидетельствуют в пользу предположения о позитивной роли H2O2 в регенерации [150]. Данные цитируемых работ позволяют выдвинуть предположение о том, что низкие концентрации АФК могут быть использованы животными, обладающими высокими способностями к регенерации, для активации программ восстановления ткани. В частности, они могут быть задействованы в механизмах замещения утраченных нейронов из эндогенных клеточных резервов, путем трансдифференцировки клеток РПЭ у хвостатых амфибий. Предполагается, что возникшие в ходе эволюции ОС-зависимые механизмы защиты РПЭ способствуют предотвращению патологического ЭМП клеток РПЭ у хвостатых амфибий, в отличие от млекопитающих. Разные стратегии поведения клеток РПЭ позвоночных, в ответ на действие ОС, могут находить объяснение в особенностях сигнальных путей (доменной организации ключевых компонентов и их экспрессии), формирующих защитные системы клетки.
ЗАКЛЮЧЕНИЕ
Длительная эволюция в аэробных условиях привела к развитию систем защиты, которые обеспечивают адаптацию позвоночных к условиям среды обитания и клеточный ответ на действие стресса [151, 152]. Дисфункция РПЭ под действием эндогенных или экзогенных факторов, сопровождаемая нарушениями межклеточных взаимодействий и окислительно-восстановительного баланса, может вызывать изменение фенотипических свойств РПЭ (рис. 1, 2). Длительный и интенсивный ОС приводит к глобальным изменениям метаболизма клеток РПЭ, нарушению активности системы АОЗ и, в конечном итоге, к серьезным патологиям сетчатки [29, 48].
Проведенный анализ литературы позволил выявить как консерватизм, так и вариабельность основных компонентов сигнальных путей, связанных с поддержанием гомеостаза и обеспечивающих защиту клеток РПЭ от разрушительного действия ОС. Консервативность основных элементов системы АОЗ позволяет использовать модельные организмы для изучения молекулярно-генетических механизмов ОС-зависимых патологий РПЭ человека, разрабатывать стратегии их предотвращения и терапии. Ключевые эволюционно-консервативные молекулярные звенья ОС-зависимых сигнальных путей, изучаемые на моделях РПЭ экспериментальных животных и клеточных системах РПЭ человека, могут служить потенциальными мишенями для селективных ингибиторов компонентов провоспалительных сигнальных путей и ЭМП, или активации АОЗ в РПЭ [23, 27, 60]. Несмотря на прогресс в изучении механизмов ОС-ассоциированных патологий РПЭ, до сих пор не удалось разработать эффективных методов стабилизации состояния РПЭ и блокирования развития дегенеративных процессов на ранних стадиях. Во многом это обусловлено различиями метаболизма РПЭ и нейральных слоев сетчатки, многофакторностью патологий, в которые также вовлечены клетки микроокружения (иммунного звена, эндотелиоциты сосудистой оболочки) [48, 113, 125]. Идентифицированные в РПЭ молекулярные мишени, как было отмечено, могут объединять несколько сигнальных путей, в том числе антагонистические [6, 10, 113]. Кроме того, данные, получаемые на разных модельных объектах, демонстрируют важность учета таксон-специфических особенностей структуры генома и активности регуляторных систем [106]. Филогенетический анализ ключевых ОС-связанных факторов транскрипции семейства Nrf2 [54, 57] и других компонентов АОЗ [79, 91, 100] позвоночных обнаруживает как консервативность, так и вариабельность доменной структуры кодируемых белков, что может иметь адаптационное значение к условиям среды и обусловливать различия клеточного ответа РПЭ.
Восприимчивость и устойчивость клеток РПЭ к ОС, помимо особенностей функционирования системы АОЗ, может объясняться различной степенью вклада внутриклеточных компартментов в продукцию АФК. К настоящему моменту остаются нерешенными многие вопросы, касающиеся взаимосвязи системы АОЗ с другими эндогенными системами в механизмах регуляции поведения клеток РПЭ (пластичности), в ответ на ОС (при повреждении) у позвоночных с различающимся потенциалом к восстановлению РПЭ. Это подчеркивает фундаментальную значимость изучения эволюции метаболических и сигнальных путей действия АФК, в контексте механизмов эндогенных систем защиты, с целью поиска способов обеспечения стабильности гомеостаза и дифференцировки клеток РПЭ в условиях окислительного повреждения у млекопитающих при травме и патологии.
Список литературы
Mendez-Romero O, Ricardez-García C, Castañeda-Tamez P, Chiquete-Félix N, Uribe-Carvajal S (2022) Thriving in Oxygen While Preventing ROS Overproduction: No Two Systems Are Created Equal. Front Physiol 13: 874321. https://doi.org/10.3389/fphys.2022.874321
Di Meo S, Venditti P (2020) Evolution of the Knowledge of Free Radicals and Other Oxidants. Oxid Med Cell Longev 2020: 9829176. https://doi.org/10.1155/2020/9829176
Country MW (2017) Retinal metabolism: A comparative look at energetics in the retina. Brain Res 1672: 50–57. https://doi.org/10.1016/j.brainres.2017.07.025
Damsgaard C, Lauridsen H, Funder AM, Thomsen JS, Desvignes T, Crossley DA 2nd, Møller PR, Huong DT, Phuong NT, Detrich HW 3rd, Brüel A, Wilkens H, Warrant E, Wang T, Nyengaard JR, Berenbrink M, Bayley M (2019) Retinal oxygen supply shaped the functional evolution of the vertebrate eye. Elife 8: e52153. https://doi.org/10.7554/eLife.52153
Fuhrmann S, Zou CJ, Levine E (2014) Retinal pigment epithelium development, plasticity, and tissue homeostasis. Exp Eye Res 123: 141–150. https://doi.org/10.1016/j.exer.2013.09.003
Amram B, Cohen-Tayar, David A, Ashery-Padan R (2017) The retinal pigment epithelium – from basic developmental biology research to translation approaches. Int J Dev Biol 61 (3–4–5): 225–234. https://doi.org/10.1387/ijdb.160393ra
Cunha-Vaz J, Bernardes R, Lobo C (2011) Blood-retinal barrier. Eur J Ophthalmol 21 Suppl (6):3–9. https://doi.org/10.5301/EJO.2010.6049
Chen M, Rajapakse D, Fraczek M, Luo Chang, Forrester John V, Xu Heping (2016) Retinal pigment epithelial cell multinucleation in the aging eye – A mechanism to repair damage and maintain homoeostasis. Aging Cell 15 (3): 436–445. https://doi.org/10.1111/acel.12447
Godley BF, Shamsi FA, Liang FQ, Jarrett SG, Davies S, Boulton M (2005) Blue light induces mitochondrial DNA damage and free radical production in epithelial cells. J Biol Chem 280 (22): 21061–21066. https://doi.org/10.1074/jbc.M502194200
Nebbioso M, Franzone F, Lambiase A, Bonfiglio V, Limoli PG, Artico M, Taurone S, Vingolo EM, Greco A, Polimeni A (2022) Oxidative Stress Implication in Retinal Diseases-A Review. Antioxidants (Basel) 11 (9): 1790. https://doi.org/10.3390/antiox11091790
Mitter SK, Song C, Qi X, Mao H, Rao H, Akin D, Lewin A, Grant M, Dunn Jr W, Ding J, Rickman CB, Boulton M (2014) Dysregulated Autophagy in the RPE Is Associated with Increased Susceptibility to Oxidative Stress and AMD. Autophagy 10 (11): 1989–2005. https://doi.org/10.4161/auto.36184
Markitantova YuV, Simirskii VN (2020) Role of the Redox System in Initiation of a Regenerative Response of Neural Eye Tissues in Vertebrates. Russ J Dev Biol 51 (1): 16–30.https://doi.org/10.1134/s106236042001004x
Grigoryan EN, Markitantova YV (2016) Cellular and molecular preconditions for retinal pigment epithelium (RPE) natural reprogramming during retinal regeneration in Urodela. Biomedicines 4 (4): 28. https://doi.org/10.3390/biomedicines4040028
Sousounis K, Bhavsar R, Looso M, Krüger M, Beebe J, Braun T, Tsonis PA (2014) Molecular signatures that correlate with induction of lens regeneration in newts: lessons from proteomic analysis. Hum Genomics 8 (1): 22. https://doi.org/10.1186/s40246-014-0022-y
Azzam EI, Jay-Gerin JP, Pain D (2012) Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury. Cancer Lett 327 (1–2): 48–60. https://doi.org/10.1016/j.canlet.2011.12.012
Roehlecke C, Schumann U, Ader M, Brunssen C, Bramke S, Morawietz H, Funk RHW (2013) Stress reaction in outer segments of photoreceptors after blue light irradiation. PLoS One 8: e71570: 1–12. https://doi.org/10.1371/journal.pone.0071570
Cervellati F, Cervellati C, Romani A, Cremonini E, Sticozzi C, Belmonte G, Pessina F, Valacchi G (2014) Hypoxia induces cell damage via oxidative stress in retinal epithelial cells. Free Radic Res 48 (3): 303–312. https://doi.org/10.3109/10715762.2013.867484
George SM, Lu F, Rao M, Leach LL, Gross JM (2021) The retinal pigment epithelium: Development, injury responses, and regenerative potential in mammalian and non-mammalian systems. Prog Retin Eye Res 85: 100969. https://doi.org/10.1016/j.preteyeres.2021.100969
Caceres PS, Rodriguez-Boulan E (2020) Retinal Pigment Epithelium Polarity in Health and Blinding Diseases. Curr Opin Cel Biol 62: 37–45. https://doi.org/10.1016/j.ceb.2019.08.001
Kaemmerer E, Schutt F, Krohne TU, Holz FG, Kopitz J (2007) Effects of lipid peroxidation-related protein modifications on RPE lysosomal functions and POS phagocytosis. Invest Ophthalmol Vis Sci 48 (3): 1342–1347. https://doi.org/10.1167/iovs.06-0549
Sinha D, Valapala M, Shang P, Hose S, Grebe R, Lutty GA, Zigler Jr JS, Kaarniranta K, Handa JT (2016) Lysosomes: regulators of autophagy in the retinal pigmented epithelium. Exp Eye Res (144): 46–53. https://doi.org/10.1016/j.exer.2015.08.018
Zadto A, Ito S, Sarna M, Wakamatsu K, Mokrzyński K, Sarna T (2020) The role of hydrogen peroxide and singlet oxygen in the photodegradation of melanin. Photochem Photobiol Sci (19): 654–667. https://doi.org/10.1039/C9PP00481E
Pan WW, Wubben TJ, Besirli CG (2021) Photoreceptor metabolic reprogramming: current understanding and therapeutic implications. Commun Biol 4 (1): 245. https://doi.org/10.1038/s42003-021-01765-3
Masutomi K, Chen C, Nakatani K, Koutalos Y (2012) All-trans retinal mediates light-induced oxidation in single living rod photoreceptors. Photochem Photobiol 88 (6): 1356–1361. https://doi.org/10.1111/j.1751-1097.2012.01129.x
Kaarniranta K, Koskela A, Felszeghy S, Kivinen N, Salminen A, Kauppinen A (2019) Fatty acids and oxidized lipoproteins contribute to autophagy and innate immunity responses upon the degeneration of retinal pigment epithelium and development of age-related macular degeneration. Biochimie 159: 49–54. https://doi.org/10.1016/j.biochi.2018.07.010
Sparrow JR, Hicks D, Hamel C (2010) The retinal pigment epithelium in health and disease. Curr Mol Med (10): 802–823. https://doi.org/10.2174/156652410793937813
Zhang ZY, Sun YJ, Song JY, Fan B, Li G-Yu (2021) Experimental models and examination methods of retinal detachment. Brain Res Bull (169): 51–62. https://doi.org/10.1016/j.brainresbull.2021.01.004
Erler P, Monaghan JR (2015) The link between injury-induced stress and regenerative phenomena: A cellular and genetic synopsis. Biochim Biophys Acta 1849 (4): 454–461. https://doi.org/10.1016/j.bbagrm.2014.07.021
Bailey TA, Kanuga N, Romero IA, Greenwood J, Luthert PJ, Cheetham ME (2004) Oxidative stress affects the junctional integrity of retinal pigment epithelial cells. Invest Ophthalmol Vis Sci 45 (2): 675–684. https://doi.org/10.1167/iovs.03-0351
Hua J, Chen H, Chen Y, Zheng G, Li F, Qu J, Ma X, Hou L (2018) MITF acts as an anti-oxidant transcription factor to regulate mitochondrial biogenesis and redox signaling in retinal pigment epithelial cells. Exp Eye Res 170: 138–147. https://doi.org/10.1016/j.exer.2018.02.023
Ray PD, Huang BW, Tsuji Y (2012) Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling. Cell Signal 24 (5): 981–990. https://doi.org/10.1016/j.cellsig.2012.01.008
Lacy F, Gough DA, Schmid-Schonbein GW (1998) Role of xanthine oxidase in hydrogen peroxide production. Free Radic Biol Med 25 (6): 720–727. https://doi.org/10.1016/S0891-5849(98)00154-3
Guerra MH, Yumnamcha T, Singh LP, Ibrahim AS (2021) Relative Contribution of Different Mitochondrial Oxidative Phosphorylation Components to the Retinal Pigment Epithelium Barrier Function: Implications for RPE-Related Retinal Diseases. Int J Mol Sci 22 (15): 8130. https://doi.org/10.3390/ijms22158130
Usui S, Oveson BC, Iwase T, Lu L, Lee SY, Jo Y-J, Wu Z, Choi E-Y, Samulski RJ, Campochiaro PA (2011) Overexpression of SOD in retina: need for increase in H2O2-detoxifying enzyme in same cellular compartment. Free Radic Biol Med 51 (7): 1347–1354. https://doi.org/10.1016/j.freeradbiomed.2011.06.010
Brennan AM, Suh SW, Won SJ (2009) NADPH oxidase is the primary source of superoxide induced by NMDA receptor activation. Nat Neurosci 12 (7): 857–863. https://doi.org/110.1038/nn.2334
Buvelot H, Jaquet V, Krause KH (2019) Mammalian NADPH Oxidases. In: Knaus U, Leto T (eds) NADPH Oxidases. Methods Mol Biol 1982: 17–36. https://doi.org/10.1007/978-1-4939-9424-3_2
Massari M, Nicoll CR, Marchese S, Mattevi A, Mascotti ML (2022) Evolutionary and structural analyses of the NADPH oxidase family in eukaryotes reveal an initial calcium dependency. Redox Biol 56: 102436. https://doi.org/10.1016/j.redox.2022.102436
Boulton M, Dontsov A, Jarvis-Evans J, Ostrovsky M, Svistunenko D (1993) Lipofuscin is a photoinducible free radical generator. J Photochem Photobiol Biol 19: 201–204. https://doi.org/10.1016/1011-1344(93)87085-2
Dontsov AE, Sakina NL, Ostrovsky MA (2017) Loss of melanin by eye retinal pigment epithelium cells is associated with its oxidative destruction in melanolipofuscin granules. Biochemistry (Moscow) 82: 916–924. https://doi.org/10.1134/S0006297917080065
Dontsov AE, Sakina NL, Koromyslova AD, Ostrovsky MA (2015) Effect of UV radiation and hydrogen peroxide on the antiradical and antioxidant activities of DOPA-melanin and melanosomes from retinal pigment epithelial cells. Russian Chemical Bulletin 64: 1623–1628. https://doi.org/10.1007/s11172-015-1051-y
Shamsi FA, Boulton M (2001) Inhibition of RPE lysosomal and antioxidant activity by the age pigment lipofuscin. Invest Ophthalmol Vis Sci 42: 3041–3046.
Lismont C, Revenco, I, Fransen M (2019) Peroxisomal Hydrogen Peroxide Metabolism and Signaling in Health and Disease. Int J Mol Sci 20: 3673. https://doi.org/10.3390/ijms20153673
Camoes F, Islinger M, Guimarães SC, Kilaru S, Schuster M, Godinho LF, Steinberg G, Schrader M (2015) New insights into the peroxisomal protein inventory: Acyl-CoA oxidases and -dehydrogenases are an ancient feature of peroxisomes. Biochim Biophys Acta 1853 (1): 111–125. https://doi.org/10.3389/fphys.2013.00261
Zhang SX, Sanders E, Fliesler SJ, Wang JJ (2014) Endoplasmic reticulum stress and the unfolded protein responses in retinal degeneration. Exp Eye Res (125): 30–40. https://doi.org/10.1016/j.exer.2014.04.015
Shao X, Guha S, Lu W, Campagno KE, Beckel JM, Mills JA, Yang W, Mitchell CH (2020) Polarized Cytokine Release Triggered by P2X7 Receptor from Retinal Pigmented Epithelial Cells Dependent on Calcium Influx. Cells 9 (12): 2537. https://doi.org/10.3390/cells9122537
Bazan NG (2006) Survival signaling in retinal pigment epithelial cells in response to oxidative stress: significance in retinal degenerations. Adv Exp Med Biol 572: 531–540. https://doi.org/10.1007/0-387-32442-9_74
Newman AM, Gallo NB, Hancox LS, Miller NJ, Radeke CM, Maloney M, Cooper JB, Hageman GS, Anderson DH, Johnson LV, Radeke MJ (2012) Systems-level analysis of age-related macular degeneration reveals global biomarkers and phenotype-specific functional networks. Genome Med 4 (16): 1–18.
Zhang M, Jiang N, Chu Y, Postnikova O, Varghese R, Horvath A, Cheema AK, Golestaneh N (2020) Dysregulated metabolic pathways in age-related macular degeneration. Sci Rep (10): 2464. https://doi.org/10.1038/s41598-020-59244-4
Voigt AP, Mulfaul K, Mullin NK, Flamme-Wiese MJ, Giacalone JC, Stone EM, Tucker BA, Scheetz TE, Mullins RF (2019) Single-cell transcriptomics of the human retinal pigment epithelium and choroid in health and macular degeneration. Proc Nat Acad Sci USA 116 (48): 24100–24107. https://doi.org/10.1073/pnas.1914143116
Meyer JG, Garcia TY, Birgit Schilling B, Gibson Bradford W, Lamba DA (2019) Proteome and Secretome Dynamics of Human Retinal Pigment Epithelium in Response to Reactive Oxygen Species. Sci Rep 9: 15440. https://doi.org/10.1038/s41598-019-51777-7
Jin HL, Jeong KW (2022) Transcriptome Analysis of Long-Term Exposure to Blue Light in Retinal Pigment Epithelial Cells. Biomol Ther (Seoul) 30: 291–297. https://doi.org/10.4062/biomolther.2021.155
Shao Z, Chwa M, Atilano SR, Park J, Karageozian H, Karageozian V, Kenney MC (2022) The Transcriptome Profile of Retinal Pigment Epithelium and Müller Cell Lines Protected by Risuteganib Against Hydrogen Peroxide Stress. J Ocul Pharmacol Ther 38 (7): 513–526. https://doi.org/10.1089/jop.2022.0015
Maher J, Yamamoto M (2010) The rise of antioxidant signaling–the evolution and hormetic actions of Nrf2. Toxicol Appl Pharmacol 244 (1): 4–15. https://doi.org/10.1016/j.taap.2010.01.011
Fuse Y, Kobayashi M (2017) Conservation of the Keap1-Nrf2 System: An Evolutionary Journey through Stressful Space and Time. Molecules 22 (3):436. https://doi.org/10.3390/molecules22030436
Holmström KM, Baird L, Zhang Y, Hargreaves I, Chalasani A, Land JM, Stanyer L, Yamamoto M, Dinkova-Kostova AT, Abramov AY (2013) Nrf2 impacts cellular bioenergetics by controlling substrate availability for mitochondrial respiration. Biol Open 2 (8): 761–770. https://doi.org/10.1242/bio.20134853
Gacesa R, Dunlap WC, Barlow DJ, Laskowski RA, Long PF (2016) Rising levels of atmospheric oxygen and evolution of Nrf2. Sci Rep 6: 27740. https://doi.org/10.1038/srep27740
Saha S, Buttari B, Panieri E, Profumo E, Saso L (2020) An Overview of Nrf2 Signaling Pathway and Its Role in Inflammation. Molecules 25 (22): 5474. https://doi.org/10.3390/molecules25225474
Rada P, Rojo AI, Evrard-Todeschi N, Innamorato NG, Cotte A, Jaworski T, Tobon-Velasco JC, Devijver H, Garcia-Mayoral MF, Van Leuven F, Hayes JD, Bertho G, Cuadrado A (2012) Structural and functional characterization of Nrf2 degradation by the glycogen synthase kinase 3/beta-TrCP axis. Mol Cell Biol 32: 3486–3499. https://doi.org/10.1016/j.freeradbiomed.2015.04.029
Wang M, Wang Q, Wang Z, Wang Q, Zhang X, Pan Y (2013) The Molecular Evolutionary Patterns of the Insulin/FOXO Signaling Pathway. Evol Bioinform 9: 1–16. https://doi.org/10.4137/EBO.S105
Boas SM, Joyce KL, Cowell RM (2021) The NRF2-Dependent Transcriptional Regulation of Antioxidant Defense Pathways: Relevance for Cell Type-Specific Vulnerability to Neurodegeneration and Therapeutic Intervention. Antioxidants (Basel) 11 (1): 8. https://doi.org/10.3390/antiox11010008
Raghunath A, Nagarajan R, Sundarraj K, Panneerselvam L, Perumal E (2018) Genome-wide identification and analysis of Nrf2 binding sites - Antioxidant response elements in zebrafish. Toxicol Appl Pharmacol 360: 236–248. https://doi.org/10.1016/j.taap.2018.09.013
Kobayashi EH, Suzuki T, Funayama R, Nagashima T, Hayashi M, Sekine H, Tanaka N, Moriguchi T, Motohashi H, Nakayama K, Yamamoto M (2016) Nrf2 suppresses macrophage inflammatory response by blocking proinflammatory cytokine transcription. Nat Commun 7: 11624. 1–14. https://doi.org/10.1038/ncomms11624
Nagara S, Noverala SM, Trudler D, Lopez KM, McKer-cher SR, Han X, Yates JR, Piña-Crespo JC, Nakanishi N, Satoh T, Okamoto S-I, Lipton SA (2017) MEF2D haploinsufficiency downregulates the NRF2 pathway and renders photoreceptors susceptible to light-induced oxidative stress. Proc Natl Acad Sci USA 114 (20): E4048–E4056. https://doi.org/10.1073/pnas.1613067114
Gureev AP, Popov VN, Starkov AA (2020) Crosstalk between the mTOR and Nrf2/ARE signaling pathways as a target in the improvement of long-term potentiation. Exp Gerontol 328: 113285. https://doi.org/10.1016/j.expneurol.2020.113285
Zhao Z, Chen Y, Wang J, Sternberg P, Freeman ML, Grossniklaus HE, Cai J (2011) Age-related retinopathy in NRF2-deficient mice. PLoS One 6 (e19456): 1–10. https://doi.org/10.1371/journal.pone.0019456
Han S, Chen J, Hua J, Hu X, Jian S, Zheng G, Wang J, Li H, Yang J, Hejtmancike JF, Qu J, Ma X, Hou L (2020) MITF protects against oxidative damage-induced retinal degeneration by regulating the NRF2 pathway in the retinal pigment epithelium. Redox Biol 34: 101537. 1–14. https://doi.org/10.1016/j.redox.2020.101537
Kandel ER (2012) The molecular biology of memory: cAMP, PKA, CRE, CREB-1, CREB-2, and CPEB. Mol Brain (5): 14. http://www.molecularbrain.com/content/5/1/14.
Katsuoka F, Yamamoto M (2016) Small Maf proteins (MafF, MafG, MafK): History, structure and function. Gene 586: 197–205. https://doi.org/10.1016/j.gene.2016.03.058
Lapierre LR, Kumsta C, Sandri M, Ballabio A, Hansen M (2015) Transcriptional and epigenetic regulation of autophagy in aging. Autophagy 11 (6): 867–880. https://doi.org/10.1080/15548627.2015.1034410
Pajares M, Jiménez-Moreno N, García-Yagüe ÁJ, Escoll M, de Ceballos ML, Leuven FV, Rábano A, Yamamoto M, Rojo AI, Cuadrado A (2016) Transcription factor NFE2L2/NRF2 is a regulator of macroautophagy genes. Autophagy 12 (10): 1902–1916. https://doi.org/10.1080/15548627.2016.1208889
Raghunath A, Sundarraj K, Nagarajan R, Arfuso F, Bian J, Kumar AP, Sethi G, Perumal E (2018) Antioxidant response elements: Discovery, classes, regulation and potential applications. Redox Biol 17: 297–314. https://doi.org/10.1016/j.redox.2018.05.002
L'honoré A, Drouin J, Buckingham M, Montarras D (2014) Pitx2 and Pitx3 transcription factors: two key regulators of the redox state in adult skeletal muscle stem cells and muscle regeneration. Free Radic Biol Med 75. https://doi.org/10.1016/j.freeradbiomed.2014.10.781
Yang S, Zhou J, Li D (2021) Functions and Diseases of the Retinal Pigment Epithelium. Front. Pharmacol 12: 727870. https://doi.org/10.3389/fphar.2021.727870
Karpukhina A, Galkin I, Ma Y, Dib C, Zinovkin R, Pletjushkina O, Chernyak B, Popova E, Vassetzky Y (2021) Analysis of genes regulated by DUX4 via oxidative stress reveals potential therapeutic targets for treatment of facioscapulohumeral dystrophy. Redox Biol 43: 102008. https://doi.org/10.1016/j.redox.2021.102008
Li Z, Dong X, Liu H, Chen X, Shi H, Fan Y, Hou D, Zhang X (2013) Astaxanthin protects ARPE-19 cells from oxidative stress via upregulation of Nrf2-regulated phase II enzymes through activation of PI3K/Akt. Mol Vis 19: 1656–1666. http://www.molvis.org/molvis/v19/1656
Chapple SJ, Siow RC, Mann GE (2012) Crosstalk between Nrf2 and the proteasome: therapeutic potential of Nrf2 inducers in vascular disease and aging. Int J Biochem Cell Biol 44 (8): 1315–1320. https://doi.org/10.1016/j.biocel.2012.04.021
Zha X, Wu G, Zhao X, Zhou L, Zhang H, Li J, Ma L, Zhang Y (2015) PRDX6 Protects ARPE-19 Cells from Oxidative Damage via PI3K/AKT Signaling. Cell Physiol Biochem 36 (6): 2217–2228. https://doi.org/10.1159/000430186
Chatzidimitriou E, Bisaccia P, Corrà F, Bonato M, Irato P, Manuto L, Toppo S, Bakiu R, Santovito G (2020) Copper/Zinc Superoxide Dismutase from the Crocodile Icefish Chionodraco hamatus: Antioxidant Defense at Constant Sub-Zero Temperature. Antioxidants (Basel) 9 (4): 325. https://doi.org/10.3390/antiox9040325
Sreekumar PG, Ferrington DA, Kannan R (2021) Glutathione Metabolism and the Novel Role of Mitochondrial GSH in Retinal Degeneration. Antioxidants (Basel) 10 (5): 661. https://doi.org/10.3390/antiox10050661
Imamura Y, Noda S, Hashizume K, Shinoda K, Yamaguchi M, Uchiyama S, Shimizu T, Mizushima Y, Shirasawa T, Tsubota K (2006) Drusen, choroidal neovascularization, and retinal pigment epithelium dysfunction in SOD1-deficient mice: a model of age-related macular degeneration. Proc Nat Acad Sci USA 103 (30): 11282–11287. https://doi.org/10.1073/pnas.0602131103
Justilien V, Pang J-J, Renganathan K Zhan X, Crabb JW, Kim SR, Sparrow JR, Hauswirth WW, Lewin AS (2007) SOD2 knockdown mouse model of early AMD. Invest Ophthalmol Vis Sci 48 (10): 4407–4420. https://doi.org/10.1167/iovs.07-0432
Khandhadia S, Lotery A (2010) Oxidation and age-related macular degeneration: insights from molecular biology. Exp Rev Mol Med 12: e34. https://doi.org/10.1017/S146239941000164X
Ueta T, Inoue T, Furukawa T, Tamaki Y, Nakagawa Y, Imai H, Yanagi Y (2012) Glutathione peroxidase 4 is required for maturation of photoreceptor cells. J Biol Chem 287 (10): 7675–7682. https://doi.org/10.1074/jbc.M111.335174
Hartong DT, Dange M, McGee TL, Berson EL, Dryja TP, Colman RF (2008) Insights from retinitis pigmentosa into the roles of isocitrate dehydrogenases in the Krebs cycle. Nat Genet 40 (10): 1230–1234. https://doi.org/10.1038/ng.223
Chiarugi P, Pani G, Giannoni E, Taddei L, Colavitti R, Raugei G, Symons M, Borrello, Galeotti, Ramponi G (2003) Reactive oxygen species as essential mediators of cell adhesion: the oxidative inhibition of a FAK tyrosine phosphatase is required for cell adhesion. J Cell Biol 161 (5): 933–944. https://doi.org/10.1083/jcb.200211118
Karlsson M, Frennesson C, Gustafsson T, Brunk UT, Nilsson SEG, Kurz T (2013) Autophagy of iron-binding proteins may contribute to the oxidative stress resistance of ARPE-19 cells. Exp Eye Res 116: 359–365. https://doi.org/10.1016/j.exer.2013.10.014
Rozanowski B, Burke JM, Boulton ME, Sarna T, Różanowska M (2008) Human RPE melanosomes protect from photosensitized and iron-mediated oxidation but become pro-oxidant in the presence of iron upon photodegradation. Invest.Ophthalmol Vis Sci 49 (7): 2838–2847. https://doi.org/10.1167/iovs.08-1700
Ostrovsky MA, Sakina NL, Dontsov AE (1987) An antioxidative role of ocular screening pigments. Vision Res 27 (6): 893–899. https://doi.org/10.1016/0042-6989(87)90005-8
Richardson DR, Lane DJR, Becker EM, Huang ML-H, Whitnall M, Rahmanto YS, Sheftel AD, Ponka P (2010) Mitochondrial iron trafficking and the integration of iron metabolism between the mitochondrion and cytosol. ProcNat Acad Sci USA 107 (24): 10775–10782. https://doi.org/10.1073/pnas.091292510
Lu H, Hunt DM, Ganti R, Davis A, Dutt K, Alam J, Hunt RC (2002) Metallothionein protects retinal pigment epithelial cells against apoptosis and oxidative stress. Exp Eye Res 74 (1): 83–92. https://doi.org/10.1006/exer.2001.1101
Guirola M, Pérez-Rafael S, Capdevila M, Palacios O, Atrian S (2012) Metal dealing at the origin of the Chordata phylum: the metallothionein system and metal overload response in amphioxus. PLoS One 7 (8): e43299. https://doi.org/10.1371/journal.pone.0043299
Bonilha VL (2018) Oxidative Stress Regulation and DJ-1 Function in the Retinal Pigment Epithelium: Implications for AMD. Adv Exp Med Biol 1074: 3–9. https://doi.org/10.1007/978-3-319-75402-4_1
Bergwik J, Kristiansson A, Allhorn M, Gram Magnus, Åkerström B (2021) Structure, Functions, and Physiological Roles of the Lipocalin α 1-Microglobulin (A1M). Front Physiol 12: 645650. https://doi.org/10.3389/fphys.2021.645650
Kaarniranta K, Salminen A, Eskelinen E-L, Kopitz J (2009) Heat shock proteins as gatekeepers of proteolytic pathways-Implications for age-related macular degeneration (AMD). Ageing Res Rev 8 (2): 128–139. https://doi.org/10.1016/j.arr.2009.01.001
Haslbeck M, Vierling E (2015) A first line of stress defense: small heat shock proteins and their function in protein homeostasis. J Mol Biol 427 (7): 1537–1548. https://doi.org/10.1016/j.jmb.2015.02.002
Zhou P, Kannan R, Spee C, Sreekumar PG, Dou G, Hinton DR (2014) Protection of retina by αB crystallin in sodium iodate induced retinal degeneration. PLoS One 9: e98275: 1–15. https://doi.org/10.1371/journal.pone.0098275
Strunnikova N, Baffi J, Gonzalez A, Silk W, Cousins SW, Csaky KG (2001) Regulated heat shock protein 27 expression in human retinal pigment epithelium. Invest Ophthalmol Vis Sci 42 (9): 2130–2138.
Conrad M, Kagan VE, Bayir H, Pagnussat GC, Head B, Traber MG, Stockwell BR (2018) Regulation of lipid peroxidation and ferroptosis in diverse species. Genes Dev 32 (9-10): 602–619. https://doi.org/10.1101/gad.314674.118
Ryhanen T, Hyttinen JMT, Kopitz J, Rilla K, Kuusisto E, Mannermaa E, Viiri J, Holmberg CI, Immonen I, Meri S, Parkkinen J, Eskelinen E-L, Hannu U, Salminen A, Kaarniranta K (2009) Crosstalk between Hsp70 molecular chaperone, lysosomes and proteasomes in autophagy-mediated proteolysis in human retinal pigment epithelial cells. J Cell Mol Med 13 (9B): 3616–3631. https://doi.org/10.1111/j.1582-4934.2008.00577.x
Song L, Li C, Xie Y, Liu S, Zhang J, Yao J, Jiang C, Li Y, Liu Z (2016) Genome-wide identification of Hsp70 genes in channel catfish and their regulated expression after bacterial infection. Fish Shellfish Immunol 49: 154–62. https://doi.org/10.1016/j.fsi.2015.12.009
Arunkumar R, Gorusupudi A, Bernstein PS (2020) The macular carotenoids: A biochemical overview. Biochim Biophys Acta Mol Cell Biol Lipids 1865 (11): 158617. https://doi.org/10.1016/j.bbalip.2020.158617
Yin J, Thomas F, Lang JC, Chaum E (2011) Modulation of oxidative stress responses in the human retinal pigment epithelium following treatment with vitamin C. J Cell Physiol 226 (8): 2025–2032. https://doi.org/10.1002/jcp.22532
Duque P, Vieira CP, Bastos B, Vieira J (2022) The evolution of vitamin C biosynthesis and transport in animals. BMC Ecol Evol 22 (1): 84. https://doi.org/10.1186/s12862-022-02040-7
van der Vliet A, Janssen-Heininger YM (2014) Hydrogen peroxide as a damage signal in tissue injury and inflammation: murderer, mediator, or messenger? J Cell Biochem 115 (3): 427–435. https://doi.org/10.1002/jcb.24683
Giansanti V, Villalpando Rodriguez GE, Savoldelli M, Gioia R, Forlino A, Mazzini G, Pennati M, Zaffaroni N, Scovassi AI, Torriglia A (2013) Characterization of stress response in human retinal epithelial cells. J Cell Mol Med 17 (1): 103–115. https://doi.org/10.1111/j.1582-4934.2012.01652.x
Tummers B, Green DR (2022) The evolution of regulated cell death pathways in animals and their evasion by pathogens. Physiol Rev 102 (1): 411–454. https://doi.org/10.1152/physrev.00002.2021
Cui J, Zhao S, Li Y, Zhang D, Wang B, Xie J, Wang J (2021) Regulated cell death: discovery, features and implications for neurodegenerative diseases. Cell Commun Signal 19 (1): 120. https://doi.org/10.1186/s12964-021-00799-8
Eckhart L, Ballaun C, Hermann M, VandeBerg JL, Sipos W, Uthman A, Fischer H, Tschachler E (2008) Identification of novel mammalian caspases reveals an important role of gene loss in shaping the human caspase repertoire. Mol Biol Evol (5): 831–841. https://doi.org/10.1093/molbev/msn012
Nagai H, Noguchi T, Takeda K, Ichijo H (2007) Pathophysiological roles of ASK1-MAP kinase signaling pathways. J Biochem Mol Biol 40 (1): 1–6. https://doi.org/10.5483/BMBRep.2007.40.1.001
Lu L, Hackett S.F, Mincey A, Lai H, Campochiaro PA (2006) Effects of different types of oxidative stress in RPE cells. J Cell Physiol 206 (1): 119–125. https://doi.org/10.1002/jcp.20439
Wu W-C, Hu D-N, Gao H-X, Chen M, Wang D, Rosen R, McCormick SA (2010) Subtoxic levels hydrogen peroxide-induced production of interleukin-6 by retinal pigment epithelial cells. Mol Vis 16: 1864–1873.
Xu XZ, Tang Y, Cheng LB, Yao J, Jiang Q, Li -R, Zhen Y-F (2019) Targeting Keap1 by miR-626 protects retinal pigment epithelium cells from oxidative injury by activating Nrf2 signaling. Free Radic Biol Med 143: 387–396. https://doi.org/10.1016/j.freeradbiomed.2019.08.024
Cano M, Datta S, Wang L, Liu T, Flores-Bellver M, Sachdeva M, Sinha D, Handa JT (2021) Nrf2 deficiency decreases NADPH from impaired IDH shuttle and pentose phosphate pathway in retinal pigmented epithelial cells to magnify oxidative stress-induced mitochondrial dysfunction. Aging Cell 20: Article ID e13444 1–15. https://doi.org/10.1111/acel.13444
Ye S-S, Tang Y, Song J-T (2021) ATP and Adenosine in the Retina and Retinal Diseases. Front Pharmacol 12 (654445): 1–8. https://doi.org/10.3389/fphar.2021.654445
Yang D, Elner SG, Clark AJ, Hughes BA, Petty HR, Elner VM (2011) Activation of P2X Receptors Induces Apoptosis in Human Retinal Pigment Epithelium. Invest Ophthalmol Vis Sci 52 (3): 1522–1530. https://doi.org/10.1167/iovs.10-6172
Luthra S, Fardin B, Dong J, Hertzog D, Kamjoo S, Gebremariam S, Butani V, Narayanan R, Mungcal JK, Kuppermann BD, Kenney MCr (2006) Activation of Caspase-8 and Caspase-12 Pathways by 7-Ketocholesterol in Human Retinal Pigment Epithelial Cells. Inves Ophthalmol Vis Sci 47 (12): 5569–5575. https://doi.org/10.1167/iovs.06-0333
Bruey JM, Ducasse C, Bonniaud P, Ravagnan L, Susin SA, Diaz-Latoud C, Gurbuxani S, Arrigo AP, Kroemer G, Solary E, Garrido C (2000) Hsp27 negatively regulates cell death by interacting with cytochrome c. Nat Cell Biol 2 (9): 645–652. https://doi.org/10.1038/35023595
Nita M, Grzybowski A (2020) Interplay between reactive oxygen species and autophagy in the course of age-related macular degeneration. EXCLI J (19): 1353–1371. https://doi.org/10.17179/excli2020-2915
Tang B, Cai J, Sun L, Li Y, Qu J, Snider BJ, Wu S (2014) Proteasome inhibitors activate autophagy involving inhibition of PI3K-Akt-mTOR pathway as an anti-oxidation defense in human RPE cells. PLoS One 9 (7): e103364: 1–8. https://doi.org/10.1371/journal.pone.0103364
Morescalchi F, Duse S, Gambicorti E, Romano MR, Costagliola C, Semeraro F (2013) Proliferative Vitreoretinopathy after Eye Injuries: An Overexpression of Growth Factors and Cytokines Leading to a Retinal Keloid. Mediators Inflamm 2013 (269787): 1–12. https://doi.org/10.1155/2013/269787
Bian Z-M, Elner SG, Elner VM (2007) Regulation of VEGF mRNA Expression and Protein Secretion by TGF-β2 in Human Retinal Pigment Epithelial Cells. Exp Eye Res 84 (5): 812–822. https://doi.org/10.1016/j.exer.2006.12.016
Pollreisz A, Afonyushkin T, Oskolkova OV, Gruber F, Bochkov VN, Schmidt-Erfurth U (2013) Retinal pigment epithelium cells produce VEGF in response to oxidized phospholipids through mechanisms involving ATF4 and protein kinase CK2DOI: Comparative Study. Exp Eye Res (116): 177–184. https://doi.org/10.1016/j.exer.2013.08.021
Grigoryan EN, Novikova YP, Gancharova OS, Philippov PP (2012) Newantioxidant SkQ1 is an effective protector of rat eye retinal pigment epithelium and choroid under conditions of long term organotypic cultivation. Adv Aging Res 1 (2): 31–37. https://doi.org/10.4236/aar.2012.12004
Payne AJ, Kaja S, Naumchuk Y, Kunjukunju N, Koulen P (2014) Antioxidant drug therapy approaches for neuroprotection in chronic diseases of the retina. Int J Mol Sci 15 (2): 1865–1886. https://doi.org/10.3390/ijms15021865
Hsueh Y-J, Chen Y-N, Tsao Y-T, Cheng C-M, Wu W-C, Chen H-C (2022) The Pathomechanism, Antioxidant Biomarkers, and Treatment of Oxidative Stress-Related Eye Diseases. Int J Mol Sci 23: 1255. https://doi.org/10.3390/ijms23031255
Cho Y-K, Lee S-M, Kang Y-J, Kang Y-M, Jeon I-C, Park D-H (2022) The Age-Related Macular Degeneration (AMD)-Preventing Mechanism of Natural Products. Processes 10 (4):678. https://doi.org/10.3390/pr10040678
Grebowski J, Kazmierska P, Krokosz A (2013) Fullerenols as a new therapeutic approach in nanomedicine. BioMed Res Int 2013:751913. https://doi.org/10.1155/2013/751913
Josifovska N, Albert R, Nagymihály R, Lytvynchuk L, Moe MC, Kaarniranta K, Veréb ZJ, Petrovski G (2020) Resveratrol as Inducer of Autophagy, Pro-Survival, and Anti-Inflammatory Stimuli in Cultured Human RPE Cells. Int J Mol Sci 21: 813. https://doi.org/10.3390/ijms21030813
Biswal R, Justis BD, Han P, Li H, Gierhart D, Dorey Cheryl K, Lewin AS (2018) Daily zeaxanthin supplementation prevents atrophy of the retinal pigment epithelium (RPE) in a mouse model of mitochondrial oxidative stress. PLoS One 13 (9): e0203816. https://doi.org/10.1371/journal.pone.0203816
Qin S, McLaughlin AP, De Vries GW (2006) Protection of RPE cells from oxidative injury by 15-deoxy-Δ12.14-prostaglandin J2 by augmenting GSH and activating MAPK. Invest Ophthalmol Vis Sci (47): 5098–5105. https://doi.org/10.1167/iovs.06-0318
Jitsanong T, Khanobdee K, Piyachaturawat P, Wongpra-sert K (2011) Diarylheptanoid 7-(3,4 dihydroxyphenyl)-5-hydroxy-1-phenyl-(1E)-1-heptene from Curcuma comosa Roxb. protects retinal pigment epithelial cells against oxidative stress-induced cell death. Toxicol In Vitro 25 (1): 167–176. https://doi.org/10.1016/j.tiv.2010.10.014
Nakamura S, Hayashi K, Takizawa H, Murase T, Tsuruma K, Shimazawa M, Kakuta H, Nagasawa H, Hara H (2011) An arylidene-thiazolidinedione derivative, GPU-4, without PPARγ activation, reduces retinal neovascularization. Curr Neurovasc Res. 8 (1): 25–34. https://doi.org/10.2174/156720211794520224
Chen M, Wang J, Yang Y, Zhong T, Zhou P, Ma H, Li J, Li D, Zhou J, Xie S, Liu M (2021) Redox dependent Regulation of End-Binding Protein 1 Activity by Glutathionylation. Sci China Life Sci 64 (4): 575–583. https://doi.org/10.1007/s11427-020-1765-6
Ciesielska S, Slezak-Prochazka I, Bil P, Rzeszowska-Wolny J (2021) Micro RNAs in Regulation of Cellular Redox Homeostasis. Int J Mol Sci 22 (11): 6022. https://doi.org/10.3390/ijms22116022
Intartaglia D, Giamundo G, Conte I (2021) The Impact of miRNAs in Health and Disease of Retinal Pigment Epithelium. Front Cell Dev Biol 8: 589985. https://doi.org/10.3389/fcell.2020.589985
Hadziahmetovic M, Song Y, Wolkow N, Iacovelli J, Grieco S, Lee J, Lyubarsky A, Pratico D, Connelly J, Spino M, Harris ZL, Dunaief JL (2011) The oral iron chelator deferiprone protects against iron overload-induced retinal degeneration. Invest Ophthalmol Vis Sci 52 (2): 959–968. https://doi.org/10.1167/iovs.10-6207
Wu L, Tan X, Liang L, Zhang D, Kijlstra A, Yang P (2017) The Role of Mitochondria-Associated Reactive Oxygen Species in the Amyloid β Induced Production of Angiogenic Factors by ARPE-19 Cells. Curr Mol Med 17 (2): 140–148. https://doi.org/10.2174/1566524017666170331162616
Wu J, Cui D, Li H, Zeng J (2022) Protective effects of NAC and salubrinal on apoptosis of retinal pigment epithelial cells induced by all-trans retinoic acid. Eur J Ophthalmol 32 (1): 395–401. https://doi.org/10.1177/11206721211000674
Cheng L, Yu H, Yan N, Lai K, Xiang M (2017) Hypoxia-Inducible Factor-1 alpha Target Genes Contribute to Retinal Neuroprotection. Front Cell Neurosci 11: 20. https://doi.org/10.3389/fncel.2017.00020
Liu J, Lu W, Reigada D, Nguyen J, Laties AM, Mitchell CH (2008) Restoration of Lysosomal pH in RPE Cells from Cultured Human and ABCA4(–/–) Mice: Pharmacologic Approaches and Functional Recovery. Invest Ophthalmol Vis Sci 49 (2): 772–780. https://doi.org/10.1167/iovs.07-0675
Pavan B, Capuzzo A, Forlani G (2014) High glucose-induced barrier impairment of human retinal pigment epithelium is ameliorated by treatment with Goji berry extracts through modulation of cAMP levels. Exp Eye Res (120): 50–54. https://doi.org/10.1016/j.exer.2013.12.006
Alcazar O, Cousins SW, Marin-Castano ME (2007) MMP-14 and TIMP2 Overexpression Protects Against Hydroquinone-Induced Oxidant Injury in RPE: Implications for Extracellular Matrix Turnover. Invest Ophthalmol Vis Sci 48 (12): 5662–5670. https://doi.org/10.1167/iovs.07-0392
Chong C-M, Zheng W (2016) Artemisinin Protects Human Retinal Pigment Epithelial Cells from Hydrogen Peroxide-Induced Oxidative Damage through Activation of ERK/CREB Signaling. Redox Biol 9: 50–56. https://doi.org/10.1016/j.redox.2016.06.002
Patel AK, Hackam AS (2013) Toll-like Receptor 3 (TLR3) Protects Retinal Pigmented Epithelium (RPE) Cells from Oxidative Stress through a STAT3-Dependent Mechanism. Mol Immunol 54 (2): 122–131. https://doi.org/10.1016/j.molimm.2012.11.005
Dorion M-F, Mulumba M, Kasai S, Itoh K, Lubell WD, Ong H (2021) The CD36 Ligand-Promoted Autophagy Protects Retinal Pigment Epithelial Cells from Oxidative Stress. Oxid Med Cell Longev 2021: 6691402. https://doi.org/10.1155/2021/6691402
Barbosa KY, Chang J, Lal M, Bharti K (2017) The Role of Oxidative Stress Pathway in RPE Epithelial to Mesenchymal Transition. Invest Ophthalmol Vis Sci 58: 3010.
Grigoryan EN, Markitantova YuV (2021) Molecular Strategies for Transdifferentiation of Retinal Pigment Epithelial Cells in Amphibians and Mammals In Vivo. Russ J Devel Biol 52 (4): 220–243. https://doi.org/10.1134/S106236042104003
Carbonell-MB, Zapata Cardona J, Delgado JP (2022) Post-amputation reactive oxygen species production is necessary for axolotl limb regeneration. Front Cell Dev Biol 10: 921520. https://doi.org/10.3389/fcell.2022.921520
Hameed LS, Berg DA, Belnoue L, Jensen LD, Cao Y, Simon A (2015) Environmental changes in oxygen tension reveal ROS-dependent neurogenesis and regeneration in the adult newt brain. Elife 4: e08422. https://doi.org/10.7554/eLife.08422.001
Rieger S, Sagasti A (2011) Hydrogen peroxide promotes injury induced peripheral sensory axon regeneration in the zebrafish skin. PLoS Biol 9 (5): e1000621. https://doi.org/10.1371/journal.pbio.1000621
Rossnerova A, Izzotti A, Pulliero A, Bast A, Rattan SIS, Rossner P (2020) The Molecular Mechanisms of Adaptive Response Related to Environmental Stress. Int J Mol Sci 21 (19): 7053. https://doi.org/10.3390/ijms21197053
de Sousa AA, Todorov OS, Proulx MJ (2022) A natural history of vision loss: Insight from evolution for human visual function. Neurosci Biobehav Rev 134: 104550. https://doi.org/10.1016/j.neubiorev.2022.104550
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


